PENENTUAN POTENSI INDUKSI APOPTOSIS TILIROSIDA DARI
EKSTRAK DAUN JATI BELANDA (Guazuma ulmifolia Lamk.)
TERHADAP SEL T47D DENGAN METODE
FLOW CYTOMETRY
NASKAH PUBLIKASI
Oleh:
MARHAMAH NUR AZIZAH
K 100110006
FAKULTAS FARMASI
UNIVERSITAS MUHAMMADIYAH SURAKARTA
SURAKARTA
1 PENENTUAN POTENSI INDUKSI APOPTOSIS TILIROSIDA DARI EKSTRAK
DAUN JATI BELANDA (Guazuma ulmifolia Lamk.) TERHADAP SEL T47D DENGAN METODE FLOW CYTOMETRY
DETERMINATION OF POTENCY APOPTOSIS INDUCTION OF TILIROSIDE FROM PIGEON WOOD LEAVES (Guazuma ulmifolia Lamk.)
ON T47D CELL USING FLOW CYTOMETRY METHOD
Muhammad Da’i*, Ika Trisharyanti D.K*, Marhamah Nur Azizah*
Fakultas Farmasi Universitas Muhammadiyah Surakarta
Jl. Ahmad Yani Tromol Pos I, Pabelan Kartasura Surakarta 57102 ABSTRAK
Jati belanda (Guazuma ulmifolia Lamk.) mempunyai aktivitas sitotoksik. Penelitian ini bertujuan untuk mengetahui persentase induksi apoptosis tilirosida dari daun jati belanda terhadap sel T47D. Induksi apoptosis dilakukan dengan metode flow cytometry dengan alat FACSCaliburTM menggunakan reagen Annexin V dan zat pewarna PI (Propidium Iodida). Konsentrasi induksi apoptosis yang digunakan berdasarkan pada uji MTT assay (IC50) tilirosida pada sel T47D, yaitu sebesar 60 µg/mL. Konsentrasi yang
dibutuhkan yakni 1 IC50, ½ IC50, dan ¼ IC50. Hasil percobaan menunjukkan bahwa induksi apoptosis awal
tilirosida tertinggi yaitu 11,01 % pada konsentrasi ¼ IC50, dan apoptosis akhir tertinggi yaitu 4,93 % pada
konsentrasi ½ IC50. Jika persentase tersebut dibandingkan dengan kontrol,persentase induksi apoptosis
tilirosida lebih kecil. Jadi tilirosida tidak mampu menginduksi apoptosis sel kanker payudara T47D.
Kata kunci : Tilirosida, Guazuma ulmifolia Lamk., apoptosis, flow cytometry, sel T47D: ABSTRACT
Pigeon wood (Guazuma ulmifolia Lamk.) has cytotoxic activity. This research was purposed to know persentage of apoptosis induction of tiliroside from pigeon wood on T47D. Apoptosis induction used flow cytometry with instrument FACSCaliburTM use reagent Annexin-V and dye PI (Propidium Iodide). Concentrations of apoptosis induction based on cytotoxic value (IC50) of tiliroside on T47D cells, the value is
60 mg/mL. Concentration required were 1 IC50, ½ IC50, and ¼ IC50. The results indicated that the highest
percentage of early apoptosis was 11.01% at concentration of ¼ IC50 and late apoptosis was 4,93% at
concentration of ½ IC50.The percentage of apoptosis induction by tiliroside was smaller than the percentage
of control. In conclusion, tiliroside did not induce apoptosis on breast cancer cells (T47D).
Key word : Tiliroside, Guazuma ulmifolia Lamk., apoptosis induction, flow cytometry, T47D cell.
PENDAHULUAN
Kanker payudara merupakan penyebab kematian kedua pada wanita akibat dari kanker setelah kanker serviks (Rasjidi, 2009). Di Indonesia dan negara lain peningkatan jumlah penderita kanker payudara dari tahun 1980 sampai 2010 mengalami peningkatan sebesar 3,1% (Forouzanfar, 2011). Menurut American Cancer Society, ada sekitar 465.000 wanita didunia meninggal tiap tahunnya karena kanker payudara (Rasjidi, 2009) dan satu dari sebelas wanita mengalami kanker payudara (Price & Wilson, 1995).
Faktor risiko penyebab kanker payudara di negara maju seperti Jepang dan Amerika adalah faktor reproduktif yang dipengaruhi oleh kadar estrogen endogen, hormon eksogen (hormon post menopausal, kontrasepsi oral), faktor gizi dan aktivitas fisik, faktor
2 antropometri, faktor genetik dan keluarga (Saika & Sobue, 2009). Cara pengobatan kanker menurut Tagliaferri (2007), yaitu pembedahan, radiasi, kemoterapi, modulasi hormon, pengobatan alternatif, meningkatkan sistem imun tubuh. Namun, ada efek samping dari pengobatan modern seperti mual, muntah, rambut rontok, inflamasi, abnormalitas genetik. Untuk mengurangi efek tersebut perlu adanya kombinasi dengan pengobatan alternatif, cara yang bisa dilakukan seperti menggunakan akupuntur dan obat herbal. Pengobatan herbal menjadi pilihan terapeutik karena aman dan banyak instansi fitomedis yang telah membuktikan keefektifannya secara klinis (Heinrich, 2009).
Untuk menangani penyakit kanker payudara pada wanita harus diketahui sifat dari sel kanker, karena setiap individu memiliki gen yang berbeda (Soemitro, 2012). Salah satu karakteristik sel kanker yaitu tidak sensitif terhadap induksi apoptosis, penyebabnya adalah mutasi p53. Apoptosis berfungsi untuk penghambatan sel kanker sehingga meningkatkan sensitivitas dari sel kanker untuk memacu induksi apoptosis menjadi target dalam penemuan antikanker baru (Brown & Attardi, 2005).
Menurut Food and Agriculture Organization of the United Nations (FAO), ada 940 spesies tanaman di Indonesia yang telah digunakan sebagai tanaman obat, salah satunya adalah tanaman jati belanda (Guazuma ulmifolia Lamk.). Menurut BPOM (2008), tilirosida adalah isolat atau senyawa murni yang dapat diperoleh dari jati belanda, selain itu senyawa ini merupakan senyawa identitas jati belanda. Senyawa identitas bermanfaat untuk pengembangan obat baru, sehingga dapat bermanfaat untuk kehidupan dimasa yang akan datang. Tilirosida merupakan flavonoid polifenol yang mempunyai aktivitas antikanker (Tsimplouli et al., 2011) dan antioksidan (Tomczyk et al., 2008). Antioksidan dari flavonoid dan polifenol berperan dalam melindungi sel dari dampak oksidatif. Biasanya aktivitas antioksidan berperan pada antikanker termasuk pro-apoptosis, kerusakan DNA, antiangiogenik dan efek imunostimulator (Leong et al., 2001).
Senyawa ini telah diteliti aktivitas antikankernya terhadap sel CCRF-CEM, NAMALWA (leukemia) (Dimas et al., 2000), Ehrlich (Esteves-Souza et al., 2002), HepG2 (hepatoma), Colon 205 (kolon), Jurkat (limfositik) (Rao et al., 2007), MCF-7 (Tomczyk et
al., 2008), dan L292 (Matsuda et al., 2002). Nilai IC50 dari beberapa sel menunjukkan
bahwa tilirosida terbukti aktif menghambat sel dibuktikan dengan nilai IC50 < 20 µg/mL
atau < 33,7 µM (Matsuda et al., 2002; Dimas et al.,2000; Tomczyk et al., 2008; Rao et al., 2007; Saifudin, 2014). Tilirosida mampu menginduksi apoptosis pada sel MCF-7 (Tomczyk et al., 2008) dan tilirosida yang dimodifikasi dengan asetilasi mampu
3 meningkatkan aktivitas sitotoksik dan mampu menginduksi apoptosis pada sel SF268 (Tsimplouli et al., 2012).
Penelitian-penelitian di atas menunjukan bahwa tilirosida mempunyai aktivitas antikanker pada beberapa sel kanker. Masih sedikitnya pengetahuan aktivitas induksi apoptosis pada sel kanker payudara T47D menjadi hal yang menarik untuk diteliti. Metode kuantitatif dengan metode flow cytometry memiliki banyak kelebihan dibandingkan metode yang lain seperti pengecatan DNA, degradasi PARP dengan western blot, dan assay of cleavage of
caspase. Penelitian ini dilakukan sebagai salah satu upaya untuk meningkatkan
pengetahuan tentang khasiat dan manfaat, dan sebagai dasar utama pembuatan bahan obat dari senyawa tilirosida yang berguna di masa mendatang.
METODOLOGI PENELITIAN Alat dan Bahan
Alat. Alat yang digunakan yaitu botol duran, tabung eppendorf (Iwaki), TCD (Tissue
Culture Dish) (Iwaki), mikropipet (Nichipet Ex), LAF (Laminar Air Flow) (Labconco),
inkubator (Napco), cyrotube (Falcon), tabung konikel steril (BDsciences), sentrifus (Centrifuge 5415 D), vorteks (Thermolyne), flowcytometer (FACSCalibur™), counter, mikroskop cahaya (Olympus), hemositometer, dan kamera digital (Canon).
Bahan. Bahan yang digunakan yaitu tilirosida dari ekstrak daun jati belanda yang didapatkan dari Universitas Muhammadiyah Surakarta, sel T47D diperoleh dari Laboratorium Parasitologi FK UGM, media kultur RPMI (Roswell Park Memorial
Institute) 1640, FBS (Fetal Bovine Serum) 10%, antibiotik penisilin-streptomisin 2%,
fungizon 0,5%, aquadest, PBS (Phosphate Buffered Saline), tripsin-EDTA 0,25%, Annexin V-PI (Propidium Iodida) (BDBiosciences), blue tips (Thermo), yellow tips (Thermo), dan
white tips (Thermo).
Jalannya Penelitian
Penumbuhan sel. Media kultur disiapkan dalam konikel, lalu dimasukkan ke culture dish dan diberi penanda. Ampul yang berisi sel diambil dari tangki nitrogen cair. Suspensi sel pada ampul dicairkan pada suhu kamar, lalu suspensi tersebut diambil 1000 µL dan dipindahkan ke media kultur yang telah disiapkan. Konikel yang telah ditutup, disentrifus 5 menit. Setelah itu konikel dibawa ke LAF dan disemprot alkohol 70%. Tutup dibuka lalu supernatan pada media tersebut dibuang. Konikel ditambahkan media kultur sebanyak 4 mL. Kemudian konikel diresuspensi hingga homogen dengan mikropipet. Suspensi sel sebanyak 2 mL dipindahkan ke dalam 2 dish. Lalu, masing-masing dish ditambahkan 5 mL
4 media kultur. Kondisi sel diamati dengan menggunakan mikroskop lalu disimpan dalam inkubator CO2.
Pemanenan sel. Sel yang telah diinkubasi, diambil dan diamati kondisi sel dengan mikroskop. Pemanenan sel dikerjakan ketika sel telah mengalami kondisi 80% konfluen. Pemanenan dilakukan dengan cara membuang media dengan mikropipet. Sel dicuci dua kali dengan PBS, volume yang dibutuhkan setengah dari volume media awal. Tripsin-EDTA dimasukkan secara merata dengan tujuan untuk melepaskan sel dari matrik, kemudian diinkubasi selama 3 menit. Setelah itu dish ditambahkan media kultur 5 mL untuk menginaktifkan tripsin dan resuspensi sel dengan mikropipet. Keadaan sel diamati dengan mikroskop untuk melihat sel terlepas satu-satu. Jika masih menggerombol lakukan resuspensi kembali. Sel yang telah terlepas satu-satu dipindahkan ke dalam konikel steril baru.
Perhitungan sel. Hasil panen sel diresuspensi dan diambil 10 µL lalu diletakkan diatas hemositometer. Perhitungan sel dilihat dengan mikroskop cahaya dan dihitung dengan
counter.
Perlakuan Sel. Sel T47D yang telah dihitung jumlah selnya, dibuat pengenceran dengan media kultur sesuai kebutuhan (jumlah sel yang diperlukan untuk 6 well plate sebanyak 5x105 sel/1000 µL). Sel dipindahkan sebanyak 2000 µL ke dalam masing-masing sumuran. Distribusi sel diamati dengan mikroskop serta didokumentasi dengan kamera. Sumuran yang berisi sel diinkubasi pada suhu 370C selama 24 jam. Sampel dibuat seri konsentrasi untuk perlakuan ketika sel normal. Jika sel belum normal maka media diganti dan sel diinkubasi kembali. Seri konsentrasi sampel terdiri dari 3 konsentrasi yaitu 1 IC50, ½ IC50
dan ¼ IC50. Kontrol diperlukan untuk membandingkan percobaan dengan tilirosida dengan
kontrol negatif yang berisi sel dan media dan kontrol positif yang berisi sel dan doksorubisin.
Setelah 24 jam plate yang berisi sel diambil dari inkubator. Media sel dibuang dengan mikropipet perlahan-lahan. Sel yang ada di sumuran dicuci dengan 1000 µL PBS lalu dibuang dan dimasukkan 2000 µL dari seri konsentrasi sampel, media RPMI untuk kontrol negatif dan doksorubisin untuk kontrol positif ke masing-masing sumuran dan dilakukan inkubasi pada 370C selama ±24 jam.
Pembuatan reagen flow cytometry. Reagen flow cytometry untuk analisis apoptosis yang digunakan 1 sampel dilakukan dengan mengambil buffer sebanyak 100 µL, propidium iodida (PI) sebanyak 2 μL dan Annexin-V sebanyak 2 µL lalu dicampur. Satu well plate (6 sumuran) membutuhkan 650 µL buffer, 12 µL PI, dan 12 µL Annexin-V. Eppendorf
5 dibungkus dengan aluminium foil, karena reagen tidak tahan terhadap cahaya. Pembuatan reagen ini dilakukan dengan sarung tangan karena senyawa karsinogen.
Persiapan sampel. Satu konikel disiapkan untuk satu jenis perlakuan serta diberi penanda pada masing-masing konikel. Media diambil dari sumuran dengan mikropipet 1 mL dan dipindahkan ke konikel. Masing-masing sumuran dimasukkan 1000 µL PBS untuk mencuci sel dan membersihkan serum yang berasal dari media, karena serum tersebut dapat menghambat kerja tripsin. Kemudian PBS diambil dengan mikropipet lalu dipindahkan kedalam konikel. Pada masing-masing sumuran ditambahkan 200 µL tripsin-EDTA 0,25% agar sel terlepas satu per satu lalu diinkubasi pada 37ºC selama 5 menit. Masing-masing sumuran dimasukkan 1000 µL media kultur (RPMI) dengan mikropipet lalu diresuspensi. Sel diamati dengan mikroskop hingga terlihat sel terlepas satu per satu. Media kultur yang berada disumuran dipindahkan kedalam konikel lalu konikel disentrifus pada 600 rpm selama 5 menit. Media dibuang dengan cara dituang lalu dicuci masing-masing pellet dengan 500 µL PBS dingin dengan cara diresuspensi agar pellet yang mengendap dibawah menjadi larut dalam PBS. Pellet tersebut dipindahkan ke dalam
eppendorf dan disentrifus pada 2000 rpm selama 3 menit dan sel siap untuk diuji dengan flow cytometer.
Media pada tabung eppendorf dibuang, lalu dimasukkan 100 µL reagen Annexin V-PI ke dalam tabung eppendorf dan buffer sebanyak 350 µL. Agar bercampur maka divorteks, kemudian diinkubasi pada suhu ruang dan tempat gelap selama 10 menit. Suspensi sel tersebut dipindahkan ke flowcyto-tube. Suspensi sel siap untuk diinjek pada alat flow cytometry.
Analisis data. Analisis data dilakukan dengan program cell quest untuk melihat persentase sel hidup, apoptosis awal, apoptosis akhir dan nekrosis. Dari hasil percobaan dibandingkan antara sel T47D yang diinduksi dengan tilirosida dengan kontrol positif (doksorubisin) dan kontrol negatif (sel). Hasil persentase induksi apoptosis dilanjutkan dengan menghitung rata-rata .
HASIL DAN PEMBAHASAN
MTT assay dilakukan untuk mengetahui kemampuan tilirosida dalam menghambat pertumbuhan sel T47D. Tilirosida memiliki kemampuan sitotoksik terhadap sel T47D sebesar 60 µg/mL (Dhewanti, 2015). Nilai IC50 dari MTT assay menunjukkan
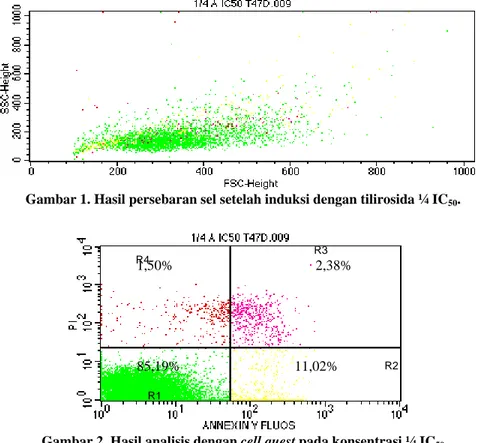
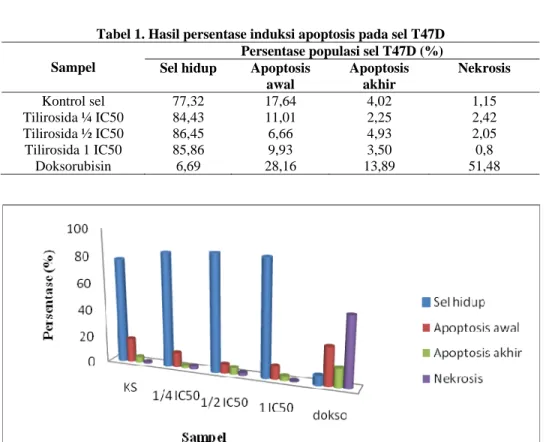
6 bahwa tilirosida mampu menghambat pertumbuhan sel sebanyak 50% pada konsentrasi 60 µg/mL. Pengamatan induksi apoptosis dilakukan untuk mengetahui penyebab kematian sel baik apoptosis maupun nekrosis. Metode flow cytometry mampu membedakan sel hidup, apoptosis awal, apoptosis akhir dan nekrosis, karena reagen Annexin V dan PI bekerja secara selektif mengikat sel yang utuh maupun tidak utuh (fragmentasi). Hasil uji induksi apoptosis dengan flow cytometry diperoleh hasil pada Gambar 1 dan Gambar 2. Percobaan dilakukan duplo ditunjukkan pada Tabel 1, Gambar 3.
Gambar 1. Hasil persebaran sel setelah induksi dengan tilirosida ¼ IC50.
R2 R3
R4
R1
Gambar 2. Hasil analisis dengan cell quest pada konsentrasi ¼ IC50
Keterangan: (R1) sel hidup, (R2) apoptosis awal, (R3) apoptosis akhir, dan (R4) nekrosis.
Data persebaran sel (Gambar 1) menghubungkan diameter sel pada sumbu X atau bagian FSC (forward-angle light scatter) dan konformasi struktur sel pada sumbu Y atau bagan SSC (side-single light scatter). Persebaran sel apoptosis pada FSC akan menurun dan pada SSC akan menaik, sedangkan persebaran sel nekrosis pada FSC akan menaik dan SSC akan menurun.
Dari data persebaran sel tersebut agar memudahkan analisis, maka warna-warna yang terbentuk dipisahkan dengan metode cell quest (Gambar 2). Data diperoleh 4 macam warna, yakni hijau menunjukkan sel hidup, kuning menunjukkan apoptosis awal, merah muda menunjukkan apoptosis akhir, dan merah menunjukkan nekrosis. Warna tersebut
1,50% 2,38%
7 bisa terbentuk disebabkan oleh sel yang memancarkan epi-fluoresensi oleh ikatan Annexin V atau PI lalu ditangkap oleh sinar UV. Panjang gelombang warna hijau pada 488 nm – 525 nm, absorbansi maksimal berada pada 490 nm. Pada apoptosis awal akan berfluoresensi kuning dengan intensitas yang lemah pada panjang gelombang 536 nm – 617 nm. Sel yang mengalami nekrosis atau apoptosis akhir akan berfluoresensi merah pada panjang gelombang 650 nm – 700 nm (Rahman, 2014).
Tabel 1. Hasil persentase induksi apoptosis pada sel T47D
Sampel
Persentase populasi sel T47D (%) Sel hidup Apoptosis
awal Apoptosis akhir Nekrosis Kontrol sel 77,32 17,64 4,02 1,15 Tilirosida ¼ IC50 84,43 11,01 2,25 2,42 Tilirosida ½ IC50 86,45 6,66 4,93 2,05 Tilirosida 1 IC50 85,86 9,93 3,50 0,8 Doksorubisin 6,69 28,16 13,89 51,48
Gambar 3. Grafik apoptosis awal, apoptosis akhir dan nekrosis pada perlakuan tilirosida.
Pada apoptosis awal, sel T47D mengalami ekspresi fosfatidilserin dalam membran sel yang menyebabkan fosfatidilserin keluar dari membran sel sehingga menyebabkan reagen Annexin V mampu mengidentifikasi adanya peristiwa tersebut. Apoptosis akhir ditandai dengan fragmentasi DNA yang menyebabkan Annexin V dan PI mampu mengidentifikasi peristiwa tersebut.
Persentase sel hidup (Gambar 1) pada perlakuan tilirosida lebih besar dibandingkan dengan dibandingkan kontrol sel dan kontrol doksorubisin. Hal tersebut disebabkan oleh sedikitnya sel yang mengalami kematian akibat apoptosis dan nekrosis. Sel hidup seharusnya dipertahankan pada 90%, namun persentase sel hidup kontrol pada sel T47D kurang dari 90%. Pada kontrol doksorubisin sel hidup sangatlah sedikit karena
8 sel banyak yang mengalami kematian akibat apoptosis dan nekrosis. Apoptosis dan nekrosis akan meningkat seiring menurunnya persentase sel hidup.
Persentase apoptosis awal (Gambar 1) pada kontrol sel T47D lebih besar dibandingkan dengan perlakuan tilirosida. Hal tersebut terjadi disebabkan karena sel T47D mengalami silencing p53 mutan melalui nuclear blebbing dan pembelahan PARP-1. PARP-1 terlibat dalam proses transformasi tumor dan pemulihan DNA yang rusak pada sel normal maupun abnormal (Lim et al., 2009). Silencing p53 akan menyebabkan sel mampu melakukan apoptosis yang besar serta menunjukkan bahwa sel T47D telah metastasis. Persentase apoptosis akhir (Gambar 1) perlakuan tilirosida tertinggi sebesar 4,93 % pada konsentrasi ½ IC50. Apoptosis akhir menandakan bahwa sel telah mengalami fragmentasi
DNA dan mengalami proses fagositosis, sel yang terfragmentasi akan dihilangkan oleh sel darah putih sehingga tidak menimbulkan inflamasi. Namun hasil tersebut tidak selaras dengan persentase apoptosis awal yang rendah. Persentase induksi apoptosis yang baik adalah persentase apoptosis awal dan apoptosis lebih besar dibandingkan dengan kontrol sel serta persentase nekrosisnya lebih rendah.
Persentase sel nekrosis (Gambar 1) perlakuan tilirosida mengalami penurunan dengan semakin menurunnya konsentrasi tilirosida yang diberikan. Penurunan sel nekrosis menunjukkan bahwa tilirosida tidak mempunyai kemampuan sitotoksik. Persentase perlakuan tilirosida dibandingkan dengan kontrol doksorubisin (Gambar 1) menunjukkan bahwa tilirosida tidak mampu menyamai persentase kematian sel akibat apoptosis, karena sel T47D sensitif terhadap doksorubisin.
Pengamatan morfologi pada sel T47D yang hidup dan mati ditemukan adanya perbedaan (Gambar 2). Sel hidup memiliki bentuk sel yang tidak beraturan sedangkan sel yang mati ditandai dengan bulatan yang berwarna kuning menyala. Sel mati tersebut berwarna kuning menyala dan berbentuk bulat karena membran sel sudah rusak sehingga cairan sitoplasma menghilang sehingga tidak mampu meneruskan cahaya dari mikroskop. Pada sel hidup, membran sel masih utuh dan mengandung sitoplasma sehingga cahaya dari mikroskop mampu diteruskan ke sel. Perbedaan mencolok terlihat pada hasil uji perlakuan dengan tilirosida dan doksorubisin. Pada kontrol positif, sel menunjukkan sensitivitas yang tinggi terhadap doksorubisin dibuktikan banyaknya sel yang mati, sedangkan pada perlakuan tilirosida masih ditemukan adanya sel hidup.
9
A. Kontrol sel B. Perlakuan sel dengan 1 IC50/60 µg/mL
C. Kontrol positif (doksorubisin) Gambar 2. Hasil percobaan kontrol sel, perlakuan dengan tilirosida dan doksorubisin.
Keterangan : Panah hitam ( ) sel hidup dan panah merah ( ) sel mati
Aktivitas biologi molekuler sel T47D menunjukkan bahwa tilirosida tidak mampu menginduksi apoptosis. Persentase apoptosis dari kontrol sel lebih tinggi dibandingkan dengan perlakuan tilirosida belum mampu menyamai induksi apoptosis dari doksorubisin. Kemungkinan hal tersebut terjadi karena karakteristik sel T47D yaitu mutasi p53 yang stabil sehingga fungsi normal p53 untuk menginduksi apoptosis tidak bisa terjadi (Lim et
al., 2009).
Jika dilihat dari struktur tilirosida, grup coumaryl yang berada didekat glikosida mempengaruhi kemampuan sitotoksik, yakni akan menurunkan kemampuan penghambatan sel dan induksi apoptosis. Kaempferol glycosides yang aktif yaitu platanosida yang memiliki 2 gugus coumaryl yang berikatan dengan gugus glikosida (Dimas et al., 2000) dan trans-asetilasi tilirosida (Tsimplouli et al., 2012). Hal tersebut berkaitan dengan kepolaran senyawa tersebut, tilirosida menjadi lebih polar daripada platanosida. Semakin polar suatu senyawa maka kemampuan sitotoksik semakin rendah (Setyowati et al., 2007).
KESIMPULAN
Berdasarkan uraian pembahasan, peneliti menyimpulkan bahwa tilirosida dari daun jati belanda tidak mampu menginduksi apoptosis pada sel T47D.
SARAN
Berdasarkan kesimpulan, peneliti menyarankan adanya modifikasi struktur tilirosida pada gugus coumaryl dan dilakukan uji aktivitas antikanker, induksi apoptosis dan imunohistokimia.
10 UCAPAN TERIMA KASIH
Bapak Muhammad Da’i, M.Si., Apt. selaku dosen pembimbing utama dan Bu Ika Trisharyanti D. K., M.Farm., Apt selaku pembimbing pendamping, yang telah memberikan pengarahan, bimbingan, nasihat, masukan, dan ilmu yang bermanfaat selama penelitian dan penyusunan skripsi.
DAFTAR ACUAN
Brown, J.M., & Attardi, L.D., 2005, The Role of Apoptosis in Cancer Development and Treatment Response, Nat Rev Cancer, 5, 231-237.
Badan POM RI, 2008, Farmakope Herbal, 36-39, Jakarta, Badan POM Republik Indonesia.
Dimas, K., Demetzoz, C., Mitaku, S., Marselos, T. T., & Kokkinopoulos, D., 2000, Cytotoxic Activity of Kaempferol Glycosides Against Human Leukemic Cell Line In Vitro, Pharmacological Research, 41 (1), 85-88.
Esteves-Souza, A., Sarmento da Silva, T.M., Alves, F.C.C, De Carvalho, M.G., Braz-Filho, R., Echevarria, A., 2002 Cytotoxic activities against Ehrlich carcinoma and human K562 leukaemia of alkaloids and flavonoid from two Solanum species, J
Braz Chem Soc, 13, 838–842.
Dhewanti, F.C., 2015, Aktivitas Sitotoksik Isolat Ekstrak Metanol Daun Jati Belanda (Guazuma ulmifolia Lamk.) Terhadap Sel MCF-7 dan Sel T47D, Skripsi, Surakarta, UMS.
FAO (Food and Agriculture Organization of The United Nations), (tanpa tahun), Country Report on The State of Plant Genetic Resources For Food and Agriculture: Indonesia, Report, The State of World’s Plant Genetic Resources for Food and
Agriculture, 1-39.
Forouzanfar, M.H., Foreman, K.J., Delossantos, A.M., Lozano, R., Lopez, A.D., Murray, C.J., et al., 2011, Breast and Cervical Cancer in 187 Countries Between 1980 and 2000: A Systematic Analysis, Lancet, 378, 1461-1465.
Heinrich, M., Syarief, W.R., & Hadinata, A. H., 2009, Farmakognosi dan Fitoterapi, Jakarta, EGC.
Leong, A.C.N., Kinjo, Y., Tako, M., Iwasaki, H., Oku, H., & Tamaki, H., 2001, Flavonoid Glycosides in the Shoot System of Okinawa Taumu (Colocasia esculenta S.), Food
Chemistry, 119 (2), 630-635.
Lim, L.Y., Vidnovic, N., Ellisen, L.W., & Leong, C.O., 2009, Mutant p53 mediates survival of breast cancer cells, Br J Cancer, 101, 1606–1612.
11 Matsuda, H., 2002, Hepatoprotective Principles from The Flowers of Tilia argentea (Linden): Structure Requirements of Tiliroside and Mechanisms of Action.
Bioorganic & Medicinal Chemistry, 10 (3), 707-712.
Price, S.A. & Wilson, L.M.,1995, Patofisiologi: Konsep Klinis Proses–Proses Penyakit, Edisi 4, 1142, Jakarta, EGC.
Rao, Y.K., Geethangili, Fang, S.H, Tzeng, Y.M., 2007, Antioxidant and cytotoxic activities of naturally occurring phenolic and related compounds: A comparative study, Food Chem Toxicol, 45, 1770–1776.
Rasjidi, I., 2009, Deteksi Dini dan Pencegahan Kanker pada Wanita, Jakarta, CV Sagung Seto.
Saifudin, A., 2014, Senyawa Alam Metabolit Sekunder: Teori, Konsep, dan teknik
Pemurnian, 71-72, Yogyakarta, Deepublish.
Saika, K. & Sobue, T., 2009, Epidemiology of Breast Cancer in Japan and The US,
Journal of the Japan Medical Association, 52 (1), 39-44.
Setyowati, E.P., Jenie, U.A., Sudarsono, Kardono, B., Rahmat, R., & Meiyanto, E., 2007, Isolasi senyawa sitotoksik spons Kaliapsis, Majalah Farmasi Indonesia, 18 (4), 183-189.
Soemitro, M.P., 2012, Blak-blakan Kanker Payudara (Informasi Lengkap dan Akurat), Jakarta, Qanita.
Tagliaferri, M., Tripathy, D., & Cohen, I., 2007, Kanker Payudara: Cara Penyembuhan
Alternatif, Jakarta, PT Indeks.
Tomczyk, M., Drozdowska, D., Bielawska, A., Bielawska, K., & Gudej, J., 2008, Human DNA topoisomerase inhibitors from Potentilla argentea and their cytotoxic effect against MCF-7, Pharmazie, 63, 389-393.
Tsimplouli, C., Demetzos, C., Cladaras, M.H., Pantazis, P., & Dimas, K., 2012, In Vitro Activity of Dietary Flavonol Congeners Against Human Cancer Cell Lines, Eur J