LAPOR
PENELITI
OPTIMASI MIKROS
DAN MAKROSKOPIS
PADA HIDR
UNTUK P
Tahun ke
Dr. Megawati, S.T., M.T.
Astrilia Damayanti, S.T.,
Prof. Ir. Wahyudi B Sedia
Daftar Isian Pelaksanaan An Nomor: DIPA-023.04.2.189822
Surat Perjanjian Pelaks 1.14.5/PPK.3
UNIVERSITA
LAPORAN TAHUNAN
PENELITIAN FUNDAMENTAL
SI MIKROSKOPIS
MONTE CARLO METHOD
OSKOPIS
RESPONSE SURFACE METHODOLOGY
ADA HIDROLISIS LIGNOSELULOSA
UNTUK PEMBUATAN ETANOL
Tahun ke 1 dari rencana 2 tahun
S.T., M.T. NIDN. 00061172
yanti, S.T., M.T. NIDN. 00080973
udi B Sediawan, SU. Ph.D. NIDN. 00170953
Dibiayai Oleh:
ksanaan Anggaran (DIPA) Universitas Negeri Semara 4.2.189822/2013, tanggal 5 Desember 2012 Sesuai d
jian Pelaksanaan Penelitian Desentralisasi Nomor: 14.5/PPK.3.1/2013, Tanggal 14 Mei 2013
NIVERSITAS NEGERI SEMARANG
November 2013
ETHOD
HODOLOGY
. 0006117203
. 0008097306
. 0017095302
iii
RINGKASAN
Lignoselulosa merupakan polimer organik (selulosa+hemiselulosa+lignin) yang harus didegradasi melalui hidrolisis sebelum dikonversi menjadi etanol, yang dapat dimanfaatkan sebagai bahan bakar terbarukan. Hidrolisis lignoselulosa dengan asam sebagai katalis merupakan reaksi depolimerisasi, yaitu polisakarida-oligosakarida-monosakarida, yang dipengaruhi oleh kondisi proses. Tujuan penelitian ini adalah memodelkan hidrolisis lignoselulosa dengan metode Monte Carlo. Pertama, menyusun program perhitungan jumlah gula terbentuk menggunakan model kinetika yang diselesaikan dengan Runge-Kutta. Kedua, menyusun program simulasi dengan Monte Carlo untuk menghitung jumlah gula terbentuk. Di dalam program simulasi ini, hasil perhitungan jumlah gula dengan metode Monte Carlo dibandingkan dengan cara kinetika. Selanjutnya, optimasi parameter-parameter reaksi hidrolisis dengan metode Monte Carlo berdasarkan data percobaan yang diperoleh.
Proses pemodelan hidrolisis lignoselulosa dengan metode Monte Carlo dapat dilakukan dengan baik jika mekanisme reaksi hidrolisis lignoselulosa pada jenis bahan baku tertentu dapat diformulasikan dengan benar berdasar kondisi prosesnya. Optimasi mikroskopis akan diselesaikan berdasar data percobaan yang sudah diperoleh, yang sudah diakui keakuratannya melalui publikasi karya ilmiah pada seminar dan jurnal pada taraf nasional dan internasional. Variabel proses hidrolisis yang diambil berdasarkan data hasil percobaan pada semua variasi bahan baku, waktu, dan suhu.
Hasil pemodelan hidrolisis lignoselulosa dengan metode Monte Carlo menunjukkan bahwa metode Monte Carlo dapat digunakan untuk menyelesaikan perhitungan hidrolisis lignoselulosa dengan variasi bahan baku, waktu, dan suhu dengan hasil yang sangat baik. Proses simulasi dengan metode Monte Carlo terlihat lebih mudah dan cepat serta hasilnya cukup baik bila dibandingkan dengan metode kinetika yang disusun melalu persamaan diferensial simultan. Ke depan, simulasi mikroskopis dengan metode Monte Carlo ini akan dilengkapi dengan optimasi makroskopis untuk mencari hubungan antar variabel proses yang berpengaruh menggunakan Response Surface Methodology.
iv
PRAKATA
Laporan tahunan penelitian fundamental dengan judul Optimasi
Mikroskopis Monte Carlo Method dan Makroskopis Response Surface
Methodology pada Hidrolisis Lignoselulosa untuk Pembuatan Etanol pada tahun
pelasanaan ke 1 inidapat kami selesaikan dengan baik. Metode Monte Carlo dapat
digunakan untuk menyelesaikan perhitungan pada hidrolisis lignoselulosa. Hasil
perhitungan menunjukkan bahwa metode Monte Carlo lebih mudah, singkat, dan
cukup baik bila dibandingkan dengan metode kinetika yang diturunkan melalui
persamaan diferensial simultan. Hasil simulasi ini sudah diseminarkan pada
seminar internasional dan diberi kesempatan juga untuk dipublikasikan pada
jurnal internasional yang dikelola oleh organisasi seminar tersebut.
Keseluruhan laporan kemajuan penelitian fundamental ini, mulai dari
penyusunan proposal, melakukan penelitian, penyusunan karya ilmiah, dan
penulisan laporan kemajuan dapat tercapai atas kerjasama, saran, bimbingan, dan
nasehat Prof. Ir. Wahyudi Budi Sediawan, SU., Ph. D., selaku Anggota Peneliti ke
2, serta Astrilia Damayanti, S.T., M.T., selaku Anggota Peneliti ke 1.
Pemodelan hidrolisis lignoselulosa dengan optimasi mikroskopis
menggunakan metode Monte Carlo ini perlu diaplikasikan untuk masing-masing
bahan baku. Pada kesempatan untuk tahun kedua, kami akan melakukan optimasi
makroskopis menggunakan Response Surface Methodology untuk mencari
variabel-variabel proses yang optimal dan hubungan antara variabel-variabel
tersebut.
Akhir kata, semoga laporan tahunan penelitian fundamental ini dapat
bermanfaat bagi nusa dan bangsa dalam mengembangkan ilmu pengetahuan
khususnya di bidang pengembangan energi hijau.
v
DAFTAR ISI
Halaman
Halaman sampul I
Halaman Pengesahan Ii
Ringkasan Iii
Prakata Iv
Daftar isi V
Daftar tabel Vi
Daftar gambar Vii
Daftar lampiran Viii
BAB 1. PENDAHULUAN 1
BAB 2. TINJAUAN PUSTAKA 9
BAB 3. TUJUAN DAN MANFAAT PENELITIAN 25
BAB 4. METODE PENELITIAN 27
BAB 5. HASIL DAN PEMBAHASAN 32
BAB 6. RENCANA TAHAPAN BERIKUTNYA
BAB 7. KESIMPULAN DAN SARAN
DAFTAR PUSTAKA
45
46
47
vi DAFTAR TABEL
Tabel 1 Yield gula hasil hidrolisis pada variasi bahan baku pada suhu 220 oC dan konsentrasi katalisator 0,18 mol/L
13
Tabel 2 Nilai-nilai parameter pada model 1 pada variasi konsentrasi katalisator
18
Tabel 3 Nilai-nilai parameter pada model 2 pada variasi konsentrasi katalisator
19
Tabel 4 Nilai-nilai parameter pada model 3 pada variasi konsentrasi katalisator
20
Tabel 5 Nilai-nilai parameter pada model 4 pada variasi konsentrasi katalisator
21
Tabel 6 Kandungan lignoselulosa dalam bahan baku 29
Tabel 7 Bahan-bahan kimia yang digunakan 29
Tabel 8 Data percobaan untuk bahan baku tongkol jagung 41 Tabel 9 Data percobaan untuk bahan baku serbuk gergaji kayu 42
Tabel 10 Data percobaan untuk bahan baku campuran 43
vii DAFTAR GAMBAR
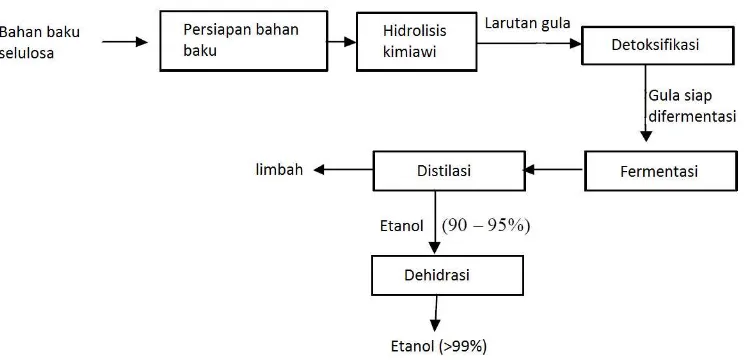
Gambar 1 Diagram proses pembuatan etanol dari lignoselulosa berbasis hidrolisis secara kimiawi (Taherzadeh dan Karimi, 2007)
3
Gambar 2 Perbandingan data percobaan dan hasil perhitungan untuk bahan baku sekam padi pada suhu akhir 160 oC dan 220 oC pada model 1
5
Gambar 3 Perbandingan data percobaan dan hasil perhitungan untuk bahan baku sekam padi pada suhu akhir 220 oC pada model 2
6
Gambar 4 Perbandingan data percobaan dan hasil perhitungan untuk bahan baku sekam padi pada suhu akhir 160 oC dan 220 oC pada model 3
6
Gambar 5 Perbandingan data percobaan dan hasil perhitungan untuk bahan baku sekam padi pada suhu akhir 220 oC pada model 4
7
Gambar 6 Perbandingan model 1, 2, 3, dan 4 untu hidrolisis sekam padi pada konsentrasi katalisator 0,4780 mol/L
7
Gambar 7 Mekanisme reaksi hidrolisis dengan katalisator asam (Philipp, 1984) 10 Gambar 8 Pengaruh waktu dan konsentrasi asam sebagai katalisator pada
hidrolisis kayu poplar (Lee dkk., 2000)
11
Gambar 9 Pengaruh suhu terhadap konsentrasi gula pada hidrolisis batang padi (Karimi dkk., 2006)
12
Gambar 10 Perbandingan data percobaan dan hasil perhitungan untuk bahan baku sekam padi pada suhu akhir 160 oC pada model 1
16
Gambar 11 Perbandingan data percobaan dan hasil perhitungan untuk bahan baku sekam padi pada suhu akhir 160 oC pada model 4
17
Gambar 12 Pengaruh konsentrasi katalisator (CH2SO4) terhadap tenaga pengaktif degradasi gula (lnEdeg) pada model 4
21
Gambar 13 Rangkaian alat hidrolisis 30
Gambar 14 Perbandingan hasil perhitungan menggunakan model kinetik (spotted line) dengan model Monte Carlo (solid line) pada hidrolisis 35 menit pada derajad polimerisasi 200
38
Gambar 15 Perbandingan hasil perhitungan menggunakan model kinetik (spotted line) dengan model Monte Carlo (solid line) pada hidrolisis 35 menit pada derajad polimerisasi 400
38
Gambar 16 Perbandingan hasil perhitungan menggunakan model kinetik (spotted line) dengan model Monte Carlo (solid line) pada hidrolisis 35 menit pada derajad polimerisasi 600
39
Gambar 17 Perbandingan hasil perhitungan menggunakan model kinetik (spotted line) dengan model Monte Carlo (solid line) pada hidrolisis 35 menit pada derajad polimerisasi 1000
39
Gambar 18 Perbandingan hasil perhitungan menggunakan model kinetik (spotted line) dengan model Monte Carlo (solid line) pada hidrolisis 40 menit pada derajad polimerisasi 1000
40
Gambar 19 Distribusi panjang rantai lignoselulosa menggunakan metode Monte Carlo pada derajad polimerisasi 1000 dan variasi waktu hidrolisis
viii
DAFTAR LAMPIRAN
Instrumen 51
Personalia tenaga peneliti 55
1 BAB 1
PENDAHULUAN
1.1. Latar Belakang
Krisis bahan bakar minyak telah memberikan tanda bahwa cadangan energi
fosil yang dimiliki Indonesia sudah menipis. Setelah sempat naik pada tahun 2006
sebesar 2,8 persen menjadi 4370 juta barrel. Pada tahun 2007, cadangan turun
sebesar 8,5 persen menjadi 4000 juta barrel. Cadangan ini kembali turun pada
tahun 2008 sebesar 7,5 persen menjadi 3700 juta barrel. Hal ini disebabkan karena
kondisi sumur minyak yang sudah tua yang produktivitasnya turun. Menurut BP
Migas, 85 persen sumur minyak di Indonesia sudah tua dan mengalami penurunan
produksi rata-rata 15 persen dalam setahun. Menurunnya produksi pada
sumur-sumur tersebut kurang diikuti dengan penemuan sumur-sumur baru yang cadangannya
besar dan bisa diandalkan sebagai salah satu sumber produksi utama. Kegiatan
eksplorasi turun pada tahun 2008. Pada tahun 2008, survei mencakup luas 452 km
persegi yang semuanya merupakan survei di daratan. Luasan ini turun jauh
dibandingkan tahun 2007 yang mencapai 30.335,67 km persegi yang terdiri dari
survey daratan seluas 23.522,17 km persegi dan survei di laut seluas 6.833,5 km
persegi (BP Migas, 2009).
Sebaliknya, konsumsi BBM (dalam negeri) sudah lama meningkat dari
tahun ke tahun. Salah satu indikatornya adalah kebutuhan premium mulai tahun
2004 sampai 2007 yang terus naik dari 16.418 sampai 17.500 kL (Ditjen Migas,
2007). Sementara itu pada tahun 2008 dan 2009, kebutuhan premium ini tercatat
juga terus meningkat menjadi 19.600 dan 21.000 kL. Secara keseluruhan angka
laju pertumbuhan konsumsi BBM mencapai sekitar 7% setahun. Kalau
pertumbuhannya 7% setahun terus menerus maka setiap 10 tahun konsumsinya
meningkat dua kali. Sejak tahun 2004 produksi BBM lebih kecil dibandingkan
konsumsinya. Hal ini menyebabkan Indonesia menjadi nett importer minyak bumi
2 Terbatasnya sumber energi fosil menyebabkan perlunya pengembangan
energi terbarukan dan konservasi energi. Salah satu bentuk dari energi terbarukan
adalah energi biomassa (Sediawan dkk., 2007). Indonesia sebagai negara tropis
memiliki sumber-sumber lignoselulosa sangat melimpah. Sebagai negara agraris,
Indonesia memiliki 60,000 unit penggiling padi dengan kapasitas produksi sekam
padi sebesar 15 juta ton per tahun. Menurut Deputi Statistik Bidang Produksi
BPS; produksi jagung pada tahun 2008 sebesar 16,32 juta ton pipilan kering
(BPS, 2008). Menurut perhitungan Ditjen Listrik dan Pemanfaatan Energi (2009),
potensi lignoselulosa di Indonesia jika dikonversi menjadi energi sebesar 49810
MW atau 1,571 x 1018 J/tahun. Oleh karena itu, penelitian tentang proses
pembuatan etanol dari lignoselulosa akan memberikan manfaat untuk kemajuan
negara.
Penelitian yang berfokus pada potensi limbah lignoselulosa, seperti ranting,
daun, dan sekam padi sudah pernah peneliti lakukan, dan sudah dipublikasikan
pada seminar dan jurnal pada lingkup nasional dan internasional (Sediawan dkk.,
2007; Megawati dkk., 2008; Megawati dkk., 2009; Megawati dkk., 2010; Astrillia
dan Megawati, 2011; Megawati dkk., 2011). Penelitian yang sudah dilakukan
tersebut mengacu pada proses pembuatan etanol dari lignoselulosa dengan asam
sebagai katalis seperti pada Gambar 1. Hasil penelitian menunjukkan bahwa
lignoselulosa dari limbah organik perkotaan cukup prospek untuk diproses
3
Gambar 1. Diagram proses pembuatan etanol dari lignoselulosa berbasis hidrolisis secara kimiawi (Taherzadeh dan Karimi, 2007)
Penelitian-penelitian tentang konversi lignoselulosa menjadi etanol tidak
bersifat menyeluruh, namun hanya bersifat eksplorasi untuk mempelajari
pengaruh suatu kondisi proses tertentu terhadap gula yang dihasilkan pada bahan
baku tertentu. Tidak semua perubahan yang terjadi pada semua komponen yang
terdapat dalam lignoselulosa diamati, beberapa hanya mengamati konversi
senyawa heksosan dan beberapa hanya senyawa pentosan. Sedangkan penelitian
yang mengamati secara keseluruhan selalu menganggap bahwa gula hasil
hidrolisis dapat diekuivalenkan sebagai glukosa. Keterbatasan-keterbatasan alat
analisis menyebabkan kondisi pengamatan yang terbatas tersebut diambil. Hal ini
mengakibatkan suatu kendala untuk mempelajari pengaruh jenis bahan baku dan
kondisi proses terhadap hidrolisis lignoselulosa dengan asam. Oleh karena itu,
simulasi mikroskopis terhadap mekanisme reaksi hidrolisis yang sebenarnya
sangat penting untuk dilakukan. Melalui simulasi ini, panjang rantai polisakarida
yang sudah bereaksi dapat diramalkan, sehingga pada tahap mana reaksi hidrolisis
sudah terjadi dapat diketahui. Akibatnya, jenis dan jumlah gula serta jenis dan
jumlah senyawa selain gula dapat dihitung. Optimasi mikroskopis ini akan
4 simulasi bilangan random terhadap kapan dan dimana panjang rantai polimer yang
sudah diserang oleh ion H+ dari asam sehingga menjadi gula.
1.2. Perumusan Masalah
Didasari bahwa Indonesia sebagai negara tropis, maka konversi sumber
bahan baku berbasis lignoselulosa menjadi etanol sangat penting untuk dipelajari.
Kondisi masyarakat Indonesia menunjukkan bahwa jenis bahan baku yang dalam
waktu dekat yang cukup menjanjikan untuk diimplementasikan adalah limbah
organik perkotaan, berupa sekam padi, tongkol jagung, ranting, daun, dan serbuk
gergaji kayu, dengan cara hidrolisis dengan asam dan fermentasi dengan yeast.
Penelitian-penelitian yang sudah dilakukan belum sampai pada taraf generalisasi
jenis bahan baku lignoselulosa yang prospek dengan metode hidrolisis dengan
asam pada kondisi non-isotermal. Generalisasi bahan baku dapat dilakukan jika
tersedia hubungan antara jenis bahan baku dan kondisi proses terhadap
mekanisme reaksi hidrolisis yang sebenarnya.
Metode yang paling sering digunakan untuk menyusun persamaan hubungan
kondisi proses hidrolisis terhadap konsentrasi gula yang dihasilkan adalah
menggunakan model kinetika. Peneliti sudah pernah menggali model kietika ini
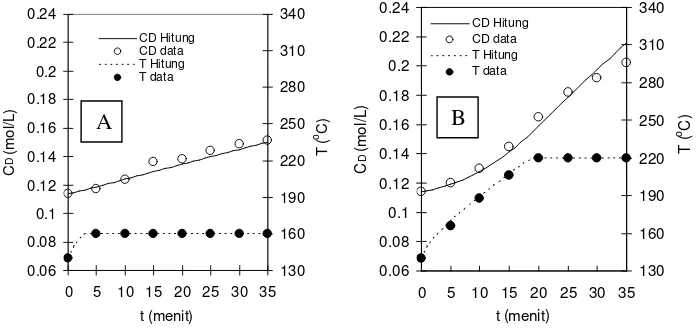
secara lengkap. Model kinetika 1 (Gambar 2) dan 2 (Gambar 3) disusun dengan
anggapan bahwa hidrolisis merupakan reaksi homogen, meskipun bahan bakunya
terdiri dari lignoselulosa (padat) dan air (cair). Model ini mengasumsi bahwa
perpindahan massa sangat cepat sehingga yang mempengaruhi jalannya proses
hanya reaksi kimia (Canettieri dkk., 2007; Mosier dkk., 2002; dan Torget dkk.,
2000). Model 1 untuk reaksi hidrolisis tanpa degradasi gula dan model 2 dengan
adanya degradasi gula.
5 0.06 0.08 0.1 0.12 0.14 0.16 0.18 0.2 0.22 0.24
0 5 10 15 20 25 30 35 t (menit)
C
D (
m o l/ L ) 130 160 190 220 250 280 310 340 T ( o C ) CD Hitung CD data T Hitung T data 0.06 0.08 0.1 0.12 0.14 0.16 0.18 0.2 0.22 0.24
0 5 10 15 20 25 30 35 t (menit) C D ( m o l/ L ) 130 160 190 220 250 280 310 340 T ( o C ) CD Hitung CD data T Hitung T data
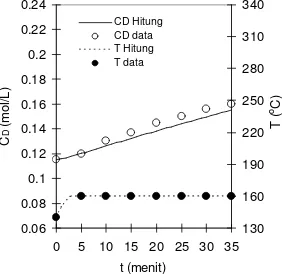
Gambar 2. Perbandingan data percobaan dan hasil perhitungan untuk bahan baku sekam padi pada suhu akhir 160 oC (A) dan 220 oC (B) pada model 1
Model homogen ini tidak sesuai untuk kondisi operasi pada suhu tinggi dan
konsentrasi katalis tinggi. Oleh karena itu, peneliti mengembangkan model ke 3
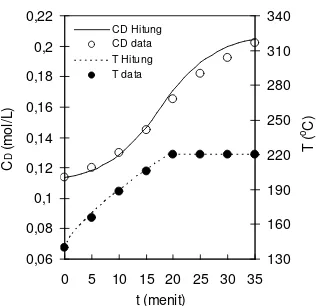
(Gambar 4) dan 4 (Gambar 5), yaitu model heterogen tanpa dan dengan degradasi
gula. Model ini sangat kompleks karena mempertimbangkan gradien konsentrasi
asam sebagai katalis dalam padatan dan reaksi hidrolisis yang terjadi setiap saat
pada setiap lapisan padatan yang diukur. Model ini disusun dengan melipatkan
perpindahan massa dan reaksi yang terjadi selama hidrolisis, serta merupakan
model yang paling sesuai untuk semua kondisi. Namun demikian, model ini
sangat sulit diterapkan untuk bahan baku lignoselulosa yang memiliki panjang
rantai yang besar, seperti limbah kayu-kayuan keras dan berserat panjang.
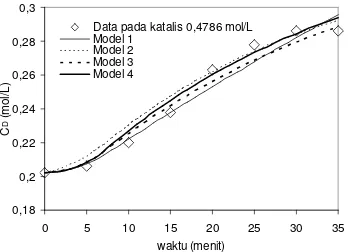
Perbandingan keempat model tersebut dapat dilihat pada Gambar 6.
6 0,06 0,08 0,1 0,12 0,14 0,16 0,18 0,2 0,22
0 5 10 15 20 25 30 35
t (menit) C D ( m o l/ L ) 130 160 190 220 250 280 310 340 T ( oC ) CD Hitung CD data T Hitung T data
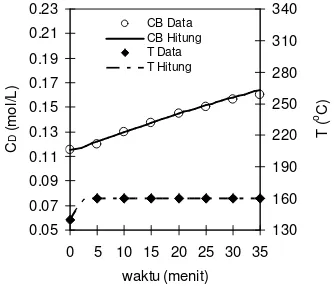
Gambar 3. Perbandingan data percobaan dan hasil perhitungan untuk bahan baku sekam padi pada suhu akhir 220 oC pada model 2
0.05 0.07 0.09 0.11 0.13 0.15 0.17 0.19 0.21 0.23
0 5 10 15 20 25 30 35
waktu (menit)
C
D (
m o l/ L ) 130 160 190 220 250 280 310 340 T ( o C ) CB Data CB Hitung T Data T Hitung 0.05 0.08 0.11 0.14 0.17 0.2 0.23 0.26
0 5 10 15 20 25 30 35
waktu (menit) C D ( m o l/ L ) 130 160 190 220 250 280 310 340 T ( 0 C ) CD Data CD Hitung T Data T Hitung
7 0.05 0.08 0.11 0.14 0.17 0.2 0.23 0.26
0 5 10 15 20 25 30 35 waktu (menit)
C
D (
m o l/ L ) 130 160 190 220 250 280 310 340 T ( o C ) CD Data CD Hitung T Data T Hitung
Gambar 5. Perbandingan data percobaan dan hasil perhitungan untuk bahan baku sekam padi pada suhu akhir 220 oC pada model 4
0,18 0,2 0,22 0,24 0,26 0,28 0,3
0 5 10 15 20 25 30 35
waktu (menit) C D ( m o l/ L )
Data pada katalis 0,4786 mol/L Model 1
Model 2 Model 3 Model 4
Gambar 6. Perbandingan model 1, 2, 3, dan 4 untuk hidrolisis sekam padi pada konsentrasi katalisator 0,4780 mol/L
Simulasi mikroskopis berdasarkan mekanisme reaksi hidrolisis yang
sebenarnya dengan menggunakan metode Monte Carlo dapat digunakan untuk
menyederhanakan proses perhitungan yang panjang dan sulit pada model kinetika.
Simulasi ini dilakukan berdasar data percobaan yang sudah diperoleh dan
dibandingkan dengan model kinetika homogen yang sudah terlebih dahulu diteliti.
Simulasi Monte Carlo merupakan metode perhitungan yang sangat unik namun
bila algoritmanya sudah berhasil disusun, model ini lebih mudah untuk
8 menggunakan bilangan random untuk meramalkan parameter-parameter proses
sehingga hasil simulasinya akan dapat mendekati kenyataan untuk proses yang
sebenarnya. Penyusunan algoritma untuk simulasi Monte Carlo memerlukan daya
imaginasi yang tinggi yang didukung oleh teori-teori fundamental yang dalam
sehingga pemilihan pembangkitan bilangan random dapat tepat digunakan sesuai
9 BAB 2
TINJAUAN PUSTAKA
Lignoselulosa
Lignoselulosa merupakan senyawa polisakarida yang terdiri atas selulosa,
hemiselulosa dan lignin. Selulosa merupakan senyawa polimer dari glukosa yang
memiliki gugus ikatan C yang berbeda dengan pati. Ikatan polimer selulosa terjadi
pada gugus C-beta, sedangkan pati memiliki ikatan polimer pada gugus C-alfa
(Wertheim dan Jeskey, 1956). Hemiselulosa merupakan ikatan polimer heterogen
dari polisakarida, monomernya dapat berupa glukosa, manosa, galaktosa, xilosa,
dan arabinosa. Manosa dan glukosa merupakan jenis gula dari hemiselulosa yang
paling banyak ditemukan pada kayu lunak, sedangkan xilosa ditemukan sangat
banyak pada kayu keras. Susunan ikatan pada hemiselulosa lebih mudah dipecah
pada hidrolisis dari pada susunan ikatan pada selulosa (Palmqvist dan
Hahn-Hagerdal, 2000). Sedangkan lignin merupakan senyawa yang berfungsi sebagai
pengikat komponen penyusun tanaman (hemiselulosa dan selulosa). Lignin
terbentuk dari senyawa aromatif yang saling dihubungkan dengan rantai alifatik.
Ikatan polimer yang berbeda antara selulosa dan pati inilah yang menyebabkan
perlakuan bagaimana mengubah kedua polisakarida di atas menjadi bioetanol juga
berbeda.
Komposisi lignoselulosa berbeda-beda untuk setiap jenis tanaman.
Komposisi kayu Jati: +46,5% selulosa, +14,4% hemiselulosa dan +29,9% lignin
(Suryana, 2001), kayu Sengon terdapat 49,7% selulosa (Santoso, 1992), dan kayu
Akasia terdapat 51,54% selulosa dan 29,58% hemiselulosa (Syafii dan Siregar,
2006). Jenis kayu-kayu lain seperti Rotan, komposisinya: 71-76% holoselulosa
dan 18-27% lignin (Dephutb, 2006), sedangkan bambu, komposisinya: 42,4-53,6%
10
racun Senyawa da
Monosakari ida
oligosakar O
H da
Polisakari + 2 → → →
Hidrolisis
Hidrolisis untuk memecah senyawa-senyawa selulosa dan hemiselulosa
menjadi gula. Mekanisme reaksi hidrolisis dengan menggunakan katalisator asam
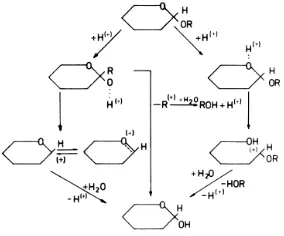
seperti terlihat pada Gambar 7. Menurut Philipp (1984) mekanisme reaksi
hidrolisis didahului oleh ion H+ yang berasal dari katalisator menyerang selulosa,
sehingga struktur ikatanyya menjadi tidak stabil, akibatnya akan memudahkan
selulosa bereaksi dengan air (H2O).
Gambar 7. Mekanisme reaksi hidrolisis dengan katalisator asam (Philipp, 1984)
Reaksi kimia yang terjadi pada hidrolisis selulosa merupakan reaksi
irreversible yang dapat dituliskan sebagai berikut:
(1)
Sebagaimana yang terdapat dalam pustaka; waktu yang diperlukan untuk
hidrolisis lignoselulosa dengan asam encer sangat dipengaruhi oleh kondisi
operasinya. Hidrolisis sering dilakukan secara batch pada waktu paling lama 20
menit. Konsentrasi gula hasil hidrolisis pada berbagai waktu dapat dilihat pada
Gambar 8, yang menunjukkan bahwa konsentrasi asam sebagai katalisator
memberi pengaruh pada konsentrasi gula hasil hidrolisis. Hidrolisis dengan
konsentrasi katalisator tinggi dapat menghasilkan gula dengan konsentrasi tinggi
11 dkk., 2000; Kim dkk., 2000). Di sisi lain, konsentrasi gula yang dihasilkan dari
para peneliti pendahulu belum cukup bila dikehendaki konsentrasi etanol hasil
fermentasi mencapai +6%. Mereka kebanyakan menggunakan katalisator dengan
konsentrasi antara 0,5–5% dan konsentrasi gula yang dihasilkan jauh di bawah
120 g/L, sebagai contoh: 1) Hidrolisis kayu L. Camara dengan asam sulfat 5%,
suhu 140 oC, dan waktu 30 menit) memproduksi gula dengan konsentrasi 14,42 +
0,382 g/L dan yield +14.43% (Kuhad dkk., 2010). 2) Total gula dengan
konsentrasi 18,24 g/L (yield = 14.89%) dihasilkan dari hidrolisis kayu Prosopis
juliflora dengan asam sulfat 5%, suhu 140 oC, dan waktu 30 menit (Gupta dkk.,
2009).
Gambar 8. Pengaruh waktu dan konsentrasi asam sebagai katalisator pada
hidrolisis kayu Poplar (Lee dkk., 2000)
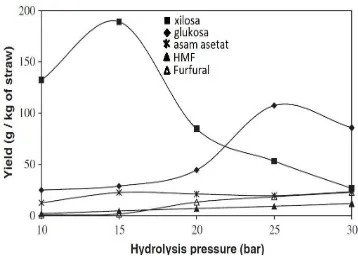
Suhu juga merupakan variabel hidrolisis yang berpengaruh (Gambar 9).
Pada gambar tersebut, nilai suhu dapat diwakili oleh nilai tekanan, yaitu tekanan
semakin tinggi maka suhu juga semakin tinggi. Hidrolisis yang terlalu lama dan
suhu yang terlalu tinggi dapat mengakibatkan terjadinya degradasi gula,
membentuk senyawa-senyawa kimia yang dapat bertindak sebagai racun bagi
pertumbuhan mikroorganisme ketika difermentasi. Senyawa-senyawa tersebut
12 Gambar 9. Pengaruh tekanan terhadap konsentrasi gula pada hidrolisis batang padi
(Karimi dkk., 2006)
Banyak penelitian yang telah dilakukan terkait dengan kinetika hidrolisis
lignoselulosa dengan asam encer. Canettieri dkk. (2007), Mosier dkk. (2002), dan
Torget dkk. (2000) pernah mempelajari kinetika hidrolisis lignoselulosa dengan
model pseudo-homogen. Sementara itu, Joksimovic dan Markovic (2007)
berpendapat bahwa hidrolisis lignoselulosa dengan asam encer merupakan reaksi
heterogen padat-cair. Namun demikian, reaksi tersebut dapat didekati dengan
model pseudo-homogen ketika ukuran partikelnya kurang dari 840 µm. Lavarack
(2002) melakukan penelitian terhadap hidrolisis hemiselulosa pada ampas tebu
dengan asam. Kinetika reaksi diturunkan dari reaksi seri yang terbentuk pada
gugus xilan menjadi xilosa dan xilosa menjadi furfural dengan pendekatan model
reaksi homogen. Hidrolisis diberlakukan pada variasi kondisi: jenis ampas tebu
yaitu bagasse dan bagacillo, suhu (80–200 oC), rasio padatan (1:5-1:20),
konsentrasi asam (0,25–8% berat) dan jenis asam yaitu asam sulfat dan asam
klorida. Perbedaan kedua jenis ampas tebu ini terdapat pada jumlah senyawa
pentosa, yaitu bagasse sebesar 268 mg/g dan bagacillo sebesar 277 mg/g. Pada
kondisi proses (suhu 120 oC, rasio padatan 1:20 dan konsentrasi asam sulfat
0,25% berat) didapatkan furfural terbentuk setelah reaksi berlangsung selama 50
menit. Kondisi optimum didapatkan yield xilosa 80%, yield furfural 15%. Asam
klorida kurang aktif mendegradasi xilosa dibanding asam sulfat. Variasi
13 130 oC. Perbedaan bahan baku relatif tidak memberi pengaruh terhadap degradasi
xilan, demikian juga terhadap kinetika reaksinya, model homogen yang dipilih
dapat menggambarkan hasil percobaan dari kedua bahan baku tersebut.
Berdasarkan penelitian sebelumnya dapat disimpulkan bahwa hidrolisis
lignoselulosa dengan asam encer juga sangat dipengaruhi oleh jenis bahan baku.
Secara lebih detail nilai yield gula pada berbagai variasi jenis bahan baku dapat
dilihat pada Tabel 1.
Tabel 1. Yield gula hasil hidrolisis pada variasi jenis bahan baku (suhu akhir = 180 oC dan konsentrasi asam sulfat = 0,18 mol/L)
Jenis bahan baku Kadar Lignin (%) Yield gula (%)
Daun 10,93 40,75
Sekam padi 14,78 31,13
Ranting 26,27 24,28
Jenis bahan baku yang mudah dihidrolisis adalah daun, sedangkan yang sulit
dihidrolisis adalah ranting. Ranting memiliki lignin yang jumlahnya lebih tinggi
dari pada daun, sehingga ikatan antar selulosanya lebih sulit untuk dipecah-pecah.
Kesimpulan ini didukung oleh Badger (2002) serta Hendriks dan Zeeman (2009),
yang menyatakan bahwa lignin memiliki struktur ikatan penghubung antara
senyawa-senyawa kimia tanaman lain.
Berdasar komposisi senyawa kimia yang terdapat dalam lignoselulosa dan
mekanisme reaksi hidrolisis dengan asam encer dapat diketahui bahwa prediksi
terhadap gula terbentuk pada variasi jenis bahan baku dan kondisi proses sangat
diperlukan. Ikatan antar senyawa kimia dalam lignoselulosa mengakibatkan hasil
yang berbeda pada hidrolisis dengan dengan asam encer. Prediksi tersebut dapat
diselesaikan melalui optimasi mikroskopis dengan metode Monte Carlo.
Model-model Kinetika
Perhitungan matematis terhadap kinetika hidrolisis lignoselulosa dengan
asam sulfat encer pernah dilakukan secara menyeluruh menggunakan empat
14
− =
RT E A
De De
De exp
1. Model 1 = Model homogen dengan anggapan tidak ada degradasi gula.
2. Model 2 = Model homogen dengan anggapan ada degradasi gula.
3. Model 3 = Model heterogen dengan anggapan tidak ada degradasi gula.
4. Model 4 = Model heterogen dengan anggapan ada degradasi gula.
Perhitungan pemodelan matematis ini dibedakan dalam 2 kelompok
berdasarkan variabel percobaan yang dilakukan pada hidrolisis. Kelompok
pertama untuk hidrolisis dengan variasi suhu akhir. Sedangkan kelompok kedua
untuk hidrolisis dengan variasi konsentrasi katalisator.
a. Hidrolisis dengan variasi suhu akhir
Perhitungan model pada kinetika hidrolisis dengan variasi suhu akhir
dilandasi oleh:
1. Parameter Arrhenius baik untuk hidrolisis dan degradasi gula diambil
nilainya konstan pada variasi suhu akhir. Hal ini disebabkan karena faktor
frekuensi dan tenaga pengaktif memang tidak dipengaruhi oleh suhu.
Berarti nilai-nilai Ahyd, Ehyd, Adeg, dan Edeg adalah konstan pada semua
variasi suhu akhir.
2. Menurut Johnstone dan Thring (1957), persamaan (2) dapat dipakai untuk
mengkorelasikan nilai koefisien difusi terhadap suhu.
. (2)
Data perhitungan:
Bahan Baku = Sekam Padi
Konsentrasi katalisator = 0,18 mol/L
Hasil perhitungan untuk masing-masing model dijabarkan sebagai berikut:
1. Model 1 (Model homogen dengan anggapan tidak ada degradasi gula)
Pada model homogen semu tanpa degradasi gula ini, kondisi batas adalah
pada t = 0 nilai-nilai untuk T = 140 oC dan CD = CD(140 C). Langkah awal
perhitungan didahului dengan mencari persamaan yang cocok untuk
15
− =
RT khyd 158,87 exp 39,89
Persamaan dicoba-coba sampai memperoleh yang sesuai dengan data. Persamaan
empiris yang cocok tersebut dituliskan sebagai persamaan (3–6).
Run 1: Sebelum mencapai 160 oC:
T = 140 + 3,3737 t 1,074 , (3)
dan kemudian konstan pada 160 oC.
Run 2: Sebelum mencapai 180 oC:
T = 140 + 3,3737 t 1,074 , (4)
dan kemudian konstan pada 180 oC.
Run 3: Sebelum mencapai 200 oC:
T = 140 + 5,6442 t 0,876 , (5)
dan kemudian konstan pada 200 oC.
Run 4: Sebelum mencapai 220 oC:
T = 140 + 5,5488 t 0,9073 , (6)
dan kemudian konstan pada 220 oC.
Hasilnya adalah nilai order reaksi, m, yang cocok adalah 1 untuk semua
variasi jenis bahan baku. Hasil optimasi Ahyd dan Ehyd dapat dilihat pada
persamaan (7).
, (7)
16 − = RT khyd 3,6.105exp 68,01
− = RT kdeg 4.109exp 98,06
2. Model 2 (Model homogen dengan anggapan ada degradasi gula)
Pada model homogen semu dengan degradasi gula ini, kondisi batas yang
diambil adalah pada t = 0 nilai-nilai untuk T = 140 oC, CB = CB(140 C) dan CD =
CD(140 C). Dengan cara yang sama dengan model 1, hasil perhitungan menunjukkan
bahwa order reaksi untuk hidrolisis yang cocok sebesar 1 dan degradasi gula
sebesar 2. Persamaan Arrheniusnya dinyatakan sebagai persamaan:
, (8)
, (9)
dengan nilai SSE = 4,2259.10-4 dan kesalahan rerata = 1,60%.
Perbandingan data percobaan dan hasil perhitungan dapat dilihat pada
Gambar 10 untuk suhu akhir 160 oC.
0.06 0.08 0.1 0.12 0.14 0.16 0.18 0.2 0.22 0.24
0 5 10 15 20 25 30 35
t (menit)
C
D (
m o l/ L ) 130 160 190 220 250 280 310 340 T ( oC ) CD Hitung CD data T Hitung T data
17 3. Model 3 (Model heterogen dengan anggapan tidak ada degradasi gula)
Kondisi batas yang dipakai untuk menyelesaikan model heterogen ini
adalah sebagai berikut: pada t = 0 nilai-nilai untuk T = 140 oC, CH2SO4 = 0 dan Clig
= Clig(140 C). Hasil perhitungan terhadap nilai-nalai parameter kinetik adalah
sebagai berikut: Ahyd = 7.103 L/(mol.menit), Ehyd = 43,73 kJ/mol, ADe = 5.10-5
cm2/menit, EDe = 37,08 kJ/mol. Nilai SSE = 1,0983.10-4 dan kesalahan rerata =
1,51%.
4. Model 4 (Model heterogen dengan anggapan ada degradasi gula)
Model 4 ini diselesaikan dengan langkah yang sama pada penyelesaian
model 3. Kondisi batas yang dipakai untuk menyelesaikan model heterogen ini
adalah sebagai berikut: pada t = 0 nilai-nilai untuk T = 140 oC, CH2SO4 = 0, Clig =
Clig(140 C), dan CD = CD(140 C). Hasil dari nilai-nilai parameternya: Ahyd = 105
L/(mol.menit), Ehyd = 53,21 kJ/mol, Adeg = 107 1/menit, Edeg = 76,49 kJ/mol, ADe
= 5.10-5 cm2/menit, EDe = 37,08 kJ/mol. Nilai SSE = 1,1052.10-4 dan kesalahan
rerata = 1,55%. Hasil perhitungan dibandingkan dengan data percobaan pada
Gambar 11. 0.05 0.07 0.09 0.11 0.13 0.15 0.17 0.19 0.21 0.23
0 5 10 15 20 25 30 35 waktu (menit)
C
D (
m o l/ L ) 130 160 190 220 250 280 310 340 T ( o C ) CB Data CB Hitung T Data T Hitung
18 b. Hidrolisis pada variasi konsentrasi katalisator
Perhitungan model pada kinetika hidrolisis dengan variasi konsentrasi
katalisator dilandasi oleh:
1. Parameter Arrhenius baik untuk hidrolisis dan degradasi gula diambil
nilainya tidak konstan pada variasi konsentrasi katalisator. Meskipun
faktor frekuensi tidak dipengaruhi oleh konsentrasi katalisator namun
tenaga pengaktif dipengaruhi. Berarti nilai-nilai Ehyd dan Edeg tidak konstan
pada semua variasi konsentrasi katalisator, sedangkan nilai-nilai Ahyd dan
Adeg konstan.
2. Nilai koefisien difusi dipengaruhi oleh suhu (karena prosesnya non
isotermis) dengan persamaan (2).
Data percobaan:
Bahan Baku = Sekam Padi
Suhu Akhir = 180 oC
Langkah-langkah perhitungan dilakukan sama dengan untuk variasi suhu akhir.
1. Model 1
Nilai order reaksi, m, yang cocok adalah 1 dan hasil optimasi
parameter-parameternya disajikan pada Tabel 2. Tabel tersebut menunjukkan bahwa semakin
tinggi konsentrasi katalisator yang dipakai maka tenaga pengaktifnya semakin
menurun. Berarti pada konsentrasi katalisator tinggi reaksi berjalan lebih cepat.
Akibatnya pada waktu yang sama, yield gula yang didapat juga semakin
meningkat pada konsentrasi yang semakin tinggi.
Tabel 2. Nilai-nilai parameter pada model 1 pada variasi konsentrasi katalisator (Ahyd = 158,8682 1/menit dan kesalahan rerata = 2,03%)
Kosentrasi Katalisator (mol/L) Tenaga pengaktif, Ehyd (kJ/mol) SSE
0,3677 39,08 6,18.10-5
0,4045 38,83 2,42.10-4
0,4412 38,49 2,40.10-4
0,4786 38,33 3,46.10-4
0,5149 37,83 9,91.10-4
19
4 2
3427 , 0 15 , 11 )
ln(Ehyd = − CH SO
4 2
02 , 12 701 , 12 ) 50 , 59
ln(Edeg − = − CHSO
2. Model 2
Hasil perhitungan menunjukkan bahwa order reaksi untuk hidrolisis dan
degradasi gula yang cocok masing-masing sebesar 1 dan 2, serta
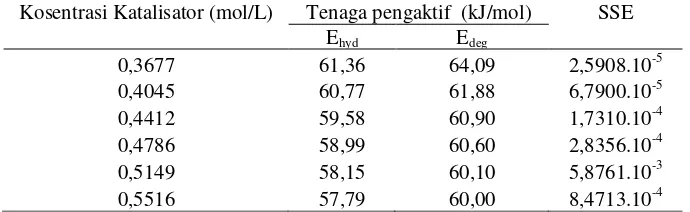
parameter-parameter kinetika reaksi disajikan pada Tabel 3.
Tabel 3. Nilai-nilai parameter pada model 2 pada variasi konsentrasi katalisator (Ahyd =
7,1621.104 1/menit, Adeg = 2,9422.105 L/(mol.menit), dan kesalahan rerata =
1,85%)
Kosentrasi Katalisator (mol/L) Tenaga pengaktif (kJ/mol) SSE
Ehyd Edeg
0,3677 61,36 64,09 2,5908.10-5
0,4045 60,77 61,88 6,7900.10-5
0,4412 59,58 60,90 1,7310.10-4
0,4786 58,99 60,60 2,8356.10-4
0,5149 58,15 60,10 5,8761.10-3
0,5516 57,79 60,00 8,4713.10-4
Korelasi antara tenaga pengaktif dengan konsentrasi katalisator dapat
dinyatakan dengan persamaan (10) dan (11).
, (10)
, (11)
kedua persamaan di atas mengindikasikan bahwa pengaruh konsentrasi katalisator
20
t C C
k lig lig
δ δ = −
4 2 4
2
)
(CH SO k CH SO
f
k = = hyd
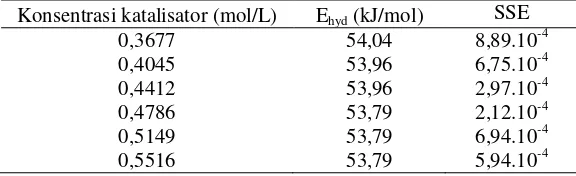
3. Model 3
Nilai-nilai parameter kinetikanya dapat dilihat pada Tabel 4.
Tabel 4. Nilai-nilai parameter pada model 3 dengan variasi konsentrasi katalisator (Ahyd =
9,9.104 L/(mol.menit), ADe = 5.10-5 cm2/menit, EDe = 37,08 kJ/mol, dan
kesalahan rerata = 2,33%)
Konsentrasi katalisator (mol/L) Ehyd (kJ/mol) SSE
0,3677 54,04 8,89.10-4
0,4045 53,96 6,75.10-4
0,4412 53,96 2,97.10-4
0,4786 53,79 2,12.10-4
0,5149 53,79 6,94.10-4
0,5516 53,79 5,94.10-4
Hasil perhitungan terhadap nilai tenaga pengaktif, seperti yang tersaji pada
Tabel 4, terlihat jelas bahwa pada variasi konsentrasi katalisator nilai tenaga
pengaktif hidrolisis yang diperoleh relatif konstan. Hal ini menandakan bahwa
persamaan neraca massa lignoselulosa dapat dipakai (sesuai) untuk
menggambarkan mekanisme hidrolisi yang terjadi. Persamaan tersebut diturunkan
dari hasil simplifikasi persamaan neraca massa lignoselulosa dalam reaktor sistem
batch seperti pada persamaan (12) dan (13).
, (12)
dengan: . (13)
4. Model 4
Tabel 5 (Nilai-nilai parameter kinetika untuk masing-masing variasi
konsentrasi katalisator) menunjukkan dengan jelas bahwa variasi konsentrasi
katalisator relatif tidak berpengaruh terhadap nilai tenaga pengaktif hidrolisis,
21
4 2
0252 , 0 209 , 11 )
ln(Edeg = − CHSO
Tabel 5. Nilai-nilai parameter pada model 4 dengan variasi konsentrasi katalisator (Ahyd = 105 L/(mol.menit), Adeg = 107 1/menit, ADe = 5.10-5 cm2/menit, EDe = 37,08 kJ/mol, dan kesalahan rerata = 2,02%)
Konsentrasi katalisator (mol/L) Ehyd (kJ/mol) Edeg(kJ/mol) SSE
0,3677 53,21 73,16 1,43.10-4
0,4045 53,21 73,08 1,25.10-4
0,4412 53,21 73,00 2,46.10-4
0,4786 53,21 72,91 4,46.10-4
0,5149 53,21 72,87 7,59.10-4
0,5516 53,21 72,83 1,10.10-3
Korelasi antara nilai tenaga pengaktif degradasi gula dan konsentrasi
katalisator dituliskan seperti pada persamaan (14) serta dapat dilihat pada Gambar
12.
. (14)
11,192 11,196 11,200 11,204
0,3 0,35 0,4 0,45 0,5 0,55 0,6
CH2SO4 (mol/L)
ln
(
E
d
e
g)
Data Hitung
Gambar 12. Pengaruh konsentrasi katalis (CH2SO4) terhadap tenaga pengaktif (Edeg) pada model 4
Pada Tabel 4 dan 5 menunjukkan bahwa nilai energi aktivasi difusivitas,
EDE, sekitar 37,08 kJ/mol, lebih besar sedikit dari yang normal menurut Johnstone
dan Thring (1957), yaitu 37 kJ/mol untuk larutan sangat encer. Nilai ini lebih
tinggi dari nilai yang diberikan oleh Johnstone dan Thring karena konsentrasi
asamnya cukup tinggi (0,5516 mol/L). Selain itu, asam sulfat merupakan jenis
22 sehingga suhu operasi relatif rendah untuk asam sulfat. Oleh karena itu efek suhu
terasa kuat.
Sejarah Singkat Monte Carlo
Nama Monte Carlo diambil dari nama sebuah kota di Monaco yang terkenal
sebagai pusat kasino. Di sana pada umumnya judi menggunakan bilangan yang
dibangkitkan secara acak melalui berbagai alat judi. Lalu apa yang sama antara
tehnik simulasi komputer dengan casino Monte Carlo. Unsur peluang berperan
pada keduanya dan dalam waktu yang panjang hasil yang diharapkan akan
muncul. Pemilik kasino ingin agar dalam jangka panjang, dia memperoleh
keuntungan, sementara dalam setiap permainan para penjudi memperoleh
kesempatan yang masuk akal untuk menang. Metode Monte Carlo menggunakan
pembangkit bilangan random untuk membangkitkan kejadian.
Secara sistematik metode Monte Carlo mulai berkembang tahun 1944,
walaupun sebelumnya yaitu pada paruh ke dua abad 19 banyak orang melakukan
percobaan menjatuhkan jarum diantara dua garis sejajar untuk menghitung
pendekatan π . Percobaan tersebut asal mulanya dimulai oleh George Buffon. Tahun 1931 Kolmogorov menunjukkan hubungan antara proses stokastik Markov
dengan persamaan differensial. Tahun 1908 seorang mahasiswa bernama W.S.
Gosset menggunakan percobaan untuk membantunya menemukan distribusi
koefisien korelasi. Pada tahun yang bersamaan mahasiswa menggunakan metode
sampling untuk memantapkan keyakinannya pada distribusi yang disebutnya
distribusi t. Penggunaaan riil dari metode Monte Carlo berasal dari penelitian pada
bom atom selama perang dunia kedua. Pekerjaan ini menyangkut simulasi
langsung dari persoalan probabilistik berkaitan dengan difusi acak neutron pada
material fissile. Tetapi perkembangan sistematik ide ini harus menunggu hasil
karya Harris and Herman Kahn tahun 1948. Sekitar tahun 1948 Fermi,
Metropolis, and Ulam menemukan estimasi Monte Carlo untuk nilai eigen dari
persamaan Schrodinger.
Sekitar tahun 1970, perkembangan teori baru dalam kompleksitas kompuasi
23 Monte Carlo. Teori ini mengidentifikasi sekumpulan masalah dimana saat itu
orang masih berkonsentrasi mendapatkan solusi eksak.
State of The Art
Metode Simulasi Mekanisme Reaksi dengan Monte Carlo
Menurut Banks, Monte Carlo merupakan salah satu jenis metode simulasi
yang dapat digunakan untuk melakukan optimasi mikroskopis dalam memprediksi
proses dunia nyata atau sistem. Simulasi menyangkut pembangkitan proses serta
pengamatan dari proses untuk menarik kesimpulan dari sistem yang diwakili
(Banks, 1998). Metode Monte Carlo memberikan solusi pendekatan untuk
berbagai masalah dengan melakukan ’eksperimen’ sampling statistik pada
komputer. Walaupun pendekatannya stokastik, metode Monte Carlo dapat
dipergunakan untuk mencari solusi pendekatan dari persoalan-persoalan yang
bersifat deterministik. Pemakaian Monte Carlo pada reaksi kimia sudah sering
dilakukan, namun secara spesifik untuk reaksi hidrolisis lignoselulosa dengan
asam (Silva dan Freitas, 2007; Edgecombe dan Linse, 2008; Balabanyan dkk.,
2005; Meimaroglu dkk., 2011; Meimaroglu dkk., 2007; Krallis, 2008).
Secara umum, simulasi sebagai suatu cara menyelesaikan masalah,
mempunyai tahapan-tahapan atau langkah-langkah penting yang harus dilalui
diantaranya:
1. Formulasi masalah-mekanisme reaksi hidrolisis
2. Menyusun tujuan-panjang rantai yang berikatan dengan H2O
3. Pembuatan model-menggunakan metode Monte Carlo
4. Pengumpulan data-percobaan hidrolisis dengan variasi jenis bahan baku dan
kondisi proses
5. Verifikasi program komputer
7. Validasi model
Langkah yang paling sulit dan menentukan dalam simulasi dengan Monte
Carlo adalah membangkitakn bilangan random, yang dapat terdistribusi seragam.
Saat ini dapat dipastikan bahwa semua paket pemrograman sudah dilengkapi
24 seragam. Salah satu cara yang dapat dipergunakan membangkitkan bilangan
random adalah dengan menggunakan prinsip bilangan kongruensi modulo. Tehnik
ini dikenal dengan sebutan Linier Congruential Generator (LCG). Bentuk
umumnya adalah
X < −i + 1 = aX < −i + c(mod m)
dengan X0 sebagai seed dan a, m ∈ Z+, c adalah nol atau bilangan postif. Jika
c≠0 disebut mixed congruential generator sedangkan jika c=0 disebut
Multiplicative Linear Congruential Generator (MLCG). Maka X∈{0, 1, 2, · · · ,
m−1}. X disebut menyerupai bilangan random (pseudo random numbers). Disebut
“menyerupai” karena sesungguhnya barisan bilangan yang terjadi bersifat
deterministik dengan pola yang berulang dengan panjang tertentu. Algoritma
untuk menghasilkan bilangan bulat random pada interval (0, m) akan dinyatakan
25 BAB 3
TUJUAN DAN MANFAAT PENELITIAN
Tujuan Penelitian
Tujuan umum penelitian ini adalah melakukan optimasi mikroskopis dan
makroskopis hidrolisis lignoselulosa dengan asam encer sebagai katalis pada
kondisi non-isotermal.
Tujuan khusus penelitian pada tahun pertama untuk optimasi mikroskopis
hidrolisis lignoselulosa dengan asam encer sebagai katalis pada kondisi
non-isotermal. Tujuan khusus tersebut dapat dituliskan sebagai berikut:
1. Menyusun algoritma perhitungan konsentrasi gula hasil hidrolisis
lignoselulosa dengan asam encer sebagai katalis pada kondisi non-isotermal
dengan model kinetika yang diselesaikan menggunakan Runge-Kutta.
2. Menyusun algoritma perhitungan konsentrasi gula hasil hidrolisis
lignoselulosa dengan asam encer sebagai katalis pada kondisi non-isotermal
dengan menggunakan metode Monte Carlo.
3. Mencari parameter-parameter reaksi hidrolisis lignoselulosa dengan asam
encer pada kondisi non-isotermal menggunakan metode Monte Carlo.
Tujuan khusus penelitian pada tahun kedua untuk optimasi makroskopis
hidrolisis lignoselulosa dengan asam encer sebagai katalis pada kondisi
non-isotermal. Tujuan khusus tahun kedua dapat dituliskan sebagai berikut:
1. Mencari persaman hubungan antara variabel proses dengan konsentrasi gula
hasil hidrolisis lignoselulosa dengan asam encer pada kondisi non-isotermal
menggunakan Response Surface Methodology.
2. Mencari kondisi optimum pada hidrolisis lignoselulosa dengan asam encer
pada kondisi non-isotermal menggunakan Response Surface Methodology.
3. Mendapatkan batasan jenis bahan baku yang prospek untuk dikonversi menjadi
26 Manfaat Penelitian
Manfaat penelitian ini terlihat pada latar belakang yang diuraikan dan tujuan
yang akan dicapai, yaitu untuk kepentingan negara akan sumber energi
terbarukan, khususnya pemanfaatan limbah organik berbasis lignoselulosa untuk
dikonversi menjadi etanol. Didasari bahwa Indonesia sebagai negara tropis, maka
konversi sumber bahan baku berbasis lignoselulosa menjadi etanol sangat penting
untuk dipelajari. Kondisi masyarakat Indonesia menunjukkan bahwa jenis bahan
baku yang dalam waktu dekat yang cukup menjanjikan untuk diimplementasikan
adalah limbah organik perkotaan, berupa sekam padi, tongkol jagung, ranting,
daun, dan serbuk gergaji kayu, dengan cara hidrolisis dengan asam dan fermentasi
dengan yeast. Penelitian ini akan memodelkan mekanisme hidrolisis lignoselulosa
dengan asam encer menggunakan metode Monte Carlo. Hasil simulasi juga
dibandingkan dengan hasil perhitungan menggunakan metode kinetika dan
selanjutkan akan dioptimasi berdasar data percobaan dalam rangka mendapatkan
parameter-parameter reaksinya. Oleh karena ini, kontribusi dan manfaat yang
akan diberikan oleh hasil-hasil penelitian ini terhadap ilmu pengetahuan atau
pembangunan antara lain:
1. Hasil kegiatan penelitian ini diharapkan dapat memberikan manfaat bagi
pengembangan ilmu pengetahuan, terutama dalam perhitungan konsentrasi
gula hasil hidrolisis lignoselulosa menggunakan asam encer sebagai katalis
pada kondisi non-isotermal menggunakan metode simulasi dengan Monte
Carlo. Selain itu, hasil penelitian ini akan memberikan kajian fundamental
yang sangat bermanfaat terhadap pemecahan masalah kinetika yang sulit
dipecahkan karena membutuhkan penyelesaian persamaan diferensial derajad
tinggi.
2. Penelitian ini menghasilkan program simulasi dengan Monte Carlo untuk
menghitung konsentrasi gula hasil hidrolisis yang dapat diterapkan untuk
semua jenis bahan baku dengan panjang rantai pada ikatan selulosanya yang
27 m
B hyd
D k C
dt dC
=
) (
exp
T R
E A
khyd hyd hyd − =
BAB 4
METODE PENELITIAN
Kegiatan penelitian ini mencakup dua tahapan penting, yaitu menyusun
program simulasi dengan komputer dan melakukan percobaan di laboratorium
untuk mendapatkan data nyata. Program yang disusun terdiri dari tiga program.
Program pertama merupakan program perhitungan konsentrasi gula hasil
hidrolisis menggunakan metode kinetika yang diselesaikan dengan Runge-Kutta.
Program kedua untuk perhitungan konsentrasi gula menggunakan metode simulasi
dengan Monte Carlo. Program ketiga, melakukan optimasi parameter-parameter
reaksi hidrolisis menggunakan Monte Carlo. Sementara itu, percobaan di
laboratorium dikerjakan untuk mencari data konsentrasi gula hasil hidrolisis pada
variasi bahan baku, waktu, dan suhu.
4.1. Menyusun Program
4.1.1. Program perhitungan konsentrasi gula menggunakan model kinetika
disusun menggunakan persamaan-persamaan berikut.
a. Persamaan neraca massa untuk gula:
. (15)
b. Konstanta reaksi, khycd, dipengaruhi oleh suhu. Konstanta reaksi tersebut
diekspresikan dengan persamaan Arrhenius (Fogler, 1999), sebagaimana
dalam persamaan:
. (16)
c. Hidrolisis dijalankan pada kondisi non-isotermis sehingga nilai suhu
berubah selama hidrolisis,
28 d. Persamaan diferensial (15) tersebut akan diselesaikan dengan
menggunakan Runge-Kutta.
e. Pemograman dilakukan menggunakan Fortran versi Salford Plato.
4.1.2. Program perhitungan konsentrasi gula menggunakan simulasi dengan
Monte Carlo yang disusun menggunakan imaginasi berdasarkan
mekanisme reaksi hidrolisis sebagai berikut:
a. Reaksi hidrolisis disederhanakan sebagai reaksi depolimerisasi dari
polimer gula menjadi polimer gula dengan panjang rantai yang lebih kecil
dengan tujuan akhir menjadi monomer gula itu sendiri. Reaksi
depolimerisasi tersebut dapat dituliskan sebagai berikut.
… (18)
… (19)
… (20)
.
.
… (21)
Pada deretan persamaan reaksi di atas, symbol i adalah derajad
poliemarisasi dari polimer gula.
b. Berdasarkan mekanisme reaksi hidrolisis, bilangan random pertama
digunakan untuk menentukan kapan terjadinya perpecahan rantai polimer.
Nilai rata-rata interval waktu dihitung menggunakan formula di bawah ini:
(22)
c. Bilangan random kedua digunakan untuk menentukan rantai polimer yang
mana yang pecah.
d. Kedua bilangan random itu digunakan untuk menentukan probabilitas
29
(23)
e. Pemograman dilakukan menggunakan Fortran versi Salford Plato.
f. Program digunakan juga untuk mencari parameter-parameter reaksi
hidrolisis dengan cara curve-fitting antara data percobaan dengan hasil
perhitungan.
4.2. Melakukan Percobaan Laboratorium
4.2.1.Bahan
Bahan-bahan yang digunakan meliputi bahan baku lignoselulosa,
bahan-bahan kimia yang digunakan untuk hidrolisis, fermentasi, dan
pengujian-pengujian. Komposisi bahan baku berdasarkan kadar hemiselulosa, selulosa, dan
lignin disajikan pada Tabel 6 dan bahan-bahan kimia yang digunakan disajikan
pada Tabel 7. Jumlah komposisi pada Tabel 6 tidak 100% karena
senyawa-senyawa lain (pati, oligosakarida, dan senyawa-senyawa ekstraktif lain) tidak dianalisis.
Tabel 6. Kadar lignoselulosa dalam bahan baku
Jenis bahan baku Hemiselulosa (%) Selulosa (%) Lignin (%)
run 1 run 2 run 1 run 2 run 1 run 2
Serbuk gergaji kayu 08,83 9,55 33,23 36,25 31,55 30,91
Tongkol jagung 29,37 28,66 32,15 31,93 21,17 20,95
Tabel 7. Bahan-bahan kimia yang digunakan
Nama bahan Kegunaan Keterangan
Asam sulfat Katalisator untuk hidrolisi
Merck, Art. 713
Fehling A dan B
Analisis glukosa Produk lokal (konsentrasi 0,025 mol/L)
Glukosa standar
Analisis Fehling D(+)-Glucose-Monohydrat, Merck,
30 4.2.2. Variabel Penelitian
Variabel penelitian meliputi: jenis bahan baku (tongkol jagung, serbuk
gergaji kayu, dan campuran), suhu akhir (160, 180, 200, 220 oC), dan waktu (0, 5,
10, 15, 20, 25, 30, 35 menit). Hidrolisis dengan variasi suhu akhir dan waktu
dilakukan pada semua variasi jenis bahan baku dengan konsentrasi katalisator
tetap (0,18 mol/L).
4.2.3.Alat Percobaan
Peralatan hidrolisis dapat dilihat pada Gambar 13.
Autoclave Diameter = 14 cm dan tinggi = 12,5 cm
Flash chamber Diameter = 4 cm dan tinggi = 17,5 cm Pendingin Diameter = 5 cm dan tinggi = 40 cm
Gambar 13. Rangkaian alat hidrolisis 2
8
1 4
5
7 6
3
9
10
Keterangan:
1. Reaktor (Autoclave) 2. Alat ukur tekanan 3. Kran pengambilan sample 4. Termokopel
5. Motor penggerak reaktor 6. Termostat
7. Kontaktor 8. Pendingin 9. Flash chamber
31 0 0 0 100 x C C gula yield B D = L mol m x m x C lig S lig H B 180 111 , 1 . . 180 150 . ) 136 , 1 . . ( 0 + = Pelaksanaan penelitian
Hidrolisis diawali dengan memasukkan larutan asam sulfat dan
lignoselulosa dengan berat tertentu ke dalam reaktor (autoclave). Kemudian
reaktor ditutup dengan sempurna dan pemanas serta motor pengaduk dinyalakan.
Melalui termostat suhu diset pada angka tertentu. Selama reaksi berlangsung, suhu
akan naik terus (non-isotermis) sampai mencapai suhu tertentu, lalu dijaga
konstan (suhu akhir). Suhu pada berbagai waktu dicatat. Ketika suhu mencapai
140 oC, diambil sampel pertama kira-kira 6 mL dan seterusnya sampel diambil
setiap interval 5 menit sampai proses berlangsung 35 menit. Selanjutnya
konsentrasi gula dalam sampel dianalisis dengan metode Fehling.
4.2.4.Analisis hasil
Analisis gula dalam sampel hasil hidrolisis dilakukan dengan metode
Fehling. Hasil analisis menunjukkan nilai konsentrasi gula hasil hidrolisis (CD).
Hasil hidrolisis pada pustaka sering dinyatakan sebagai nilai yield gula. Oleh
karena itu nilai konsentrasi gula perlu dikonversi menjadi nilai yield gula, yaitu
perbandingan konsentrasi gula hasil hidrolisis (CD) terhadap kadar gula total (CB0)
dalam bahan baku, seperti pada persamaan (23).
. (23)
Sementara itu kadar gula total dalam bahan baku dihitung dengan persamaan (24).
32
BAB 5
HASIL DAN PEMBAHASAN
Hasil dari penelitian fundamental ini berupa program simulasi perhitungan
konsentrasi gula menggunakan model kinetika yang diselesaikan dengan
Runge-Kutta dan simulasi dengan Monte Carlo, serta data eksperimen untuk kemudian
akan digunakan mencari parameter-parameter reaksinya. Program perhitungan
menggunakan metode kinetika ini merupakan salah satu cara yang sudah teruji
keakuratannya dan didukung oleh teori-teori fundamental yang sudah diuraikan
pada laporan ini. Hasil program ini dijadikan acuan untuk menguji hasil program
perhitungan menggunakan metode simulasi dengan Monte Carlo. Adapun hasil
program dapat dilihat pada tampilan berikut ini.
C BATCH HYDROLYSIS C RUNGE-KUTTA METHOD
C A(J) + H2O ---> A(1) + A(J-1) C A(J) + H20 ---> A(2) + A(J-2) C A(J) + H20 ---> A(3) + A(J-3) C .
C . C .
C A(J) + H20 ---> A(J-1) + A(1) C MAY 20, 2012
DIMENSION CPOL(1000),AKRK1(1000),AKRK2(1000), A AKRK3(1000),AKRK4(1000),CTRANS(1000), A FUNGSI(1000),FKON(1000)
C INITIAL CONCENTRATION OF MONOMER, MOL/L C0=1.
C MAXIMUM TEMPERATURE TMAX=493.
C TIME INCREMENT, MIN DELT=0.1
C TIME OF SIMULATION, MIN TEND=40.
NSIM=INT(TEND/DELT+0.001) C TIME UNTIL PRINT
TPRINT=5.
NEVAL=INT(TPRINT/DELT+0.001)
C NUMBER OF DEGREE OF POLYMERIZATION OF INITIAL MOLECULES NINIT=80
33 CPOL(NINIT)=C0
DO 10,I=1,NINIT-1 CPOL(I)=0.
10 CONTINUE
C SIMULATION STARTS HERE ISIM=0
IEVAL=0
C RUNGE-KUTTA CALCULATION 20 TIME=FLOAT(ISIM)*DELT DO 30,I=1,NINIT CTRANS(I)=CPOL(I) 30 CONTINUE CALL DIFEQ(TMAX,NINIT,TIME,CTRANS,FUNGSI) DO 40,I=1,NINIT AKRK1(I)=FUNGSI(I)*DELT 40 CONTINUE TIME=TIME+DELT/2. DO 50,I=1,NINIT CTRANS(I)=CPOL(I)+AKRK1(I)/2. 50 CONTINUE CALL DIFEQ(TMAX,NINIT,TIME,CTRANS,FUNGSI) DO 60 I=1,NINIT
AKRK2(I)=FUNGSI(I)*DELT 60 CONTINUE
DO 70 I=1,NINIT
CTRANS(I)=CPOL(I)+AKRK2(I)/2. 70 CONTINUE CALL DIFEQ(TMAX,NINIT,TIME,CTRANS,FUNGSI) DO 80,I=1,NINIT AKRK3(I)=FUNGSI(I)*DELT 80 CONTINUE TIME=TIME+DELT/2. DO 90,I=1,NINIT CTRANS(I)=CPOL(I)+AKRK3(I) 90 CONTINUE CALL DIFEQ(TMAX,NINIT,TIME,CTRANS,FUNGSI) DO 100,I=1,NINIT AKRK4(I)=FUNGSI(I)*DELT 100 CONTINUE DO 110,I=1,NINIT CPOL(I)=CPOL(I)+(AKRK1(I)+2.*AKRK2(I)+ A 2.*AKRK3(I)+AKRK4(I))/6. 110 CONTINUE
ISIM=ISIM+1 IEVAL=IEVAL+1
IF(IEVAL .EQ. NEVAL) GOTO 120 GOTO 20
120 DO 130,I=1,NINIT FKON(I)=CPOL(I)/C0 130 CONTINUE
TOTAL=0.
34 140 CONTINUE
WRITE(*,250) FLOAT(ISIM)*DELT WRITE(*,255)
WRITE(*,260)
WRITE(*,270) DO 150 I=1,10
WRITE(*,280)I,FKON(I),CPOL(I)/TOTAL 150 CONTINUE
WRITE(*,270) IEVAL=0
IF(ISIM .LT. NSIM) GOTO 20 250 FORMAT(/2X,'TIME = ',F7.2,' MIN')
255 FORMAT(2X,'---')
260 FORMAT(4X,'NPOLY',5X,' CI/C0 ',4X,' POP(I) ') 270 FORMAT(4X,'---',5X,'---',4X,'---') 280 FORMAT(5X,I4,5X,F7.3,6X,F6.4)
STOP END
SUBROUTINE DIFEQ(TMAX,NINIT,TIME,CTRANS,FUNGSI) C CALCULATING DERIVATIVES
C MAY 20, 2012
DIMENSION CTRANS(1000),FUNGSI(1000) TEMP=413.+5.5*TIME**0.91
IF(TEMP .GT. TMAX)THEN TEMP=TMAX
ENDIF
AK=6.E6*EXP(-80000/8.314/TEMP) DO 500,J=1,NINIT
FUNGSI(J)=0.
DO 450,I=J+1,NINIT
FUNGSI(J)=FUNGSI(J)+2.*AK*CTRANS(I) 450 CONTINUE
FUNGSI(J)=FUNGSI(J)-FLOAT(J-1)*AK*CTRANS(J) 500 CONTINUE
RETURN
END
Hasil program dapat dilihat pada Gambar 14-18. Pada gambar-gambar
tersebut, hasil program perhitungan dengan model kinetika yang diselesaikan
menggunakan Runge-Kutta langsung ditampilkan bersama hasil program
menggunakan simulasi dengan Monte Carlo. Sementara itu untuk program
simulasi menggunakan Monte Carlo dapat disajikan seperti di bawah ini. Program
ini sudah diterima sebagai salah satu cara untuk menyelesaikan perhitungan pada
35
C BATCH HYDROLISIS C NON-ISOTHERMIC C MONTE CARLO METHOD
C A(J) + H2O ---> A(1) + A(J-1) C A(J) + H20 ---> A(2) + A(J-2) C A(J) + H20 ---> A(3) + A(J-3) C .
C . C .
C A(J) + H20 ---> A(J-1) + A(1) C MAY 20, 2012
DIMENSION ISTAT(500000),FMOL(50000)
C DEGREES OF POLYMERIZATION OF INITIAL POLYMERS NINIT=80
C MAXIMUM (FINAL)TEMPERATURE OF REACTION, K TMAX=493.
C MAXIMUM REACTION RATE CONSTANT, MOL/L/MIN TEMP=TMAX
CALL AKREAC(TEMP,AK) AKMAX=AK
C TIME OF SIMULATION, MIN TEND=40.
C NUMBER OF INITIAL POLYMER
C (NMOL0*NINIT MUST BE LESS THAN DIMENSION OF ISTAT) NMOL0=500
C NUMBER OF INITIAL BONDS NBOND=NINIT*NMOL0
C MINIMUM REACTION TIME AT INITIAL CONCENTRATION, MIN DELTR=1./AKMAX/FLOAT(NBOND)
C TIME INCREMENT (DELT MUST BE LESS OR EQUAL TO DELTR) DELT=0.001
IF(DELT .LE. DELTR) GOTO 15 WRITE(*,10)
10 FORMAT(2X,'DELT TOO LARGE, USE SMALLER DELT!') GOTO 290
15 IF(DELT .GE. 0.2*DELTR) GOTO 20 WRITE(*,18)
18 FORMAT(2X,'DELT TOO SMALL, USE LARGE DELT!') GOTO 290
C PROBABILITY OF REACTION
20 PROB=DELT/DELTR C NUMBER OF SIMULATION STEPS NSIM=INT(TEND/DELT+0.001)
C TIME INCREMENT FOR EVALUATION DELTP=5.
NEVAL=INT(DELTP/DELT+0.001)
C INITIAL STATUS OF BONDS(1=EXISTED, 0=NOT EXISTED) DO 30, I=1,NBOND
ISTAT(I)=1 30 CONTINUE
36
ISTAT(I)=0 40 CONTINUE
C SIMULATION STARTS HERE ISIM=0
IEVAL=0
C INDEX OF REACTING BOND 50 TIME=FLOAT(ISIM)*DELT
TEMP=413.+5.5*TIME**0.91 IF(TEMP .GT. TMAX)THEN TEMP=TMAX
ENDIF
CALL AKREAC(TEMP,AK) RATIO=AK/AKMAX
GAMA=RANDOM() Y=PROB*RATIO
IF(GAMA .GT. Y) GOTO 60
IREAC=1+RANDOM()*FLOAT(NBOND-1) IF(ISTAT(IREAC) .EQ. 0) GOTO 60 ISTAT(IREAC)=0
60 ISIM=ISIM+1 IEVAL=IEVAL+1
IF(IEVAL .EQ. NEVAL) GOTO 90 GOTO 50
90 CALL POPULATION(NINIT,NMOL0,NBOND,ISTAT,FMOL) WRITE(*,250) TIME
WRITE(*,255) WRITE(*,260) WRITE(*,270) TOTAL=0.
DO 120,I=1,NINIT TOTAL=TOTAL+FMOL(I) 120 CONTINUE
DO 130,I=1,10
WRITE(*,280)I,FMOL(I),FMOL(I)/TOTAL 130 CONTINUE
WRITE(*,270) IEVAL=0
IF(ISIM .LT. NSIM) GOTO 50 250 FORMAT(/2X,'TIME = ',F7.2,' MIN')
255 FORMAT(2X,'---')
260 FORMAT(4X,'NPOLY',4X,' CI/C0 ',4X,' POP(I) ') 270 FORMAT(4X,'---',4X,'---',4X,'---') 280 FORMAT(5X,I4,3X,F9.3,6X,F6.4)
290 STOP END
SUBROUTINE POPULATION(NINIT,NMOL0,NBOND,ISTAT,FMOL) C CALCULATING DISTRIBUTION BASED ON COUNTED NUMBER DATA DIMENSION ISTAT(500000),JSUM(20000),FMOL(20000)
37
640 CONTINUE ISTART=0
DO 700,I=1,NBOND
IF(ISTAT(I).EQ. 1) GOTO 700 IEND=I
NPOLY=IEND-ISTART
JSUM(NPOLY)=JSUM(NPOLY)+1 ISTART=IEND
700 CONTINUE
DO 720,I=1,NINIT
FMOL(I)=FLOAT(JSUM(I))/NMOL0 720 CONTINUE
RETURN END
SUBROUTINE AKREAC(TEMP,AK)
AK=6.E6*EXP(-80000/8.314/TEMP) RETURN
END
Di awal ketika melakukan pemograman, hasil simulasi Monte Carlo ini
belum sempurna karena di beberapa bagian terlihat osilasi yang menandakan
bahwa kurva hasil perhitungan belum memiliki konsistensi atau konvergen.
Simulasi dicoba-coba lagi dengan memperbesar nilai derajad polimerisasi sampai
diperoleh hasil perhitungan yang mendekati model kinetika, untuk derajad
polimerisasi 400 hasilnya pada Gambar 15 dan untuk 600 pada Gambar 16. Pada
derajad polimerisasi yang semakin tinggi (1000), hasil simulasi untuk perhitungan
konsentrasi gula hasil hidrolisis dengan asam encer pada kondisi non-isotermal
sudah baik dan hasilnya disajikan pada Gambar 17. Bahkan, untuk waktu reaksi
yang lama, yang awalnya 35 menit menjadi 40 menit, konsistensi kurva dapat
dipertahankan. Pada Gambar 18 terlihat bahwa simulasi Monte Carlo dapat
38 Gambar 14. Perbandingan hasil perhitungan menggunakan model kinetik (spotted line) dengan model Monte Carlo (solid line) pada hidrolisis 35 menit pada derajad
polimerisasi 200
Gambar 15. Perbandingan hasil perhitungan menggunakan model kinetik (spotted line) dengan model Monte Carlo (solid line) pada hidrolisis 35 menit pada derajad
39 Gambar 16. Perbandingan hasil perhitungan menggunakan model kinetik (spotted line) dengan model Monte Carlo (solid line) pada hidrolisis 35 menit pada derajad
polimerisasi 600
Gambar 17. Perbandingan hasil perhitungan menggunakan model kinetik (spotted line) dengan model Monte Carlo (solid line) pada derajad polerisasi 1000
40 Gambar 18. Perbandingan hasil perhitungan menggunakan model kinetik (spotted
line) dengan model Monte Carlo (solid line) pada derajad polimerisasi 1000 dan waktu 40 menit
41 Selain membuat program perhitungan, penelitian ini juga melakukan
percobaan laboratorium untuk mendapatkan data hidrolisis lignoselulosa dengan
asam encer dengan variasi bahan baku tongkol jagung, grajen kayu, dan campuran
bahan baku. Adapun hasilnya dituliskan sebagai berikut.
Bahan Baku: Tongkol jagung
Kadar gula total : 1,0098 mol/L
Hasil pengukuran suhu dan konsentrasi gula total hasil hidrolisis dapat
dilihat pada Tabel 8. Yield gula dari hasil hidrolisis tongkol jagung ini lebih kecil
bila dibandingkan dengan data pustaka. Pertama, perbandingan dilakukan
terhadap hasil hidrolisis dengan pemakaian asam sulfat 1% (0,36 mol/L) dan suhu
121 oC selama 1 jam. Glukosa yang dihasilkan sebesar 50,4 g/L (yield gula
sebesar 42,84%) (O’Brien, dkk., 2004).
Tabel 8. Data percobaan untuk bahan baku tongkol jagung Waktu
(menit)
Run 1 = suhu akhir 160 oC Run 2 = suhu akhir 180 oC Suhu
(oC)
Konsentrasi gula (mol/L)
Suhu (oC)
Konsentrasi gula (mol/L)
0 140 0,122 140 0,122
5 158 0,124 160 0,126
10 160 0,134 180 0,138
15 160 0,140 180 0,148
20 160 0,148 180 0,154
25 160 0,152 180 0,164
30 160 0,160 180 0,170
35 160 0,162 180 0,184
Yield = 16,0428 % 18,2214 %
Run 3 = suhu akhir 200 oC Run 4 = suhu akhir 220 oC
0 140 0,122 140 0,123
5 161 0,126 161 0,130
10 184 0,144 187 0,146
15 202 0,148 204 0,160
20 200 0,164 220 0,192
25 200 0,196 220 0,215
30 200 0,206 220 0,246
35 200 0,218 220 0,266
42 Kedua, perbandingan terhadap pemakaian konsentrasi katalisator lebih tinggi (0,6
mol/L) dan suhu 130 oC dan waktu reaksi 50 menit. Yield gula yang didapatkan
sebesar +60% (Saracoglu, dkk., 1998). Sementara itu, pada penelitian ini, suhu
160 oC, waktu reaksi 35 menit, dan konsentrasi asam 0,18 mol/L (0,5%), yield
gula yang didapatkan sebesar 16,04% (0,162 mol/L). Hasil perbandingan ini
menunjukkan bahwa pemakaian katalisator dengan konsentrasi tinggi dapat
meninggkatkan yield gula.
Bahan Baku: Serbuk gergaji kayu
Kadar gula total : 0,7305 mol/L
Hasil pengukuran suhu dan konsentrasi gula total hasil hidrolisis dapat dilihat
pada Tabel 9.
Tabel 9. Data percobaan untuk bahan baku serbuk gergaji kayu Waktu
(menit)
Run 1 = suhu akhir 160 oC Run 2 = suhu akhir 180 oC Suhu
(oC)
Konsentrasi gula (mol/L)
Suhu (oC)
Konsentrasi gula (mol/L)
0 140 0,070 140 0,071
5 160 0,080 157 0,079
10 160 0,085 179 0,092
15 160 0,092 180 0,102
20 160 0,095 180 0,110
25 160 0,102 180 0,118
30 160 0,107 180 0,124
35 160 0,110