PENETAPAN KADAR ASIKLOVIR PADA SEDIAAN TABLET MENGGUNAKAN PELARUT HCl SECARA SPEKTROFOTOMETRI ULTRAVIOLET
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh: Tiwi Anggraini NIM : 078114106
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
i
PENETAPAN KADAR ASIKLOVIR PADA SEDIAAN TABLET MENGGUNAKAN PELARUT HCl SECARA SPEKTROFOTOMETRI ULTRAVIOLET
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh: Tiwi Anggraini NIM : 078114106
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
2011
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
ii
Persetujuan Pembimbing
PENETAPAN KADAR ASIKLOVIR PADA SEDIAAN TABLET MENGGUNAKAN PELARUT HCl SECARA SPEKTROFOTOMETRI ULTRAVIOLET
Skripsi yang diajukan oleh: Tiwi Anggraini NIM : 078114106
telah disetujui oleh:
Pembimbing Utama
Prof. Dr. Sudibyo Martono, M.S., Apt. Tanggal : 10 Agustus 2011
Pengesahan Skripsi Berjudul
PENET APAN KADAR ASIKLOVIR PAD A SEDIAAN TABLET MENGGUNAKAN PELARUT HCl SECARA SPEKTROFOTOMETRI ULTRAVIOLET
Oleh: Tiwi Anggraini NIM: 078114106
Dipertahankan di hadapan Panitia Penguji Skripsi Fakultas Farmasi
Universitas Sanata Dharma pada tanggal : 19 Oktober 2011
Mengetahui Fakultas Farmasi
Pembimbing
Prof. Dr. Sudibyo Martono, M.S., Apt.
Panitia Penguji
1. Prof. Dr. Sudibyo Martono, M.S., Apt.
2. Christine Patramurti, M.Si., Apt.
3. Jeffry Julianus, M.Si.
iii
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
iv
PERNYATAAN KEASLIAN KARYA
Saya menyatakan dengan sesungguhnya bahwa skripsi yang saya tulis ini tidak memuat karya atau bagian karya orang lain, kecuali yang telah disebutkan dalam kutipan dan daftar pustaka, sebagaimana layaknya karya ilmiah.
Apabila di kemudian hari ditemukan indikasi plagiarisme dalam naskah ini, maka saya bersedia menanggung segala sanksi sesuai peraturan perundang-undangan yang berlaku.
Yogyakarta, 8 Oktober 2011 Penulis
v
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS
Yang bertanda tangan di bawah ini, saya mahasiswa Universitas Sanata Dharma:
Nama : Tiwi Anggraini
Nomor Mahasiswa : 078114106
Demi pengembangan ilmu pengetahuan, saya memberikan kepada Perpustakaan Universitas Sanata Dharma karya ilmiah saya yang berjudul:
PENETAPAN KADAR ASIKLOVIR PADA SEDIAAN TABLET MENGGUNAKAN PELARUT HCl SECARA SPEKTROFOTOMETRI ULTRAVIOLET
beserta perangkat yang diperlukan (bila ada). Dengan demikian saya memberikan kepada Perpustakaan Universitas Sanata Dharma hak untuk menyimpan, mengalihkan dalam bentuk media lain, mengelolanya dalam bentuk pangkalan data, mendistribusikan secara terbatas, dan mempublikasikannya di Internet atau media lain untuk kepentingan akademis tanpa perlu meminta ijin dari saya maupun memberikan royalti kepada saya selama tetap mencantumkan nama saya sebagai penulis.
Demikian pernyataan ini yang saya buat dengan sebenarnya. Dibuat di Yogyakarta
Pada tanggal: 8 Oktober 2011 Yang menyatakan
(Tiwi Anggraini)
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
vi
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Tuhan Yang Maha Esa atas segala anugerah dan bimbingan-Nya kepada penulis selama menyelesaikan penelitian ini.
Skripsi berjudul “Penetapan Kadar Asiklovir pada Sediaan Tablet Menggunakan Pelarut HCl secara Spektrofotometri Ultraviolet” ini disusun dalam rangka untuk memenuhi salah satu syarat memperoleh gelar Sarjana Farmasi (S.Farm) Program Studi Ilmu Farmasi Universitas Sanata Dharma.
Keberhasilan dalam penulisan skripsi ini juga tidak terlepas dari bantuan dan dukungan berbagai pihak yang telah memberikan saran, kritik, dan dukungan kepada penulis, maka dari itu penulis mengucapkan terima kasih yang sebesar-besarnya kepada:
1. Ipang Djunarko, M.Sc., Apt. selaku Dekan Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
2. Prof. Dr. Sudibyo Martono, M.S., Apt. selaku dosen pembimbing yang dengan sabar memberikan pengarahan, masukan, kritik dan saran baik selama penelitian maupun penyusunan skripsi ini.
3. Christine Patramurti, M.Si., Apt. selaku dosen penguji yang telah memberikan kritik dan saran yang bermanfaat untuk skripsi ini.
4. Jeffry Julianus, M.Si. selaku dosen penguji yang telah memberikan kritik dan saran yang bermanfaat untuk skripsi ini.
vii
5. PT. Novell Pharmaceutical Laboratories yang telah bersedia memberikan baku Asiklovir yang berguna dalam skripsi.
6. Mike dan Ibu Endang Wijayanti yang telah bersedia memberikan HCl untuk penelitian ini.
7. Segenap dosen dan karyawan atas ilmu dan pengalaman yang berharga sehingga berguna dalam proses penyusunanan skripsi.
8. Pak Parlan, Mas Kunto, dan Mas Bimo selaku laboran Laboratorium Kimia Analisis, Laboratorium Kimia Organik dan Laboratorium Kimia Analisis Instrumental, Fakultas Farmasi Universitas Sanata Dharma Yogyakarta yang telah banyak membantu selama proses penelitian di laboratorium.
9. Papa, Mama, dan Adjie yang selalu memberikan semangat, doa, dan dukungan sampai akhirnya skripsi ini selesai.
10. Teman-teman FST 07 dan kelas C 2007 atas segala dukungan, semangat dan persahabatan yang terjalin selama perkuliahan.
11. Semua pihak yang telah membantu penulis dan tidak tertulis di sini, terima kasih atas semua bantuannya.
Penulis menyadari bahwa penyusunan skripsi ini masih banyak kekurangan, untuk itu penulis dengan senang hati menerima segala kritik dan saran yang dapat membangun penelitian ini. Akhir kata, penulis berharap hasil penelitian ini dapat bermanfaat bagi pembaca sekalian.
Penulis
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
viii
DAFTAR ISI
HALAMAN JUDUL ………. i
HALAMAN PERSETUJUAN PEMBIMBING ……….….. ii
HALAMAN PENGESAHAN ………... iii
PERNYATAAN KEASLIAN KARYA ……… iv
HALAMAN PERSETUJUAN PUBLIKASI ……… v
PRAKATA ……… vi
DAFTAR ISI ………. viii
DAFTAR TABEL ………. xii
DAFTAR GAMBAR ……… xiii
DAFTAR LAMPIRAN ………. xiv
INTISARI ……….. xv ABSTRACT ……… xvi BAB I PENGANTAR ………... 1 A. Latar Belakang ………... 1 1. Permasalahan ……….. 3 2. Keaslian Penelitian ……….. 3 3. Manfaat Penelitian ……….. 4 B. Tujuan Penelitian ………... 4
BAB II PENELAAHAN PUSTAKA ………... 5
A. Asiklovir ………. 5
ix
C. Spektrofotometri Ultraviolet ……….. 7
D. Validasi Metode Analisis ………... 13
1. Spesifisitas ……….. 13
2. Linearitas ………. 13
3. Rentang ………... 14
4. Batas deteksi (Limit of Detection) dan batas kuantitasi (Limit of Quantitation) ………... 14
5. Presisi (keterulangan) ……….. 14
6. Akurasi (ketepatan) ………. 15
E. Landasan Teori ………... 17
F. Hipotesis ………. 18
BAB III METODOLOGI PENELITIAN ……….. 19
A. Jenis dan Rancangan Penelitian ………. 19
B. Variabel Penelitian ………... 19
1. Variabel Bebas ……… 19
2. Variabel Tergantung ………... 19
3. Variabel Pengacau Terkendali ……… 19
C. Definisi Operasional ………... 19
D. Bahan ……….. 20
E. Alat ………. 20
F. Tata Cara Penelitian ………... 20
1. Pembuatan Larutan Asam Klorida 0,1 N ……… 20
2. Pembuatan Larutan Induk Asiklovir 1 mg/mL …………... 21
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
x
3. Pembuatan Larutan Intermediet Asiklovir 0,1 mg/mL …... 21
4. Penentuan Panjang Gelombang Serapan Maksimum …………. 21
5. Pembuatan Larutan Seri Kurva Baku Asiklovir ………... 21
6. Penentuan rentang ………... 22
7. Penentuan nilai batas deteksi (LOD) dan batas kuantitasi (LOQ) ……….. 22 8. Preparasi sampel ………. 22 9. Pengujian spesifisitas ……….. 22 10. Pengujian akurasi …………...………. 23 11. Penentuan presisi…………...………... 23 G. Analisis Hasil ………. 24
1. Panjang gelombang serapan maksimum ………...………… 24
2. Spesifisitas ………. 24
3. Penentuan linearitas dan rentang ………... 25
4. Batas deteksi (LOD) dan batas kuantitasi (LOQ) ………. 25
5. Penentuan nilai absorptivitas molar (ε) ... 25
6. Penentuan presisi ………... 25
7. Penentuan akurasi ……….. 26
BAB IV HASIL DAN PEMBAHASAN ……….. 27
A. Pemilihan Sampel ………... 27
B. Pembuatan Larutan Asiklovir …...……… 28
C. Penentuan Panjang Gelombang Serapan Maksimum Pengukuran … 28 D. Pembuatan Kurva Baku Asiklovir ……….……… 30
xi
E. Penentuan Nilai Absorptivitas Molar (
ε
) ... 32F. Validasi Metode ……….………… 33
1. Spesifisitas ……….……… 33
2. Linearitas ……….…... 34
3. Rentang ……….. 35
4. Batas deteksi (LOD) dan batas kuantitasi (LOQ) ……….……… 37
5. Akurasi ……….………. 39
6. Presisi ……..………... 40
BAB V KESIMPULAN DAN SARAN ………... 43
A. Kesimpulan ……... 43
B. Saran ………... 43
DAFTAR PUSTAKA ………... 44
LAMPIRAN ……….. 47
BIOGRAFI PENULIS ……….. 69
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
xii
DAFTAR TABEL
Tabel I. Kriteria penerimaan presisi pada konsentrasi analit yang berbeda ……….…… 15 Tabel II. Kriteria penerimaan akurasi pada konsentrasi analit
yang berbeda ……… 16 Tabel III. Parameter analitik yang harus dipertimbangkan untuk
tipe prosedur analitik yang berbeda ………. 17 Tabel IV. Data replikasi seri kurva baku asiklovir ……….. 30 Tabel V. Data replikasi seri kurva baku asiklovir dengan
penyesuaian satuan kadar ………. 31 Tabel VI. Perhitungan nilai absorptivitas molar .………. 32 Tabel VII. Data replikasi seri kurva baku dalam penetapan
rentang ………... 36
Tabel VIII. Data absorbansi blangko larutan HCl 0,1 N …..……… 38 Tabel IX. Hasil penetapan perolehan kembali asiklovir dalam
tablet asiklovir “X” secara spektrofotometri UV.….…. 39 Tabel X. Hasil penetapan keterulangan asiklovir dalam tablet
xiii
DAFTAR GAMBAR
Gambar 1. Struktur Asiklovir ………... 5 Gambar 2. Diagram Tingkat Energi Elektronik ………... 9 Gambar 3. Reaksi antara asiklovir dan HCl ………. 28 Gambar 4. Spektra absorbansi maksimum asiklovir HCl pada 3
konsentrasi ………... 29
Gambar 5. Konsentrasi asiklovir versus absorbansi (replikasi II) … 32 Gambar 6. Spektra sampel dan baku asiklovir kadar 2; 4; dan 7
µg/mL ………. 34
Gambar 7. Grafik linearitas larutan asiklovir pada kadar 3 – 14
µg/mL (replikasi I) ….………..….. 37
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
xiv
DAFTAR LAMPIRAN
Lampiran 1. Sertifikat Analisis Asiklovir dari PT. Novell
Pharmaceutical Laboratories ……… 48
Lampiran 2. Data penimbangan baku asiklovir ……… 49
Lampiran 3. Spektra hasil penentuan panjang gelombang maksimum asiklovir ………... 53
Lampiran 4. Data pengujian spesifisitas ………... 57
Lampiran 5. Perhitungan persamaan kurva baku asiklovir ……….. 61
Lampiran 6. Perhitungan nilai koefisien variansi pada penentuan rentang ………. 63
Lampiran 7. Perhitungan LOD dan LOQ ………. 64
Lampiran 8. Perhitungan akurasi tablet asiklovir “X” ………. 65
xv
INTISARI
Asiklovir merupakan obat antiviral yang biasanya terdapat dalam sediaan tablet, injeksi, dan salep. Aktifitas farmakologi asiklovir tergantung pada ketepatan dan keseragaman dosis. Perlu adanya penelitian untuk menetapkan kadar asiklovir dalam bentuk sediaan untuk menjamin mutu dan kualitas sediaan tersebut. Tujuan penelitian ini adalah menetapkan kadar asiklovir dalam sediaan tablet.
Penelitian ini bersifat non eksperimental deskriptif. Asiklovir merupakan basa lemah dengan satu gugus amina primer yang memiliki gugus kromofor dan auksokrom sehingga dapat ditetapkan kadarnya secara spektrofotometri ultraviolet. Penetapan kadar Asiklovir dilakukan dengan memasukkan hasil serapan asiklovir ke dalam persamaan kurva baku yang didapat dari hasil analisis regresi linier antara kadar asiklovir dan absorbansinya. Kevalidan metode ini dilihat dari parameter spesifisitas, linearitas, batas deteksi, batas kuantitasi, rentang, presisi, dan akurasi.
Hasil penelitian menunjukkan bahwa koefisien korelasi (r) persamaan garis linier kurva baku sebesar 0,999; LOD dan LOQ masing-masing 0,025 µg/mL dan 0,083 µg/mL; perolehan kembali sebesar 99,05%; dan koefisien variansi sebesar 0,43%. Aplikasi metode penetapan kadar pada sediaan tablet asiklovir menunjukkan kadar rata-rata asiklovir dalam tablet adalah 402,33 mg. Disimpulkan bahwa tablet asiklovir yang diuji memenuhi persyaratan kadar tablet dalam Farmakope Indonesia.
Kata kunci : Asiklovir, spektrofotometri ultraviolet, penetapan kadar.
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
xvi
ABSTRACT
Acyclovir is an antiviral drug that is usually contained in tablets, injections, and ointments dosage form. Pharmacological activity of acyclovir depends on the accuracy and uniformity of dosage. Need for research to establish levels of acyclovir in dosage forms to ensure the quality and the quality of such preparations. This study aims to determine levels of acyclovir in tablets dosage form.
This research is a type of non-experimental descriptive studies. Acyclovir is a weak base with a primary amine group which has a chromophore group and auxochrome so its level can be determined by spectrophotometry ultraviolet levels. Assay of acyclovir is done by spectrophotometry method using standard curve equation derived from the results of linear regression analysis between acyclovir standard concentration and absorbance. Validity of this method is seen from specificity, linearity, detection limit, quantitation limit, range, precision, and accuracy.
The results showed that the correlation coefficient (r) linear equation for standard curve 0.999; LOD and LOQ respectively 0.025 µg/mL and 0.083 µg/mL; recoveries of 99.05%; and 0.43% coefficient of variance. Application of the assay method in tablets acyclovir showed average levels of acyclovir in tablets was 402.33 mg. It can be concluded that the tablets acyclovir levels is fulfill the requirements of tablets in Indonesian Pharmacopoeia.
1
BAB I PENGANTAR
A. Latar Belakang
Asiklovir adalah obat antivirus yang secara klinis terbukti efektif untuk pengobatan infeksi virus herpes simplex tipe I dan II, virus varicella zoster, herpes genital primer dan sekunder, juga herpes neonatorum (Hardjasaputra, Budipranoto, Sembiring, dan Kamil, 2002). Whitley et al. (1986) menyebutkan, dibanding obat antivirus lain, misalnya vidarabine, asiklovir lebih efektif dalam mengobati penyakit akibat virus DNA (deoxyribonucleic acid
Asiklovir memiliki bioavailabilitas rendah (hanya 15% hingga 30% dosis yang diabsorpsi dari saluran gastrointestinal). Asiklovir diserap secara lambat dan sedikit dalam saluran gastrointestinal dan waktu untuk mencapai kadar puncak adalah 1,5 hingga 2 jam. Dengan pemberian secara multidosis, kadar tunak plasma dapat dicapai dalam waktu 2 hari (Dollery, 1999). Asiklovir aman digunakan pada individu yang mengalami masalah pada sistem imunnya. Selain digunakan untuk pengobatan penyakit-penyakit akibat virus seperti disebutkan di atas, penelitian menunjukkan bahwa asiklovir juga dapat digunakan untuk meningkatkan ketahanan pasien penderita AIDS (Dollery, 1999) sehingga asiklovir berpotensi untuk pengobatan penyakit AIDS.
) dan lebih aman bila dibandingkan dengan Ganciclovir dalam mengobati penyakit akibat
citomegalovirus.
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
Bentuk sediaan asiklovir yang beredar di pasaran yaitu berupa tablet, salep, dan larutan injeksi. Tablet asiklovir mengandung asiklovir 200 dan 400 mg. Pemeriksaan kadar zat aktif merupakan persyaratan yang harus dipenuhi untuk menjamin kualitas sediaan obat. Sediaan obat yang berkualitas baik akan menunjang tercapainya efek terapeutik yang diharapkan. Salah satu persyaratan mutu adalah kadar yang dikandung harus memenuhi persyaratan kadar seperti yang tercantum dalam Farmakope Indonesia. Tablet asiklovir mengandung tidak kurang dari 90,0% dan tidak lebih dari 110,0% dari kadar yang tertera pada label.
Penetapan kadar asiklovir dalam sediaan tablet bertujuan untuk menetapkan kadar asiklovir dalam sediaan tablet yang beredar di pasaran apakah memenuhi persyaratan mutu obat sehingga dengan kadar yang tepat obat dapat memberikan efek terapi yang dikehendaki.
Metode penetapan kadar asiklovir secara spektrofotometri ultraviolet menggunakan pelarut HCl 0,1 N ini merupakan metode alternatif yang dapat Penetapan kadar asiklovir dalam Farmakope Indonesia IV tahun 1995 dilakukan dengan Kromatografi Cair Kinerja Tinggi. Metode kromatografi cair kinerja tinggi memiliki kepekaan analisis yang tinggi. Berdasarkan British Pharmacopoeia 2011 tahun 2010, asiklovir dapat ditetapkan kadarnya secara spektrofotometri ultraviolet. Asiklovir memiliki gugus kromofor dan gugus auksokrom sehingga asiklovir dapat menyerap radiasi pada panjang gelombang di daerah ultraviolet. Pelarut yang digunakan yaitu HCl 0,1 N karena berdasarkan strukturnya, asiklovir merupakan basa lemah dengan satu gugus amina primer sehingga sukar larut dalam pelarut air, namun lebih mudah larut dalam pelarut HCl 0,1 N (Anonim, 2005).
3
digunakan untuk menetapkan kadar asiklovir secara rutin agar sediaan asiklovir yang dihasilkan memenuhi persyaratan mutu. Metode spektrofotometri merupakan metode yang cukup mudah dan cepat untuk dilakukan, serta memiliki sensitivitas dan spesifisitas yang cukup baik, sehingga dapat digunakan untuk menetapkan kadar suatu senyawa.
1. Permasalahan
a. Berapakah kadar asiklovir dalam sediaan tablet asiklovir merk “X” yang beredar di pasaran?
b. Apakah kadar asiklovir dalam tablet memenuhi ketentuan yang tertera dalam Farmakope Indonesia edisi IV yaitu tablet asiklovir mengandung tidak kurang dari 90% dan tidak lebih 110% C8H11N5O3 yang tertera pada label kemasan?
2. Keaslian Penelitian
Penelitian tentang penetapan kadar asiklovir pada sediaan tablet secara spektrofotometri ultraviolet mengunakan pelarut HCl 0,1 N ini mengacu pada penetapan kadar dalam British Pharmacopoeia 2011 tahun 2010. Perbedaan penelitian ini dengan penelitian dalam acuan yakni sampel yang digunakan, laboratorium, spesifikasi alat, dan peneliti.
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
3. Manfaat Penelitian
a. Manfaat metodologis
b.
. Penelitian ini diharapkan dapat memberi informasi mengenai metode penetapan kadar asiklovir secara spektrofotometri ultraviolet.
Manfaat praktis. Penelitian ini dapat menyediakan metode alternatif untuk penetapan kadar asiklovir yang dapat dimanfaatkan oleh industri dan peneliti lain.
B. Tujuan Penelitian
a. Mengetahui kadar asiklovir dalam sediaan tablet asiklovir merk “X” yang beredar di pasaran.
b. Mengetahui apakah kadar asiklovir dalam tablet memenuhi ketentuan yang tertera dalam Farmakope Indonesia edisi IV yaitu tablet asiklovir mengandung tidak kurang dari 90% dan tidak lebih 110% C8H11N5O3 yang tertera pada label kemasan.
5
BAB II
PENELAAHAN PUSTAKA A. Asiklovir
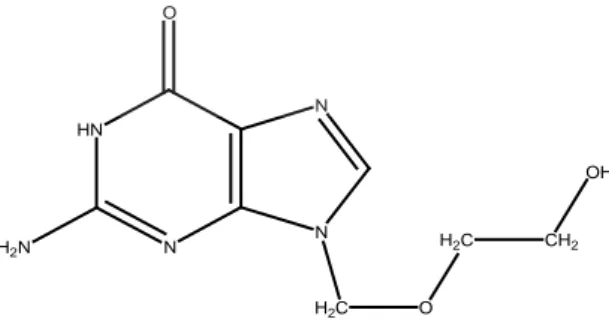
Asiklovir (gambar 1) adalah analog nukleosida purin sintetik dengan aktivitas inhibisi secara in vitro dan in vivo pada jenis virus herpes simpleks 1 (HSV-1), 2 (HSV-2), dan virus varicella-zoster (VZV) (Anonim, 2007). Toksisitas akut (LD50
Asiklovir berupa serbuk berbentuk kristal berwarna putih, dengan rumus molekul C
) asiklovir ketika diberikan secara oral lebih besar dari 1 g/kg, karena bioavailabilitas oral yang rendah (15-30%). Aktivitas antiviral asiklovir yaitu dengan bertindak sebagai substrat yang menghambat DNA polymerase pada virus (Testereci et al., 1998). Di dalam sel yang terinfeksi virus herpes, asiklovir mengalami fosforilasi menjadi bentuk aktif asiklovir-trifosfat, 30-100 kali lebih cepat daripada di dalam sel yang tidak terinfeksi. Asiklovir trifosfat menghambat sintesa DNA virus tanpa mempengaruhi proses sel yang normal (Hardjasaputra dkk., 2002).
8H11N5O3 dan bobot molekul 225 g/mol. Kelarutan maksimum dalam air pada suhu 37 0
HN N N N O H2N H2C O H2C CH2 OH
C adalah 2,5 mg/mL. Nilai pKa asiklovir yaitu 2,27 dan 9,25 (Anonim, 2007). Nama kimia asiklovir adalah 9-(2-hidroksi-etoksi)metil guanin. Rumus struktur asiklovir yaitu sebagai berikut:
Gambar 1. Struktur Asiklovir
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
Tablet asiklovir yang beredar di pasaran mengandung asiklovir 200 mg dan 400 mg. Tablet asiklovir yang digunakan dalam penelitian ini yaitu tablet asiklovir yang mengandung asiklovir 400 mg. Tiap tablet mengandung 400 mg asiklovir, magnesium stearat, microcrystalline cellulose, povidone, dan sodium
strach glycolate (Anonim, 2007). Farmakope Indonesia edisi IV tahun 1995
menyebutkan bahwa tablet asiklovir mengandung tidak kurang dari 90,0% dan tidak lebih dari 110,0% C8H11N5O3 jumlah yang tertera pada label. Tablet asiklovir harus disimpan dalam wadah tertutup rapat pada suhu kamar terkendali.
B. Penetapan Kadar Asiklovir yang Pernah Dilakukan
Penetapan kadar asiklovir secara spektrofotometri ultraviolet menggunakan pelarut HCl 0,1 M pernah dilakukan sebelumnya dalam British Pharmacopoeia 2011 tahun 2010. Larutan uji asiklovir di-scanning pada panjang gelombang 230-350 nm. Panjang gelombang maksimum yang didapatkan yaitu pada 255 nm dan lebar bahu spektra di sekitar panjang gelombang 274 nm.
Penelitian mengenai penetapan kadar asiklovir secara spektrofotometri ultraviolet juga pernah dilakukan oleh Gandhi et al. (2006). Asiklovir dilarutkan dalam akuades lalu diukur absorbansinya pada λmaks 253 nm. Absorbansi yang terukur dimasukkan ke persamaan kurva baku yang telah diperoleh sehingga dapat diketahui kadarnya.
Penelitian lain mengenai penetapan kadar asiklovir secara spektrofotometri yang pernah dilakukan oleh Darwish et al. (2006) yaitu menggunakan agen pengoksidasi amonium sulfat, kalium permanganat, amonium
7
metavanidate, kromium trioksida, dan kalium dikromat. Penetapan kadar ini dilakukan dengan mereaksikan asiklovir menggunakan beberapa agen pengoksidasi tersebut dimana agen pengoksidasi dibuat berlebih. Larutan yang terbentuk diukur absorbansinya menggunakan spektrofotometer visibel dan kadar asiklovir sebanding dengan absorbansi larutan.
Penelitian lain mengenai penetapan kadar asiklovir secara spektrofotometri yang pernah dilakukan yaitu menggunakan kompleksasi logam yang pernah dilakukan oleh Mustafa et al. (2001). Asiklovir direaksikan dengan
copper (II) dan cobalt (II) menggunakan bufer NaOH, Na-borat pH 9 dalam
medium berair 1% piridin dalam metanol. Kompleks yang terbentuk memiliki absorbansi maksimum pada panjang gelombang 290 nm dan 287 nm.
Metode lainnya yaitu penetapan kadar asiklovir dalam serum menggunakan kromatografi cair kinerja tinggi dengan detektor fluoresensi yang pernah dilakukan oleh Testereci et al. (1998). Sampel dideproteinisasi dengan asam lalu diektraksi dengan 30% HClO4 untuk mengendapkan protein yang masih tersisa. Fase gerak yang digunakan yaitu pelarut organik HClO4 0,02 M yang disiapkan dalam akuabides yang dialirkan secara isokratik.
C. Spektrofotometri Ultraviolet
Spektrofotometri ultraviolet adalah teknik analisis spektroskopik yang menggunakan sumber sinar ultraviolet (190-380 nm) dengan instrumen spektrofotometer. Hasil pembacaan absorbansi disebut sebagai absorban (A) dan
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
tidak memiliki satuan, sedangkan hasil pembacaan transmitansi disebut transmitan dan memiliki satuan %T (Mulja dan Suharman, 1995).
Absorpsi energi direkam sebagai absorban, dan pada suatu panjang gelombang didefinisikan sebagai:
A = log 𝐼𝐼𝐼𝐼
𝐼𝐼 (1)
dengan A = absorban
Io = intensitas berkas cahaya rujukan
I = intensitas berkas cahaya contoh (Fessenden dan Fessenden, 1994). Panjang gelombang cahaya UV atau cahaya tampak bergantung pada mudahnya promosi elektron. Molekul-molekul yang memerlukan lebih banyak energi untuk promosi elektron, akan menyerap pada panjang gelombang yang lebih pendek. Molekul yang memerlukan energi lebih sedikit akan menyerap pada panjang gelombang yang lebih panjang (Fessenden dan Fessenden, 1994).
Adanya radiasi ultraviolet dan cahaya tampak mengakibatkan transisi elektronik, yaitu promosi elektron-elektron dari orbital keadaan dasar yang berenergi rendah ke orbital keadaan tereksitasi berenergi lebih tinggi. Energi yang terserap kemudian terbuang sebagai cahaya atau tersalurkan dalam reaksi kimia. Absorbsi cahaya tampak meningkatkan energi elektronik sebuah molekul, artinya energi yang disumbangkan oleh foton-foton memungkinkan elektron-elektron itu mengatasi kekangan inti dan pindah ke luar ke orbital baru yang lebih tinggi energinya. Semua molekul dapat menyerap radiasi dalam daerah tampak karena mereka mengandung elektron, baik sekutu maupun menyendiri, yang dapat dieksitasi ke tingkat energi yang lebih tinggi (Day dan Underwood, 2002). Transisi elektron yang mungkin terjadi seperti ditunjukkan pada gambar 2, yaitu:
9
Gambar 2. Diagram Tingkat Energi Elektronik
1) Transisi σ → σ*
Transisi ini terjadi pada daerah ultraviolet jauh, membutuhkan energi yang besar dan terjadi pada molekul yang memiliki ikatan tunggal. Elektron di orbital σ bonding akan tereksitasi ke orbital σ* antibonding (Mulja dan Suharman, 1995).
2) Transisi n→π* dan π →π*
Transisi n → π* terjadi pada senyawa yang memiliki elektron n
nonbonding yang tereksitasi ke orbital π* antibonding. Sedangkan transisi π →π*
terjadi pada senyawa yang memiliki ikatan rangkap dua atau tiga (alkena dan alkuna) yang menyerap energi yang sesuai dan terjadi pada daerah ultraviolet dekat (Mulja dan Suharman, 1995). Sebagian besar penerapan spektrofotometri UV-Vis pada senyawa organik didasarkan pada transisi ini. Energi yang diperlukan untuk transisi ini menghasilkan absorban maksimum pada daerah 200-700 nm (Khopkar, 1990).
3) Transisi n → σ*
Senyawa-senyawa jenuh yang mengandung hetero atom seperti nitrogen, oksigen, belerang, atau halogen memiliki elektron n menyendiri (unshared).
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
Senyawa-senyawa hetero atom menunjukkan jalur serapan yang kemungkinan disebabkan oleh transisi elektron-elektron dari orbital tak berikatan atom-atom hetero ke orbital anti ikatan σ*. Transisi n → σ* membutuhkan tenaga yang lebih sedikit daripada transisi σ → σ*. Namun demikian kebanyakan senyawa-senyawa dalam kelas ini tidak menunjukkan serapan di daerah ultraviolet dekat (Mulja dan Suharman, 1995).
Keadaan dasar suatu molekul organik mengandung elektron-elektron valensi dalam 3 tipe utama orbital molekul: orbital sigma (σ); orbital phi (π); dan orbital terisi tetapi tak terikat (n). Baik orbital σ maupun π dibentuk dari tumpang tindih 2 orbital atom atau hibrid. Oleh karena itu, masing-masing orbital molekul ini mempunyai suatu orbital σ* atau π* antibonding yang berikatan dengannya. Suatu orbital yang mengandung elektron π tidak mempunyai suatu orbital antibonding. Transisi-transisi elektron mencakup promosi suatu elektron dari salah satu dari 3 keadaan dasar (σ, π, atau n) ke salah satu dari 2 keadaan eksitasi (σ* atau π*). Pada daerah UV, transisi yang berguna (200-400 nm) adalah π→π* untuk senyawa dengan ikatan rangkap berkonjugasi serta beberapa transisi n→σ*
dan n→π* (Fessenden dan Fessenden, 1994).
Pemisahan tenaga yang paling tinggi diperoleh bila elektron-elektron dalam ikatan tereksitasi yang menimbulkan serapan dalam daerah dari 120-200 nm. Daerah ini dikenal sebagai daerah Ultra Violet (UV) vakum dan relatif tidak banyak menimbulkan keterangan. Transisi yang terjadi yaitu: π → π* untuk ikatan rangkap menyendiri dan σ → σ* untuk ikatan -ikatan karbon biasa. Daerah yang paling berguna dari spektrum UV adalah daerah dengan panjang gelombang di
11
atas 200 nm. Transisi yang terjadi pada daerah ini adalah π → π* untuk senyawa dengan ikatan rangkap berkonjugasi serta beberapa transisi n → σ* dan n → π* (Fessenden dan Fessenden, 1994).
Absorbsi untuk transisi elektron seharusnya tampak pada panjang gelombang diskrit sebagai suatu spektrum garis atau peak tajam namun ternyata berbeda. Baik spektrum UV maupun spektrum tampak terdiri dari pita absorbsi, lebar pada daerah panjang gelombang yang lebar. Ini disebabkan terbaginya keadaan dasar dan keadaan eksitasi sebuah molekul dalam subtingkat-subtingkat rotasi dan vibrasi. Transisi elektronik dapat terjadi dari subtingkat apa saja keadaan dasar ke subtingkat apa saja keadaan eksitasi. Karena berbagai transisi ini berbeda energi sedikit sekali, maka panjang gelombang absorpsinya juga berbeda sedikit dan menimbulkan pita lebar yang tampak dalam spektrum itu (Sastrohamidjojo, 2001).
Panjang gelombang dimana terjadi eksitasi elektronik yang memberikan absorban maksimum disebut sebagai panjang gelombang maksimum (λmaks). Penentuan panjang gelombang maksimum yang pasti (tetap) dapat dipakai untuk identifikasi molekul yang bersifat karakteristik sebagai data sekunder. Dengan demikian, spektrum visibel dapat dipakai untuk tujuan analisis kualitatif (data sekunder) dan kuantitatif (Khopkar, 1990).
Molekul-molekul yang memerlukan lebih banyak energi untuk promosi elektron akan menyerap cahaya pada panjang gelombang yang lebih pendek. Molekul yang menyerap energi lebih sedikit akan menyerap cahaya pada panjang gelombang yang lebih panjang. Senyawa yang menyerap cahaya dalam daerah
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
tampak memiliki elektron yang lebih mudah dipromosikan daripada senyawa yang menyerap cahaya pada panjang gelombang UV yang lebih pendek (Mulja dan Suharman, 1995).
Prinsip spektrofotometri pada analisis kuantitatif yaitu suatu berkas radiasi dikenakan pada cuplikan (larutan sampel) dan intensitas sinar radiasi yang diteruskan diukur. Intensitas yang diteruskan oleh larutan zat penyerap berbanding lurus dengan tebal dan konsentrasi larutan (Gandjar dan Rohman, 2007
Hukum Lambert-Beer menyatakan hubungan antara absorban dan panjang jalan melewati medium yang menyerap, dan hubungan antara konsentrasi spesies penyerap dan tingkat absorbsi. Hukum ini menyatakan absorban zat terlarut adalah proporsional dengan konsentrasi sebagai:
).
A = ε. b. C (2)
dimana A = absorban
ε = koefisien ekstingsi molar C = konsentrasi solut (mol/L
-1
b = tebal kuvet dalam cm (Mulja dan Suharman, 1995). )
Nilai koefisien ekstingsi molar (ε) adalah karakteristik untuk molekul atau ion penyerap dalam suatu pelarut tertentu, pada panjang gelombang tertentu, dan tidak bergantung pada konsentrasi dan panjang gelombang lintasan radiasi (Sastrohamidjojo, 2001). Nilai ε sangat mempengaruhi puncak spektrum yang dihasilkan oleh suatu zat. Rincian nilai ε terhadap puncak spektrum adalah: 1 - 10 = sangat lemah; 10 - 102 = lemah; 102 - 103 = sedang; 103 - 104 = kuat; 104 - 105 = sangat kuat (Mulja dan Suharman, 1995). Semakin besar nilai ε, maka semakin mudah senyawa tersebut untuk dianalisis menggunakan spektrofotometri UV, karena semakin besar absorbansi yang diperoleh untuk kadar analit yang sama.
13
D. Validasi Metode Analisis
Validasi metode menurut United States Pharmacopeia (USP) edisi 28
tahun 2005 dilakukan untuk menjamin bahwa metode analisis akurat, spesifik,
reprodusibel, dan tahan pada kisaran analit yang akan dianalisis. Aktivitas validasi
harus didokumentasi dengan tepat dan dilakukan pada instrumen dan alat yang
memenuhi persyaratan dan terkalibrasi (Basset et al., 1994).
1. Spesifisitas
Spesifisitas merupakan kemampuan pengukuran analit secara akurat dan spesifik dengan kehadiran komponen lain (zat aktif, eksipien, pengotor, dan produk degradasi) dalam matriks sampel (United States Pharmacopeial
Convention, 2005).
2. Linearitas
Linearitas merupakan kemampuan suatu metode untuk memperoleh
hasil-hasil uji yang secara langsung proporsional dengan konsentrasi analit pada
kisaran yang diberikan. Linearitas suatu metode merupakan ukuran seberapa baik
kurva kalibrasi yang menghubungkan antara konsentrasi (x) dengan respon (y).
Linearitas dapat diperoleh dengan melakukan pengukuran tunggal pada
konsentrasi yang berbeda-beda. Data yang diperoleh selanjutnya diproses dengan
metode kuadrat terkecil, untuk selanjutnya dapat ditentukan nilai kemiringan
(slope), intersep, dan koefisien korelasinya (Mulja dan Hanwar, 2003). Syarat suatu metode dikatakan memiliki linearitas yang baik adalah bila nilai koefisien korelasi (r)-nya ≥ 0,999 (Snyder et al.,1997).
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
3. Rentang
Rentang pada metode analisis dapat didefinisikan sebagai interval antara
batas atas dan batas bawah pada analit yang dapat diukur dan memenuhi syarat
presisi, akurasi, dan linearitas (Yuwono dan Indrayanto, 2005).
4. Batas deteksi (Limit of Detection) dan batas kuantitasi (Limit of
Quantitation)
Batas deteksi adalah konsentrasi terkecil suatu analit dalam sampel yang dapat terdeteksi. Batas deteksi digambarkan sebagai perbandingan signal-to-noise
(S/N) antara hasil uji sampel dengan analit yang diketahui konsentrasinya dan blangko. Rasio signal-to-noise untuk batas deteksi adalah sekurangnya 3:1 (Snyder et al., 1997). Batas deteksi merupakan konsentrasi terendah dari analit dalam sampel yang dapat dideteksi. Batas deteksi biasanya dinyatakan sebagai konsentrasi analit dalam sampel. Penentuan batas deteksi juga dapat didasarkan pada perhitungan tiga kali nilai standar deviasi blangko dibagi dengan nilai slope
kurva baku. Batas kuantifikasi dapat diartikan sebagai kuantitas terkecil analit dalam sampel yang masih dapat memenuhi kriteria cermat dan seksama. Penentuan batas kuantitasi didasarkan pada perhitungan sepuluh kali nilai standar deviasi blangko dibagi dengan nilai slope kurva baku (Anonim, 2005).
5. Presisi (keterulangan)
Presisi merupakan ukuran keterulangan metode analisis dan biasanya
diekspresikan sebagai simpangan baku relatif dari sejumlah sampel yang berbeda
15
Harmonisation (ICH), presisi harus dilakukan pada 3 tingkatan yang berbeda
yaitu:
a. Keterulangan, yakni pada kondisi percobaan yang sama (berulang) baik orangnya, peralatannya, tempatnya, maupun waktunya.
b. Presisi antara, yakni pada kondisi percobaan yang berbeda, baik orangnya,
peralatannya, tempatnya, maupun waktunya.
c. Ketertiruan, yakni merujuk pada hasil-hasil dari laboratorium yang lain
(Mulja dan Hanwar, 2003).
Presisi dinyatakan dengan persen koefisien variasi (CV) atau standar deviasi relatif (RSD), seperti yang tertera pada tabel I.
Tabel I. Kriteria penerimaan presisi pada konsentrasi analit yang berbeda (Yuwono dan Indrayanto, 2005) Konsentrasi Analit (%) Unit RSD (%) 100 >10 >1 >0,1 0,01 0,001 0,0001 (1 ppm) 0,00001 (100 ppb) 0,000001 (10 ppb) 0,0000001 (1 ppb) 100% 10% 1% 0,1% 100 ppm 10 ppm 1 ppm 100 ppb 10 ppb 1 ppb 1,3 2,7 2,8 3,7 5,3 7,3 11 15 21 30 6. Akurasi (ketepatan)
Menurut Mulja dan Hanwar (2003), akurasi merupakan ketelitian metode analisis atau kedekatan antara nilai terukur dengan nilai yang diterima baik nilai konvensi, nilai sebenarnya, atau nilai rujukan. Akurasi diukur sebagai banyaknya analit yang diperoleh kembali pada suatu pengukuran dengan melakukan spiking pada suatu sampel. Untuk pengujian senyawa obat, akurasi diperoleh dengan
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
membandingkan hasil pengukuran dengan bahan rujukan standar (standard reference material, SRM).
Untuk mendokumentasikan akurasi, ICH merekomendasikan pengumpulan data dari 9 kali penetapan kadar dengan 3 konsentrasi yang berbeda (misal 3 konsentrasi dengan 3 kali replikasi). Data harus dilaporkan sebagai persentase perolehan kembali (Yuwono dan Indrayanto, 2005).
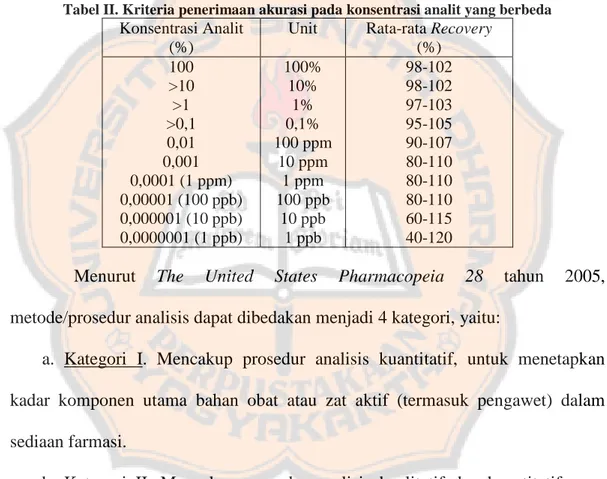
Tabel II. Kriteria penerimaan akurasi pada konsentrasi analit yang berbeda
Konsentrasi Analit (%)
Unit Rata-rata Recovery
(%) 100 >10 >1 >0,1 0,01 0,001 0,0001 (1 ppm) 0,00001 (100 ppb) 0,000001 (10 ppb) 0,0000001 (1 ppb) 100% 10% 1% 0,1% 100 ppm 10 ppm 1 ppm 100 ppb 10 ppb 1 ppb 98-102 98-102 97-103 95-105 90-107 80-110 80-110 80-110 60-115 40-120
Menurut The United States Pharmacopeia 28 tahun 2005, metode/prosedur analisis dapat dibedakan menjadi 4 kategori, yaitu:
a. Kategori I
b.
. Mencakup prosedur analisis kuantitatif, untuk menetapkan kadar komponen utama bahan obat atau zat aktif (termasuk pengawet) dalam sediaan farmasi.
Kategori II
c.
. Mencakup prosedur analisis kualitatif dan kuantitatif yang digunakan untuk menganalisis impurities ataupun degradation compounds dalam sediaan farmasi. Metode ini termasuk perhitungan kembali secara kuantitatif dan batas tes.
Kategori III. Mencakup prosedur analisis yang digunakan untuk menentukan performa karakteristik, misalnya disolusi dan pelepasan obat.
17
d.
Tabel III. Parameter analitik yang harus dipertimbangkan untuk tipe prosedur analitik yang berbeda
Kategori IV (tes identifikasi).
Parameter Analisis
Kategori I Kategori II Kategori III Kategori IV
Kuantitatif Batas tes Akurasi Presisi Spesifisitas LOD LOQ Linearitas Rentang Ya Ya Ya Tidak Tidak Ya Ya Ya Ya Ya Tidak Ya Ya Ya * Tidak Tidak Ya Ya Tidak * * Ya * * * * * Tidak Tidak Ya Tidak Tidak Tidak Tidak *mungkin diperlukan, tergantung pada sifat spesifik tes
(United States Pharmacopeial Convention, 2005)
E. Landasan Teori
Asiklovir adalah obat antivirus yang digunakan untuk mengobati penyakit-penyakit yang disebabkan oleh infeksi virus, terutama virus herpes. Asiklovir aman digunakan pada individu yang mengalami masalah pada sistem imunnya. Asiklovir berpotensi untuk pengobatan penyakit AIDS karena dapat meningkatkan ketahanan pasien penderita AIDS. Asiklovir merupakan senyawa basa lemah dengan satu gugus amina primer. Asiklovir larut dalam asam klorida 0,1 N, agak sukar larut dalam air, dan tidak larut dalam etanol.
Tablet asiklovir mengandung asiklovir 400 mg. Tablet asiklovir mengandung tidak kurang dari 90,0% dan tidak lebih dari 110,0% C8H11N5O3 jumlah yang tertera pada label. Tablet asiklovir harus disimpan dalam wadah tertutup rapat pada suhu kamar terkendali. Pemeriksaan kadar zat aktif pada sediaan asiklovir harus dipenuhi untuk menjamin kualitas sediaan obat. Sediaan obat harus memenuhi persyaratan mutu agar dapat memberikan efek terapi yang dikehendaki.
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
Asiklovir memiliki gugus kromofor dan auksokrom pada strukturnya sehingga dapat dianalisis menggunakan metode spektrofotometri ultraviolet. Pelarut yang digunakan adalah HCl 0,1 N karena asiklovir mudah larut dalam pelarut ini. Metode spektrofotometri ultraviolet ini sederhana, cukup sensitif dan selektif.
F. Hipotesis
1. Kadar asiklovir dalam sediaan tablet asiklovir merk “X” yang beredar di pasaran sesuai dengan kadar pada label kemasan.
2. Kadar asiklovir dalam tablet memenuhi ketentuan yang tertera dalam Farmakope Indonesia edisi IV yaitu tablet asiklovir mengandung tidak kurang dari 90% dan tidak lebih 110% C8H11N5O3 yang tertera pada label kemasan.
19
BAB III
METODOLOGI PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini merupakan jenis penelitian non-eksperimental dengan rancangan penelitian deskriptif. Jenis penelitian non-eksperimental karena tidak dilakukan variasi uji terhadap subjek uji, yaitu asiklovir. Rancangan penelitian bersifat deskriptif karena hanya mendeskripsikan keadaan yang ada.
B. Variabel Penelitian
1. Variabel Bebas
Variabel bebas dalam penelitian ini adalah sediaan tablet asiklovir merk “X” yang digunakan.
2. Variabel Tergantung
Variabel tergantungpada penelitian ini adalah kadar asiklovir.
3. Variabel Pengacau Terkendali
Variabel pengacau terkendali dalam penelitian ini adalah kemurnian pelarut yang digunakan. Pada penelitian ini digunakan pelarut dengan derajat pro
analysis yang memiliki tingkat kemurnian yang tinggi.
C. Definisi Operasional
1. Asiklovir baku yang dianalisis adalah asiklovir dari PT. Novell Pharmaceutical Laboratories.
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
2. Sistem spektrofotometri yang digunakan adalah seperangkat alat spektrofotometri UV-Vis merk Optima.
3. Parameter kesahihan metode analisis yang digunakan yaitu spesifisitas, linearitas, rentang, batas deteksi, batas kuantitasi, akurasi, dan presisi.
4. Kadar asiklovir ditetapkan dalam satuan mg/tablet.
D. Bahan
Bahan yang digunakan pada penelitian ini meliputi baku asiklovir (Novell Pharmaceutical Laboratories); akuabides (Laboratorium Kimia Instrumen Fakultas Farmasi Universitas Sanata Dharma); HCl kualitas p. a., (E. Merck); dan tablet asiklovir 400 mg merk X.
E. Alat
Peralatan yang digunakan dalam penelitian ini antara lain: seperangkat alat spektrofotometri UV-Vis merk Optima; neraca analitik Ohaus Carat Series PAJ 1003 (max 60/120 g, min 0,001g, d = 0,01/0,1 mg); pipet mikro (Socorex); dan alat-alat gelas yang lazim digunakan dalam laboratorium analisis.
F. Tata cara Penelitian
1. Pembuatan Larutan Asam Klorida 0,1 N
Dipipet 0,83 mL HCl p.a (12 N) ke dalam labu takar 100,0 mL lalu diencerkan dengan akuabides sampai tanda.
21
2. Pembuatan Larutan Induk Asiklovir 1 mg/mL
Ditimbang seksama 10,0 mg baku asiklovir dan dimasukkan ke dalam labu takar 10,0 mL, dilarutkan dengan HCl 0,1 N hingga larut. Larutan kemudian diencerkan dengan HCl 0,1 N sampai tanda.
3. Pembuatan Larutan Intermediet Asiklovir 0,1 mg/mL
Sebanyak 1,0 mL diambil dari larutan induk asiklovir dan dimasukkan ke dalam labu takar 10,0 mL. Larutan kemudian diencerkan dengan HCl 0,1 N sampai tanda.
4. Penentuan Panjang Gelombang Serapan Maksimum
Sebanyak 200; 400; dan 700 μL diambil dari larutan intermediet asiklovir, dimasukkan ke dalam labu takar 10,0 mL. Masing-masing larutan kemudian diencerkan dengan HCl 0,1 N sampai tanda. Labu takar digojog lalu
di-scanning pada panjang gelombang 200-400 nm. Panjang gelombang maksimum
yang terpilih adalah panjang gelombang yang memberikan absorban asiklovir yang paling tinggi di daerah ultraviolet.
5. Pembuatan Larutan Seri Kurva Baku Asiklovir
Sebanyak 200; 300; 400; 500; 600; dan 700 μL diambil dari larutan intermediet asiklovir, dimasukkan ke dalam labu takar 10,0 mL. Masing-masing larutan kemudian diencerkan dengan HCl 0,1 N sampai tanda. Labu takar digojog lalu diukur absorbannya pada λmaks. Kurva hubungan antara kadar versus
absorban dibuat kemudian ditentukan persamaan regresi linier serta nilai koefisien korelasinya. Dilakukan replikasi sebanyak 3 kali. Nilai koefisien korelasi yang dihasilkan harus ≥ 0,999.
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
6. Penentuan rentang
Sebanyak 200; 300; 400; 500; 600; 700; 800; 900; 1000; 1100, 1200; 1300; 1400; 1500 μL diambil dari larutan intermediet asiklovir, dimasukkan ke dalam labu takar 10,0 mL. Masing-masing larutan kemudian diencerkan dengan HCl 0,1 N sampai tanda. Labu takar digojog lalu diukur absorbannya pada λmaks. Kurva hubungan antara kadar versus absorban dibuat kemudian ditentukan persamaan regresi linier serta nilai koefisien korelasinya. Dilakukan replikasi sebanyak 3 kali. Nilai koefisien korelasi yang dihasilkan harus ≥ 0,999.
7. Penentuan nilai batas deteksi (LOD) dan batas kuantitasi (LOQ)
Diukur absorbansi larutan blangko, yakni larutan HCl 0,1 N pada panjang gelombang maksimum. Nilai LOD diperoleh pada 3 x SD dibagi slope
dan nilai LOQ diperoleh pada 10 x SD dibagi slope. Dilakukan replikasi sebanyak 10 kali.
8. Preparasi sampel
Tablet asiklovir merk X diambil sebanyak 30 buah. Ditimbang seksama 10 tablet satu per satu, dan hitung bobot rata-rata. Tiga puluh tablet tersebut lalu digerus halus menggunakan mortir dan stamper hingga menjadi serbuk dan homogen. Serbuk ini selanjutnya akan digunakan untuk pengujian spesifisitas, pengujian presisi, dan penentuan recovery.
9. Pengujian spesifisitas
Ditimbang seksama sejumlah serbuk setara dengan lebih kurang 100 mg asiklovir. Serbuk kemudian dilarutkan dalam HCl 0,1 N hingga larut lalu dimasukkan ke dalam labu takar 100,0 mL. Larutan kemudian diencerkan dengan
23
HCl 0,1 N sampai tanda lalu disaring. Sebanyak 1,0 mL filtrat diambil dan dimasukkan ke dalam labu takar 10,0 mL, kemudian diencerkan dengan HCl 0,1 N sampai tanda. Sebanyak 200; 400; dan 700 μL larutan tersebut dimasukkan ke dalam labu takar 10,0 mL dan diencerkan dengan HCl 0,1 N sampai tanda. Labu takar digojog lalu di-scanning pada panjang gelombang 200-400 nm. Spektra yang didapat lalu dibandingkan dengan spektra dari standar asiklovir.
10. Pengujian akurasi
Ditimbang seksama sejumlah serbuk setara dengan lebih kurang 100 mg asiklovir. Baku asiklovir ditimbang seksama 10 mg. Sampel dan baku asiklovir dicampur kemudian dilarutkan dalam HCl 0,1 N hingga larut lalu dimasukkan ke dalam labu takar 100,0 mL. Larutan kemudian diencerkan dengan HCl 0,1 N sampai tanda lalu disaring. Sebanyak 1,0 mL filtrat diambil dan dimasukkan ke dalam labu takar 10,0 mL, kemudian diencerkan dengan HCl 0,1 N sampai tanda. Sebanyak 200; 400; dan 700 μL larutan tersebut dimasukkan ke dalam labu takar 10,0 mL dan diencerkan dengan HCl 0,1 N sampai tanda. Labu takar digojog lalu larutan diukur serapannya pada λmaks. Kadar asiklovir dihitung dengan memasukkan nilai serapan yang diperoleh ke dalam persamaan regresi linear kurva baku asiklovir. Dilakukan replikasi sebanyak 3 kali untuk masing-masing level konsentrasi dan dihitung nilai koefisien variansi masing-masing replikasi.
11. Pengujian presisi
Ditimbang seksama sejumlah serbuk setara dengan lebih kurang 100 mg asiklovir. Serbuk kemudian dilarutkan dalam HCl 0,1 N hingga larut lalu dimasukkan ke dalam labu takar 100,0 mL. Larutan kemudian diencerkan dengan
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
HCl 0,1 N sampai tanda lalu disaring. Sebanyak 1,0 mL filtrat diambil dan dimasukkan ke dalam labu takar 10,0 mL, kemudian diencerkan dengan HCl 0,1 N sampai tanda. Sebanyak 200; 400; dan 700 μL larutan tersebut dimasukkan ke dalam labu takar 10,0 mL dan diencerkan dengan HCl 0,1 N sampai tanda. Labu takar digojog lalu larutan diukur serapannya pada λmaks. Kadar asiklovir dihitung dengan memasukkan nilai serapan yang diperoleh ke dalam persamaan regresi linear kurva baku asiklovir. Dilakukan replikasi sebanyak 3 kali untuk masing-masing level konsentrasi dan dihitung nilai koefisien variansi masing-masing-masing-masing replikasi.
G. Analisis Hasil
Hasil optimasi dan validasi metode penetapan kadar asiklovir secara spektrofotometri ultraviolet dapat dilihat dari:
1. Panjang gelombang serapan maksimum
Panjang gelombang maksimum yang terpilih adalah panjang gelombang yang memberikan absorban yang paling tinggi di daerah ultraviolet untuk senyawa asiklovir.
2. Spesifisitas
Spektra panjang gelombang maksimal yang dihasilkan oleh standar asiklovir dan pelarut (blangko) dibandingkan dengan spektra panjang gelombang maksimal sampel asiklovir dalam sediaan tablet. Jika spektra keduanya mirip, dikatakan bahwa metode tersebut spesifik (Anonim, 2005).
25
3. Penentuan linearitas dan rentang
Linearitas dapat ditentukan melalui nilai koefisien korelasi (r) dengan memasukkan data kadar asiklovir dan absorban dari data penentuan kurva baku ke persamaan regresi linear. Suatu metode dapat dikatakan memiliki linearitas yang baik jika r > 0,999 (Snyder et al.,1997).
4. Batas deteksi (LOD) dan batas kuantitasi (LOQ)
Larutan baku konsentrasi terkecil diukur absorbannya minimal 3 kali. Nilai LOD diperoleh pada 3 x SD dibagi slope dan nilai LOQ diperoleh pada 10 x SD dibagi slope (Anonim, 2005).
SD = √(∑�𝑥𝑥− �2
𝑛𝑛−1 ) (3)
5. Penentuan nilai absorptivitas molar(ε)
Nilai absorptivitas molar dihitung untuk kelima konsentrasi seri larutan baku dengan persamaan:
𝜀𝜀
=
𝑏𝑏𝐴𝐴𝑥𝑥𝑐𝑐 (4)Keterangan: ε = absorptivitas molar A = absorbansi
b = tebal kuvet (cm) c = konsentrasi (Molar)
6. Penentuan presisi
Persamaan linear kurva baku (y = bx + a) digunakan untuk menentukan besarnya kadar asiklovir terukur (x) dengan memasukkan nilai absorban yang dihasilkan (y).
Nilai pada penetapan kadar asiklovir digunakan untuk menentukan nilai koefisien variasi (KV) dari keseluruhan replikasi. Presisi metode analisis dinyatakan dengan KV yang dihitung dengan cara berikut:
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
KV = 𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑛𝑛𝑠𝑠𝑠𝑠𝑛𝑛 𝑏𝑏𝑠𝑠𝑏𝑏𝑏𝑏
𝑏𝑏𝑠𝑠𝑘𝑘𝑠𝑠𝑘𝑘 𝑘𝑘𝑠𝑠𝑟𝑟𝑠𝑠 −𝑘𝑘𝑠𝑠𝑟𝑟𝑠𝑠 x 100% (5)
Presisi yang baik untuk kadar analit 100 % (bahan baku) adalah jika nilai KV ≤ 1,3 (Yuwono dan Indrayanto, 2005).
7. Penentuan akurasi
Persamaan linear kurva baku (y = bx + a) digunakan untuk menentukan besarnya kadar asiklovir terukur (x) dengan memasukkan nilai absorban yang dihasilkan (y). Akurasi metode analisis dinyatakan dengan recovery yang dihitung dengan cara berikut:
Recovery = 𝑏𝑏𝑠𝑠𝑘𝑘𝑠𝑠𝑘𝑘 𝑟𝑟𝑡𝑡𝑘𝑘𝑏𝑏𝑏𝑏𝑏𝑏𝑘𝑘
𝑏𝑏𝑠𝑠𝑘𝑘𝑠𝑠𝑘𝑘 𝑘𝑘𝑠𝑠𝑏𝑏𝑡𝑡𝑟𝑟𝑠𝑠 ℎ𝑏𝑏𝑠𝑠 x 100% (6)
Akurasi untuk bahan analit baku yang masih dapat diterima yaitu 98-102 % (Mulja dan Hanwar, 2003).
27
BAB IV
HASIL DAN PEMBAHASAN
A. Pemilihan Sampel
Penelitian ini bertujuan untuk penjaminan mutu sampel sediaan Tablet asiklovir. Dalam Farmakope Indonesia edisi IV tahun 1995, jumlah sampel tablet yang digunakan untuk uji keseragaman bobot adalah 30 tablet. Sampel yang digunakan adalah tablet asiklovir merk “X” dengan nomor batch yang sama yang dibeli dari salah satu apotik di Yogyakarta. Tujuan dari uji keseragaman bobot dalam skala analisis di laboratorium yakni untuk melihat homogenitas sediaan tablet. Sedangkan pada skala industri, tujuan uji keseragaman bobot adalah untuk mengetahui reprodusibiltas mesin pembuat sediaan. Hasil uji keseragaman bobot dapat dilihat pada lampiran 2.
Rata-rata keseragaman bobot tablet asiklovir yaitu 0,4460; 0,4446; dan 0,4474 gram. Menurut Farmakope Indonesia IV (1995) keseragaman bobot untuk tablet tidak lebih dari satu tablet yang masing-masing bobotnya menyimpang dari bobot isi rata-rata lebih besar dari 7,5% dan tidak satu tabletpun yang bobotnya menyimpang dari bobot rata-rata lebih besar dari 15%. Data keseragaman bobot pada lampiran 2 menunjukkan bahwa tidak terdapat penyimpangan keseragaman bobot karena tidak terdapat satupun bobot yang menyimpang sebanyak 7,5% maupun 15%.
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
B. Pembuatan Larutan Asiklovir
Asiklovir merupakan basa lemah yang kurang larut dalam pelarut air (kelarutannya 2,5 mg/mL). Asiklovir larut dalam larutan HCl 0,1 N (Anonim, 2005) karena terjadi penggaraman yang menyebabkan asiklovir lebih mudah larut. Reaksi antara asiklovir dengan larutan HCl 0,1 N yaitu sebagai berikut:
HN N N N O H2N H2C O H2C CH2 OH HN N N N O H2C O H2C CH2 OH + HCl N+Cl -H H H
Gambar 3. Reaksi antara asiklovir dan HCl
Pelarut HCl yang digunakan yaitu yang nilai Normalitasnya 0,1. Pada Normalitas ini diperkirakan asiklovir yang diuji telah bereaksi semua dengan HCl dan HCl yang tersisa hanya sedikit sehingga kemungkinan HCl untuk bereaksi dengan gugus selain amina primer kecil.
Pelarut HCl 0,1 N memenuhi kriteria pelarut yang baik untuk analisis secara spektrofotometri karena tidak berwarna, tidak memiliki sistem ikatan rangkap terkonjugasi sehingga tidak mengabsorbsi pada daerah yang sama dengan analitnya, serta memiliki kemurnian yang tinggi.
C. Penentuan Panjang Gelombang Serapan Maksimum Pengukuran
Panjang gelombang serapan maksimum merupakan panjang gelombang dimana suatu analit menunjukkan absorbansi yang maksimum. Pada panjang gelombang ini kemungkinan kesalahan yang terjadi saat pengukuran relatif kecil karena spektra absorban relatif datar. Secara teoritis, panjang gelombang
29
maksimum asiklovir adalah 255 nm dalam pelarut HCl 0,1 M (British Pharmacopoeial Commission, 2010).
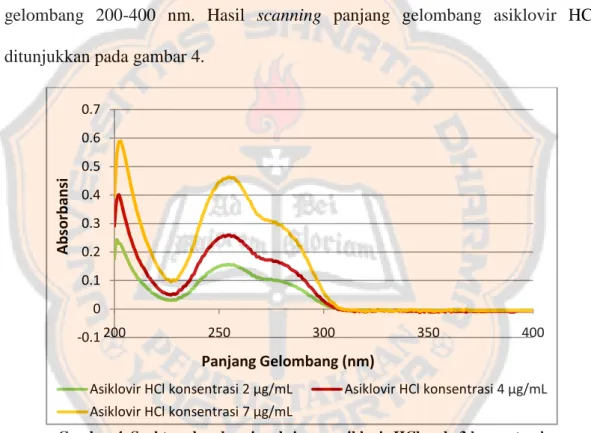
Pengukuran panjang gelombang maksimum dilakukan pada 3 level konsentrasi kurva baku (rendah, sedang, tinggi) untuk melihat apakah pada konsentrasi yang berbeda terjadi perubahan panjang gelombang maksimum. Larutan asiklovir konsentrasi 2; 4; dan 7 µg/mL di-scanning pada rentang panjang gelombang 200-400 nm. Hasil scanning panjang gelombang asiklovir HCl ditunjukkan pada gambar 4.
Gambar 4. Spektra absorbansi maksimum asiklovir HCl pada 3 konsentrasi
Diperoleh panjang gelombang yang memberikan serapan maksimum pada 3 konsentrasi (2; 4; dan 7 µg/mL) yaitu pada panjang gelombang 255 nm. Hasil ini sesuai bila dibandingkan dengan panjang gelombang teoritis asiklovir dalam pelarut HCl 0,1 M yakni 255 nm.
-0.1 0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 200 250 300 350 400
Asiklovir HCl konsentrasi 2 µg/mL Asiklovir HCl konsentrasi 4 µg/mL Asiklovir HCl konsentrasi 7 µg/mL Panjang Gelombang (nm) Abs or ba ns i
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
D. Pembuatan Kurva Baku Asiklovir
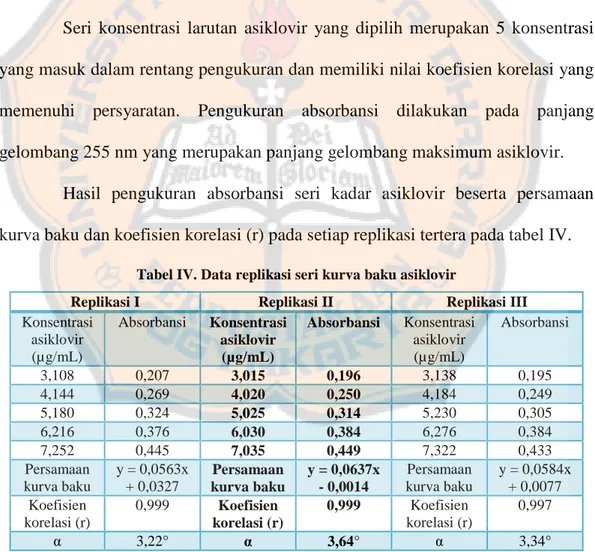
Kurva baku asiklovir dibuat menggunakan 5 seri konsentrasi asiklovir, yaitu 3; 4; 5; 6; dan 7 µg/mL dan dilakukan replikasi untuk setiap konsentrasi. Masing-masing seri larutan baku ini diukur absorbansinya lalu ditentukan persamaan kurva bakunya menggunakan regresi linear. Persamaan kurva baku yang didapat menunjukkan hubungan antara absorbansi larutan dengan konsentrasi asiklovir. Persamaan kurva baku ini nantinya dapat digunakan untuk menentukan kadar asiklovir dalam sampel.
Seri konsentrasi larutan asiklovir yang dipilih merupakan 5 konsentrasi yang masuk dalam rentang pengukuran dan memiliki nilai koefisien korelasi yang memenuhi persyaratan. Pengukuran absorbansi dilakukan pada panjang gelombang 255 nm yang merupakan panjang gelombang maksimum asiklovir.
Hasil pengukuran absorbansi seri kadar asiklovir beserta persamaan kurva baku dan koefisien korelasi (r) pada setiap replikasi tertera pada tabel IV.
Tabel IV. Data replikasi seri kurva baku asiklovir
Replikasi I Replikasi II Replikasi III
Konsentrasi asiklovir (µg/mL) Absorbansi Konsentrasi asiklovir (µg/mL) Absorbansi Konsentrasi asiklovir (µg/mL) Absorbansi 3,108 0,207 3,015 0,196 3,138 0,195 4,144 0,269 4,020 0,250 4,184 0,249 5,180 0,324 5,025 0,314 5,230 0,305 6,216 0,376 6,030 0,384 6,276 0,384 7,252 0,445 7,035 0,449 7,322 0,433 Persamaan kurva baku y = 0,0563x + 0,0327 Persamaan kurva baku y = 0,0637x - 0,0014 Persamaan kurva baku y = 0,0584x + 0,0077 Koefisien korelasi (r) 0,999 Koefisien korelasi (r) 0,999 Koefisien korelasi (r) 0,997 α 3,22° α 3,64° α 3,34°
Data pada tabel IV memiliki nilai α yang kurang layak saji sehingga diperlukan penyesuaian pada satuan kadar agar diperoleh kemiringan kurva yang
31
mendekati sudut 45°. Hasil penyesuaian satuan kadar dapat dilihat pada tabel V berikut:
Tabel V. Data replikasi seri kurva baku asiklovir dengan penyesuaian satuan kadar
Replikasi I Replikasi II Replikasi III
Konsentrasi asiklovir (µg/0,05 mL) Absorbansi Konsentrasi asiklovir (µg/0,05 mL) Absorbansi Konsentrasi asiklovir (µg/0,05 mL) Absorbansi 0,1554 0,207 0,1508 0,196 0,1569 0,195 0,2072 0,269 0,2010 0,250 0,2092 0,249 0,2590 0,324 0,2513 0,314 0,2615 0,305 0,3108 0,376 0,3015 0,384 0,3138 0,384 0,3626 0,445 0,3518 0,449 0,3661 0,433 Persamaan kurva baku y = 1,1255x + 0,0327 Persamaan kurva baku y = 1,2736x – 0,0014 Persamaan kurva baku y = 1,1683x + 0,0077 Koefisien korelasi (r) 0,999 Koefisien korelasi (r) 0,999 Koefisien korelasi (r) 0,997 α 48,38° α 51,86° α 49,44°
Persamaan kurva baku yang digunakan yaitu y = 1,2736x + 0,0014 yang diperoleh dari replikasi II karena memiliki nilai r yang paling besar, yakni 0,999. Nilai ini menunjukkan bahwa hubungan antara konsentrasi asiklovir dan absorbansinya semakin besar. Menurut Snyder et al. (1997), syarat koefisien korelasi yang baik adalah ≥ 0,999. Nilai koefisien korelasi pada replikasi I dan II memenuhi syarat ini sedangkan pada replikasi III tidak memenuhi. Hubungan korelasi antara kadar asiklovir dengan serapan yang diperoleh dapat dilihat pada gambar 5 berikut ini.
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
Gambar 5. Konsentrasi asiklovir versus absorbansi (replikasi II)
E. Penentuan Nilai Absorptivitas Molar (
ε
)Nilai koefisien ekstingsi molar (ε) adalah karakteristik untuk molekul atau ion penyerap dalam suatu pelarut tertentu, pada panjang gelombang tertentu, dan tidak bergantung pada konsentrasi dan panjang gelombang lintasan radiasi. Nilai ε sangat mempengaruhi puncak spektrum yang dihasilkan oleh suatu zat. Nilai absorptivitas molar dari 5 konsentrasi seri larutan baku asiklovir diperoleh melalui perhitungan dan hasilnya dapat dilihat pada tabel VI.
Tabel VI. Perhitungan nilai absoprtivitas molar
Konsentrasi (Molar) Tebal Kuvet (cm) Absorbansi
ε
0,0000134 1 0,196 14627 0,0000179 1 0,250 13966 0,0000223 1 0,314 14081 0,0000268 1 0,384 14328 0,0000313 1 0,449 14345 Rerata 14269Rincian nilai ε terhadap puncak spektrum adalah: 1 - 10 = sangat lemah; 10 - 102 = lemah; 102 - 103 = sedang; 103 - 104 = kuat; 104 - 105 = sangat kuat (Mulja dan Suharman, 1995). Semakin besar nilai ε, maka semakin mudah
0 0.1 0.2 0.3 0.4 0.5 0.196 0.25 0.314 0.384 0.449
Kurva Baku Asiklovir
Abs or ba ns i Konsentrasi asiklovir (µg/0,05 mL) y = 1,2376x - 0,0014 r = 0,999
33
senyawa tersebut untuk dianalisis menggunakan spektrofotometri UV, karena semakin besar absorbansi yang diperoleh untuk kadar analit yang sama. Rerata nilai absorptivitas molar (
ε)
asiklovir dalam penelitian ini adalah 14269. Ini dapat diartikan bahwa asiklovir mudah dianalisis secara spektrofotometri ultraviolet.F. Validasi Metode
Parameter validitas yang diamati dalam penelitian ini adalah spesifisitas, linearitas, rentang, LOD, LOQ, akurasi, dan presisi.
1. Spesifisitas
Spesifisitas merupakan kemampuan pengukuran analit secara akurat dan spesifik dengan kehadiran komponen lain (zat aktif, eksipien, pengotor, dan produk degradasi) dalam matriks sampel (Anonim, 2005). Dalam penelitian ini akan dibandingkan spektra analit dalam sampel tablet asiklovir dengan baku asiklovir. Tujuannya yaitu untuk membuktikan bahwa zat yang terukur kadarnya adalah asiklovir dan absorbansi yang didapat tidak dipengaruhi eksipien.
Hasil penelitian menunjukkan spektra sampel tablet asiklovir memiliki kemiripan dengan spektra baku asiklovir. Kemiripan spektra antara suatu sampel dengan baku menunjukkan bahwa kemungkinan sampel tersebut mengandung senyawa yang sama dengan senyawa baku. Pada penelitian ini selain kemiripan spektra sampel dan baku asiklovir, pembuktian bahwa sampel yang digunakan benar mengandung asiklovir tertera pada label tablet yang diuji. Pada label tertera tablet tersebut mengandung asiklovir 400 mg. Oleh karena itu, dapat disimpulkan bahwa senyawa dalam sampel yang terukur adalah asiklovir dan bukan
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
eksipiennya. Perbandingan antara spektra sampel dan baku asiklovir dapat dilihat pada gambar 6 berikut ini.
Gambar 6. Spektra sampel dan baku asiklovir kadar 2; 4; dan 7 µg/mL
Pada uji spesifisitas ini penulis menggunakan 3 level konsentrasi, yakni 2; 4 ; dan 7 µg/mL untuk memastikan bahwa tidak ada perbedaan bentuk spektra pada sampel dengan baku yang digunakan walaupun pada konsentrasi yang berbeda. Kadar sampel pada uji spesifisitas ini dihitung berdasarkan label claim
karena hanya sebagai identifikasi kualitatif. Pada panjang gelombang 255 nm tidak terdapat gangguan dari eksipien sehingga dapat dikatakan bahwa metode penetapan kadar asiklovir secara spektrofotometri UV memiliki spesifisitas yang baik.
2. Linearitas
Menurut Mulja dan Hanwar (2003), linearitas merupakan kemampuan
suatu metode untuk memperoleh hasil-hasil uji yang secara langsung proporsional -0.1 0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 200 250 300 350 400
Standar 2 µg/mL Sampel 2µg/mL Standar 4 µg/mL Sampel 4 µg/mL Standar 7 µg/mL Sampel 7 µg/mL
Panjang Gelombang (nm) A bs or ban si
35
dengan konsentrasi analit pada kisaran yang diberikan. Linearitas ditunjukkan
dengan nilai koefisien korelasi (r). Syarat suatu metode dikatakan memiliki
linearitas yang baik menurut Snyder et al. (1997) adalah bila nilai koefisien korelasi (r)-nya ≥ 0,999.
Hasil pengukuran pada 3 replikasi seri kurva baku menghasilkan nilai r masing-masing 0,9990; 0,9990; dan 0,9974 (tabel V). Replikasi I dan II memenuhi syarat linearitas yang baik karena memiliki nilai koefisien korelasi ≥ 0,999. Dengan demikian dapat disimpulkan bahwa metode penetapan kadar asiklovir secara spektrofotometri UV memiliki linearitas yang baik.
3. Rentang
Menurut Yuwono dan Indrayanto (2005), rentang pada metode analisis
dapat didefinisikan sebagai interval antara batas atas dan batas bawah pada analit
yang dapat diukur dan memenuhi syarat presisi, akurasi, dan linearitas. Pada
penelitian ini dilakukan 3 replikasi seri larutan baku dengan kadar 3; 4; 5; 6; 7; 8;
9; 10; 11; 12; 13; dan 14 µg/mL. Masing-masing larutan tersebut diukur
absorbansinya dan dihitung nilai koefisien korelasinya. Pemilihan konsentrasi
larutan ini didasarkan pada konsentrasi yang memberikan absorbansi 0,2 – 0,8.
Data yang diperoleh dapat dilihat pada tabel VII.
Data pada tabel VII menunjukkan ketiga replikasi memenuhi syarat presisi. Nilai koefisien variansi rata-rata dari 12 konsentrasi pada penentuan rentang adalah 2,07%. Menurut Yuwono dan Indrayanto (2005), nilai koefisien variansi untuk konsentrasi analit > 0,1% adalah 3,7%. Sedangkan yang memenuhi
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
syarat linearitas yaitu hanya pada replikasi I karena nilai koefisien korelasi yang didapat ≥ 0,999.
Tabel VII. Data replikasi seri kurva baku dalam penetapan rentang
Replikasi I Replikasi II Replikasi III CV
(%) Konsentrasi asiklovir (µg/mL) Abs Konsentrasi asiklovir (µg/mL) Abs Konsentrasi asiklovir (µg/mL) Abs 3,108 0,207 3,015 0,196 3,138 0,195 2,07 4,144 0,269 4,020 0,250 4,184 0,249 2,07 5,180 0,324 5,025 0,314 5,230 0,305 2,07 6,216 0,376 6,030 0,384 6,276 0,384 2,07 7,252 0,445 7,035 0,449 7,322 0,433 2,07 8,288 0,517 8,040 0,494 8,368 0,457 2,07 9,324 0,550 9,045 0,532 9,414 0,583 2,07 10,360 0,657 10,050 0,574 10,460 0,638 2,07 11,396 0,702 11,055 0,655 11,506 0,740 2,07 12,432 0,775 12,060 0,701 12,552 0,766 2,07 13,468 0,834 13,065 0,719 13,598 0,856 2,07 14,504 0,890 14,070 0,798 14,644 0,899 2,07 Koefisien korelasi (r) 0,999 Koefisien korelasi (r) 0,997 Koefisien korelasi (r) 0,996
Dapat disimpulkan bahwa rentang kadar yang memenuhi syarat presisi dan linearitas untuk dijadikan batas bawah dan batas atas dalam metode penetapan kadar asiklovir pada penelitian ini yakni 3 – 14 µg/mL yaitu pada replikasi I. Nilai r pada replikasi II dan III tidak memenuhi syarat linearitas dapat disebabkan karena terjadi ketidaksesuaian kadar terhitung dengan kadar terukur akibat kurang teliti saat pengenceran. Berikut ini grafik yang menunjukkan hubungan antara konsentrasi larutan baku asklovir versus absorbansi yang digunakan dalam penentuan rentang.
37
Gambar 7. Grafik linearitas larutan asiklovir pada kadar 3 – 14 µg/mL (Replikasi I)
4. Batas deteksi (LOD) dan batas kuantitasi (LOQ)
Pada penetapan kadar asiklovir sebenarnya tidak memerlukan parameter batas deteksi dan batas kuantitasi karena metode ini termasuk dalam kategori I, yakni mencakup prosedur analisis kuantitatif untuk menetapkan kadar komponen utama bahan obat dalam sediaan farmasi. Penulis melakukan penentuan batas deteksi dan batas kuantitasi untuk mengetahui sensitivitas metode spektrofotometri UV dalam menetapkan kadar asiklovir.
Batas deteksi (LOD) adalah konsentrasi analit terendah yang masih dapat terdeteksi dengan metode yang digunakan, sedangkan batas kuantitasi adalah konsentrasi terkecil suatu analit dalam sampel yang masih memenuhi syarat akurasi dan presisi yang baik. Batas deteksi dan batas kuantitasi dihitung berdasarkan garis regresi linier dari kurva baku. Secara teoritis LOD dan LOQ dapat diperoleh dengan rumus:
LOD = 3 𝑥𝑥𝑆𝑆𝑆𝑆𝑏𝑏𝑏𝑏𝑠𝑠𝑛𝑛𝑠𝑠𝑏𝑏𝐼𝐼 𝑠𝑠𝑏𝑏𝐼𝐼𝑠𝑠𝑡𝑡 0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.91 0.21 0.27 0.32 0.38 0.45 0.52 0.55 0.66 0.70 0.78 0.83 0.89 Konsentrasi asiklovir (µg/mL) A bs o rba ns i r = 0,999
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
LOQ = 10 𝑥𝑥𝑆𝑆𝑆𝑆𝑏𝑏𝑏𝑏𝑠𝑠𝑛𝑛𝑠𝑠𝑏𝑏𝐼𝐼
𝑠𝑠𝑏𝑏𝐼𝐼𝑠𝑠𝑡𝑡 (Anonim, 2005).
Blangko yang digunakan yaitu larutan HCl 0,1 N. Pengukuran blangko dilakukan sebanyak 10 kali dan dihitung standar deviasinya. Slope yang digunakan berasal dari persamaan kurva baku asiklovir replikasi I yaitu 1,2376. Batas deteksi dari metode ini secara teoritis adalah 0,025 µg/mL, sedangkan batas kuantitasinya yaitu 0,083 µg/mL. Data absorbansi blangko yang diperoleh disajikan pada tabel VIII.
Tabel VIII. Data absorbansi blangko larutan HCl 0,1 N Absorbansi 0,044 0,045 0,044 0,045 0,045 0,045 0,044 0,045 0,044 0,045 x rata-rata = 0,0446 SD = 0,000516 CV = 1,16%
Dalam penentuan kadar zat aktif yang ada dalam suatu bentuk sediaan, LOQ tidak dapat digunakan sebagai kadar terkecil. Penggunaan LOQ sebagai batas bawah yaitu pada metode bioanalisis. Berdasarkan nilai LOD dan LOQ yang diperoleh dapat disimpulkan bahwa metode penetapan kadar asiklovir secara spektrofotometri UV memenuhi syarat sensitifitas karena dengan kadar yang kecil (yakni 0,025 µg/mL) sudah dapat mendeteksi adanya asiklovir serta memenuhi syarat akurasi dan presisi untuk penetapan kadar asiklovir pada konsentrasi 0,083 µg/mL.