4.1 Hasil Penelitian 4.1.1 Pengaruh zat pe
Pada penelitian i
warna putih kekuningan
Pada penelitian ini dila
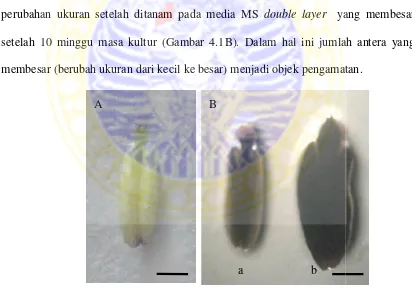
perubahan ukuran setela
pengatur tumbuh terhadap ukuran antera
n ini digunakan antera Capsicum frutescens L. y an dengan ujung antera sedikit berwarna ungu (Ga
dilakukan pengamatan antera C. frutescens yan telah ditanam pada media MS double layer ya asa kultur (Gambar 4.1B). Dalam hal ini jumlah
h ukuran dari kecil ke besar) menjadi objek pengamat
ndingan antera C. frutescens sebelum dan setelah
C. frutescens sebelum di kultur, B) Perbandingan sar (a) dan membesar (b) (Bar=1 mm).
Pada setiap perlakuan kombinasi zat pengatur tumbuh memiliki persentase
antera membesar yang berbeda-beda. Hal ini seperti yang ditunjukkan oleh tabel 4.1
sebagai berikut :
Tabel 4.1. Pengaruh kombinasi zat pengatur tumbuh auksin dan kinetin terhadap persentase anteraC. frutescensmembesar.
Berdasarkan tabel 4.1 perlakuan yang paling optimum adalah perlakuan
kombinasi zat pengatur tumbuh kinetin 0,5 ppm dengan NAA 1,5 ppm (K0,5N1,5) dan
kinetin 0,5 ppm dengan 2,4-D 0,5 ppm (K0,5D0,5) dengan persentase rata-rata yang
sama yaitu sebesar 80,00%. Sedangkan perlakuan yang mendapatkan hasil persentase
jumlah antera yang membesar paling sedikit adalah kinetin 0 ppm dengan 2,4-D 1,5
ppm (K0D1,5) yaitu 16,67%.
Berdasarkan Uji Brown-forshyte menyatakan bahwa perlakuan kombinasi zat
pengatur tumbuh kinetin dan auksin (IAA, NAA, 2,4-D, dan IBA) berpengaruh nyata
(α < 0,05) terhadap jumlah antera C. frutescens L. yang membesar. Uji Games-Howell menunjukkan bahwa ada beda nyata antar perlakuan.
Selama masa kultur, terjadi perubahan warna pada antera yang dikultur pada
media pertumbuhan. Antera C. frutescens yang awalnya berwarna putih kekuningan dengan bagian ujung berwarna ungu akan mengalami perubahan warna menjadi
kecoklatan (browning).
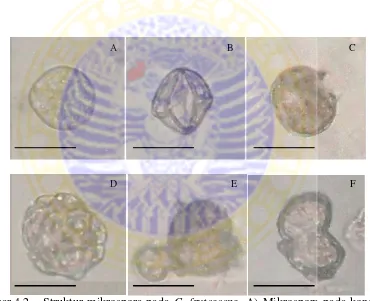
Pada penelitian ini, juga dilakukan pengamatan mikrospora yang ada di dalam
antera yang dilakukan setelah 10 minggu masa kultur. Hasil pengamatan
menunjukkan bahwa terdapat perubahan struktur mikrospora pada akhir masa kultur
jika dibandingkan dengan kondisi awal (Gambar 4.2 A). Pada kondisi awal
mikrospora berbentuk bulat dengan tepi rata dengan diameter ±20µm, sedangkan
setelah masa kultur mikrospora memiliki beberapa struktur. Pada penelitian ini,
terdapat mikrospora yang berbentuk oval dan struktur bagian tengah seperti membuka
pecah. Hal ini berbeda
han massa sel secara tidak terkendali sehingga
perkembangan menuju arah kalus. Gambar 4.2 E
embentuk bagian dengan proporsi yang tidak sa
gian besar). Pada penelitian ini, juga ditemuk
i pembelahan menjadi dua bagian yang sama (Gam
ur mikrospora pada C. frutescens. A) Mikrospora kultur, B-F) Berbagai struktur mikrospora setela 10 minggu (Bar= 20 µm).
pengatur tumbuh terhadap persentase antera yan
kukan pengamatan antera yang membesar, dalam pene
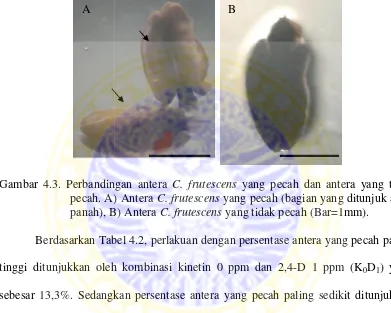
n antera C. frutescens yang pecah (Gambar 4.3)
antera akan menjadi jala
tinggi ditunjukkan oleh
sebesar 13,3%. Sedangk
oleh perlakuan K0I1, K0
sebesar 0%. Hal ini me
yang pecah selama 10 m A
alan keluar bagi mikrospora yang mengalami pert
amatan pecahnya antera dilakukan selama 10 m
eminggu sekali.
ndingan antera C. frutescens yang pecah dan ante A) AnteraC. frutescens yang pecah (bagian yang , B) AnteraC. frutescensyang tidak pecah (Bar=1m Tabel 4.2, perlakuan dengan persentase antera yang
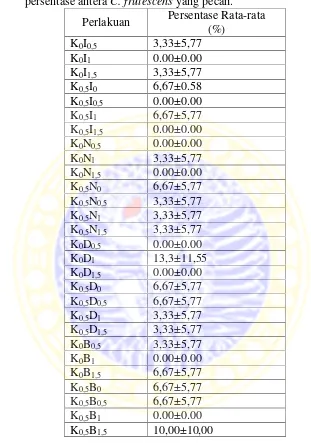
eh kombinasi kinetin 0 ppm dan 2,4-D 1 ppm
gkan persentase antera yang pecah paling sediki
, K0,5I0,5, K0,5I1,5, K0N0,5, K0N1,5, K0D1,5, K0B1, dan
menunjukkan bahwa pada perlakuan tersebut tida
Tabel 4.2. Pengaruh kombinasi zat pengatur tumbuh auksin dan kinetin terhadap persentase anteraC. frutescensyang pecah.
Perlakuan Persentase Rata-rata
Pada penelitian ini, untuk menentukan waktu pecahnya antera C. frutescens
dilakukan proses rata-rata dari setiap perlakuan. Dengan penambahan kombinasi zat
kultur pada media tersebut menjadi pecah. Walaupun demikian, tidak semua
perlakuan memiliki waktu pecahnya antera yang sama.
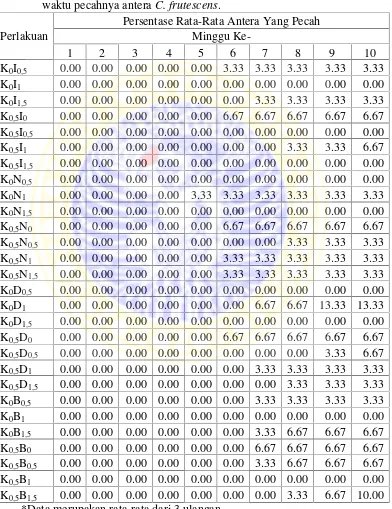
Tabel 4.3. Pengaruh kombinasi zat pengatur tumbuh auksin dan kinetin terhadap waktu pecahnya anteraC. frutescens.
Perlakuan
Berdasarkan Tabel 4.3, perlakuan kombinasi kinetin 0 ppm dan NAA 1 ppm
(K0N1) antera mulai pecah pada minggu ke-5 dengan persentase antera yang pecah
sebesar 3,33%. Hal ini berbeda dengan pada perlakuan K0,5I0, K0,5N0, dan K0,5D0.
Antera pada ketiga perlakuan tersebut mulai pecah pada minggu ke-6 dengan
persentase antera yang pecah sebesar 6,67%. Pada perlakuan K0,5D0,5, antera mulai
pecah pada minggu ke-9 dengan persentase 3,33% dan meningkat pada minggu ke-10
yaitu sebesar 6,67%.
Berdasarkan Uji Kruskal-Wallis, perlakuan kombinasi zat pengatur tumbuh
kinetin dan auksin (IAA, NAA, 2,4-D, dan IBA) tidak berpengaruh nyata (α > 0,05)
terhadap jumlah antera C. frutescens yang pecah sehingga tidak dapat dilakukan uji lanjutan statistik.
4.2 Pembahasan
4.2.1 Pengaruh zat pengatur tumbuh terhadap ukuran antera
Pada hasil penelitian menunjukkan bahwa pemberian kombinasi zat pengatur
tumbuh terhadap antera cabai rawit (C. frutescens) menyebabkan perbedaan persentase jumlah antera yang membesar. Perlakuan kombinasi zat pengatur tumbuh
yang paling optimal adalah kombinasi kinetin 0,5 ppm dengan NAA 1,5 ppm
(K0,5N1,5) dan kinetin 0,5 ppm dengan 2,4-D 0,5 ppm (K0,5D0,5). Hal ini ditunjukkan
dengan nilai persentase antera yang membesar paling tinggi yaitu sebesar 80%.
Kombinasi kinetin 0,5 ppm dengan NAA 1,5 ppm dan kinetin 0,5 ppm dengan
lebih besar dari ukuran pada awal proses penanaman. Kombinasi antara zat pengatur
tumbuh termasuk auksin dan kinetin sangat diperlukan sebagai penambahan
komponen media bagi pertumbuhan dan diferensiasi. Selain itu, penentuan kadar zat
pengatur tumbuh yang akan ditambahkan pada media pertumbuhan harus tepat. Hal
ini disebabkan jika kadar yang diberikan terlalu tinggi maka pertumbuhan eksplan
akan terhambat, bersifat racun dan bahkan menyebabkan eksplan tersebut mati.
Sedangkan pemberian zat pengatur tumbuh di bawah kadar optimum menjadi tidak
efektif (Hendaryono & Wijayani, 1994).
Antera yang telah dikulturkan pada media MS dengan penambahan auksin dan
kinetin akan mengalami perubahan termasuk ukuran eksplan. Peran dari zat pengatur
tumbuh auksin adalah untuk melonggarkan serat-serat dinding sel. Pada saat dinding
sel lebih fleksibel, sel bebas mengambil tambahan air dan zat hara melalui osmosis.
Sel eksplan (antera C. frutescens) akan mulai membesar dan memberikan dorongan melawan dinding selnya. Beda potensial air dan zat terlarut dalam sel akan mencapai
titik konsentrasi yang sama sehingga kondisi ini akan menyebabkan sel turgid. Sel
turgid dengan penambahan sitokinin akan mempengaruhi pembelahan dan
pemanjangan sel (Desriatin, 2011).
Pada antera yang membesar, dilakukan pengamatan mikrospora yang ada di
dalamnya. Hasil penelitian menunjukkan bahwa terdapat berbagai struktur
mikrospora setelah masa kultur 10 minggu. Pada kondisi awal, mikrospora berbentuk
bulat dengan tepi rata dengan diameter ± 20µm (Gambar 4.2 A). Pada gambar 4.2 B,
penelitian Supena et al. (2004) menyatakan bahwa pada C. annum juga ditemukan struktur mikrospora seperti gambar 4.2 B. Struktur tersebut merupakan tahap
uninukleat akhir yang ditemukan pada antera setelah masa kultur 2 minggu.
Pada gambar 4.2 C, mikrospora terlihat pecah dengan lapisan luar mikrospora
(exine) yang mengalami kerusakan struktur (pecah) sedangkan pada gambar 4.2 D, mikrospora mengalami perkembangan menuju arah kalus. Hal ini ditunjukkan dengan
adanya pembelahan massa sel secara tidak terkendali sehingga mikrospora tersebut
mengalami perkembangan menuju ke arah kalus.
Pada gambar 4.2 E menunjukkan bahwa mikrospora membentuk bagian
dengan proporsi yang tidak sama (terdapat bagian kecil dan bagian besar). Hal ini
sama dengan penelitian Bal et al. (2003) yang menyatakan bahwa pada antera C. annum ditemukan mikrospora dengan bentuk yang sama. Struktur tersebut merupakan perkembangan kalus yang memungkinkan akan berkembang menjadi
embrio. Struktur yang kecil akan menjadi embrio sedangkan struktur yang besar
dapat mengalami perkembangan menjadi kotiledon.
Struktur mikrosporaC. frutescensmengalami pembelahan menjadi dua bagian yang sama (Gambar 4.2 F). Setelah perlakuan dengan penambahan zat pengatur
tumbuh, beberapa mikrospora akan membelah menjadi dua sel dengan ukuran dan
strktur yang sama (Baranyet al., 2005).
Berdasarkan hasil tersebut, mikrospora yang ada di dalam antera telah
mengalami perkembangan walaupun antera tersebut tidak pecah. Hal ini
tidak mampu mendesak dinding antera sehingga mikrospora di dalamnya tidak dapat
keluar.
4.2.2 Pengaruh zat pengatur tumbuh terhadap persentase antera yang pecah.
Pecahnya antera diawali proses pemanjangan endotesium secara signifikan
pada bagian dinding antera. Stomium akan mengalami degenerasi (membuka) pada
dinding antera. Sehingga antera dapat mengeluarkan mikrospora melalui stomium
yang mengalami degenerasi (Sanderset al., 2000).
Walaupun demikian, jika dibandingkan dengan Berdasarkan hasil penelitian,
pemberian kombinasi zat pengatur tumbuh auksin dan kinetin tidak berpengaruh
terhadap persentase jumlah antera cabai rawit (Capsicum frutescens L.) yang pecah. perlakuan yang lain, perlakuan kinetin 0 ppm dan 2,4-D 1 ppm (K0D1) mendapat
persentase jumlah antera yang pecah paling tinggi yaitu sebesar 13,3%. Hal ini
berbeda dengan penelitian Supenaet al.(2004) yang menyatakan bahwa penambahan kombinasi zat pengatur tumbuh zaetin 2,5 µM dan IAA 5 µM ke dalam media
pertumbuhan mampu menginduksi pecahnya antera Capsicum annum serta menghasilkan embrio normal.
Setiap eksplan memiliki respon yang berbeda terhadap zat pengatur tumbuh
yang ditambahkan pada media pertumbuhan. Menurut Dumas de Vaulx et al. (1981) penambahan 0,01 mg/L kinetin dan 0,01 mg/L 2,4-D merupakan kombinasi zat
paling tinggi adalah perlakuan kombinasi kinetin 0 ppm dan 2,4-D 1 ppm dengan
persentase jumlah antera yang pecah sebesar 13,3%. Walaupun begitu, jumlah
persentase yang dihasilkan sangat kecil.
Hal ini kemungkinan dikarenakan oleh browning. Browning merupakan perubahan warna eksplan yang awalnya berwarna putih kekuningan dengan ujung
sedikit berwarna ungu menjadi berwana coklat. Browning kemungkinan terjadi karena adanya akumulasi komponen fenolik pada eksplan dimana terjadi proses
perubahan adaptif bagian tanaman akibat adanya pengaruh fisik (memar, pengupasan,
pemotongan, atau kondisi yang tidak normal) dan biokimia, bisa juga merupakan
gejala ilmiah dari proses penuaan (Kartiningrum dkk., 2011). Senyawa kuinon akan
menghambat aktifitas enzim yang selanjutnya dapat mematikan tanaman (Agustin,
2005). Berdasarkan hal tersebut, kemungkinan adanya browning pada eksplan mempengaruhi jumlah antera yang pecah. Sehingga pemberian kombinasi zat
pengatur tumbuh auksin dan kinetin tidak memberikan pengaruh terhadap jumlah
antera cabai rawit (C. frutescens) yang pecah.
Menurut Sheeler & Bianchi (1987), bagian sel tanaman yaitu vakuola sebagai
tempat untuk menyimpan air dan produk-produk sel khususnya metabolit sekunder
termasuk fenol. Pada saat proses pemotongan jaringan, vakuola terpotong dan akan
mengeluarkan fenol yang bereaksi dengan enzim fenol oksidase di dalam sitosol,
sehingga terbentuk kuinon yang menyebabkan warna berubah menjadi coklat.
dikulturkan. Hal tersebut dilakukan untuk mencegah terbentuknya kuinon. Zat yang
biasa ditambahkan adalah polivinylpyrrolidone. Penambahan zat polivinylpyrrolidone
(PVP) cukup efektif untuk menyerap senyawa toksik (Chunget al., 1987).
Menurut Supena et al. (2004), waktu yang dibutuhkan antera Capsicum annum untuk pecah dan mengeluarkan mikrospora adalah 3 minggu setelah kultur. Hal ini berbeda dengan hasil penelitian ini. Berdasarkan hasil penelitian, waktu
tercepat dalam proses pecahnya antera C. frutescens adalah minggu ke-5 yaitu perlakuan kombinasi kinetin 0 ppm dan NAA 1 ppm (K0N1). Meskipun begitu, pada
perlakuan K0N1 persentase jumlah antera yang pecah hanya 3,3%. Jika dibandingkan
dengan perlakuan K0N1, walaupun perlakuan K0D1 waktu yang dibutuhkan antera
untuk lebih lama (minggu ke-7) tetapi K0D1 memiliki persentase jumlah antera yang
pecah lebih tinggi dibandingkan perlakuan K0N1 yaitu sebesar 13,3%. Hal ini
menunjukkan bahwa tidak ada hubungan antara waktu awal pecahnya antera dengan