ANALISIS SENYAWA KARSINOGENIK NITROSODIPROPILAMIN (NDPA) PADA SOSIS MENTAH DENGAN HEADSPACE-SINGLE DROP MICROEXTRACTION-GAS CHROMATOGRAPHY-FLAME IONIZATION
DETECTOR (HS-SDME-GC-FID)
SKRIPSI
Sebagai Salah Satu Syarat Untuk Memperoleh Gelar Sarjana Sains Bidang Kimia Pada Fakultas Sains dan Teknologi
Universitas Airlangga
Disetujui Oleh :
Dosen Pembimbing I, Dosen Pembimbing II,
LEMBAR PENGESAHAN NASKAH SKRIPSI
Judul : Analisis Senyawa Karsinogenik Nitrosodipropilamin (NDPA) Pada Sosis Mentah Dengan Headspace-Single Drop Microextraction-Gas Chromatography-Flame Ionization Detector (HS-SDME-GC-FID)
Penyusun : Kartika Laksmi Prasetyowati NIM : 080810187
Pembimbing I : Dra. Usreg Sri Handajani., M.Si Pembimbing II : Yanuardi Raharjo, S.Si., M.Sc Tanggal Ujian : 17 Juli 2012
Disetujui oleh :
Pembimbing I, Pembimbing II,
Dra. Usreg Sri Handajani., M.Si Yanuardi Raharjo, S.Si., M.Sc NIP. 19560929 198303 2 001 NIK. 139090961
Mengetahui,
Ketua Program Studi S-1 Kimia Fakultas Saintek, Universitas Airlangga
PEDOMAN PENGGUNAAN SKRIPSI
KATA PENGANTAR
Puji syukur ke hadirat Allah SWT yang telah melimpahkan rahmat dan hidayah-Nya segala petunjuk yang telah diberikan, sehingga penulis dapat menyelesaikan skripsi yang berjudul “Analisis Senyawa Karsinogenik Nitrosodipropilamin (NDPA) Pada Sosis Mentah Dengan Headspace-Single Drop Microextraction-Gas Chromatography-Flame Ionization Detector (HS-SDME-GC-FID)” dengan lancar dan tepat pada waktunya. Penulis menyampaikan ucapan terima kasih kepada :
1. Ibu Dra. Usreg Sri Handajani., M.Si selaku dosen pembimbing I dan dosen wali, serta Bapak Yanuardi Raharjo, S.Si., M.Sc selaku dosen pembimbing II yang telah memberikan bimbingan dan arahan kepada penulis hingga selesainya skripsi ini.
2. Kedua Orang Tua yang telah memberikan motivasi dan nasehat kepada penyusun.
3. Adik-adikku Riri dan Rizki yang telah memberikan semangat kepada penyusun.
4. Sahabat-sahabatku Della, Rey, Ike, Ayu dan Laras yang selalu memberi semangat, penghiburan, dukungan dan bantuannya kepada penulis.
5. Kakak-kakak kimia angkatan 2007 yang telah membantu dalam penyelesaian skripsi ini.
6. Teman-teman kimia angkatan 2008 tercinta yang telah membantu dalam penyelesaian skripsi ini.
Penyusun menyadari bahwa masih terdapat banyak kekurangan dalam penyusunan skripsi ini, oleh karena itu penulis sangat mengharapkan kritik dan saran yang bersifat membangun untuk kesempurnaan penyusunan skripsi ini agar bermanfaat bagi semua pihak.
Surabaya, 2 Juli 2012
Penyusun,
Prasetyowati K. L., 2012, Analisis Senyawa Karsinogenik Nitrosodipropilamin (NDPA) Pada Sosis Mentah Dengan Headspace-Single Drop Microextraction-Gas Chromatography-Flame Ionization Detector (HS-SDME-GC-FID). Skripsi Ini Dibawah Bimbingan Dra. Usreg Sri Handajani., M.Si dan Yanuardi Raharjo, S.Si., M.Sc. Departemen Kimia, Fakultas Sains dan Teknologi, Universitas Airlangga, Surabaya.
ABSTRAK
Prasetyowati K. L., 2012, Analysis of Nitrosodipropylamines Carcinogenic Compound to Sausage Using Headspace-Single Drop Microextraction-Gas Chromatography-Flame Ionization Detector (HS-SDME-GC-FID). This thesis is under advisement of Dra. Usreg Sri Handajani., M.Si and Yanuardi Raharjo, S.Si., M.Sc. Chemistry Department, Science and Technology Faculty, Universitas Airlangga.
ABSTRACT
A simple, fast and accurate method using head space-single drop micro extraction (HS-SDME) for quantitative analysis of nitosodipropylamine (NDPA) in sausage had been studied using gas chromatography-flame ionization detector (GC-FID). This method used three analytical parameters had been optimized. The three analytical parameters consisted of, toluene (type of organic solvent), 20 mL volume of extract solution and 30 minutes of extraction time. In the process of HS-SDME, the organic phase (toluene) was inserted into the syring and was extracted by the use of HS-SDME and then analyzed by GC-FID. This optimization yielded a linier calibration curve for standard of NDPA in concentration of 2 to 10 ppm with r = 0.999, limit of detection up to 0.078 ppm, accuracy (recovery) 99.9 %, precision (coefficient of variation) between 0.005 to 1.29 % and the enrichment factor 6,658.66. NDPA in sausage samples A, B, and C were successfully extracted and analyzed using HS-SDME-GC-FID. Concentrations of NDPA wich resulted 0.64 ppm in sample A, 1.5 ppm in sample B, and 1.38 ppm in sample C
DAFTAR ISI
Halaman
LEMBAR JUDUL ... i
LEMBAR PERNYATAAN... ii
LEMBAR PENGESAHAN... ... iii
LEMBAR PEDOMAN PENGGUNAAN SKRIPSI... iv
KATA PENGANTAR ... v
DAFTAR LAMPIRAN... xiii
BAB I PENDAHULUAN ... 1
2.4.2 Headspace-Single Drop Microextraction... ... 16
2.5 Kromatografi Gas... ... 19
3.4.2 Headspace-single drop microextraction (HS-SDME).. . 23
3.4.3 Pembuatan larutan induk NDPA 50 ppm... . 24
3.4.4 Pembuatan larutan standar NDPA 2 ppm,4ppm, 6 ppm, 8 ppm, 10 ppm.. ... 24
3.4.5 Pembuatan kurva kalibrasi tanpa HS-SDME... . 24
3.4.6.1 Optimasi jenis pelarut organik... 24
3.4.6.2 Optimasi volume larutan ekstrak ... 25
3.4.6.3 Optimasi waktu ekstraksi... 25
3.4.7 Pembuatan kurva kalibrasi menggunakan parameter HS-SDME yang telah di optimasi... ... 26
3.5 Validasi Parameter Analitik ... 26
3.5.1 Penentuan limit deteksi ... 26
3.5.2 Penentuan persen recovery (R) ... 27
3.5.3 Uji koefisien variasi ... 27
3.5.4 Perhitungan enrichment factor ... 28
3.6 Preparasi Sampel dan Penyimpanan Sampel ... 28
3.7 Analisis Sampel ... 29
3.8 Penentuan Persen Recovery Pada Analisis Sampel ... 29
BAB IV HASIL DAN PEMBAHASAN ... 31
4.1 Penentuan Kondisi Optimum Instrumen Gas Chromatography (GC) Untuk Senyawa NDPA ... 31
4.2 Pembuatan Kurva Kalibrasi NDPA Tanpa Ekstraksi ... 32
4.3 Optimasi parameter analitik ... 34
4.3.1 Optimasi jenis pelarut organik ... 34
4.3.2 Optimasi volume larutan ekstrak ... 38
4.3.3 Optimasi waktu ekstraksi ... 40
4.4 Pembuatan Kurva Kalibrasi NDPA dengan Parameter Hasil Optimasi ... 42
4.5 Penentuan Parameter-Parameter Validasi ... 44
4.5.1 Limit deteksi (sensitivitas) ... 44
4.5.2 Persen Recovery (R) ... 45
4.5.3 Ketelitian (presisi) ... 46
4.5.4 Enrichment factor ... 47
4.6 Sampling, Penyimpanan Sampel dan Preparasi Sampel ... 49
4.7 Analisis Sampel ... 50
4.8 Persen Recovery (R) Sampel ... 52
BAB V KESIMPULAN DAN SARAN ... 54
5.1 Kesimpulan ... 54
5.2 Saran ... 54
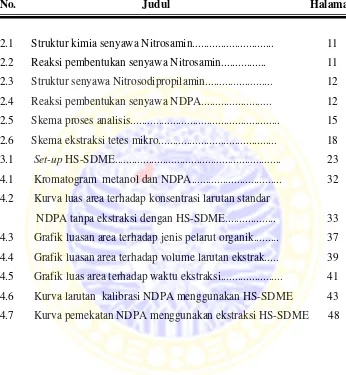
DAFTAR GAMBAR
No. Judul Halaman
2.1 Struktur kimia senyawa Nitrosamin... 11
2.2 Reaksi pembentukan senyawa Nitrosamin... 11
2.3 Struktur senyawa Nitrosodipropilamin... 12
2.4 Reaksi pembentukan senyawa NDPA... 12
2.5 2.6 Skema proses analisis... Skema ekstraksi tetes mikro... 15 18 3.1 Set-up HS-SDME... 23
4.1 Kromatogram metanol dan NDPA... 32
4.2 Kurva luas area terhadap konsentrasi larutan standar NDPA tanpa ekstraksi dengan HS-SDME... 33
4.3 Grafik luasan area terhadap jenis pelarut organik... 37
4.4 Grafik luasan area terhadap volume larutan ekstrak... 39
4.5 Grafik luas area terhadap waktu ekstraksi... 41
4.6 Kurva larutan kalibrasi NDPA menggunakan HS-SDME 43
DAFTAR TABEL
Karakteristik senyawa NDPA... Pembuatan larutan buffer asetat... Pembuatan larutan buffer fosfat... Data luas area pengukuran larutan standar NDPA tanpa ekstraksi HS-SDME... Karakteristik kimia dan fissika pelarut organik... Data luas area tiga jenis pelarut organik... Data luas area terhadap volume larutan ekstrak... Data luas area terhadap waktu ekstraksi... Data pengukuran larutan standar NDPA menggunakan SDME... Data persen recovery larutan standar NDPA... Data KV larutan standar NDPA... Data luas area sampel... Data konsentrasi NDPA pada sampel... Data spiking sampel... Data persen recovery spiking sampel...
DAFTAR LAMPIRAN
No. Judul
1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14.
Pembuatan Larutan
Pembuatan Kurva Kalibrasi NDPA Tanpa Ektraksi Pembuatan Grafik Optimasi Jenis Pelarut Organik Pembuatan Grafik Optimasi Volume Larutan Ekstrak Pembuatan Grafik Optimasi Waktu Ekstraksi
Pembuatan Kurva Kalibrasi NDPA menggunakan Ekstraksi HS-SDME Perhitungan Enrichment Factor
Perhitungan Konsentrasi Sampel
Perhitungan Spiking dan Recovery (%R) Spiking Kromatogram Nitrosodipropilamin (NDPA) Kromatogram Metanol dan NDPA
Kromatogram Metanol dan Toluena
1 BAB I
PENDAHULUAN
1.1 Latar Belakang
Seiring kebutuhan masyarakat modern, berbagai makanan olahan saat ini telah banyak diproduksi, baik oleh perusahaan besar hingga industri rumah tangga, sebagai contoh makanan olahan tersebut adalah sosis. Sosis merupakan produk makanan olahan dengan bahan utama daging. Terdapat berbagai jenis sosis yang beredar di pasaran, seperti sosis segar, sosis masak, sosis fermentasi, ataupun sosis daging giling yang diasap. Sedangkan dalam proses pembuatannya, bahan utama daging dicampur dengan berbagai bahan lainnya. Bahan tambahan ini diperlukan untuk meningkatkan daya beli konsumen karena lebih menarik dan tahan lama.
Bahan dasar daging pada pembuatan sosis sangat mudah rusak, hal ini disebabkan oleh mudah tumbuhnya bakteri Clostridium botulinum, sehingga pada proses penyimpanannya perlu penambahan bahan pengawet tertentu. Nitrit merupakan zat yang sengaja ditambahkan pada produk daging olahan seperti sosis untuk mencegah pembentukan racun dari bakteri Clostridium botulinium (Ikeda dan Migliorese, 1990). Penggunaan nitrit selain sebagai pencegahan terhadap pertumbuhan mikroba, penambahan nitrit juga bermanfaat memberikan tampilan yang lebih menarik terhadap daging olahan (Husni dkk., 2007).
Kanker nasofaring merupakan salah satu dari beberapa jenis kanker yang mematikan. Kanker nasofaring tumbuh di rongga belakang hidung dan belakang langit-langit rongga mulut. Kanker ini banyak dijumpai pada orang-orang ras mongoloid, yaitu penduduk Cina bagian selatan, Hong Kong, Thailand, Malaysia, Indonesia dan India. Angka kejadian kanker nasofaring di Indonesia cukup tinggi yakni 4,7 kasus/tahun/100.000 penduduk. Faktor kuat penyebab kanker ini adalah konsumsi makanan yang mengandung bahan pengawet, termasuk makanan yang diawetkan dengan cara pengasinan dan pengasapan (Ozel et al., 2010).
Nitrosamin merupakan senyawa yang berpotensi karsinogen, mutagen dan teratogen untuk hewan dan manusia (Scanlan, 2003). Nitrosamin adalah suatu senyawa yang terbentuk dari nitrit yang bereaksi dengan berbagai amina dan asam amino di lingkungan dan di dalam tubuh manusia. Nitrosamin juga dapat dibentuk secara endogen di dalam tubuh manusia (Andrade et al., 2004). Jika kadar senyawa nitrit tinggi dalam tubuh manusia akan mengakibatkan resiko alergi dan menghasilkan senyawa nitrosamin yang bersifat karsinogen (Marco et al., 2006). Senyawa nitrosamin ditemukan dalam makanan seperti keju (Gloria et al., 1997; Scanlan, 2003), ikan (Mitacek et al., 1999), dan juga pada bahan – bahan yang disimpan dalam temperatur ruang seperti produk yang diawetkan (Rywotycki, 2002).
makanan kurang dari 10 µg L-1 (Filho et al., 2003). Hal ini membuktikan bahwa di beberapa negara telah dibuat peraturan yang sangat ketat dalam pengamanan makanan, sehingga dapat mengurangi angka keracunan makanan yang akan menyebabkan kematian.
(Solid-Phase Microextraction) dan SPE (Solid-(Solid-Phase Extraction) yang prinsip kerjanya hampir sama dengan kromatografi kolom yakni adsorpsi antara fase diam dan fase gerak. Teknik SPME masih sulit diterapkan untuk analisis rutin karena membutuhkan instrumen analisis yang canggih dan mahal, prosesnya rumit, menggunakan material seperti absorben pelapis fiber, dan teknik ekstraksi tradisional menghasilkan limbah pelarut organik yang digunakan untuk ekstraksi tidak dapat didaur ulang. Adapun kekurangan dari metode SPE adalah membutuhkan pelarut dengan kemurnian yang tinggi dan dalam jumlah yang banyak sehingga limbah yang dihasilkan juga banyak dan waktu yang dibutuhkan relatif lama (Supriyanto, 2005). Sedangkan untuk teknik TSE (Traditional Solvent Extraction) memiliki prinsip kerja penarikan zat dalam larutan dengan pelarut lain yang tidak saling campur. Proses yang terjadi adalah distribusi solut, akan tetapi teknik TSE masih memiliki kekurangan yaitu timbulnya emulsi, banyaknya pelarut organik yang dibutuhkan, menghasilkan limbah organik dalam jumlah banyak serta proses ekstraksinya membutuhkan waktu yang lama. Sehingga ketiga teknik tersebut masih belum efisien digunakan untuk analisis secara rutin.
akurat dan dapat digunakan untuk sampel dengan konsentrasi kecil. Teknik ini mempunyai dua model ekstraksi, yakni direct-SDME dan HS-SDME (Headspace-Single Drop Microextraction) (Pena-Pereira et al., 2010).
pada sampel daging olahan (sosis) sehingga dapat digunakan sebagai acuan oleh konsumen untuk memilih produk makanan. Teknik HS-SDME ini sangat tepat untuk diterapkan dalam proses persiapan sampel karena metode ini berbasis prinsip green chemistry, yaitu dapat meminimalisir pembuangan limbah berbahaya ke lingkungan selama proses ekstraksi.
1.2 Rumusan Masalah
Berdasarkan latar belakang masalah, maka dapat dirumuskan masalah sebagai berikut.
1. Apakah senyawa nitrosodipropilamin (NDPA) dapat diekstraksi menggunakan teknik HS-SDME dengan instrumen GC-FID?
2. Bagaimana hasil optimasi terhadap parameter jenis pelarut organik, waktu ekstraksi, dan volume larutan ekstrak pada analisis senyawa NDPA menggunakan teknik HS-SDME?
3. Apakah hasil optimasi tersebut dapat digunakan sebagai parameter untuk ekstraksi dan penentuan kadar senyawa NDPA dalam sampel sosis mentah?
1.3 Tujuan Penelitian
Tujuan penelitian ini adalah :
2. mengetahui hasil optimasi terhadap parameter jenis pelarut organik, waktu ekstraksi, dan volume larutan ekstrak pada analisis senyawa NDPA menggunakan teknik HS-SDME
3. mengekstrak dan menentukan kadar senyawa NDPA dalam sampel sosis mentah dengan menggunakan parameter hasil optimasi.
1.4 Manfaat Penelitian
8 BAB II
TINJAUAN PUSTAKA
2.1 Nitrit
Nitrit (NO2-) adalah ion anorganik alami, merupakan bagian dari siklus nitrogen. Pertama-tama nitrogen organik yang berasal dari sampah akan diuraikan menjadi ammonia oleh mikroba yang berada di tanah atau air, kemudian ammonia yang terbentuk dioksidasi menjadi nitrit. Nitrit dapat dengan mudah dioksidasikan menjadi nitrat, maka dari itu nitrat merupakan senyawa yang paling sering ditemukan di dalam air baik air bawah tanah maupun air permukaan. Pencemaran oleh pupuk nitrogen, termasuk ammonia anhidrat seperti sampah organik dari hewan maupun manusia, dapat meningkatkan kadar nitrat di dalam air. Senyawa di dalam tanah yang mengandung nitrat biasanya larut dan dapat dengan mudah berpindah melalui air bawah tanah (Thompson, 2004).
natrium nitrat (NaNO3) sebagai pengawet maupun pewarna makanan. Methemoglobinemia simptomatik telah terjadi pada anak-anak yang mengkonsumsi sosis yang menggunakan nitrit dan nitrat secara berlebihan (Thompson, 2004).
atau nitrit dimasak dengan panas yang tinggi. Sementara itu, nitrit sendiri diketahui menjadi salah satu bahan karsinogenik seperti timbulnya kanker perut pada manusia (Anonim, 2005).
Dalam makanan nitrit merupakan zat aditif penting sebagai pemberi warna yang khas bagi daging yang diawetkan, perasa, penjaga tekstur serta untuk melindungi terhadap ketengikan oksidatif dan melindungi makanan terhadap berkembangnya mikroorganisme patogen, terutama Clostridium Botulinum yang terdepat pada produk olahan daging (Cassens, 1995).
2.2 Nitrosamin
Nitrosamin merupakan senyawa organik yang bersifat volatil, larut dalam air, dengan kelarutan sebanyak 29gr/100mL. Nitrosamin terkenal sebagai zat yang toksik dan karsinogenik (Tannenbaum et al.,1994) yang biasa ditemukan pada makanan yang diawetkan dengan menggunakan nitrit. Nitrit sering digunakan sebagai bahan pengawet daging, ikan serta keju agar bakteri pembusuk tidak berkembang biak. Daya mengawetkannya bertambah besar bila ditambah garam dan asam. Pengggunaan nitrit pada makanan dibatasi dalam jumlah 150 mg/kg daging.
yang mengandung nitrosamin akan menyebabkan kanker saluran cerna atau kanker hati.
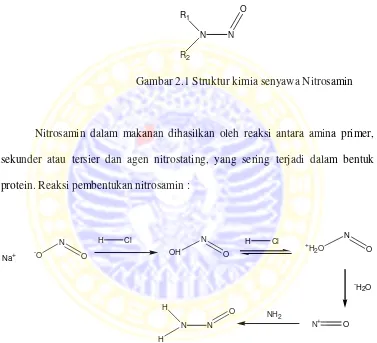
Nitrosamin adalah senyawa kimia yang mempunyai struktur kimia R1N(R 2)-N = O.
Gambar 2.1 Struktur kimia senyawa Nitrosamin
Nitrosamin dalam makanan dihasilkan oleh reaksi antara amina primer, sekunder atau tersier dan agen nitrostating, yang sering terjadi dalam bentuk protein. Reaksi pembentukan nitrosamin :
Gambar 2.2 reaksi pembentukan senyawa Nitrosamin
karsinogenik), N-nitrosodietilamin, dan N-nitrosodipropilamin (Prangdimurti dkk., 2007). Persamaan reaksi:
NO2- + 2H → NO+ + H2O (2.1)
R2NH + NO+→ R2N-NO + H+ (2.2)
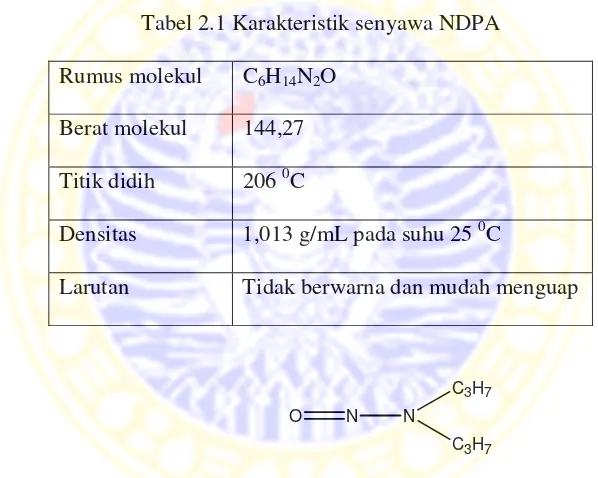
Salah satu senyawa turunan nitrosamin adalah nitrosodipropilamin (NDPA). Karakteristik senyawa NDPA dapat dilihat pada Tabel 2.1.
Tabel 2.1 Karakteristik senyawa NDPA Rumus molekul C6H14N2O
Berat molekul 144,27
Titik didih 206 0C
Densitas 1,013 g/mL pada suhu 25 0C
Larutan Tidak berwarna dan mudah menguap
N N
C3H7 C3H7 O
Gambar 2.3 Struktur senyawa nitrosodpropilamin Reaksi pembentukan senyawa NDPA dapat dilihat pada Gambar 2.4
NO2- + 2H+ NO
+ + H
2O
N C3H7
C3H7
H + NO+ N
C3H7
C3H7
N O + H+
2.3 Sosis
Daging merupakan semua jaringan hewan dan semua produk hasil pengolahan jaringan-jaringan tersebut yang sesuai untuk dimakan serta tidak menimbulkan gangguan kesehatan bagi yang memakannya (Soeparno, 1994). Komposisi daging terdiri dari 75% air, 19% protein, 3,5% substansi non protein yang larut, dan 2,5% lemak (Lawrie, 2003). Daging dapat dibagi dalam dua kelompok yaitu daging segar dan daging olahan. Daging segar ialah daging yang belum mengalami pengolahan dan dapat dijadikan bahan baku pengolahan pangan. Sedangkan daging olahan adalah daging yang diperoleh dari hasil pengolahan dengan metode tertentu dengan atau tanpa bahan tambahan, misalnya sosis, dendeng, daging burger dan daging olahan dalam kaleng dan sebagainya (Desroiser, 1988).
Kontaminasi bakteri dapat menyebabkan perubahan warna dan bau. Selama proses memasak, warna daging dapat mengalami perubahan dan kurang menarik. Warna daging segar adalah warna merah terang dari oksimioglobin, warna daging yang dimasak adalah warna coklat dari globin hemikromogen, warna daging yang ditambahkan nitrit adalah warna merah (Soeparno, 1994).
Komponen utama sosis terdiri dari daging, lemak, dan air. Selain itu, pada sosis juga ditambahkan bahan tambahan seperti garam, fosfat, pengawet (biasanya nitrit), pewarna, asam askorbat, isolat protein, dan karbohidrat. Dalam pembuatannya sosis ditambahkan pengawet nitrit yang akan bereaksi dengan protein yang terdapat dalam daging membentuk nitrosamin dalam suasana yang ekstrim (lingkungan asam dengan suhu tinggi). Sosis daging sapi dapat mengandung air sampai 60% (Soeparno, 1994). Menurut Standar Nasional Indonesia (SNI 01-3820-1995), sosis yang baik harus mengandung protein minimal 13%, lemak maksimal 25% dan karbohidrat maksimal 8%.
Sosis mengandung lemak, kolesterol dan natrium yang tinggi yang bisa mengganggu kesehatan, bahkan bisa menyebabkan kanker usus. Peneliti dari World Cancer Research Fund (WCRF) juga menegaskan bahwa 50 gram saja sosis yang dimakan setiap hari dapat meningkat penyakit kanker usus hingga 20%.
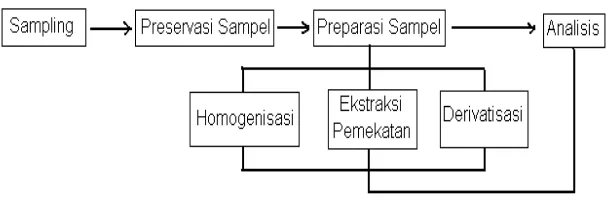
2.4 Teknik Analisis Sampel
Gambar 2.5 Skema Proses Analisis (Supriyanto, 2005). 2.4.1 Ekstraksi
Secara umum pengertian ekstraksi adalah proses penarikan suatu zat dengan pelarut yang sesuai. Tujuan dari ekstraksi adalah untuk pemisahan komponen-komponen yang terdapat dalam sampel. Pemisahan dipengaruhi oleh sifat kimia dan fisika analit, matriks sampel dan pelarut. Apabila komposisi matriks sampel dan pelarut konstan, maka derajat pemisahan dan persentase analit yang terekstrak juga konstan, karena pemisahan tidak tergantung pada konsentrasi analit. Ekstraksi merupakan metode pemisahan yang paling baik dan populer, alasan utamanya adalah bahwa pemisahan dengan metode ini dapat dilakukan baik dalam tingkat mikro maupun makro.
kelarutan zat maka makin sempurna proses pemisahan yang terjadi. Proses yang terjadi dalam ekstraksi pelarut atau LLE adalah distribusi solut.
Ekstraksi pelarut atau LLE mempunyai beberapa kelemahan diantaranya adalah timbulnya emulsi, tingginya konsumsi pelarut organik yang dibutuhkan, menghasilkan limbah pelarut organik dalam jumlah banyak serta proses ekstraksinya membutuhkan waktu yang lama. Oleh karena itu saat ini telah banyak dikembangkan teknik ekstraksi yang lebih menguntungkan seperti ekstraksi fasa padat (solid phase extraction) dan ekstraksi fasa padat mikro (solid phase microextraction) walaupun dalam prakteknya teknik baru tersebut masih sulit diterapkan untuk analisis rutin karena metode ini membutuhkan instrumen analisis yang canggih dan mahal, prosesnya rumit serta material yang digunakan tidak dapat didaur ulang (Supriyanto, 2005).
Berdasarkan kenyataan di atas maka pengembangan teknik ekstraksi cair-cair terus dilakukan dengan tujuan untuk menemukan teknik-teknik baru yang difokuskan pada pengurangan kebutuhan pelarut organik dan peningkatan selektivitas dan sensitivitas dalam proses analisisnya. Teknik-teknik baru tersebut salah satunya adalah teknik ekstraksi tetes mikro atau SDME.
2.4.2 Headspace-Single Drop Microextraction (HS-SDME)
target ke pelarut organik berlangsung sempurna (Liu et al., 1996). Faktor yang mempengaruhi efektivitas dari ekstraksi dalam SDME adalah waktu ekstraksi, ukuran tetesan, bentuk fisik dan kimia dari bahan pelarut, volume sampel, kecepatan pengadukan, suhu, dan kekuatan ion dari campuran (Wardencki et al., 2007). Teknik ini dibagi dalam dua jenis, yakni direct-SDME dan HS-SDME (Headspace-Single Drop Microextraction) (Pena-Pereira et al., 2010).
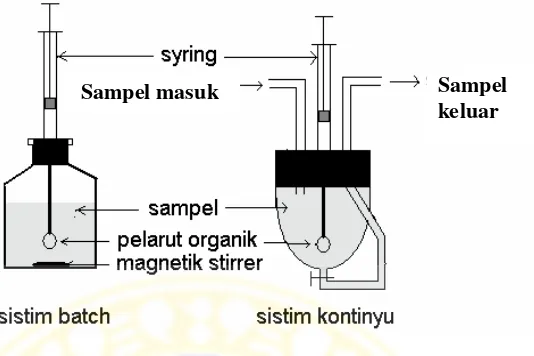
Ekstraksi senyawa target dengan teknik ini dapat dilakukan dengan dua cara yaitu sistem batch dan sistem kontinyu. Dalam sistem batch sejumlah volume pelarut organik di ujung syringe dimasukkan ke dalam sejumlah volume sampel. Kemudian larutan sampel diaduk terus-menerus dengan menggunakan pengaduk magnetik. Setelah ekstraksi senyawa organiknya, tetesan mikro tadi dihisap kembali sampai ke microsyringee dan disuntikkan secara langsung ke GC untuk dianalisis (Hashemi et al., 2011).
Sampel masuk Sampel
keluar
Gambar 2.6 Skema Ekstraksi Tetes Mikro ( Supriyanto, 2005 ).
Pemekatan senyawa target akan terjadi karena volume pelarut organik jauh lebih kecil dibandingkan dengan volume sampel. Derajat pemekatan teoritis didefinisikan sebagai perbandingan antara volume sampel dan volume pelarut organik. Transfer massa senyawa target dari larutan sampel ke pelarut organik dipengaruhi oleh beberapa faktor, antara lain jenis dan volume pelarut organik, kecepatan pengadukan, waktu pengadukan, penambahan garam, pH, suhu, dan volume larutan ekstrak.
2.5 Kromatografi Gas (GC)
Kromatografi gas (GC) adalah suatu jenis kromatografi yang digunakan dalam analisis kimia untuk memisahkan dan menganalisa campuran zat yang dilakukan antara fasa diam (cair) dan fasa geraknya (gas). GC dapat digunakan untuk mengidentifikasi senyawa kimia dengan sifat mudah diuapkan (Riccio et al., 2008). Pemisahan senyawa ini berdasarkan sifat-sifat penyerapan isi kolom untuk memisahkan komponen sampel yang berbentuk gas. Isi kolom yang biasa digunakan untuk keperluan ini adalah silica gel, saringan molekul dan arang. Sampel yang dianalisis dapat berbentuk gas, cair maupun padat, namun cair dan padat harus terlebih dahulu diubah menjadi bentuk gas dengan cara pemanasan.
20 BAB III
METODE PENELITIAN
3.1 Tempat dan Waktu Penelitian
Penelitian dilaksanakan di Laboratorium Kimia Analitik dan Laboratorium Instrumentasi Departemen Kimia, Fakultas Sains dan Teknologi Universitas Airlangga, Surabaya. Penelitian dilaksanakan mulai bulan Januari 2012 sampai dengan bulan Juni 2012.
3.2 Bahan dan Alat Penelitian 3.2.1 Bahan penelitian
Bahan-bahan yang digunakan pada penelitian ini antara lain metanol, larutan standar nitrosodipropilamin (NDPA 99%), pelarut organik (n-heksana, toluena, dan etil asetat) pro analisis (pa). Sampel yang akan digunakan pada penelitian ini adalah sosis mentah dengan tiga macam merek yakni A, B, dan C, yang dibeli dari pasar yang berada di kecamatan Buduran, desa Siwalanpanji, Sidoarjo.
3.2.2 Alat-alat penelitian
pengaduk, pengaduk magnetik merk Daihan Labtech Model LMS-1003 Serial No. 2010051312, dan alat gelas yang biasa digunakan di laboratorium.
3.3 Variabel Penelitian 3.3.1 Variabel bebas
Variabel bebas dalam penelitian ini adalah jenis pelarut organik (n-heksana, toluena, dan etil asetat), waktu ekstraksi (15, 30, 45, dan 60 menit), dan volume larutan ekstrak (10, 20 dan 30 mL).
3.3.2 Variabel terikat
Variabel terikat adalah luasan kromatogram GC. 3.3.3 Variabel terkontrol
3.4 Prosedur Penelitian 3.4.1 Diagram alir penelitian
Pembuatan Larutan Standar NDPA
Volume Larutan Ekstrak (mL) Jenis Pelarut
Organik
Optimasi Parameter Analitik
Analisis Sampel Penentuan Parameter
Validasi Pembuatan Kurva
Kalibrasi dengan menggunakan Parameter
yang telah di Optimasi Pembuatan Kurva
Standar NDPA
Waktu Ekstraksi (menit)
Analisis Data
Limit Deteksi (LOD)
Persen Recovery (%R)
Koefisien Variasi (%KV)
3.4.2 Headspace-single drop microextraction (HS-SDME)
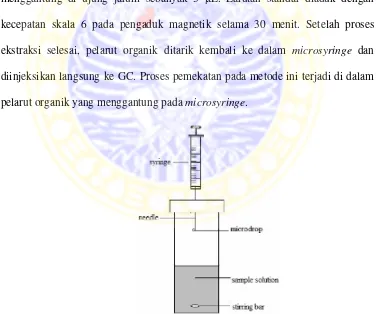
Pada penelitian ini digunakan 3 jenis pelarut organik untuk mengekstrak senyawa nitrosodipropilamin (NDPA) yaitu toluena, n-heksana, dan etil asetat. Sebanyak 20 mL larutan standar NDPA 50 ppm dimasukkan ke dalam botol yang sudah berisi batang pengaduk, kemudian ditutup dengan penutup karet. Microsyringe yang telah berisi pelarut organik (mis.toluena) sebanyak 3µL dimasukkan ke dalam botol secara tegak lurus hingga ujung syringe menggantung di atas larutan standar. Kemudian microsyringe ditekan sehingga pelarut organik menggantung di ujung jarum sebanyak 3 μL. Larutan standar diaduk dengan kecepatan skala 6 pada pengaduk magnetik selama 30 menit. Setelah proses ekstraksi selesai, pelarut organik ditarik kembali ke dalam microsyringe dan diinjeksikan langsung ke GC. Proses pemekatan pada metode ini terjadi di dalam pelarut organik yang menggantung pada microsyringe.
3.4.3 Pembuatan larutan induk NDPA 50 ppm
Larutan induk NDPA 50 ppm dibuat dengan cara melarutkan 25µL NDPA murni (100 mg; 99,99%; 0,5 mL) dalam metanol dan diencerkan pada labu ukur hingga 100 mL.
3.4.4 Pembuatan larutan standar NDPA 2 ppm; 4 ppm; 6 ppm; 8 ppm; dan 10 ppm
Larutan standar NDPA 6 ppm dibuat sebanyak 500 mL. Sebanyak 60 mL larutan induk NDPA 50 ppm dimasukkan ke dalam labu ukur 500 mL, kemudian ditambahkan metanol sampai tanda batas dan dihomogenkan. Untuk larutan standar 2 ppm; 4 ppm; 8 ppm; dan 10 ppm, masing-masing dibuat dari 0,4 mL; 0,8 mL; 1,6 mL; dan 2,0 mL larutan induk NDPA 50 ppm dimasukkan ke dalam labu ukur 10 mL, kemudian ditambahkan metanol sampai tanda batas. Larutan standar 6 ppm dibuat sebanyak 500 mL dikarenakan larutan ini akan digunakan untuk optimasi parameter-parameter analitik.
3.4.5 Pembuatan kurva kalibrasi tanpa HS-SDME
Sebanyak 5 jenis konsentrasi larutan standar NDPA masing-masing 2 ppm; 4 ppm; 6 ppm; 8 ppm; dan 10 ppm, yang dianalisis dengan cara diinjeksikan langsung ke GC, kemudian dibuat kurva kalibrasi antara luas area terhadap konsentrasi.
3.4.6 Optimasi parameter analitik 3.4.6.1 Optimasi jenis pelarut organik
ekstrak 20 mL, dan kecepatan pengadukan pada skala 6. Larutan hasil ekstraksi dianalisis dengan GC, kemudian dibuat suatu grafik antara luas area terhadap jenis pelarut organik.
3.4.6.2 Optimasi volume larutan ekstrak
Optimasi volume larutan ekstrak yaitu (10 mL; 20 mL; 30 mL; dan 40 mL). Sementara variabel lain dibuat tetap yakni volume pelarut organik 3 μL, waktu ekstraksi 30 menit, dan kecepatan pengadukan pada skala 6, sedangkan jenis pelarut organik sesuai dengan hasil optimasi pada prosedur 3.4.6.1. Prosedur ekstraksi seperti pada prosedur 3.4.2. Larutan hasil ekstraksi dianalisis dengan instrumen GC, kemudian dibuat suatu grafik antara luas puncak terhadap luas area.
3.4.6.3 Optimasi waktu ekstraksi
3.4.7 Pembuatan kurva kalibrasi menggunakan parameter HS-SDME yang telah di optimasi
Sebanyak 5 jenis konsentrasi larutan standar NDPA masing-masing 2 ppm; 4 ppm; 6 ppm; 8 ppm; dan 10 ppm, diekstraksi sesuai prosedur 3.4.2 dengan menggunakan parameter yang telah dioptimasi pada prosedur 3.4.6.1, 3.4.6.2, dan 3.4.6.3.
3.5 Validasi Parameter Analitik 3.5.1 Penentuan limit deteksi
Limit deteksi dapat ditentukan dari persamaan regresi yang diperoleh dari kurva kalibrasi larutan standar NDPA dengan menggunakan HS-SDME. Hal pertama yang dilakukan untuk menetukan LOD adalah dengan cara menghitung standar deviasi dari signal blanko (Sy/x), dengan persamaan:
Sy/x =
2 ˆ 2 ny y
(3.1)
dengan y merupakan besarnya luas area rata-rata dari masing-masing pengukuran,
ŷ merupakan nilai yang dihitung dari memasukkan konsentrasi sebenarnya dari
larutan standar NDPA sebagai nilai x, dan n merupakan jumlah larutan standar. Kemudian, hasil Sy/x dimasukkan ke dalam persamaan:
YLOD = Ybl + 3 Sbl (3.2)
Setelah itu, nilai YLOD yang diperoleh dimasukkan ke persamaan regresi kurva kalibrasi NDPA. Sehingga didapatkan suatu konsentrasi NDPA (x) terkecil dalam sampel yang masih dapat diukur atau terdeteksi dengan baik.
3.5.2 Penentuan persen recovery (R)
Persen recovery dihitung dari persamaan regresi yaang diperoleh dari kurva kalibrasi larutan standar setelah ekstraksi menggunakan HS-SDME. Luas area pada masing-masing konsentrasi dimasukkan sebagai nilai y pada persamaan regresi kurva kalibrasi untuk memperoleh nilai x. x merupakan nilai konsentrasi rata-rata hasil pengukuran. Kemudian nilai x dimasukkan kedalam persamaan :
%
x = Nilai (konsentrasi) rata-rata hasil pengukuran
μ = Nilai (konsentrasi) sebenarnya (standar)
Suatu pengukuran dikatakan akurat jika persen recovery mendekati 100% 3.5.3 Uji koefisien variasi
Nilai koefisien variasi didapatkan dengan beberapa tahapan. Pertama-tama dilakukan perhitungan terhadap standar deviasi menggunakan persamaan:
1
konsentrasi, dan n merupakan jumlah pengulangan (replication). Setelah itu menentukan nilai %KV untuk masing-masing konsentrasi dengan persamaan:
% 100
_ x
x SD
KV (3.5)
Suatu pengukuran dikatakan memberikan presisi yang baik jika %KV < 3%. 3.5.4 Perhitungan enrichment factor
Terdapat 2 (dua) rumus yang digunakan untuk menentukan seberapa besar derajat pemekatan selama proses ekstraksi analit sampel ke pelarut organik. Theoretecal enrichment factor merupakan nilai atau besaran yang menyatakan besarnya pemekatan yang terjadi selama proses ekstraksi analit dari sampel ke pelarut organik secara teoritis dan dirumuskan sebagai berikut,
e s th
V V
EF (3.6)
dengan Vs merupakan volume larutan ekstrak, Ve merupakan Volume pelarut organik.
Namun seberapa besar pemekatan yang terjadi selama proses ekstraksi analit dari sampel ke pelarut organik dirumuskan dengan true enrichment factor (EFtr) yang merupakan perkalian theoretecal enrichment factor dengan recovery;
EFtr = EFth x R (3.7)
3.6 Preparasi Sampel dan Penyimpanan Sampel
didiamkan selama ± 2 jam, selanjutnya filtrat yang diperoleh dimasukkan ke dalam labu ukur 100 mL dan ditambahkan metanol hingga tanda batas. Setelah itu larutan disaring menggunakan kertas saring.
Larutan sampel yang jernih dimasukkan dalam botol gelas coklat terbungkus kertas aluminium foil dan disimpan pada tempat yang gelap, pada suhu kamar. Hal ini di karenakan senyawa nitrosamin mudah terdegradasi menjadi senyawa turunannya yang bersifat toksik.
3.7 Analisis Sampel
Sejumlah larutan sampel sesuai dengan hasil optimasi pada 3.4.6.2 diekstraksi dengan menggunakan parameter-parameter analitik yang telah dioptimasi. Hasil ekstraksi dianalisis dengan menggunakan GC. Kadar senyawa nitrisodipropilamin (NDPA) dapat dihitung menggunakan persamaan regresi linier yang diperoleh dari kurva kalibrasi larutan standar setelah ekstraksi menggunakan teknik HS-SDME.
3.8 Penentuan Persen Recovery Pada Analisis Sampel
yang kemudian dimasukkan ke persamaan kurva kalibrasi NDPA menggunakan ekstraksi HS-SDME hasil optimasi sebagai sumbu y dan akan dihasilkan konsentrasi sesungguhnya sebagai sumbu x, yang selanjutnya ditentukan %recovery sampel dengan persamaan:
% 100%
] [
] [
] [
x Analit
Sampel Spiking
BAB IV
HASIL DAN PEMBAHASAN
4.1 Penentuan Kondisi Optimum Instrumen Gas Chromatography (GC) Untuk Senyawa NDPA
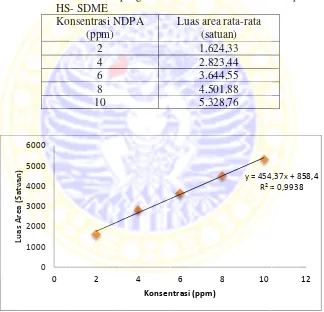
0,993, hal ini menunjukkan terdapat korelasi antara konsentrasi NDPA dengan luas area kromatogram yang dihasilkan. Semakin besar konsentrasi larutan standar NDPA semakin besar luas area kromatogram yang dihasilkan,.
Berdasarkan data di atas diperoleh reprodusibilitas dengan rentang 0,15% sampai dengan 6,7%, empat dari lima data konsentrasi larutan standar memiliki nilai KV<3%, sedangkan untuk persen recovery diperoleh rentang 84,5% sampai dengan 108 % dan untuk LOD diperoleh sebesar 0,86 ppm sehingga dapat dikatakan bahwa presisi yang dihasilkan oleh instrumen GC baik untuk digunakan dalam analisis senyawa NDPA.
4.3 Optimasi Parameter – Parameter Analitik
Optimasi Parameter analitik digunakan untuk mendapatkan hasil optimum pada analisis NDPA dengan teknik ekstraksi HS-SDME menggunakan GC-FID. Penentuan kondisi-kondisi optimum pada proses analisis pada penelitian ini antara lain jenis pelarut organik, volume larutan ekstrak dan waktu ekstraksi.
4.3.1 Optimasi jenis pelarut organik
Batle dan Nerin, 2004). Oleh karena itu pelarut organik yang digunakan untuk ekstraksi perlu dioptimasi.
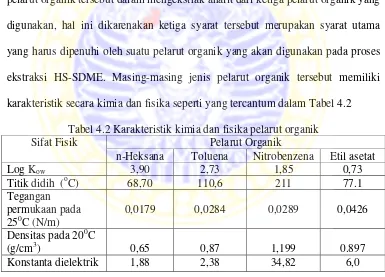
Pelarut organik yang digunakan dalam analisis NDPA dengan proses ekstraksi HS-SDME terdapat tiga jenis pelarut organik yaitu toluena, etil asetat dan n-heksana. Pemilihan ketiga jenis pelarut ini dipengaruhi oleh beberapa sifat fisik yang dimiliki oleh pelarut organik tersebut diantaranya titik didih, densitas, dan tegangan permukaan. Selain itu dipertimbangkan juga mengenai selektivitas seperti pada prinsip like disolve like , kestabilan tetes pelarut organik, dan efisiensi pelarut organik tersebut dalam mengekstrak analit dari ketiga pelarut organik yang digunakan, hal ini dikarenakan ketiga syarat tersebut merupakan syarat utama yang harus dipenuhi oleh suatu pelarut organik yang akan digunakan pada proses ekstraksi HS-SDME. Masing-masing jenis pelarut organik tersebut memiliki karakteristik secara kimia dan fisika seperti yang tercantum dalam Tabel 4.2
Tabel 4.2 Karakteristik kimia dan fisika pelarut organik
Sifat Fisik Pelarut Organik
n-Heksana Toluena Nitrobenzena Etil asetat
Log Kow 3,90 2,73 1,85 0,73
Titik didih (oC) 68,70 110,6 211 77.1
Tegangan permukaan pada 250C (N/m)
0,0179 0,0284 0,0289 0,0426
Densitas pada 200C
(g/cm3) 0,65 0,87 1,199 0.897
Konstanta dielektrik 1,88 2,38 34,82 6,0
berpengaruh pada selektivitas pelarut organik. Semakin besar konstanta dielektrik suatu pelarut organik maka interaksi Coulomb yang terjadi di dalam larutan semakin kecil, sehingga pelarut organik tersebut cenderung melarutkan senyawa dalam bentuk ion (zarah bebas) (Widati, 2006). Dalam ilmu kimia konstanta dielektrik dapat dijadikan pengukur relatif dari kepolaran suatu pelarut. Kepolaran suatu pelarut juga dapat dilihat dari momen dipol yang dimiliki oleh pelarut tersebut. Momen dipol dapat dilihat pada struktur kimia dari suatu pelarut organik, jika suatu pelarut mengandung atom-atom dari unsur yang berbeda biasanya merupakan pelarut polar dan memiliki momen dipol yang tinggi, sedangkan pelarut organik yang mengandung atom-atom dari unsur yang sama memiliki momen dipol nol atau sangat kecil dan merupakan pelarut non polar. Momen dipol toluena adalah sebesar 0,31 D, sedangkan momen dipol n-heksana dan etil asetat sebesar 0,08 D dan 1,88 D.
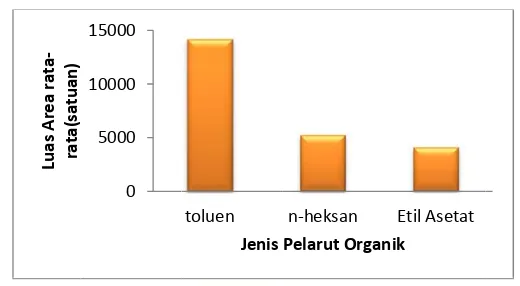
Pada optimasi jenis pelarut organik, kondisi dibuat tetap dengan konsentrasi NDPA dengan konsentrasi 6 ppm, kecepatan pengadukan pada skala 6, volume larutan ekstrak 20 mL, volume pelarut organik 3 μL, dan waktu ekstraksi selama 30 menit. Pengukuran luas area pada masing-masing jenis pelarut organik dilakukan sebanyak tiga kali pengulangan. Data hasil ekstraksi terhadap tiga jenis pelarut organik dapat dilihat pada Tabel 4.3 dan diagram yang dihasilkan dari data optimasi pelarut organik dapat dilihat pada Gambar 4.3.
Tabel 4.3. Data luas area tiga jenis pelarut organik Pelarut organik Luas area rata-rata (satuan)
Toluena 14.220,66 n-heksana 5.280,22
toluena digunakan untuk proses optimasi parameter yang lain dalam penentuan senyawa NDPA.
Pelarut organik n-heksana dan etil asetat meiliki luas area lebih kecil bila dibandingkan dengan toluena. Titik didih n-heksan (68,70oC) dan etil asetat (77.1oC) yang kecil menyebabkan kedua pelarut organik tersebut mudah menguap sehingga NDPA yang terekstrak kedalam n-heksan dan etil asetat kurang optimum. Pelarut organik nitrobenzena tidak memberikan hasil, hal ini dikarenakan titik didih nitrobenzena yang tinggi (2110C) sehingga menyebabkan puncak nitrobenzena yang muncul menutupi peak NDPA yang muncul pada menit ke 8-9. Nitrobenzena memiliki drop yang tidak stabil, sehingga drop mudah jatuh pada proses ekstraksi.
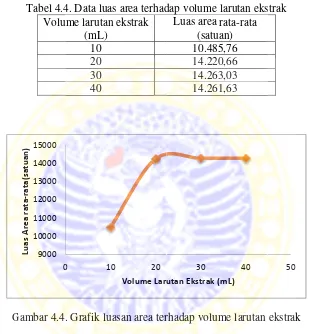
4.3.2 Optimasi volume larutan ekstrak
Pengamatan selama eksperimen menunjukkan bahwa jika volume larutan ekstrak terlalu sedikit maka analit yang terekstrak juga lebih sedikit. Sedangkan volume larutan terlalu banyak maka senyawa yang terekstrak tetap (sama) dengan volume larutan ekstrak yang optimum. Hasil ini sesuai dengan penelitian yang dilakukan oleh Lu Wang et al., (2009) dimana digunakan larutan sebanyak 20 mL dalam proses ekstraksi menggunakan metode HS-SDME-GC-MS.
Volume larutan ekstrak sebanyak 10 mL didapatkan %R sebesar 10% sedangkan untuk volume larutan ekstrak 20 mL didapatkan %R sebesar 98,33%. Hal ini berarti bahwa perolehan kembali NDPA dalam larutan menggunakan volume pelarut organik 20 mL hampir mencapai nilai 100% sehingga diduga bahwa jumlah NDPA yang terekstrak dengan menggunakan volume larutan ekstrak 30 dan 40 mL tidak jauh berbeda dengan volume larutan ekstrak 20 mL. Patel et al., (2010) menyatakan bahwa semakin banyak volume larutan ekstrak akan membutuhkan waktu ekstraksi yang lebih lama, sehingga diperlukan volume minimum untuk memaksimalkan efisiensi ekstraksi. Sedangkan Hashemi et al., (2010) menyatakan bahwa pada volume sampel yang besar, kelarutan dari analit meningkat dan koefisien partisi antara sampel dengan drop berkurang serta efisiensi ekstraksi menurun. Oleh karena itu volume larutan ekstrak 20 mL digunakan untuk optimasi parameter dan analisis selanjutnya.
4.3.3 Optimasi waktu ekstraksi
yang diekstrak. Penelitian optimasi waktu ekstraksi penting dilakukan karena waktu ekstrasi mungkin bervariasi pada bahan yang berbeda. Waktu ekstraksi dipengaruhi oleh nilai dielektrik pelarut. Optimasi waktu ekstraksi dapat menaikkan efisiensi ekstraksi dari analit target ke pelarut organik (Hashemi et al., 2011dan Wardencki et al., 2006).
Prosedur optimasi waktu ekstraksi sama dengan prosedur optimasi pada jenis pelarut organik dan prosedur optimasi volume larutan ekstrak. Parameter yang dibuat tetap pada optimasi waktu ekstraksi antara lain konsentrasi larutan NDPA 6 ppm, volume tetesan pelarut organik (toluena) 3 μL, volume larutan ekstrak 20 mL, kecepatan pengadukan skala 6. Pengaruh waktu ekstraksi terhadap hasil ekstraksi menggunakan HS-SDME dapat dilihat pada Tabel 4.5, sedangkan untuk kurva luasan area terhadap waktu ekstraksi dapat dilihat pada Gambar 4.5.
Tabel 4.5. Data luas area terhadap waktu ekstraksi
Gambar 4.5. Grafik luas area terhadap waktu ekstraksi
0 5000 10000 15000 20000
0 20 40 60 80
Luas A
rea
rata-rata
(satuan)
Waktu Ekstraksi (menit)
Waktu ekstraksi (menit)
Luas area rata-rata (satuan)
Berdasarkan data yang diperoleh pada Tabel 4.5 dan Gambar 4.5 menunjukkan bahwa semakin lama waktu ekstraksi menyebabkan semakin kecil area yang diperoleh. Dengan semakin lamanya waktu ekstraksi menyebabkan analit yang terekstrak akan kembali menguap. Waktu ekstraksi berkorelasi positif dengan jumlah analit yang terdistribusi ke dalam pelarut organik. Pada umumnya, transfer massa merupakan proses yang bergantung pada waktu dan laju rata-rata. Pada beberapa kasus, kenaikan waktu kontak dapat menyebabkan volume drop pelarut organik bertambah secara signifikan, hal ini dikarenakan pelarut menyerap analit. Apabila pelarut merupakan senyawa yang hidrofilik, maka pelarut juga dapat menyerap air. Selain itu, semakin lama waktu ekstraksi, drop pelarut organik dapat jatuh, hal ini dikarenakan oleh pengaruh gaya gravitasi (Wardencki et al., 2006).
Kondisi optimum yang dipilih untuk waktu ekstraksi adalah 30 menit. Ini dikarenakan luas area yang lebih besar dibandingkan waktu ekstraksi 15, 45 dan 60 menit. Hal ini menunjukkan bahwa analit optimum terekstrak pada waktu ekstraksi 30 menit. Oleh karena itu, waktu ekstraksi 30 menit digunakan untuk pembuatan kurva kalibrasi NDPA dengan parameter-parameter yang telah dioptimasi
4.4 Kurva Kalibrasi NDPA dengan Parameter Hasil Optimasi
Berdasarkan kurva kalibrasi larutan standar NDPA menggunakan HS-SDME pada kondisi optimum diperoleh persamaan regresi sebesar y = 704,0x + 10063 dengan r2 sebesar 0,999. Data kalibrasi larutan standar NDPA menggunakan HS-SDME pada kondisi optimum jika dibandingkan dengan data kurva standar NDPA tanpa ekstraksi menunjukkan bahwa pemekatan terjadi pada penentuan NDPA menggunakan HS-SDME. Besarnya pemekatan yang terjadi akan dibahas pada 4.5.4.
Persamaan regresi larutan standar NDPA hasil optimasi ini selanjutnya digunakan untuk menentukan konsentrasi NDPA dalam sampel, menentukan % recovery (akurasi), presisi, enrichment factor dan juga digunakan untuk menentukan limit deteksi (LOD) dari instrumen dan metode analisis yang digunakan.
4.5 Penentuan Parameter-Parameter Validasi
Penentuan parameter-parameter validasi adalah suatu proses penilaian terhadap metode analisis tertentu berdasarkan percobaan laboratorium untuk membuktikan bahwa metode tersebut memenuhi persyaratan untuk digunakan (Harmita, 2004). Persamaan regresi linier kurva kalibrasi NDPA dengan ekstraksi HS-SDME digunakan untuk menentukan konsentrasi NDPA dalam sampel, menentukan % recovery, koefisien variasi dan limit deteksi (LOD) dari instrumen.
4.5.1 Penentuan limit deteksi
dalam limit deteksi (LOD). Limit deteksi atau batas deteksi merupakan salah satu parameter proses validasi yang menyatakan kesensitivitasan suatu instrumen dan metode analisis. Limit deteksi menyatakan besarnya kadar analit terkecil dalam matriks sampel yang masih dapat diukur (dideteksi) oleh instrumen atau metode analisis dengan baik. Suatu metode analisis atau instrumen dapat dikatakan baik jika dapat mengukur analit pada konsentrasi yang kecil sehingga semakin kecil kadar analit yang dapat diukur maka semakin baik suatu metode pengukuran atau instrumen yang digunakan.
Berdasarkan persamaan kurva kalibrasi larutan standar NDPA tanpa menggunakan ekstraksi HS-SDME, nilai limit deteksi instrumen sebesar 0,86 ppm. Sedangkan dari persamaan kurva kalibrasi larutan satandar NDPA menggunakan hasil optimasi parameter-parameter ekstraksi HS-SDME, nilai limit deteksi untuk GC-FID menggunakan HS-SDME sebesar 0,078 ppm. Sehingga, dengan membandingkan nilai limit deteksi pengukuran NDPA tanpa dan dengan menggunakan HS-SDME menunjukkan bahwa metode HS-SDME mampu meningkatkan sensitivitas alat GC-FID untuk memberikan respon terhadap adanya analit.
4.5.2 Persen recovery (R)
Banyaknya analit yang terekstrak dapat diketahui dari persen recovery (%R). Persen recovery dapat juga digunakan untuk mengetahui ada tidaknya pengaruh matriks lingkungan yang mempengaruhi pengukuran. Berdasarkan data yang diperoleh dari kurva standar NDPA sebelum ekstraksi recovery yang didapatkan berkisar antara 84,5% sampai 108%, sedangkan recovery yang didapatkan dari data kurva standar setelah ekstraksi berkisar antara 99% sampai 100,65%. Hal ini berarti bahwa perolehan kembali NDPA sebagai analit dengan menggunakan teknik ekstraksi HS-SDME mendekati kedekatan konsentrasi NDPA yang sebenarnya, atau dapat dikatakan metode HS-SDME ini mampu memiliki ketepatan atau akurasi yang baik. Nilai dari persen recovery yang melebihi 100% menunjukkan adanya senyawa lain yang memberikan sinyal yang sama pada waktu retensi NDPA.
Tabel 4.7 Data persen recovery larutan standar NDPA Konsentrasi (ppm) recovery (%)
2 100,6 4 99,5 6 99 8 100,3 10 99,9 Rata-rata 99,9
apabila rentang nilai %recovery untuk larutan dengan konsentrasi diatas 1 ppm berkisar 90-107% (Harmita, 2004).
4.5.3 Ketelitian (presisi)
Presisi atau ketelitian menyatakan derajat kedapatulangan (reproducibility) yakni besarnya kesesuaian atau penyimpangan dari suatu atau setiap nilai hasil pengukuran yang dilakukan berulang-ulang pada sampel yang sama. Presisi dinyatakan dengan nilai simpangan baku (standar deviasi) dan koefisien variasi dari hasil pengukuran yang berulang-ulang. Koefisien variasi digunakan untuk melihat reprodusibilitas instrumen. Suatu metode dapat dikatakan mempunyai ketelitian atau presisi yang baik jika nilai koefisien variasi (KV<3%) (Miller et al., 1988). Nilai KV dari 5 macam larutan standar dapat dilihat pada Tabel 4.8.
Tabel 4.8 Data KV larutan standar NDPA
Konsentrasi (ppm) KV (%)
2 0,02 4 0,05 6 1,29 8 0,04 10 0,005
tanpa menggunakan HS-SDME sehingga metode HS-SDME yang digunakan adalah baik karena koefisien variasinya kurang dari 3%.
4.5.4 Enrichment factor
Enrichment factor merupakan faktor besarnya pemekatan yang terjadi selama proses ekstraksi menggunakan HS-SDME. Pemekatan analit yang terjadi dapat dilihat pada perbandingan kurva larutan standar NDPA sebelum dan sesudah ekstraksi menggunakan HS-SDME yang ditunjukkan pada Gambar 4.7.
Gambar 4.7 Kurva Pemekatan NDPA menggunakan ekstraksi HS-SDME
Terdapat 2 (dua) rumus yang digunakan untuk menentukan seberapa besar derajat pemekatan selama proses ekstraksi analit dari sampel ke pelarut organik. Theoretical enrichment factor merupakan nilai atau besaran yang menyatakan berapa besarnya pemekatan yang terjadi selama proses ekstraksi analit dari sampel ke pelarut organik secara teoritis. Namun seberapa besar pemekatan sebenarnya yang terjadi selama proses ekstraksi analit dari sampel ke pelarut organik dirumuskan dengan true enrichment factor (EFtr) yang merupakan perkalian
theoretical enrichment factor dengan recovery. Setelah dilakukan perhitungan, hasil EFth sebesar 6.666,66. Maksudnya adalah secara teoritis, pemekatan yang terjadi selama proses ekstraksi adalah 6.666,66 kali. Sehingga konsentrasinya lebih pekat 6.666,66 kali dari konsentrasi mula-mula. Sedangkan pemekatan sebenarnya (setelah mengalami perhitungan rumus EFtr), dihasilkan pemekatan 6.658,66 kali dari konsentrasi mula-mula. Jadi dapat disimpulkan bahwa dalam proses ekstraksi HS-SDME, pemekatan yang terjadi selama ekstraksi hampir sama dengan pemekatan yang seharusnya terjadi (theoretical enrichment factor) yakni 6.666,66 kali. Dengan kata lain, pemekatan pada metode HS-SDME sangat baik.
4.6 Sampling, Penyimpanan Sampel dan Preparasi Sampel
Setelah semua parameter untuk metode HS-SDME teroptimasi, langkah selanjutnya adalah mengaplikasikan metode analisis untuk penentuan senyawa NDPA pada sampel. Sampel yang digunakan pada penelitian ini adalah sampel yang diambil dari pasar yang berada di sekitar desa Siwalanpanji, kecamatan Buduran, kabupaten Sidoarjo.
lebih lanjut. Ketiga sampel yang telah di peroleh di hancurkan menggunakan mortar setelah itu ditimbang sebanyak 50 gram untuk masing-masing sampel. Kemudian sampel yang telah dihancurkan tadi di rendam dalam 50 mL metanol, dan didiamkan selama ± 2 jam. Filtrat yang diperoleh kemudian dimasukkan ke dalam labu ukur 100 mL dan di tambahkan metanol sampai tanda batas. Selanjutnya larutan sampel disaring menggunakan kertas saring. Ini dilakukan sampai filtrat yang diperoleh jernih.
Hal yang dilakukan selanjutnya adalah penyimpanan sampel. Penyimpanan larutan sampel dilakukan dengan cara memasukkan larutan yang berada di labu ukur tersebut kedalam botol coklat yang kemudian ditutup rapat dengan menggunakan aluminium foil, disimpan pada tempat yang gelap pada suhu kamar, pada keadaan basa atau netral, dan maksimal penyimpanan 14 hari. Penyimpanan sampel ini dilakukan agar senyawa yang diinginkan (analit) yang berada dalam sampel tidak rusak atau terdegradasi oleh mikroba dalam sampel (Report Carsinogens National Toxicology Program Department of Health and Human Services, 2011).
4.7 Analisis Sampel
ekstraksi 30 menit, dan volume pelarut organik (toluena) 3 μL. Hasil analisis dari tiga sampel dapat dilihat pada Tabel 4.9.
Tabel 4.9 Data luas area sampel Sampel Luas area rata-rata
(satuan)
A 10.519,42 B 11.129,86 C 11.040,58
Konsentrasi NDPA dalam ketiga sampel tersebut dapat diketahui dengan cara memasukkan luas area rata-rata yang dihasilkan ke persamaan kurva kalibrasi larutan standar NDPA menggunakan HS-SDME sebagai sumbu y. Persamaan kurva kalibrasi standar NDPA menggunakan HS-SDME adalah y = 704,0x + 10063. Setelah proses perhitungan dengan memasukkan luas area yang dihasilkan dari masing sampel didapatkan bahwa konsentrasi NDPA pada masing-masing sampel bernilai positif yang berarti pada masing-masing-masing-masing sampel terdeteksi adanya senyawa NDPA. Hal ini dapat disimpulkan bahwa instrumen dan metode analisis yang digunakan pada penelitian ini mampu mendeteksi senyawa NDPA pada sampel. Konsentrasi NDPA pada masing-masing sampel dapat dilihat pada Tabel 4.10.
Tabel 4.10 Data konsentrasi NDPA pada sampel
Sampel Konsentrasi (ppm)
4.8 Persen Recovery (R) Sampel
Spiking sampel merupakan salah satu cara yang digunakan untuk mengetahui pengaruh matrik dalam lingkungan terhadap suatu metode analisis. Spiking pada sampel bertujuan untuk membantu meningkatkan sinyal analisis konsentrasi analit yang terlalu kecil. Spiking juga merupakan suatu cara untuk memastikan senyawa target yang terdeteksi pada saat analisis menggunakan GC-FID merupakan analit yang diinginkan. Metode spiking ini dilakukan dengan cara menambahkan larutan standar dengan konsentrasi yang sudah diketahui ke dalam sampel. Dalam penelitian ini, spiking dilakukan dengan cara menambahkan larutan standar NDPA sehingga dalam sampel tersebut mengandung NDPA dengan konsentrasi 2 ppm. Sampel yang telah di tambahkan larutan standar kemudian diekstraksi dengan metode HS-SDME dan dianalisis dengan GC. Parameter yang dibuat tetap pada tahap ini adalah volume sampel 20 mL, volume pelarut organik yakni toluena sebanyak 3 μL, kecepatan pengadukan skala 6, dan waktu pengadukan 30 menit. Hasil analisis spiking untuk ketiga sampel dapat dilihat pada Tabel 4.11.
Tabel 4.11 Data spiking sampel
Sampel Luas area rata-rata (satuan)
Konsentrasi ppm
A 11.853,22 2,54
B 12.442,07 3,38
C 12.320,93 3,2
dikatakan bahwa matrik lingkungan tidak berpengaruh terhadap metode analisis, begitu juga sebaliknya apabila recovery-nya lebih besar dari 100% dapat dikatakan matrik lingkungan berpengaruh terhadap metode analisis. Hasil recovery untuk masing-masing konsentrasi setiap sampel dapat dilihat pada Tabel 4.12.
Tabel 4.12 Data persen recovery spiking sampel
Sampel Recovery (%)
A 95,1 B 94 C 91
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Berdasarkan penelitian yang telah dilakukan dapat ditarik kesimpulan sebagai berikut :
1. Senyawa nitrosodipropilamin (NDPA) dapat diekstraksi dengan menggunakan teknik HS-SDME dengan instrumen GC-FID.
2. Hasil optimasi parameter-parameter analitik yang digunakan pada analisis senyawa NDPA menggunakan teknik HS-SDME-GC-FID adalah menggunakan jenis pelarut organik toluena, dengan waktu ekstraksi 30 menit, dan volume larutan ekstrak 20 mL.
3. Hasil optimasi tersebut dapat digunakan sebagai parameter untuk ekstraksi senyawa NDPA dalam sampel sosis mentah. Konsentrasi NDPA pada sampel sosis A sebesar 0,64 ppm, pada sampel sosis B sebesar 1,5 ppm, dan pada sampel sosis C sebesar 1,38 ppm.
5.2 Saran
55
DAFTAR PUSTAKA
Andrade, R., Reyes, F. G. R., Rath, S., 2004, A method for The Determination of Volatile N-Nitrosamines in Food by HS-SPME-GC-TEA, J. of Food Chem, Vol.91: 173-179
Argonne National Laboratory, EVS., 2005, Nitrates and Nitrites. Human Health
Fact Sheet, Available from: http://www.epa.gov/ogwgdw/dwh/cioc/nitrates.html Access on:
November, 22, 2011
Batlle, R., dan Nerin, C., 2004, Application of Single-drop Microextraction to the Determination of Dialkyl Phthalate Ester in Food Simulants, J. of Chrom A, Vol. 1045 : 29-35
Belitz, H.D., dan Grosch, W., 1999, Food Chemistry,Translation from the Fourth German Edition by M.M. Burghagen, D. Hadziyev, P. Hessel, S. Jordan and C. Sprinz.
Biswas, R.K., dan Hayat, M.A., 2002, Kinetics of Solvent Extraction of Zirconium (IV) from Chloride Medium by D2EHPA in Kerosene Using the Single Drop Technique, J. of Hydromet, Vol. 65 : 205-216 Cassens, R. G. 1997. Residual nitrite in cured meat, J. of Food Technology,51,
53–55.
Demeestere, K., Dewulf, J., Witte, B, D., langenhove, H, V., 2007, Sample Preparation for The Analysis of Volatile Organic Compunds in Air and Water Matrices, J. of Chrom A, Vol. 1153: 130-144
Desroiser, N. W., 1988, Teknologi Pengawetan Pangan, Terjemahan oleh Muljoharjo, UI-Press, Jakarta.
Filho, P.J.S., Rios, A., Valcárcel, M., Zanin, K.D., Caramão, E.B., 2003, Development of a New Method for The Determination of Nitrosamines by Miceller Electrokinetic Capillary Chromatography, Water Research, 37: 3837-3842
Gloria, M., Beatriz, A., Vale Silvana, R., Vargas Octacı ´lio, L., Barbour James, F., & Scanlan Richard, A. 1997, Influence Of Nitrate Levels Added To Cheesemilk On Nitrate, Nitrite And Volatile Nitrosamine Contents In Gruyere Cheese, J. of Agricult and Food Chem, 45, 3577–3579.
Hashemi, M., Habibi, A., Jahanshahi, N., 2011, Determination of Cyclamate in Artificial Sweeteners and Beverages Using Headspace Single-Drop Microextraction and Gas Chromatography Flame-Ionisation Detection, J. of Food Chemistry, Vol.124: 1258-1263
Husni, E., Samah, A., dan Ariati, R., 2007, Analisa Zat Pengawet dan Protein dalam Makanan Siap Saji Sosis, Jurnal Sains dan Teknologi Farmasi, Vol. 12: 108-111
Ikeda. K. K.G. Migliorese, 1990. J. Soc. Chem. Vol. 41, 283.
Lawrie, R.A 2003, Ilmu Daging, Penerbit Universitas Indonesia, Jakarta.
Incavo, J, A., dan Schafer, M, A., 2006, Simplified Method for The determination of N-nitrosamines in Rubber Vulcanizates, J. of Anal Chim. Acta, Vol. 557: 256-261
Jurado- Sánchez, B., ballesteros, E., Gallego, M., 2007, Comparison of The Sensitivities of Seven N-nitrosamines in Pre-screened Waters Using Automated Preconcentration System and Gas Chromatography with Different detectors, J. of Chrom A, Vol. 1154: 66-73
Jurado- Sánchez, B., ballesteros, E., Gallego, M., 2009, Comparison of several solid-phase extraction sorbents for continuous determination of amines in water by gas chromatography–mass spectrometry, Talanta Vol. 79: 613–620
Lovelock J. E., 1960, Gas Chromatography 1960 , (Ed. R. P. W. Scott), Butterworths, London.
Khopkar, 1990, Konsep Dasar Kimia Analitik. UI Press, Jakarta.
Li, Ning., Deng, Chunhui., Yin, Xinying., Yao, Ning., Shen., Xizhong., Zhang, Xiangmin., 2005, Gas Chromatography-mass Spectrometric Analaysis of Hexanal and Heptanal in Human Blood by Headspace Single-drop Microextraction with Droplet Derivatization, J. of Anal Biochem
Liu, Hangui., Dasgupta, Pumenda K., 1996, Analytical Chemistry in Drop Solvent Extraction in Microdrop, J. of Anal Chem, Vol.68: 1817-1821 Lopez-Blanco, M.C., Blanco-Cid, S., Cancho-Grande, B., Simal-Gandara, J.,
45-252
Marco, A., Navarro, J, S., Flores, M., 2006, The Influence of Nitrite and Nitrate on Microbal, Chemical and Sensory Parameters of Slow Dry Fermented Sausage, J. of Meat Science, Vol.73: 660-673
Miller, J.C., dan Miller, J.N., 1988, Statistics for Analytical Chemistry Second Edition, Elllis Horwood Limited, England
Mitacek, E. J., Brunnemann, D., Suttajit, M., Martin, N., Limsila, T., Ohshima, H., dan Caplan, L. S., 1999, Exposure To N-Nitroso Compounds In A Population Of High Liver Cancer Regions In Thailand: volatile nitrosamine (VNA) levels in Thai food. J. of Food and Chem Toxic, 37, 297–305.
Ozel, M, Z., Gogus, F., Yagci, S., Hamilton, J, F., Lewis, A, C., 2010, Determination of Volatile Nitrosamines in Various meat Products Using Comprehensive Gas Chromatography-Nitrogen Chemiluminescence Detection, J. of Food and Chem Tech, Vol.48: 3268-3273
Patel, K., Mehta, P., Sahoo, U., Sen, A, K., B, Dhanya., 2010, A Single Drop Micro Extraction and Future Trends, International J. of ChemTech Research, Vol. 2: 1638-1652
Pena-Pereira, Francicso., Lavilla, Isela., Bendicho, Carlos., 2010, Colorimetric Assay for Determination of Trimethylamine-Nitrogen (TMA-N) in Fish by Combining Headspace-Single-Drop Microextraction and Microvolume UV-Vis Spectrophotometry, J. of Food Chemistry, Vol.119: 402-407
Prangdimurti, E. Zakaria, F, R. dan Palupi, N, S., 2007, Toksikan yang Terbentuk Karena Pengolahan Pangan, Modul e-learning ENBP topik 7, Departemen Ilmu dan Teknologi Pangan IPB, Bogor
Psilakis, E., Kalogerakis, N. 2002, Developments in single-drop microextraction, J. of trends in anal chem, vol. 21, no. 1.
Riccio, D., Wood, D.C., Miller, J.M., 2008, Using Single Drop Microextraction for Headspace Analysis with Gas Chromatography, J. of Chem Edu, 85(7), 965-968
Rywotycki, R. 2003, Meat nitrosamine contamination level depending on animal breeding factors. J. of Meat Science, 65, 669–676.
Scanlan, R. A. 2003, Nitrosamines. In Benjamin Caballero, C. Trugo Luiz, & Paul Finglas (Eds.), Encyclopedia of food sciences and nutrition (2nd ed.). Oxford: Elsevier Science Ltd.
Shah, K, A., Halquist, M, S., Karnes, H, T., 2009, A Modified Method for The Determination of Tobacco Specific Nitrosamine 4-(methylnitrosamino)-1-(3-pyridyl)-1-butanol in Human Urine by Solid Phase Extraction using a Molecularly Imprinted Polymer and Liquid Chromatography Tandem Mass Spectrometry, J. of Chromatography B, Vol.877: 1575-1582
Skoog, Douglas A., F. James Holler, & Stanley R. Crouch, 2007, Principles of Instrumental Analysis. 6th Edition. United States: Thomson Brooks/Cole.
Soeparno, 1994, Ilmu dan Teknologi Daging. Gajah mada University. Yogyakarta. Supriyanto, G., 2005, Chromatomembrane Methode Applied in Pharmaceuticals
Analysis, Logus Verlag, Berlin
Tannenbaum, S.R., Tamir, S., deRoojas-Walker, T., Wishnok, J.S., in: R.N. Loeppky, J.S. Michejda (Eds.), 1994, Nitrosamines and Related N-nitro Compounds, American Chemical Society, Washington, DC.
Thompson B., 2004, Nitrates And Nitrites Dietary Exposure and Risk Assessment. Institute of Environmental Science & Research Limited. Christchurch Science Centre. New Zealand. Available from: www.esr.cri.nz. Access on: November 22, 2006.
Wang Lu, Wang Z., Zhang H., Li X., & Zhang Hanqi. 2009, Ultrasonic Nebulization Extraction Coupled With Headspace Single Drop Microextraction And Gas Chromatography–Mass Spectrometry For Analysis Of The Essential Oil In Cuminum Cyminum L, J. of Anal Chim Acta, Vol. 647: 72-7
Wardencki, W., Curylo, J., Namieśnik, J., 2007, Trends in Solventless Sample Preparation Techniques For Environmental Analysis, J. of Biochem and Biophysic Methods, Vol.70: 275-288
Lampiran 1 : Pembuatan Larutan
a. Pembuatan Larutan Induk NDPA 50 ppm dari larutan NDPA Murni 99,9 %
Jadi, larutan induk NDPA 50 ppm dibuat dengan mengencerkan 25 μL NDPA 99,9 % dengan metanol hingga 100 mL.
b. Pembuatan Larutan Standar NDPA 2 ppm, 4 ppm, 6 ppm, 8 ppm, dan 10 ppm
1. Pembuatan larutan standar NDPA 2 ppm V1 x N1 = V2 x N2
Jadi, larutan standar NDPA 2 ppm dibuat dengan mengencerkan 400 µL NDPA 50 ppm dengan metanol pada labu ukur 10 mL sampai tanda batas.
2. Pembuatan larutan standar NDPA 4 ppm V1 x N1 = V2 x N2
V1 x 50 ppm = 10 mL x 4 ppm V1 = 0,8 mL =800 µL
Jadi, larutan standar NDPA 4 ppm dibuat dengan mengencerkan 800 µL NDPA 50 ppm dengan metanol pada labu ukur 10 mL sampai tanda batas.
3. Pembuatan larutan standar NDPA 6 ppm V1 x N1 = V2 x N2
V1 x 50 ppm = 500 mL x 6 ppm V1 = 60 mL
Jadi, larutan standar NDPA 6 ppm dibuat dengan mengencerkan 60 mL NDPA 50 ppm dengan metanol pada labu ukur 500 mL sampai tanda batas.. 4. Pembuatan larutan standar NDPA 8 ppm
V1 x N1 = V2 x N2
V1 x 50 ppm = 10 mL x 8 ppm V1 = 1,6 mL
5. Pembuatan larutan standar NDPA 10 ppm V1 x N1 = V2 x N2
V1 x 50 ppm = 10 mL x 10 ppm V1 = 2,0 mL
Jadi, larutan standar NDPA 10 ppm dibuat dengan mengencerkan 2,0 mL NDPA 50 ppm dengan metanol pada labu ukur 10 mL sampai tanda batas.
j. Pembutan Larutan Spiking Sampel
(V x N)50 ppm = (V x N)sampel V50 ppm x 50 ppm = 100 mL x 2 ppm
V50 ppm = 4,0 mL
Lampiran 2 : Pembuatan Kurva Kalibrasi NDPA Tanpa Ekstraksi Data kurva kalibrasi NDPA tanpa ekstraksi :
Keterangan
Luas area (satuan)
2 ppm 4 ppm 6 ppm 8 ppm 10 ppm Replikasi 1 1748,06 2809,27 3662,98 4457,38 5321,44 Replikasi 2 1581,17 2827,95 3659,97 4576,2 5327,39 Replikasi 3 1543,77 2833,11 3610,69 4472,05 5337,45
Rata-rata 1624,33 2823,44 3644,55 4501,88 5328,76
SD 108,77 12,54 29,36 64,78 8,09
KV (%) 6,696 0,444 0,806 1,439 0,152 R (%) 84,5 108 102,17 100,25 98,4
Dari data di atas, diperoleh kurva sebagai berikut :
a. Perhitungan Standar Deviasi (SD) dan Koefisien Variasi (% KV) 1. Konsentrasi larutan standar NDPA 2 ppm
Replikasi Luas Area (satuan) X –x (X –x)2
1 1748,06 123,73 15309,11
2 1581,17 -43,16 1862,79
3 1543,77 -80,56 6489,91
2. Konsentrasi larutan standar NDPA 4 ppm
Replikasi Luas Area (satuan) X –x (X –x)2
3. Konsentrasi larutan standar NDPA 6 ppm
_ x100%
4. Konsentrasi larutan standar NDPA 8 ppm
Replikasi Luas Area (satuan) X –x (X –x)2
5. Konsentrasi larutan standar NDPA 10 ppm
b. Perhitungan Recovery (% R)
1. Konsentrasi larutan standar NDPA 2 ppm
y = 454,37x + 858,38
2. Konsentrasi larutan standar NDPA 4 ppm
y = 454,37x + 858,38
3. Konsentrasi larutan standar NDPA 6 ppm
y = 454,37x + 858,38
4. Konsentrasi larutan standar NDPA 8 ppm
5. Konsentrasi larutan standar NDPA 10 ppm
c. Perhitungan Limit of Detection (LOD)
X y ŷ (y-ŷ)2
Lampiran 3 : Pembuatan Grafik Optimasi Jenis Pelarut Organik Data optimasi Jenis Pelarut Organik :
Dari data di atas, diperoleh kurva sebagai berikut : Keterangan
Luas Area (satuan)
toluena n-heksana Etil asetat
Replikasi 1 14.284,8 5.260,9 4.137,51
Replikasi 2 14.105,9 5.225,06 4.148,97
Replikasi 3 14.217,3 5.354,7 4.133,69
Lampiran 4 : Pembuatan Grafik Optimasi Volume Larutan Ekstrak Diperoleh data optimasi volume larutan ekstrak:
Keterangan
Luas Area (satuan)
10 mL 20 mL 30 mL 40 mL
Re plikasi 1 10.447,3 14.284,8 14.264,9 14.292,8 Replikasi 2 10.536,5 14.105,9 14.259,4 14.259,5 Replikasi 3 10.473,48 14.271,3 14.264,4 14.232,6
Rata-rata 10.485,76 14.220,66 14.263,03 14.261,63
Lampiran 5 : Pembuatan Grafik Optimasi Waktu Ekstraksi Diperoleh data optimasi waktu ekstraksi:
Keterangan
Luas Area (satuan)
15 mnt 30 mnt 45 mnt 60 mnt
Replikasi 1 5.653,62 14.463,02 9.293,52 6.647,04 Replikasi 2 5.725,64 14.431,94 9.236,1 6.677,98 Replikasi 3 5.743,65 14.455,49 9.276,67 6613,74 Rata-rata 5.707,64 14.450,15 9.268,76 6.646,25