PRODUKSI DAN PEMURNIAN ENZIM PEKTINASE (POLIGALAKTURONASE) DARI BAKTERI Pseudomonas stutzeri
SKRIPSI
NUR ROHISHOH
DEPARTEMEN KIMIA
FAKULTAS SAINS DAN TEKNOLOGI UNIVERSITAS AIRLANGGA
PRODUKSI DAN PEMURNIAN ENZIM PEKTINASE (POLIGALAKTURONASE) DARI BAKTERI Pseudomonas stutzeri
SKRIPSI
Sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana Sains Bidang Kimia Pada Fakultas Sains dan Teknologi
Universitas Airlangga
Disetujui oleh:
Pembimbing I
Prof. Dr. Ni Nyoman Tri Puspaningsih, M.Si NIP. 19630615 198701 2 001
Pembimbing II
HALAMAN PENGESAHAN NASKAH SKRIPSI
Judul : Produksi dan Pemurnian Enzim Pektinase
(Poligalakturonase) dari Bakteri Pseudomonas stutzeri
Penyusun : Nur Rohishoh
NIM : 080810123
Tanggal ujian : 16 Juli 2012
Disetujui oleh : Pembimbing I
Prof. Dr. Ni Nyoman Tri Puspaningsih, M.Si NIP. 19630615 198701 2 001
Pembimbing II
Dr. Endang Dewi Masithah, Ir., MP NIP. 19690912 199702 2 001
Mengetahui : Ketua Departemen Kimia Fakultas Sains dan Teknologi
Universitas Airlangga
PEDOMAN PENGGUNAAN SKRIPSI
Skripsi ini tidak dipublikasikan, namun tersedia di perpustakaan dalam lingkungan Universitas Airlangga, diperkenankan untuk dipakai sebagai referensi kepustakaan, tetapi pengutipan harus seizin penulis dan harus menyebutkan sumbernya sesuai kebiasaan ilmiah.
KATA PENGANTAR
Puji syukur kehadirat Allah SWT atas segala rahmat dan hidayah-Nya, sehingga penulis dapat menyelesaikan naskah skripsi dengan judul “Produksi dan Pemurnian Enzim Pektinase (Poligalakturonase) dari Bakteri Pseudomonas stutzeri” yang disusun sebagai syarat akademis untuk memperoleh gelar sarjana di Fakultas Sains dan Teknologi Universitas Airlangga.
Penulisan naskah skripsi ini tidak lepas dari bantuan dan dukungan dari berbagai pihak. Oleh karena itu, penulis ingin mengucapkan terima kasih kepada:
1. Ibu Prof. Dr. Ni Nyoman Tri Puspaningsih, M.Si selaku dosen pembimbing I dan Ibu Dr. Endang Dewi Masithah, Ir., MP selaku pembingbing II yang telah meluangkan waktunya untuk memberikan bimbingan, masukan dan saran kepada penulis dalam penyusunan skripsi ini.
2. Ibu Dr. Afaf Baktir, MS selaku dosen penguji I dan bapak Drs. Hamami, M.Si selaku dosen penguji II atas masukan dan saran yang telah diberikan dalam perbaikan skripsi ini.
3. Ibu Dr. Alfinda Novi Kristanti, DEA selaku Ketua Departemen Kimia yang senantiasa memberikan motivasi kepada penulis.
4. Ibu Dra. Usreg Sri Handajani, M.Si selaku dosen wali atas bimbingan dan motivasi yang telah diberikan.
5. Seluruh dosen pengajar Program Studi S1 Kimia atas segala ilmu yang telah diberikan.
7. Teman–teman angkatan 2008 dan semua pihak yang tidak dapat disebutkan satu persatu yang selalu memberikan semangat kepada penulis dalam menyelesaikan skripsi ini.
Penulis menyadari bahwa masih terdapat banyak kekurangan dalam penyusunan naskah skripsi ini. Oleh karena itu, penulis mengharapkan kritik dan saran yang bersifat membangun untuk kesempurnaan skripsi ini. Semoga skripsi ini dapat bermanfaat bagi semua pihak.
Surabaya, Juli 2012 Penulis,
ABSTRAK
Telah dilakukan produksi dan pemurnian enzim pektinase khususnya poligalakturonase dari bakteri Pseudomonas stutzeri. Tujuan dari penelitian ini adalah untuk mengetahui tingkat kemurnian enzim pektinase dan mengetahui berat molekul enzim pektinase melalui analisis SDS-PAGE. Proses pemurnian enzim diawali dengan pengendapan ammonium sulfat 70% dan diikuti dengan proses dialisis untuk menghilangkan sisa-sisa ammonium sulfat. Selanjutnya dilakukan kromatografi penukar anion dengan matriks DEAE Toyopearl 650 M, untuk memisahkan protein enzim berdasarkan muatannya. Enzim dielusi dengan larutan NaCl [0-1] M dalam buffer tris HCl pH 7 bergradien dari konsentrasi rendah ke tinggi. Hasil yang diperoleh menunjukkan terjadi peningkatan kemurnian enzim setelah dilakukan kromatografi penukar anion sebesar 77,7 kali dibandingkan ekstrak kasarnya. Hasil pemurnian enzim pektinase selanjutnya dikonfirmasi melalui analisis SDS-PAGE. Berdasarkan analisis SDS-PAGE, diperoleh 2 pita protein dengan berat molekul masing-masing pita yaitu 44,95 kDa dan 46,73 kDa.
ABSTRACT
Polygalacturonase was one of types of pectinase from Pseudomonas stutzeri was partially purified by anion exchange chromatography. The objectives of this study are determining the purity level of pectinase and estimating the molecular weight of pectinase by SDS-PAGE analysis. The partial purification was started by 70% ammonium sulfate precipitation and followed by dialysis to remove the remains of ammonium sulfate. After that, the anion exchange chromatography with DEAE Toyopearl 650 M as matrix is used to separate the enzyme protein based on its anion. The enzyme was eluted with NaCl solution [0-1] M in Tris HCl buffer pH 7 from low to high concentration. The results of anion exchange chromatography indicated purification level 77.7 from crude extract. Based on SDS-PAGE analysis, the result of enzyme purification by anion exchange chromatography obtained two protein bands with molecular weight of protein bands are 44.95 kDa and 46.73 kDa.
DAFTAR ISI
2.1.1 Mekanisme kerja enzim ... 8
2.1.2 Aktivitas enzim ... 11
2.5.2 Kromatografi kolom ... 22
2.5.2.1 Kromatografi filtrasi gel... 23 3.1 Tempat dan Waktu Penelitian ... 28
3.2 Sampel, Bahan, dan Alat Penelitian ... 28
3.2.1 Sampel penelitian ... 28
3.2.3 Alat penelitian ... 29
3.3 Prosedur Kerja... 30
3.3.1 Diagram alir penelitian ... 30
3.3.2 Pembuatan media ... 31
3.3.2.1 Media padat ... 31
3.3.2.2 Media cair... 31
3.3.3 Kultivasi bakteri Pseudomonas stutzeri... 31
3.3.4 Produksi enzim pektinase ... 32
3.3.5 Uji aktivitas enzim pektinase ... 32
3.3.6 Penentuan kadar protein ... 33
3.3.7 Pemurnian enzim pektinase ... 34
3.3.7.1 Pengendapan dengan amonium sulfat ... 34
3.3.7.2 Dialisis ... 35
3.3.7.3 Pemurnian enzim pektinase dengan kromatografi penukar anion ... 36
3.3.8 Analisis SDS-PAGE... 36
BAB IV HASIL DAN PEMBAHASAN 4.1 Hasil Produksi Enzim Pektinase dari Pseudomonas stutzeri... 38
4.2 Uji Aktivitas Enzim Pektinase ... 39
4.3 Uji Kadar Protein... 41
4.4 Hasil Pemurnian Enzim Pektinase ... 42
4.4.1 Hasil pengendapan enzim pektinase dengan amonium sulfat... 42
4.4.2 Hasil dialisis enzim pektinase ... 44
4.4.3 Hasil pemurnian enzim pektinase dengan kromatografi penukar anion ... 46
4.5 Hasil Analisis SDS-PAGE ... 49
BAB V KESIMPULAN DAN SARAN 5.1 Kesimpulan ... 53
4.2 Saran ... 53
DAFTAR GAMBAR
Nomor Judul Gambar Halaman
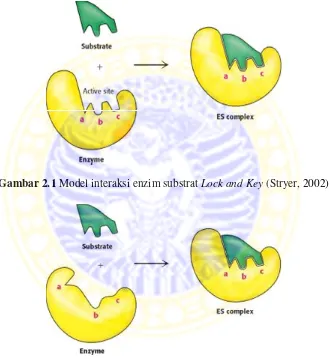
2.1 Model interaksi enzim substrat Lock and Key... 10
2.2 Model interaksi enzim substrat Induced Fit. ... 10
2.3 Pengaruh konsentrasi enzim terhadap laju reaksi. ... 11
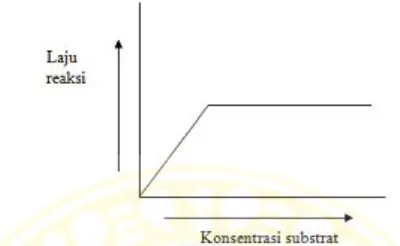
2.4 Pengaruh konsentrasi substrat terhadap laju reaksi... 12
2.5 Pengaruh suhu terhadap laju reaksi ... 13
2.6 Pengaruh pH terhadap laju reaksi ... 13
2.7 Struktur molekul pektin ... 14
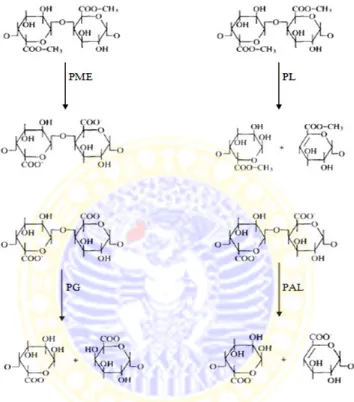
2.8 Mekanisme kerja enzim pektinase: pektin metil esterase (PME), pektin liase (PL), poligalakturonase (PG), dan pektat liase (PAL) ... 17
2.9 Uji pewarnaan gram negatif Pseudomonas stutzeri... 18
2.10 Pemisahan dengan dialisis ... 22
2.11 Kromatografi filtrasi gel ... 23
2.12 Kromatografi penukar ion (a); matriks penukar kation dan anion (b)... 24
2.13 Kromatografi afinitas... 25
2.14 Teknik SDS-PAGE... 27
3.1 Diagram alir penelitian ... 30
4.1 Isolat bakteri penghasil enzim pektinase ... 38
4.2 Hasil isolasi enzim pektinase, sebelum disentrifugasi (a) dan . sesudah disentrifugasi (b) ... 39
4.4 Optimasi pengendapan ekstrak kasar enzim pektinase dengan
amonium sulfat... 44 4.5 Profil elusi enzim pektinase dengan kromatografi penukar anion 47 4.6 Hasil analisis SDS-PAGE; marker protein (M), ekstrak kasar enzim
DAFTAR TABEL
Nomor Judul Tabel Halaman
DAFTAR LAMPIRAN
Nomor Judul Lampiran
1 Pembuatan reagen
2 Pembuatan kurva standar asam galakturonat
3 Pembuatan kurva standar BSA (Bovine Serum Albumin) 4 Penentuan aktivitas poligalakturonase dengan metode DNS 5 Perhitungan kadar protein
6 Data optimasi pengendapan enzim dengan (NH4)2SO4 7 Hasil elusi kromatografi penukar anion
BAB I PENDAHULUAN
1.1 Latar Belakang Masalah
Pengetahuan dan penggunaan enzim dalam berbagai bidang saat ini telah mengalami perkembangan yang sangat pesat. Enzim berfungsi sebagai katalis untuk proses biokimia yang terjadi di dalam maupun di luar sel. Melalui aktivitas katalitiknya, enzim mampu mempercepat reaksi 108sampai 1011 kali lebih cepat dibandingkan dengan reaksi tanpa katalis (Poedjiadi, 1994). Hal ini menjadi salah satu alasan enzim banyak digunakan sebagai katalis pada laboratorium dan industri.
Pektinase merupakan salah satu jenis enzim yang luas penggunaannya dalam bidang industri dan lapangan ilmu pengetahuan lainnya. Fakta menyebutkan bahwa 25% enzim pangan dunia yang digunakan dalam proses industri adalah pektinase (Tari et al., 2008). Enzim pendegradasi pektin ini digunakan dalam proses industri pangan khususnya industri sari buah-buahan dan sayuran, yang fungsinya antara lain untuk menjernihkan sari buah, menurunkan kekentalan, memudahkan penyaringan, mempercepat pengendapan sedimen, mempertahankan tekstur dan penampakan produk akhir, mencegah presipitasi pektin selama penyimpanan, dan meningkatkan efisiensi ekstraksi sari buah (Alkorta et al., 1998).
oleh mikroba. Hal tersebut disebabkan karena enzim dari mikroba memiliki kelebihan, di antaranya biaya produksi relatif ringan, dapat diproduksi dalam jumlah besar dan dalam waktu yang singkat, serta produktivitasnya lebih mudah ditingkatkan (Stanbury and Whitaker, 1995).
Langkah pertama dalam pengembangan proses produksi enzim pektinase adalah mencari galur mikroba yang produktif menghasilkan enzim pektinase. Banyak penelitian sebelumnya menyebutkan bahwa spesies Aspergillus dan Rhizopus merupakan galur mikroba produktif dari jenis kapang yang menghasilkan enzim pektinase komersial dengan aktivitas pektinolitik tinggi dalam skala industri (Fawole and Odunfa, 2003). Tidak hanya dari jenis kapang, enzim pektinase juga banyak dihasilkan dari berbagai jenis bakteri seperti dari genus Pseudomonas danBacillus(Kobayashi et al., 2000).
dan terjadi penurunan kepadatan populasi Microcystis aeruginosa secara eksponensial hingga hari ke-14 (Masithah, 2008).
Bakteri dengan genus Pseudomonas dipilih pada penelitian ini karena berdasarkan hasil penelitian Masithah (2008) menunjukkan bahwa isolat terbesar dari perairan tambak yaitu bakteri Pseudomonas sekitar 70-90% dan mempunyai aktivitas pektinase yang tinggi. Salah satu dari jenis bakteri tersebut yaitu Pseudomonas stutzeri.Bakteri jenis ini banyak ditemukan dalam perairan tambak udang dan lele dengan jumlah sekitar 97,81% (Rahardja, 2010). Bakteri Pseudomonas mampu menghasilkan enzim pektinase dengan jenis poligalakturonase (PG, EC 3.2.1.15), pektat liase (PAL, EC 4.2.2.2), dan pektin liase (PL, EC 4.2.2.10) (Masithah, 2008).
Poligalakturonase mendegradasi asam poligalakturonat (poligalakturonat acid) yaitu pektin dengan derajat esterfikasi yang sangat tinggi (lebih dari 50%) atau disebut juga dengan asam pektinat. Poligalakturonase bekerja dengan
memutus ikatan α-1,4 glikosidik pada rantai asam poligalakturonat secara
hidrolisis (Ortega et al., 2004). Pektin liase mendegradasi pektin dengan derajat esterfikasi yang cukup tinggi (50%) sedangkan pektat liase mendegradasi pektin yang dengan derajat esterfikasi rendah atau yang tidak teresterfikasi. Pektin liase
dan pektat liase bekerja dengan memutus ikatan α-1,4 glikosidik pada pektin
melalui reaksi β-eliminasi (Mayans et al., 1997).
lebih cepat dibanding dengan pektat liase dan pektin liase. Berdasarkan hasil karakterisasi, waktu inkubasi poligalakturonase lebih pendek (45 menit) dibanding dengan pektin liase (60 menit) dan pektat liase (90 menit). Sehingga produk yang dihasilkan lebih cepat melalui degradasi oleh poligalakturonase (Masithah, 2008).
Ekstrak kasar enzim pektinase yang diproduksi dari berbagai isolat bakteri memiliki aktivitas yang sangat rendah. Hal ini disebabkan di dalam ekstrak kasar enzim masih mengandung beberapa protein maupun kontaminan selain protein target. Aktivitas spesifik dari suatu enzim dapat meningkat setelah dilakukan berbagai tahapan pemurnian enzim melalui pengendapan enzim dan serangkaian kromatografi kolom (Stryer, 2002). Aktivitas spesifik poligalakturonase meningkat 18,64 kali setelah pemurnian dengan kromatografi penukar anion (Yadav et al., 2008), 54,9 kali setelah pemurnian menggunakan kromatografi kolom afinitas Sephadex G-100 (Jacob et al., 2008), dan 61 hingga 3200 kali setelah pemurnian dengan kromatografi kolom afinitas Sepharose (Shen et al., 1995).
dilakukan dengan pengendapan enzim menggunakan ammonium sulfat optimum, selanjutnya dilakukan dialisis dan kromatografi penukar anion.
1.2 Rumusan Masalah
Berdasarkan latar belakang yang telah diuraikan, maka dapat dirumuskan permasalahan sebagai berikut :
a. Bagaimanakah tingkat kemurnian enzim pektinase (poligalakturonase) yang diisolasi dari bakteri Pseudomonas stutzeri setelah dilakukan pemurnian dengan pengendapan ammonium sulfat, dialisis, dan kromatografi penukar anion?
b. Berapakah perkiraan berat molekul enzim pektinase (poligalakturonase) dari bakteri Pseudomonas stutzeri?
1.3 Tujuan Penelitian
Tujuan dari penelitian ini adalah :
a. Mengetahui tingkat kemurnian enzim pektinase (poligalakturonase) yang diisolasi dari bakteri Pseudomonas stutzeri setelah dilakukan pemurnian dengan pengendapan ammonium sulfat, dialisis, dan kromatografi penukar anion.
1.4 Manfaat Penelitian
BAB II
TINJAUAN PUSTAKA
2.1 Enzim
Enzim merupakan katalisator organik (biokatalisator) yang dihasilkan oleh sel hidup. Fungsi enzim yaitu mempercepat reaksi kimia 108 sampai 1011di dalam maupun di luar sel dengan menurunkan energi aktivasi dan tanpa mengubah hasil akhir (produk). Enzim bekerja dengan urut-urutan yang teratur, mengkatalisis ratusan reaksi bertahap yang menguraikan molekul nutrien, reaksi yang menyimpan dan mengubah energi kimiawi, dan yang membuat makromolekul sel dari prekusor sederhana (Lehninger, 1993). Keunggulan enzim sebagai biokatalisator antara lain daya katalitik dan spesifitas yang tinggi, dapat bekerja pada kondisi suhu dan pH yang tidak eksterm, aktivitas katalitik beberapa enzim dapat dikendalikan dan dapat diproduksi sehingga memudahkan penyediaan (Stryer, 2002).
menjadi produk akhir. Namun, enzim bersifat tidak stabil, yakni aktivitasnya dapat berkurang atau rusak oleh berbagai faktor baik fisik maupun kimia.
Molekul enzim adalah protein yang dihasilkan oleh sel hidup berupa protein globular yang terbentuk dari rantai polipeptida yang berlipat secara kompak. Konformasi tersier protein globular merupakan bentuk yang paling stabil karena ditunjang oleh berbagai ikatan yang menstabilkan struktur tersier protein. Jenis-jenis ikatan tersebut antara lain : ikatan hidrogen yang terdapat di antara gugus R residu asam amino rantai samping yang berdekatan, ikatan ion di antara gugus R yang berlawanan, interaksi hidrofobik dari gugus R asam amino hidrofobik dan ikatan kovalen berupa ikatan disulfida dari residu sistein (Ottoway dan Apps, 1984).
2.1.1 Mekanisme kerja enzim
Mekanisme katalis enzim merupakan reaksi-reaksi yang melibatkan gugus-gugus fungsi dari residu asam amino yang terdapat pada sisi aktif enzim. Sebelum melakukan fungsi katalitiknya, enzim terlebih dahulu membentuk ikatan dengan substrat, seperti yang ditunjukkan oleh reaksi berikut:
E + S kompleks ES EP E + P
Ikatan yang terjadi antara enzim dan substrat merupakan ikatan yang lemah seperti ikatan elektrostatik, ikatan hidrogen, gaya Van Der Walls ataupun interaksi hidrofobik. Interaksi yang terjadi antara molekul enzim dan substrat melibatkan gugusan reaktif, baik dari enzim maupun dari substrat. Enzim hanya dapat mengikat substrat yang memiliki gugusan-gugusan reaktif yang sama. Gugusan reaktif enzim yang terlibat dalam pengikatan substrat disebut gugusan-gugusan pengikat (binding group). Proses katalitik melibatkan sejumlah gugusan-gugusan reaktif lain yang disebut gugusan-gugusan katalitik (catalytic group). Gugusan tersebut terletak pada gugusan samping (Poedjiaji, 1994).
Menurut Winarno (1990), ada dua model interaksi enzim substrat yaitu : 1. ModelLock and Key(lubang dan anak kunci)
Model Lock and Key(lubang dan anak kunci) dikemukakan oleh Emil Fisher pada tahun 1890. Pada model ini, substrat harus mempunyai ukuran atau bentuk yang sesuai dengan sisi aktif enzim. Dalam model Fisher, tempat katalitik dianggap terbentuk terlebih dahulu agar sesuai dengan substratnya. Walaupun model Lock and Key ini merupakan model cetakan yang kaku, tetapi dapat dipakai untuk memahami sifat-sifat tertentu dari enzim, misalnya pengikatan secara berurutan dua atau lebih substrat atau kinetika suatu kurva kejenuhan substrat yang sederhana.
2. Model Induced Fit
substratnya sesaat setelah enzim mengikat substrat. Jadi substrat dianggap mampu menginduksi perubahan bentuk dalam sisi aktif enzim. Perubahan ini menempatkan residu asam amino pada sisi aktif enzim yang memungkinkan terjadinya pengikatan substrat selama proses katalisis.
Gambar 2.1Model interaksi enzim substrat Lock and Key(Stryer, 2002)
biologis protein tersebut. Penyebab terjadunya denaturasi antara lain : kondisi pH ekstrem, suhu tinggi, dan pengaruh senyawa lain seperti detergen, pelarut organik, urea konsentrat, anion besar dari asam kuat dan ion chaotropic (I-, SCN-) (Ottoway dan Apps, 1984).
2.1.2 Aktivitas enzim
Faktor-faktor yang mempengaruhi aktivitas enzim adalah konsentrasi enzim, konsentrasi substrat, suhu dan pH.
2.1.2.1 Konsentrasi enzim
Kecepatan reaksi suatu enzim secara langsung dapat dipengaruhi oleh konsentrasi enzim. Jika konsentrasi enzim banyak, maka reaksi akan lebih cepat. Jika jumlah enzim dua kali lipat, maka kecepatan reaksi akan menjadi dua kali lipat. Jadi ada hubungan linier antara kecepatan reaksi enzim dengan jumlah enzim (Poedjiadi, 1994).
Gambar 2.3 Pengaruh konsentrasi enzim terhadap laju reaksi (Poedjiadi, 1994) 2.1.2.2 Konsentrasi substrat
Akan tetapi pada batas konsentrasi tertentu, tidak terjadi kenaikan kecepatan walaupun konsentrasi substrat diperbesar (Poedjiadi, 1994).
Gambar 2.4Pengaruh konsentrasi substrat terhadap laju reaksi (Poedjiadi, 1994) 2.1.2.3 Pengaruh suhu
Gambar 2.5 Pengaruh suhu terhadap laju reaksi (Poedjiadi, 1994) 2.1.2.4 Pengaruh pH
Enzim mempunyai pH tertentu yang pada pH tersebut aktivitas enzim optimum. Perubahan pH lingkungan berpengaruh terhadap efektivitas bagian aktif enzim dalam membentuk kompleks enzim substrat. pH yang rendah atau tinggi dapat menyebabkan terjadinya proses denaturasi dan mengakibatkan turunnya aktivitas enzim (Poedjiadi, 1994).
Gambar 2.6Pengaruh pH terhadap laju reaksi (Poedjiadi, 1994)
2.2 Pektin
yang tersusun atas residu asam D-galakturonat yang dihubungkan oleh ikatan α -1,4 glikosidik (Quiroga et al., 2009). Menurut Nussinovitch (1997), komponen utama dari senyawa pektin tidak hanya asam D-galakturonat tetapi terdapat juga D-galaktosa, L-arabinosa, dan L-ramnosa dalam jumlah yang beragam dan terkadang terdapat gula lain dalam jumlah yang kecil. Beberapa gugus karboksilnya dapat teresterifikasi dengan metanol. Polimer asam galakturonat tersebut dapat berupa rantai lurus atau tidak bercabang.
Gambar 2.7Struktur molekul pektin (Alkorta et al., 1998)
American Chemical Society telah menetapkan istilah baku untuk menyeragamkan pektin yang hingga kini masih dipakai (Nussinovitch, 1997), yaitu :
1. Substansi pektat merupakan kelompok zat turunan karbohidrat kompleks berbentuk koloid yang dihasilkan dari tumbuh-tumbuhan dan sebagian besar mengandung asam anhidrogalakturonat dalam suatu kombinasi turunannya menyerupai rantai. Gugus karboksil asam-asam poligalakturonat dapat teresterifikasi sebagian dengan gugus metil dan sebagian atau seluruhnya dapat dinetralkan oleh satu atau lebih jenis basa.
3. Asam pektinat adalah istilah yang digunakan bagi asam poligalakturonat yang mengandung gugus metil ester dalam jumlah yang banyak (lebih dari 50%). Asam pektinat dalam keadaan yang sesuai mampu membentuk gel dengan ion-ion logam.
4. Pektin adalah istilah yang digunakan untuk asam-asam pektinat yang dapat larut dalam air dengan kandungan metil ester dan derajat netralisasi beragam dan dapat membentuk gel dengan asam dan gula pada kondisi yang sesuai. 5. Asam pektat adalah zat pektat yang seluruhnya tersusun dari asam
poligalakturonat yang bebas dari gugus metil ester.
2.3 Enzim Pektinase
Pektinase adalah enzim yang digunakan dalam degradasi molekul pektin (Jacob et al., 2008). Enzim pektinase dibagi menjadi tiga kelompok besar yaitu enzim yang melakukan deesterifikasi (pektinesterase), enzim yang melakukan depolimerisasi (hidrolase dan liase) dan protopektinase. Enzim deesterifikasi memotong ikatan ester antara gugus karboksil dari unit asam poligalakturonat
dengan gugus metil. Enzim depolimerisasi membelah ikatan α-1,4 glikosidik pada
senyawa pektin. Sedangkan protopektinase adalah enzim pektinase yang melarutkan protopektin (Alkorta et al., 1998).
Berdasarkan cara kerjanya enzim depolimerisasi dibagi menjadi dua yaitu
hidrolase dan liase. Hidrolase memotong ikatan α-1,4 glikosidik asam
poligalakturonat dengan hidrolisis, sedangkan liase memotong ikatan α-1,4
Pemecahan hidrolisa atau β-eliminasi dapat berlangsung secara acak (endo enzim)
atau hanya memutus pada bagian ujung (ekso enzim) (Alkorta et al., 1998).
Klasifikasi enzim pektinase berdasarkan mekanisme kerjanya pada molekul pektin, yaitu: pektinesterase atau pektin metilesterase (PME, EC 3.1.1.11), poligalakturonase (PG, EC 3.2.1.15), pektat liase (PAL, EC 4.2.2.2), dan pektin liase (PL, EC 4.2.2.10) (Debing et al., 2006).
Pektinesterase atau pektin metilesterase (PME) merupakan enzim yang yang memutus ikatan antara gugus karboksil dengan gugus metil pada asam poligalakturonat teresterifikasi. Poligalakturonase (PG) merupakan golongan enzim hidrolase yaitu enzim yang menghidrolisis molekul pektin dengan derajat esterifikasi yang sangat tinggi dengan membuka ikatan α-1,4-glikosidik pada rantai asam poligalakturonat (Shen et al., 1995). Pektat liase (PAL) dan pektin liase (PL) merupakan enzim depolimerase yang memutus ikatan α-1,4-glikosidik
pada asam poligalakturonat melalui mekanisme reaksi β-eliminasi menghasilkan
Gambar 2.8 Mekanisme kerja enzim pektinase: pektin metil esterase (PME), pektin liase (PL), poligalakturonase (PG), dan pektat liase (PAL) (Alkorta et al., 1998)
2.4 Pseudomonas stutzeri
Pseudomonas stutzerimemiliki klasifikasi sebagai berikut: Kingdom : Bacteria
Filum : Proteobacteria
Ordo : Pseudomonadales Famili : Pseudomonadaceae Genus : Pseudomonas
Spesies : Pseudomonas stutzeri
Gambar 2.9Uji pewarnaan gram negatif Pseudomonas stutzeri
2.5 Pemurnian Enzim
Pemurnian bertujuan untuk memisahkan enzim yang diinginkan dari senyawa yang tidak dikehendaki. Tahap-tahap pemurnian tergantung dari tujuan akhir, apakah untuk tujuan komersial atau tujuan riset. Enzim yang kasar atau yang dimurnikan sebagian masih dapat dipakai untuk komersial, sedangkan enzim yang murni atau hampir murni digunakan dalam riset atau dipakai dalam produk analitik. Untuk tujuan riset, biasanya digunakan untuk mempelajari aktivitas enzim, struktur dan fungsinya. Jumlah dari protein yang telah dimurnikan tidak hanya bergantung pada material awal tetapi juga proses. Ada protein yang hilang pada setiap tahap pemurnian. Karena itu, untuk memaksimalkan proses diusahakan sesedikit mungkin tahap pemurnian yang digunakan (Harris dan Angal, 1993).
2.5.1 Pemekatan enzim
Pemekatan protein enzim merupakan tahap awal dari prosedur pemurnian enzim sebelum tahap pemurnian berikutnya atau dapat pula digunakan untuk keperluan analisis enzim (Harris, 1989). Pemekatan protein dapat dilakukan dengan dua metode, yaitu analitik dan preparatif (penyiapan). Metode analitik menggunakan pemekatan asam (asam trikloroasetat), pemekatan organik (aseton dan etanol), dan imunopresipitasi yang dapat menyebabkan denaturasi protein. Berbeda dengan metode analitik, metode preparatif tetap mempertahankan aktivitas protein. Pemekatan protein dengan metode preparatif misalnya pemekatan dengan garam, pemekatan dengan pelarut organik, pemekatan dengan polimer organik, ultrafiltrasi, dan dialisis (Bollag & Edelstein, 1991). Metode pemekatan protein enzim yang biasa dilakukan adalah dengan menggunakan garam ammonium sulfat dan pelarut organik aseton.
sering digunakan untuk mengendapkan protein karena memilki daya larut tinggi di dalam air, relatif tidak mahal, dan kestabilan protein di dalam larutan ammonium sulfat (2M-3M) tahan bertahun-tahun (Scopes, 1993).
Pemekatan protein dengan menggunakan pelarut organik aseton berdasarkan pada pengurangan kelarutan protein dan konstanta dielektrika pelarut. Semakin banyak pelarut organik yang ditambahkan, semakin kurang daya solvasi air dan muatan pada permukaan molekul protein yang hidrofilik. Hal ini akan mengakibatkan molekul-molekul protein cenderung berinteraksi dengan sesamanya, hingga akhirnya protein mengendap. Prosedur pemekatan pelarut organik aseton dilakukan pada suhu di bawah 0oC. Pada suhu di atas 10oC, konformasi protein akan segera berubah yang memungkinkan molekul-molekul pelarut organik mendapatkan jalan masuk ke bagian dalam struktur protein, kemudian merusak interaksi hidrofobik dan akhirnya akan terjadi denaturasi (Harris, 1989; Scopes, 1993).
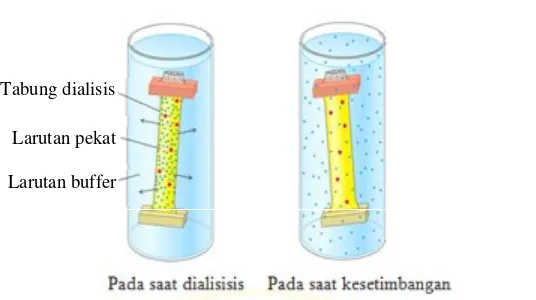
Gambar 2.10Pemisahan dengan dialisis (Stryer,2002)
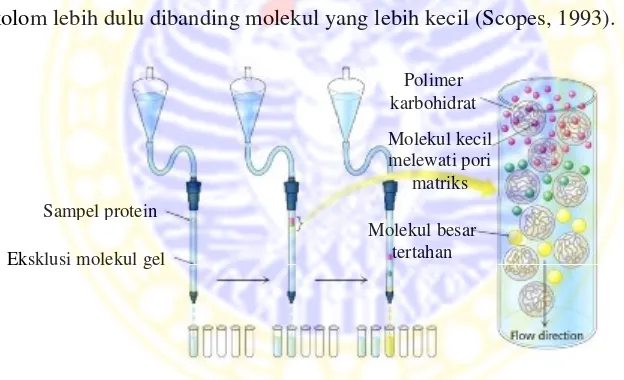
Berbeda dengan dialisis dan diafiltrasi, penghilangan garam dengan filtrasi gel diterapkan untuk jumlah sampel yang sedikit, yaitu tidak melampaui 25-30% volume kolom untuk mendapatkan resolusi yang memadai antar protein dan garam. Pada umumnya matriks filtrasi gel yang biasa digunakan memiliki pori berukuran kecil, misalnya (Sephadex G-25) (Pharmacia). Kekurangan metode ini adalah terjadi pengenceran sampel protein.
2.5.2 Kromatografi kolom
Kromatografi merupakanmetode utama dalam pemisahan senyawa organik yang mana senyawa tersebut terdistribusi di antara 2 fase, yaitu fase diam dan fase gerak. Fase gerak berupa pelarut dan molekul yang akan dipisahkan, sedangkan fase diam berupa padatan atau larutan yang mendukung padatan atau gel. Fase gerak bergerak kontinyu terhadap fase diam.
Ada beberapa macam kromatografi kolom, antara lain kromatografi filtrasi gel, kromatografi penukar ion, kromatografi afinitas, kromatografi interaksi hidrofobik.
Tabung dialisis
Larutan pekat
2.5.2.1 Kromatografi filtrasi gel
Kromatografi filtrasi gel merupakan teknik pemisahan protein dan makromolekul biologi lain berdasarkan ukuran molekul. Matriks filtrasi gel berupa gel yang berpori seperti dekstran, agarosa atau poliakrilamida. Contoh matriks komersial tersebut adalah Sepharose, Sephadex, dan Biogel, kemudian dikemas di dalam kolom dan dielusi dengan fase cair. Pori-pori matriks dapat menampung molekul berukuran lebih kecil. Molekul berukuran lebih kecil akan memasuki pori-pori matriks, namun molekul yang besar tidak terperangkap ke dalam pori kolom. Hasil yang dicapai adalah molekul besar akan keluar dari kolom lebih dulu dibanding molekul yang lebih kecil (Scopes, 1993).
Gambar 2.11Kromatografi filtrasi gel (Stryer,2002) 2.5.2.2 Kromatografi penukar ion
protein dengan jumlah muatan positif dan negatif sama disebut titik isoelektrik (pI). Titik isoelektrik sebagian besar protein di antara 5-9. Protein yang memiliki pH di atas pI akan bermuatan negatif, sedangkan pH di bawah pI akan bermuatan positif (Harris and Angal, 1993).
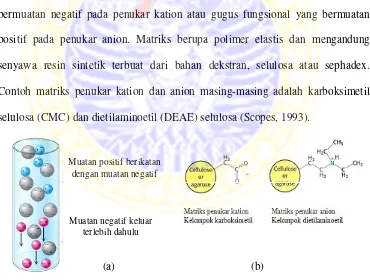
Pengerjaan kromatografi penukar ion didahului dengan mengelusi protein enzim dengan pH buffer awal yang telah diatur. Protein diharapkan terikat kuat pada kolom dan protein lain dibiarkan terelusi terlebih dahulu. Protein yang terikat pada kolom dilepaskan dengan cara mengubah pH buffer atau kekuatan ion pelarut. Matriks penukar ion mengikat secara kovalen gugus fungsional yang bermuatan negatif pada penukar kation atau gugus fungsional yang bermuatan positif pada penukar anion. Matriks berupa polimer elastis dan mengandung senyawa resin sintetik terbuat dari bahan dekstran, selulosa atau sephadex. Contoh matriks penukar kation dan anion masing-masing adalah karboksimetil selulosa (CMC) dan dietilaminoetil (DEAE) selulosa (Scopes, 1993).
Gambar 2.12Kromatografi penukar ion (a); matriks penukar kation dan anion (b) (Stryer,2002)
Muatan positif berikatan dengan muatan negatif
Muatan negatif keluar terlebih dahulu
2.5.2.3 Kromatografi afinitas
Pemisahan protein dengan kromatografi afinitas berdasarkan interaksi spesifik di antara makromolekul biologi dengan pasangannya, sebagai contoh enzim dengan substrat atau inhibitor dan antibodi dengan antigen. Kromatografi afinitas menggunakan suatu ligan alami, yang secara khusus berinteraksi dengan protein yang diinginkan (Scopes, 1993). Ligan akan terikat secara kovalen pada matriks. Komponen protein yang memiliki afinitas spesifik terhadap ligan akan diserap, sedangkan komponen lainnya (protein kontaminan) yang tidak memiliki afinitas akan terelusi terlebih dahulu.
Gambar 2.13Kromatografi afinitas (Stryer,2002) 2.5.2.4 Kromatografi interaksi hidrofobik
Kromatografi interaksi hidrofobik banyak digunakan untuk pemisahan protein dan peptida. Pada kekuatan ion yang tinggi protein terikat kuat pada matriks melalui interaksi hidrofobik. Matriks bersifat nonpolar. Campuran protein dimasukkan ke dalam kolom dengan buffer konsentrasi garam tinggi. Setelah protein yang tidak terikat keluar terlebih dahulu, protein yang terikat dielusi dengan eluen yang polaritasnya diturunkan (konsentrasi garam lebih rendah) (O’Farrel, 1998). Kromatografi interaksi hidrofobik didasarkan pada gaya Van
Der Waals antara protein dengan ligan yang terikat fasa diam yang dipengaruhi struktur air pada penambahan garam (Builder, 1993).
2.6 SDS – PAGE
SDS-PAGE atau Elektroforesis gel poliakrilamida-sodium dodesil sulfat adalah teknik elektroforesis gel yang menggunakan poliakrilamida untuk memisahkan protein yang bermuatan berdasarkan berat molekulnya. Sodium Dodesil Sulfat (SDS) merupakan deterjen ionik yang dapat melarutkan molekul hidrofobik yang memberikan muatan negatif pada keseluruhan struktur protein. Cara kerja SDS-PAGE adalah dengan menghambat interaksi hidrofobik dan merusak ikatan hidrogen (Davis et al., 1994). Metode SDS-PAGE digunakan untuk memisahkan protein demi keperluan biokimia, genetika forensik, dan biologi molekuler (Boyer, 1993).
Untuk melihat pita komponen yang terbentuk, gel perlu diwarnai dengan pewarna khusus. Beberapa pewarna yang dapat digunakan dalam SDS-PAGE adalah Commasie Brilliat Bluedan Silver Salt Staining. Commasie Brilliant Blue mengikat protein secara spesifik dengan ikatan kovalen. Silver Salt Staining memiliki sifat lebih sensitif dan akurat namun membutuhkan proses yang lebih lama (Boyer, 1993).
Gambar 2.14Teknik SDS-PAGE (Stryer, 2002) Campuran makromolekul
Elektroforesis
BAB III
METODE PENELITIAN
3.1 Tempat dan Waktu Penelitian
Penelitian ini dilakukan di Laboratorium Kimia Organik dan Biokimia Fakultas Sains dan Teknologi Universitas Airlangga. Waktu penelitian ini dimulai pada bulan Februari sampai dengan Juni 2012.
3.2 Sampel, Bahan, dan Alat Penelitian 3.2.1 Sampel Penelitian
Sampel yang digunakan adalah isolat bakteri Pseudomonas stutzeri yang telah diisolasi dari perairan tambak yang mengalami blooming Microcystis aeruginosa di Gresik (Masithah, 2008).
3.2.2 Bahan Penelitian
3.2.3 Alat Penelitian
3.3 Prosedur Kerja
3.3.1 Diagram alir penelitian
Gambar 3.1 Diagram alir penelitian
Analisis :
Uji aktivitas enzim SDS-PAGE Pengendapan dengan
ammonium sulfat Ekstrak kasar enzim pektinase
Kromatografi penukar ion
Dialisis
Kultivasi isolat bakteri Pseudomonas stutzeri
Produksi enzim pektinase dari bakteri Pseudomonas stutzeri
3.3.2 Pembuatan media 3.3.2.1 Media padat
Media padat terdiri dari 0,2 g bacto pepton, 0,2 g yeast extract, 0,1 g K2HPO4, 0,01 g CaCl2, 0,05 g MgSO4, 0,5 g Na2CO3, 1,0 g pektin, dan 1,5 g bacto agar. Semua bahan dilarutkan dengan 100 ml akuades dalam labu Erlenmeyer 250 ml. Kemudian labu Erlenmeyer ditutup dengan kapas dan alumunium foil lalu disterilkan dengan autoclave selama 45 menit pada suhu 121oC dan tekanan 1 atm. Setelah dikeluarkan dari autoclave campuran atau medium ditunggu sampai suam-suam kuku, lalu medium dituang ke dasar cawan petri dan dibiarkan sampai menjadi dingin dan memadat.
3.3.2.2 Media cair
Media cair terdiri dari 0,2 g bacto pepton, 0,2 g yeast extract, 0,1 g K2HPO4, 0,01 g CaCl2, 0,05 g MgSO4, 0,5 g Na2CO3, dan 1,0 g pektin. Semua bahan dilarutkan dengan 100 ml akuades dalam labu Erlenmeyer 250 ml. Kemudian labu Erlenmeyer ditutup dengan kapas dan alumunium foil lalu disterilkan dengan autoclave selama 45 menit pada suhu 121oC dan tekanan 1 atm.
3.3.3 Kultivasi bakteri Pseudomonas stutzeri
kemudian dipilih salah satu isolat dengan daerah bening terbesar yang menunjukkan aktivitas pektinase tertinggi. Supaya zona bening yang terbentuk lebih jelas maka dilakukan pewarnaan pada media padat dengan Congo red. Bidang halo akan tampak berwarna kuning bening, sedangkan media berwarna merah kecoklatan. Selanjutnya koloni-koloni tunggal dari media pektin padat dibuat inokulum dengan cara memasukkan isolat bakteri ke dalam 20 ml media cair di Erlenmeyer 100 ml, diinkubasi pada suhu kamar selama 12 jam dengan kecepatan 150 rpm.
3.3.4 Produksi enzim pektinase
Produksi enzim dilakukan dengan menumbuhkan 1% inokulum dalam 100 ml media pektin cair dan diinkubasi dengan shaker incubator pada suhu kamar dengan kecepatan 150 rpm. Panen dilakukan pada jam ke-12 dengan cara sentrifugasi 6000 rpm selama 15 menit, selanjutnya supernatan yang mengandung enzim pektinase diambil dan diuji aktivitasnya.
3.3.5 Uji aktivitas enzim pektinase
kemudian didinginkan dalam air es selama 20 menit. Selanjutnya absorbansi diukur dengan Spektrofotometer UV-Vis pada panjang gelombang 546,5 nm dan dihitung aktivitasnya menggunakan persamaan berikut :
Sebagai standar digunakan asam galakturonat masing-masing dengan konsentrasi 0,1; 0,2; 0,3; 0,4; dan 0,5 mg/ml. Sebanyak 1 ml larutan standar asam galakturonat ditambah dengan 3 ml larutan DNS dan dihomogenkan. Campuran kemudian dipanaskan dalam penangas air selama 15 menit dan didinginkan dalam air es selama 20 menit. Selanjutnya absorbansi diukur dengan Spektrofotometer UV-Vis pada panjang gelombang 546,5 nm.
3.3.6 Penentuan kadar protein
akuades sampai volume 100 µL lalu ditambahkan reagen Bradford. Blanko yang digunakan terdiri dari 100 µL akuades dan 1 µL reagen Bradford. Setelah itu, larutan dihomogenkan dengan vortex kemudian absorbansi dibaca menggunakan spektrofotometer pada panjang gelombang 595 nm.
Standar BSA dibuat pada kisaran 100-500 µg/ml dari stok BSA dengan kadar 1 mg/ml. Dari stok tersebut dilakukan pengenceran dengan akuades untuk memperoleh konsentrasi yang diinginkan. Blanko yang digunakan adalah 100 µL akuades dan 1 ml reagen Bradford. Selanjutnya absorbansi dibaca menggunakan spektrofotometer pada panjang gelombang 595 nm.
3.3.7 Pemurnian enzim pektinase
Tahapan pemurnian enzim pektinase diawali dengan pemekatan pengendapan ammonium sulfat, dialisis menggunakan tabung selofan, dan selanjutnya dimurnikan kromatografi penukar anion menggunakan DEAE-Toyopearl 650 M (Tosoh, Jepang). Hasil pemurnian dianalisis dengan SDS-PAGE.
3.3.7.1 Pengendapan dengan ammonium sulfat
enzim pektinase diendapkan dengan ammonium sulfat kemudian tabung dibolak-balik hingga garam larut dalam enzim pektinase. Selanjutnya disentrifugasi dengan kecepatan 6000 rpm pada 4oC selama 20 menit. Setelah dilakukan sentrifugasi akan diperoleh endapan dan supernatan, endapan hasil sentrifugasi tersebut dilarutkan dalam buffer fosfat sitrat pH 7, kemudian diuji aktivitasnya. Setelah didapatkan kadar kejenuhan ammonium sulfat yang optimum, pengendapan enzim pektinase dilanjutkan dalam skala besar, yaitu sebanyak 500 ml ekstrak kasar enzim pektinase dijenuhkan dengan ammonium sulfat.
Pengendapan dalam skala besar dilakukan dengan merendam ekstrak kasar enzim pektinase dalam penangas es, selanjutnya dimasukkan sejumlah ammonium sulfat sedikit demi sedikit secara perlahan sambil diaduk dengan pengaduk magnetik sampai ammonium sulfat larut dalam enzim. Enzim yang mengendap selanjutnya disentrifugasi dengan kecepatan 6000 rpm pada 4oC selama 20 menit. Selanjutnya endapan enzim dilarutkan dalam buffer fosfat sitrat pH 7 hingga tepat larut, kemudian dilakukan dialisis menggunakan tabung selofan.
3.3.7.2 Dialisis
sampai fraksi enzim bebas ammonium sulfat. Proses dialisis selesai apabila fraksi enzim telah bebas dari ammonium sulfat yang ditandai dengan tidak terbentuknya endapan putih ketika larutan buffer ditetesi larutan BaCl2atau tidak terbentuknya endapan coklat ketika larutan buffer ditetesi pereaksi Nessler. Setelah proses dialisis selesai, larutan enzim dikeluarkan dari tabung selofan dan diukur volumennya. Selanjutnya dilakukan uji aktivitas dan dilanjutkan dengan tahap pemurnian menggunakan kromatografi penukar ion.
3.3.7.3 Pemurnian enzim pektinase dengan kromatografi penukar anion Kromatografi penukar anion dilakukan dengan memasukkan kapas secukupnya ke dalam kolom. Sebanyak 1-2 ml matriks DEAE-Toyopearl 650 M dalam etanol dituangkan ke dalam kolom. Selanjutnya ke dalam matriks ditambahkan 10 ml larutan buffer Tris HCl pH 7. Sebanyak 2 ml enzim pektinase hasil dialisis dimasukkan ke dalam kolom. Fraksi enzim dipisahkan dengan mengalirkan eluen NaCl [0-1] M dalam buffer Tris HCl 7 dibuat bergradien dari konsentrasi rendah ke tinggi dalam kolom. Selanjutnya masing-masing fraksi diukur kadar protein dan aktivitasnya.
3.3.8 Analisis SDS-PAGE
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Produksi Enzim Pektinase dariPseudomonas stutzeri
Bakteri Pseudomonas stutzeri yang telah telah berhasil diisolasi dari perairan tambak di Gresik, diremajakan kembali pada media padat yang mengandung substrat pektin. Penggunaan substrat bertujuan agar dapat menginduksi bakteri untuk menghasilkan enzim pektinase. Bakteri yang tumbuh merupakan bakteri yang memanfaatkan pektin sebagai sumber karbon dengan cara mendegradasi pektin menjadi monomer-monomer asam galakturonat (Masithah, 2008). Tujuan peremajaan ini adalah untuk menumbuhkan kembali bakteri pada media yang baru dengan kebutuhan nutrisi yang cukup. Setelah diperoleh beberapa isolat tunggal, dilakukan seleksi isolat bakteri yang memiliki aktivitas pektinolitik tertinggi yang dapat dideteksi dengan adanya bidang halo yang paling besar di sekitar koloni bakteri. Bidang halo akan tampak berwarna bening setelah proses pewarnaan menggunakan Congo red, sedangkan media pektin akan berwarna merah kecoklatan.
P-1
P-2
P-3
Di antara keempat isolat bakteri pektinolitik pada Gambar 4.1, isolat bakteri dengan kode P-3 memiliki diameter bidang halo terbesar yang menunjukkan bahwa isolat bakteri tersebut memiliki aktivitas pektinolitik tertinggi (Masithah, 2008). Isolat dengan bidang halo terbesar (P-3) diinokulasi dalam media dengan penggoyangan menggunakan shaker 150 rpm pada suhu kamar selama 12 jam. Biakan inokulum dipindahkan ke dalam media produksi dan diinkubasi selama 12 jam dengan penggoyangan 150 rpm yang bertujuan agar proses aerasi merata di seluruh bagian media cair sehingga bakteri dapat tumbuh dengan baik. Enzim pektinase yang diproduksi terdapat pada bagian supernatan hasil sentrifugasi karena enzim pektinase merupakan enzim ekstraseluler (Alkorta et al., 1998).
(a) (b)
Gambar 4.2Hasil isolasi enzim pektinase, sebelum disentrifugasi (a) dan sesudah disentrifugasi (b)
4.2 Uji Aktivitas Enzim Pektinase
Enzim pektinase diuji aktivitas poligalakturonasenya pada substrat asam poligalakturonat (pektin teresterifikasi) menggunakan metode DNS. Substrat asam poligalakturonat didegradasi oleh poligalakturonase menjadi
monomer-Supernatan (crude enzyme)
monomer asam galakturonat secara hidrolisis (Alkorta et al., 1998). Asam galakturonat merupakan gula pereduksi yang dapat mereduksi asam 3,5-dinitrosalisilat menjadi asam 3-amino-5-nitrosalisilat (Zheng et al.,2000). Secara kualitatif, reaksi reduksi ini dapat dilihat dari perubahan warna campuran enzim pektinase, substrat asam poligalakturonat, dan reagen DNS yang berwarna kuning tua menjadi coklat tua. Reaksi yang terjadi sebagai berikut:
asam 3,5-dinitrosalisilat asam 3-amino-5-nitrosalisilat (kuning) (coklat)
Gambar 4.3 Reaksi reduksi asam 3,5-dinitrosalisilat menjadi asam 3-amino-5-nitrosalisilat
Pada pengukuran uji aktivitas enzim digunakan kontrol yang berfungsi sebagai pembanding banyaknya produk yang dihasilkan. Adapun komposisi kontrol sama dengan sampel enzim, perbedaannya terletak pada urutan penambahan komposisi dan proses inkubasi. Perlakuan pada sampel dimulai dari penambahan enzim dan substrat kemudian diinkubasi selama 30 menit pada suhu 40oC yang bertujuan agar enzim bereaksi dengan substrat secara optimal, selanjutnya ditambah dengan reagen DNS. Sedangkan pada kontrol, urutan penambahan komposisinya dimulai dari enzim kemudian reagen DNS dan terakhir substrat tanpa inkubasi. Hal ini bertujuan agar enzim tidak bereaksi
merupakan substrat spesifik untuk aktivitas poligalakturonase. Pada pembuatan substrat asam poligalakturonat ditambahkan larutan EDTA 1 mM yang bertujuan untuk menghambat aktivitas enzim pektat liase dan pektin liase (Yadav et al., 2008).
Uji aktivitas enzim dengan metode DNS yaitu dengan menginkubasi enzim yang telah ditambahkan dengan substrat selama 30 menit pada suhu 40 oC. Selama proses ini terjadi degradsi pektin oleh poligalakturonase menjadi monomer-monomer asam galakturonat yang merupakan salah satu jenis gula pereduksi. Setelah penambahan reagen DNS, dilakukan pemanasan dalam air mendidih yang bertujuan untuk mematikan enzim dan menyempurnakan reaksi antara gula pereduksi asam galakturonat dengan reagen DNS. Banyaknya gula pereduksi yang terbentuk diukur menggunakan spektrofotometer UV-Vis pada panjang gelombang 546,5 nm. Satu unit aktivitas enzim pektinolitik didefinisikan sebagai jumlah enzim yang memproduksi 1 µmol produk asam galakturonat per satuan waktu untuk setiap ml enzim pada kondisi percobaan (Zheng et al., 2000). Aktivitas yang terukur pada ekstrak kasar enzim sebesar 0,15513 U/ml.
4.3 Uji Kadar Protein
Beberapa reagen yang harus dipersiapkan adalah reagen Bradford dan standar Bovine Serum Albumin (BSA). Reagen Bradford ini terdiri dari 50 mg Coomassie brilliant blue G-250 yang dilarutkan dalam 25 ml etanol 96%, kemudian ditambahkan 50 ml asam fosfat 85% dan diencerkan dengan akuades sampai volume 500 ml (Bollag and Edelstein, 1991). Prosedur yang dilakukan yaitu menambahkan sampel enzim dengan reagen Bradford. Setelah dihomogenkan dengan vortex, diukur absorbansinya dengan spektrofotometer UV-Vis pada panjang gelombang 595 nm. Pada penelitian ini, reagen Bradford dibuat dengan menambahkan asam fosfat yang bertujuan untuk memberikan respon yang lebih konsisten dengan protein lain dan merupakan reagen yang stabil (Scope, 1993). Kadar protein untuk ekstrak kasar enzim pektinase (poligalakturonase) yaitu 2,54132 mg/ml, sehingga diperoleh aktivitas spesifik ekstrak kasar enzim pektinase (poligalakturonase) sebesar 0.06104 U/mg.
4.4 Hasil Pemurnian Enzim Pektinase
4.4.1 Hasil pengendapan enzim pektinase dengan ammonium sulfat
Enzim pektinase yang dihasilkan berupa ekstrak kasar yang merupakan campuran dari berbagai macam protein lainnya sehingga perlu dilakukan pemurnian untuk mendapatkan enzim yang lebih murni. Prosedur awal pemurnian yaitu dengan mengendapkan enzim pektinase menggunakan ammonium sulfat berdasarkan tabel Scopes (1993).
konsentrasi rendah ion-ion garam mengeilingi molekul protein enzim dan mencegah bersatunya molekul protein enzim sehingga protein berada dalam keadaan larut (salting in). Pada penambahan ammonium sulfat dengan konsentrasi tinggi, molekul air akan tertarik ke ion-ion garam sehingga molekul air yang berinteraksi dengan protein akan berkurang. Keadaan ini mengakibatkan terjadinya interaksi hidrofobik di antara sesama molekul protein enzim yang dapat menurunkan kelarutan protein sehingga protein mengendap (Scopes, 1993).
Penambahan ammonium sulfat dalam ekstrak kasar enzim pektinase dilakukan sedikit demi sedikit disertai pengadukan dengan magnetic stirreruntuk mempercepat kelarutan ammonium sulfat dan menghomogenkan ammonium sulfat ke seluruh bagian ekstrak kasar enzim. Proses pengadukan secara perlahan-lahan untuk menghindari terbentuknya buih, karena pembentukan buih ini merupakan indikasi enzim terdenaturasi (Suhartono, 1992).
Gambar 4.4 Optimasi pengendapan ekstrak kasar enzim pektinase dengan ammonium sulfat
Berdasarkan hasil penelitian, enzim pektinase memiliki aktivitas optimum pada pengendapan dengan 70% ammonium sulfat. Selanjutnya aktivitas enzim menurun karena enzim telah jenuh dengan ammonium sulfat. Enzim pektinase hasil pengendapan dengan amonium sulfat optimum memiliki aktivitas total sebesar 0.09204 U/ml. Besarnya kadar protein setelah pengendapan enzim ini sebesar 0,50964 mg/ml, sehingga diperoleh aktivitas spesifik enzim pektinase dengan jenis poligalakturonase sebesar 0,18059 U/mg.
4.4.2 Hasil dialisis enzim pektinase
Untuk penyimpanan, tabung selofan direndam dalam larutan EDTA dan disimpan dalam suasana dingin (Harris dan Angal, 1993).
Pada proses dialisis, molekul berukuran lebih kecil seperti garam ataupun ion pengganggu lainnya akan melewati pori-pori tabung selofan sampai konsentarsi di dalam dan di luar tabung mencapai nilai yang sama dan larutan buffer masuk ke dalam tabung menggantikan molekul kecil yang keluar (Boyer, 1993), sedangkan molekul-molekul protein yang berukuran lebih besar tertahan di dalam tabung selofan.
Proses dialisis enzim pektinase berlangsung selama kurang lebih 10 jam di mana setiap 2 jam sekali buffer tris HCl diganti agar tidak terjadi penumpukan ammonium sulfat dalam buffer. Dialisis dihentikan setelah tidak ada lagi ammonium sulfat yang keluar dari tabung selofan. Hal ini dapat diidentifikasi dengan menambahkan beberapa tetes pereaksi Nessler pada buffer dialisis, jika sudah tidak terbentuk endapan coklat maka proses dialisis telah selesai. Identifikasi ammonium sulfat pada proses dialisis ini tidak menggunakan BaCl2 karena ion fosfat dari buffer fosfat sitrat yang digunkanan untuk melarutkan enzim pektinase akan membentuk endapan putih Ba3(PO3)2. Begitu pula dengan ion sulfat dari amonium sulfat akan membentuk endapan putih BaSO4, sehingga reagen BaCl2 ini kurang spesifik jika digunakan untuk mengidentifikasi adanya amonium sulfat dalam buffer selama proses dialisis.
0,07794 U/ml, kadar protein 0,25482 mg/ml, dan aktivitas spesifik enzim pektinase dengan jenis poligalakturonase sebesar 0,30585 U/mg.
4.4.3 Hasil pemurnian enzim pektinase dengan kromatografi penukar anion
Tahap pemurnian enzim pektinase selanjutnya menggunakan metode kromatografi penukar anion. Kromatografi penukar anion digunakan untuk memisahkan protein berdasarkan muatannya (Stryer, 2002). Seperangkat alat kromatografi penukar ion terdiri dari kolom plastik transparan berukuran 5 ml yang dirangkai dengan selang yang menghubungkan eluen dengan kolom. Eluen yang digunakan adalah NaCl dalam buffer tris HCl pH 7 bergradien 0-1 M dan matriks yang digunakan adalah DEAE-Toyopearl 650 M dalam etanol.
Preparasi kolom kromatografi penukar ion dilakukan dengan menyumbat ujung kolom dengan kapas untuk mencegah kebocoran matriks. Matriks DEAE-Toyopearl 650 M yang telah berada dalam kolom dikondisikan dengan mengalirkan 5 ml buffer tris HCl pH 7, karena pada pH 7 merupakan kondisi optimal dari enzim pektinase khususnya poligalakturonase (Pathak et al., 2000). Enzim pektinase dalam kolom penukar ion dielusi dengan NaCl dalam buffer tris HCl pH 7 yang dialirkan secara bergradien dari konsentrasi rendah ke tinggi. Perbandingan volume NaCl dan buffer tris HCl yang digunakan yaitu 1:1 (Yadav et al., 2008). NaCl 1 M dialirkan ke dalam buffer tris HCl disertai dengan pengadukan menggunakan magnetic stirrer yang bertujuan untuk menghomogenkan aliran gradien eluen.
Enzim pektinase yang bermuatan negatif akan diselimuti oleh komponen buffer tris HCl yang bermuatan positif (H+), sedangkan matriks DEAE yang bermuatan positif akan diselimuti oleh komponen dari buffer yang bermuatan negatif (Cl-). Interaksi antara enzim dan matriks DEAE akan terjadi di mana ion Cl-akan segera digantikan posisinya oleh enzim. Ion Cl- selanjutnya akan bergabung kembali dengan Htris+ menjadi Tris Cl yang tidak bermuatan. Peningkatan konsentrasi Tris Cl akhirnya dapat mengusir kedudukan enzim, sehingga enzim akan terelusi keluar kolom dengan fraksi yang berbeda-beda (Scopes, 1993). Peningkatan konsentrasi ion dalam penelitian ini dilakukan dengan gradien NaCl 0-1 M.
Enzim pektinase yang telah dielusi, ditampung dalam botol untuk setiap 1 ml fraksi enzim yang dikeluarkan dari kolom. Fraksi enzim yang diperoleh sebanyak 22 botol dengan hasil uji sebagai berikut :
menunjukkan aktivitas spesifik yang lebih kecil, masing-masing yaitu (0,19212 U/mg) dan (0,39517 U/mg). Hal ini dapat diartikan aktivitas enzim pektinase pada fraksi ke-14 tidak hanya tidak hanya poligalakturonase melainkan juga enzim pektinase jenis lainnya seperti pektin liase dan pektat liase. Sedangkan pada fraksi ke-18 menunjukkan aktivitas spesifik yang paling tinggi (4,74208 U/mg), yang dapat diartikan bahwa sebagian besar enzim yang bekerja pada fraksi ke-18 adalah poligalakturonase. Kemurnian poligalakturonase pada fraksi ke-18 dapat dideteksi melalui analisis SDS-PAGE.
Berdasarkan hasil serangkaian pemurnian enzim pektinase, dapat diinformasikan lebih lanjut melalui suatu tabel pemurnian sebagai berikut :
Tabel 4.1Pemurnian enzim pektinase (poligalakturonase)
Ekstrak kasar 500 0,15513 2,54132 0,06104 100 1
Pengendapan (NH4)2SO470%
50 0,09204 0,50964 0,18059 59,3 2,9
Dialisis 30 0,07794 0,25482 0.30585 50,2 5,0
Kromatografi
penukar anion 5 0,06532 0,01377 4,74208 42,1 77,7
terendapkan karena tujuan dari pengendapan enzim ini yaitu memekatkan enzim dan memisahkanya dari molekul air (Scopes, 1993). Hal ini menunjukkan bahwa pengendapan enzim dengan amonium sulfat yang dilakukan pada satu titik kejenuhan yang dalam penelitian ini hanya dilakukan pada kejenuhan 70% belum memberikan hasil yang maksimal, sehingga perlu dilakukan fraksinasi enzim pektinase dengan amonium sulfat pada range kejenuhan tertentu untuk mendapatkan hasil pengendapan enzim dengan persentase yang lebih besar.
Berdasarkan hasil pemurnian enzim dengan kromatografi penukar anion, diperoleh tingkat kemurnian enzim yang cukup tinggi yaitu 77,7 kali lebih murni dibandingkan dengan ekstrak kasarnya, sedangkan hasil pemurnian yang diperoleh sebesar 42,1%. Hasil pemurnian ini menunjukkan protein enzim pektinase telah terpisah dengan baik dari beberapa protein maupun kontaminan lainnya, walaupun kadar protein yang diperoleh cukup rendah dan masih dimungkinkan terdapat kontaminan yang belum terpisah dari protein enzim pektinase.
4.5 Hasil Analisis SDS-PAGE
Pada pembuatan gel SDS-PAGE baik stacking gel 5% maupun separating gel 12%, ditambahkan ammonium persulfat yang berfungsi sebagai inisiator polimerisasi dan TEMED (N,N,N’,N’-tetramethylen-ethylendiamine) yang berfungsi sebagai katalis untuk mempercepat pembentukan radikal SO4 (Janson, 1998). Sedangkan perlakuan terhadap sampel yaitu dengan menambahkan sampel buffer disertai dengan pemanasan untuk proses denaturasi. Sampel buffer mengandung beta-merkaptoetanol yang berperan untuk merusak struktur tiga dimensi protein dengan cara memecah ikatan disulfida yang tereduksi menjadi gugus sulfhidril. Adanya gliserol dalam buffer sampel berfungsi untuk meningkatkan berat jenis larutan sampel sehingga dapat masuk dengan mudah ketika diinjeksikan ke dalam sumur gel. Buffer sampel juga mengandung pewarna bromophenol blue yang berfungsi untuk membantu memonitor jalannya elektroforesis (Wilson dan Walker, 2000)
Pergerakan protein dalam medan listrik hanya didasarkan pada ukuran molekul protein. Protein yang berukuran kecil akan bergerak lebih cepat dibandingkan dengan protein yang berukuran lebih besar. Massa molekul relatif (Mr) protein dapat diukur menggunakan protein standar (marker protein) yang yang telah diketahui Mr-nya dengan cara membandingkan nilai mobilitas relatif (Rf). Rf protein merupakan perbandingan jarak antara titik awal ke pita protein dengan jarak titik awal ke titik akhir elektroforesis (Wilson dan Walker, 2000). Marker proteinyang digunakan yaitu LMW standardyang dapat mendeteksi berat molekul suatu protein antara 14,4-97,0 kDa.
Gambar 4.6Hasil analisis SDS-PAGE; marker protein (M), ekstrak kasar enzim (CE), pengendapan dengan ammonium sulfat (AS), dialisis (D), dan fraksi ke-18 kromatografi penukar anion
Berdasarkan hasil SDS-PAGE, sumur 1 merupakan marker protein yang sudah diketahui berat molekulnya sekitar 20,1-97,0 kDa. Pada sumur 2 merupakan ekstrak kasar enzim pektinase yang diisolasi dari bakteri Pseudomonas stutzeri., terlihat banyak pita-pita protein yang belum terpisah
dengan jelas (smear). Hal ini mengindikasikan dalam ekstrak kasar pektinase masih terdapat berbagai macam protein kontaminan. Sumur 3 merupakan hasil pengendapan enzim dengan ammonium sulfat 70% yang dilanjutkan dengan hasil dialisis pada sumur 4. Pada sumur 2 pita protein terlihat tidak jelas sedangkan pada sumur 3 terdapat sekitar 4 pita protein dari hasil dialisis. Hasil pemurnian dengan kolom penukar anion pada fraksi ke-18 pada sumur 5 memperlihatkan dua buah pita protein yang saling berdekatan dengan berat molekul relatif (Mr) masing-masing pita sekitar 44,95 kDa dan 46,73 kDa. Dua pita protein yang diperoleh ini diduga sebagai pita-pita protein dari enzim pektinase (poligalakturonase) karena jaraknya yang sangat berdekatan, sehingga dapat diartikan enzim pektinase (poligalakturonase) merupakan isozim, yaitu enzim yang mengkatalisisi reaksi metabolisme yang sama tetapi mempunyai sifat, ukuran dan bentuk molekul yang beragam (polimorfik) dalam suatu organisme atau spesies (Micales and Bonde, 1995).
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Berdasarkan hasil dan pembahasan dapat disimpulkan bahwa :
1. Tingkat kemurnian enzim pektinase (poligalakturonase) dari bakteri Pseudomonas stutzeri setelah dilakukan serangkaian tahap pemurnian sebesar 77,7 kali lebih murni dibandingkan ekstrak kasarnya.
2. Berat molekul enzim pektinase (poligalakturonase) dari Pseudomonas stutzeri yaitu sekitar 44,95 kDa dan 46,73 kDa.
5.2 Saran
DAFTAR PUSTAKA
Alkorta, I., Garbisu, C., Llama, M.J., and Serra, J.L., 1998, Industrial Application of Pektin Enzymes: A Review, Process Biochemistry, 33: 21-28.
Boyer, RF., 1993, Modern Experimental Biochemistry, Jilid 2, The Benjamin/Cummings PCI, California.
Bollag, D.M. and Edelstein, S.J., 1991,Protein Methods, Willey-liss, New York. Builder, E., 1993, Hydrophobic Interaction Chromatography : Principles and
Methods, Amersham Bioscience, San Fransisco.
Davis, L., Kuehl, M., and Battey, M., 1994, Basic Methods: Molecular Biology, Jilid 2, Appletn & Lange, Norwola.
Debing, J., Peijun, L., Stagnitti, F., Xianzhe, X., and Li, L., 2006, Pectinase Production by Solid Fermentation from Aspergillus niger by a New Prescription Experiment, Ecotoxicology and Environmental Safety, 64: 244-250.
Fawole, O.B. and Odunfa, S.A., 2003, Some Factors Affecting Production of Pectic Enzymes by Aspergillus niger, International Biodeterioration & Biodegradation, 52: 223-227.
Harris, E.L.V., 1989, Concentration of The Extract, di dalam Harris E.L.V., Angal S, Editor Protein Purufication Methods, A Pratical Approach, IRL PC, Oxford.
Harris, E.L.V. and Angal, S, 1993, Protein Purification Methods, A Pratical Approach, IRL Press, Oxford.
Herlina, M.S., 2010, Isolasi Bakteri Indigen Sebagai Pendegradasi Bahan Organik Pada Pembenihan Ikan Lele Dumbo Sistem Resirkulasi Tertutup, Skripsi, Fakultas Perikanan Dan Kelautan, Universitas Airlangga, Surabaya.
Jacob, N., Poorna, C.A., and Prema, P., 2008, Purification and Partial Characterization of Polygalacturonase from Streptomyces lydicus, Bioresource Technology, 99: 6697-6701.
Kobayashi, T., Hatada, Y., Suzumatsu, A., Saeki, K., Hakamada, Y., and Ito, S., 2000, Highly Alkaline Pectat Lyase Pel-4A from Alkaliphilic Bacillus sp. Strain P-4-N: Its Catalytic Properties and Deduced Amino Acid Sequence, Extremophiles, 4: 377-383.
Lehninger, A. L., 1993, Dasar-Dasar Biokimia, Jilid 1, terjemahan Maggy Thenawijaya, Penerbit Erlangga, Jakarta.
Laemmli, U.K., 1970, Cleavage of Structural Proteins during The Assembly of The Head of Bacteriophage T4, Nature, London 227 : 680-685.
Masithah, E.D., 2008, Potensi Bakteri Pektinolitik Sebagai Kandidat Pengendali Blooming Microcystis aeruginosa, Disertasi, Program Pascasarjana, Universitas Airlangga, Surabaya.
Mayans, O., Scott, M., Connerton, I., Gravesen, T., Benen, J., Visser, J., pickersgill, R., and Jenkins, J.,1997, Two Crystal Structures of Pektin Lyase A from Aspergillus Reveal a pH Driven Conformational Change and Striking Divergence in the Substrate-binding Clefts of Pektin and Pectate Lyases, Research Article, 5(5): 677-689.
Micales, J.A. and Bonde, M.R., 1995, Isozymes: Methods and Applications, di dalam: Singh RP, Singh US, Editors Molecular Methods in Plant Pathology, CRC Press-Lewis Publishers, Boca Raton.
Nussinovitch, 1997, Hydrocolloid Aplications Gum Technology in The Food and Other Industries, Blackie Academic and Profesional, London.
O’Farrel, P.A., 1998, Hydrophobic Interaction Chromatography, di dalam Repley R. and Walker JM., Molecular Biomethods Handbook, Humana Pr, Totowa.
Ortega, N., de Diego, S., Perez-Mateos, M., and Busto, M.D., 2004, Kinetic Properties and Thermal Behaviour of Polygalacturonase Used in Fruit Juice Clarification, Food Chemistry, Burgos 88: 209-217.
Ottoway, J.H., Apps, D.K., 1984, Biochemistry, Edisi ke-4, ELBS, Cambridge. Pathak, N., Mishra, S., and Sanwal, G.G., 2000, Purification and
Characterization of Polygalacturonase from Banana Fruit, Phytochemistry, 54 : 147-152.
Poedjiadi, A., 1994, Dasar-Dasar Biokimia,Universitas Indonesia Press, Jakarta. Purwani, N.N., 2006, Pemurnian Parsial Enzim Xilanase Asal Isolat Sumber
Air Panas Pacet, Jawa Timur, Skripsi, Departemen Kimia, Fakultas Sains dan Teknologi, Universitas Airlangga, Surabaya.
Quiroga, E.N., Sgariglia, M.A.., Molina, C.F., Sampietro, D.A., Soberon, J.R., and Vattuone. M.A., 2009, Purification and Characterization of an Exo-polygalacturonase from Pycnoporus sanguineus, Mycological Research, 113: 1404-1410.
Rahardja, S.B., 2010, Efektifitas Bakteri Pseudomonas Sebagai Pengurai Bahan Organik (Protein, Karbohidrat, Lemak) pada Media Air Limbah Pembenihan Ikan Lele Dumbo (Clarias sp.) Sistem Sirkulasi Tertutup, Jurnal Ilmiah Perikanan dan Kelautan, Fakultas Perikanan dan Kelautan, Universitas Airlangga, Surabaya.
Rani, H.C., 2009, Pemisahan Dan Pemurnian Kompleks Enzim Selulase Dari Bakteri Acidothermus cellulolitycus, Skripsi, Departemen Kimia, Fakultas Sains dan Teknologi, Universitas Airlangga, Surabaya.
Scopes, R.K., 1993, Protein Purification Principle and Practice, Edisi Ke-3, Springer Verlag, New York.
Shen, Z., Reese, J.C., and Reeck, G.R., 1996, Purification and Characterization of Polygalacturonase from the Rice Weevil, Sitophilus oryzae
(Coleoptera: Curculionidae), Insect Biochemistry Molecular Biology, 26 (5): 427-433.
Stanbury, P.F. and Whitaker, A., 1995, Principles of Fermentation Technology, Edisi Ke-2, Elsevier Science, Ltd., Oxford.
Stryer, L., Tymoczko, J.L., and Berg, J.M. 2002, Biochemisty, Fifth Edition, W.H. Freeman, New York.
Suhartono, M.T., 1992, Enzim dan Bioteknologi, PAU IPB, Bogor.
Tari, C., Dogan, N., and Gogus, N., 2008, Biochemical and Thermal Characterization of Crude Exo-polygalacturonase Produced by
Aspergillus sojae, Food Chemistry, 111: 824-829.
Winarno, F.G., Fardias, S., 1990, Biofermentasi dan Biosintesa Protein, Edisi X, Penerbit Angkasa, Bandung.
Zheng, Z., and Shetty, K., 2000, Solid State Production of Polygalacturonase by Lentinus edodes Using Fruit Processing Wastes, Process Biochemistry, 35 : 825-830.
LAMPIRAN
Lampiran 1. Pembuatan reagen Larutan buffer fosfat sitrat
Larutan stok A asam sitrat 0,1 M dibuat dengan cara menimbang 1,921 gram asam sitrat lalu dilarutkan dengan akuades dan diencerkan dalam labu ukur 100 mL hingga tanda batas. Larutan stok B Na2HPO4.7H2O 0,2 M dibuat dengan cara menimbang 5,365 gram lalu dilarutkan dengan akuades dan diencerkan dalam labu ukur 100 mL hingga tanda batas. Sebanyak X ml larutan A ditambah Y ml larutan B kemudian diencerkan dengan akuades sampai volume 100 ml.
X Y pH
24,3 25,7 5
17,9 32,1 6
6,5 43,6 7
Larutan asam 3,5-dinitrosalisilat (DNS)
Ditimbang dengan teliti 1 gram NaOH dilarutkan dengan 60 ml akuades, ditambahkan 18,2 gram garam Rochelle, 1 gram asam dinitrosalisilat (ditambahkan pelan-pelan sambil diaduk dengan magnetic stirrer), 0,2 gram fenol dan 0,05 gram natrium sulfit. Lalu dipindahkan secara kuantitatif ke dalam labu ukur 100 ml, diencerkan sampai tanda batas dan dikocok sampai homogen.
Larutan NaCl 1 M