PEMURNIAN DAN KARAKTERISASI ENZIM PROTEASE KATEPSIN DARI IKAN
MAS (Cyprinus carpio)
Hafiludin
Jurusan Ilmu Kelautan Fakultas Pertanian Universitas Trunojoyo Madura
Korespondonsi :Jl. Raya Telang PO BOX 2 Kamal Bangkalan,
email:[email protected]
ABSTRACT
The purpose
of
this study
wasto
obtained
a extract of protease
enzyme
from
carp
fish
,knowed the techniques of
purification
by precipitation
with
ammonium
sulfate
,knowed
his
activity in the
environmental
pH
and
temperature
,as well as in
different metals
.The study was
conducted
in two
stages
, thefirst stage
wasto extract
the enzyme
and the second
was
the
purification of
the enzyme
by the method of
precipitation with
a few
percent
saturation
of
ammonium
sulfate
.Crude
protease
extract
obtained
from
differential
centrifugation
has a
total
protein content
of
109.800
mg with
specific activity
of
0.8197
unit/mg protein
.After
purification by
ammonium
sulfate
precipitation of
the enzyme
obtained
by
highest yeld of
25.387
%,purity
multiples
of
6.123
fold
from
the supernatant
by
ammonium
sulfate
precipitation
30%
saturation
.Optimum
environmental
conditions
the enzyme
protease
goldfish (
Cyprinuscarpio
)at
a temperature of 30
0C
with a pH of
5.
Activity of enzyme katepsin
in
goldfish
inhibited
in the presence of
metal
CoCl
2,and
MnCl
2CaCl
2with
a high
concentration
(5
mM
)and is active with
the addition of
EDTA
.Key words: enzyme protease, goldfish (Cyprinus carpio), purification PENDAHULUAN
Produksi perikanan tangkap dari penangkapan ikan di laut dan di perairan umum pada tahun 2006 masing-masing sekitar 4.468.010 ton dan 301.150 ton (Ditjen Perikanan Tangkap 2007). Sedangkan produksi perikanan budidaya pada tahun 2006 mencapai 2.625.800 ton. Produksi perikanan budidaya didominasi oleh udang 327.260 ton, rumput laut 1.079.850 ton, ikan mas 285.250 ton, bandeng 269.530 ton, nila 227.000 ton, ikan lele 94.160 ton, gurameh 35.570 ton dan kerapu 8.430 ton (Ditjen Perikanan Budidaya 2007).
Proses penurunan mutu ikan segar terutama diawali dengan proses perombakan oleh aktivitas enzim yang secara alami terdapat di dalam ikan. Salah satu jenis enzim yang berperan penting dalam proses kemunduran mutu ikan adalah enzim-enzim pengurai protein (enzim proteolitis) yang menguraikan protein menjadi pepton, polipeptida dan asam-asam amino. Hidrolisis protein oleh suatu protease seperti katepsin, calpain dan kolagenase dapat menyebabkan timbulnya akumulasi metabolit, perubahan citarasa dan pelunakan tekstur, terbentuknya komponen volatil serta peningkatan jumlah bakteri yang akhirnya menimbulkan kebusukan.
Protease merupakan salah satu enzim yang penting untuk kelangsungan mahluk hidup karena berperan dalam sejumlah reaksi biokimia seluler. Selain diperlukan untuk degradasi protein nutrient, enzim protease juga terlibat dalam sejumlah mekanisme patogenitas, proses koogulasi darah, proses sporulasi, diferensiasi, sejumlah proses pasca translasi protein dan mekanisme ekspresi protein ekstra seluler (Rao et al. 1998 dalam Paada 2004). Protease juga mempunyai peran yang penting dan banyak digunakan dalam industri pangan dan non pangan. Protease dalam industri pangan dimanfaatkan sebagai penjernih bir, membuat kecap ikan, membuat protein hidrolisat, pengempuk daging dan kegunaan lainnya.
Ikan mas seperti halnya mahluk hidup lainnya merupakan sumber enzim yang dapat berada dalam sel (enzim intraseluler) yang melekat pada membran atau berada diluar sel (ekstraseluler). Enzim-enzim tersebut dapat aktif dan akan sangat merugikan ketika ikan tersebut mati. Kemunduran mutu dari ikan mas dapat menurunkan nilai ekonomisnya sehingga perlu dilakukan penghambatan dan pengontrolan aktivitas dari protease tersebut.
Salah satu langkah yang dapat dilakukan adalah melakukan karakterisasi protease yang terdapat pada ikan mas, melakukan pemurnian dan pengujian aktivitasnya pada kondisi lingkungan tertentu seperti suhu dan pH dan beberapa inhibitor dan aktivator. Sehingga dari informasi beberapa karakteristik protease tersebut dapat menemukan penghambatan yang paling efektif dan spesifik untuk memperlambat kemunduran mutu oleh aktivitas protease. Penelitian tentang enzim protease telah dilakukan yaitu Ustadi et al. (2005).
Tujuan dari penelitian ini adalah mendapatkan ekstrak enzim protease dari daging ikan mas, mengetahui teknik pemurnian melalui pengendapan dengan ammonium sulfat, mengetahui aktivitasnya dalam lingkungan pH dan suhu, serta dalam logam yang berbeda.
METODE PENELITIAN Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan April sampai bulan Juli 2009 di Laboratorium Karakteristik Bahan Baku Hasil Perairan, Laboratorium Mikrobiologi Hasil Perairan, Departemen Teknologi Hasil Perairan Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Bahan dan Alat
Bahan-bahan yang digunakan pada penelitian ini terdiri dari bahan-bahan utama berupa daging ikan mas (Cyprinus carpio) 600 gram. Bahan-bahan untuk assay aktivitas katepsin (buffer tris-HCL pH 7.4, hemoglobin, HCl 1N, TCA 5%, pereaksi Folin, tirosin), EDTA, CaCl2, MnCl2, CoCl2, pengukuran pH ( larutan buffer standar pH 7, akuades).
Alat-alat yang digunakan pada penelitian ini antara lain inkubator, oven, sentrifuse suhu dingin, spektrofotometer, mikropipet, timbangan analitik, homogenizer, magnetic stirrer, hot plate, pipet volumetrik, bulb, pipet tetes, tabung reaksi, cawan petri, erlenmenyer, pH meter, kapas, tissue, aluminium foil.
Prosedur Penelitian
Penelitian dilakukan dengan tiga tahap yaitu tahap pertama melakukan ekstraksi enzim dari ikan mas (Cyprinus carpio) dengan metode diferensial sentrifugasi sehingga diperoleh ekstrak kasar. Hasil ekstrak ini kemudian di ukur konsentrasi protein dengan metode Bradford, diukur aktivitasnya pada substrat hemoglobin, penentuan suhu optimum, pH optimum dan inhibitor logam. Tahap kedua yaitu pemurnian enzim dengan metode pengendapan dengan ammonium sulfat dengan beberapa persen kejenuhan (30 %, 40%, 50%, 60 %, 70 %, 80 %), hasil pemurnian ini kemudian diukur kandungan proteinnya serta diukur aktivitasnya.
Ekstraksi enzim protease
Pertama-tama dilakukan preparasi sampel untuk memperoleh ekstrak kasar protease dengan cara ikan dimatikan, kemudian daging ikan dibedah dengan cepat dan dicuci untuk menghilangkan darah. Daging ikan diambil dan disuspensikan dalam akuades dengan perbandingan daging ikan dan akuades sebesar 1:1, lalu dihomogenisasi pada suhu 0-4 0C. Selanjutnya ekstrak daging hasil homogenisasi disentrifus pada 600 g selama 10 menit dan supernatant yang diperoleh kemudian disentrifus lagi pada 10.000 g selama 10 menit. Pelet yang dihasilkan dari hasil sentrifus kemudian dilarutkan dalam 0,1 M buffer tris-HCl pH 7,4 dengan jumlah yang sama seperti jumlah akuades tadi dan disentrifus pada 4.000 rpm selama 10 menit. Supernatan yang diperoleh merupakan ekstrak kasar enzim protease.
Pemurnian protease melalui pengendapan dengan amonium sulfat
Pemurnian protease dengan pengendapan ammonium sulfat dilakukan pada kisaran kejenuhan 30, 40, 50, 60, 70 dan 80%. Sebanyak 80 ml larutan enzim ekstrak kasar ditambahkan ammonium sulfat sesuai dengan persen kejenuhnnya. Pengendapan protein dilakukan dengan sentrifuse dingin pada kecepatan 9000 rpm selama 15 menit kemudian dipisahkan antara supernatan dan pelet. Pelet dilarutkan dalam buffer tris 0,2 M pH 7,8 sebanyak 1 ml dan disimpan pada suhu 40C. Setelah itu dilakukan pengujian aktivitas dengan metode Barret 1970 dalam Dinu et al 2002 pada substrat hemoglobin dan penentuan kadar protein menurut metode Bradford (1976).
Pengukuran Konsentrasi Protein Enzim (Bradford 1976)
Konsentrasi protein ditentukan menggunakan metode Bradford dengan bovine serum albumin sebagai standar. Persiapan pereaksi Bradford dilakukan dengan cara melarutkan 5 mg coomassie brilliant blue G-250 dalam 2,5 ml etanol 95%, lalu ditambahkan dengan 5 ml asam fosfat 85% (w/v). Jika telah larut dengan sempurna, maka ditambahkan akuades hingga 250 mililiter dan disaring dengan kertas saring Whatman 1 dan diencerkan 5 kali sesaat sebelum digunakan.
Konsentrasi protein ditentukan dengan menggunakan metode Bradford dengan cara 0,1 ml enzim dimasukkan ke dalam tabung reaksi. Kemudian ditambahkan sebanyak 5 ml pereaksi Bradford, diinkubasi selama lima menit dan diukur dengan spektrofotometer pada panjang gelombang 595 nm. Demikian pula untuk larutan standar dilakukan sama seperti larutan sampel dengan konsentrasi antara 0,1-1,0 mg/ml. Tahap berikutnya adalah membuat kurva standar dengan absorbansi sebagai ordinat (sumbu y) dan konsentrasi protein sebagai absis (x). Berdasarkan kurva tersebut dapat ditentukan konsentrasi protein dalam sampel. Tabel komposisi volume larutan dengan pembuatan larutan standar konsentrasi 0,1-1,0 mg/ml dari larutan stok BSA konsentrasi 2 mg/ml.
Assay aktivitas katepsin (Barret 1970 dalam Dinu et al 2002)
Aktivitas protease diuji menggunakan substrat hemoglobin. Pada tahap pertama membuat larutan sampel, tabung reaksi dimasukan 0,2 ml buffer tris-HCl (pH 7,4), 0,5 ml subtrat hemoglobin (pH 2), dan 0,2 ml enzim. Membuat larutan standar yang terdiri 0,2 ml buffer tris-HCl (pH 7,4), 0,5 ml subtrat hemoglobin (pH 2) dan 0,2 ml tirosin. Membuat larutan blanko yang terdiri 0,2 ml buffer tris-HCl (pH 7,4), 0,5 ml subtrat hemoglobin (pH 2) dan 0,2 ml akuades. Ketiga larutan kemudian diinkubasi selama 10 menit. Setelah inkubasi pertama dilanjutkan dengan penambahan 2 ml TCA untuk menghentikan reaksi. Kemudian masing-masing larutan difortek dan dilakukan penyaringan dengan kertas saring. Diambil 1,5 ml larutan hasil penyaringan (sampel, standar dan blanko) dan ditambahkan pada masing-masing larutan 1,5 ml folin. Kemudian larutan diinkubasi kembali pada suhu 37 0C selama 20 menit. Kemudian diukur absorbansinya dengan menggunakan spektrofotometer pada λ = 750 nm. Untuk perlakuan penentuan suhu optimum maka inkubasi dilakukan pada suhu 10, 20, 30 dan 40 oC dengan pH buffer 7,4. Untuk perlakuan penentuan pH optimum maka pH buffer yang digunakan adalah 3, 4, 5, 6, dan 7.
Aktivitas enzim dihitung berdasarkan jumlah tirosin yang dihasilkan per ml enzim per menit dengan rumus sebagai berikut :
T
1
X
P
X
Blanko
Abs
S tandar
Abs
Blanko
Abs
S ampel
Abs
UA
)
(
)
(
Dimana :UA = jumlah tirosin yang dihasilkan per ml enzim per menit Abs = nilai absorbansi
P = faktor pengenceran T = waktu inkubasi (10 menit)
Untuk mengetahui pengaruh kation logam dan EDTA yang berperan sebagai kofaktor atau inhibitor. Pada masing-masing larutan (sampel, standar dan blanko) ditambahkan 0,5 ml logam (CoCl2 1mM dan 5 mM; CaCl2 1 mM dan 5mM, MnCl2 1mM dan 5mM ; EDTA 1mM dan 5 mM. HASIL DAN PEMBAHASAN
Pemurnian Enzim Katepsin Ikan Mas
Hasil ekstraksi enzim katepsin dan pemurnian dengan pengendapan amonium sulfat dengan berbagai karakteristik aktivitasnya adalah sebagai berikut (Tabel 1).
Tabel 1. Hasil pemurnian enzim katepsin ikan mas (Cypinus carpio) Tahap pemurnian Volume (ml) Total protein (mg) Aktifitas (unit/ml) Total Aktifitas (U) Aktifitas spesifik (unit /mg protein) yield Tingkat pemurnian Ekstrak kasar 600,000 109,800 0,150 90,000 0,8197 100,000 1,000 Pengendapan 30% supernatan 94,080 4,552 0,243 22,848 5,0190 25,387 6,123 endapan 1,000 3,113 0,333 0,333 0,1071 0,370 0,131 Pengendapan 40% supernatan 99,120 7,461 0,007 0,661 0,0886 0,734 0,108 endapan 1,000 1,285 0,260 0,260 0,2023 0,289 0,247 Pengendapan 50% supernatan 105,120 22,041 0,014 1,502 0,0681 1,669 0,083 endapan 1,000 0,398 0,200 0,200 0,5025 0,222 0,613 Pengendapan 60% supernatan 111,200 32,284 0,000 0,000 0,0000 0,000 0,000 endapan 1,000 3,194 0,087 0,087 0,0272 0,096 0,033 Pengendapan 70% supernatan 117,760 24,692 0,000 0,000 0,0000 0,000 0,000 endapan 1,000 2,629 0,420 0,420 0,1598 0,467 0,195 Pengendapan 80% supernatan 124,880 16,114 0,000 0,000 0,0000 0,000 0,000 endapan 1,000 0,935 0,420 0,420 0,4492 0,467 0,548 Ekstrak kasar protease yang diperoleh dari diferensial sentrifusi mempunyai kandungan protein total sebesar 109,800 mg dengan aktivitas spesifik sebesar 0,8197 unit/mg protein. Setelah pemurnian dengan pengendapan ammonium sulfat didapatkan enzim dengan randemen tertinggi sebesar 25,387%, kelipatan kemurnian sebesar 6,123 dari supernatan dengan pengendapan ammonium sulfat 30% kejenuhan. Namun untuk tingkat kemurnian terbesar didapat dari endapan dengan pengendapan ammonium sulfat 50% kejenuhan yaitu sebesar 0,613 fold.
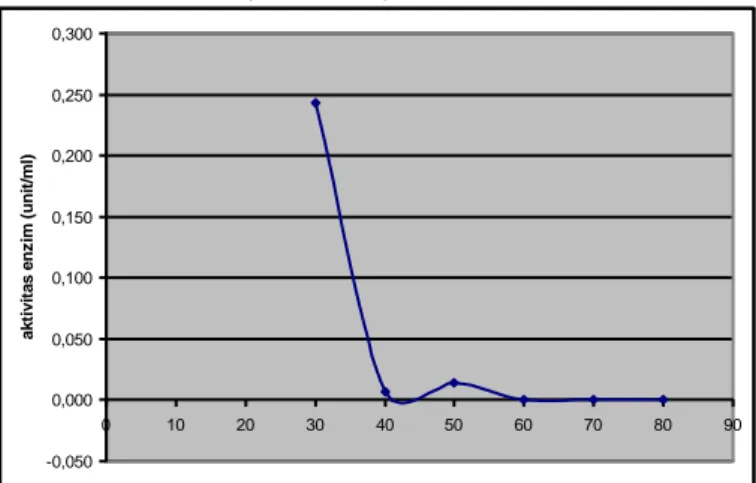
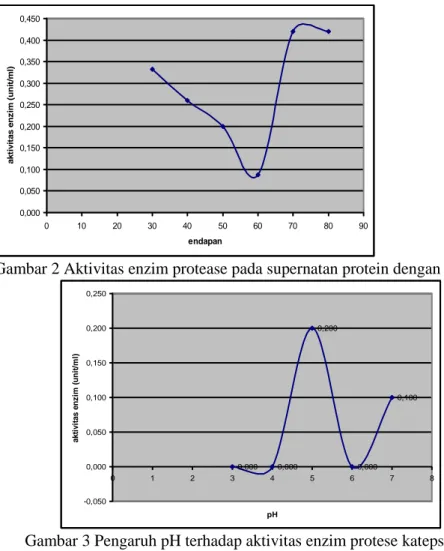
Aktivitas enzim protease supernatan dari hasil pemurnian dengan ammonium sulfat hanya terdapat pada tingkat kejenuhan 30%, 40% dan 50%, dengan semakin meningkatnya tingkat kejenuhan yaitu pada 70% dan 80% tidak terdapat aktivitas enzim (Gambar 1). Aktifitas enzim bagian rendemen terdeteksi pada pengendapan amonium sulfat 30-80%. Aktivitasnya menurun dengan meningkatnya konsentrasi amonium sulfat sampai 60% dan kemudian naik kembali pada pengendapan amonium sulfat 70 dan 80% (Gambar 2).
-0,050 0,000 0,050 0,100 0,150 0,200 0,250 0,300 0 10 20 30 40 50 60 70 80 90 supernatan a k ti v ita s e n z im (u n it/ m l)
0,000 0,050 0,100 0,150 0,200 0,250 0,300 0,350 0,400 0,450 0 10 20 30 40 50 60 70 80 90 endapan a k ti v ita s e n z im (u n it/ m l)
Gambar 2 Aktivitas enzim protease pada supernatan protein dengan ammonium sulfat
0,000 0,000 0,200 0,000 0,100 -0,050 0,000 0,050 0,100 0,150 0,200 0,250 0 1 2 3 4 5 6 7 8 pH a k ti v it a s e nz im ( un it /m l)
Gambar 3 Pengaruh pH terhadap aktivitas enzim protese katepsin ikan mas (Cyprinus carpio) Penentuan suhu optimum dengan 0,2 M buffer tris HCl pH 7,4 diukur pada kisaran pH 3-7 diperoleh aktivitas optimum protease katepsin ekstrak kasar daging ikan mas pada pH 5,0 yaitu dengan aktivitas sebesar 0,200 unit/ml (Gambar 3). Hasil ini sesuai dengan hasil penelitian Dinu et al (2002) bahwa enzim katepsin pada ikan Carrassius auratus gibelio aktif pada kisaran pH 4,0 sampai 5,0.
Berdasarkan hasil penelitian Hans H.O dan Tanja S (1997) menunjukkan bahwa enzim protese katepsin B aktif pada pH 4,5 – 5,5, sedangkan katepsin A aktif pada pH 4,7-5,8. Menurut Kirschke (1998) dalam Visessanguan et al. (2003), Katepsin L aktif pada pH 3,0 – 6,5 dengan kehadiran komponen thiol. Sedangkan hasil penelitian S.Li et al. (2008) menunjukkan bahwa katepsin L2 aktif pada pH 3,0-5,5.
Pengaruh Suhu Terhadap Aktifitas Protease Katepsin
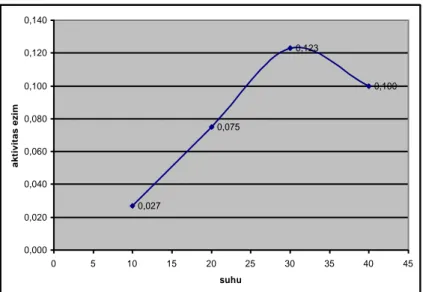
Penentuan suhu optimum dengan 0,2 M buffer tris HCl pH 7,8 diperoleh aktivitas optimum protease katepsin ekstrak kasar daging ikan mas pada suhu 30 oC. Dengan aktifitas sebesar 0.123 unit/ml (Gambar 4). Berdasarkan penelitian Visessanguan et al. (2003) menunjukkan bahwa enzim protease berupa katepsin L dari daging arrowtooth flounder mempunyai aktifitas optimum 60 0C, sedangkan aktifitas optimal untuk jenis ikan yang lain sekitar 45-50 0C. Selain interaksi non kovalen, kestabilan enzim terhadap suhu juga dipengaruhi oleh pH, kekuatan ion medium dan molekul efektor (ion logam).
0,027 0,075 0,123 0,100 0,000 0,020 0,040 0,060 0,080 0,100 0,120 0,140 0 5 10 15 20 25 30 35 40 45 suhu a k ti v it a s e zi m
Gambar 4 Pengaruh suhu terhadap aktivitas enzim protese katepsin ikan mas (Cyprinus
carpio)
Pengaruh Inhibitor dan Aktivator Terhadap Aktivitas Protease Katepsin
Hasil pengujian menunjukkan bahwa dengan penambahan logam CoCl2, CaCl2, MnCl2 pada
konsentrasi yang tinggi yaitu 5 mM menyebabkan terjadinya hambatan terhadap aktivitas enzim katepsin (Gambar 5). Penambahan CaCl2 1 mM menyebabkan aktivitas enzim menjadi meningkat
yaitu 1,00 unit/ml, Namun jika konsentrasinya ditingkatkan menjadi 5 mM maka aktivitasnya menjadi tidak ada. Hal ini menandakan bahwa logam CaCl2 bersifat aktivator pada konsentrasi 1 mM dan
bersifat inhibitor pada konsentrasi 5 mM. Begitu juga dengan penambahan EDTA yang menyebabkan peningkatan aktivitas yaitu 0.425 unit/ml pada konsentrasi 1 mM dan 0,650 unit/ml pada konsentrasi 5 mM. Hal ini menandakan bahwa EDTA bersifat aktivator pada enzim protease katepsin. Menurut hasil penelitian S.Li et al. (2008) menunjukkan bahwa penggunaan EDTA sebanyak 1 dan 2 mmol/l tidak menghambat aktivitas enzim protese katepsin L2 pada ikan Silver carp (Hypophthalmichthys molitrix
).
0,127 1,000 0,030 0,425 0,000 0,000 0,000 0,650 0,000 0,200 0,400 0,600 0,800 1,000 1,200CoCl2 CaCl2 MnCl2 EDTA
logam a k ti v it a s e nz im ( un it /m l) 1 mM 5 mM
Gambar 5 Pengaruh Inhibitor dan Aktifator Terhadap Aktifitas Enzim Protease Katepsin Ikan Mas (Cyprinus carpio)
KESIMPULAN
Ekstrak kasar protease yang diperoleh dari diferensial sentrifugasi mempunyai kandungan protein total sebesar 109,800 mg dengan aktivitas spesifik sebesar 0,8197 unit/mg protein. Setelah pemurnian dengan pengendapan ammonium sulfat didapatkan enzim dengan randemen tertinggi sebesar 25,387%, kelipatan kemurnian sebesar 6,123 fold dari supernatan dengan pengendapan ammonium sulfat 30% kejenuhan. Kondisi lingkungan optimum enzim protease ikan mas (Cyprinus
carpio) pada suhu 30 oC dengan pH 5. Aktivitas enzim katepsin pada ikan mas dihambat dengan adanya logam CoCl2, CaCl2 dan MnCl2 dengan konsentrasi tinggi (5 mM) dan aktif dengan
penambahan EDTA.
DAFTAR PUSTAKA
Bradford MM. 1967. A rapid and sensitive method for quantification of microgram quantities of protein utilizing the principle of protein dye binding . Anal Biochem 72 : 234-254.
Ditjen Perikanan Budidaya. 2007. Kebijakan dan program prioritas tahun 2008. makalah disampaikan dalam Rakornas Departemen Kelautan dan Perikanan tahun 2007. Departemen Kelautan dan Perikanan. Jakarta
Dinu D, IF Dumitru, MT Nechifor. 2002. Isolation and characterization of two cathepsin from muscle of Carrasius auratus gibellio. Roum. Biotechnol. Lett. Vol 7. (3):753-758.
Kirschke H. 1998. Cathepsin L. In: Barrett, A.J., Rawlings, N.D., Woessner, F.F. (Eds.), Handbook of Proteolytic Enzymes. Acedemic Press, California, pp. 617–621.
Paada MY. 2004. Pemurnian dan Karakterisasi Enzim Protease Serin dari Bacillus subtilis Rekombinan R1. [Tesis yang tidak dipublikasikan, Sekolah Pascasarjana, IPB].
Rao MB, AM Tanksale, MS Ghatgate, VV Deshpande VV. 1998. Molecular and biotechnological aspects of microbial proteases. Microb. Mol. Biol. Revw. 62 : 1092-2172.
S. Li, X Shou, N Zhang , H Liu dan C Ma .2008. Purification and characterisation of cathepsin L2 from dorsal muscle of silver carp (Hypophthalmichthys molitrix). Journal Food Chemestry. Ustadi, KY Kim, SM Kim. 2005. Comperative study on protease inhibitors from egg fish. Journal of
Ocean University of China. Vol 4 (3): 198-204.
Visessanguan W, Benjakul S, An H. 2003. Purification and characterization of cathepsin L in arrowtooth flounder (Atheresthes stomias) muscle. Comparative Biochemistry and Physiology Part B. 134: 477–487.