ISOLASI, KARAKTERISASI, DAN PEMURNIAN ENZIM
POLYPHENOLOXIDASE DARI UDANG VANAME
(Litopenaeus vannamei)
MEDAL LINTAS PERCEKA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis yang berjudul “Isolasi, Karakterisasi, dan Pemurnian Enzim Polyphenoloxidase dari Udang Vaname (Litopenaeus vannamei)” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2015
Medal Lintas Perceka
RINGKASAN
MEDAL LINTAS PERCEKA. Isolasi, Karakterisasi, dan Pemurnian Enzim
Polyphenoloxidase dari Udang Vaname (Litopenaeus vannamei). Dibimbing oleh TATI NURHAYATI dan MALA NURILMALA.
Udang merupakan komoditas perikanan penting di Indonesia. Udang merupakan komoditi yang mudah mengalami kerusakan dan memiliki masa simpan terbatas karena adanya proses melanosis (pembentukan blackspot).
Blackspot merupakan reaksi enzimatik yang disebabkan oleh enzim
polyphenoloxidase (PPO). Pembentukan blackspot pada udang dapat menurunkan harga jual, menurunkan penerimaan konsumen, dan menyebabkan kerugian secara ekonomi. Informasi mengenai PPO dari karapas udang vaname Indonesia belum pernah ada, oleh karena itu tujuan penelitian ini adalah mengisolasi, menentukan karakteristik dan memurnikan enzim polifenoloksidase yang berasal dari karapas udang vaname.
Penelitian ini dilakukan dalam tiga tahap. Tahap pertama yaitu mengekstrak enzim PPO dari karapas udang vaname. Tahap kedua yaitu menentukan karakteristik enzim PPO yang meliputi penentuan suhu optimum, pH optimum, substrat optimum, kinetika enzim, pengaruh inhibitor dan ion logam, serta bobot molekul enzim. Tahap ketiga yaitu melakukan pemurnian enzim PPO yang meliputi pengendapan ammonium sulfat, dialisis, dan kromatografi kolom.
Enzim PPO telah berhasil diisolasi dari karapas udang vaname menggunakan bufer fosfat 0,05 M pH 7,2 (mengandung NaCl 1 M dan Brij-35 0,2%) perbandingan 1:3. Enzim tersebut kemudian diendapkan menggunakan ammonium sulfat 40% dan didialisis selama 8 jam. Pemurnian lebih lanjut dilakukan menggunakan kromatografi filtrasi gel dengan matriks Sephadex-G150. Kelipatan pemurnian enzim menurun setelah proses dialisis.
SUMMARY
MEDAL LINTAS PERCEKA. Isolation, characterization and purification of polyphenoloxidase from white shrimp (Litopenaeus vannamei). Supervised by TATI NURHAYATI and MALA NURILMALA.
White shrimp (Litopenaeus vannamei) is an important fishery commodity. Shrimps are highly perishable product and have limited shelf life due to melanosis (formation of blackspot). Blackspot is an enzymatic reaction mainly associated with polyphenoloxidase (PPO). Blackspot on shrimps has an impact to reduce product market value, consumer acceptability and causes financial lost. However, there is no information of PPO from carapace of white shrimp in Indonesia. Thus, the aims of this research were to isolate, characterize, and purify PPO enzyme from white shrimps carapace.
The study was conducted in three steps. Firstly, extracted of PPO enzyme from white shrimps carapace. The second, characterized PPO including optimal temperature, pH and substrat concentration, enzyme kinetics, effect of inhibitor and metal ions, and molecular weight of the enzyme. The third step, purified PPO including ammonium sulphate precipitation, dialysis and column chromatoghraphy.
PPO has been isolated from carapace of white shrimp by buffer phosphate extraction 1:3 (0.05 M pH 7.2 containing 1 M NaCl and 0.2% Brij-35). PPO was purified by ammonium sulphate precipitation (40% saturation), dyalised for 8 hours, and purified by Sephadex-G150 gel filtration. Purification fold of PPO was decreased after dialysis.
The crude PPO activity was optimal at temperature 35 ºC, pH 6 and L-DOPA concentration 12.5 mM. The Km and Vmax value of the PPO for L-DOPA were 2.35 mM and 38.46 U/mL, respectively. This activity could be inhibited by sodium sulphite, EDTA, Na+, Zn2+, and Fe3+ at concentration 1 and 5 mM. The PPO activity was strongly inhibited by sodium sulphite at concentration 5 mM. Two isoform were detected by zymogram, which the molecular weights of about 302.5 kDa and 337.5 kDa.
©
Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
ISOLASI, KARAKTERISASI, DAN PEMURNIAN ENZIM
POLYPHENOLOXIDASE DARI UDANG VANAME
(Litopenaeus vannamei)
MEDAL LINTAS PERCEKA
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Teknologi Hasil Perairan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas segala Rahmat dan Karunia-Nya sehingga penulisan tesis ini dapat diselesaikan. Judul tesis
ini adalah ”Isolasi, Karakterisasi, dan Pemurnian Enzim Polyphenoloxidase dari Udang Vaname (Litopenaeus vannamei)”. Penelitian ini didanai melalui penelitian Desentralisasi 2014 atas nama Dr Tati Nurhayati, SPi, MSi dengan judul “Isolasi, Pemurnian, dan Karakterisasi Inhibitor Polyphenoloxidase Alami sebagai Penghambat Pembentukan Blackspot pada Udang”
Penulis mengucapkan terimakasih yang sebesar-besarnya kepada:
1. Dr Tati Nurhayati, SPi, MSi dan Dr Mala Nurilmala, SPi, MSi selaku dosen pembimbing yang telah memberikan bimbingan, arahan, dukungan, semangat kepada penulis sehingga penulis dapat menyelesaikan tesis ini.
2. Dr Ir Bustami Ibrahim, MSc selaku dosen penguji luar komisi yang telah memberikan bimbingan dan arahan sehingga penulis mampu menyelesaikan tesis ini.
3. Dr Kustiariyah Tarman, SPi, MSi selaku perwakilan tim gugus kendali mutu yang telah memberikan masukan dan arahan kepada penulis.
4. Kedua orang tua beserta kakak dan adik yang telah memberikan dukungan baik materil maupun spiritual kepada penulis.
5. Teman-teman satu tim penelitian polyphenoloxidase (PPO) yang saya banggakan (Kak Made dan Laela). Terimakasih atas bantuan yang tulus. Laboran yang telah membantu penelitian saya (Mas Ipul, Mba Arini, Mba Dini, Ibu Ika)
6. Keluarga besar mahasiswa sekolah pascasarjana Teknologi Hasil Perairan, yang telah memberikan dorongan semangat baik selama penelitian maupun saat penyusunan tesis ini.
7. Terima kasih penulis sampaikan kepada semua pihak yang telah membantu penyelesaian tesis ini.
8. DIKTI yang telah membiayai penelitian melalui hibah bersaing Penelitian Unggulan Perguruan Tinggi Desentralisasi Tahun 2014
Penulis menyadari bahwa masih terdapat kekurangan dalam penyusunan tesis ini. Oleh karena itu, jika terdapat kesalahan penulis memohon maaf yang sebesar-besarnya. Penulis sangat mengharapkan kritik dan saran yang membangun sehingga bermanfaat untuk penyelesaian tesis ini.
Akhirnya, semoga karya ilmiah ini bermanfaat.
Bogor, September 2015
DAFTAR ISI
Halaman
DAFTAR GAMBAR ix
DAFTAR LAMPIRAN ix
1 PENDAHULUAN 1
Latar Belakang 1
Rumusan Masalah 2
Tujuan 3
2 METODE 4
Waktu dan Tempat 4
Bahan dan Alat 4
Prosedur Kerja 4
Ekstraksi enzim PPO 5
Penentuan suhu optimum 5
Penentuan pH optimum 6
Penentuan substrat optimum dan kinetika enzim 6
Pengaruh ion logam dan inhibitor terhadap aktivitas enzim 6
Pemurnian enzim 6
Analisis 7
Pengukuran aktivitas enzim PPO 7
Pengujian konsentrasi protein 7
3 HASIL DAN PEMBAHASAN 9
Karakterisasi Enzim PPO 9
Penentuan suhu optimum enzim PPO 9
Penentuan pH optimum enzim PPO 10
Penentuan substrat optimum dan kinetika enzim PPO 11
Pengaruh inhibitor dan ion logam terhadap aktivitas PPO 12
Tahap Pemurnian Enzim PPO Udang Vaname 13
Pengendapan amonium sulfat dan dialisis 13
Pemurnian PPO menggunakan kromatografi kolom 15
Kelipatan pemurnian enzim 16
Fraksi aktif PPO 17
4 SIMPULAN DAN SARAN 19
Simpulan 19
Saran 19
DAFTAR PUSTAKA 20
DAFTAR GAMBAR
Halaman
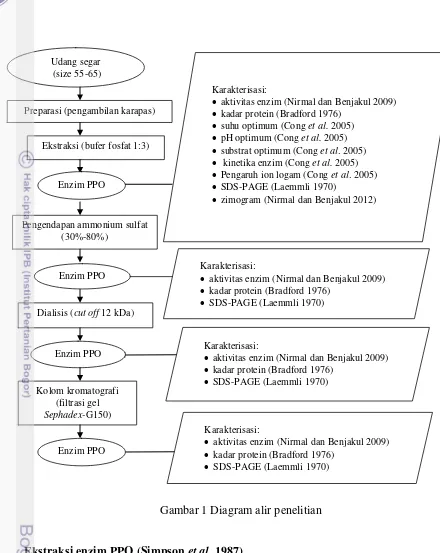
1 Diagram alir penelitian 5
2 Suhu optimum PPO udang vaname (Litopanaeus vannamei) 9 3 pH optimum PPO udang vaname ((Litopanaeus vannamei) 10 4 Konsentrasi substrat optimum PPO udang vaname 11 5 Persamaan Lineweaver-Burk untuk menentukan nilai Km dan Vmaks 11 6 Pengaruh inhibitor dan ion logam terhadap aktivitas PPO vaname;
1 mM, 5mM 12 7 Aktivitas spesifik enzim PPO hasil pengendapan ammonium sulfat;
1 mM, 5mM 14 8 Aktivitas spesifik enzim PPO udang vaname hasil dialisis 15 9 Fraksi enzim PPO hasil pemurnian kromatografi filtrasi gel;
aktivitas enzim, konsentrasi protein enzim 16
10 (A) SDS PAGE PPO vaname; (B) zimogram PPO vaname; M: marker
EK: ekstrak kasar, P: pengendapan (NH4)2SO4, D: dialisis, F3: fraksi 3 18
DAFTAR LAMPIRAN
Halaman
1 Cara membuat larutan 23
2 Pembuatan larutan standar BSA konsentrasi 0,6-2,0 mg/mL 23
3 Contoh perhitungan konsentrasi protein 24
4 Penggunaan softwarePhoto-CaptMw 24
1
1 PENDAHULUAN
Latar Belakang
Udang merupakan sumberdaya perikanan yang memiliki nilai ekonomis penting di seluruh dunia. Udang merupakan komoditas andalan ekspor Indonesia selain tuna, cakalang, tongkol, kepiting serta rumput laut. Udang memiliki posisi yang strategis dalam menopang perekonomian nasional melalui pendapatan devisa negara dan sekaligus meningkatkan kesejahteraan pembudidaya dan masyarakat sekitar lingkungan budidaya udang. Udang menempati posisi pertama baik dari segi volume maupun nilai ekspor hasil perikanan Indonesia. Nilai ekspor komoditi udang mencapai 1,6 juta US$ pada tahun 2013 (KKP 2014).
Udang merupakan komoditi yang mudah mengalami kerusakan. Udang memiliki masa simpan yang terbatas dikarenakan adanya pembentukan melanin atau lebih dikenal sebagai blackspot. Proses ini terjadi secara alami pada saat
postmortem karena adanya polimerisasi komponen fenol menjadi pigmen berwarna hitam yaitu melanin.
Melanin atau blackspot pada udang tidak berbahaya bagi konsumen, akan tetapi dapat mempengaruhi penampakan udang. Penampakan merupakan salah satu atribut yang dinilai konsumen di dalam memilih bahan pangan. Udang merupakan komoditas utama ekspor perikanan Indonesia sehingga dengan adanya
blackspot dapat menurunkan penerimaan konsumen serta nilai pasar sehingga dapat menurunkan devisa negara dan menyebabkan kerugian secara ekonomi.
Pembentukan melanin atau lebih dikenal dengan blackspot disebabkan oleh adanya enzim polyphenoloxidase. Polyphenoloxidase disebut juga phenoloxidase
atau tirosinase (EC.1.14.18.1) yang mengkatalisis hidroksilasi monohidroksifenol (aktivitas monofenolase atau kresolase) dan mengoksidasi o-dihidroksifenol menjadi o-kuinon (aktivitas katekoloksidase dan difenolase). O-kuinon akan bereaksi secara nonenzimatik dengan keberadaan oksigen sehingga membentuk melanin (Kim et al. 2000). Intensitas pembentukan melanin pada berbagai krustasea bervariasi diantara spesies tergantung kepada konsentrasi substrat alami dan konsentrasi enzim di dalam tubuh udang (Benjakul et al. 2005).
Enzim polyphenoloxidase (PPO) disintesis dari ProPPO yang merupakan bentuk tidak aktif (zimogen) dari PPO. ProPPO dapat diakifkan menjadi PPO oleh enzim-enzim protease. Cardenas (1997) menyatakan bahwa ProPO dari Red swamp crayfish dapat diaktivasi oleh tripsin, zymosan A serta lipopolisakarida yang terdapat pada membran luar bakteri gram negatif. Fan et al. (2009) menyatakan bahwa ProPO pada kepiting Charybdis japonica dapat diaktivasi oleh
serin protease, tripsin serta β-1,3 glukan. Sistem ini memainkan peranan penting di dalam sistem pertahanan diri, pengerasan kutikula dan proses penyembuhan luka pada krustasea (Sugumaran dan Nellaiappan 2000).
Berbagai penelitian telah berhasil dilakukan untuk mengisolasi, mengkarakterisasi dan memurnikan enzim PPO pada berbagai krustasea. Enzim PPO telah berhasil diteliti pada Penaeus japonicus, Artemia sinica, Penaeus vannamei, karapas dan jeroan Norway lobster (Nephrops norvegicus),
Parapenaeus longirostris, serta Penaeus monodon (Benjakul et al. 2005; Fan
2
2009; Nurhayati et al. 2015). Enzim PPO dari berbagai krustasea menunjukkan adanya perbedaan karakteristik bobot molekul, pH optimum, suhu optimum serta parameter kinetik. Enzim PPO yang berasal dari spesies yang sama akan tetapi lokasi yang berbeda menunjukkan perbedaan karakteristik.
Udang vaname merupakan komoditas yang menjadi andalan ekspor perikanan Indonesia. Studi tentang enzim PPO penyebab blackspot pada udang vaname yang berasal dari Perairan Indonesia belum pernah dilakukan. Isolasi, karakterisasi, dan pemurnian enzim PPO dari udang vaname sangat penting dilakukan untuk menentukan formula atau cara yang tepat di dalam mengontrol proses pembentukan blackspot udang vaname. Informasi mengenai enzim PPO diharapkan dapat menjadi acuan kedepannya di dalam mengontrol kerja enzim PPO.
Beberapa penelitian telah dilakukan dalam mengkaji manfaat dan aplikasi enzim PPO. Svitel dan Miertus (1998) menyatakan bahwa enzim PPO dapat digunakan sebagai biosensor dalam mengontrol proses bioremediasi komponen fenol yang berasal dari limbah pengolahan minyak dan pengolahan kulit. Yu et al. (2003) menyatakan bahwa biosensor yang digunakan untuk mendeteksi komponen fenol memiliki beberapa kelebihan diantaranya memiliki sensitivitas yang baik, biaya murah, cara kerjanya otomatis dan bisa diaplikasikan di lapangan. Van et al. (2011) menyatakan bahwa enzim PPO dapat digunakan untuk mencegah lipolisis atau degradasi lemak saat pencernaan makanan di dalam rumen sapi sehingga dapat meningkatkan kandungan PUFA pada daging dan susu sapi. Lee et al. (2004) menyatakan bahwa PPO dapat menurunkan laju degradasi lemak ketika diuji secara in vitro. Zhao et al. (2007) menyatakan bahwa PO dapat menghasilkan DHI (5.6-dihidroxyindole) yang berfungsi sebagai antibakteri dan antifungi. Zhao
et al. (2011) menyatakan bahwa enzim PO dapat menghasilkan komponen DHI yang memiliki spektrum luas sebagai anti virus, anti parasit, dan bersifat sitotoksik.
Rumusan Masalah
Udang merupakan komoditas primadona ekspor hasil perikanan Indonesia yang mudah mengalami kerusakan diantaranya pembentukan blackspot. Proses pembentukan blackspot pada udang terjadi secara alami pada saat penanganan dan penyimpanan postmortem. Blackspot merupakan reaksi biokimia yang terjadi karena adanya polimerisasi komponen fenol menjadi melanin oleh enzim
3
Tujuan
4
2 METODE
Waktu dan Tempat
Penelitian ini dilakukan pada bulan Juni 2014 hingga Mei 2015 di Laboratorium Karakteristik Bahan Baku Hasil Perairan, Laboratorium Bioteknologi Hasil Perairan II, Laboratorium Mikrobiologi Hasil Perairan, Laboratorium Biokimia Hasil Perairan, Laboratorium Terpadu Fakultas Perikanan dan Ilmu Kelautan serta Laboratorium Terpadu Fakultas Kedokteran Hewan, Laboratorium Mirobiologi dan Biokimia Hewan Pusat Penelitian Sumberdaya Hayati dan Bioteknologi (PPSHB), Institut Pertanian Bogor.
Bahan dan Alat
Bahan baku utama yang digunakan dalam penelitian ini adalah udang vaname yang diperoleh dari Everfresh Market, Pejompongan, Jakarta Pusat size 55-65. Bahan-bahan lainnya meliputi air deionisasi (Mili Q Water), NaHPO4.2H2O (Merck, Germany), NaH2PO4.4H2O (Merck, Germany), tris base (Merck, Germany), CH3COOH (Merck, Germany), NaCH3COO (Merck, Germany), HCl, NaOH, L-DOPA (Sigma, USA), ammonium sulfat (teknis), kantong dialisis dengan ukuran cut off 12 kDa (Sigma, USA), asam fosfat (Merck, Germany), Bovin Serum Albumin (Sigma, USA), Sephadex G-25, SDS (Merck, Germany), glisin (Merck, Germany), gliserol (Merck, Germany), ammonium persulfat (Sigma, USA), β-merkaptoetanol (Merck, Germany), coomasie brilliant blue (Merck, Germany), metanol (Merck, Germany), spectra multicolor broad range protein (Thermo Scientific, Finland), asam asetat glasial (Merck, Germany), dan bromphenol blue (Merck, Germany). Alat-alat yang digunakan dalam penelitian ini meliputi sentrifuse (J2-21 BECKMAN, Germany), spektrofotometer (Spectro UV-VIS 2500, Germany), pipet mikro (Thermo Scientific Vantaa, Finland), pH meter (Thermo Electron, Finland), kolom kromatografi, serta alat elektroforesis (TV-100 YK, SCIE-PLAS, England).
Prosedur Kerja
5
Gambar 1 Diagram alir penelitian
Ekstraksi enzim PPO (Simpson et al. 1987)
Karapas udang dihaluskan menjadi bubuk. Sampel dicampur dengan bufer fosfat 0,05 M pH 7,2 (mengandung 1 M NaCl dan 0,2% Brij 35) dengan perbandingan 1:3. Campuran diaduk secara kontinu pada suhu 4 ºC selama 30 menit, kemudian disentrifugasi dengan kecepatan 8.000xg pada suhu 4 ºC selama 30 menit menggunakan sentrifuse dingin.
Karakterisasi enzim
Penentuan suhu optimum (Cong et al. 2005)
Penentuan suhu optimum dilakukan dengan melakukan variasi suhu inkubasi. Ekstrak kasar PPO sebanyak 200 µL ditambahkan dengan 1,2 mL
Karakterisasi:
aktivitas enzim (Nirmal dan Benjakul 2009)
kadar protein (Bradford 1976)
aktivitas enzim (Nirmal dan Benjakul 2009)
kadar protein (Bradford 1976)
SDS-PAGE (Laemmli 1970)
Karakterisasi:
aktivitas enzim (Nirmal dan Benjakul 2009)
kadar protein (Bradford 1976)
SDS-PAGE (Laemmli 1970)
Karakterisasi:
aktivitas enzim (Nirmal dan Benjakul 2009)
6
L-DOPA 12,5 mM yang dilarutkan dalam air deionisasi, 800 µL bufer fosfat 0,05 M pH 6 dan 200 µL air deionisasi. Campuran tersebut diinkubasi pada suhu 25, 30, 35, 40, dan 45 ºC selama 3 menit. Campuran yang telah diinkubasi diukur pada panjang gelombang 475 nm.
Penentuan pH optimum (Cong et al. 2005)
Penentuan pH optimum dilakukan dengan melakukan variasi pH bufer yang digunakan. Ekstrak kasar PPO sebanyak 200 µL dicampurkan dengan 1,2 mL
Penentuan substrat optimum dan kinetika enzim (Cong et al. 2005)
Campuran yang terdiri dari enzim, buffer, air deionisasi serta L-DOPA pada konsentrasi 2,5; 5; 7,5; 10; 12,5; 15 mM diinkubasi pada suhu optimum selama 3 menit. Campuran tersebut diukur pada panjang gelombang 475 nm. Parameter kinetik yang meliputi Km dan Vmaks ditentukan menggunakan plot Lineweaver-Burk.
Pengaruh ion logam dan inhibitor terhadap aktivitas enzim (Cong et al.2005) Ekstrak kasar PPO sebanyak 200 µL dicampurkan dengan masing-masing 200 µL sodium sulfit, Na+, Zn2+, Fe3+ serta ethylene diamine tetra acetic acid
(EDTA) yang dilarutkan dalam bufer Tris-HCl 20 mM pH 7,1 untuk memperoleh konsentrasi 1 dan 5 mM. Campuran tersebut diinkubasi pada suhu ruang selama 20 menit. Sebanyak 1,2 mL L-DOPA 12,5 M yang dilarutkan dalam air deionisasi ditambahkan ke dalam campuran. Campuran reaksi diinkubasi selama 3 menit pada suhu optimum yang telah diperoleh sebelumnya. Sampel kemudian diukur pada panjang gelombang 475 nm.
Pemurnian Enzim
Pengendapan dengan ammonium sulfat dan dialisis (Benjakul et al. 2005) Ammonium sulfat ditambahkan ke dalam ekstrak kasar enzim dengan variasi tingkat kejenuhan 30% hingga 80% kemudian didiamkan pada suhu 4 ºC selama satu malam. Larutan yang telah diendapkan selama satu malam disentrifugasi dengan kecepatan 12.500xg suhu 4 ºC selama 30 menit. Pelet yang diperoleh dilarutkan dengan bufer sodium fosfat 0,05 M pH 7, lalu didialisis. Ukuran kantong dialisis yang digunakan adalah 12 kDa. Volume bufer yang berada diluar kantong dialisis adalah 100 kali volume di dalam kantong dialisis. Waktu dialisis divariasikan yaitu selama 4, 8 dan 12 jam. Hasil pengendapan ammonium sulfat dan dialisis terbaik ditentukan berdasarkan aktivitas spesifik enzim tertinggi.
Pemurnian kolom kromatografi (Cong et al. 2005)
7
ditampung sebanyak 3 mL. Aktivitas fraksi enzim diukur menggunakan L-DOPA 12,5 mM dan fraksi yang memiliki aktivitas tertinggi dikumpulkan. Proses pemurnian menggunakan kolom kromatografi filtrasi gel berlangsung pada suhu 4 ºC.
SDS-PAGE (Laemmli 1970) dan Zimogram (Nirmal dan Benjakul 2012) Metode SDS-PAGE yang dikerjakan dalam penelitian ini menggunakan 3% stacking gel dan 12,5% separating gel. Konsentrasi akrilamid yang digunakan adalah 30%. Pewarnaan yang dilakukan adalah pewarnaan coomasie brilliant blue. Ekstrak kasar PPO, hasil pengendapan ammonium sulfat, hasil dialisis, dan PPO murni hasil kromatografi kolom masing-masing dicampurkan dengan bufer sampel 1:1 (v/v). Sampel sebanyak 5 µL dimasukkan ke dalam gel poliakrilamid. Elektroforesis dijalankan secara konstan pada arus 15 mA dan voltase 150 volt menggunakan Mini Protein (SCIE PLAST) selama 3 jam. Deteksi SDS-PAGE dilakukan dengan melepaskan gel hasil elektroforesis dari cetakan dan diukur jarak migrasi bromphenol blue. Pewarnaan gel dilakukan menggunakan 0,125% Coomasie brilliant blue. Proses destaining menggunakan 25% methanol dan 10% asam asetat. Zona enzim akan membentuk pita berwarna biru.
Pengujian zimogram dilakukan dengan cara merendam gel poliakrilamid dalam larutan bufer fosfat yang mengandung 12,5 mM L-DOPA selama 25 menit pada suhu ruang. Zona enzim akan membentuk pita berwarna gelap. Protein marker yang digunakan adalah marker multicolor dengan rentang bobot molekul 10 kDa hingga 260 kDa. Protein marker ini digunakan untuk mengestimasi bobot molekul enzim PPO dari udang vaname.
Analisis
Pengukuran aktivitas enzim PPO (Nirmal dan Benjakul 2009)
Pengukuran aktivitas enzim PPO dilakukan menggunakan substrat L-DOPA. Ekstrak kasar PPO sebanyak 200 µL ditambahkan 1,2 mL L-DOPA 12,5 mM yang dilarutkan dalam air deionisasi, 800 µL bufer fosfat 0,05 M dan 200 µL air deionisasi. Campuran tersebut diinkubasi selama 3 menit pada suhu 35 ºC. Pembentukan dopakrom diamati secara spektrofotometri pada panjang gelombang 475 nm.
Pengujian konsentrasi protein (Bradford 1976)
Konsentrasi protein ditentukan menggunakan metode Bradford dengan
bovine serum albumin (BSA) sebagai standar. Persiapan pereaksi Bradford dilakukan dengan cara melarutkan 10 mg coomasie briliant blue G-250 dalam 5 mL etanol 95%, lalu ditambahkan dengan 10 mL asam fosfat 85% (b/v). Akuades ditambahkan hingga 250 mL jika telah larut sempurna dan disaring dengan kertas saring Whatman 1 sesaat sebelum digunakan.
8
standar Bradford untuk menentukan konsentrasi protein yang terkandung dalam sampel.
Analisis data
9
3 HASIL DAN PEMBAHASAN
Karakterisasi Enzim PPO
Sumber enzim PPO yang digunakan pada penelitian ini adalah karapas udang vaname (Litopenaeus vannamei). Zamorano et al. (2009) menyatakan bahwa aktivitas PPO tertinggi pada udang Penaeus longirostris terdapat pada karapas, yang diikuti oleh eksoskeleton bagian abdomen, cephalothorax, pleopods dan telson. Hal ini juga didukung oleh Montero et al. (2001) yang menyatakan bahwa aktivitas PPO tertinggi pada udang Penaeus japonicus terdapat pada karapas yang diikuti oleh bagian kaudal dan otot. Ekstrak kasar PPO yang telah diisolasi dari bagian karapas kemudian dikarakterisasi. Karakterisasi enzim meliputi penentuan suhu optimum, pH optimum, konsentrasi substrat optimum, pengaruh inhibitor dan ion logam terhadap aktivitas enzim, kinetika enzim, serta bobot molekul.
Penentuan Suhu Optimum Enzim PPO
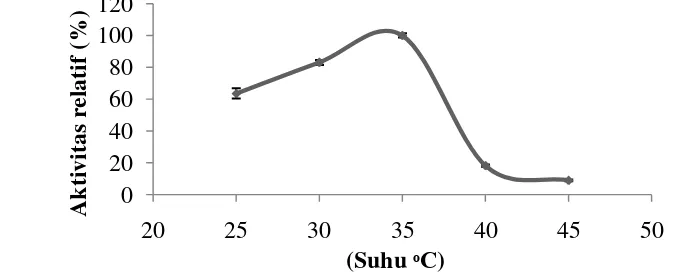
Aktivitas ekstrak kasar PPO vaname mencapai optimum pada suhu 35 ºC (Gambar 2). Aktivitas PPO meningkat seiring dengan meningkatnya suhu sampai mencapai titik optimum. Hal ini diduga karena bertambahnya energi kinetik enzim dan substrat sehingga memperbesar peluang enzim dan substrat untuk bereaksi. Aktivitas PPO menurun drastis setelah melewati suhu optimum. Hal ini diduga karena peningkatan energi termal molekul yang membentuk struktur protein enzim menyebabkan rusaknya interaksi nonkovalen (ikatan hidrogen, ikatan van der walls, ikatan hidrofobik, dan interaksi hidrofobik) yang menjaga struktur tiga dimensi enzim mengalami denaturasi. Denaturasi menyebabkan struktur lipatan protein enzim membuka di bagian permukaannya sehingga sisi aktif enzim berubah dan menyebabkan terjadinya penurunan aktivitas. Peningkatan suhu yang berlebih juga menyebabkan perubahan konformasi substrat enzim PPO (L-DOPA). Suhartono (1989) menyatakan bahwa pada suhu tinggi, substrat mengalami perubahan konformasi sehingga gugus reaktifnya mengalami hambatan dalam memasuki sisi aktif enzim.
Gambar 2 Suhu optimum PPO udang vaname (Litopenaeus vannamei). Hasil penelitian Benjakul et al. (2005) dan Suhandana et al. (2013) menunjukkan bahwa PO udang Penaeus japonicus dan black tiger (Penaeus monodon) aktivitas optimumnya dicapai pada suhu 35 ºC. Zamorano et al. (2009) menyatakan bahwa PPO dari karapas deep water pink shrimp memiliki kestabilan
10
yang tinggi pada suhu (30-35) ºC. Benjakul et al. (2005) menyatakan bahwa PO dari cephalothorax udang Penaeus japonicus tidak stabil pada suhu tinggi. Enzim ini stabil hingga suhu 40 ºC dan kehilangan kestabilannya pada suhu 50 ºC. Pemanasan pada suhu 60 ºC dapat menghilangkan aktivitas PO udang kuruma hingga 78%. Pemanasan 70 ºC dan 80 ºC selama 30 menit dapat menghilangkan aktivitas PO udang Penaeus japonicus.
Suhu optimum berbagai krustasea bervariasi tergantung pada spesies dan lokasi anatominya. Suhu optimum PPO dari karapas udang vaname Indonesia lebih rendah dibandingkan dengan PPO dari karapas tiger prawn (Penaeus japonicus) yang memiliki suhu optimum 40 dan 60 ºC (Montero et al. 2001), PO dari hemosianin whiteleg shrimp yang memiliki suhu optimum 45 ºC (Garcia-Carreno et al. 2008), PO dari hemosianin kepiting Charybdis japonica
yang memiliki suhu optimum 40 ºC (Fan et al. 2009), dan PO dari brine shrimp
(Artemia sinica) yang memiliki suhu optimum 50 ºC (Fan et al. 2011). Perbedaan suhu optimum ini diduga disebabkan oleh perbedaan molekul, spesies, suhu habitat, musim, dan perbedaan kondisi pertahanan tubuh.
Penentuan pH Optimum Enzim PPO
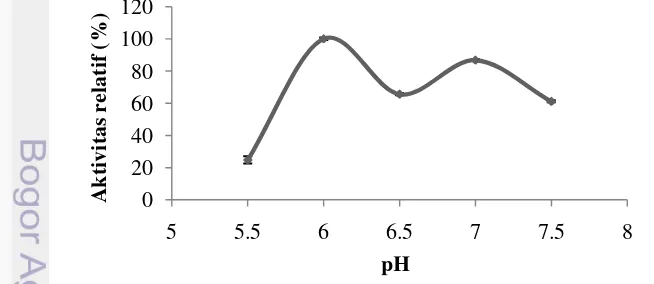
Aktivitas ekstrak kasar PPO udang vaname mencapai optimum pada pH 6 (Gambar 3). Aktivitas PPO mengalami penurunan setelah mencapai titik optimum. Nilai pH akan menentukan konformasi enzim berdasarkan keadaan asam amino pada sisi aktifnya. Pada pH 6 enzim PPO diduga memiliki konformasi yang paling sesuai dengan substratnya membentuk kompleks enzim-substrat yang tepat sehingga dapat menghasilkan produk secara maksimal. Benjakul et al. (2005) menyatakan bahwa pada suasana ekstrim asam maupun ekstrim basa terjadi penurunan ikatan elektrostatik yang menyebabkan terjadinya kehilangan aktivitas. Hasil penelitian menunjukkan terdapat dua puncak aktivitas enzim PPO vaname. Hal ini diduga karena terdapat dua isoform enzim PPO vaname. Hasil penelitian Montero et al. (2001) menunjukkan terdapat dua puncak pH optimum enzim PPO yang diisolasi dari karapas P. japonicus yaitu pH 5 dan pH 8.
Gambar 3 pH optimum PPO udang vaname (Litopenaeus vannamei).
Nilai pH optimum PPO dari karapas udang vaname lebih rendah dibandingkan dengan PO cephalothorax udang P. japonicus yang memiliki pH optimum 6,5 (Benjakul et al. 2005), PO hemosianin whiteleg shrimp memiliki pH optimum 7,6 (Garcia-Carreno et al. 2008); PPO hemosianin kepiting C. japonica
11
tinggi dari PPO karapas deepwater pink shrimp (P. longirostris) yang memiliki pH optimum 4,5. Benjakul et al. (2005) menyatakan bahwa PO cephalothorax udang
P. japonicus stabil pada kisaran pH 3-10. Perbedaan nilai pH optimum diduga disebabkan oleh perbedaan spesies, perbedaan kondisi pertahanan tubuh yang meliputi lingkungan tempat hidup dan invasi patogen.
Penentuan Substrat Optimum dan Kinetika Enzim PPO
Penentuan kinetika enzim yang meliputi Km dan Vmaks dilakukan berdasarkan variasi konsentrasi substrat. Variasi konsentrasi substrat yang dilakukan pada penelitian ini terdiri dari 2,5; 5; 7,5; 10; 12,5; dan 15 mM. Semakin tinggi konsentrasi substrat maka kecepatan enzim semakin meningkat dan pada saat tertentu akan mencapai keadaan konstan. Berdasarkan hasil penelitian, enzim PPO yang menggunakan L-DOPA sebagai substrat spesifiknya mencapai aktivitas maksimum pada saat konsentrasi 12,5 mM (Gambar 4).
Gambar 4 Konsentrasi substrat optimum PPO udang vaname
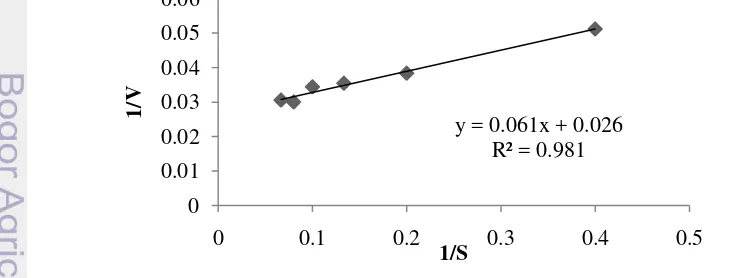
Nilai Km dan Vmaks ditentukan dengan persamaan Lineweaver-Burk dengan membuat grafik 1/[S] sebagai sumbu x dan 1/V sebagai sumbu y (Gambar 5). Berdasarkan persamaan garis tersebut diperoleh nilai Km sebesar 2,35 mM dan Vmaks sebesar 38,46 U/mL. Nilai Km menyatakan tetapan disosiasi kompleks enzim-substrat. Semakin kecil nilai Km menunjukkan kompleks enzim-substrat semakin baik sehingga enzim memiliki afinitas yang tinggi terhadap substrat.
Gambar 5 Persamaan Lineweaver-Burk untuk menentukan nilai Km dan Vmaks Zamorano et al. (2009) menyatakan bahwa nilai Km PO dari karapas udang
12
substrat L-DOPA adalah sebesar 2,90 mM dan tirosin 7,33 mM. Fan et al. (2011) menyatakan bahwa nilai Km PO brine shrimp (A. sinica) yaitu sebesar 4,2 mM untuk substrat L-DOPA dan 10,9 mM untuk katekol. Nirmal dan Benjakul (2012) menyatakan bahwa nilai Km PO dari cephalothorax L. vannamei yang dibudidayakan di Thailand untuk substrat L-DOPA adalah sebesar 2,43 mM. Suhandana et al. (2013) menyatakan nilai Km PPO dari karapas udang black tiger
(P. monodon) untuk substrat L-DOPA adalah sebesar 5,42 mM. Gimenez et al.
(2010) menyatakan bahwa enzim PO dari viscera lobster Norway (N. norvegicus) memiliki afinitas yang lebih tinggi dibandingkan dengan PO dari karapas lobster untuk substrat katekol. Nilai Km PO dari viscera lobster Norway adalah sebesar 5,97 dan karapas sebesar 19,40 mM. Perbedaan nilai Km diduga disebabkan oleh perbedaan metode penangkapan, penanganan serta kondisi penyimpanan.
Pada golongan insekta, enzim PPO diklasifikasikan menjadi 3 golongan yaitu golongan laccase (E.C 1.10.3, p-difenol: O2 oksidoreduktase), golongan
catechol oxidase (E.C.1.10.3.1, difenol: O2 oksidoreduktase) dan golongan tirosinase (E.C.1.14.18.1 monofenol, L-DOPA: O2 oksidoreduktase). PPO golongan tirosinase dapat mengoksidasi monofenol dan difenol, sedangkan golongan laccase dan catechol oxidase menunjukkan afinitas yang tinggi terhadap difenol (Cong et al. 2005).
Pengaruh inhibitor dan ion logam terhadap aktivitas PPO udang vaname PPO merupakan metaloenzim yang mengandung ion Cu pada sisi aktifnya. Enzim ini dapat dihambat menggunakan agen-agen pengkelat logam. Pada penelitian ini, beberapa ion logam termasuk sodium sulfit dan EDTA telah digunakan untuk menentukan efek penghambatan terhadap PPO udang vaname. Ion-ion logam yang digunakan pada penelitian ini adalah Na+, Zn2+ serta Fe3+. Ketiga ion logam tersebut masing-masing mewakili logam dari golongan monovalen, divalen serta trivalen. Konsentrasi sodium sulfit, EDTA dan ion-ion logam yang digunakan adalah 1 dan 5 mM. Sodium sulfit, EDTA, Na+, Zn2+ dan Fe3+ dapat menghambat aktivitas enzim PPO udang vaname. Sodium sulfit pada konsentrasi 5 mM memiliki efek inhibisi paling tinggi pada enzim PPO udang vaname (Gambar 6).
13
Sodium sulfit termasuk ke dalam kategori agen pereduksi. Encarnacion
et al. (2012) menyatakan bahwa senyawa sulfit dapat mengontrol melanosis karena kemampuannya untuk bereaksi dengan intermediet kuinon sehingga membentuk sulfokuinon serta dapat bereaksi secara ireversibel dengan PPO menyebabkan inaktivasi enzim. Penggunaan agen-agen pereduksi merupakan cara yang paling efektif dalam mengontrol browning enzimatik. Penggunaan senyawa sulfit untuk mengontrol browning enzimatik banyak dilakukan oleh industri, akan tetapi penggunaan senyawa tersebut dalam bahan pangan dibatasi. Gomez-Guillen
et al. (2005) menyatakan bahwa senyawa sulfit dapat menghasilkan reaksi alergi pada orang-orang golongan tertentu, khususnya asmatik.
Salah satu inhibitor enzim PPO yang masuk ke dalam kategori GRAS adalah EDTA. Senyawa tersebut merupakan agen pengkelat yang digunakan pada industri pangan sebagai pengawet. Prinsip kerja EDTA dalam menghambat aktivitas PPO adalah dengan cara mengkelat Cu pada sisi aktif enzim sehingga membentuk kompleks yang stabil dengan Cu. Penggunaan EDTA biasanya dikombinasikan dengan inhibitor lainnya untuk mengeliminasi terjadinya browning enzimatik. Kombinasi sodium sulfit dan EDTA 1% biasanya digunakan untuk memperlambat melanosis dan meningkatkan nilai organoleptik pada udang (Kim et al. 2000).
Garam-garam halida dikenal sebagai inhibitor enzim PPO. NaF merupakan inhibitor yang sangat potensial untuk menghambat kerja enzim PPO diikuti oleh NaCl, NaBr, dan NaI. NaCl dan CaCl2 pada konsentrasi 2-4% (b/v) biasa digunakan pada industri pangan untuk mencegah terjadinya browning enzimatik. ZnCl2 merupakan inhibitor browning yang efektif ketika dikombinasikan dengan CaCl2, asam askorbat, dan asam sitrat (Kim et al. 2000). Senyawa FeCl3 dapat menurunkan aktivitas enzim PPO vaname. Hal ini diduga ion Fe3+ berikatan dengan sisi aktif enzim sehingga menyebabkan penghambatan terhadap aktivitas enzim PPO.
Tahap Pemurnian Enzim PPO udang vaname
Pengendapan dengan ammonium sulfat dan dialisis
14
Hasil pengendapan ekstrak kasar enzim PPO menunjukkan dua bagian yang terpisah yaitu pelet dan supernatan. Aktivitas spesifik enzim PPO udang vaname mencapai maksimum pada pengendapan ammonium sulfat 40% yang berasal dari pelet (Gambar 7). Konsentrasi ammonium sulfat 40% merupakan konsentrasi yang tepat sehingga dapat memisahkan protein enzim dari komponen lainnya secara maksimal.
Gambar 7 Aktivitas spesifik enzim PPO hasil pengendapan ammonium sulfat; pelet, supernatan.
Simpson et al. (1987) menyatakan bahwa PO dari karapas udang Penaeus setiferus telah berhasil difraksinasi menggunakan ammonium sulfat 0-40%.
Benjakul et al. (2005) menyatakan bahwa PO dari cephalothorax udang
P. japonicus juga telah berhasil diekstraksi dan difraksinasi menggunakan ammonium sulfat 0-40%. Nirmal dan Benjakul (2012) menyatakan bahwa PPO dari cephalothorax udang putih Pasifik telah berhasil diendapkan menggunakan ammonium sulfat 40%. Hasil penelitian ini berbeda dengan hasil penelitian Zamorano et al. (2009) dan Nurhayati et al. (2015) yang menyatakan bahwa aktivitas terbaik PPO dari deepwater pink shrimp diperoleh melalui pengendapan ammonium sulfat 40-70% dan aktivitas terbaik PPO udang P. monodon diperoleh melalui pengendapan ammonium sulfat 70%.
Tahapan pemurnian enzim PPO dilanjutkan dengan proses dialisis. Dialisis dilakukan dengan tujuan untuk menghilangkan kelebihan garam yang terdapat di dalam protein enzim setelah pemekatan menggunakan ammonium sulfat. Aktivitas spesifik tertinggi PPO udang vaname diperoleh dengan lama waktu dialisis selama 8 jam (Gambar 8). Waktu dialisis 8 jam merupakan waktu terbaik untuk menghilangkan kelebihan garam pada protein enzim setelah pengendapan menggunakan ammonium sulfat. Waktu dialisis lebih dari 8 jam menyebabkan terjadinya penurunan aktivitas. Montero et al. (2001) menggunakan waktu dialisis selama 8 jam untuk pemurnian PO dari udang P. japonicus. Hasil penelitian Benjakul et al. (2005), Nirmal dan Benjakul (2012), serta Nurhayati et al. (2015) menyatakan bahwa PPO dari cephalothorax udang P. japonicus dan L. vannamei
yang dibudidayakan di Thailand didialisis selama 12 jam dan PPO dari udang
15
Gambar 8 Aktivitas spesifik enzim PPO udang vaname hasil dialisis Pemurnian PPO menggunakan Kromatografi Kolom
Kromatografi kolom dapat didefinisikan sebagai sistem pengaliran suatu fluida melalui kolom yang mengandung matriks bahan pengisi dan substansi yang ingin dipisahkan menjadi beberapa komponen dengan adanya perbedaan daya ikat terhadap matriks bahan pengisi. Kolom yang digunakan dapat diisi dengan partikel bahan pengisi yang daya kerjanya digolongkan ke dalam jenis absorpsi, pertukaran ion, filtrasi gel, dan interaksi biokimia. Pemurnian enzim menggunakan kromatografi kolom merupakan cara yang paling efektif dibandingkan dengan semua cara pemisahan yang lainnya (Suhartono 1989).
Jenis kromatografi yang digunakan dalam pemurnian enzim PPO udang vaname adalah filtrasi gel dengan matriks bahan pengisinya Sephadex-G150. Wilson dan Walker (2010) menyatakan bahwa kromatografi filtrasi gel merupakan pemisahan molekul melalui suatu materi berpori. Molekul yang memiliki perbedaan ukuran akan dilewatkan dalam suatu matriks berpori. Pori-pori pada permukaan gel ini cukup kecil sehingga mencegah molekul-molekul besar masuk kedalamnya, tetapi dapat menampung molekul-molekul yang lebih kecil. Molekul yang memiliki ukuran besar akan terelusi lebih dulu dibandingkan dengan molekul yang berukuran kecil. Molekul yang memiliki ukuran kecil akan terelusi lebih lambat dibandingkan dengan molekul yang berukuran besar. Fitrasi gel digunakan untuk memisahkan protein yang mempunyai berat molekul tinggi dari protein atau molekul lain dengan berat molekul yang rendah.
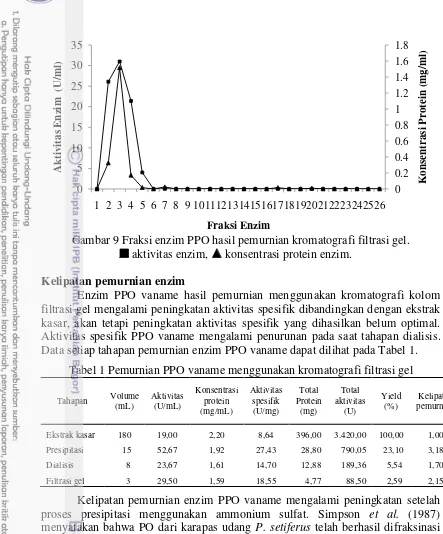
Enzim PPO yang diektrak dari karapas vaname setelah melalui tahap dialisis kemudian dimurnikan menggunakan kromatografi filtrasi gel. Fraksi PPO hasil pemurnian menggunakan kromatografi filtrasi gel disajikan pada Gambar 9. Hasil pemurnian enzim PPO menunjukkan bahwa terdapat tiga fraksi aktif yaitu fraksi 2,3 dan 4. Puncak aktivitas enzim PPO tertinggi terdapat pada fraksi 3 dengan aktivitas 29,5 U/mL. Fraksi 3 mempunyai konsentrasi protein 1,59 mg/mL. Hasil penelitian Nurhayati et al. (2015) menunjukkan bahwa terdapat lima fraksi aktif enzim PPO P. monodon yang dimurnikan dengan kromatografi filtrasi gel yaitu fraksi 5 hingga 9 dan puncak aktivitas tertinggi terdapat pada fraksi 6.
16
Gambar 9 Fraksi enzim PPO hasil pemurnian kromatografi filtrasi gel. aktivitas enzim, konsentrasi protein enzim.
Kelipatan pemurnian enzim
Enzim PPO vaname hasil pemurnian menggunakan kromatografi kolom filtrasi gel mengalami peningkatan aktivitas spesifik dibandingkan dengan ekstrak kasar, akan tetapi peningkatan aktivitas spesifik yang dihasilkan belum optimal. Aktivitas spesifik PPO vaname mengalami penurunan pada saat tahapan dialisis. Data setiap tahapan pemurnian enzim PPO vaname dapat dilihat pada Tabel 1.
Tabel 1 Pemurnian PPO vaname menggunakan kromatografi filtrasi gel
Tahapan Volume
Kelipatan pemurnian enzim PPO vaname mengalami peningkatan setelah proses presipitasi menggunakan ammonium sulfat. Simpson et al. (1987) menyatakan bahwa PO dari karapas udang P. setiferus telah berhasil difraksinasi menggunakan ammonium sulfat 0-40% dengan tingkat kelipatan pemurnian sebesar 2,4. Nirmal dan Benjakul (2012) menyatakan bahwa PPO dari
cephalothorax udang putih Pasifik telah berhasil diendapkan menggunakan ammonium sulfat 40% dengan tingkat kelipatan pemurnian sebesar 2,7. Hasil pengujian menunjukkan bahwa tingkat kelipatan pemurnian PPO udang vaname menunjukkan nilai paling tinggi dibandingkan dengan spesies lainnya.
Kelipatan pemurnian enzim PPO mengalami penurunan setelah proses dialisis yaitu dari 3,18 menjadi 1,70. Montero et al. (2001) menyatakan bahwa dialisis menyebabkan terjadinya penurunan aktivitas enzim karena paling sedikit waktu yang digunakan untuk proses dialisis adalah 8 jam. Penggunaan kolom untuk proses desalting lebih baik dibandingkan dengan dialisis karena dapat
0
1 2 3 4 5 6 7 8 9 1011121314151617181920212223242526
17
mengeluarkan kelebihan garam dalam waktu yang relatif lebih cepat yaitu 5-10 menit.
Kelipatan pemurnian enzim PPO udang vaname mengalami peningkatan menjadi 2,15 setelah dimurnikan lebih lanjut menggunakan kromatografi filtrasi gel. Simpson et al. (1987) menunjukkan kelipatan pemurnian PO dari udang
P. setiferus yaitu 65,6 setelah dimurnikan menggunakan kromatografi afinitas. Hasil penelitian Fan et al. (2011) menunjukkan bahwa PO dari A. sinica
dimurnikan menggunakan kromatografi pertukaran ion Q Sepharose FF dan filtrasi gel Superdex 200, kelipatan pemurniannya meningkat dari 18,73 menjadi 53,87. Nirmal dan Benjakul (2012) menunjukkan kelipatan pemurnian PPO dari
cephalothorax udang putih Pasifik setelah dimurnikan menggunakan kromatografi pertukaran ion DEAE-Sephacel yaitu 83,8.
Kelipatan pemurnian PPO vaname paling rendah dibandingkan dengan spesies lainnya. Hal ini diduga proses pemurnian enzim hanya menggunakan kromatografi filtrasi gel saja sehingga belum optimal. Selain itu, tahapan pemurnian dialisis diduga ikut mempengaruhi nilai kelipatan pemurnian PPO vaname.
Fraksi aktif PPO
SDS-polyacrylamid gel electrophoresis (SDS-PAGE) merupakan metode kualitatif yang umum digunakan untuk pemisahan protein. Metode ini biasanya digunakan untuk mengestimasi bobot molekul protein disamping untuk memonitor pemurnian protein. Sampel yang dianalisis menggunakan SDS-PAGE didenaturasi terlebih dahulu dalam larutan bufer sampel yang mengandung β-merkaptoetanol dan SDS. Merkaptoetanol berfungsi mereduksi jembatan disulfida yang terdapat pada struktur tersier protein. SDS merupakan deterjen anionik yang berfungsi untuk mendenaturasi dan menegatifkan muatan protein (Wilson dan Walker 2010).
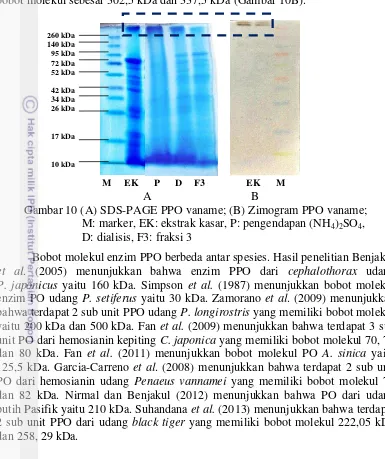
Penentuan bobot molekul dilakukan pada ekstrak kasar, enzim hasil pengendapan ammonium sulfat, hasil dialisis dan fraksi aktif hasil kromatografi kolom filtrasi gel. Hasil pengujian SDS PAGE (Gambar 10A) menunjukkan bahwa enzim PPO masih memiliki banyak pita protein, yang berarti masih terdapat banyak molekul protein yang berasal dari sel maupun protein pengotor lainnya. Pengendapan enzim dengan ammonium sulfat, dialisis maupun pemurnian menggunakan kromatografi kolom filtrasi gel tidak dapat menghilangkan protein pengotor. Hal ini ditandai dengan jumlah pita protein pada setiap tahap pemurnian tidak mengalami pengurangan. Hal ini menunjukkan bahwa proses pengendapan, dialisis maupun kromatografi kolom belum menghasilkan enzim PPO murni. Tingkat kemurnian enzim PPO yang rendah diduga disebabkan oleh fractionation range matriks Sephadex-G150 yang terlalu besar sehingga pemisahan protein enzim dan protein pengotor lainnya kurang sempurna. Wilson dan Walker (2010) menyatakan bahwa matriks yang memiliki fractionation range lebih pendek dapat meningkatkan ketepatan pemurnian.
18
zimogram menunjukkan terdapat dua sub unit enzim PPO vaname yang memiliki bobot molekul sebesar 302,5 kDa dan 337,5 kDa (Gambar 10B).
A B
Gambar 10 (A) SDS-PAGE PPO vaname; (B) Zimogram PPO vaname; M: marker, EK: ekstrak kasar, P: pengendapan (NH4)2SO4, D: dialisis, F3: fraksi 3
Bobot molekul enzim PPO berbeda antar spesies. Hasil penelitian Benjakul
et al. (2005) menunjukkan bahwa enzim PPO dari cephalothorax udang
P. japonicus yaitu 160 kDa. Simpson et al. (1987) menunjukkan bobot molekul enzim PO udang P. setiferus yaitu 30 kDa. Zamorano et al. (2009) menunjukkan bahwa terdapat 2 sub unit PPO udang P. longirostris yang memiliki bobot molekul yaitu 200 kDa dan 500 kDa. Fan et al. (2009) menunjukkan bahwa terdapat 3 sub unit PO dari hemosianin kepiting C. japonica yang memiliki bobot molekul 70, 75 dan 80 kDa. Fan et al. (2011) menunjukkan bobot molekul PO A. sinica yaitu 125,5 kDa. Garcia-Carreno et al. (2008) menunjukkan bahwa terdapat 2 sub unit PO dari hemosianin udang Penaeus vannamei yang memiliki bobot molekul 75 dan 82 kDa. Nirmal dan Benjakul (2012) menunjukkan bahwa PO dari udang putih Pasifik yaitu 210 kDa. Suhandana et al. (2013) menunjukkan bahwa terdapat 2 sub unit PPO dari udang black tiger yang memiliki bobot molekul 222,05 kDa dan 258, 29 kDa.
M EK P D F3 EK M
260 kDa 140 kDa 95 kDa 72 kDa 52 kDa 42 kDa 34 kDa 26 kDa
17 kDa
19
4 SIMPULAN DAN SARAN
Simpulan
Enzim PPO udang vaname memiliki suhu optimum 35 ºC dan pH optimum 6. Konsentrasi L-DOPA untuk memperoleh aktivitas optimum enzim adalah 12,5 mM. Penghitungan kinetika enzim menunjukkan Km enzim PPO sebesar 2,35 mM dan Vmaks 38,46 U/mL. Sodium sulfit, EDTA, Na+, Zn2+, dan Fe3+ dengan konsentrasi 1 maupun 5 mM dapat menurunkan aktivitas enzim PPO. Bobot molekul enzim PPOadalah 302,5 kDa dan 337,5 kDa. Kelipatan pemurnian enzim setelah dimurnikan menggunakan kromatografi filtrasi gel mencapai 2,15 kali. Penggunaan kromatografi pertukaran ion perlu dilanjutkan setelah kromatografi filtrasi gel agar kelipatan pemurnian enzim PPO vaname meningkat.
Saran
20 microgram quantities of protein utilizing the principle of protein dye binding. Analytical Biochemistry. 72:234-254.
Cardenas W dan Dankert JR. 1997. Phenoloxidase specific activity in the red swamp crayfish Procambarus clarkii. Fish and Shellfish Immunology. 7 (5):283-295.
Cong R, Sun W, Liu G, Fan T, Meng X, Yang L, Zhu L. 2005. Purification and caracterization of phenoloxidase from clam Ruditapes philippinarium. Fish and Shellfish Immunology. 18(1):61-70.
Encarnacion AB, Fagutao F, Jintasataporn O, Worawattanamateekul W, Hirono I, Ohshima T. 2012. Aplication of ergothioneine-rich extract from an edible mushroom Flammulina velutipes for melanosis prevention in shrimp,
Penaeus monodon and Litopenaeus vannamei. Food Research
International. 45:232-237.
Fan T, Zhang Y, Yang L, Yang X, Jiang G, Yu M,Cong R. 2009. Identification and characterization of hemocyanin-derived phenoloxidase from the crab
Charybdis japonica. Comparative Biochemistry and Physiology.
152(2):144-149.
Fan T, Jing Z, Fan X, Yu M, Jiang G. 2011. Purification and caracterization of phenoloxidase from brine shrimp Artemia sinica. Acta Biochemistry and Biophysic Science. 43(9):722-728.
Garcia-Carreno FL, Cota K, Toro MAND. 2008. Phenoloxidase activity of hemocyanin in whiteleg shrimp Penaeus vannamei: conversion, characterization of catalytic properties, and role in postmortem melanosis.
Journal of Agricultural and Food Chemistry. 56(15):6454-6459.
Gimenez B, Martinez-Alvarez O, Montero P, Gomez-Guillen MDC. 2010. Characterization of phenoloxidase activity of carapace and viscera from cephalothorax of Norway lobster (Nephrops norvegicus). Food Science and Technology. 43(8):1240-1245.
Gomez-Guillen MC, Martinez-Alvarez O, Llamas A, Montero P. 2005. Melanosis inhibition and SO2 residual levels in shrimp (Parapenaeus longirostris) after different sulfite-based treatments. Journal of the Science of Food and Agriculture. 85:1143-1148.
Kim J, Marshall MR, Wei C. 2000. Polyphenoloxidase. Di dalam: Haard NF, Simpson BK, editor. Seafood Enzymes: Utilization and Influence on Postharvest Seafood Quality. New York (US): Marcel Dekker, Inc.
[KKP] Kementerian Kelautan dan Perikanan. 2014. Kelautan dan Perikanan dalam Angka. Jakarta: Pusat Data, Statistik dan Informasi, Sekretariat Jenderal, Kementerian Kelautan dan Perikanan.
Laemmli UK. 1970. Cleavage of structural protein during the assembly of the heat of bacteriophag T4. Nature. 227(10):680-685.
21
polyphenol oxidase activities. Journal of the Science of Food and Agriculture. 84:1639-1645.
Montero P, Avalos A, Perez-Mateos M. 2001. Characterization of polyphenoloxidase of prawns (Penaeus japonicus). Alternatives to inhibition: additives and high-pressure treatment. Food Chemistry. 75:317-324.
Nirmal NP, Benjakul S. 2009. Effect of ferulic acid on inhibition of polyphenoloxidase and quality changes of pacific white shrimp (Litopenaeus vannamei) during iced storage. Food Chemistry. 116:323-331.
Nirmal NP, Benjakul S. 2012. Biochemical properties of polyphenoloxidase from the cephalothorax of Pacific white shrimp (Litopenaeus vannamei).
International Aquatic research. 4:1-13.
Nurhayati T, Ambarsari L, Suhandana M. 2015. Purification of polyphenoloxidase from black tiger shrimp (Penaeus monodon) from Indonesian water.
International Food Research Journal. In press.
Simpson BK, MR Marshall, WS Otwell. 1987. Phenoloxidase from shrimp (Penaeus setiferus): purification and some properties. Journal of Agricultural and Food Chemistry. 35:918-921.
Sugumaran M, Nellaiappan K. 2000. Characterization of a new phenoloxidase inhibitor from the cuticle of Manduca sexta. Biochemical and Biophysical Research Communications. 268:379-383
Suhandana M, Nurhayati T, Ambarsari L. 2013. Karakterisasi ekstrak kasar enzim
polyphenoloxidase dari udang windu (Penaeus monodon). Jurnal Ilmu dan Teknologi Kelautan Tropis. 5(2):343-354.
Suhartono MT. 1989. Enzim dan Bioteknologi. Bogor (ID): Pusat Antar Universitas Bioteknologi IPB-Depdikbud.
Svitel J, Miertus S. 1998. Development of tyrosinase-based biosensor and its application for monitoring of bioremediation of phenol and phenolic compounds. Journal of Enviromental Science and Technology. 32(6):828-832.
Van Rg, Lee MR, Fievez V. 2011. Red clover polyphenol oxidase and lipid metabolism. Animal. 5(4):512-521.
Wilson K, Walker J. 2010. Principles and Techniques of Biochemistry and Molecular Biology. 7th ed. London (UK): Cambridge Univ Pr.
Yu J, Liu S, Ju H. 2003. Mediator-free phenol sensor based on titania sol-gel encapsulation matrix for immobilization of tyrosinase by a vapor deposition method. Biosensor and Bioelectronics. 19:509-514.
Zamorano JP, Alvarez OM, Montero P, Guillén MdCG. 2009. Characterisation and tissue distribution of polyphenoloxidase of deepwater pink shrimp (Parapenaeus longirostris). Food Chemistry. 112:104-111.
Zhao P, Li J, Wang Y, Jiang H. 2007. Broad-spectrum antimicrobial activity of the reactive compound generated in vitro by Manduca sexta phenol oxidase.
Insect Biochemistry and Molecular Biology. 37:952-959.
22
23
Lampiran 1 Cara membuat larutan a. Cara membuat L-DOPA 12,5 mM
Sebanyak 0,0616 gram L-DOPA dilarutkan menggunakan air deionisasi hingga volumenya 25 mL. Larutan dipanaskan kemudian disimpan dalam botol gelap atau ditutup dengan aluminium foil.
b. Cara membuat bufer natrium fosfat 0,05 M pH 7
Larutan stok Na2HPO41 M dan NaH2PO41 M ditambahkan sedikit demi sedikit ke dalam 230 mL akuades. Pengukuran pH dilakukan selama penambahan kedua bahan tersebut. Penambahan akuades dilakukan hingga volumenya mencapai 250 mL.
c. Cara membuat bufer natrium fosfat 0,05 M pH 7,2 (mengandung NaCl 1 M, Brij 35 0,2%).
Sebanyak 5,84 gram NaCl dan 0,2 gram Brij 35 ditambahkan ke dalam 80 mL akuades. Pengukuran pH dilakukan hingga mencapai 7,2.
d. Cara membuat stok bovine serum albumin (BSA) 2 mg/mL
Bovine serum albumin (BSA) sebanyak 20 mg dilarutkan menggunakan akuades hingga volumenya mencapai 10 mL.
e. Cara membuat pereaksi Bradford
Sebanyak 5 mg coomassie briliant blue dilarutkan menggunakan 2,5 mL etanol 95% dan 5 mL asam fosfat 85%. Penambahan akuades dilakukan ke dalam larutan hingga volumenya mencapai 250 mL. Larutan disaring menggunakan Whatman No 1 sebelum digunakan.
f. Cara membuat Na2HPO4 1 M
Sebanyak 35,49 gram kristal Na2HPO4 dilarutkan menggunakan akuades hingga volumenya mencapai 250 mL.
g. Cara membuat NaH2PO4 1 M
Sebanyak 34,49 gram kristal NaH2PO4 dilarutkan menggunakan akuades hingga volumenya mencapai 250 mL
24
Lampiran 3 Contoh perhitungan konsentrasi protein
y = 0,085x + 0,111 y: absorbansi sampel dan x: konsentrasi protein sampel y = 0,274
�= (0,274−0,111)
0,085 = 1,9176
Jadi konsentrasi protein sampel adalah 1,9176 mg/mL
Lampiran 4 Penggunaan software Photo-CaptMw
y = 0.085x + 0.111 R² = 0.990
0 0.05 0.1 0.15 0.2 0.25 0.3
1 1.5 2 2.5
A
bsorbansi
Konsentrasi protein (mg/ml)
File
Open
Image quantification
Mw result display
Select lane (lane 1 & lane 2) Molecular weight
Lane definition
Modify Separation
Detection
25
Lampiran 5 Komposisi separating gel dan stacking gel SDS PAGE
Komponen Separating gel (12,5%) Stacking gel (3%)
Akrilamid 30% 3,1 mL 0,5 mL
Bufer separating 1,85 mL -
Bufer stacking - 0,65 mL
Akuades 2,4 mL 3,7 mL
SDS 10% 75 µL 50 µL
APS 10% 75 µL 50 µL
26
RIWAYAT HIDUP
Penulis dilahirkan di Kabupaten Garut, Jawa Barat pada tanggal 26 Oktober 1988 dari pasangan Drs. Ahmad Marsuli dan Umi Kulsum. Penulis memiliki dua saudara, yaitu Lady Larasari dan Balada. Penulis memulai jenjang pendidikan formal di SDN leuwidaun 1 (tahun 1995-2001), kemudian melanjutkan pendidikan di SLTPN 2 Garut (tahun 2001-2004). Pendidikan menengah atas ditempuh di SMAN 1 Garut dan lulus pada tahun 2007. Penulis menyelesaikan gelar sarjana di Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor pada tahun 2011.