SELEKSI DAN OPTIMASI PEMURNIAN ENZIM SELULASE
MIKROB DARI LIMBAH MEDIA TANAM
JAMUR MERANG
NUR HASANAH
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Seleksi dan Optimasi Pemurnian Enzim Selulase Mikrob dari Limbah Media Tanam Jamur Merang benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Penelitian ini didanai oleh Pusat Penelitian Biologi LIPI. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2014
Nur Hasanah
ABSTRAK
NUR HASANAH. Seleksi dan Optimasi Pemurnian Enzim Selulase Mikrob dari Limbah Media Tanam Jamur Merang. Dibimbing oleh LAKSMI AMBARSARI dan IWAN SASKIAWAN.
Mikrob selulolitik diperlukan dalam mendegradasi selulosa yang dapat dimanfaatkan lebih lanjut. Penelitian ini bertujuan melakukan seleksi mikrob selulolitik dan optimasi pemurnian aktivitas selulase dari kultur murni jamur yang diisolasi dari limbah media tanam jamur merang. Aktivitas selulase dari 20 nomor kultur murni jamur hasil isolasi diuji secara kualitatif melalui metode pewarnaan merah kongo 0.1% dan diukur indeks selulolitiknya. Tiga kultur murni dengan indeks selulolitik tertinggi, kemudian ditentukan aktivitas selulolitiknya secara kuantitatif dengan metode asam 3,5-dinitosalisilat (DNS). Hasil penelitian menunjukkan bahwa isolat JMF 12 yang memiliki aktivitas spesifik tertinggi, yaitu sebesar 2.7812±0.081 U/mg. Aktivitas selulase optimum diperoleh pada suhu 45°C dan pH 6.0. Pengaruh logam pada aktivitas enzim menunjukkan bahwa kation Zn2+ dan Na+ berfungsi sebagai aktivator dan Ca2+, K+ Co2+, Fe3+, dan Hg2+ sebagai inhibitor. Optimasi pemurnian aktivitas selulase dengan amonium sulfat 30% menghasilkan aktivitas spesifik tertinggi sebesar 7.9446±0.100 U/mg dengan nilai kemurnian 1.3675 kali. Aktivitas spesifik meningkat setelah dilakukan dialisis, yaitu sebesar 10.2483±0.303 U/mg dengan nilai kemurnian 1.7641 kali. Kata kunci : optimasi, pemurnian, seleksi, selulase, selulolitik
ABSTRACT
NUR HASANAH. Selection and Optimization of Microbial Cellulase Enzyme Purification from the Waste of Mushroom Planting Medium. Supervised by LAKSMI AMBARSARI dan IWAN SASKIAWAN.
Cellulolytic microbes necessary to degrade cellulose that can be exploited further. The aim of this study is to screening and optimization of purification microbial cellulolytic activity of pure culture fungi isolated from the spent substrate of mushroom growing media. A twenty number of fungi has been screened for the cellulase activity by determination of cellulolytic index using 0.1% Congo Red stained as well as 3,5-dinitrosalisilat acid (DNS) method for determination of specific activity. The results showed that isolate JMF 12 is the highest cellulolytic specific activity. It was 2.7812±0.081 U/mg. The optimum activity was obtained at 45°C and pH 6.0. Furthermore, the cations Zn 2+ and Na+ were affected as an activator and Ca2+, K+, Co2+, Fe3+, and Hg2+ as an inhibitors of cellulase activity. Cellulase activity with 30 % amonium sulfate is obtained the highest specific activity of 7.9446±0.100 U/mg with a purity value of 1.3675 times. Specific activity of cellulase by dialysis increased the specific activity of 10.2483±0.303 U/mg with a purity value of 1.7641 times.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biokimia
SELEKSI DAN OPTIMASI PEMURNIAN ENZIM SELULASE
MIKROB DARI LIMBAH MEDIA TANAM
JAMUR MERANG
NUR HASANAH
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul Skripsi : Seleksi dan Optimasi Pemurnian Enzim Selulase Mikrob dari Limbah Media Tanam Jamur Merang
Nama : Nur Hasanah NIM : G84100025
Disetujui oleh
Dr Laksmi Ambarsari, MS Pembimbing I
Dr Iwan Saskiawan Pembimbing II
Diketahui oleh
Dr Ir I Made Artika, MAppSc Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Allah SWT atas segala nikmat dan karunia-Nya, sehingga penulis dapat menyelesaikan penelitian dengan baik dan lancar. Tidak lupa pula, shalawat serta salam kepada Nabi Muhammad
Sallallahu ‘Alaih Wasallam, yang berkat jasa beliau manusia bisa mengenal Allah SWT lewat Islam. Penelitian ini dilaksanakan di Laboratorium Biokimia Mikrob Bidang Mikrobiologi, Pusat Penelitian Biologi LIPI dimulai dari bulan Januari 2014 hingga April 2014, dengan judul Seleksi dan Optimasi Pemurnian Enzim Selulase Mikrob dari Limbah Media Tanam Jamur Merang.
Penulis mengucapkan terima kasih kepada kedua orang tua, Rahmat Juarsa dan Sadiah atas doa, kasih sayang dan dukungan yang selalu diberikan. Penulis juga menyampaikan terima kasih dan penghargaan kepada Dr Laksmi Ambarsari, MS dan Dr Iwan Saskiawan selaku pembimbing serta Dra Nunuk Widhyastuti, MSi atas bimbingan dan arahan berikut kritik serta sarannya dalam karya ilmiah ini. Penghargaan dan terima kasih juga penulis ucapkan kepada seluruh dosen dan staf Biokimia IPB atas bimbingannya. Ucapan terima kasih penulis juga sampaikan kepada Ibu Kesi, Teh Eneng, Teh Tri, Teh Ismu, Ka Lusi atas bantuannya. Penulis juga menyampaikan terima kasih kepada Muchammad Fakhruzzaman Al Faisal atas doa, dukungan, dan kesabarannya selama ini. Terima kasih kepada Hani, Anes, Amar, Ola, Uwi, Lia, Sainstek, keluarga Biokimia 47, dan seluruh teman penulis yang tidak terucapkan atas doa, dukungan, dan persahabatannya. Penulis menyadari masih banyak kekurangan dalam penyusunan usulan penelitian ini, maka diharapkan kritik dan saran yang membangun untuk perbaikan dalam penulisan selanjutnya.
Akhir kata penulis berharap semoga apa yang dihasilkan dari penelitian ini membawa manfaat yang sebesar-besarnya bagi peningkatan kualitas penulis dan pembaca dalam ilmu pengetahuan.
Bogor, Agustus 2014
DAFTAR ISI
DAFTAR GAMBAR xi
DAFTAR LAMPIRAN xi
PENDAHULUAN 1
METODE 2
Waktu dan tempat 2
Alat 2
Bahan 2
Prosedur 3
HASIL 6
Mikrob Selulolitik yang Terseleksi melalui Uji Kualitatif dan Uji Kuantitatif 6 Kurva Pertumbuhan dan Produksi Enzim Selulase JMF 12 7
Pengendapan Selulase dengan Amonium Sulfat 8
Optimasi Kerja Enzim Selulase JMF 12 9
PEMBAHASAN 11
Mikrob Selulolitik yang Terseleksi melalui Uji Kualitatif dan Uji Kuantitatif 11 Kurva Pertumbuhan dan Produksi Enzim Selulase JMF 12 14
Pengendapan Selulase dengan Amonium Sulfat 15
Kondisi Optimum Kerja Enzim Selulase JMF 12 17
SIMPULAN DAN SARAN 18
Simpulan 18
Saran 18
DAFTAR PUSTAKA 18
LAMPIRAN 23
DAFTAR GAMBAR
1 Zona bening JMF 6 (a), JMF 11(b), dan JMF 12(c) 6
2 Indeks selulolitik JMF 6
3 Aktivitas spesifik enzim selulase isolat terpilih 7
4 Kurva pertumbuhan dan produksi Isolat JMF 12 8
5 Aktivitas spesifik hasil optimasi persen pengendapan amonium sulfat 8
6 Suhu optimum selulase isolat JMF 12 10
7 Nilai pH optimum selulase isolat JMF 12 10
8 Logam yang mempengaruhi aktivitas selulase isolat JMF 12 11
9 Isolat JMF 12 14
DAFTAR LAMPIRAN
1 Diagram alir penelitian secara umum 23
2 Kurva standar glukosa 24
3 Kurva standar BSA (Bovine Serum Albumin) 24
4 Penentuan indeks selulolitik isolat JMF 25
5 Penentuan aktivitas selulolitik isolat JMF terpilih 26 6 Penentuan kurva pertumbuhan dan produksi isolat JMF 12 28 7 Penentuan optimasi persen pengendapan amonium sulfat 29 8 Penentuan tingkat kemurnian enzim selulase JMF 12 31 9 Penentuan optimasi kerja enzim selulase JMF 12 33
PENDAHULUAN
Indonesia sebagai negara agraris setiap tahunnya menghasilkan limbah pertanian yang sangat melimpah. Limbah pertanian tersebut berupa jerami, tongkol jagung, batang kedelai, dan kulit pisang. Umumnya, limbah hasil pertanian ini masih mengandung sejumlah nutrien, sehingga dapat dikonversi menjadi produk yang memiliki nilai ekonomi seperti kompos, pakan ternak atau digunakan sebagai medium pertumbuhan mikrob (Meryandini 2009). Limbah pertanian tersebut memiliki komponen utama lignoselulosa. Lignoselulosa terdiri atas tiga polimer yaitu selulosa, hemiselulosa, dan lignin (Perez et al. 2002). Hidrolisis sempurna senyawa lignoselulosa sebagian besar menghasilkan glukosa yang merupakan bahan dasar pembuatan bioetanol. Potensi tersebut terkendala oleh sifat dari lignoselulosa yang sulit didegradasi karena struktur kristal dari selulosa yang merupakan komponen utama penyusun lignoselulosa pada tanaman (Koesnandar 2008). Selulosa adalah polimer linier glukosa dengan ikatan β -1,4-glikosidik (Kim et al. 2004). Hidrolisis selulosa menjadi glukosa merupakan proses yang komplek dan dapat dilakukan melalui konversi secara fisik, kimia maupun biologi. Salah satu proses konversi yang banyak diteliti adalah proses konversi biologi secara enzimatik.
Enzim yang dapat mendegradasi selulosa adalah enzim selulase. Enzim
selulase mengkatalisis hidrolisis ikatan β-1,4-glikosidik pada molekul selulosa
sehingga menghasilkan glukosa (Sinatari 2013). Enzim dapat diproduksi oleh kelompok bakteri, kapang maupun khamir (Imas 2009). Mikrob yang umum digunakan untuk menghasilkan enzim selulase adalah Trichoderma reseei (Kodri
et al. 2013). Selain itu juga telah diteliti produksi selulase dari jenis mikrob lain seperti Aspergillus Niger (Julfana et al. 2013), Ganoderma lucidum (Basuni 2008),
Trichoderma viride (Tridasma 2006), Penicillium nalgiovense (Nugraha 2006) dan lain-lain juga menunjukkan adanya kemampuan aktivitas selulolitik dan hemiselulolitik yang tinggi pada proses fermentasi untuk menghasilkan gula (Chandel et al. 2007). Enzim selulase umumnya digunakan dalam berbagai industri seperti bioteknologi makanan, tekstil, kertas, pertanian serta dalam pengembangan penelitian. Umumnya, enzim yang digunakan saat ini masih impor dan mahal.
berupa glukosa, CO2 dan hidrogen yang sangat berguna sebagai zat hara bagi tumbuhan dan organisme tanah lainnya (Oramahi et al, 2003). Jamur memiliki kemampuan untuk menghidrolisis selulosa alami melalui aktivitas selulase yang dimilikinya. Perolehan mikrob selulolitik yang mampu menghasilkan aktivitas selulase yang tinggi menjadi sangat penting untuk tujuan pengomposan limbah organik. Kemampuan enzim selulase dalam menghidrolisis selulosa akan meningkat apabila dilakukan optimasi pemurnian aktivitas selulase. Penelitian ini mengkaji aktivitas enzim selulase dari mikrob untuk pemanfaatan biomassa selulosa yang diisolasi dari limbah media tanam jamur merang dengan 20 nomor isolat, yaitu JMF 1 hingga JMF 20. Pokok bahasan difokuskan pada seleksi secara kualitatif dan kuantitatif aktivitas enzim selulase untuk memilih isolat yang memiliki aktivitas selulase tertinggi dari 20 nomor isolat hasil isolasi dan optimasi pemurnian enzim selulase untuk menentukan kondisi optimum dan meningkatkan aktivitas spesifik enzim selulase. Penelitian ini bertujuan menentukan mikrob yang memiliki aktivitas selulolitik dan optimasi pemurnian aktivitas enzim selulase meliputi, pengendapan dengan amonium sulfat, dialisis, optimasi pH, suhu, dan pengaruh logam terhadap aktivitas selulase.
METODE
Waktu dan tempat
Penelitian ini dilaksanakan pada tanggal 5 Januari sampai dengan 30 April 2014 di Laboratorium Biokimia Mikrob, Lembaga Ilmu Pengetahuan Indonesia,
Cibinong Science Center.
Alat
Alat yang digunakan adalah petridish steril, bunsen, jarum ose, mikropipet Sibata, laminar air flow cabinet OSK CVB-1300M, labu Erlenmeyer Pyrex, labu ukur Pyrex, tabung reaksi IWAKI TE-32 Pyrex , tip, tip steril, tabung Eppendorf, autoklaf Hirayama, neraca analitik AND GR-300, oven Isuzu, eksikator, spektrofotometer UV-VIS 1700 Shimadzu, kuvet Hellma QS 10.00 mm,
microwave Electrofast, vortex SIBATA, lemari pendingin, penangas air memmert EYELA digital waterbath SB-100, inkubator Isuzu, magnetic strirer, botol sentrifus, sentrifus PLC Series, pH meter HM-25G TOADKK, magnetic stirrer, tabung dialisis, shaker dan stopwatch. Adapun perlengkapan pendukung lainnya, yaitu kamera, penggaris, pena, logbook, dan spidol.
Bahan
Bahan yang digunakan pada penelitian ini antara lain 20 isolat jamur dengan kode JMF yang diisolasi dari limbah media tanam jamur merang, PDA (Potato Dextrosa Agar), PDB (Potato Dextrosa Borth), NaOH, Kalium Natrium Tartrat-Tetrahydrat, Carboxy Methyl-Cellulose (CMC), buffer phospat, kertas saring Whatman grade 42, akuades, glukosa, DNS (Dinitro salisilic acid), reagen Bradford, amonium sulfat, natrium klorida dan larutan congo red 0.1%.
Prosedur
Pembuatan Media PDA dan Peremajaan Isolat JMF
Media PDA (Potato Dextrosa Agar) dibuat dari 39 gram serbuk PDA dipanaskan dalam 1 liter akuades. Media disterilisasi pada suhu 121°C selama 15 menit. Sebanyak 20 isolat JMF diremajakan pada media agar miring PDA selama 3 hari pada suhu ruang.
Uji KualitatifSelulolitik (modifikasi Fikrinda et al. 2000)
Seleksi mikrob selulolitik menggunakan media CMC pada cawan petri. Media CMC dibuat dengan mencampurkan 0.4 g CMC, 0.5 g MgSO4.7H2O, 0.03 g KNO3, 1.0 g K2HPO4, 0.0008 g FeSO4.7H2O, 0.08 yeast, 2 gr NaNO3, 18 g agar dan dilarutkan dalam 1 liter akuades. Setelah diinkubasikan 24 jam pada suhu ruang, isolat kemudian ditetesi larutan merah kongo 0.1% (b/v) dan ditambahkan larutan NaCl 1%. Aktivitas selulolitik ditentukan dengan nilai indeks selulolitik yang merupakan nisbah antara diameter zona bening dengan diameter koloni.
Uji KuantitatifSelulolitik (modifikasi Anggarawati 2012)
Campuran reaksi dalam uji kuantitatif adalah 125 l sampel ekstrak kasar
enzim selulase dan 875 l larutan substrat CMC (Carboxy Methyl Celullose) 0.5
% (b/v), campuran tersebut kemudian divorteks hingga homogen dan diinkubasi selama10 menit, kemudian ditambahkan 1 mL DNS (3,5- Di Nitro Salisilic Acid) dan dipanaskan selama 5 menit dalam water bath. Hal ini dilakukan untuk menghentikan reaksi dan DNS dapat bercampur dengan produk glukosa yang terbentuk. Setelah divorteks sampai homogen, absorbansi setiap larutan sampel diukur dengan spektrofotometer UV-Vis pada panjang gelombang ( ) = 540 nm. Nilai absorbansi yang diperoleh diplotkan pada kurva standar untuk mengetahui konsentrasi produk glukosa pada sampel. Satu unit aktivitas enzim selulase
dinyatakan sebagai jumlah mol produk glukosa hasil hidrolisis enzim selulase
tiap satu menit pada kondisi pengujian. Nilai aktivitas selulase ditentukan berdasarkan perhitungan sebagai berikut.
Aktivitas selulase (U/ml) = konsentrasi glukosa sampel x 1000 V.t.BM Aterkoreksi : ((As – Ab) – (Ak – Ab))
Keterangan :
As = Absorbansi sampel Ab = Absorbansi blanko Ak = Absorbansi kontrol V = Volume enzim (125 l)
t = waktu inkubasi BM = Bobot molekul glukosa (180 g/mol) 1000 = konversi dari mmol ke µmol
Pembuatan Kurva Standar Glukosa
Konsentrasi gula dalam kurva standar diukur dengan metode DNS. Pereaksi DNS dibuat dengan melarutkan 1 g DNS (3,5-Di Nitro Salisilic Acid) secara perlahan dalam 20 ml larutan NaOH 2 N dan 50 ml aquadest. Larutan DNS tersebut kemudian ditambah dengan 30 gram K-Na tartrat dan diaduk dengan magnetic stirrer serta ditera dengan aquadest hingga volume akhir 100 ml.
Sebanyak 7 tabung reaksi dimasukkan sebanyak 1 ml larutan standar glukosa glukosa (0.100, 0.125, 0.150, 0.175, 0.200, 0.225, 0.250 mg/ml) dan 1 tabung reaksi dengan 1 mL aquadest sebagai kontrol. Selanjutnya sebanyak l mL reagen DNS ditambahkan pada larutan standar glukosa tersebut. Semua tabung reaksi dipanaskan di dalam water bath selama 5 menit agar terjadi reaksi antara glukosa dengan DNS. Tabung reaksi didinginkan kemudian divorteks, sehingga homogen. Absorbansi tiap larutan diukur dengan spektrofotometer UV-Vis pada = 540 nm, konsentrasi standar glukosa ditunjukkan dengan kurva standar.
Produksi Enzim Selulase pada Media PDB (Potato Dextrosa Broth)
Isolat yang memiliki indeks selulolitik tertinggi diuji aktivitas selulolitiknya secara kuantitatif. Dengan menggunkan cork borer dengan diameter 0,6 cm isolat tersebut dipindahkan ke 200 ml media PDB (Potato Dextrosa Broth) dalam labu Erlenmeyer 300 ml, kemudian diinkubasi selama 4 hari pada suhu 370C dengan kecepatan shaker 120 rpm/menit. Setiap 24 jam diuji nilai aktivitas selulase isolat terpilih. Ekstrak kasar enzim selulase diperoleh dengan melakukan sentrifugasi pada sampel dengan kecepatan 9500 rpm, selama 30 menit, pada suhu 40C. Ekstrak kasar enzim selulase berada pada bagian supernatant, sementara limbah padat sel isolat akan terendap menjadi pelet. Supernatan tersebut, selanjutnya difiltrasi dengan menggunakan kertas saring Whatman grade 42, sehingga diperoleh filtrat jernih yang merupakan ekstrak kasar enzim selulase. Pertumbuhan Isolat JMF 12 (Kusnatul 2002)
Isolat JMF 12 berdiameter 0.6 cm dimasukkan kedalam media PDB (Potato Dextrosa Broth) 200 ml dengan 3 ulangan untuk penentuan bobot kering miselia setiap 24 jam. Kemudian diinkubasi selama 4 hari pada suhu 370C dengan kecepatan shaker 120 rpm/menit. Setiap 24 jam selama 4 hari, dilakukan penentuan bobot kering miselia, yaitu dengan menimbang biomasa sel JMF 12. Setelah diinkubasi, biomasa sel disaring, lalu dikeringkan dengan menggunakan oven pada suhu 800C sampai bobot konstan.
Penentuan Kadar Protein (Bradford 1976)
Pengukuran Kurva Standar. Standar protein yang digunakan adalah
bovine serum albumin (BSA) dengan konsentrasi 0.3-1.00 mg/mL dan menggunakan pelarut NaCl 0.15 M. Sebanyak 20 µl BSA ditambahkan dalam 1 mL larutan Bradford. Reagen Bradford dibuat dengan mencampurkan Coomassie Brilliant Blue G-250 100 mg, etanol 95% 50 ml, asam phospat 85% 100 ml dan akuades hingga 1 liter. Larutan divorteks dan diinkubasi selama 5 menit.
Absorban larutan kemudian diukur pada 5λ5 nm.
Pengukuran Sampel. Sebanyak 20 µl sampel enzim selulase ditambahkan dalam 1 mL larutan Bradford. Larutan tersebut kemudia divorteks dan diinkubasi selama 5 menit pada suhu ruang. Absorban larutan kemudian diukur pada =5λ5 nm.
Pembuatan Blanko. Sebanyak 20 µl NaCl 0.15 M ditambahkan dalam 1 mL lautan Bradford. Larutan divorteks dan diinkubasi selama 5 menit pada suhu ruang. Absorban larutan kemudian diukur pada =5λ5 nm.
Pengendapan Amonium Sulfat (modifikasi Kresnawati 2013).
Selulase diendapkan dengan amonium sulfat dari persen kejenuhan 10% hingga 80%. Sebanyak 50 ml ekstrak enzim diendapkan dengan cara menambahkan amonium sulfat yang telah dihaluskan sedikit demi sedikit sambil diaduk perlahan dengan pengaduk bermagnet sampai mencapai kejenuhan. Semua pekerjaan dilakukan di atas penangas es. Pengadukan dilanjutkan selama 20 menit dan larutan disimpan dalam lemari pendingin selama 2 jam. Endapan yang terbentuk dipisahkan dengan sentrifugasi dan dilarutkan dengan 0.05 M bufer fosfat pH 6.5. Setelah diperoleh optimasi persen kejenuhan, pengendapan dengan amonium sulfat dilakukan dalam jumlah yang besar, yaitu 450 ml ekstrak enzim selulase yang diendapkan selama semalam. Endapan yang terbentuk dipisahkan dengan sentrifugasi dan dilarutkan dengan 0.05 M bufer fosfat pH 6.5. Larutan tersebut kemudian disentrifugasi dan diambil supernatannya. Kejenuhan amonium sulfat yang optimum akan ditunjukkan oleh aktivitas spesifik yang tinggi. Perhitungan jumlah amonium sulfat dihitung berdasarkan rumus sebagai berikut.
Jumlah amonium sulfat (gram/liter) =
Keterangan
S1 : Konsentrasi awal amonium sulfat S2 : Konsentrasi akhir amonium sulfat
NB : Nilai 533 menunjukkan bahwa dibutuhkan 533 gram amonium sulfat per liter untuk membuat larutan jenuh 100%.
Dialisis (modifikasi Kresnawati 2013).
Tabung dialisis (Novagen D-TubeTM Dialyzer Maxi, MWO 6-8 kDa) diisi 2.6 mL selulase hasil pengendapan amonium sulfat. Tabung kemudian direndam dalam buffer phospat 0.01 M yang diletakkan diatas stirer dan disimpan dalam
Cool Room bersuhu 4ºC selama 24 jam.
Kondisi Optimum Kerja Enzim Selulase
Suhu Optimum. Sebanyak 875 l CMC 0.5% dalam larutan buffer phospat 0.05 M pH 6.5 dicampurkan 125 l enzim selulase. Campuran dalam
labu diinkubasi selama 10 menit pada suhu berbeda (25oC, 30oC, 35oC, 40oC, 45oC, 50oC, dan 55oC) dan diuji aktivitasnya dengan metode DNS.
Nilai pH Optimum. Kondisi pH optimum ditentukan dengan cara menyediakan beberapa larutan CMC 0.5% dalam buffer phospat 0.05 M dengan pH berbeda, yaitu 4.50; 5.00; 5.50; 6.00; 6.50; 7.00 dan 7.50. Masing-masing
larutan diambil 875 l dan ditambahkan 125 l larutan enzim kemudian
divorteks lalu diinkubasi 10 menit dan suhu optimum dan diuji aktivitasnya dengan metode DNS.
Pengaruh Logam. Sebanyak 125 l enzim selulase dicampurkan substrat CMC konsentrasi optimum, pH optimum dan suhu optimum, kemudian ditambah dengan senyawa logam CaCl2, NaCl, KCl, CoCl2, FeCl3, ZnCl2, dan HgCl2 dengan konsentrasi 10 mM dan diuji aktivitasnya dengan metode DNS.
HASIL
Mikrob Selulolitik yang Terseleksi melalui Uji Kualitatif dan Uji Kuantitatif
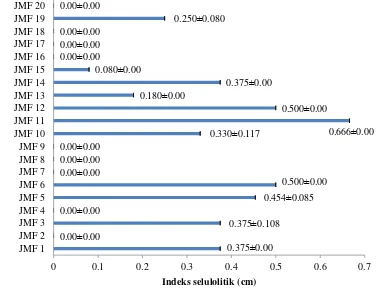
Uji kualitatif 20 nomor isolat jamur dilakukan pada media CMC komplek dan diinkubasi selama 24 jam. Terdapat 11 nomor isolat jamur yang menunjukkan hasil positif terhadap aktivitas selulolitik dan 9 isolat JMF yang tidak menunjukkan adanya aktivitas selulolitik. Zona bening yang dihasilkan dapat dilihat pada Gambar 1. Hasil analisis nilai indeks selulolitik dari 20 isolat jamur tersebut menunjukkan tiga nilai tertinggi dibandingkan dengan isolat lain yang diujikan, yaitu 0.500±0.000 cm, 0.666±0.000 cm, dan 0.500±0.000 cm masing-masing untuk isolat JMF6, JMF 11, dan JMF 12 (Gambar 2).
Gambar 1 Zona bening JMF 6, JMF 11, dan JMF 12
Gambar 2 Indeks selulolitik JMF
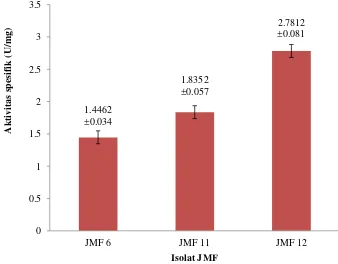
Tiga isolat terpilih dengan nilai indeks selulolitik tertinggi kemudian diuji secara kuantitatif untuk mengetahui aktivitas selulase dengan metode DNS. Penentuan aktivitas selulolitik isolat JMF terpilih terlampir pada Lampiran 5. Nilai aktivitas selulase (U/ml) untuk isolat JMF 6 sebesar 0.4800±0.012 U/ml dengan aktivitas spesifik sebesar 1.4462±0.034 U/mg, isolat JMF 11 memiliki aktivitas sebesar 0.5291±0.015 U/ml dengan nilai aktivitas spesifik sebesar 1.8352±0.057 U/mg dan isolat JMF 12 sebesar 0.7727±0.019 U/ml dengan aktivitas spesifik sebesar 2.7812±0.081 U/mg (Gambar 3). Berdasarkan hasil uji kuantitatif, JMF 12 merupakan isolat jamur yang memiliki aktivitas selulase dan aktivitas spesifik selulase tertinggi dibandingkan dengan isolat lainnya. Isolat tersebut kemudian digunakan dalam tahapan optimasi pemurnian enzim selulase yang dihasilkan.
Gambar 3 Aktivitas spesifik enzim selulase isolat terpilih
Kurva Pertumbuhan dan Produksi Enzim Selulase JMF 12
Kurva pertumbuhan yang dinyatakan dengan bobot kering miselia dan produksi enzim selulase diperlihatkan pada Gambar 4. Bobot kering mengalami peningkatan pada hari ke-1 hingga hari ke-3 dan selanjutnya mengalami penurunan. Aktivitas selulase mengalami peningkatan pada hari ke 1, kemudian mengalami penurunan pada hari selanjutnya. Aktivitas tertinggi sebesar 1.2796±0.115 U/ml pada hari pertama dengan bobot kering sebesar 1.4520±0.048 gram. Selanjutnya nilai aktivitas pada hari kedua sebesar 1.1162±0.057 U/ml dengan bobot kering 1.6222±0.046 gram. Nilai aktivitas pada hari ke-3 sebesar 1.1248±0.152 U/ml dengan bobot kering 2.0384±0.011 gram dan pada hari keempat nilai aktivitas JMF 12 sebesar 1.056±0.042 U/ml dengan bobot kering 1.9793±0.125 gram. Nilai aktivitas enzim selulase tertinggi pada hari ke-1 menunjukkan waktu produksi optimum pada hari ke-1.
Gambar 4 Kurva Pertumbuhan ( ) dan Produksi Isolat JMF 12 ( )
Pengendapan Selulase dengan Amonium Sulfat
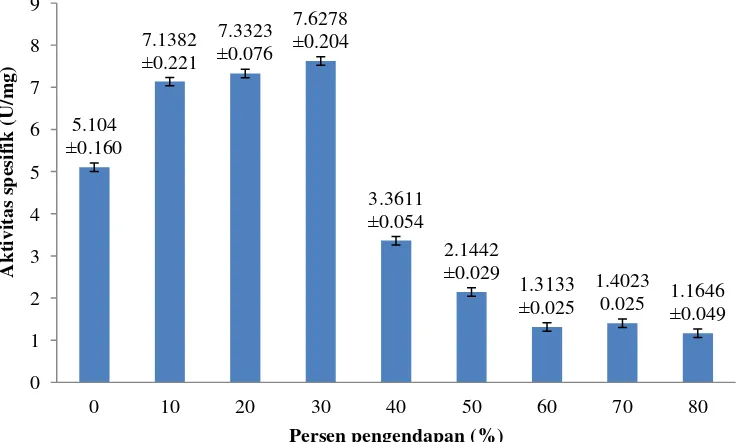
Produksi enzim selulase dilakukan dengan menumbuhkan mikrob penghasil selulase tertinggi dalam penelitian ini, yaitu JMF 12 pada media PDB 200 mL selama 1 hari inkubasi. Tahapan pemurnian pertama untuk meningkatkan aktivitas enzim selulase dari isolat JMF 12 dalam penelitian ini adalah dengan mengendapkan larutan enzim dengan amonium sulfat. Penentuan persen pengendapan dengan amonium sulfat optimum dilakukan pada penelitian ini dari amonium sulfat 10% hingga 80% (Lampiran 7). Hasil optimasi persen pengendapan dari 10% hingga 80% menunjukkan konsentrasi amonium sulfat pada 30% yang memiliki aktivitas spesifik tertinggi dibandingkan persen pengendapan lainnya, yaitu sebesar 7.6278±0.204 U/mg (Gambar 5).
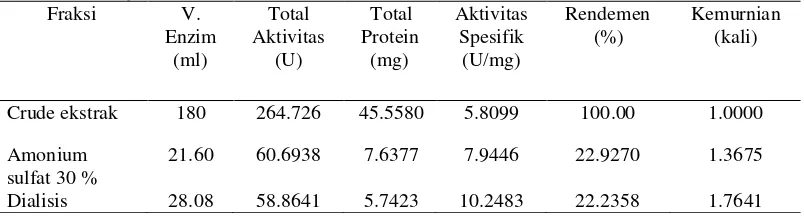
Ekstrak kasar enzim yang diperoleh sebesar 180 mL dengan nilai aktivitas selulolitiknya sebesar 1.4707±0.040U/ml dengan total aktivitas 264.7260 U dan kadar proteinnya adalah 0.2531±0.003 mg/ml dengan total kadar protein sebesar 45.5580 mg. Total aktivitas diperoleh dengan menghitung seluruh aktivitas dari volume enzim yang dihasilkan. Nilai aktivitas spesifik sebesar 5.8099±0.137 U/mg. Nilai rendemen yang diperoleh adalah 100% dengan nilai kemurniannya adalah 1 kali. Tahap pemurnian selanjutnya adalah dengan menggunakan amonium sulfat, berdasarkan hasil optimasi persen pengendapan pada ekstrak kasar selulase, nilai aktivitas spesifik tertinggi diperoleh pada persen pengendapan 30% amonium sulfat. Volume yang digunakan dalam pengendapan protein dengan amounium sulfat adalah 21.6 ml. Nilai aktivitas yang diperoleh dari tahap pemurnian dengan pengendapan larutan kasar enzim menggunakan amonium sulfat diperoleh sebesar 2.8099±0.004 U/ml dengan total aktivitas sebesar 60.6938 U. Kadar protein pada fraksi 30% sebesar 0.3536±0.003 mg/ml dengan total kadar protein sebesar 7.6377 mg. Nilai aktivitas spesifik setelah enzim diendapkan oleh amonium sulfat sebesar 7.9446±0.100 U/mg. Nilai rendemen yang diperoleh adalah 22.9270 % dengan nilai kemurniannya adalah 1.3675 kali.
Setelah dilakukan pengendapan protein dengan menggunakan amonium sulfat dilakukan dialisis yang bertujuan menghilangkan ion-ion garam. Nilai aktivitas selulolitik setelah dialisis sebesar 2.0963±0.030 U/ml dengan total aktivitas sebesar 58.8614 U. Kadar protein setelah dialisis adalah 0.2045±0.004 mg/ml dengan total kadar protein sebesar 5.7423 mg. Nilai aktivitas spesifik sebesar 10.2483±0.303 U/mg. Rendemen yang diperoleh dari hasil dialisis sebesar 22.2358 % dengan tingkat kemurnian 1.7641 kali. Tingkat kemurnian enzim selulase dari JMF 12 disajikan pada Tabel 1.
Tabel 1 Tingkat kemurnian enzim selulase dari isolat JMF 12
Fraksi V.
Optimasi Kerja Enzim Selulase JMF 12
Suhu Optimum
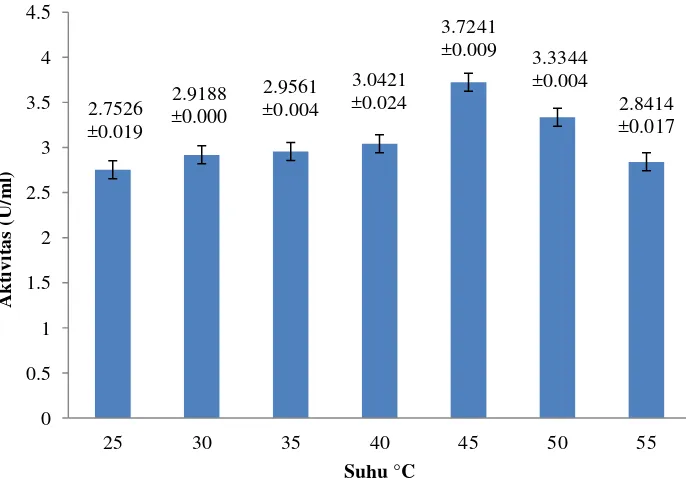
Gambar 6 menunjukkan pengaruh suhu terhadap aktivitas selulase. Pada suhu 25°C sampai 45°C, aktivitas selulase mengalami peningkatan, yaitu pada suhu 25°C sebesar 2.7526±0.019 U/ml, suhu 30°C sebesar 2.9188±0.000, suhu 35°C sebesar 2.9561±0.004 U/ml, suhu 40°C sebesar 3.0421±0.024 U/ml, hingga suhu 45°C sebesar 3.7241±0.009 U/ml dan menurun pada suhu 50-55°C, yaitu pada suhu 50°C sebesar 3.3344±0.004 U/ml, suhu 55°C sebesar 2.8414±0.017 U/ml. Aktivitas optimum diperoleh pada suhu 45°C dengan nilai aktivitas tertinggi.
Gambar 6 Suhu optimum selulase isolat JMF 12
Nilai pH Optimum
Gambar 7 menunjukkan pengaruh pH terhadap aktivitas selulase. Nilai pH antara pH 4.5 hingga 6.0 aktivitas selulase mengalami peningkatan, yaitu pada pH 4.5 sebesar 1.6578±0.021 U/ml, pH 5.0 sebesar 2.2367±0.013 U/ml, pH 5.5 sebesar 2.3199±0.019 U/ml, hingga pH 6.0 nilai aktivitas sebesar 3.3917±0.008 U/ml dan mengalami penurunan pada pH 6.5 sebesar 2.5721±0.004 U/ml, pH 7.0 sebesar 1.8871±0.008 U/ml, hingga 7.5 sebesar 0.7723±0.017 U/ml. Aktivitas tertinggi diperoleh pada pH 6.0 sebagai pH optimum.
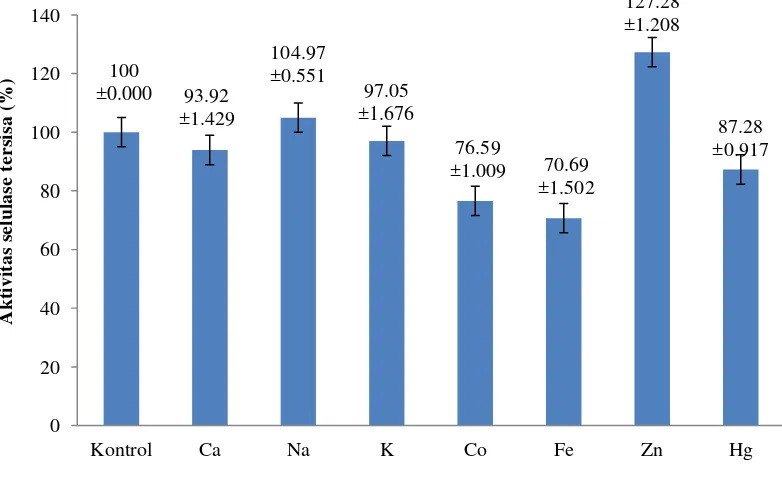
Logam yang Mempengaruhi Aktivitas Selulase
Pengaruh ion logam terhadap aktivitas selulase ditunjukkan pada Gambar 8. Hasil menunjukkan bahwa penambahan kation Na+ dan Zn2+ meningkatkan aktivitas, sedangkan Co2+, Ca2+, K+, Fe3+ dan Hg2+ menghambat aktivitas selulase.
Gambar 8 Logam yang mempengaruhi aktivitas selulase isolat JMF 12
PEMBAHASAN
Mikrob Selulolitik yang Terseleksi melalui Uji Kualitatif dan Uji Kuantitatif
Tahap pewarnaan dilakukan dalam media agar CMC selama 60 menit. Dalam selang waktu ini, pewarna merah Kongo akan mendeteksi zona yang mampu dihidrolisis oleh selulase. Prinsip pewarnaan ini adalah zat pewarna akan berdifusi ke dalam media agar dan hanya akan diabsorbsi oleh rantai panjang polisakarida yang memiliki ikatan β-D-glukan (Zhang et al. 2006). Setelah itu, kelebihan pewarna merah Kongo dibilas dengan larutan garam NaCl 1 % sebagai pencuci. Pencucian dengan larutan NaCl akan membuat zona hasil hidrolisis selulase akan tampak lebih jelas. Uji kualitatif terhadap 20 isolat jamur yang diisolasi dari limbah media jamur merang menunjukkan bahwa terdapat 11 nomor isolat yang mempunyai zona bening dan 9 isolat yang tidak menghasilkan zona bening. Zona bening yang diamati dikonversi menjadi nilai indeks selulolitik uji kualitatif dalam seleksi. Indeks selulolitik diperoleh dari nilai perbandingan antara diameter zona bening dan diameter zona koloni. Zona bening menunjukkan
zona tempat terputusnya ikatan β-1,4-glikosidik yang menghubungkan
monomor D-glukosa pada CMC (Hartanti 2010). Hal ini menunjukkan bahwa isolat yang memiliki zona bening merupakan isolat yang memiliki kemampuan dalam mendegradasi selulosa.
Berdasarkan hasil penelitian, diketahui bahwa isolat dari limbah media tanam jamur merang memiliki potensi menghasilkan enzim selulase untuk
menghidrolisis ikatan β-1,4-glikosidik pada CMC. Selulase yang digunakan
untuk proses hidrolisis ini bersifat ekstraseluler. Sifat enzim ekstraseluler terlihat dari zona bening yang terbentuk di sekitar koloni. Merah kongo
berinteraksi kuat dengan ikatan β-1.4-glikosidik. Metode ini dipilih karena proses
seleksi dapat berlangsung cepat, mudah, dan sensitif. Pewarnaan dengan merah kongo dapat menentukan mikrob selulolitik dalam konsentrasi selolusa yang rendah pada substrat dan dapat mempersingkat waktu inkubasi (Teather dan Wood 1982). Berbagai jenis selulase diperlukan dalam mendegradasi sempurna struktur selulosa yang kompleks (Yang et al. 2006). Hasil uji kualitatif berdasarkan penelitian ini, yaitu isolat JMF 1, JMF 3, JMF 5, JMF 6, JMF 10, JMF 11, JMF 12, JMF 13, JMF 14, JMF 15, dan JMF 19 memiliki aktivitas selulase karena mempunyai nilai indeks selulolitik, akan tetapi indeks selulolitik dari setiap 11 nomor isolat tersebut berbeda, hal tersebut menandakan bahwa terdapat perbedaan dari masing-masing isolat JMF dalam menghasilkan enzim selulase dalam menghidrolisis selulosa pada medium CMC. Kemampuan jamur dalam mendegradasi CMC dapat mendukung pertumbuhan miselia jamur dikarenakan bentuk selulosa yang lebih sederhana sehingga mudah untuk dihidrolisis oleh jamur (Ezekiel 2010). Uji degradasi dengan menggunakan metode zona bening adalah uji semi-kuantitatif, karena data yang diperoleh berupa perbandingan antara diameter zona bening dan diameter koloni yang terbentuk. Zona bening yang terbentuk terkait dengan kelarutan dari enzim selulase (Mustika et al. 2013). Berdasarkan nilai indeks selulolitik dari 11 nomor isolat JMF yang positif adanya aktivitas selulase dipilih 3 nomor Isolat JMF yang memiliki indeks selulolitik tertinggi diantaranya adalah isolat JMF 6, JMF 11, dan JMF 12. Kemudian isolat tersebut diuji secara kuantitatif dan diuji kadar protein menggunakan metode Bradford.
penelitian ini menggunakan substrat CMC. Substrat CMC merupakan substrat selulosa murni yang berbentuk amorphous sehingga aktivitas enzim selulase pada substrat CMC merupakan aktivitas enzim endo-1,4-β-glukanase (Lynd et al. 2002). Endo-1,4-β-glukanase bekerja pada rantai dalam CMC menghasilkan oligosakarida atau rantai selulosa yang lebih pendek (Lynd et al. 2002).
Kurva Pertumbuhan dan Kurva Produksi Selulase dari Isolat JMF 12
Setiap mikroorganisme mempunyai kurva pertumbuhan. Kurva pertumbuhan fungi mempunyai beberapa fase, yaitu fase lag, fase akselerasi, fase eksponensial, fase deselerasi, fase stasioner, dan fase kematian. Fase lag, yaitu fase penyesuaian sel- sel dengan lingkungan dan pembentukan enzim-enzim untuk menguraikan substrat. Selanjutnya, fase akselerasi yang merupakan fase mulainya sel-sel membelah dan fase lag menjadi fase aktif. Fase eksponensial merupakan fase perbanyakan jumlah sel yang sangat banyak, aktivitas sel sangat meningkat dan fase ini merupakan fase yang penting bagi kehidupan fungi. Pada fase eksponensial dapat memanen enzim-enzim. Fase selanjutnya adalah fase deselerasi, yaitu waktu sel mulai kurang aktif membelah. Selanjutnya, fase stasioner merupakan fase jumlah sel yang bertambah dan jumlah sel yang mati relatif seimbang. Fase terakhir adalah fase kematian yang merupakan jumlah sel-sel yang mati lebih banyak daripada sel-sel-sel-sel yang masih hidup (Gandjar et al. 2006).
Tahapan pembuatan kurva pertumbuhan bertujuan mengetahui pola pertumbuhan jamur sejak fase adaptasi hingga fase kematian sel berdasarkan perhitungan bobot kering miselium atau biomassa (Gandjar et al. 2006). Gambar 9 menunjukkan isolat JMF 12 yang dikultivasi pada media PDA. Hasil kurva pertumbuhan dalam media PDB menunjukkan bahwa media ini mampu mensuplai nutrisi bagi pertumbuhan sel jamur dengan baik. Pembuatan kurva pertumbuhan JMF 12 diketahui berdasarkan bobot kering (gram) miselia yang ditimbang setiap hari sampai hari ke empat. Bobot kering miselia yang ditimbang hingga stabil menunjukkan hasil bahwa dari hari pertama hingga hari ke tiga terjadi peningkatan gram miselia dan pada hari ke empat bobot kering miselia mengalami penurunan. Penurunan tersebut disebabkan nutrisi yang dibutuhkan oleh mikrob sudah mencapai jumlah relatif sedikit, sehingga tidak dapat mensuplai nutrisi untuk pertumbuhan mikrob.
Produksi enzim selulase dilakukan dengan menggunakan media PDB. Penggunaan media PDB dalam produksi enzim selulase menunjukkan adanya produksi enzim selulase. Aktivitas enzim selulase yang dihasilkan dapat ditingkatkan dengan menambahkan substrat pada media produksi enzim. Kurva produksi selulase didapatkan berdasarkan nilai aktivitas selulase dari hari pertama hingga hari ke empat. Kurva produksi selulase isolat JMF 12 menunjukkan bahwa hari pertama adalah waktu optimum produksi enzim selulase oleh JMF 12. Nilai aktivitas enzim selulase pada hari pertama sebesar 1.2796±0.115 U/ml. Nilai aktivitas enzim selulase pada hari ke dua sebesar 1.1162±0.057 U/ml. Nilai aktivitas selulase hari ke tiga sebesar 1.1248±0.152 U/ml dan hari ke empat sebesar 1.0560±0.042 U/ml. Waktu optimum produksi enzim digunakan sebagai waktu panen enzim.
Pengendapan Selulase dengan Amonium Sulfat
Pemanfaatan enzim selulase secara luas perlu didasarkan pada keefektifan aktivitasnya spesifiknya. Hal ini terkait optimasi pemurnian enzim selulase yang harus dikembangkan agar enzim selulase dapat bekerja secara optimal. Hal tersebut mendasari perlu dilakukannya pemurnian dengan pengendapan enzim oleh garam untuk meningkatkan aktivitas spesifik enzim. Penelitian ini, menggunakan garam amonium sulfat untuk pemurnian enzim selulase. Optimasi persen kejenuhan dilakukan untuk mengetahui konsentrasi optimum yang menghasilkan aktivitas selulase spesifik tertinggi dari persen pengendapan yang dilakukan. Hasil optimasi persen pengendapan yang dilakukan dapat dilihat pada Gambar 5. Berdasarkan hasil optimasi persen pengendapan garam amonium sulfat, aktivitas selulase tertinggi diperoleh pada pengendapan 30%, yaitu 2.7841±0.021 U/ml dengan aktivitas spesifik tertinggi sebesar 7.6278±0.204 U/mg. Hasil ini sesuai dengan penelitian yang dilakukan oleh Sinatari (2013), aktivitas spesifik selulase tertinggi berada pada fraksi 20-40% amonium sulfat.
Pengendapan enzim selulase dengan konsentrasi garam amonium sulfat 10% hingga 20 % belum dapat mengendapkan enzim selulase secara keseluruhan atau protein masih mengalami salting in, hal ini dibuktikan dari aktivitas selulase yang rendah. Ketika salting in, ion garam yang dihasilkan pada konsentrasi garam rendah akan melindungi molekul protein dan mencegah bersatunya molekul protein sehingga protein masih banyak yang larut dan enzim banyak yang terbuang pada saat pemisahan. Pengendapan pada konsentrasi 30% garam amonium sulfat dapat mengendapkan sebagian besar enzim selulase (salting out). Ketika salting out, ion garam yang dihasilkan akan meningkatkan muatan listrik disekitar protein yang mengakibatkan tertariknya mantel air dari protein, sehingga terjadi interaksi hidrofobik dan menurunkan kelarutan protein tersebut.
protein terdiri atas bagian asam amino hidrofobik dan bagian asam amino hidrofilik. Bagian asam amino hidrofilik dari protein berinteraksi dengan molekul air sehingga protein yang mengandung asam amino hidrofilik akan larut dalam air, sedangkan protein yang mengandung asam amino hidrofobik akan mengendap terlebih dahulu (Sinatari et al. 2013). Penggunaan garam amonium sulfat digunakan untuk pengendapan enzim selulase, karena garam ini memiliki beberapa keuntungan, yaitu mudah larut, tidak toksik, dan stabil terhadap enzim karena tidak mempengaruhi struktur proteinnya. Proses pengendapan enzim selulase dengan garam amonium sulfat ditambahkan dalam bentuk kristal halus, hal ini bertujuan agar volume sampel tidak bertambah terlalu besar. Penambahan garam amonium sulfat dilakukan secara perlahan dan sambil diaduk dengan magnetic stirrer yang berfungsi agar kontak antara protein dengan garam dapat berlangsung baik. Suhu yang dingin sekitar 4°C digunakan juga pada saat pengendapan protein yang bertujuan menjaga agar protein yang terendapkan tidak mengalami kerusakan (Kristanti 2001).
Larutan kasar enzim memiliki banyak pengotor sehingga memiliki nilai aktivitas spesifik yang kecil, pada penelitian ini aktivitas spesifik larutan kasar enzim sebesar 5.8099±0.137 U/mg dengan kadar protein sebesar 0.2531±0.003 mg/ml dan aktivitas sebesar 1.4707±0.040 U/ml. Menurut penelitian Basuni (2008), aktivitas selulase yang dihasilkan sebesar 116.72 U/ml. Hal ini menunjukkan nilai aktivitas yang dihasilkan dalam penelitian ini masih rendah. Aktivitas spesifik dihitung dari perbandingan nilai aktivitas selulase dengan kadar protein. Kadar protein diukur menggunakan metode Bradford. Penentuan kadar protein dihitung berdasarkan persamaan garis y = 0.7957x + 0.0229 (Lampiran 3). Nilai limit deteksi kurva standar BSA sebesar 0.0516. Data yang didapatkan dalam penelitian ini dapat digunakan karena diatas nilai limit deteksi kurva standar BSA. Tingkat kemurnian larutan kasar enzim adalah 1 kali dengan nilai rendemen sebesar 100 %. Tingkat kemurnian diperoleh perbandingan aktivitas spesifik pemurnian dengan aktivitas spesifik larutan kasar enzim. Nilai rendemen enzim diperoleh berdasarkan dari perbandingan total aktivitas enzim yang dimurnikan dengan total aktivitas larutan kasar enzim. Aktivitas spesifik merupakan unit enzim yang terkandung dalam miligram protein. Setelah dilakukan amonium sulfat, nilai aktivitas spesifik meningkat menjadi 7.9446±0.100 U/mg pada 30% pengendapan amonium sulfat dengan kadar protein sebesar 0.3536±0.003 mg/ml dan aktivitas sebesar 2.8099±0.004 U/ml. Tingkat kemurnian setelah dilakukan amonium sulfat meningkat, menjadi 1.3675 kali dengan rendemen sebesar 22.9270 %. Hal ini disebabkan tahapan pemurnian dengan mengendapkan enzim selulase menggunakan amonium sulfat pada 30 % dapat meningkatkan aktivitas spesifik dari enzim selulase, sehingga tingkat kemurnian dari enzim bertambah. Aktivitas spesifik dapat meningkat disebabkan oleh berkurangnya kadar protein dari larutan enzim.
penurunan protein pada sampel dialisis dapat disebabkan oleh adanya beberapa protein yang hilang selama proses dialisis. Ukuran pori-pori kantung selofan adalah 10 kDa (kilo Dalton). Adanya protein yang keluar dari kantong selofan diduga protein yang memiliki ukuran yang lebih kecil dibandingkan pori-pori kantung selofan. Tabung dialisis memiliki membran semipermeabel yang memungkinkan senyawa berukuran lebih kecil dari 10 kDA dapat keluar dari membran. Menurut penelitian Gang et al. (2010), bobot molekul enzim selulase yang dihasilkan dari Trichoderma reesei dan Aspergillus niger
berkisar antara 18-120 kDa. Hal ini menunjukkan bahwa dimungkinkan enzim selulase tertahan pada tabung dialisis. Mekanisme pemurnian dengan metode dialisis adalah adanya konsentrasi garam yang lebih pekat dalam kantung selofan dibandingkan konsentrasi garam diluar kantung mengakibatkan garam yang ada dalam kantung akan keluar dan digantikan dengan larutan bufer hingga mencapai keseimbangan yaitu konsentrasi garam di dalam kantung dan diluar sama. Teknik pemurnian dialisis dilakukan tiga kali penggantian bufer, hal ini bertujuan agar ion garam amonium sulfat dapat dikeluarkan dari dalam sampel secara maksimal.
Kondisi Optimum Kerja Enzim Selulase JMF 12
Suhu Optimum
Beberapa parameter yang mempengaruhi aktivitas enzim adalah suhu, pH, dan pengaruh logam (Bintang 2010). Penelitian ini, dalam upaya mengoptimalkan aktivitas selulase maka setelah didapatkan enzim hasil pengendapan amonium sulfat, dilakukan optimasi yang meliputi suhu, pH, dan pengaruh adanya logam. Enzim dalam melakukan reaksinya dipengaruhi oleh suhu. Setiap enzim memiliki kisaran suhu tertentu untuk mencapai aktivitas yang optimum. Faktor suhu terhadap aktivitas enzim sangat kompleks, karena adanya peningkatan suhu dapat meningkatkan kecepatan reaksi enzim hingga mencapai aktivitas optimum dan disisi lain peningkatan suhu dapat mempercepat inaktivasi enzim. Gambar 6 menunjukkan aktivitas selulase yang dipengaruhi oleh suhu. Rentang pengaruh suhu terhadap aktivitas enzim selulase yang diujikan dimulai dari 25°C hingga 55°C selama 10 menit.
merubah struktur lipatan enzim. Stuktur enzim akan terbuka dibagian permukaan sehingga sisi aktifnya berubah dan aktivitas enzim mengalami penurunan (Hames dan Hooper 2005). Setiap enzim bekerja lebih baik dalam kondisi tertentu dari pada kondisi yang lain, Karena kondisi optimal dapat mendukung bentuk paling aktif dari molekul enzim tersebut (Murray et al. 2009).
Nilai pH Optimum dengan aktivitas enzim selulase sebesar 3.3917±0.008 U/ml. Menurut penelitian Febriana (2010), selulase bekerja pada pH mendekati netral, yaitu antara 6 hingga 7. Peningkatan aktivitas selulase sebelum mencapai aktivitas optimum disebabkan adanya interaksi antara H+ dari lingkungan dengan residu asam amino yang terletak pada sisi aktif enzim. Interaksi tersebut menyebabkan peningkatan keadaan ionisasi sisi aktif enzim. Hal ini menyebabkan sifat katalitik enzim untuk mengikat substrat meningkat. Ketika mencapai pH optimum, keadaan ionisasi berada pada keadaan yang tepat sehingga aktivitas enzim mencapai nilai tertinggi. Aktivitas enzim pada pH yang basa mengalami penurunan karena interaksi antara OH- dari lingkungan dengan residu asam amino akan menurunkan sifat katalitik enzim dan menyebabkan enzim terdenaturasi (Nelson dan Cox 2005).
Logam yang Mempengaruhi Aktivitas Selulase
Enzim membutuhkan koenzim dan kofaktor untuk meningkatkan sifat katalitiknya. Ion logam merupakan kofaktor yang dibutuhkan enzim untuk mengaktivasi kompleks substrat dengan enzim (Bintang 2010). Sebagai kofaktor ion logam dapat berperan sebagai aktivator atau inhibitor enzim. Ion logam akan mengikat substrat pada sisi pemotongan. Ion logam juga dapat menstabilkan konformasi aktif enzim (Baehaki et al. 2008). Hasil penelitian menunjukkan, enzim, merubah konstanta keseimbangan reaksi enzimatis, merubah muatan listrik, menghambat ion inhibitor, dan menukar ion yang kurang efektif pada sisi aktif enzim atau substrat. Penurunan aktivitas enzim terjadi karena ion logam bertindak sebagai inhibitor. Hasil penelitian menunjukkan Co2+, Ca2+, K+, Fe3+ dan Hg+ menghambat aktivitas selulase. Kekuatan ion logam akan mempengaruhi konformasi dari enzim. Ion Cu2+ dan Hg2+ bertindak sebagai inhibitor irreversibel yang membentuk ikatan kovalen dengan gugus prostetik di sisi aktif enzim (Bintang 2010). Hampir semua enzim dapat dihambat oleh senyawa kimia tertentu misalnya ion logam, senyawa pengkelat, senyawa organik, bahkan substrat enzim itu sendiri (Lehninger 2004).
SIMPULAN DAN SARAN
Simpulan
Isolat terpilih hasil seleksi secara kualitatif dan kuantitaif yang memiliki nilai aktivitas selulase dan aktivitas spesifik tertinggi adalah isolat JMF 12 dengan nilai sebesar 0.7727±0.019 U/ml dan 2.7812±0.081 U/mg serta waktu produksi selulase JMF 12 optimum terjadi pada hari ke-1, yaitu sebesar 1.2796±0.115 U/ml. Optimasi pemurnian untuk meningkatkan aktivitas spesifik enzim selulase isolat JMF 12 melalui pengendapan amonium sulfat 30% menghasilkan aktivitas spesifik sebesar 7.9446±0.100 U/mg dengan nilai kemurnian sebesar 1.3675 kali. Tahapan pemurnian melalui dialisis menghasilkan aktivitas spesifik sebesar 10.2483±0.303 U/mg dengan nilai kemurnian sebesar 1.7641 kali. Selain itu, enzim selulase dari isolat JMF 12 optimum pada suhu 45ºC, pH 6 dan adanya pengaruh kation Zn2+ dan Na+ sebagai aktivator serta pengaruh kation Ca2+, K+ Co2+, Fe3+, dan Hg2+ sebagai inhibitor terhadap aktivitas selulase JMF 12. Optimasi pemurnian dapat mempengaruhi kemampuan enzim dalam meningkatkan aktivitas spesifik enzim.
Saran
Peningkatkan aktivitas spesifik dan untuk memperoleh karakter protein enzim selulase yang sudah diisolasi diperlukan penelitian lebih lanjut dengan melakukan produksi enzim selulase menggunakan induser substratnya. Selain itu, perlu dilakukan pemurnian lebih lanjut, menentukan parameter kinetika enzim, elektroforesis SDS PAGE, amobilisasi selulase, dan identifikasi isolat.
DAFTAR PUSTAKA
Alam M, Manchur M, Anwar M. 2004. Isolation, purification, characterization of cellulolytic enzymes produced by the isolate Streptomyces omiyaencis.Pakist J Biol Sci. 7(10): 1647-1653.
Anggarawati D. 2012. Aktivitas enzim selulase isolat SGS 2609 BBP4B-KP menggunakan substrat limbah pengolahan rumput laut yang dipretreatment dengan Asam [skripsi]. Depok (ID): Universitas Indonesia.
Anindyawati. 2009. Prospek enzim dan limbah selulosa untuk produksi bioetanol.
Bioteknologi. 44 (1): 49-56.
Baehaki A, Maggy T, Nurheni S, Tati N. 2008. Purifikasi dan karakterisasi protease dari bakteri patogen Pseudomonas aeruginosa. Jurnal. Teknol Dan Industri Pangan. 19 (1): 80-87.
Bradford MM. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding . Anal Biochem. 72: 248-254.
Chandel A, Chan E, Rudravaram, Narasu M, Rao, Ravindra. 2007. Economics and environmental impact of bioethanol production technologies: an appraisal. Biotechnology and Molecular Biology Review. 2 (1): 14-32. Dashtban M, Maki M, Leung K T, Mao C, Qin W. 2010. Cellulase activities in
biomass conversion: measurenment method and comparison. Critical Reviews in Biotechnology. 1-8.
Ezekiel C, Odebode A, Omenka R, Adesioye F.A. 2010. Growth response and comparative cellulase induction in soil fungi grown on different cellulose media. Acta ATECH. 3(2): 52-59.
Febriana R. 2010. Optimasi aktivitas selulase ekstraseluler dari isolat bakteri RF-10 [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Fikrinda, Anas I, Purwadaria T, Santosa D. 2000. Isolasi dan seleksi bakteri penghasil selulase ekstremofil dari ekosistem air hitam. Mikrobiologi Indonesia. 5 (2): 48-53.
Gandjar I, Sjamuridjal W, Oetari A. 2006. Mikologi Dasar dan Terapan. Jakarta : Yayasan Obor Indonesia.
Gang Hu, John A. Heitmann, Jfr., Orlando J. Rojas, Joel J. Pawlak, Dimitris S. Argyropoulos. 2010. Monitoring cellulase protein adsorption and recovery using SDS-PAGE. Ind. Eng. Chem. Res. 49: 8333–8338.
Hames D, Hooper N. 2005. Biochemistry. New York: Taylor & Francis Group. Ed ke-3.
Harisha S. 2007. Biotechnology Procedures and Experiments Handbook. Kanada: Infinity Sci Pr.
Harvey D. 2000. Modern Analitycal Chemistry. Singapore (SG): McGraw-Hill. Haryati T., Marbun P.A., Purwadaria T. 2010. Preservasi selulase Bacillus
pumilus PU4-2 dengan teknik imobilisasi pada pollard dan penambahan kation. Mikrobiol Indonesia. 15(1): 63-71.
Imas T. 2009. Mikrobiologi Esensial. Jakarta: Ardy Agency.
Julfana R, Anita T, Idiawati N. 2013. Hidrolisis enzimatik selulosa dari ampas sagu menggunakan campuran selulase dari Trichoderma reesei dan
Aspergillus niger. JKK. 2 (1): 52-57.
Kim K.H. Jeong, J.S. Ham, C.B. Yang, I.B. Chung, M.K. Kim, K.N. Kim, J. Compost Sci. 2004. Isolation and characterization of cellulase secreting bacterium from cattle manure: application to composting. Compost Science & Utilization. 12: 242-248.
Kodri, Dwi B, Yulianingsih R. 2013. Pemanfaatan enzim selulase dari
Trichoderma reesei dan Aspergillus niger sebagai katalisator hidrolisis enzimatik jerami padi dengan pretreatment microwave. Bioproses Komoditas Tropis. 1 (1).
Koesnandar H, Nurhayati N. 2008. Recent development in the bioconversion of lignocelluloses into ethanol, Microbiology Indonesia. 2(3): 101-102. Kresnawati L. 2013. Purifikasi parsial dan karakterisasi β-Galaktosidase dari
isolat bakteri asam laktat (BAL) strain B134 [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Kristanti ND. 2001. Pemurnian Parsial dan Karakterisasi Lipase Ekstraseluler dari Kapang R. oryzae TR 32 [tesis]. Bogor (ID): Program Pascasarjana Ilmu Pangan, Institut Pertanian Bogor.
Kusnatul R. 2002. Pertumbuhan miselium jamur tiram abu-abu (Pleurolus sajor-ca/u) pada medium TEB (Tauge Extract Broth) yang dimodifikasi dengan berbagai konsentrasi sukrosa [thesis]. Semarang (ID): Universitas Diponegoro.
Lee Y. 2008. Purification and characterization of cellulase produced by Bacillus amyoliquefaciens DL-3 utilizing rice hull. Bioresource Technology. 99: 378–386.
Lehninger A. 2004. Principle of Biochemistry. Dasar-dasar Biokimia. Thenawidjaja Penerjemah. Jakarta : Erlangga. Jilid 1.
Lynd L, Paul J, Willem H, Isak. 2002. Microbial cellulosa utilization: fundamentals and biotechnology. Micro. Mol. Bio. Rev. 66:506-577. Meryandini A, Widosari W et al. 2009. Isolasi bakteri selulolitik dan karakterisasi
enzimnya. Makara Sains. 13 (1): 33-38.
Munifah I. 2013. produksi dan karakterisasi enzim selulase dari limbah pengelola rumput laut. Teknologi Pengelolaan Limbah. 16: 221-228.
Murray R, Granner D, Rodwell V. 2009. Biokimia Harper. Edisi ke 27. Jakarta: ECG.
Mustika R, Martina A, Leni B, Zul D, Ramadhan N. 2013. Isolasi dan seleksi jamur selulolitik dari tanah gambut di perkebunan karet Desa Rimbo Panjang kabupaten kampar Riau. Lampung, Indonesia.
Nelson D L, Cox M M. 2005. Principles of Biochemistry. New York: W.H Freeman and Company. Ed ke-4.
Nugraha R. 2006. Produksi enzim selulase oleh Penicillium nalgiovense SS240 pada substrat tandan sawit [skripsi]. Bogor (ID): Institut Pertanian Bogor. Oramahi H, Darmadji P, Haryadi. 2003. Optimasi kadar asam dalam asap cair dari
kayu karet dengan RSM [skripsi]. Yogyakarta (ID) : Universitas Gadjah Mada.
Perez J, Munoz , Rubia T, Martinez J. 2002. Biodegradation and biological treatments of cellulose, hemicelluloses and lignin: an overview. Int Microbiol. 5:53-63.
Purwadaria T, Marbun P, Arnold, Ketaren P. 2003. Perbandingan aktivitas enzim selulase dari bakteri dan kapang hasil isolasi dari rayap. JITV. 8(4).
Scopes RK. 1993. Protein Purification. New York: RR Doneley and Sons.
Sinatari, Aminin, Sarjono. 2013. Pemurnian selulase dari isolat KB kompos termofilik desa Bayat Klaten menggunakan fraksinasi amonium sulfat. Chem Info. 1: 130-140.
Sunandar B. 2010. Budidaya Jamur merang. Jakarta: Balai Pengkajian Teknologi Pertanian Jawa Barat.
Teather RM, Wood PJ. 1982. Use of congo red-polysaccharide interactions in enumeration and characterization of cellulolytic bacteria from the bovine rumen. Appl Environ Microbiol. 43(4):777-780.
Tridasma E. 2006. Produksi selo-oligosakarida dari fraksi selulosa tongkol jagung oleh selulase Trichoderma viride [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Yang Y, Biedendieck R, Wang W, Gamer M, Malten M, Jahn D, Deckwer. 2006. High yield recombinant penicillin G amidase production and export into the growth medium using Bacillus megaterium. Microb Cell Fact. 20(10):1-8
Yuanita L, Aline P, Suzana S, Sri H, Farid A, Arif B. 2005. Isolasi, pemurnian dan karakterisasi fitase Bacillus subtilis dari Holiwood Gresik. Berk Penel Hayati. 12:113-119.
Yusak Y. 2004. Pengaruh suhu dan pH buffer asetat terhadap hidrolisis CMC oleh enzim selulase dari ekstrak Aspergillus niger dalam media campuran onggok dan dedak. Sains Kimia. 8 (2): 35-37.
Zhang Y-HP, Himmel ME, Mielenz JR. 2006. Outlook for cellulase improvement: screening and selection strategies. Biotechnol Adv. 24: 452–4.
Lampiran 1 Diagram alir penelitian secara umum Kultivasi 20 nomor isolat JMF
Seleksi mikrob selulolitik
Uji kualitatif
Uji kuantitatif
Optimasi pemurnian aktivitas isolat terpilih
Pengendapan amonium sulfat
Dialisis
Optimasi suhu
Optimasi pH
Pengaruh logam Indeks
selulolitik
Lampiran 2 Kurva standar glukosa
Konsentrasi [mg/ml] Absorbansi
0.100 0.299
0.125 0.372
0.150 0.514
0.175 0.590
0.200 0.660
0.225 0.757
0.250 0.838
Lampiran 3 Kurva standar BSA (Bovine Serum Albumin)
Konsentrasi [mg/ml] Absorbansi
0.3 0.276
0.5 0.417
0.6 0.484
0.8 0.649
0.9 0.744
1.0 0.830
y = 3.6186x - 0.0575 R² = 0.9926
0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9
0.075 0.1 0.125 0.15 0.175 0.2 0.225 0.25
Abs
o
rba
ns
i
Lampiran 3 Kurva standar BSA (Bovine Serum Albumin)
Lampiran 4 Penentuan indeks selulolitik isolat JMF Nama
Isolat
Diameter Hifa (cm) Diamter Zona
Bening (cm)
26 Lampiran 5 Penentuan aktivitas selulolitik isolat JMF terpilih
Nama
Isolat Ulangan Absorbansi
sampel
Absorbansi terkoreksi = Absorbansi sampel – absorbansi kontrol = 0.174 – 0.155
= 0.019
Persamaan garis kurva standar glukosa adalah Y = 3.6186 x - 0.0575 Konsentrasi glukosa mg/ml = Absorbansi terkoreksi + 0.0575
Lampiran 5 Penentuan aktivitas selulolitik isolat JMF terpilih
= 0. 0211 mg/ml x FP = 0. 0211 mg/ml x 5 = 0.1057 mg/ml
Aktivitas U/ml = konsentrasi glukosa sampel x 1000 V.t.BM = 0.1057 mg/ml x 1000
0.125 mL. 10 menit. 180 g/mol = 0.4697 U/ml
Persamaan garis kurva standar BSA adalah Y = 0.7957 x + 0.0229 Kadar protein mg/ml = Absorbansi terkoreksi – 0.0299
0.7957 = 0.287 - 0.0299 0.7957 = 0.3319 mg/ml Aktivitas spesifik U/mg = Aktivitas U/ml
Kadar protein mg/ml = 0.4697 U/ml
0.3319 mg/ml = 1.4462 U/mg
Lampiran 6 Penentuan kurva pertumbuhan dan produksi isolat JMF 12 Hari
ke Ulangan Asampel Akontrol Aterkoreksi
Lampiran 8 Penentuan tingkat kemurnian enzim selulase JMF 12
Total aktivitas (U) = Volume enzim (ml) x Aktivitas (U/ml) = 180 x 1.4707
= 264.764 U
Total kadar protein (mg/ml) = Volume enzim (ml) x Kadar protein (mg/ml) = 180 x 0.2531
= 45.5580 mg
Lampiran 8 Penentuan tingkat kemurnian enzim selulase JMF 12
Aktivitas spesifik (mg/ml) = Total aktivitas (U)
Total kadar protein (mg/ml) = 264.764 U
45.5580 mg = 5.8107 U/mg
Rendemen (%) = Total aktivitas enzim pemurnian Total aktivitas enzim kasar = 60.6938
264.726 = 22.9270 %
Kemurnian (kali) = Aktivitas spesifik enzim pemurnian Aktivitas spesifik enzim kasar = 7.9465
5.8107 = 1.3675 kali
Lampiran 9 Penentuan optimasi kerja enzim selulase JMF 12 Perlakuan
Suhu
A sampel A control Aterkoreksi Glukosa(mg/ml) Aktivitas (U/ml)
Rata-rata ± SD
1 2 3 1 2 3 1 2 3 1 2 3 1 2 3
25 0.556 0.555 0.553 0.292 0.291 0.293 0.264 0.264 0.260 0.6219 0.6219 0.6141 2.7641 2.7641 2.7297 2.7526±0.019
30 0.587 0.586 0.585 0.305 0.304 0.303 0.282 0.282 0.282 0.6567 0.6567 0.6567 2.9188 2.9188 2.9188 2.9188±0.000
35 0.588 0.587 0.586 0.301 0.301 0.300 0.287 0.286 0.286 0.6664 0.6644 0.6644 2.9618 2.9532 2.9532 2.9561±0.004
40 0.585 0.579 0.584 0.287 0.286 0.286 0.298 0.293 0.298 0.6876 0.6780 0.6876 3.0564 3.0134 3.0564 3.0421±0.024
45 0.599 0.598 0.599 0.224 0.223 0.222 0.375 0.375 0.377 0.8366 0.8366 0.8405 3.7184 3.7184 3.7356 3.7241±0.009
50 0.498 0.496 0.495 0.167 0.166 0.165 0.331 0.330 0.330 0.7515 0.7495 0.7495 3.3401 3.3315 3.3315 3.3344±0.004
55 0.466 0.467 0.465 0.193 0.192 0.194 0.273 0.275 0.271 0.6393 0.6432 0.6354 2.8414 2.8586 2.8242 2.8414±0.017
Perlakuan pH
A sampel A kontrol A terkoreksi Glukosa (mg/ml) Aktivitas (U/ml)
Rata-rata ± SD
1 2 3 1 2 3 1 2 3 1 2 3 1 2 3
4.5 0.321 0.322 0.324 0.188 0.187 0.186 0.133 0.135 0.138 0.3685 0.3723 0.3781 1.6378 1.6550 1.6808 1.6578±0.021
5.0 0.345 0.345 0.344 0.142 0.141 0.143 0.203 0.204 0.201 0.5039 0.5058 0.5000 2.2396 2.2482 2.2224 2.2367±0.013
5.5 0.366 0.364 0.369 0.155 0.153 0.154 0.211 0.211 0.215 0.5194 0.5194 0.5271 2.3084 2.3084 2.3428 2.3199±0.019
6.0 0.401 0.402 0.403 0.065 0.065 0.065 0.336 0.337 0.338 0.7612 0.7631 0.7650 3.3831 3.3917 3.4003 3.3917±0.008
6.5 0.399 0.398 0.399 0.157 0.156 0.158 0.242 0.242 0.241 0.5793 0.5793 0.5774 2.5749 2.5749 2.5663 2.5721±0.004
7.0 0.376 0.378 0.376 0.214 0.215 0.215 0.162 0.163 0.161 0.4246 0.4265 0.4226 1.8871 1.8957 1.8785 1.8871±0.008
7.5 0.345 0.344 0.347 0.315 0.311 0.313 0.030 0.033 0.034 0.1692 0.1750 0.1770 0.7522 0.7780 0.7866 0.7723±0.017
Lampiran 8 Penentuan optimasi kerja enzim selulase JMF 12
Perlakuan logam
A sampel A control A terkoreksi Glukosa (mg/ml) Aktivitas (U/ml) Aktivitas
Rata-rata ± SD
Rerata aktivitas tersisa %
1 2 3 1 2 3 1 2 3 1 2 3 1 2 3
Kontrol 0.331 0.332 0.331 0.209 0.208 0.207 0.122 0.124 0.124 0.3472 0.3511 0.3511 1.5432 1.5604 1.5604 1.5547±0.009 100±0.000
Ca 0.335 0.333 0.332 0.221 0.222 0.22 0.114 0.111 0.112 0.3317 0.3259 0.3278 1.4744 1.4486 1.4572 1.4601±0.013 93.92±1.429
Na 0.342 0.345 0.344 0.211 0.211 0.212 0.131 0.134 0.132 0.3646 0.3704 0.3665 1.6206 1.6464 1.6292 1.6321±0.013 104.97±0.551
K 0.330 0.329 0.328 0.210 0.211 0.212 0.120 0.118 0.116 0.3433 0.3394 0.3356 1.5260 1.5088 1.4916 1.5088±0.017 97.057±1.676
Co 0.225 0.224 0.223 0.143 0.144 0.142 0.082 0.08 0.081 0.2698 0.2659 0.2679 1.1993 1.1821 1.1907 1.1907±0.008 76.59±1.009
Fe 0.219 0.216 0.214 0.147 0.145 0.146 0.072 0.071 0.068 0.2505 0.2485 0.2427 1.1133 1.1047 1.0789 1.0990±0.017 70.69±1.502
Zn 0.401 0.403 0.400 0.229 0.228 0.229 0.172 0.175 0.171 0.4439 0.4497 0.4420 1.9731 1.9989 1.9645 1.9788±0.017 127.28±1.208
Hg 0.276 0.278 0.276 0.176 0.176 0.177 0.100 0.102 0.099 0.3046 0.3085 0.3027 1.3541 1.3713 1.3455 1.3569±0.013 87.28±0.917
Lampiran 10 Dokumentasi kegiatan
Isolat JMF Bahan-bahan Persiapan media PDB
Media PDB Inkubator Bioshaker Spektrofotometer
Laminar Autoklaf Neraca analitik Proses dialisis
Sentrifuse Pengendapan Tabung dialisis
Uji aktivitas selulase Substrat CMC Waterbath
RIWAYAT HIDUP
Penulis dilahirkan di Depok, 4 Oktober 1992 dari ayah Rahmat Juarsa dan Ibu Sadiah. Penulis merupakan anak ketiga dari empat bersaudara. Penulis menyelesaikan pendidikan menengah atas di SMA Plus PGRI Cibinong tahun 2010, Provinsi Jawa Barat. Pada tahun yang sama, penulis meneruskan pendidikan di Departemen Biokimia Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Selama masa perkuliahan, penulis mengikuti organisasi kampus sebagai staf Departemen Sains dan Teknologi BEM FMIPA IPB tahun 2011-2012. Penulis juga aktif dalam berbagai kepanitian, diantaranya divisis Publikasi Dokumentasi dan Dekorasi Biochemistry Champion League FMIPA pada tahun 2010, divisi Publikasi Dokumentasi dan Dekorasi MPKMB 48 IPB pada tahun 2010, divisi Sponsorship dan Dana Usaha Pesta Sains Nasional IPB “Hero Science” pada tahun 2011, divisi Desain Dokumentasi dan Dekorasi Sintesa 48 Biokimia IPB pada tahun 2011, Sekretaris Umum EXPLO-SCIENCE pada tahun 2012, Sekretaris Divisi Sponsorship Pesta Sains Nasional 2012 “Techno Science” pada tahun 2012, Bedahara Umum Tripsinogen “Generasi Muda Pembangun Pertanian Berkelanjutan Berbasis Sains dan Biokimia” pada tahun 2013, Ketua Divisi Kestari International Scholarship and Education Expo (ISEE) ”Go Abroad and Prepare Your Self for ASEAN Economy Community” pada tahun 2013, divisi Acara FEROMON pada tahun 2014.
Selain itu, penulis juga aktif diberbagai pelatihan dan seminar, diantaranya Seminar Kesehatan Biokimia IPB pada tahun 2010, Seminar Keamanan, Kesehatan dan Keselamatan Kerja Laboratorium pada tahun 2011, Upgrading (Pengembangan Diri) BEM FMIPA IPB pada tahun 2012, Seminar PIMPI IPB pada tahun 2012, Seminar ISEE IPB pada tahun 2012, Seminar Kajian Ilmiah dan Kehalalan bersama BPPOM & MUI pada tahun 2012, Seminar FMIPA
Bioinformatika pada tahun 2013, Peserta “Youth Educators Regional Training”
pada tahun 2013, dan Seminar Internasional “LabIndonesia” pada tahun 2014.
Adapun prestasi dan penghargaan yang diraih penulis selama perkuliahan, diantaranya, juara II Lomba Desain poster IT Compitition se-TPB IPB pada tahun 2010, PKM didanai DIKTI pada tahun 2011 : Uji Aktivitas Daya Serap Kulit Pisang (Musaceaea sp) terhadap Logam Berat dalam Air Tercemar sebagai Upaya Mengatasi Krisis Air Bersih, PKM didanai DIKTI pada tahun 2012 : Kajian In Vitro Takokak (Solanum torvum Swartz.) sebagai Peluruh Batu Ginjal, PKM didanai DIKTI pada tahun 2012 : Pemanfaatan Limbah Cangkang Telur Sebagai Substrat Produksi Nanokalsium, PKM didanai DIKTI pada tahun 2012 : Upaya Pemanfaatan Limbah Styrofoam untuk Produksi Biosurfaktan oleh Pseudomonas aeruginosa dengan Penambahan Saponin dari Sapindus rarak, PKM didanai DIKTI pada tahun 2012 : Sintesis Bioetanol dari Sabut Kelapa dengan metode Sakarifikasi dan Fermentasi Simultan Menggunakan Biakan Zymomonas mobilis
dan Pichia stipitis, dan pada tahun 2013 meraih Best Presentation “Youth
Scientist’s Conference” EXPLOSCIENCE 2013. Bulan Juli sampai Agustus 2013, penulis melaksanakan Praktik Lapang di Pusat Penelitian Biologi LIPI Laboratorium Taksonomi dengan judul Identifikasi 16S-rRNA Isolat Bakteri