PERKEMBANGAN KASUS DAN TEKNOLOGI
D
D
I
I
A
A
G
G
N
N
O
O
S
S
I
I
S
S
T
T
O
O
K
K
S
S
O
O
P
P
L
L
A
A
S
S
M
M
O
O
S
S
I
I
S
S
DIDIK T SUBEKTI1, WAYAN T ARTAMA2 dan TOLIBIN ISKANDAR1 1Balai Penelitian Veteriner, Bogor
2Fakultas Kedokteran Hewan Universitas Gadjah Mada, Yogyakarta
ABSTRAK
Diagnosis toksoplasmosis pada manusia dan hewan saat ini mengalami pergeseran orientasi. Pada masa lalu, diagnosis hanya terbatas menentukan terinfeksi atau tidak dengan menggunakan berbagai uji serologi yang memiliki interpretasi hasil terbatas. Namun, seiring dengan berkembangnya imunologi dan biologi molekuler teknik diagnosis yang dikembangkan telah mengalami kemajuan yang sangat nyata. Dewasa ini tujuan diagnosis tidak hanya sekedar menyatakan positif atau negatif infeksi semata tetapi justru berkembang untuk menentukan status infeksi, waktu terjadinya infeksi, daya proteksi antibodi yang terbentuk berdasarkan titer maupun kekuatan ikatan intrinsik antibodi-antigen serta menentukan tipe Toxoplasma gondii yang menginfeksi. Tidak semua tujuan diagnosis tersebut dapat dipenuhi oleh satu alat atau perangkat diagnosis. Masing masing tujuan diagnosis tersebut hanya dapat dipenuhi oleh satu atau dua teknik diagnosis yang berbeda dan saling melengkapi. Pada naskah review ini akan diuraikan secara ringkas teknik teknik diagnosis yang telah dikembangkan dari awal sampai yang mutakhir dewasa ini. Teknik teknik diagnosis tersebut pada dasarnya melibatkan diagnosis serologis, molekuler maupun kombinasi diantara keduanya.
Kata kunci: Tehnik diagnosis, toksoplasmosis, serologis, molekuler
PENDAHULUAN
Dinamika kasus toksoplasmosis (baik pada manusia maupun hewan) di Indonesia cukup sulit diikuti secara tepat karena surveilen yang teratur atau periodik tidak didesain dengan terencana. Data yang ada saat ini memperlihatkan bahwa kasus toksoplasmosis pada hewan di Indonesia sangat bervariasi. Variasi tersebut tidak dapat digunakan sebagai bahan komparatif antar wilayah karena secara teknis epidemiologis tidaklah sebanding. Secara kumulatif kasus toksoplasmosis pada manusia secara serologis sangat tinggi (diatas 40%).
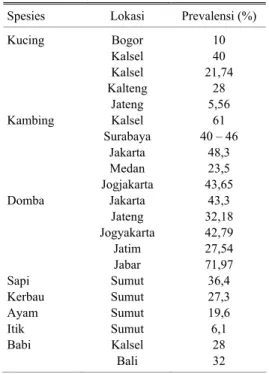
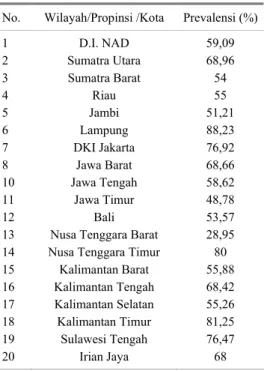
Penetapan kasus toksoplasmosis di Indonesia sampai saat ini masih bersifat acak dan dilakukan secara cross sectional pada satu waktu tertentu dan beberapa diantaranya disajikan dalam Tabel 1. Hal yang serupa juga terjadi pada data kasus toksoplasmosis pada manusia (Tabel 2). Poin lain yang perlu dicatat adalah bahwa kasus toksoplasmosis tidak hanya terbatas pada kucing tetapi telah menyebar pada berbagai jenis hewan. Bahkan dewasa ini dilaporkan bahwa toksoplasmosis juga telah ditemukan pada lumba lumba dan
cetacean (RESENDES et al., 2002).
Tabel 1. Rata-rata kasus toksoplasmosis pada
beberapa hewan di Indonesia
Spesies Lokasi Prevalensi (%)
Kucing Kambing Domba Sapi Kerbau Ayam Itik Babi Bogor Kalsel Kalsel Kalteng Jateng Kalsel Surabaya Jakarta Medan Jogjakarta Jakarta Jateng Jogyakarta Jatim Jabar Sumut Sumut Sumut Sumut Kalsel Bali 10 40 21,74 28 5,56 61 40 – 46 48,3 23,5 43,65 43,3 32,18 42,79 27,54 71,97 36,4 27,3 19,6 6,1 28 32
Sumber: Disarikan dari SUPRIHATI et al., 1998,
ISKANDAR, 1999 dan SUBEKTI, 2004 dengan beberapa tambahan data baru
Fenomena dan informasi tersebut memperlihatkan dan mengisyaratkan adanya kemungkinan toksoplasma akan ditemukan dalam bangsa ikan yang sampai saat ini belum ada laporannya, baik di Indonesia maupun Internasional (dengan mengesampingkan lumba lumba dan paus).
Mengingat tingginya kasus dan variatifnya faktor yang terkait dengan insidensi kasus toksoplasmosis baik pada manusia maupun hewan, maka diagnsosis merupakan hal yang sangat mendasar. Baik untuk kepentingan penetapan prevalensi, penetapan tipe toksoplasma, penetapan status infeksi dan bahkan juga sebagai dasar ilmiah medik untuk penetapan tindakan medis yang harus dilakukan secara tepat dan selektif. Diagnosis juga sangat esensial bagi penetapan status infeksi dan prediksi resiko toksoplasmosis pada masa kehamilan maupun dalam kaitannya dengan keamanan pangan.
Tabel 2. Rata-rata kasus toksoplasmosis pada
manusia di Indonesia
No. Wilayah/Propinsi /Kota Prevalensi (%) 1 2 3 4 5 6 7 8 10 11 12 13 14 15 16 17 18 19 20 D.I. NAD Sumatra Utara Sumatra Barat Riau Jambi Lampung DKI Jakarta Jawa Barat Jawa Tengah Jawa Timur Bali Nusa Tenggara Barat Nusa Tenggara Timur Kalimantan Barat Kalimantan Tengah Kalimantan Selatan Kalimantan Timur Sulawesi Tengah Irian Jaya 59,09 68,96 54 55 51,21 88,23 76,92 68,66 58,62 48,78 53,57 28,95 80 55,88 68,42 55,26 81,25 76,47 68
Keterangan: Berdasar data survey tahun 1995 oleh
MA'ROEF dan SOEMANTRI (2003) Dewasa ini telah terjadi perkembangan yang siknifikan dalam teknologi diagnosis toksoplasmosis, baik pada manusia maupun
hewan. Masing masing teknologi memiliki kelebihan dan kekurangan. Namun yang paling esensial dari ketersediaan tekonologi tersebut adalah tujuan dan manfaat yang diperoleh dari penggunaan teknik diagnosis tersebut secara implikatif di tingkat riil. Semakin luas implikasi dan kemampuan interpretasi suatu perangkat (kemanfaatannya) serta semakin sederhana atau terjangkau nilai ekonomis teknologi tersebut akan semakin ideal. Tolok ukurnya bukan lagi pada kecanggihan perangkat diagnosis tetapi lebih ditekankan pada kegunaan dan tujuan secara spesifik berdasar pengguna dan sasarannya.
EPIDEMIOLOGI KASUS DI INTERNASIONAL
Sebelum memulai paparan mengenai teknologi diagnsosis untuk toksoplasmosis akan lebih bijaksana untuk mengetahui tren atau kecenderungan kasus di dunia internasional. Khususnya yang terkait dengan penetapan kasus sebagai komparasi dengan berbagai penetapan kasus yang dilakukan di Indonesia. Apabila di Indonesia sebagian besar data yang diketahui hanya terbatas pada prevalensi berdasar seroepidemiologis, maka dibeberapa negara berkembang maupun negara maju telah diketahui masing masing klonet dari toksoplasma. Melalui informasi keterkaitan klonet dengan galur Toxoplasma gondii dapat diprediksi sumber sumber yang mungkin menjadi penularan disuatu wilayah sekaligus dapat menentukan tindakan medis yang paling sesuai dan harus dilakukan disuatu wilayah tertentu.
Berdasar laporan yang dikemukakan oleh FUENTES et al (2001) terlihat bahwa secara nasional di Spanyol kasus toksoplasmosis yang disebabkan oleh klonet I adalah 40%, klonet II 40% dan klonet III 20%. Sebaliknya secara nasional di Prancis kasusnya berbeda yaitu 10% toksoplasmosis disebabkan oleh klonet I, 81% oleh klonet II, 9% oleh klonet III (HOWE
et al., 1997). Implikasi dari deskripsi kasus
tersebut adalah, wilayah Spanyol dan Prancis memiliki berbagai perbedaan baik geografis, budaya dan gaya hidup, variasi dan lalu lintas ternak maupun faktor lain yang belum tereksplorasi.
Dibeberapa negara juga telah dilaporkan (secara parsial) klonet atau tipe Toxoplasma
gondii yang telah teridentifikasi dari ayam
yang dipelihara bebas (free range chickens) di negara tersebut. Diantaranya adalah dari SAO
PAOLO Brasil diketahui 64% adalah tipe I dan
36% adalah tipe III (DUBEY et al., 2002). Laporan berikutnya dari Parana Brasil juga memperlihatkan hasil serupa yaitu 53,85% adalah tipe I dan 46,15% tipe III (DUBEY et al.,
2003). Informasi dari Asia diantaranya adalah dari Srilanka yang menunjukkan bahwa tipe II dan III masing masing 50% ditemukan pada ayam ayam yang dipelihara secara bebas (DUBEY et al., 2005a). Demikian pula di India dilaporkan 28,57% tipe II dan 71,43% tipe III ditemukan menginfeksi ayam ayam yang dipelihara secara bebas (SREEKUMAR et al.,
2004). Contoh lain dari Eropa misalnya adalah dari Austria yang justru dilaporkan 100% adalah tipe II (DUBEY et al., 2005b). Secara keseluruhan contoh laporan tersebut diatas hanya berasal dari ayam yang dipelihara secara bebas dalam skala terbatas. Belum banyak diperoleh laporan lain yang terbaru mengenai tipe tipe pada setiap ternak secara regional.
Apabila dibandingkan dengan Indonesia yang merupakan negara kepulauan dengan keragaman geografis, budaya, prilaku dan ternak yang demikian majemuk tentu akan mempengaruhi distribusi kasus toksoplasmosis dan tipe Toxoplasma gondii yang mungkin menginfeksi masing masing hewan dan manusia serta strategi pengendalian yang paling tepat untuk diaplikasikan secara integral. Secara umum, jelas bahwa sesungguhnya penetapan kausal dan status infeksi serta epidemiologi toksoplasmosis merupakan hal yang lebih mendasar jika dibandingkan dengan sekadar mengetahui besaran kasus (prevalensi) temporer insidental secara serologis. Terlebih lagi, tipe yang menginfeksi manusia dan hewan belum dideterminasi dengat jelas. Penetapan tipe toksoplasma pada manusia dan hewan (ternak) juga dapat membantu mendeterminasi sumber penularan yang dominan menginfeksi kelompok populasi manusia pada suatu wilayah (SWITAJ et al., 2005).
DIAGNOSIS TOKSOPLASMOSIS
Deskripsi penyebaran dan besaran kasus diatas memperlihatkan bahwa kasus toksoplasmosis di Indonesia khususnya dan di dunia pada umumnya tidak dapat dianggap ringan. Apabila paradigma lama masih digunakan sebagai acuan maka kemungkinan akan terlambat melakukan penanganan secara personal maupun kolektif pada saat terjadi perubahan pola gejala klinis yang muncul. Oleh sebab itu dukungan perangkat dan teknik diagnosis yang tepat sangat esensial. Perkembangan teknik diagnosis toksoplas-mosis dewasa ini semakin variatif seiring dengan majunya ilmu dan teknologi yang telah berkembang. Aplikasi dan kemanfaatan suatu teknologi diagnosis tidak boleh dilihat hanya berdasarkan kemajuan atau kecanggihan perangkat semata tetapi yang lebih mendasar adalah tujuan yang hendak dicapai melalui penggunaan teknologi tersebut. Pada review ini akan dipaparkan secara filosofis mengenai masing masing teknologi dari yang awal hingga yang terbaru saat ini (2005). Diharapkan informasi dan upaya pemahaman mengenai teknologi diagnosis tersebut akan dapat membantu menjadi lebih berwawasan serta bijaksana dalam mengambil keputusan untuk melakukan diagnsosis.
Apabila memperhatikan siklus hidup, imunopatogenesis dan populasi klonal dari
Toxoplasma gondii akan terlihat keragaman
kepentingan diagnosis untuk suatu tujuan tertentu yang spesifik dengan interpretasi dan implementasi yang spesifik pula. Berpijak dari landasan tersebut telah dikembangkan berbagai teknik diagnosis toksoplasmosis pada hewan dan manusia mulai dari yang sederhana sampai yang komplek. Secara prinsip teknik diagnosis toksoplasmosis terbagi empat macam yaitu diagnosa morfologis, serologis, molekuler dan serologis-molekuler. Sebaliknya apabila mempertimbangkan target yang akan didiagnosis terdapat 3 kelompok (minimal) yang harus diperhatikan yaitu hewan, lingkungan dan produk pangan serta manusia. Pada manusia, menurut REMINGTON et al (2004) masih dibedakan lagi berdasarkan pada
kepentingan diagnosisnya menjadi 4 kelompok yaitu wanita hamil, fetus dan bayi yang baru lahir, pasien imunokompromais
(immunocom-promaised patient) dan penderita
retinokho-roiditis. Pembagian atau pengelompokan tersebut tidak mutlak karena masih terdapat kepentingan diagnosis pada wanita normal pada umumnya, penderita ensefalitis toksoplasmosis (TE, toxoplasmic encephalitis) dan kebutaan.
Diagnosa non serologis/morfologis
Teknologi yang pertama kali berkembang adalah pemeriksaan morfologis dengan menggunakan mikroskop. Teknologi ini sudah tentu menjadi kunci identifikasi, diferensiasi dan klasifikasi Toxoplasma gondii pada awal penemuan parasit tersebut. Meskipun telah berusia hampir sepuluh dasawarsa sejak pertama kali parasit tersebut ditemukan tahun 1908, sampai saat ini teknik diagnosis morfologis mikroskopis masih tetap dipergunakan. Diagnosa morfologis umumnya dilakukan untuk mengidentifikasi ookista, takizoit atau bahkan kista yang berisi bradizoit. Teknik diagnosis morfologis umumnya bersifat subyektif, kualitatif sampai semikuantitatif. Teknik diagnosis morfologis hanya berguna untuk identifikasi ada atau tidaknya parasit dalam suatu sampel yang sangat kecil dan terbatas.
Syarat mutlak untuk dapat melakukan pemeriksaan mikroskopis adalah mengetahui bentuk dan ukuran ookista, takizoit dan bradizoit. Ookista dan takizoit dapat diperiksa secara natif ataupun dengan pewarnaan, sedangkan bradizoit umumnya dalam bentuk preparat histopat. Ookista Toxoplasma gondii serupa dengan ookista apikompleksa lainnya seperti Eimeria sp., Neospora sp., Hammondia
sp., Isospora sp. dan sejenisnya. Perbedaan
khas terletak pada jumlah sporokista dan sporozoit serta diameter ookistanya (LEVINE,
1985). Jumlah sporokista dan sporozoit hanya dapat diobservasi apabila ookista mengalami sporulasi, sehingga pada ookista yang belum sporulasi harus terlebih dahulu disporulasikan. Kondisi demikian menjadi salah satu kelemahan dalam diagnosis morfologis. Kelemahan lainnya adalah kesamaan morfologis Toxoplasma gondii (baik stadium
ookista, takizoit maupun bradizoit) dengan
Neospora caninum, Hammondia sp., Sarcosystis sp. yang secara praktis sulit
dibedakan. Keunggulan mendasar pada teknik diagnosis morfologis adalah alat dan bahan yang sangat sederhana serta relatif mudah diaplikasikan pada laboratorium yang sederhana sekalipun. Sayangnya interpretasi yang dihasilkan dengan teknik diagnosis morfologis sangat terbatas untuk kepentingan klinik.
Diagnosa serologis
Beberapa teknik diagnosis secara serologis telah banyak dikembangkan dalam diagnosis tokoplasmosis pada hewan dan manusia. Beberapa teknik yang telah diketahui digunakan untuk diagnosis toksoplasmosis diantaranya adalah Dye test (Sabin – Feldman
dye test), CFT (complement fixation test),
MAT (modified agglutination test), CAT (card
agglutination test), DAT (direct agglutination test), IHA (indirect hemagglutination test) dan
LAT (latex agglutination test), IFA (indirect
fluorescen assay) dan FA (fluorescen assay),
ELISA (enzyme linked immunosorben assay) dan immunoblotting (JENUM dan STRAY
-PEDERSEN, 1998; FIGUEIREDO et al., 2001;
PIETKIEWIETZ et al., 2004) serta PCR
(polymerase chain reaction) (JONES et al.,
2000; LIN et al., 2000; MENOTTI et al., 2003;
CHABBERT et al., 2004; REMINGTON et al., 2004; VIDAL et al., 2004).
Meskipun telah banyak dikembangkan teknik diagnosis toksoplasmosis, namun sampai saat ini hanya beberapa yang masih digunakan diantaranya adalah Uji warna Sabin Feldman (REITER-OWONA et al., 1999;
SUBEKTI, 2004), MAT, CAT, LAT (SUBEKTI,
2004), IHA, ELISA (REMINGTON et al., 2004),
PCR-RFLP (FUENTES et al., 2001; GRIGG dan BOOTHROYD, 2001; GRIGG et al., 2001), RT-PCR dan RT-PCR-ELISA (SIMMON et al., 2004;
MENOTTI et al., 2003; SCHWAB dan
MCDEVITT, 2003). Diantara masing masing uji tersebut di Indonesia penggunaan teknik diagnosis pada hewan saat ini masih terbatas pada CAT dan LAT, sebaliknya pada manusia menggunakan DAT, IHA dan ELISA.
Urgensi diagnosis toksoplasmosis saat ini tidak hanya terbatas pada sekadar menentukan
positivitas semata tetapi yang lebih krusial adalah menentukan tipe dari Toxoplasma
gondii, tipe antibodi yang terdeteksi dan
kekuatan ikatannya, serta status infeksi saat itu. Tujuan penentuan tipe atau klonet tidak hanya terkait dengan imunopatogenesis klinis tetapi juga dengan sensitivitas penggunaan obat serta determinasi sumber penularan berbasis molekuler. Adapun penentuan tipe antibodi dan aviditas terkait dengan protektifitas dan prediksi status infeksi sehingga dapat ditentukan tindakan medis yang harus dilakukan. Oleh karena beragamnya teknik diagnosis tersebut maka fokus bahasan akan diutamakan pada teknik teknik diagnosis utama, sementara yang lainnya akan dibahas sekilas.
CFT (Complement Fixation Test)
Diagnosa toksoplasmosis dengan CFT saat ini tidak lagi direkomendasi pada manusia dan hewan. Meskipun demikian untuk keperluan tertentu dengan sarana laboratorium yang terbatas teknik tersebut tetap dapat diaplikasikan. Secara prinsip kunci pengujian dengan CFT adalah adanya antibodi yang spesifik terhadap toksoplasma akan berikatan dengan komplemen (SUBEKTI, 2004).
Komponen yang diperlukan untuk pengujian dengan CFT adalah takizoit toksoplasma, serum yang akan diuji, serum marmot (tidak memiliki antibodi spesifik terhadap toksoplasma), eritrosit domba serta antibodi anti eritrosit domba. Umumnya bahan bahan biologis tersebut dapat dibuat secara mandiri dengan peralatan yang relatif sederhana sehingga sangat mungkin diaplikasikan pada laboratorium paling sederhana sekalipun.
Kelemahan mendasar dari metoda CFT adalah rumitnya standarisasi semua reagen biologis dalam sistem tersebut, hasil pengujian bersifat kualitatif sampai semikuantitatif dan subyektif. Beberapa produk komersial juga tersedia, meskipun dapat mengatasi kelemahan standarisasi namun kelemahan esensinya tetap belum terpecahkan. Kelemahan esensial tersebut yaitu tidak mampu membedakan status kronis dan akut, tidak dapat menentukan klas ataupun subklas imunoglobulin yang terbentuk serta tidak dapat mengukur kekuatan ikatan imunoglobulin/antibodi–antigen. Hal demikian berdampak pada interpretasi hasil dan
implikasi pengujian yang sangat terbatas dari aspek klinis terutama jika digunakan untuk diagnosis pada manusia.
Uji warna Sabin Feldman
Teknik diagnosa toksoplasmosis dengan teknik Dye Test (Sabin – Feldman dye test) atau uji warna Sabin Feldman juga termasuk dalam pengujian yang melibatkan komplemen. Pada dasarnya teknik Dye Test (DT) merupakan modifikasi dari CFT. Modifikasinya terletak pada teknik pewarnaannya yang menggunakan biru metilen. Kelebihan dan Kelemahan utama teknik ini hampir serupa dengan CFT pada umumnya, aplikasinya pun juga mulai banyak ditinggalkan. Bahkan secara ilmiah tingkat akurasinya juga dipertanyakan mengingat beberapa komponen komplemen tetap dapat bereaksi secara langsung dengan organisme meskipun tidak diperantarai oleh antibodi. Walaupun demikian uji ini dianggap sebagai standar emas pengujian dalam toksoplasmosis meskipun telah diketahui beberapa kelemahan esensial yang paling mendasar.
Kelompok uji aglutinasi (Agglutination Test; MAT, CAT, DAT, IHA dan LAT)
Teknik diagnosa dengan aglutinasi dapat dibedakan menjadi dua kelompok yaitu aglutinasi langsung (direct agglutination) dan aglutinasi tidak langsung (indirect
agglutination). Teknik diagnosa yang termasuk
dalam aglutinasi langsung adalah DAT (Direct
Agglutination Test), MAT (Modified Agglutination Test) dan CAT (Card Agglutination Test). Adapun teknik aglutinasi
tidak langsung adalah IHA (Indirect
Hemeagglutination Test) ataupun LAT (Latex Agglutination Test). Walaupun dewasa ini
penggunaan teknik diagnosis serologis dengan aglutinasi sudah jarang diaplikasikan pada manusia, namun secara terbatas penggunaannya pada hewan masih dilakukan. Umumnya diagnosis serologis dengan prinsip aglutinasi dilakukan hanya untuk penentuan positif atau negatif toksoplasmosis dengan penentuan titer secara semikuantitatif.
Prinsip kerja aglutinasi langsung adalah terjadinya aglutinasi takizoit (clumping) apabila bereaksi dengan antibodi/
imunoglobulin anti takizoit dalam serum. Pada DAT, umumnya takizoit disuspensikan dalam formalin (formaline fixed tachyzoite). Sebaliknya pada MAT dapat menggunakan formalin atau aseton (acetone fixed tachyzoite)
(SUBEKTI, 2004). Perbedaan lainnya adalah
adanya penambahan merkaptoetanol (merchaptoethanol, ME) untuk mendestruksi IgM sehingga hanya IgG yang akan bereaksi (SUBEKTI, 2004). Modifikasi lainnya adalah
merkaptoetanol diinkorporasi dalam suspensi antigen. Beberapa produk komersial seperti produksi Biomerieux saat ini merkaptoetanol digunakan bersama dengan serum sampel. MAT dan DAT menggunakan mikroplate dasar bulat (U round bottomed microplate) sedangkan CAT menggunakan media kartu atau kertas.
Teknik diagnosis dengan aglutinasi langsung mendeteksi respon imun secara kualitatif maupun semikuantitatif dengan akurasi kurang lebih setara dengan CFT. Perbedaan utamanya adalah pembedaan klas imunoglubulin yang dapat dideteksi, namun pembedaan subklas tetap tidak mampu dilakukan. Klas imunoglobulin yang dibedakan dengan teknik diagnosis aglutinasi diatas adalah IgG dan total antibodi, sedangkan pada CFT dan DT hanya mendeteksi total antibodi atau mixed antibody/mixed immunoglobulin. Secara umum kelemahan esensial metoda aglutinasi langsung relatif sama dengan metode CFT.
Modifikasi lain dari teknik aglutinasi langsung adalah dengan melakukan pelapisan atau coating monoklonal anti IgM (umumnya pada manusia) pada mikroplat. Penambahan reagen biologis ini ternyata mampu memperbaiki kemampuan teknik aglutinasi langsung sehingga dapat digunakan untuk mendeteksi IgM. Cara kerjanya sama dengan sebelumnya, hanya saja mikroplatenya telah dilapisi monoklonal antibodi anti IgM. Melalui modifikasi tersebut maka teknik aglutinasi langsung dapat membedakan IgM (misalnya Toxo ISAGA IgM, BioMerieux) dan IgG (misalnya Toxo Screen DA, BioMerieux) yang dengan sendirinya dapat membedakan kasus akut dan kronis berdasarkan IgM dan IgG
(SUBEKTI, 2004). Namun demikian kelemahan
esensial seperti pengukurannya masih semikuantitatif, subyektivitas pengamatan visual, pembedaan subklas imunoglobulin dan
aviditas yang belum dapat terukur serta sensitifitas uji yang tidak mengalami peningkatan tetap belum teratasi. Bahkan pada manusia IgM dapat bertahan sekitar 6 – 12 bulan paska infeksi sehingga determinasi kasus akut atau kronis hanya berdasar IgM menjadi tidak adekuat.
Berbeda dengan teknik aglutinasi langsung, teknik aglutinasi tidak langsung memiliki kepekaan uji yang lebih tinggi dibanding teknik sebelumnya. Termasuk dalam kelompok metoda aglutinasi tidak langsung adalah IHA dan LAT. Secara prinsip metode kerja kedua teknik tersebut sangat serupa, perbedaanya adalah partikel pengikat antigen yang digunakan. Pada IHA, partikel yang digunakan adalah eritrosit manusia golongan O sedangkan pada LAT yang digunakan adalah partikel lateks. Kedua partikel tersebut selanjutnya masing masing akan dilapisi dengan protein solubel dari takizoit Toxoplasma gondii sehingga membentuk partikel yang lebih besar.
Ditinjau dari sisi penyediaan antigen, pada teknik aglutinasi tak langsung tidak menggunakan takizoit secara utuh tetapi menggunakan protein solubel dari takizoit. Melalui cara tersebut terjadi penghematan produksi antigen yang sangat besar dan efisien sekaligus memperbaiki sensitifitas uji. Walaupun secara teknis terdapat perbaikan yang bermakna dalam hal sensitifitas uji serta efisiensi penggunaan antigen dibanding teknik sebelumnya, namun secara implikatif belum banyak perbaikan yang bermakna. Hal tersebut disebabkan karena kelemahan esensial dari metoda aglutinasi tidak langsung serupa dengan aglutinasi langsung. Bahkan umumnya pada teknik diagnosis dengan IHA dan LAT yang diukur hanya total antibodi tanpa membedakan IgM dan IgG. Mungkin terasa aneh karena kepekaan uji meningkat tetapi hal esensial dalam interpretasi hasil justru tidak diperbaiki. Tampaknya teknik IHA dan LAT merupakan teknik transisi karena untuk penentuan pembedaan IgM dan IgG para produsen lebih merekomendasi pengujian lanjut dengan imunofluoresen atau enzyme immunoassay.
Immunofluorescen Assay (IFA dan FA)
Teknik diagnosis dengan imunofluoresen sangat mirip dengan EIA (enzyme
immunoassay yang kemudian berkembang
menjadi ELISA (enzyme linked immunosorbent
assay). Pada prinsipnya mekanisme
imunofluoresen terdiri atas dua macam yaitu imunofluoresen langsung (FA,
immuno-fluorescens assay) dan tidak langsung (IFA, indirect immunofluorescens assay). Secara
teknis IFA lebih sensitif dibanding FA. Pada FA, monoklonal antibodi yang spesifik dan dilabel dengan FITC digunakan untuk mengenali antigen target secara langsung pada slide atau jaringan. Sebaliknya pada IFA, monoklonal antibodi spesifik tanpa label (mAb I) digunakan untuk mengenali antigen target. Selanjutnya diikuti dengan penambahan antibodi yang dilabel FITC yang akan mengenali mAb I.
Pada manusia aplikasi teknik IFA/FA jarang digunakan, demikian pula pada hewan penggunaannya juga terbatas. Umumnya pada manusia menggunakan teknik aglutinasi langsung atau ELISA sedangkan pada hewan umumnya menggunakan aglutinasi langsung (DAT, MAT dan CAT), IHA dan LAT atau ELISA (SUBEKTI, 2004). Penggunaan IFA/FA masih umum dijumpai secara terbatas dibanding dengan ELISA. Sensitivitas dan spesifisitas ELISA pada diagnosis toksoplasmosis terutama menggunakan protein rekombinan dilaporkan lebih tinggi dibanding IFA/FA (PIETKIEWIEZ et al., 2004). Mengingat
aplikasi imunofluoresen untuk diagnosis toksoplasmosis pada manusia dan hewan secara komersial dan rutin sangat terbatas dibanding ELISA, maka fokus utama untuk pembahasan cenderung pada ELISA.
Enzyme Linked Immunosorbent Assay (ELISA) dan Imunokromatografi
Teknologi ELISA merupakan teknologi diagnosis paling utama digunakan dewasa ini. Hal ini disebabkan tidak hanya sensitivitas dan spesifisitasnya yang lebih tinggi dibanding teknik lainnya tetapi juga keluwesan dan keluasan aplikasi untuk berbagai tujuan cukup memadai. Disisi lain, diagnosis dengan ELISA mampu melakukan pengukuran yang bersifat kuantitatif murni. Diantara sejumlah teknik diagnosis serologis sampai saat ini hanya ELISA yang mampu melakukan pengukuran secara kuantitatif serta mampu melakukan pengujian untuk berbagai tujuan yang selama
ini menjadi titik kelemahan esensial pada teknik diagnosis serologis toksoplasmosis. Berbagai kepentingan seperti penentuan subklas antibodi/imunoglobulin, sitokin, deteksi antigen, diagnosis aviditas, penentuan status infeksi (akut atau klinis) dan bahkan kombinasi dengan teknik diagnosis molekuler dapat dilakukan secara baik (SUBEKTI, 2004).
Walaupun sarat dengan berbagai keunggulan, namun kelemahan yang sangat terasa khususnya untuk laboratorium veteriner adalah penyediaan berbagai konjugat (antibodi terlabel enzim) yang spesifik untuk masing masing spesies hewan. Hal demikian tentunya sangat high cost (terutama untuk laboratorium yang jarang melakukan diagnosis rutin), terlebih apabila menghendaki pengukuran yang kuantitatif. Pada pengukuran secara kuantitatif masih diperlukan sejumlah antibodi dan monoklonal antibodi tertentu untuk pembuatan kurva baku. Apabila keperluan tersebut tidak dapat terpenuhi maka konversi hasil pengukuran hanya bersifat semikuantitatif. Oleh sebab itu perangkat demikian sangat sesuai untuk laboratorium atau lembaga yang memegang mandat sebagai laboratorium referensi regional, nasional atau bahkan internasional untuk konfirmasi lebih rinci.
Namun demikian pada kebutuhan aplikasi lapangan yang lebih sederhana saat ini juga telah dikembangkan uji cepat imuno-kromatografi dengan menggunakan protein natif maupun rekombinan (HUANG et al., 2004, JIN et al., 2005). Kemampuan uji serologis yang berbasis pada teknik ELISA tersebut dilaporkan memiliki sensitivitas dan spesifisitas yang setara dengan teknik ELISA pada umumnya. Walaupun demikian kelemahan dari teknik imunokromatografi adalah tidak bersifat kuantitatif sepertihalnya ELISA.
Pada aplikasi ELISA untuk diagnosis toksoplasmosis terdapat beberapa hal yang perlu dipertimbangkan yaitu konfigurasi ELISA, jenis protein atau antigen yang digunakan serta spesifikasi konjugat yang dipergunakan. Konfigurasi ELISA pada hakikatnya untuk meningkatkan sensitivitas. Pemilihan jenis konjugat (misalnya whole
molecule, Fab specific, Fc specific atau γ/µ/δ/ε chain specific) berkaitan dengan peningkatan
spesifisitas dan modifikasi sensitivitas. Jenis protein yang digunakan akan sangat
menentukan spesifisitas, sensitivitas dan interpretasi hasil. Oleh sebab itu pemilihan jenis protein yang akan digunakan merupakan prioritas pertama dalam pengembangan ELISA..
Protein natif vs protein tunggal
Protein yang digunakan untuk diagnosis toksoplasmosis bervariasi mulai dari protein natif seperti protein membran, STAg/LTA (soluble of tachyzoite antigen/lysate of
tachyzoite antigen), ESA (excretory and secretory antigen) dan fraksinasi dari protein
natif tersebut (GIRALDO et al., 2000; SINGH,
2003) sampai protein tunggal hasil teknologi rekombinan seperti SAG1, GRA7, MIC3, dan SAG2 (HARNING et al., 1996; AUBERT et al., 2000; LI et al., 2000; MARCOLINO et al., 2000; PFREPER et al., 2005). Penggunaan protein
natif memiliki keunggulan dalam hal kemudahan preparasi, sensitivitas dan spesifisitas cukup tinggi dan dapat digunakan untuk uji aviditas dengan baik. Sebaliknya protein tunggal memiliki keunggulan dalam hal spesifisitas dan sesnsitivitas yang lebih baik dibanding protein natif namun tidak selalu cocok untuk uji aviditas.
Uji aviditas pada ELISA bermanfaat untuk determinasi prediktif kapan seseorang atau individu tersebut diperkirakan terinfeksi (PAUL, 1999; PRINCE dan WILSON, 2001; SINGH, 2003; REMINGTON et al., 2004).
Aviditas ELISA juga dapat digunakan untuk menentukan status infeksi serta kekuatan ikatan intrinsik antara antibodi dengan antigen. Apabila ikatan intrinsiknya lemah maka daya proteksinya juga lemah meskipun titernya cukup tinggi. Sebaliknya apabila ikatan intrinsik antigen-antibodinya cukup tinggi maka daya proteksinya cukup baik meskipun titernya tidak terlalu tinggi.
Diagnosis molekuler
Keterbatasan ELISA yang menonjol untuk kepentingan diagnosis toksoplasmosis dewasa ini adalah ketidakmampuannya untuk membedakan tipe toksoplasma yang menginfeksi individu (baik hewan maupun manusia). Keterbatasan utama lainnya adalah tidak mampu mendeteksi toksoplasma dalam
jumlah yang kecil (baik ELISA maupun Imunofluoresen) pada serum maupun jaringan. Keterbatasan tersebut dapat dipenuhi dengan menggunakan suatu teknik yang berbasis pada PCR (polymerase chain reaction). Walaupun teknik PCR juga dapat mendeteksi respon antibodi melalui ekspresi gen tetapi spesifisitasnya masih jauh dibawah ELISA. Oleh sebab itu penggunaan PCR untuk diagnosis diarahkan pada determinasi tipe toksoplasma yang menginfeksi hewan dan manusia.
Pada prinsipnya pada PCR, satu gen tertentu dari DNA atau RNA akan diamplifikasi sebanyak mungkin yang selanjutnya dielektroforesis dalam gel agarose. Teknik diagnosis yang memanfaatkan basis teknologi PCR serta mulai banyak digunakan adalah RFLP (Random Fragment Length
Polymorphism) yang dapat dipakai untuk
penentuan klonet Toxoplasma gondii, RT PCR (Real Time Polymerase Chain Reaction) yang memiliki sensitifitas dan spesifisitas tinggi dibanding PCR konvensional (LIN et al., 2000; GRIGG et al., 2001; SIMMON et al., 2004). Alternatif lainnya yang sedang dikembangkan dan kemungkinan akan dapat segera diaplikasikan secara praktis dilapangan dalam waktu yang tidak akan terlalu lama lagi adalah PCR – ELISA (MENOTTI et al., 2003; SCHWAB
dan MCDEVITT, 2003).
Diantara ketiga teknik tersebut, teknik diagnosis untuk determinasi tipe toksoplasma yang umum digunakan sampai saat ini adalah RFLP PCR (random fragment length
polymorphism – PCR) (JONES et al., 2000;
FUENTES et al., 2001; GRIGG dan BOOTHROYD, 2001; GRIGG et al., 2001). Teknik PCR nya sendiri dapat menggunakan PCR dasar ataupun PCR bertingkat (nested PCR). Pada PCR dasar, gen tertentu dari DNA/RNA langsung diamplifikasi menggunakan sepasang primer spesifik dari gen tersebut. Sebaliknya pada PCR bertingkat, gen targetnya diamplifikasi menggunakan dua pasang primer secara bertingkat. Secara teoritis teknik PCR bertingkat lebih tinggi akurasinya dibanding teknik dasar.
Dewasa ini juga telah berkembang teknik diagnosis toksoplasma dengan Real Time PCR yang bersifat kuantitatif dan dapat menentukan jumlah takizoit yang menginfeksi. Pada dasarnya RT PCR serupa dengan PCR dasar
pada umumnya, namun pada RT PCR juga disertakan penanda hibridasi (hybridization
probe) berlabel fluoresen yang akan menjadi
petanda (reporter) untuk konversi hasil amplifikasi ke dalam bentuk kuantitatif. Dibandingkan dengan PCR dasar kemampuan RT PCR lebih sensitif dan bersifat kuantitatif namun jika dibandingkan dengan PCR bertingkat, kemampuan deteksinya setara (LIN
et al., 2000) namun kemampuan
kuantifikasinya tidak dapat dipenuhi PCR bertingkat.
Akhir akhir ini juga telah dikembangkan teknik diagnosis lain yaitu PCR-ELISA dan Multiplex PCR (MENOTTI et al., 2003; SCHWAB dan MCDEVITT, 2003; SIMMON et al., 2004; AJZENBERG et al., 2005). Pada PCR
ELISA memungkinkan dilakukan kuantifikasi seperti halnya RT PCR dengan sensitivitas yang setara (MENOTTI et al., 2003). Namun pada PCR-ELISA, waktu yang dibutuhkan sedikit lebih lama karena menggabungkan teknik PCR dengan ELISA produk PCR. Namun demikian ditinjau dari segi biaya operasional, PCR-ELISA jauh lebih terjangkau
(HAMMOND, 20041). Adapun teknik Multiplex
PCR, baru baru ini telah dikembangkan untuk diagnosis toksoplasmosis dan menentukan tipe
Toxoplasma gondii. Multiplex PCR diklaim
lebih sensitif dan memerlukan waktu yang lebih singkat dibanding RFLP PCR dalam menentukan tipe toksoplasma (AJZENBERG et
al., 2005). Pada Multiplex PCR dapat
melakukan deteksi pada multilokus dalam sekali PCR dengan 5 marka satelit (satellite
marker) yang berbeda sekaligus (AJZENBERG
et al., 2005). Baik RFLP PCR maupun
Multiplex PCR keduanya hanya dapat digunakan untuk mendeterminasi tipe
Toxoplasma gondii namun tidak untuk tujuan
kuantifikasi takizoit. Walaupun demikian, ketersedian marka genetik untuk Multiplex PCR masih terbatas dibanding RFLP PCR yang jumlahnya mencapai ratusan. Oleh sebab itu aplikasi Multiplex PCR saat ini masih perlu pengembangan terutama yang terkait dengan sejumlah marka genetik yang akan menjamin validitas penentuan tipe atau klonet
Toxoplasma gondii.
KESIMPULAN
Kasus toksoplasmosis pada hewan dan manusia baik didunia maupun di Indonesia sangat tinggi. Pada manusia kasus berkisar antara 40 – 85% sedangkan pada hewan berkisar antara 5 – 80%. Tipe atau klonet yang ada di Indonesia belum diketahui sementara dibeberapa negara didunia telah teridentifikasi meskipun masih parsial. Beberapa tipe (misalnya tipe I) mampu menyebabkan gejala klinis pada manusia meskipun individu tersebut imunokompeten.
Teknologi diagnosis toksoplasmosis pada manusia dan hewan telah berkembang dengan sangat cepat. Teknologi diagnosis yang dapat digunakan adalah morfologis, serologis dan molekuler. Umumnya serologis dan molekuler merupakan teknologi diagnosis yang paling sesuai untuk diaplikasikan saat ini. Diagnosis serologis sangat terkait dengan evaluasi profil respon imun dan penetapan status infeksi sedangkan diagnosis molekuler sangat esensial untuk menentukan keberadaan parasit dalam darah dan tipe atau klonet Toxoplasma gondii.
Teknologi diagnosis serologis yang umum digunakan saat ini adalah LAT, IHA, IFA dan ELISA (pada hewan), serta ELISA dengan berbagai variasinya (pada manusia). Adapun teknologi diagnosis molekuler yang umum diaplikasikan saat ini adalah RFLP PCR baik untuk hewan maupun manusia. Beberapa teknologi diagnosis yang saat masih dalam taraf pengembangan untuk segera dapat diaplikasi dalam waktu dekat adalah imunokromatografi, PCR-ELISA, Real Time PCR dan Multiplex PCR.
DAFTAR PUSTAKA
AJZENBERG, D., A. DUMÈTRE and M-L. DARDÉ. 2005. Multiplex PCR for Typing Strains of
Toxoplasma gondii. J. Clin. Microbiol. 43 (4):
1940 – 1943.
AUBERT, D., G.T. MAINE, I. VILLENA, J.C. HUNT, L. HOWARD, M. SHEU, S. BROJANAC, L.E. CHOVAN, S.F. NOWLAN and J.M. PINON. 2000. Recombinant Antigens to Detect Toxoplasma
gondii-Specific Immunoglobulin G and
Immunoglobulin M in Human Sera by Enzyme Immunoassay. J. Clin. Microbiol. 38 (3) : 1114 – 1150.
CHABBERT, E., L. LACHAUD, L. CROBU and P. BASTIEN. 2004. Comparison of Two Widely Used PCR Primer Systems for Detection of Toxoplasma in Amniotic Fluid, Blood and Tissues. J. Clin. Microbiol. 42 (4): 1719 – 1722.
DUBEY, J.P., D.H. GRAHAM, C.R. BLACKSTON, T. LEHMANN, S.M. GENNARI, A.M.A. RAGOZO, S.M. NISHI, S.K. SHEN, O.C.H. KWOK, D.E. HILL and P. THULLIEZ. 2002. Biological and Genetic Characterization of Toxoplasma
gondii Isolates from Chickens (Gallus domesticus) from Sao Paolo, Brazil:
Unexpected Findings. Int. J. Parasitol. 32: 99 – 105.
DUBEY, J.P., I.T. NAVARRO, D.H. GRAHAM, R.L. FREIRE, L.B. PRUDENCIO, C. SREEKUMAR, M.C. VIANNA, T. LEHMANN and E. DAHL. 2003. Characterization of Toxoplasma gondii Isolates from Free Range Chickens from Parana, Brazil. Vet. Parasitol. 117 : 229 – 234. DUBEY, J.P., R.P.V. RAJAPAKSE, D. EKANAYAKE, C. SREEKUMAR and T. LEHMANN. 2005a. Isolation
and Molecular Characterization of
Toxoplasma gondii from Chickens from
Srilanka. J. Parasitology (In Press).
SREEKUMAR, G., D.H. GRAHAM, E. DAHL, T. LEHMANN, M. RAMAN, D.P. BHALERAO, M.C. VIANNA, and J.P. DUBEY. 2004. Genotyping of
Toxoplasma gondii Isolates from Chickens
from India. Vet. Parasitol. 118: 187 – 194. DUBEY, J.P., R. EDELHOFER, P. MARCET, M.C.
VIANNA, O.C.H. KWOK, and T. LEHMANN. 2005b. Genetic and Biologic Characteristics of
Toxoplasma gondii Infections in Free-Range
Chickens from Austria. Vet. Parasitol (In Press).
FIGUEIREDO, J.F., D.A.O. SILVA, D.D. CABRAL and J.R. MINEO. 2001. Seroprevalence of
Toxoplasma gondii Infection in Goats by the
Indirect Haemagglutination, Immunofluo-rescence and Immunoenzymatic Test in the Region of Uberlândia, Brazil. Mem. Inst.
Oswaldo Cruz. 96 (5) : 687 – 692.
FUENTES, I., J.M. RUBIO, C. RAMÍREZ and J. ALVAR. 2001. Genotypic Characterization of
Toxoplasma gondii Strains Associated with
Human Toxoplasmosis in Spain: Direct Analysis from Clinical Samples. J. Clin.
Microbiol. 39 (4): 1566 – 1570.
GIRALDO, M., H. CANNIZZARO, M.A.J. FERGUSON, I.C. ALMEIDA and R.T. GAZZINELLI. 2000. Fractionation of Membrane Components from Tachyzoite Forms of Toxoplasma gondii:
Differential Recognition by Immunoglobulin M (IgM) and IgG Present in Sera from Patients with Acute or Chronic Toxoplasmosis. J. Clin. Microbiol. 38 (4) : 1453 – 1460.
GRIGG, M.E. and J.C. BOOTHROYD. 2001. Rapid Identification of Virulent Type I Strains of Protozoan Pathogen Toxoplasma gondii by PCR-Restriction Fragment Length Polymorphism Analysis at the B1 Gene. J.
Clin. Microbiol. 39 (1): 398 – 400.
GRIGG, M.E., J. GANATRA, J.C. BOOTHROYD and T.P. MARGOLIS. 2001. Unusual Abundance of Atypical Strains Associated with Human Ocular Toxoplasmosis. J. Infect. Dis. 184: 633 – 639.
HARNING, D., J. SPENTER, A. METSIS, J. VUUST and E. PETERSEN. 1996. Recombinant Toxoplasma
gondii Surface Antigen 1 (P30) Expressed in
Escherichia coli Is Recognized by Human Toxoplasma Specific Immunoglobulin M (IgM) and IgG Antibodies. Clin. Diag. Lab.
Immunol. 3 (3): 355 – 357.
HOWE, D.K., S. HONORE, F. DEROUIN and L.D. SIBLEY. 1997. Determination of Genotypes of
Toxoplasma gondii Strains Isolated from
Patients with Toxoplasmosis. J. Clin.
Microbiol. 35 (6) : 1411 – 1414.
HUANG, X., X. XUAN, H. HIRATA, N. YOKOYAMA, L. XU, N SUZUKI and I. IGARASHI. 2004. Rapid Immunochromatographic Test Using Recom-binant SAG2 for Detection of Antibodies against Toxoplasma gondii in Cats. J. Clin.
Microbiol. 42 (1) : 351 – 353.
ISKANDAR, T. 1999. Tinjauan Tentang Toksoplas-mosis Pada Hewan dan Manusia. Wartazoa. 8 (2) : 58 – 63.
JENUM , P. and B. STRAY-PEDERSEN. 1998. Development of Specific Immunoglobulins G, M, and A following Primary Toxoplasma
gondii infection in Pregnant Women. J. Clin. Microbiol. 36 (10) : 2907 – 2913.
JIN, S., Z.Y. CHANG, X. MING, C.L. MIN, H. WEI, L.Y. SHENG and G.X. HONG. 2005. Fast Dipstick Dye Immunoassay for Detection of Immunoglobulin G (IgG) and IgM Antibodies of Human Toxoplasmosis. Clin. Diag. Lab.
Immunol. 12 (1) : 198 – 201.
JONES, C.D., N. OKHRAVI, P. ADAMSON, S. TASKER and S. LIGHTMAN. 2000. Comparison of PCR Detection Methods for B1, P30 and 18S rDNA Genes of T. gondii in Aqueous Humor. Invest.
LEVINE, N.D. 1985. Protozoologi Veteriner. UGM Press. Jogyakarta.
LI, S., G. GALVAN, F.G. ARAUJO, Y. SUZUKI, J.S. REMINGTON and S. PARMLEY. 2000. Serodiagnosis of Recently Acquired
Toxoplasma gondii Infection Using an
Enzyme Linked Immunosorbent Assay with a Combination of Recombinant Antigens. Clin.
Diag. Lab. Immunol. 7 (5) : 781 – 787.
LIN, M-H., T-C. CHEN, T-T. KUO, C-C. TSENG and C-P. TSENG. 2000. Real Time PCR for Quantitative Detection of Toxoplasma gondii.
J. Clin. Microbiol. 38 (11) : 4121 – 4125.
MARCOLINO, P.T., D.A.O. SILVA, P.G. LESER, M.E. CAMARGO and J.R. MINEO. 2000. Molecular Marker in Acute and Chronic Phase of Human Toxoplasmosis: Determination of Immunoglobulin G Avidity by Western Blotting. Clin. Diag. Lab. Immunol. 7 (3): 384 – 389.
MA’ROEF, S. dan S. SOEMANTRI. 2003. Toksoplasmosis Ibu Hamil di Indonesia (Studi Tindak Lanjut Survai Kesehatan Rumah Tangga 1995). Cermin Dunia Kedok. 139 : 41 – 45.
MENOTTI, J., G. VILELA, S. ROMAND, Y.J-F. GARIN, L. ADES, E. GLUCKMAN, F. DEROUIN and P. RIBAUD. 2003. Comparison of PCR-Enzyme Linked Immunosorbent Assay and Real Time PCR Assay for Diagnosis of an Unusual Case of Cerebral Toxoplasmosis in a Stem Cell Transplant Recipient. J. Clin. Microbiol. 41 (11) : 5313 – 5316.
PAUL, M. 1999. Immunoglobulin G Avidity in Diagnosis of Toxoplasmic Lymphadenopathy and Ocular Toxoplasmosis. Clin. Diag. Lab.
Immunol. 6 (4) : 514 -518.
PFREPER, K-I., G. ENDERS, M. GOHL, D. KRCZAL, H. HLOBIL, D. WASSENBERG and E. SOUTSCHEK. 2005. Seroreactivity to and Avidity for Recombinant Antigens in Toxoplasmosis.
Clin. Diag. Lab. Microbiol. 12 (8): 977 – 982.
PIETKIEWIETZ, H., E. HISZEZYŃSKA-SAWICKA, J. KUR, E. PETERSEN, H.V. NIELSEN, M. STANKIEWIEZ, I. ANDRZEJEWSKA and P. MYJAK. 2004. Usefulness of Toxoplasma
gondii Specific Recombinant Antigens in
Serodiagnosis of Human Toxoplasmosis. J.
Clin. Microbiol. 42 (4) : 1779 – 1781.
PRINCE, H.E. and M. WILSON. 2001. Simplified Assay for Measuring Toxoplasma gondii Immunoglobulin G Avidity. Clin. Diag. Lab.
Immunol. 8 (5) : 904 – 908.
REITER-OWONA, I., E. PETERSEN, D. JOYNSON, H. ASPOCK, M.L DARDÉ, R. DISKO, O. DRAEZEN, H. DUMON, R. GRILLO, U. GROSS, M. HAYDE, R. HOLLIMAN, D.O. HO-YEN, K. JANITSCHKE, P.A. JENUM, K. NASER, M. OLSZEWSKI, P. THULLIEZ and H.M. SEITZ. 1999. The Past and Present Role of The Sabin Feldman Dye Test in the Serodiagnosis of Toxoplasmosis. Bull.
World Health Org. 77 (11): 929 – 935.
REMINGTON, J.S., P. THULLIEZ and J.G. MONTOYA. 2004. Minireview: Recent Developments for Diagnosis Toxoplasmosis. J. Clin. Microbiol. 42 (3): 941 – 945.
RESENDES, A.R., S.ALMERIA, J.P. DUBEY, E.OBON, C. JUAN-SALLES, E. DEGOLLADA, F.ALEGRE, O. CABEZON, S. PONT and M. DOMINGO. 2002. Disseminated Toxoplasmosis in a Mediterranean Pregnant Risso's Dolphin (Grampus griseus) with Tranplacental Fetal Infection. J. Parasitol. 88: 1029 – 1032. SCHWAB, K.J. and J.J. MCDEVITT. 2003.
Development of a PCR-Enzyme Immunoassay Oligoprobe Detection Method for Toxoplasma gondii Oocysts, Incorporating PCR Controls.
App. Env. Microbiol. 69 (10) : 5819 – 5825.
SIMMON, A., P. LABALETTE, I. ORDINAIRE, E. FRÉALLE, E. DI-CAS, D. CAMUS and L. DELHAES. 2004. Use of Fluorescence Resonance Energy Transfer Hybridization Probes to Evaluate Quantitative Real Time PCR for Diagnosis of Ocular Toxoplasmosis.
J. Clin. Microbiol. 42 (8): 3681 – 3685.
SINGH, S. 2003. Mother to Child Transmissin and Diagnosis of Toxoplasma gondii Infection During Pregnancy. Indian J. Medic.
Microbiol. 21 (2): 69 – 76.
SUBEKTI, D.T. 2004. Teknik Diagnosis plasmosis. Pelatihan Teknik Diagnosis Tokso-plasmosis Tingkat Dasar. Balai Penelitian Veteriner. 27 September – 1 Oktober 2004. Bogor.
SUPRIHATI, E., N.D.R. LASTUTI dan L.T. SUWANTI. 1998. Seroepidemiologi Toksoplasmosis Pada Kambing yang Dijual sebagai Sate Kambing di Kotamadya Surabaya. Med. Kedok. Hewan. 14 (3). 172 – 177.
SWITAJ, K., A. MASTER, M. SKRZYPCZAK and P ZABOROWSKI. 2005. Recent Trends in Molecular Diagnostics for Toxoplasma gondii Infections. Clin. Microbiol. Infect. 11 : 170 – 176.
VIDAL, J.E., F.A. COLOMBO, A.C.P.DE OLIVEIRA, R. FOCACCIA and V.L. PEREIRA-CHIOCCOLA. 2004. PCR Assay using Cerebrospinal Fluid for Diagnosis of Cerebral Toxoplasmosis in Brazilian AIDS Patients. J. Clin. Microbiol. 42 (10) : 4765 – 4768.