EFISIENSI ARUS ELEKTROLISIS
PADA SEL ELEKTROLISIS PLATINA-PLATINA ASAM NITRAT
Mulyono Daryoko
Pusat Pengembangan Pengelolaan Limbah Radioaktif-BATAN, Serpong
ABSTRAK
EFISIENSI ARUS ELEKTROLISIS PADA SEL ELEKTROLISIS PLATINA-PLATINA ASAM NITRAT. Telah dilakukan penelitian untuk mempelajari efisiensi arus elektrolisis pada sel elektrolisis elektrode pt·pt dengan larutan anolyle HNO~ AgN03 dan larutan catholyte 13M HN03. Perubah yang dipelajari pada penelitian ini adalah arus elektrolisis dan temperatur. Arus elektrolisis divariasi pada 3A, SA dan 10A dengan temperatur dan kecepatan pengadukan dibuat tetap, masing·masing 2S"C dan 1000 rpm. Temperatur divariasi pada 10°C, 1S"C dan 25°C, dengan arus elektrolisis dan kecepatan pengadukan dibuat tetap, pada kondisi optimum percobaan pertama. Lama elek1rolisis masing-masing percobaan adalah 90 menit. Dari penelitian ini didapal kesimpulan bahwa efisiensi arus elektrolisis akan semakin berkurang dengan kenaikan arus eleklrolisis dan akan semakin bertambah dengan penurunan temperatur. Pad a waktu 30 menit harga efisiensi arus elektrolisis adalah 74,4% pada 3A, 62,7% pada 5A dan 33,4% pada 10A, sedangkan pada variasi temperatur harga efisiensi arus elektrolisis adalah 33,4% pada 25°C, 37,0% pada 15°C dan 43,6% pada 10nC.
ABSTRACT
THE ELECTROL
mc
CURRENT EFFICIENCY IN THE PLA TlNUM-PLA TlNUM NITRIC ACID ELECTROLmc
CELL The eleclrolytic current efficiency in the Pt·Pt electrolytic oxidation cell, solution of 4M HNOy'0.5M AgNOJ as anolyte, and solution of 13M HNOJ as catholyte have been investigated. The parameters investigated where electrolytic current and temperature. The electrolytic current conditioning was varied at 3A. 5A and 10A. where the stirring speed and temperature were maintained at 1000 rpm and25'C,respectively. Afterwards the dependency of the temperelure was examined at 10, 15 and 25'C, in the electrolytic current and the stirring speed at 10A and 1000 rpm. The results shows that the electrolytic current efficiency decreases with the increase of electrolytic current, and increases with Ihe decrease of temperature. The electrolytic current efficiency at 30 minutes experiment are 74.4% at 3A, 62.7% at 5A and 33.4% at 10A, then ofthe variation of temperature are 33.4% at 25'C, 37.0% at 15'C and 43.6% at 10'C.PENDAHULUAN
Teknik elektrokimia mulai diterapkan dalam berbagai hal semenjak tahun 1807, dimana saat itu Sir Humphry Davy berhasil memisahkan logam kalium dari senyawanya. Prinsip pen era pan ini berkaitan dengan sel elektrokimia. Secara umum sel elektrokimia dibagi menjadi sel galvani dan sel elektrolisis. Proses yang terjadi pada sel galvani ialah reaksi kimia berubah menjadi energi listrik, sedangkan di dalam sel elektrolisis energi listrik menjadi reaksi kimia. Pada sel galvani elektrode positif sebagai katode, dan elektrode negatif sebagai iilnode, IiiQdangksn pad a sel elektrolisis elektrode negatif sebagai katode, dan elektrode positif sebagai anode. Penggunaan sel elektrolisis untuk pengolahan limbah telah dimulai tahun 1950, namun penggunaannya secara profesional baru dimulai semenjak beberapa tahun terakhir ini, terutama setelah ditemukannya beberapa bahan elektrode, bahan membran serta inovasi-inovasi metode teknik kimia(1). Sebagai contoh saat ini semakin banyak ditemukan bahan elektrode yang mempunyai stabilitas kimia maupun fisika yang sangat tinggi, konduktivitas listrik yang tinggi, non fouling, elektrode potensial tinggi dan
mempunyai tegangan lebih yang rendah, yang kesemuanya merupakan sifat-sifat yang baik terhadap efisiensi reaksi elektrolisisnya.
Pada sel elektrolisis zat-zat dapat terurai sehingga terjadi perubahan massa(1,2,3,4). Peruraian tersebut disebabkan oleh energi listrik yang diangk\.lt oleh ion-ion yang bergerak di dalam larutan elektrolit, atau karena adanya daya gerak listrik di dalam sel terse but. Daya gerak listrik ini merupakan perbedaan potensial standar elektrode negatif (katode) dan potensial standar electrode positif (anode). Perbedaan potensial standar ini biasanya disebabkan perbedaan bahan yang dipakai antara anode dan katode, namun bisa juga bahan yang dipakai sama, tetapi konsentrasi larutan elektrofitnya berbeda. Jenis yang terakhir ini disebut sel konsentrasi(5).
Pada sel elektrolisis PUPt dengan larutan elektrolit 4M HNO;J0,5M AgN03 sebagai larutan anode (anolyte) dan AgN03 sebagai media serta 13M HN03 sebagai larutan katode (catholyte), maka akan terjadi reaksi sbb(1,2.3,4,6):
Ag+-> Ag+2+ e' (anode) (1)
H20 -) 2 H+ +%O2 + 2 eO(anode) (2)
Daftar Isi
Secara teoritis, perubahan massa yang terjadi pada sel elektrolisis ini dapat dinyatakan dengan rumus :
2H·+N03·+e·~ N02+H20 (katode) (3) 4H++N03·+3e·~ NO.+2H20 (katode) (4) H20 + e ~ Y,H2 + OH" (katode) (5)
Keefektifan reaksi-reaksi oksidasi yang terjadi pada anode, ditandai dengan efisiensi arus elektrolisis(I1). Efisiensi arus ini didefinisikan sebagai perbandingan antara massa yang terjadi dari percobaan dibagi dengan massa yang terjadi secara teoritis, sebagai berikut :
M = Q(Nn)(1/F)(5) dimana,
M = massa
a
= jumlah listrik, coulomb Nn=
massa eklvalenA = massa atom atau massa molekul n = perubahan bilangan oksidasi F = tetapan Faraday
= 96500 coulomb
11= M/M(teoritis)(2)
(6)
(7)
dibagi menjadi kompartemen anode dan kompartemen katode yang dibatasi dengan suatu membran, dan dilengkapi dengan anode dan katode platinum dan pengaduk dari teflon. Temperatur larutan ano/yte di dalam kompartimen anode diukur dengan termometer dan dikontrol dengan sistem penukar panas. Pada alat terse but dilengkapi juga dengan lubang untuk mengambil sam pel.
Metode
Setelah ano/yte dan catho/yte diisikan ke dalam kompartimen anode dan kompartimen katode, sel dibangkitkan dengan arUB 10 amper dan pengadukan diatur pada kecepatan 1000 rpm. Pada penelitian ini arus elektrolisis divariasi, yaitu 3, 5 dan 10A, sedangkan temperatur dijaga tetap pada 25°C. Terbentuknya Ag+2 ditandai dengan perubahan warna dari jernih menjadi hitam. Secara periodik sam pel ano/yte diambil melalui lubang sam pel, dan kandungan Ag+2
dianalisis dengan cara titrasi. Harga efisiensi arus elektrolisis adalah Ag +2yang terjadi dari percobaan ini dibagi dengan Ag +2 yang terjadi secara teoritis. Percobaan dilanjutkan dengan variasi temperatur 25, 15 dan 10°C, dimana arus elektrolisis dibuat tetap 10A.
Secara teoritis efisiensi arus elektrolisis tergantung pada arus elektrolisis, temperatur, kecepatan alir (kecepatan pengadukan), konsentrasi dan jenis ano/yte, serta desain dari sel tersebut(2).
Pada penelitian ini dibahas pengaruh beberapa parameter: besar arus elektrolisis dan temperatur terhadap efisiensi arus sel elektrolisis PUPt dengan ano/yte 4M HNO~O,5M Ag N03 dan catho/yte 13M HN03. Penelitian ini penting dilakukan karena efisiensi arus sangat berperan pada aplikasi penggunaan sel elektrolisis, terutama pad a scale-up nya.
TAT A KERJA
Bahan
Bahan yang dipakai pada penelitian ini . adalah ano/yte 4M HNO~O,5M Ag N03 dan catholyte 13M HN03.
Alat
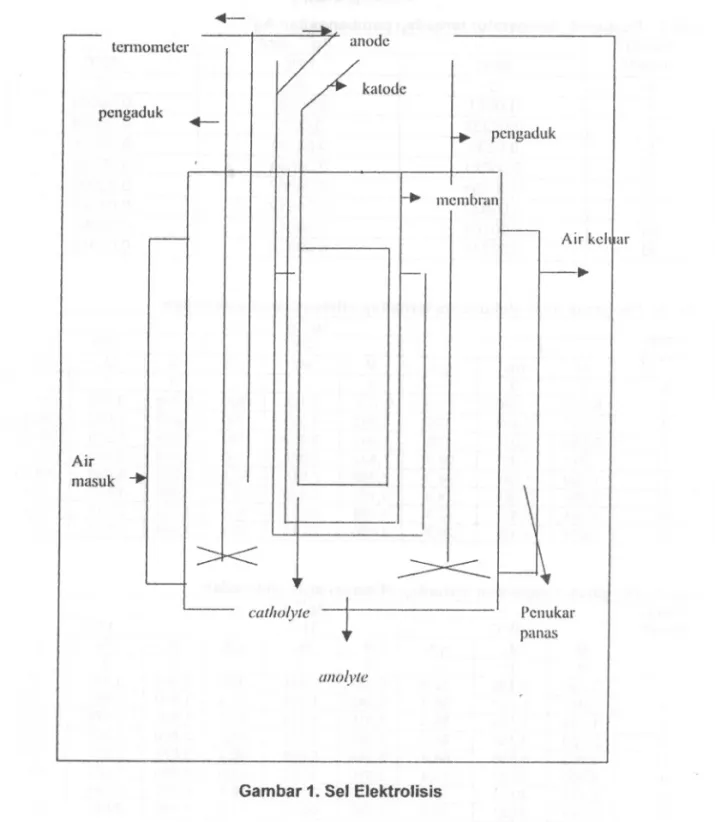
Alat utama yang dipakai adalah sel elektrolisis yang terbuat dari gelas dan teflon seperti terlihat pada Gambar 1. Sel terse but
HASIL DAN PEMBAHASAN
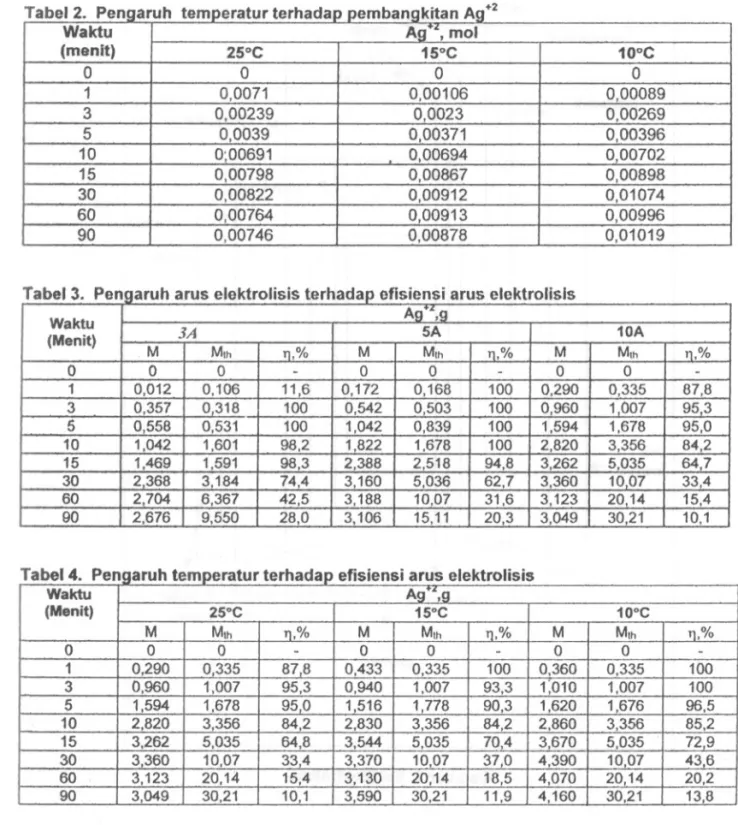
Dari penelitian ini, jumlah Ag +2 yang dibangkitkan dapat dilihat pada Tabel 1 dan Tabel 2, sedangkan jumlah Ag+2 yang dibangkitkan secara teoritis bisa dihitung dengan persamaan (6). Dengan persamaan (7) bisa didapatkan efisiensi, dan hasil-hasil perhitungan tersebut ditunjukkan pada Tabel 3 dan Tabel 4.
Pada Tabel 3 dapat dilihat bahwa pada tahap-tahap awal reaksi efisiensi akan relatif stabil dan tidak mempunyai perbedaan yang signifikan untuk arus elektrolisis 3, 5 dan 10A. Setelah waktu 30 men!t terlihat bahwa penambahan arus elektrolisis akan menyebabkan efisiensi menurun. Misalnya pada waktu 30 menit, efisiensi arus elektrolisis pada 3A 74,4%, maka pada 5A akan menjadi 62,'7% dan berikutnya pada
tcnnomctcr pcngaduk Air masuk pcngaduk mcmbran Air kcluar catllO/ytc
i
al/o/yteGambar 1. SeJ ElektroJisis
+2
Pcnukar
panas
--- --.- --- --- -~--- --- --- •...•... ----w-- __·n .._____· ..'"D
Waktu Ag+z, mol
(men
it)
3A5A10A 0 0 00 1 0,003 0,00420,0071 3 0,0087 0,001320,00235 5 0,00136 0,002540,0039 10 0,00254 0,004440,00691 15 0,00358 0,005820,00798 30 0,00577 0,007700,00822 60 0,006590,007770,00764 90 0,00652 0,007570,00746---
--
---
--- ~._~ ----Waktu
Ag·\ mol
(menlt)
25°C15°C10°C0
000
1 0,0071 0,001060,00089 3 0,00239 0,00230,00269 5 0,0039 0,003710,00396 10 0;00691 0,006940,00702 15 0,00798 0,008670,00898 30 0,00822 0,009120,01074 60 0,00764 0,009130,00996 90 0,00746 0,008780,01019Tabel 2. P
h
t
hadbanakitan
A-+2en
garu
Waktu AgY.,g (Menit) 3A 10A 5A M MthM1h11,0/0TJ,%MM Mth11,%°
0 0000-
-
-
01906030101535
Tabel 3. P
0,2900,9602,8201,5943,2623,0493,3603,1230,1720,5421,0422,3883,1883,1603,1061,8220,5580,0120,3571,6783,35620,145,03530,210,3350,3180,8396,3670,5313,1849,5505,0362,51810,071,59110070,1061,6010,5031,67810,0720,331,62,36815,112,6761,04262,794,81,4692,70495,00,16887,895333,464,710010010,110015,484,210098,328,042,598,274,411 6100100h
lektrolisis terhad
fI"
lektrolisl
Tabel 4. Pengaruh temperatur terhadap efisiensi arus elektrolisis
Waktu
I
AgY.,g (Menit)I
25°C 15°C M1h TJ,% M M1h o -0
0
0,335 87 8 0,433 0,335 1,007 95,3 0,940 1,007 1,678 950 1,516 1,778 3,356 84,2 2,830 3,356 5,035 64,8 3,544 5,035 10,07 33,4 3,370 10,07 20,14 15,4 3,130 20,14 30,21 10,1 3,590 30,21 o1
3
5
10
15
30 60 90 M o 0,290 0,960 1,594 2,820 3,262 3,360 3,123 3,049 11,% 100 93,3 90,3 84,2 70,4 37,0 18,5 11,9 M o 0,360 1;010 1,620 2,860 3,670 4,39Q. 4,070 4,160 10°C Mth o 0,335 1,007 1,676 3,356 5,035 10,07 20,14 30,21 100 100 96,5 85,2 72,9 43,6 20,2 13,8Perbedaan itu akan terlihat signifikan pada menit-menit berikutnya, Penurunan efisiensi arus elektrolisis ini disebabkan karena semakin terjadinya kompetisi antara reaksi pembangkitan Ag+2 dengan reaksi antara Ag+2dengan air seperti berikut :
Reaksi ini merupakan reaksi oksidasi air seperti pada persamaan (2). Dominasi reaksi dengan penambahan arus lebih besar terhadap persarnaan (8) dibandingkan
dengan reaksi pembangkitan Ag+2. Reaksi pembangkitan Ag+2 bukanlah reaksi yang dominan dipengaruhi oleh arus elektrolisis (non current Iimited)(7). Oreh karena secara teoritis massa yang te~adi akan linier terhadap kenaikan arus elektrolisis (persamaan 6), maka pad a kenaikan arus elektrolisis akan menyebabkan etisiensi arus semakin turun.
Pengaruh temperatur terhadap efisiensi ditunjukkan pada Tabel 4. Walaupun tidak terlalu signitikan, semakin rendah temperatur harga efisiensi arus akan semakin besar.
Hal ini juga berkaitan dengan terjadinya reaksi antara Ag+z dengan air (persamaan 8). Jika dianggap reaksi ini order 2, maka mekanisme reaksinya sebagai berikut(8,9J:
2Ag+2-4 Ag+ +Ag+3 (9)
Ag+3 + HzO -4 AgO" + 2 H+ (10) AgO" + H20 -4 Ag+ + HzOz . (11) Ag+z +H20Z -4 Ag+ + OzH" + H+ (12) Ag+z + OzH" -4 Ag+ + H+ + Oz (13)
Kecepatan reaksinya :
(14)
dari sisi termodinamika, semakin rendah temperatur anolyte maka Ag +Z yang terjadi akan semakin besar. Ini menunjukkan bahwa pengaruh temperatur terhadap harga tetapan kecepatan reaksi, k pad a persamaan (8) lebih signifikan dibandingkan dengan pengaruhnya terhadap persamaan (1), atau pengaruh temperatur terhadap reaksi antara Ag+2 dengan air lebih kuat 'dibandingkan dengan pengaruhnya terhadap
reaksi terbentuknya Ag+z. Disisi lain secara teoritis tidak ada faktor temperatur pada perhitungan efisiensi, sehingga semakin rendah temperatur harga efisiensi arus elektrolisis akan semakin besar. Harga efisiensi arus pad a 30 men it adalah 33,4% pad a 25°C, 37,0% pada 15°C dan 43,6% pada 1DoC.
Apabila reaksi dianggap reaksi order 1 maka mekanismenya sbb.: AgN03+ +H20 -4 AgON03+ + 2H+ (15) AgON03 + + HzO -4 Ag+ + OH++OH"+N03' (16) H+ + OH' -4 HzO (17) AgN03+ -4 Ag+ +N03" (18) N03" + HzO -4 H+ +N03" +OH" (19) AgN03 +
+
HzO -4 Ag++ OH" + H++N03' (20) 20H' -4 HzOz (21) AgN03+ + HzOz-4 Ag+ + OzH"+H+ +N03" AgN03 + + OzH" -4 Ag+ + Oz +H++N03"Seperti terlihat pada reaksi (1) dan dengan persamaan reak$i (14) atau (24), dimana
maka kenaikan temperatur mestinya juga akan memperbesar kecepatan terjadinya
Ag+2, tetapi seperti yang terjadi pada persamaan (8) bahwa Ag+2 yang te~adi dengan air akan berubah kembali menjadi Ag+. Pada Tabel 4 memperlihatkan bahwa
Kecepatan reakslnya, -d{Ag +z}/dt = ku{Ag+z) k = Ae'EalRT (22) (23) (24) (25) KESIMPULAN
Dari hasil-hasil penelitian ini didapatkan kesimpulan-kesimpulan sebagai berikut:
Efisiensi arus elektrolisis akan semakin berkurang, dengan kenaikan arus elektrolisis. Hal ini disebabkan karena bertambahnya reaksi pembentukan Ag +Z tidak sebanding dengan kenaikan arus elektrolisis. Reaksi pembangkitan Ag+z bukanlah reaksi yang dominan dipengaruhi oleh arus elektrolisis. Pada waktu 30 menit harga efisiensi arus elektrolisis adalah 74,4% pada 3A, 62,7% pada 5A dan 33,4% pada 10A. Efisiensi arus elektrolisis akan semakin bertambah dengan penurunan temperatur. 'Hal ini disebabkan pengaruh temperatur terhadap reaksi antara Ag +2 dengan air lebih kuat dibandingkan dengan pengaruhnya terhadap reaksi terbentuknya Ag +z, disisi lain tidak ada faktor temperatur pada perhitungan efisiensi. Harga efisiensi arus elektrolisis pada 30 menit adalah 33,4% pada 25°C, 37,0% pada 15°C dan 43,6% pada 1DoC.
DAFTAR PUSTAKA
1. RYAN,
J.
L., BRAY, L. A.,WHEELWRIGHT, E.
J.,
"Catalyzed Electrolytic Plutonium Oxide Dissolution (CEPOD)", PNL, Richland (1982). 2. BRAY,J.
L., RYAN, L. A., WHEELWRIGHT, E.
J.
"Electrochemical Process for Dissolving Plutonium Dioxide and Leaching Plutonium from Scrap on Wastes", AICE, Miami, Florida (1986).3. RYAN,
J.
l., BRAY, l. A., WHEELWRIGHT, E.J.,
BRYAN, G. H., ·Catalyzed Electrolytic Plutonium Oxide Dissolution", Paper Presented at the International Symposium to Comm. 50thAnnl. of Transuranium Elements, Washington, DC(1990).,
4. SUKIGAWA,
5.,
UMEDA. M., "Alpha Bearing Waste Treatment by Electrochemical Oxidation Technique", Safewaste 2000 (2000).5. ACHMAD, H., "Elektrokimia dan Kinetika", PT. Citra Aditya Sakti, Bandung (1992).
6. ALSENOY, V. V., RAHIER, A., "The Electrochemical Oxidation of Organic Wastes and Activated Graphite by Ag +2 in Nitric Acid : a literature study, SCK-CEN, Mol, Belgium (1996).
7. DARYOKO, M., "Pembangkitan Ag+2 pada Dekontaminasi Elektrokimia", Prosiding pada Seminar Nasional Penelitian Dasar IImu Pengetahuan dan Teknologi, P3TM, SATAN, Yogyakarta (2002).
8. CHIBA, Z., LEWIS, P.R., and MURGURIA, l.C., "Mediated Electrochemical Oxidation Treatment for Rocky Flats Flats Combustible Low·Level Mixed Waste", Final Report to Rocky Flats Plant, FY 93 and 94 Tasks under TIP SF 221207, Lawrence livermore National Laboratory livermore, CA 94550, 1994.
9. CHIBA, Z., SCHUMACHHER, B., LEWIS, P., dan MURGURIA, L., " Mediated Electrochemical Oxidation as an Alternative to Incineration for Mixed Wastes", LLNL, 1995.