2 Tinjauan Pustaka
2.1 Sel Bahan Bakar (Fuel Cell)
2.1.1 Pengertian
Sel bahan bakar (fuel cell) merupakan alat penghasil listrik dengan hidrogen sebagai bahan bakarnya.(6) Selain hidrogen, dibutuhkan juga oksigen dari udara sebagai oksidatornya. Saat
menghasilkan arus listrik, gas hidrogen dan oksigen akan diubah oleh sel bahan bakar menjadi air.(17) Berbeda dengan baterai, sel bahan bakar tidak perlu diisi ulang (recharging)
selama bahan bakar dan oksidatornya terus disuplai dari luar.(18)
Satu unit sel bahan bakar yang terdiri atas 2 lembar elektroda platina (Pt) dan elektrolit disebut sel tunggal. Tegangan yang diperoleh dari 1 buah sel tunggal ini berkisar 1 volt, sama dengan sel kering. Untuk mampu menghasilkan tegangan lebih tinggi yang dinginkan maka sel tersebut dapat disusun secara seri atau pararel. Kumpulan dari banyak sel tunggal ini disebut stack. Untuk membuat stack, selain dibutuhkan sel tunggal satuan, juga diperlukan sel separator.(6)
2.1.2 Sejarah dan Perkembangan Sel Bahan Bakar
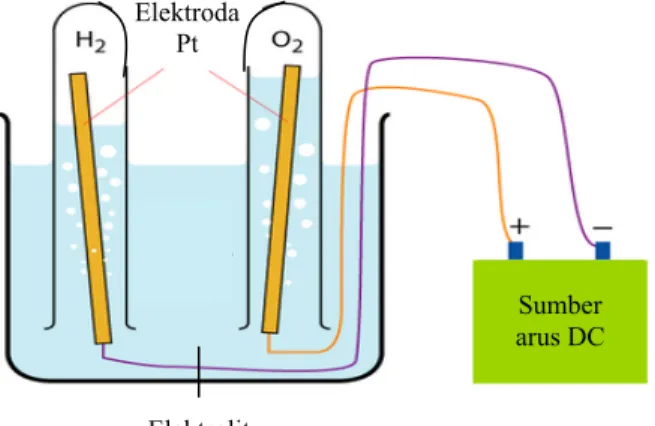
Konsep sel bahan bakar pertama kali diperkenalkan oleh William R. Grove, seorang ahli fisika berkebangsaan Inggris, pada tahun 1839. Sel yang diperkenalkan saat itu masih sangat sederhana, seperti ditunjukkan oleh Gambar 2.1. (18)
Elektroda Pt
Sumber arus DC Elektrolit
Dengan memberikan tegangan melewati dua elektroda, dapat dihasilkan hidrogen dan oksigen (proses ini disebut elektrolisis, yang sebenarnya telah ditemukan oleh William Nicholson pada tahun 1800). Proses yang terjadi pada sel bahan bakar merupakan kebalikan dari proses ini. Dengan adanya elektroda platina, yang berfungsi sebagai katalis, bila diumpankan gas hidrogen pada anoda dan gas oksigen pada katoda, elektrolisis akan berjalan ke arah kebalikannya dan aliran listrik dapat dihasilkan melewati sirkuit antara kedua elektroda tersebut.
Francis Bacon (1904-1992), seorang pria berkebangsaan Inggris, adalah orang pertama yang berhasil membuat sel bahan bakar pada tahun 1932. Bacon menggunakan gas O2 dan H2
murni, elektroda nikel, dan elektrolit basa (KOH), yang kemudian disebut Alkaline Fuel Cell (sel bahan bakar tipe basa). 27 tahun kemudian, Bacon dan rekan-rekannya baru berhasil membuat sel bahan bakar dengan daya 5 kW, menunjukkan betapa sulitnya membuat perkembangan di bidang ini.
Berselang setelah ditemukan Alkaline Fuel Cell, di tahun 1950-an, perusahaan Amerika Serikat, General Electric (GE), berhasil mengembangkan sel bahan bakar tipe baru, dengan membran polimer sebagai elektrolitnya, yang kemudian disebut Proton Exchange Membrane
Fuel Cell (PEMFC). PEMFC yang ditemukan oleh GE mampu menghasilkan sekitar 1 kW,
dan memiliki keunggulan pada design, lebih compact, bila dibandingkan sel bahan bakar yang ditemukan oleh Bacon saat itu.
Sel bahan bakar mulai mendapat perhatian ketika NASA mulai menggunakan sel bahan bakar buatan GE sebagai sumber energi pada komputer dan alat komunikasinya pada tahun 1965. Program Gemini mereka menggunakan PEMFC. Sedangkan program Apollo, termasuk yang mengangkut Neil Amstrong dan rekan-rekannya ke bulan, menggunakan
Alkaline Fuel Cell (AFC). NASA menggunakan AFC hingga tahun 1990-an lalu beralih
kembali ke PEMFC karena PEMFC saat itu telah mengalami berbagai perbaikan yang akhirnya menjadi lebih cocok dan efektif untuk pesawat mereka.
Kini, perkembangan sel bahan bakar berkembang sangat pesat, terutama di bidang otomotif dan alat elektronik. Misalnya mobil keluaran Honda yang menggunakan sel bahan bakar (Gambar 2.2) dan yang terbaru saat ini adalah sel bahan bakar menggunakan film keramik yang disebut Low Temperature Co-fired Ceramic (LTCC) (Gambar 2.3). LTCC memang terbuat dari keramik, tetapi LTCC terlihat seperti film fleksibel yang dapat dengan mudah ditekuk dan akan kembali lagi ke bentuk asalnya karena sebenarnya material LTCC terdiri dari 50 % keramik dan 50 % polimer. (18,22,23)
Gambar 2.2 Mobil sel bahan bakar Honda
Sel bahan bakar LTCC dapat menggunakan berbagai macam bahan bakar – terutama hidrogen dan metanol, serta bahan bakar lain seperti asam format. Asam format merupakan sumber energi yang sangat baik, tetapi dapat menyebabkan korosi pada material sel bahan bakar biasa. Namun, material keramik pada LTCC dapat tahan terhadap asam format.(6,18,19,20)
Sejumlah 50 mL bahan bakar yang terdiri atas 67 % metanol dalam air kini dapat untuk 27 jam waktu bicara pada telepon seluler atau 1 hingga 2 bulan dalam keadaan standby. Dalam rangkaian sel bahan bakar mikro ini, terdapat prosesor bahan bakar tempat berlangsungnya reaksi reformasi kukus. Di sini campuran metanol dan air akan bereaksi dalam saluran mikro seukuran rambut manusia yang telah dilapisi atau diisi oleh katalis. Dari reaksi tersebut akan dihasilkan gas hidrogen yang akan memasuki sel bahan bakar dan bereaksi dengan gas oksigen menghasilkan arus listrik dan air.(21)
Gambar 2.3 Sel bahan bakar terbaru
(a) Sel bahan bakar mikro (LTCC); (b) telepon seluler yang menggunakan sel bahan bakar mikro (LTCC) (Dalam keadaan standby, telepon seluler ini dapat bertahan 1 hingga 2 bulan)
2.1.3 Prinsip Kerja
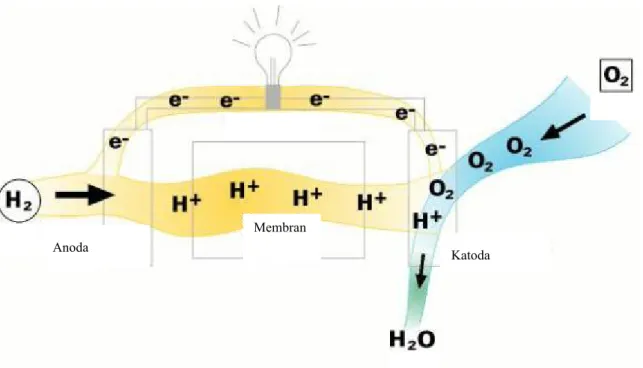
Fuel cell terdiri atas anoda, katoda, elektrolit, dan katalis. Di anoda, dengan bantuan katalis
bahan bakar (umumnya gas hidrogen) mengalami oksidasi membentuk dua ion H+. Reaksi
yang terjadi di anoda adalah sebagai berikut: H2 Æ 2H+ + 2e
-Ion H+ yang dihasilkan akan melewati membran elektrolit dan menuju katoda, sedangkan
elektonnya akan bergerak melalui sirkuit luar dan menghasilkan arus listrik, lalu bergerak lagi menuju katoda. Di katoda, ion H+, oksigen, dan elektron bereaksi menghasilkan air,
H2O. Reaksi yang terjadi adalah sebagai berikut:
1/2O2 + H+ + 2e- Æ H2O
Sehingga, total reaksi keseluruhan adalah 2H2 + O2 → 2H2O.
Reaksi lengkapnya adalah sebagai berikut:
Anoda : 2H2 Æ 4H+ + 4e- Eo = 0 V
Katoda : O2 + 4H+ + 4e-Æ 2H2O Eo = 1,23 V
Reaksi keseluruhan : 2H2 + O2 Æ 2H2O (2,3,6,24,25)
Anoda Katoda
Membran
2.1.4 Jenis-Jenis
Sel bahan bakar diklasifikasikan berdasarkan jenis elektrolitnya. Hal inilah yang menentukan jenis reaksi kimia yang terjadi di dalam sel, jenis katalis yang diperlukan, rentang suhu operasi sel, jenis bahan bakar, dan faktor-faktor lainnya. Karakteristik tersebut menentukan aplikasi yang sesuai untuk masing-masing sel bahan bakar. Di bawah ini merupakan beberapa jenis sel bahan bakar yang saat ini masih dalam tahap pengembangan. 1. PEMFC (Proton Exchange Membrane Fuel Cell)
Proton Exchange Membrane Fuel Cells (PEMFC) — atau sering juga disebut Polymer Electrolyte Membrane Fuel Cells — memiliki berbagai kelebihan dibandingkan jenis sel
bahan bakar lainnya. Antara lain PEMFC memiliki berat dan volume yang kecil, lebih efisien, dan suhu operasinya rendah, yaitu sekitar 80°C. Rendahnya suhu operasi ini menyebabkan singkatnya waktu pemanasan (warm-up time).(24) PEMFC menggunakan polimer padat sebagai elektrolit dan karbon berpori yang mengandung katalis platina sebagai elektroda. Untuk beroperasi, PEMFC hanya membutuhkan hidrogen, oksigen dari udara bebas, dan tidak memerlukan fluida yang bersifat korosif seperti beberapa jenis sel bahan bakar lainnya. Karena singkatnya waktu pemanasan dan bobotnya yang ringan, PEMFC sangat cocok untuk digunakan pada kendaraan dan alat-alat elektronik.
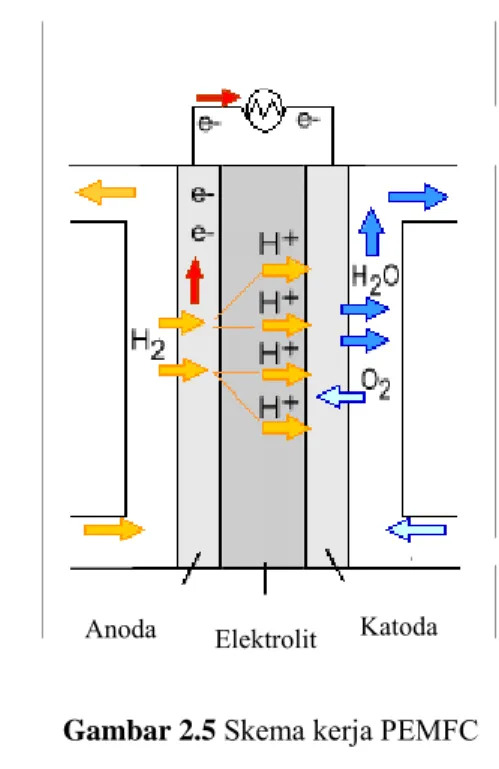
Proses yang terjadi saat PEMFC beroperasi adalah sebagai berikut:
a. Gas hidrogen sebagai bahan bakar dialirkan menuju anoda, sedangkan gas oksigen dari udara bebas dialirkan menuju katoda.
b. Di anoda, katalis platinum menyebabkan hidrogen pecah menjadi ion hidrogen yang bermuatan positif (H+) dan elektron yang bermuatan negatif (e-).
c. Membran pada PEMFC hanya melewatkan ion H+ menuju katoda, sedangkan elektron akan melewati sirkuit luar menuju katoda dan menghasilkan arus listrik.
d. Di katoda, elektron dan ion H+ bergabung dengan gas oksigen dari udara membentuk air yang akan keluar dari sel bahan bakar.
Skema kerja PEMFC dapat dilihat pada Gambar 2.5.(17)
Katoda Elektrolit
Anoda
Gambar 2.5 Skema kerja PEMFC
2. AFC (Alkaline Fuel Cell)
Tipe sel ini adalah jenis yang tertua. AFC digunakan pada pesawat luar angkasa Amerika Serikat sejak 1960-an. AFC sangat mudah terkontaminasi oleh CO2, sehingga memerlukan
gas hidrogen dan oksigen murni. Keracunan CO2 pada sel ini mempengaruhi operasi dan
usia sel. Sel bahan bakar ini menggunakan larutan kalium hidroksida dalam air sebagai elektrolit. AFC beroperasi pada 100ºC dan 250ºC. Kini, terdapat AFC yang beroperasi pada suhu rendah, yaitu antara 23ºC hingga 70ºC. Namun, sel jenis ini harganya sangat mahal, sehingga tidak cocok untuk dikomersialkan.
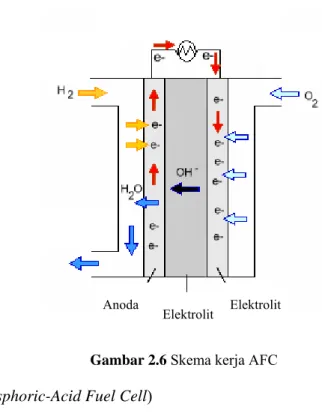
Proses yang terjadi saat AFC beroperasi adalah sebagai berikut:
a. Gas hidrogen sebagai bahan bakar dialirkan menuju anoda, sedangkan gas oksigen dialirkan menuju katoda.
b. Di anoda, katalis platinum menyebabkan hidrogen pecah menjadi ion hidrogen yang bermuatan positif (H+) dan elektron yang bermuatan negatif (e-).
c. Ion H+ akan bereaksi dengan ion OH- dari elektrolit dan membentuk air, sedangkan
elektron akan melewati sirkuit luar menuju katoda dan menghasilkan arus listrik.
d. Di katoda, elektron akan bergabung dengan oksigen dan air untuk membentuk ion OH
Skema kerja AFC dapat dilihat pada Gambar 2.6.(17)
Anoda Elektrolit
Elektrolit
Gambar 2.6 Skema kerja AFC
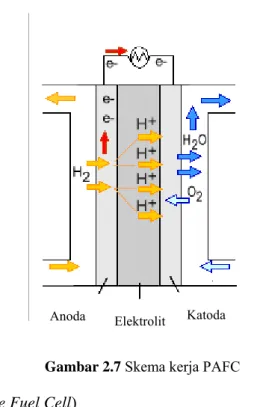
3. PAFC (Phosphoric-Acid Fuel Cell)
PAFC sangat potensial digunakan untuk pembangkit tenaga listrik berskala kecil. Suhu operasinya lebih tinggi daripada PEMFC, sehingga memerlukan waktu pemanasan yang lama. Hal ini menyebabkan PAFC tidak cocok digunakan di kendaraan. Selain itu sel ini memiliki berat dan volume yang besar, serta harga yang mahal.
PAFC menggunakan asam fosfat sebagai elektrolit dan karbon berpori yang mengandung katalis platinum sebagai elektroda. Asam fosfat tersebut terdapat pada matriks silikon karbida yang berikatan dengan Teflon.
Proses yang terjadi saat PAFC beroperasi adalah sebagai berikut:
a. Gas hidrogen sebagai bahan bakar dialirkan menuju anoda, sedangkan gas oksigen dari udara bebas dialirkan menuju katoda.
b. Di anoda, katalis platinum menyebabkan hidrogen pecah menjadi ion hidrogen yang bermuatan positif (H+) dan elektron yang bermuatan negatif (e-).
c. Asam fosfat sebagai elektrolit hanya melewatkan ion H+ menuju katoda, sedangkan
elektron akan melewati sirkuit luar menuju katoda dan menghasilkan arus listrik.
d. Di katoda, elektron dan ion H+ bergabung dengan gas oksigen dari udara membentuk air yang akan keluar dari sel bahan bakar.
Skema kerja PAFC dapat dilihat pada Gambar 2.7.(17)
Katoda Elektrolit
Anoda
Gambar 2.7 Skema kerja PAFC
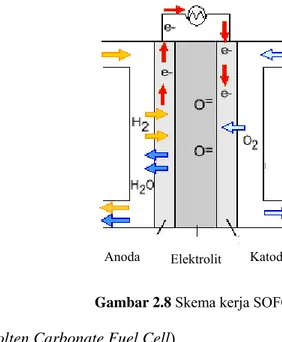
4. SOFC (Solid Oxide Fuel Cell)
SOFC menggunakan keramik yang keras dan tak berpori sebagai elektrolitnya (umumnya zirkonium oksida). Sel ini beroperasi pada suhu tinggi sekitar 1000oC. Tingginya suhu ini
menyebabkan SOFC tidak membutuhkan logam mulia sebagai katalisnya, sehingga dapat menurunkan harga jualnya. SOFC juga dapat mengubah bentuk bahan bakar dalam sel, sehingga tidak dibutuhkan reformer pada sistemnya. Namun, tingginya suhu yang diperlukan untuk mengoperasikan SOFC memiliki kekurangan, antara lain waktu pemanasan (warm-up time) yang lama dan dibutuhkannya sistem pengamanan panas di bagian luarnya. Oleh karena itu, SOFC tidak sesuai untuk diaplikasikan pada kendaraan dan alat elektronik. Walaupun demikian, sel ini sangat sesuai digunakan untuk pembangkit tenaga listrik berskala besar, sehingga dapat menyediakan listrik untuk pabrik maupun sebuah kota. SOFC juga merupakan sel bahan bakar yang paling tahan terhadap sulfur dan karbon monoksida (CO).
Proses yang terjadi saat SOFC beroperasi adalah sebagai berikut:
a. Gas hidrogen sebagai bahan bakar dialirkan menuju anoda, sedangkan gas oksigen dari udara bebas dialirkan menuju katoda.
b. Di katoda, katalis menyebabkan elektron dari sirkuit luar bergabung dengan oksigen dan membentuk ion oksigen bermuatan negatif (O2-).
d. Di anoda, katalis menyebabkan hidrogen bereaksi dengan ion O2- membentuk air dan
elektron.
e. Elektron akan melalui sirkuit luar menuju katoda dan menghasilkan arus listrik. Skema kerja SOFC dapat dilihat pada Gambar 2.8.(17)
Katoda Elektrolit
Anoda
Gambar 2.8 Skema kerja SOFC
5. MCFC (Molten Carbonate Fuel Cell)
MCFC menggunakan elektrolit yang terdiri dari campuran lelehan garam karbonat yang tersuspensi pada pori matriks keramik inert litium aluminium oksida (LiAlO2). Sel ini juga
sangat sesuai digunakan untuk pembangkit tenaga listrik berskala besar. Suhu operasinya sekitar 600oC, lebih rendah daripada SOFC. Hal ini menyebabkan tidak diperlukannya
material khusus untuk MCFC, sehingga harganya bisa lebih murah.
Seperti SOFC, MCFC juga resisten terhadap CO dan CO2, tetapi tidak terlalu resisten
terhadap sulfur dan partikulat dari batu bara. Kelemahan utama dari MCFC adalah usianya yang tidak terlalu panjang. Tingginya suhu operasi sel dan elektrolit yang korosif dapat mengurangi usia MCFC.
Proses yang terjadi saat MCFC beroperasi adalah sebagai berikut:
a. Gas hidrogen sebagai bahan bakar dialirkan menuju anoda, sedangkan gas oksigen dari udara bebas, CO2, dan elektron dari sirkuit luar dialirkan menuju katoda.
b. Di katoda, oksigen, CO2, dan elektron bereaksi membentuk ion oksigen yang bermuatan
positif dan ion karbonat yang bermuatan negatif (CO32-).
d. Di anoda, katalis mendorong hidrogen untuk bergabung dengan ion karbonat membentuk air, CO2, dan melepaskan elektron yang akan mengalir melalui sirkuit luar.
e. CO2 yang terbentuk di anoda didaur ulang kembali menuju katoda.
Skema kerja MCFC dapat dilihat pada Gambar 2.9.(17)
Anoda Elektrolit Katoda
Gambar 2.9 Skema kerja MCFC
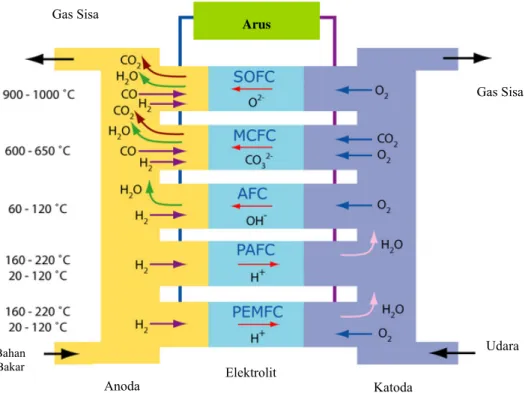
Perbandingan skema kerja keseluruhan sel dapat dilihat pada Gambar 2.10.(18)
Katoda Elektrolit Anoda Gas Sisa Udara Gas Sisa Arus Bahan Bakar
2.2 Sumber-Sumber Hidrogen untuk Sel Bahan Bakar
Hidrogen sebagai sumber energi mulai dikenal sejak 1874. Saat itu Jules Verne menulis novel yang berjudul “The Mysterious Island”. Pada novel tersebut diceritakan tentang energi yang bersumber pada air dan hidrogen. Namun pada saat itu, hidrogen sebagai sumber energi masih dianggap cerita fiksi belaka. Padahal pada tahun 1830, teknologi yang menggunakan hidrogen sebagai bahan bakar telah ditemukan.(26)
Namun, terdapat beberapa kendala dalam menerapkan hidrogen sebagai bahan bakar, antara lain harga hidrogen murni yang sangat mahal, ketersediaannya yang terbatas, serta penyimpanannya yang relatif sulit. Stasiun pengisian bahan bakar hidrogen (gambar) juga berbahaya karena bila terjadi kebocoran dapat berakibat sangat fatal.
Terdapat beberapa metode untuk memproduksi hidrogen, antara lain elektrolisis air [yang terdiri dari pemecahan air secara biologi (biological water-splitting), fotoelektrolisis, dan pemecahan air menggunakan panas matahari (solar thermal water splitting)], reformasi biomasa, dan reformasi bahan bakar fosil (minyak bumi, batubara, dan gas alam).(26) Sayangnya metode-metode tersebut menghabiskan biaya yang sangat tinggi karena alat yang dibutuhkan sangat rumit. Metode yang cukup populer yaitu reformasi metana (gas alam). Namun, metode ini dapat menghasilkan hasil samping yang tidak diinginkan, yaitu CO2.
Saat ini sedang dilakukan penelitian mengenai perilaku hidrida logam dan campuran kaya hidrogen seperti sodium borohidrida (NaBH4) pada penyimpanan bertekanan tinggi.(3)
Tetapi lagi-lagi terbentur masalah pada pengaplikasiannya karena harga jualnya yang mahal. Hidrogen bisa juga didapatkan dari metanol.(9) Metanol, selain merupakan sumber yang
terbarukan, juga murah, dan mudah mendapatkannya. Bahkan, metanol bisa didapatkan dari selulosa (jenis polisakarida yang ada di hampir semua tumbuhan) dengan reaksi enzimatik, dari hasil samping distilasi kayu, dan dari metabolisme anaerob beberapa jenis bakteri. Hal tersebut menunjukkan bahwa metanol tidak akan pernah habis dari muka bumi ini. Selain itu, konversi metanol menjadi hidrogen berlangsung pada suhu yang tidak terlalu tinggi (200-400oC). Rasio H/C yang tinggi pada metanol juga menyebabkan terbentuk gas hidrogen dengan konsentrasi tinggi dari metanol (efisiensinya mencapai 75%).(8,10,26) Oleh
karena itu, metanol sangat cocok bila digunakan sebagai sumber hidrogen pada sel bahan bakar.
Gambar 2.11 Stasiun pengisian bahan bakar hidrogen
2.3 Reaksi Konversi Metanol Menjadi Hidrogen
Ada empat reaksi yang menghasilkan hidrogen dari metanol, yaitu dekomposisi metanol (DM), oksidasi parsial metanol (OPM), dan reformasi kukus metanol (RKM) atau Steam
Reforming of Methanol (SRM), dan reformasi kukus metanol oksidatif (RKMO). Keempat
reaksi tersebut dijelaskan lebih lanjut di bawah ini. a. Dekomposisi Metanol (DM)
Reaksi yang terjadi pada dekomposisi metanol (DM) adalah sebagai berikut: CH3OH
≡
2H2+ CO ∆H° = +128 kJ mol-1Dapat dilihat bahwa proses ini sangat endotermik dan menghasilkan gas karbon monoksida (CO) yang dapat meracuni katalis pada sel bahan bakar. Oleh karena itu, proses ini tidak sesuai digunakan pada sel bahan bakar.(10)
b. Oksidasi Parsial Metanol (OPM)
Reaksi yang terjadi pada oksidasi parsial metanol (OPM) adalah sebagai berikut: CH3OH + 1/2O2 Æ 2H2 + CO2 ∆Ho = -155 kJ mol-1
Berbeda dengan DM, reaksi OPM merupakan reaksi yang eksoterm. Panas yang dihasilkan dari reaksi tersebut dapat mengakibatkan sintering (penggumpalan) dari partikel katalis,
sehingga katalis menjadi terdeaktivasi. Jumlah hidrogen maksimal, yaitu sekitar 66% hanya dapat dipenuhi bila oksigen yang digunakan untuk reaksi merupakan oksigen murni. Jika reaksi OPM diterapkan dalam kendaraan yang menggunakan sel bahan bakar, hidrogen yang diproduksi hanya sekitar 41% karena oksigen yang digunakan bukan oksigen murni, melainkan oksigen dari udara bebas. Deaktivasi juga akan terjadi saat menggunakan udara bebas sebagai reaktan karena senyawa sulfur dan klorin dari udara akan dapat meracuni material katalis.(10)
c. Reformasi Kukus Metanol (RKM)
Dibandingkan dengan kedua reaksi di atas, reaksi RKM lebih baik karena dapat menghasilkan gas hidrogen dengan konsentrasi tinggi (75%) dan gas karbon monoksida dengan konsentrasi yang sangat rendah.(9) Selain itu, selektivitasnya terhadap gas karbon dioksida juga sangat tinggi.(10) Reaksi yang terjadi pada RKM adalah sebagai berikut:
CH3OH + H2O ≡ 3H2 + CO2 ∆Ho = 49,4 kJ mol-1(27)
Pemaparan lebih jauh mengenai reaksi RKM dapat dilihat pada sub.bab 2.7. d. Reformasi Kukus Metanol Oksidatif (RKMO)
Cara ini merupakan kombinasi antara reaksi reformasi kukus metanol dan oksidasi parsial metanol. Reaksi yang terjadi pada RKMO adalah sebagai berikut:
CH3OH+(1 – x)H2O+ ½ x O2 ≡ (3 – x) H2+CO2(3)
Dengan cara ini, panas yang dihasilkan dari reaksi oksidasi parsial metanol dapat digunakan pada reaksi reformasi kukus metanol.(27)
2.4 Katalis RKM
Katalis adalah suatu zat yang mempercepat laju reaksi kimia pada suhu tertentu, tanpa mengalami perubahan atau terpakai oleh reaksi itu sendiri. Katalis memungkinkan reaksi berlangsung lebih cepat atau memungkinkan reaksi pada suhu lebih rendah akibat perubahan yang dipicunya terhadap pereaksi. Katalis menyediakan suatu jalur pilihan dengan energi aktivasi yang lebih rendah dan mengurangi energi yang dibutuhkan untuk berlangsungnya reaksi.(26,27)
Katalis dapat dibedakan ke dalam dua golongan utama: katalis homogen dan katalis heterogen. Katalis heterogen adalah katalis yang ada dalam fase berbeda dengan pereaksi dalam reaksi yang dikatalisisnya, sedangkan katalis homogen berada dalam fase yang sama.
Satu contoh sederhana untuk katalisis heterogen yaitu bahwa katalis menyediakan suatu permukaan di mana pereaksi-pereaksi (atau substrat) untuk sementara terjerap. Ikatan dalam substrat-substrat menjadi lemah sedemikian sehingga memadai terbentuknya produk baru, ikatan antara produk dan katalis lebih lemah, sehingga akhirnya terlepas.
Katalis untuk sintesis metanol dari hidrogen dan karbon dioksida ternyata dapat juga digunakan untuk katalis RKM karena reaksi RKM merupakan reaksi kebalikan dari reaksi sintesis metanol.(28) Katalis yang umum digunakan adalah katalis berbasis logam Cu karena
katalis tersebut mampu memberikan aktivitas dan selektivitas yang tinggi pada suhu operasi rendah dibandingkan dengan katalis berbasis logam lainnya.(11)
Pada tahun 1980-an, Takezawa melaporkan penelitian mereka tentang katalis Cu/SiO2 yang
dibandingkan dengan katalis Pt/SiO2. Ternyata katalis Cu/SiO2 dengan persen berat Cu lebih
besar atau sama dengan 10% atau dikalsinasi pada suhu yang tinggi memiliki selektivitas yang lebih tinggi dan aktivitasnya lebih baik karena adanya CuO yang terreduksi menjadi Cu selama reaksi RKM.(29)
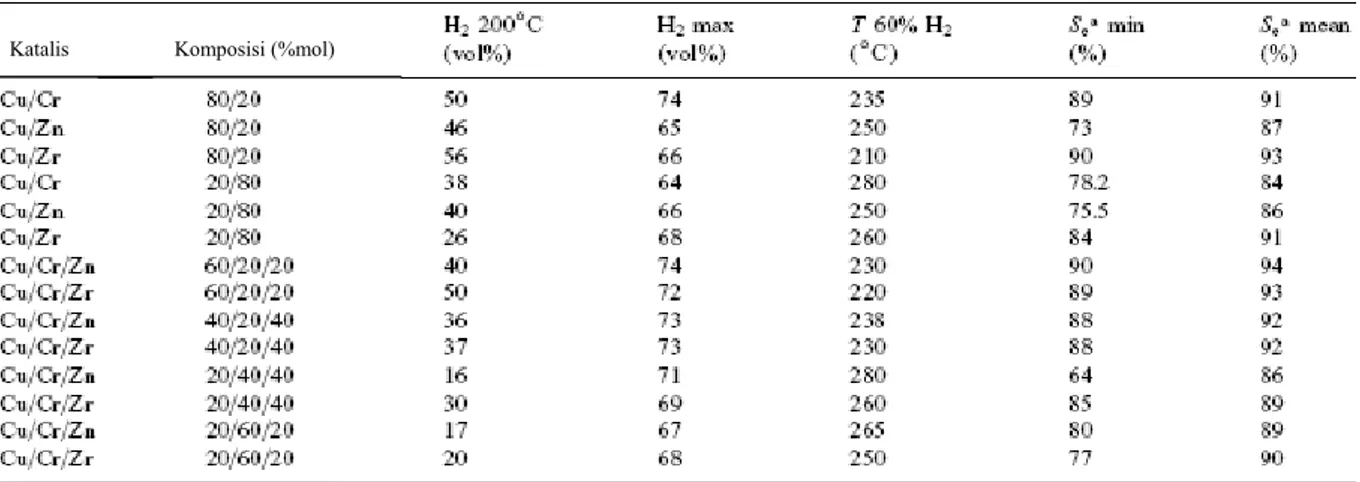
Lindstrom telah meneliti bahwa semakin banyak jumlah mol Cu pada katalis untuk RKM, maka katalis akan semakin selektif terhadap CO2, menghasilkan gas hidrogen dengan
konsentrasi lebih tinggi pada seluruh rentang suhu. Seluruh katalis yang mengandung jumlah Cu yang besar dan menggunakan penyangga zirkonia diuji aktivitasnya dan ternyata menghasilkan gas hidrogen di atas 60% pada temperatur rendah. Hasil percobaan dari Linstrom dapat dilihat pada Tabel 2.1.(30)
Tabel 2.1 Hasil percobaan Linstrom
Di sisi lain, hasil analisis EXAFS (Extended X-Ray Absorption Fine Structure) Szizybalski menunjukkan bahwa semakin besar jumlah oksigen dalam kumpulan logam Cu, maka aktivitas pada reaksi RKM akan makin meningkat. Setelah beberapa saat yang cukup lama (673 K, 2% volume H2/He), katalis masih tetap aktif. Konsentrasi Cu juga memegang Katalis
aS
e: Selektivitas CO2
peranan penting. Pada konsentrasi Cu yang rendah (lebih rendah dari 15%), akan dicapai interaksi yang terbaik.(10)
2.4.1 Zirkonia (ZrO
2) sebagai penyangga katalis reaksi RKM
Selama ini, katalis yang banyak digunakan, baik untuk RKM maupun sintesis metanol,
lah diteliti katalis RKM berbasis Cu dengan penyangga zirkonia (ZrO2). Zirkonia
rapa orang penulis juga menyebutkan kegunaan dari penyangga zirkonia untuk katalis,
n penyangga ZrO2
Gamba /ZrO2
Naiknya aktivitas katalitik setelah dialiri gas oksigen berhubungan dengan adanya transisi adalah Cu/ZnO/Al2O3. Namun, katalis ini tidak tahan lama, memiliki ketahanan termal yang
rendah, menghasilkan gas CO dengan konsentrasi tinggi, dan mengalami deaktivasi selama reaksi.(10,12)
Kini te
memiliki konduktivitas ionik dan kekuatan mekanik yang tinggi. Bila dibandingkan dengan Cu/ZnO/Al2O3, katalis dengan penyangga zirkonia memiliki kestabilan yang jauh lebih lama,
sehingga tidak mudah untuk terdeaktivasi, kemungkinan karena zirkonia lebih efektif untuk mencegah sintering Cu. Selain itu penyangga zirkonia dapat menekan pembentukan gas CO.(9,10,13)
Bebe
yaitu dapat menurunkan temperatur reduksi CuO secara drastis. Hasil ini menunjukkan bahwa adanya interaksi Cu/penyangga, yang menjembatani reduksi tembaga (II) oksida. Alasan yang tepat dari hasil ini masih menjadi kontroversi banyak pihak.(10)
Szizybalski menjelaskan bahwa oksigen yang dialirkan pada permukaa
dapat menstabilkan oksidasi parsial oksida Cu. Skema representasi partikel Cu pada penyangga ZrO2 dalam katalis Cu/ZrO2 dapat dilihat pada Gambar 2.12.(10)
r 2.12 Skema representasi partikel Cu pada penyangga ZrO2 dalam katalis Cu
a) setelah direduksi oleh hidrogen; b) setelah dialiri gas oksigen pada umpan RKM.
dari permukaan mikrostruktur partikel Cu ideal (Gambar 2.12 a) menjadi partikel Cu yang lebih acak (terstabilkan oleh oksigen), sehingga menghasilkan bentuk permukaan yang
termodifikasi. Bentuk permukaan seperti b merupakan bentuk yang lebih aktif pada reaksi RKM. Cara sintesis katalis (seperti kopresipitasi dan impregnasi), pemilihan bahan prekursor, dan terkadang langkah-langkah sintesis (seperti pencucian dan kalsinasi), juga menentukan aktivitas katalis. Bila dibandingkan dengan katalis Cu/ZnO/Al2O3, katalis
dengan penyangga zirkonia tersebut terbukti lebih aktif, menghasilkan gas CO lebih sedikit, dan stabil lebih lama. Penelitian yang dilakukan Szizybalski tersebut menggunakan metanol dan air yang diumpankan ke reaktor sebanyak 1:1 dengan laju 0,07 mL/menit. Oksigen ditambahkan ke campuran reaktan tersebut dengan laju 50 mL/menit selama 5 menit.(10)
Hasil penelitian Szizybalski didukung oleh Dutta yang meneliti TPR (Temperature
Hasil analisis TPR akan me ksida, keadaan elektronik,
Programmed Reduction) dari katalis Cu/ZrO2. Hasil TPR tersebut dapat dilihat pada
Gambar 2.13.
Gambar 2.13 Hasil analisis TPR Dutta
nunjukkan temperatur reduksi dari o
dan interaksi katalis dengan penyangganya. Puncak ganda pada daerah sekitar 160oC terjadi
karena Cu2+ Æ Cu+ Æ Cuo mengalami kontak yang kuat dengan penyangga ZrO
2. Intensitas
puncak kedua di daerah sekitar 190-200oC akan semakin besar seiring dengan meningkatnya
konsentrasi Cu. Hal tersebut disebabkan oleh masih adanya endapan CuO yang berinteraksi dengan ZrO2.(31)
Breen dan Ross melaporkan bahwa aktivitas katalis Cu/ZrO2 meningkat dengan
meningkatnya jumlah Cu pada kondisi RKM (H2O:CH3OH = 1,3:1). Dilaporkan juga bahwa tidak ada CO yang terdeteksi dalam jumlah yang signifikan sampai pada suhu 280oC.
Penambahan alumina dan oksida zink pada katalis tersebut ternyata dapat meningkatkan dispersi Cu. Katalis dengan performa terbaik ada pada katalis Cu-Zn-Zr-Al.(32)
2.4.2 Zirkon (ZrSiO
4) sebagai sumber zirkonia
Zirkonia umumnya diproduksi dari zirkon (ZrSiO4). Untuk memproduksi zirkonia dari
zirkon, langkah pertama yang dilakukan adalah mengubah zirkon menjadi zirkonil klorida, seperti ditunjukkan pada Gambar 2.14. (33)
Zirkon (ZrSiO4) + NaOH
↓ Dilelehkan Na2ZrO3
↓ + HCl ZrOCl2 ·8H2O
Gambar 2.14 Diagram pembuatan zirkonil klorida dari zirkon
Terdapat dua metode untuk membuat zirkonia dari zirkonil klorida, yaitu dekomposisi termal dan presipitasi.
a.
Pertama-tama zirkonil klorida (ZrOCl2.8H2O) dipanaskan hingga 200°C. Awal mulanyaakan terjadi dehidrasi pada zirkonil klorida dan menjadi ZrOCl2 terdehidrasi. Langkah
selanjutnya, ZrOCl2 terdekomposisi menjadi gas klorin dan menjadi zirkonia pada
temperatur yang lebih tinggi. Setelah dikalsinasi, dilakukan proses penyeragaman ukuran pada butiran zirkonia, menggunakan proses seperti ball milling, menjadi ukuran partikel yang diinginkan, umumnya hingga 325 mesh. Metode ini cukup ekonomis untuk dilakukan. Namun, sulit untuk dapat menghasilkan zirkonia dengan kemurnian tinggi dan ukuran partikel yang seragam menggunakan metode ini.
b.
Pada metode presipitasi, digunakan reaksi kimia untuk mendapatkan zirkonium hidroksida sebagai intermediet. Proses ini dapat dideskripsikan pada Gambar 2.15.ZrOCl2 ·8H2O
↓
Larutan ↓ + Presipitat NH4OH Intermediet Zr(OH)4↓
Dicuci Cl--bebas presipitat↓
Filtrasi Butiran basah Zr(OH)4↓
Pendinginan kering (N2 cair)Butiran kering Zr(OH)4
↓
Kalsinasi Butiran zirkonia ZrO2Pada metode ini, ukuran dan bentuk partikel dapat dimodifikasi dengan mengontrol proses presipitasi dan kondisi kalsinasi. Kemurnian zirkonia yang dihasilkan juga dapat dikontrol.(14) Zirkon juga dapat direduksi mengunakan karbon pada suhu 1400-1650oC
menjadi zirkonia ZrO2.(33) Namun, semua proses di atas membutuhkan perlakuan tertentu
yang menambah harga jual dari zirkonia.
2.4.3 Zirkon (ZrSiO
4) sebagai penyangga katalis reaksi RKM
Agar dapat menjadi penyangga katalis, sifat-sifat material yang dibutuhkan antara lain memiliki tingkat kekerasan (hardness) yang sangat tinggi, inert, memiliki titik leleh yang sangat tinggi, dan memiliki luas permukaan yang besar (10-3000 m2/g). Diharapkan pada
penyangga akan terjadi dispersi optimal dari fasa aktif dan stabilisasi terhadap sintering.(34) Zirkon memiliki beberapa kelebihan, antara lain tingkat kekerasan (hardness) yang sangat tinggi dan stabilitas termal yang sangat baik. Tingkat kekerasan dan stabilitas termal yang baik merupakan sifat fisik yang sangat penting karena proses fabrikasi katalis akan berlangsung pada perubahan tekanan dan temperatur yang drastis yang dapat menyebabkan putusnya ikatan-ikatan pada permukaan material katalis.(16) Oleh karena itu zirkon dapat
dijadikan sebagai penyangga katalis. Namun selama ini zirkon belum pernah dijadikan sebagai penyangga katalis.
Zirkon, atau disebut juga zirkonium silikat (ZrSiO4) tergolong ke dalam kelas neosilikat dari
mineral silikat. Zirkon mengandung tetrahedral SiO4 yang terisolasi (Gambar 2.16). Tiap
atom zirkonium terletak antara 8 atom oksigen yang tersusun pada sudut ZrO8 dodekahedral
triangular. Pada strukturnya, terdapat sharing sisi tepi SiO4 tetrahedral dan ZrO8
dodekahedral.
Zr
Zirkon merupakan hasil samping dari pertambangan timah. Keberadaan zirkon di alam sangat melimpah. PT Timah Tbk. sendiri menghasilkan zirkon sekitar 200 ton per tahun. Karena memiliki koefisien ekspansi termal yang rendah dan ketahanan termal yang tinggi, zirkon banyak ditemui pada berbagai industri keramik dan barang pecah belah.(35)
2.5 Metoda Sintesis Katalis RKM
Terdapat bermacam-macam metode sintesis katalis. Pemilihan metode yang digunakan tergantung pada kebutuhan dan dipengaruhi oleh banyak faktor, antara lain sifat kimia dari komponen katalis, prekusor, perbedaan komposisi, sifat fisik dan kondisi reaksi yang digunakan untuk menghilangkan kontaminan.(36) Terdapat dua metode yang paling sering
digunakan untuk sintesis katalis RKM, yaitu impregnasi dan kopresipitasi.
2.5.1 Impregnasi
Pengertian dari impregnasi adalah proses penjenuhan total sesuatu menggunakan zat tertentu. Misalnya penjenuhan kapas menggunakan eter.(37) Banyak katalis yang disintesis dengan
metode ini. Metode ini merupakan teknik preparasi katalis yang paling sering digunakan daripada metode lainnya. Alasan utamanya adalah karena kemudahan dalam pengerjaannya. Tujuannya adalah untuk mengisi pori-pori menggunakan larutan garam logam dengan konsentrasi tertentu.(38) Setelah diimpregnasi, langkah selanjutnya adalah pengeringan dan pemanasan pada suhu tinggi (kalsinasi), sehingga terjadi dekomposisi prekursor menjadi spesi aktif.(8)
Terdapat dua metode impregnasi, yaitu impregnasi basah (wet impregnation) dan impregnasi kering (dry impregnation).(39) Pada impregnasi basah, jumlah larutan prekursor fasa aktif
ditambahkan ke penyangga melebihi volume pori penyangga. Walaupun metode ini adalah yang termudah, tetapi dapat menghasilkan deposisi prekursor fasa aktif yang sangat banyak pada bagian luar penyangga setelah dikeringkan dan menghasilkan distribusi fasa aktif mirip kulit telur pada bagian luar penyangga. Distribusi seperti ini bermanfaat bila dilihat dari sisi aplikasi karena dapat mengurangi kebutuhan penetrasi reaktan ke dalam katalis, sehingga dapat meningkatkan aktivitas katalis. Namun lama kelamaan dapat terjadi abrasi pada permukaan katalis selama reaksi. Oleh karena itu metode impregnasi lain dikembangkan untuk mengatasi masalah ini, yaitu impregnasi kering. Metode ini sering juga disebut impregnasi tetes menggantung (incipient wetness impregnation). Pada metode ini, jumlah larutan prekursor fasa aktif yang ditambahkan sama dengan jumlah volume penyangga. Kondisi pengeringan sangat mempengaruhi distribusi prekursor fasa aktif pada material
penyangga. Oleh karena itu, perlu dilakukan kontrol laju pengeringan. Ilustrasi metode impregnasi ditunjukkan oleh Gambar 2.17. (34)
Larutan garam logam Penyangga terimpregnasi Kalsinasi T = 400oC Reduksi Katalis Aktif Penyangga
Gambar 2.17 Ilustrasi metode impregnasi
2.5.2 Kopresipitasi
Kopresipitasi menurut kamus Oxford adalah proses yang menyebabkan suatu zat dari bentuk cairan menjadi berbentuk padat. Pada metode ini komponen-komponen prekursor katalis dicampurkan kemudian diendapkan bersama-sama pada pH tertentu dengan penambahan bahan pengendap. Pengendapan ini dikarenakan oleh pengaruh ion senama yang ditambahkan pada larutan. Hal ini tentu saja membuat zat yang kelarutannya kecil untuk mengendap lebih dahulu.(3) Tujuan utama kopresipitasi adalah untuk menghasilkan
campuran yang merata antar komponen katalis dan pembentukan partikel yang sangat kecil untuk menyediakan luas permukaan yang luas.(40)
Contoh gambaran umum kopresipitasi menurut Purnama adalah sebagai berikut. Larutan Cu(NO3)2/Zn(NO3)2 dan larutan kopresipitat (Na2CO3) dicampurkan bersama pada
temperatur yang lebih tinggi dari lingkungan sekitarnya, misalnya 65oC, sambil terus diaduk.
Kemudian, endapan yang terbentuk disaring, dicuci dengan aquades, dan dikeringkan pada suhu 120oC selama beberapa jam. Prekursor lalu dikalsinasi pada suhu 350oC. Parameter
reaksi seperti pH, temperatur, waktu atau lamanya proses, urutan pencampuran, pengadukan, dan pencucian menjadi sangat berpengaruh pada struktur dan aktivitas katalis.(9) Ilustrasi
Larutan garam logam
Perubahan T, pH, konsentrasi
Penurunan kelarutan logam
Gambar 2.18 Ilustrasi metode kopresipitasi
2.6 Karakterisasi Katalis RKM
Karakterisasi katalis dapat dilakukan dengan metode difraksi sinar-X untuk mengetahui fasa ruah, ukuran partikel, dan struktur katalis; dan BET untuk mengetahui luas permukaan katalis.
2.6.1 Difraksi Sinar-X
Gambar 2.19 Penataan tipe geometri Bragg-Brentano pada analisis XRD
Penataan tipe geometri Bragg-Brentano pada analisis XRD diberikan pada Gambar 2.19. Dengan penataan tersebut, maka akan dapat mengukur refleksi geometri. Sinar datang dan sampel memenuhi sudut Bragg θ (theta). Setelah sinar datang didifraksikan pada sampel, detektor mengukur intensitas sinar yang dipantulkan. Sinar datang dan sinar pantul memenuhi sudut 2θ. Puncak pada pola sinar X akan diduplikasikan agar memenuhi persamaan Bragg, yaitu nλ = 2 dhkl sin θ, di mana λ = panjang gelombang, dhkl = jarak
Pola difraksi yang didapat merupakan representasi dari garis difraksi pada sudut 2θ, dan intensitasnya. Posisi puncak memuat informasi mengenai parameter lattice. Jarak garis difraksi (contohnya pada Gambar 2.20) biasa disebut Full Width at Half Maximum (FWHM). Bersama dengan intensitas, parameter ini menentukan ketajaman garis difraksi. Rumus dari Scherrer dapat memperkirakan ukuran kristal dengan menghubungkan luas puncak yang melebar dengan ketebalan kristal. Rumus Scherrer adalah sebagai berikut:
dengan β = FWHM, λ = panjang gelombang, K = faktor bentuk kristal: 0,89 untuk bentuk kubik and 0.94 untuk bentuk bulat, L = ketebalan kristal, θ = sudut Bragg.
Gambar 2.20 Contoh pola difraksi sinar-X
Intensitas puncak tergantung dari distribusi kerapatan elektronnya (struktur kristal). Struktur kristal sendiri ditentukan dari kisi kristal, simetri, penataan dan posisi atomnya. Intensitas puncak dapat menjadi indikator untuk kristalinitas sampel. Dengan semua data di atas, maka informasi pola difraksi, parameter kisi, dan ukuran kristal bisa didapatkan.(10)
2.6.2 Adsorpsi Isoterm Brunauer Emmett Teller (BET)
Firmansyah menyebutkan bahwa peristiwa adsorpsi gas pada permukaan padatan dapat dimanfaatkan untuk penentuan luas permukaan padatan jika adsorpsi gas dapat membentuk lapisan tunggal pada permukaan padatan. Penentuan luas permukaan ini dilakukan dengan pendekatan isoterm adsorpsi BET (Brunauer-Emmet-Teller). Dalam eksperimen, penentuan luas permukaan dilakukan dengan mengalirkan gas nitrogen ke permukaan padatan pada suhu tertentu. Luas permukaan dapat ditentukan dari perbandingan volume/jumlah partikel teradsorpsi yang membentuk lapisan tunggal (Vm) seperti persamaan berikut.
)
1
)(
1
(
X
x
CX
CX
Vm
V
+
−
−
=
dengan X = P/Po, P adalah tekanan gas yang teradsorpsi, Po adalah tekanan gas yang membentuk lapisan tunggal, dan C adalah konstanta adsorpsi-desorpsi (C = Kads/Kdes).
Persamaan di atas dapat disesuaikan dengan hasil eksperimen yang menghasilkan data berupa P atau V dengan cara membuat resiprok kedua sisi persamaan tersebut kemudian mengalikan kedua sisi dengan Vm dan X/(1-X), sehingga didapat persamaan sebagai berikut.
cVm
X
c
cVm
V
X
X
1
1
(
1
)
1
−
+
=
−
Persamaan akhir tersebut dapat diterapkan pada plot (x/1-x)1/V terhadap X, sehingga Vm dan c dapat ditentukan. Melalui dua nilai tersebut, luas permukaan dapat ditentukan.(8)
2.7 Uji Aktivitas Katalis RKM
Setelah dilakukan sintesis dan karakterisasi katalis, langkah selanjutnya adalah menguji aktif tidaknya katalis tersebut untuk reaksi yang dikatalisisnya. Untuk reaksi RKM, skema diagram kerjanya ditunjukkan pada Gambar 2.21. Metanol dan air diuapkan menggunakan evaporator dan dibawa menggunakan gas nitrogen lalu bereaksi dalam reactor yang dibantu oleh katalis. Gas hasil reaksi dianalisis menggunakan alat kromatografi gas. (30)
Gambar 2.21 Diagram alir RKM
1: Gas pembawa (Nitrogen)
2: Tank bahan bakar (air dan metanol) 3: Pompa
4: Pengontrol laju alir 5: Evaporator
6 : Reaktor 7 : Termokopel 8 : Alat GC
9 : Komputer untuk analisis hasil GC
10: Komputer untuk analisis hasil pengukuran suhu reaktor
2.7.1 Faktor-Faktor Penentu Aktivitas
a. Proses sintesis
Sintesis katalis RKM menggunakan metode kopresipitasi lebih disukai karena biasanya lebih mudah untuk memperoleh fasa aktif katalis berkonsentrasi tinggi dibandingkan dengan sintesis menggunakan metoda impregnasi.(40) Firmansyah telah meneliti bahwa pH
pengendapan berpengaruh terhadap distribusi komponen katalis pada permukaannya.(8)
b. Proses kalsinasi
Kalsinasi dibutuhkan untuk mengubah kristal-kristal yang ada pada katalis. Perubahan ini terjadi karena atom-atom karbon, hidrogen dan oksigen dapat teruapkan menjadi air dan karbon dioksida. Fasa setelah kalsinasi dapat bertahan lama untuk penyimpanan tetapi tidak aktif.(40)
c. Proses reduksi
Salah satu langkah penting setelah sintesis dan kalsinasi katalis berbasis Cu adalah reduksi dari oksida Cu. Proses reduksi oksida Cu tersebut tergantung dari fasa, loading dan dispersi prekursor, suhu kalsinasi, interaksi oksida Cu dengan zat penyangga, serta ukuran dan morfologi dari oksida Cu.(41) Sedangkan konsentrasi dan laju alir reduktor, laju pemanasan,
desain reaktor, dan properti dari katalis juga memegang peranan penting.(10)
CuO dapat terreduksi secara optimal menjadi Cu menggunakan gas hidrogen pada suhu 146-154oC.(42) Tahap reduksi adalah tahap yang sangat penting. Kesalahan pada tahap ini
mengakibatkan katalis menjadi tidak aktif. d. Stabilitas
Katalis sangat rentan terhadap deaktivasi. Kondisi yang salah serta adanya racun atau inhibitor dalam umpan dapat mendeaktivasi katalis. Menurut Twigg, deaktivasi pada katalis dapat disebabkan oleh racun katalis, sintering termal, pembentukan karbon, dan kerusakan fisik katalis.(36)
1. Racun katalis
Deaktivasi katalis berbasis Cu umumnya disebabkan oleh zat kimia sepert sulfur dan klorida yang dapat meracuni katalis. Racun katalis merupakan suatu agen yang bereaksi permanen dengan fasa aktif katalis. Belerang merupakan racun yang sangat kuat bagi setiap katalis berbasis tembaga.
Keberadaan belerang perlu dihindari di dalam reaktor karena tembaga sulfida (Cu2S)
cenderung tidak stabil dan masih dapat bereaksi kembali.
Senyawa klorida juga merupakan racun bagi katalis karena dapat bereaksi dalam bentuk asam klorida sesuai dengan reaksi di bawah ini.
Cu(s) + HCl(g) → CuCl(s) + 0,5 H2(g) ∆Ho = -43,5 kJ/mol
CuCl yang dihasilkan dari reaksi ini memiliki titik leleh yang rendah (430°C) dan interaksi antar CuCl memiliki pergerakan yang tinggi pada kondisi operasi reaksi. Pergerakan yang tinggi ini mengakibatkan rusaknya struktur kristal katalis, menyebabkan sintering dan berkurangnya aktivitas katalis. Oleh karena itu, kehadiran senyawa klorida (≥1 ppm) di dalam reaktor sebaiknya dihindari.(40)
2. Sintering termal
Agrell et.al. (2002) memberikan urutan kestabilan untuk logam: Ag < Cu < Au < Pd < Fe < Ni < Co < Pt < Rh < Ru < Ir < Os < Re. Berdasarkan urutan tersebut, dapat dilihat bahwa tembaga tidak stabil dan sangat rawan terhadap sintering termal. Tembaga juga memiliki titik leleh yang cukup rendah, sehingga reformasi kukus harus berlangsung pada suhu yang rendah.(40)
3. Pembentukan karbon
Twigg menemukan adanya pembentukan karbon pada reaksi reformasi kukus metanol. Hal ini dapat disebabkan oleh terjadinya reaksi disproporsionasi karbon monoksida dan reaksi karbon monoksida dengan hidrogen:
2CO → CO2 + C
CO + H2 → C + H2O
Reaksi ini sangat mungkin terjadi pada suhu yang rendah. Katalis yang sudah ditutupi oleh karbon akan menjadi kurang aktif.(40)
4. Kerusakan fisik
Kerusakan fisik katalis dapat berupa pecahnya katalis akibat vibrasi atau perubahan suhu drastis. Katalis berbasis tembaga umumnya rentan terhadap penyimpangan suhu yang akan memicu sintering termal kristalit tembaga, sehingga dapat menurunkan aktivitas katalis. Kontrol terhadap suhu menjadi penting untuk mencegah proses deaktivasi ini. Menurut Catillon, penggunaan katalis tembaga tanpa menggunakan penyangga yang berdaya tahan tinggi dapat menjadi masalah pada penerapan kendaraan bermotor.(43)
e. Temperatur reaksi RKM
Menurut penelitian Zhang, konversi metanol dan selektifitas CO akan meningkat seiring dengan meningkatnya temperatur. (3)
Konversi MeOH Konsentrasi CO Konsentrasi H2
Gambar 2.22 Pengaruh temperatur terhadap aktivitas katalis
f. Komposisi umpan
Zhang juga menemukan bahwa semakin banyak air yang diumpankan maka semakin besar pula konversi metanol yang diperoleh. Selektivitas CO juga semakin kecil seiring dengan semakin banyaknya air yang diumpankan. Mereka juga menyarankan untuk menggunakan rasio air : metanol = 1-1,5.(3)
Konversi MeOH Konsentrasi CO Konsentrasi H2
g. Waktu Kontak
Zhang juga meneliti tentang pengaruh waktu pemakaian katalis. Semakin tinggi waktu pemakaian katalis di reaktor maka konversi menurun. Hal ini disebabkan oleh katalis yang telah terdeaktivasi.(3)
Waktu/jam
Gambar 2.24 Pengaruh waktu pemakaian katalis terhadap aktivitas katalis
2.7.2 Parameter Unjuk Kerja Aktivitas Katalis
a. Konversi Metanol
Katalis yang disintesis diujikan pada alat reformasi kukus metanol agar diketahui aktivitas dan selektivitasnya. Komposisi gas keluaran hasil reformasi dianalisis menggunakan Gas
Chromatography (GC). Aktivitas katalis ditentukan dari tingkat konversi metanol tiap
metanol umpan. Sedangkan selektivitas dari katalis diketahui melalui perbandingan jumlah hidrogen terbentuk terhadap jumlah metanol yang terkonversi.(3)
Konversi dapat dihitung dengan persamaan berikut:
masuk keluar masuk OH molCH OH molCH OH molCH X 3 3 3 − = ; X = aktivitas katalis b. Selektivitas CO
Keberadaan CO dapat merusak elektroda platina pada sel bahan bakar. Oleh karena itu, pembentukan CO harus ditekan. Semakin sedikit produksi CO, yaitu sekitar 10-20 ppm, maka semakin baik pula katalis tersebut.(3)
Perolehan selektivitas CO dapat dihitung dengan persamaan berikut: 3 3 x masuk keluar