UNIVERSITAS INDONESIA
SISTEM PRODUKSI HIDROGEN MENGGUNAKAN REAKTOR GLOW DISCHARGE PLASMA ELECTROLYSIS DALAM LARUTAN KOH -
ETANOL
SKRIPSI
TAHER BATUBARA 0806456865
FAKULTAS TEKNIK DEPARTEMEN TEKNIK KIMIA
DEPOK JUNI 2012
UNIVERSITAS INDONESIA
SISTEM PRODUKSI HIDROGEN MENGGUNAKAN REAKTOR GLOW DISCHARGE PLASMA ELECTROLYSIS DALAM LARUTAN KOH –
ETANOL
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh gelar sarjana
TAHER BATUBARA 0806456865
FAKULTAS TEKNIK DEPARTEMEN TEKNIK KIMIA
DEPOK JUNI 2012
Puji syukur saya panjatkan kepada Tuhan Yesus Kristus atas anugerah, hikmat, dan karunia-Nya saya dapat menyelesaikan skripsi ini. Penulisan skripsi dengan judul “Sistem Produksi Hidrogen Menggunakan Reaktor Glow Discharge Plasma Electrolysis Dalam Larutan KOH - Etanol“ ini disusun untuk memenuhi sebagian persyaratan akademis dalam meraih gelar Sarjana Teknik di Departemen Teknik Kimia Fakultas Teknik Universitas Indonesia.
Dalam penyusunan skripsi ini saya mendapatkan banyak bantuan dan bimbingan dari berbagai pihak. Oleh karena itu, saya mengucapkan terima kasih kepada :
1. Bapak Dr. Ir. Nelson Saksono, MT., selaku dosen pembimbing skripsi atas ide, saran, dan dana untuk menyelesaikan penelitian dan skripsi. 2. Bapak Prof. Dr. Ir. Widodo W. Purwanto, DEA., selaku kepala
Departemen Teknik Kimia, Universitas Indonesia.
3. Ibu Eva Fathul Karamah, ST, MT ., selaku pembimbing akademis. 4. Bapak dan Mama adek abang’ yang memberikan dukungan materi, doa,
serta semangat yang selalu mengalir tiada henti kepada penulis.
5. POFT UI (Teman-teman pengurus, TKK, AKK, dan Tim Reg; Franz, Kristina, Ingrid) atas penghiburan dan pembinaannya.
6. Mbak Tiwi, Mang Ijal, Mas Eko, Mas Taufik serta seluruh staf dosen dan staf karyawan Teknik Kimia FT UI.
7. Victor Pinontoan selaku rekan penelitian serta rekan-rekan Teknik Kimia Universitas Indonesia angkatan 2008, yang telah memberikan dukungan moril dan sukacita dalam mengerjakan skripsi ini.
Semoga makalah ini dapat memberikan manfaat kepada pembacanya. Kritik dan saran yang membangun penulis terima dengan senang hati.
Depok, 03 Juli 2012
Nama : Taher Batubara Program Studi : Teknik Kimia
Judul : Sistem Produksi Hidrogen Menggunakan Reaktor Glow
Discharge Electrolysis Dalam Larutan KOH – Etanol.
Elektrolisis plasma adalah salah satu teknologi yang menghasilkan gas hidrogen dalam jumlah besar dengan kebutuhan listrik yang rendah. Penelitian ini dilakukan untuk mendapatkan gas hidrogen dalam jumlah besar dengan konsumsi listrik yang rendah dengan memvariasikan konsentrasi KOH dan aditif etanol, tegangan, dan posisi katoda. Penelitian berhasil mendapatkan produksi hidrogen hingga 55,35 mmol / menit dan konsumsi energi 1,135 kJ / mmol. Proses elektrolisis plasma akan lebih efektif jika dilakukan pada tegangan tinggi dengan posisi katoda tercelup hingga ujungnya menyentuh permukaan larutan.
Kata kunci : Hidrogen, oksigen, KOH, elektrolisis plasma, tegangan, katoda
ABSTRACT
Name : Taher Batubara Study Program : Chemical Engineering
Title : Hydrogen Production System By Glow Discharge Plasma Electrolysis Reactor with KOH – Etanol Soluton.
Plasma electrolysis is one of the technologies that produce large quantities of hydrogen gas while lowering demand for electricity. The study did to get high quantity of hydrogen gas with low power consumption with variation of KOH concentration and additive ethanol, voltage, and the position of the cathode. The experiment results obtain the hydrogen production up to 55.35 mmol / min and the consumption energy of 1.135 kJ / mmol. Plasma electrolysis process more effective at high voltage and cathode immersed up to its end touching the surface solution.
HALAMAN JUDUL ... i
HALAMAN PERNYATAAN ORISINALITAS ... iii
HALAMAN PENGESAHAN ... iv
KATA PENGANTAR ... v
HALAMAN PERSETUJUAN PUBLIKASI KARYA ILMIAH ... vi
ABSTRAK ... vii
DAFTAR ISI ... viii
DAFTAR GAMBAR ... x
DAFTAR TABEL ... xii
BAB I PENDAHULUAN ... 1 1.1. Latar Belakang ... 1 1.2. Perumusan Masalah ... 2 1.3. Tujuan Penelitian ... 2 1.4. Batasan Masalah ... 2 1.5. Sistematika Penulisan ... 3
BAB II. TINJAUAN PUSTAKA ... 4
2.1.Hidrogen ... 4
2.2.Produksi Hidrogen... 4
2.3. Elektrolisis ... 6
2.3.1. Penggunaan Katoda Terhadap Pembentukan Hidrogen... 13
2.3.2. Penggunaan Anoda Terhadap Pembentukan Oksigen ... 14
2.4. Plasma ... 15
2.4.1. Jenis Jenis Plasma ... 16
2.4.2. Spesi Aktif Plasma Non-Termal ... 18
2.5. Elektrolisis Plasma ... 20
2.5.1. Larutan Etanol Sebagai Aditif Pada Elektrolisis Plasma Non-Termal ... 21
2.5.2. Faktor-faktor yang Mempengaruhi Kinerja Elektrolisis Plasma Pijar ... 23
BAB III METODE PENELITIAN ... 31
3.1. Penelititan ... 31
3.2. Alat dan bahan penelitian ... 33
3.2.1. Alat dan Bahan Penelitian ... 33
3.2.2. Peralatan Pemisahan dan Pemurnian ... 34
3.2.3. Peralatan Sumber Tegangan ... 35
3.2.4. Peralatan Pengambilan Data ... 36
3.2.5. Bahan Larutan Elektrolisis ... 38
3.3. Variabel penelitian ... 38
3.4. Preparasi Bahan ... 39
3.5. Prosedur Penelitian ... 39
BAB IV PEMBAHASAN ... 45
4.1. Kondisi Operasi Elektrolisis Plasma ... 45
4.1.1. Penampilan Dari Elektrolisis Plasma ... 45
4.1.2. Suhu ... 46
4.1.3. Konduktivitas ... 47
4.1.4. pH ... 47
4.1.5. Arus ... 48
4.2. Pengaruh Variabel – Variabel Penelitian ... 49
4.3.1. Penentuan Larutan Uji Berdasarkan Variasi Konsentrasi Etanol ... 49
4.3.2. Penentuan Larutan Uji Berdasarkan Variasi Konsentrasi KOH ... 53
4.3.3. Variasi Jarak Katoda Terhadap Permukaan Larutan ... 56
4.3.4. Penentuan Kondisi Elektrolisis Plasma Pada Tegangan Tinggi ... 60
BAB V KESIMPULAN DAN SARAN ... 65
DAFTAR REFERENSI ... 67
Gambar 2.1. Pengaruh Tegangan Terhadap Konsumsi Energi (daya) Pada Berbagai Elektrolit Dalam Kondisi Konduktivitas = 11,55 mScm-1, Suhu = 337,15 K, Konsentrasi Metanol = 99,5% ... 10 Gambar 2.2 Fenomena pembentukan gas Oksigen dan Hidrogen dalam Elektrolisis. ... 11 Gambar 2.3. Pengaruh Tegangan Listrik Terhadap Pembentukan Konsentrasi Radikal OH Berdasarkan Fungsi Waktu Pada Konduktivitas Larutan 4,577 mS/cm dan pH 3,00... 24 Gambar 2.4 Pengaruh tegangan listrik terhadap pembentukan konsentrasi radikal OH berdasarkan fungsi waktu pada konduktivitas larutan 4,577 mS/cm dan pH 3,00... 25 Gambar 2.5. Pengaruh Tegangan Discharge Terhadap G(H2) Dari Larutan Etanol
99,5% Temperatur 303.15 K, Konduktivitas 5.6 mS cm-1 ... 26 Gambar 2.6. Pengaruh Tegangan Discharge Terhadap Wr Dari Larutan Etanol 99,5% Temperatur 303.15 K, Konduktivitas 5.6 mS cm-1 ... 26 Gambar 2.7. Hubungan Konsentrasi Etanol Dengan G(H2). Temperatur 303.15 K,
Konduktifitas 5.6 mS cm-1 , Tegangan Discharge 1000 V ... 27 Gambar 2.8 Hubungan Konsentrasi Etanol Dengan Wr. Temperatur 303.15 K, Konduktifitas 5.6 mS cm-1, Tegangan Discharge 1000 V ... 28 Gambar 2.9 Pengaruh Konduktivitas Larutan Terhadap Pembentukan Radikal Hidroksil Terhadap Fungsi Waktu Pada Tegangan 560 V dan pH 3,00 ... 28 Gambar 2.10. Pengaruh Konduktivitas Larutan Terhadap Pembentukan Radikal Hidrogen Terhadap Fungsi Waktu Pada Tegangan 560 V dan pH 3,00 ... 29 Gambar 2.11 Pengaruh pH Awal Terhadap Pembentukan Radikal Hidroksil Terhadap Fungsi Waktu Pada Tegangan 560 Volt dan Konduktivitas 4,577 mS/cm ... 30 Gambar 3.1. Diagram Alir Riset Keseluruhan ... 32 Gambar 3.2. Peralatan Reaktor Elektrolisis Plasma Glow Discharge ... 34 Gambar 3.3. Peralatan Pemisahan dan Pemurnian Yang Terdiri Dari 2 Buah Tabung Pendingin dan 1 Buah Absorber ... 35 Gambar 3.4. Peralatan Sumber Tegangan ... 36
Gambar 3.6. Konfigurasi Alat Penghasil Gas Hidrogen Dan Oksigen Elektrolisis Plasma ... 38 Gambar 3.7. Gambar Percobaan Pada Variabel Perbedaan Jarak Katoda Dengan Permukaan Larutan ... 40 Gambar 4.1. Pijaran Plasma Dari Larutan KOH Dengan Additif Etanol ... 46 Gambar 4.2 Analogi Sirkuit Listrik Dari Resistansi Dalam Sistem Elektrolisis Air ... 48 Gambar 4.3 Grafik Perbandingan Laju Alir Gas H2 Pada Konsentrasi 0,05 M
KOH Dengan Perbedaan Konsentrasi Etanol ... 50 Gambar 4.4. Grafik Perbandingan Energi Yang Dibutuhkan Pada Konsentrasi 0,05 M KOH Dengan Perbedaan Konsentrasi Etanol ... 52 Gambar 4.5. Grafik Laju Alir Gas Hidrogen Pada Variasi Perbedaan Konsentrasi KOH Dengan Konsentrasi Etanol 10% ... 53 Gambar 4.6. Grafik Perbandingan Konsumsi Energi Pada Variasi Perbedaan Konsentrasi KOH Dengan Konsentrasi Etanol 10% ... 54 Gambar 4.7. Volume Plasma Yang Menghalangi Transfer Elektron Melalui Ion ... 55 Gambar 4.8. Gambar Percobaan Pada Variabel Perbedaan Jarak Katoda Dengan Permukaan Larutan ... 56 Gambar 4.9. Pijaran Plasma Yang Terbentuk Pada Variasi Jarak Katoda Dengan Permukaan Larutan ... 57 Gambar 4.10. Grafik Laju Alir Gas H2 dan O2 Serta Konsumsi Energi dari
Electrolyzer Pada Variasi Perbedaan Jarak Katoda Dengan Permukaan Larutan ... 58 Gambar 4.11 Animasi Plasma yang Terbentuk di Reaktor GDPE Pada Variasi Ketinggian Katoda ... 59 Gambar 4.12. Grafik Laju Alir Gas H2 dan O2 Serta Energi Dari Elektrolisis
Tabel 2.1. Beberapa Proses Pembuatan Gas Hidrogen ... 5
Tabel 2.2. Parameter Kinetika Produksi Hidrogen Dari Berbagai Metal Katoda ... 12
Tabel 2.3. Parameter Kinetika Produksi Oksigen Dari Berbagai Metal Anoda ... 12
Tabel 2.4. Warna Plasma Yang Timbul Akibat Adanya Aliran Gas Tertentu ... 16
Tabel 2.5. Klasifikasi Plasma ... 18
Tabel 2.6. Energi-Energi Foton Dalam Spektrum Elektromagnetik ... 19
Tabel 2.7. Komposisi Gas Yang Dihasilkan Dari CGDPE Pada Beberapa Konenstrasi Etanol Pada Suhu = 303,15 K, Tegangan Discharge = 1000 V, Konduktivitas = 5,6 mS cm-1 ... 20
Tabel 2.8. Produk CGDPE Larutan Etanol (Suhu = 303,15 K, Konduktivitas = 5,6 mS cm-1). ... 22
Tabel 2.9 Komposisi Gas Yang Dibebaskan Katoda Pada Elektrolisis Plasma Glow Discharge (GDPE) Dengan Variasi Tegangan Discharge. Temperatur 303.15 K, Konsentrasi Etanol 99.5%, Konduktivitas 5.6 mS cm-1 ... 23
Tabel 2.10. Komposisi Gas Yang Dibebaskan Anoda Pada Elektrolisis Plasma Glow Discharge (GDPE) Dengan Variasi Tegangan Dischage. Temperatur 303.15 K, Konsentrasi Etanol 99.5%, Konduktifitas 5.6 mS cm-1 ... 23
Tabel 4.1 Komposisi Gas Yang Dibebaskan Katoda Pada Elektrolisis Plasma Glow Discharge (GDE) Dengan Variasi Tegangan Discharge. Temperatur 303.15 K, Konsentrasi Etanol 99.5%, Konduktivitas 5.6 mS cm-1 ... 51
Tabel 4.2. Perbandingan Produktifitas Gas Hidrogen Pada Berbagai Variabel Dalam Percobaan ... 62
Tabel 4.3. Perbandingan Energi Elektrolisis Plasma Pada Berbagai Variabel Dalam Percobaan ... 63
1.1. Latar Belakang
Hidrogen dipertimbangkan sebagai bahan bakar yang sangat penting dan menjanjikan baik dalam industri kimia maupun industri mesin. Hal ini karena hidrogen memiliki karakteristik kepadatan energi yang tinggi dan emisi yang rendah ketika dikonsumsi. Hidrogen juga digunakan dalam jumlah besar di industri kimia dan petroleum sebagai raw material atau sebagai reaktan yang esensial dalam banyak proses seperti pemurnian minyak, pembuatan metanol, pembuatan amonia, dll.
Beberapa metode pembuatan gas hidrogen sudah dikembangkan seperti Steam Reforming, Gasifikasi Biomasa, Gasifikasi Batubara. Pirolisis, dll. Hingga saat ini, metode pembuatan gas hidrogen diatas masih mengalami kendala. Kendala utama pengembangan sumber energi alternatif terbarukan ini terletak pada produksi yang kecil, tingkat keekonomian yang masih jauh di bawah energi konvensional (energi dari bahan bakar hidrokarbon), dan emisi yang dihasilkan.
Pembuatan hidrogen dengan metode elektrolisis plasma muncul untuk mengatasi kendala diatas. Teknologi elektrolisis plasma mirip dengan elektrolisis konvensional, tetapi dilakukan pada tegangan yang cukup tinggi untuk membentuk bunga api listrik dan plasma pada larutan.
Produktivitas hidrogen yang dihasilkan melalui proses elektrolisis plasma jauh lebih besar dibandingkan proses elektrolisis Faraday. Pada proses elektrolisis konvensional, satu mol air dapat menghasilkan satu mol hidrogen dan setengah mol oksigen pada kondisi suhu 25 oC dan tekanan 1 atm dengan perubahan entalphi ( sebesar 285,83 kJ (Chaffin dkk, 2006).
Elektrolisis plasma dengan menggunakan larutan KOH 0,1 M pada suhu 85
o
C dan tegangan 300 V, mendapatkan peningkatan produksi hidrogen hingga 13,4 kali lebih besar dibanding proses elektrolisis Faraday untuk jumlah energi listrik yang sama(Saksono dan Bismo, 2010).
Penelitian terhadap elektrolisis plasma terus dikembangkan untuk mendapatkan produksi hidrogen yang lebih besar dengan konsumsi energi yang rendah. Yan (2008) mendapatkan bahwa tegangan dan konsentrasi elektrolit berpengaruh terhadap produksi H2 dan konsumsi energi pada Glow Discharge
Plasma Electrolysis. Penelitian ini dilakukan untuk mendapatkan produksi hidrogen yang lebih besar dengan konsumsi energi yang rendah dengan mengatur sedemikian rupa tegangan, konsentrasi larutan dan konfigurasi reaktor Glow Discharge Plasma Electrolysis. Diharapkan penelitian ini akan mendapatkan produksi hidrogen terbaik pada tegangan yang lebih tinggi dan konduktivitas larutan yang rendah.
1.2. Perumusan Masalah :
Ruang lingkup masalah yang akan diselesaikan pada tulisan ini diantaranya adalah :
1. Bagaimana pengaruh tegangan terhadap produksi gas hidrogen dan konsumsi energi dalam Glow Discharge Plasma Electrolysis.
2. Bagaimana pengaruh konsentrasi KOH dan etanol terhadap produksi gas hidrogen dan konsumsi energi dalam Glow Discharge Plasma Electrolysis. 3. Bagaimana pengaruh kedalaman katoda terhadap produksi hidrogen dan
konsumsi energi di proses Glow Discharge Plasma Electrolysis.
1.3. Tujuan Penelitian :
Tujuan penelitian yang dilakukan adalah untuk menguji dan mengetahui hubungan tegangan, konsentrasi KOH-etanol, serta kedalaman katoda terhadap kinerja dan produktivitas Glow Discharge Plasma Electrolysis dalam memproduksi hidrogen.
1.4. Batasan Masalah :
Dalam makalah ini, pembahasan akan dibatasi pada :
a. Larutan elektrolit yang digunakan adalah KOH dengan aditif etanol.
b. Elektroda yang digunakan adalah logam Stainless steel (Anoda) dan Tungsten (Katoda).
c. Variabel bebas yang divariasikan meliputi tegangan, konsentrasi larutan kalium hidroksida (KOH), konsentrasi aditif etanol, dan kedalaman katoda. d. Produktivitas proses Glow Discharge Plasma Electrolysis hanya dilihat pada
jumlah H2 dan O2 yang dihasilkan dan energi listrik yang dibutuhkan.
1.5. Sistematika Penulisan :
Sistematika penulisan dalam makalah skripsi ini dilakukan dengan membagi tulisan menjadi tiga bab utama, yaitu :
BAB I : PENDAHULUAN
Meliputi latar belakang penelitian dan penulisan, perumusan masalah yang dibahas, tujuan dilakukannya penelitian, ruang lingkup penelitian, serta sistematika penulisan makalah ini.
BAB II : TINJAUAN PUSTAKA
Berisi tinjauan pustaka yang menjadi dasar penelitian yang meliputi plasma, elektrolisis konvensional, elektrolisis plasma, penggunaan etanol sebagai aditif larutan.
BAB III : METODE PENELITIAN
Berisi diagram alir penelitian, peralatan percobaan, bahan percobaan dan prosedur penelitian yang di dalamnya menjelaskan mengenai langkah-langkah yang dilakukan untuk mencapai tujuan penelitian.
BAB IV : HASIL DAN PEMBAHASAN
Bab ini berisi hasil dari penelitian yang telah dilakukan berdasarkan prosedur yang tertera di Bab III. Dalam bab ini juga terdapat analisis dan pembahasan dari hasil penelitian yang telah diperoleh.
BAB V : KESIMPULAN DAN SARAN
Berisi rangkuman keseluruhan atau kesimpulan dari penelitian yang telah dilakukan, serta mengacu pada hasil yang telah diperoleh.
BAB 2
TINJAUAN PUSTAKA
2.1. Hidrogen
Hidrogen adalah unsur kimia yang memiliki simbol H dan nomor atom 1. Pada suhu dan tekanan standar, hidrogen tidak berwarna, tidak berbau, bersifat non-logam, bervalensi tunggal, dan merupakan gas diatomik yang sangat mudah terbakar pada konsentrasi serendah 4 % di udara bebas. Dengan massa atom 1,00794 amu, hidrogen adalah unsur teringan di dunia. Hidrogen berasal dari bahasa Yunani yaitu Hydro = air dan genes = pembentukan sehingga hidrogen bisa disebut sebagai unsur pembentuk air.
Menurut American Nuclear Society (Juni 2012), kebutuhan dunia akan hidrogen sangat besar yaitu sekitar 5 juta ton per tahun. Hidrogen sebesar ini diperlukan dalam proses kimia seperti mengikat nitrogen dengan unsur lain dalam proses Haber bosch, produksi metanol, bahan bakar roket, memproduksi asam hidroklorida, mereduksi bijih-bijih besi dan sebagai gas pengisi balon, bahan bakar alternatif, pembentuk amonia, serta bahan oil refining dan oil upgrading.
Hidrogen merupakan elemen paling melimpah di bumi (sepersepuluh masa bumi), namun sangat jarang ditemukan dalam bentuk H2. Karena hidrogen
di bumi sangat jarang ditemukan dalam bentuk H2, maka dilakukanlah produksi
hidrogen untuk mencukupi kebutuhan hidrogen dunia. Pada prinsipnya, hidrogen bisa diperoleh dengan memecah senyawa yang paling banyak mengandung unsur hidrogen.
2.2. Produksi Hidrogen
Di awal perkembangan teknologi industri dengan menggunakan mesin, produksi hidrogen masih menggunakan hidrokarbon sebagai bahan utamanya. Metode untuk memproduksi hidrogen terus berkembang. Hidrogen dapat diproduksi dari berbagai bahan baku dan menggunakan beberapa teknologi seperti pada Tabel 2.1. di bawah.
Tabel 2.1. Beberapa Proses Pembuatan Gas Hidrogen.
Metode Proses Bahan Baku Energi Emisi
Thermal Steam Reforming Gas alam, hidrokarbon ringan
Steam bersuhu tinggi Emisi gas rumah kaca
Gasifikasi
Batubara, Hidrokarbon
berat
Steam dan oksigen pada tekanan dan suhu tinggi
Emisi gas rumah kaca Autotermal Reformation (Oksidasi Parsial) Gas Alam, Hidrokarbon ringan. Steam yang dibangkitkan dengan panas proses eksoterm
Emisi gas rumah kaca
Catalytic Reforming.
Naptha dari oil refining
Panas dari proses oil refiining
Emisi gas rumah kaca
Pirolysis Biomassa Steam bersuhu tinggi Emisi gas rumah kaca
Thermochemical
Water Splitting Air Panas bersuhu tinggi Tidak ada emisi
Elektrokimia
Elektrolisis Air Listrik dari energi
yang terbarukan Tidak ada emisi
Elektrolisis Air Listrik dari bahan bakar fosil
Emisi gas rumah kaca dan emisi lain dari bahan bakar fosil Thermal Catalytic Dry Reformation Metana, air, gas landfill
Panas (dari energi matahari atau sumber panas lain)
Emisi gas rumah kaca (tergantung dari feedstok) Disosiasi Plasma Biomassa,
gas alam
Lisrik (plasma
discharge) Tidak ada emisi
Byproduct Recovery Recover H2 dari berbagai proses (Tidak ada umpan spesifik untuk produksi hidrogen) Energi incremental untuk gas clean up dan compressi
Tidak ada emisi
Biologi
Photobiologi Air dan alga Sinar matahari Tidak ada emisi
Pencernaan
anaerobik Biomassa
Steam bertemperatur tinggi
Emisi gas rumah kaca dan emisi lain
Fermentasi
mikroorganisme Biomassa
Steam bertemperatur tinggi
Emisi gas rumah kaca dan emisi lain
Sumber : (Sustainable Development Technology Canada. (2006, November). Renewable Fuel — Hydrogen, SD Business Case™. Canada : Author. “ telah diolah kembali”)
Proses termal seperti pada tabel diatas mampu menghasilkan hidrogen dalam jumlah yang besar, namun terkendala pada energi yang digunakan dan emisi yang dihasilkan. Proses elektrokimia tidak menghasilkan emisi namun jumlah hidrogen yang dihasilkan sedikit. Sedangkan proses biologi menghasilkan jumlah hidrogen yang sedikit dan penerapannya hanya bisa dilakukan dalam skala kecil. Berkembangnya sistem produksi energi yang ramah lingkungan membuat proses elektrolisis terus dimodifikasi agar menghasilkan hidrogen yang lebih besar.
2.3. Elektrolisis
Elektrolisis adalah metode pemecahan molekul-molekul air menjadi atom-atom penyusunnya (hidrogen dan oksigen) dengan menggunakan arus listrik yang melewati 2 kutub elektroda. Teknologi elektrolisis yang umum digunakan adalah elektrolisis berbasis alkali (menggunakan larutan alkali).
Pada elektrolisis, sebuah sumber listrik dihubungkan dengan dua elektroda atau 2 plat (umumnya terbuat dari platina atau kabon) yang diletakkan di dalam suatu larutan. Setelah proses dijalankan, maka air akan terpisah menjadi hidrogen dan oksigen. Hidrogen akan terkumpul di katoda (elektroda negatif) dan oksigen akan terkumpul pada anoda (elektoda positif). Gas hidrogen yang dihasilkan jumlahnya dua kali lipat dari gas oksigen yang dihasilkan dan keduanya proporsional dengan total energi listrik yang dialirkan melalui air.
Melalui proses elektrolisis, idealnya satu mol air dapat menghasilkan satu mol hidrogen dan setengah mol oksigen pada suhu 25 oC dan 1 atm. Perubahan entalphi yang terjadi adalah 285,83 kJ sedangkan perubahan entropi ( T ΔS ) yang terjadi adalah 48,7 kJ. Energi yang diperlukan (disediakan oleh energi listrik dari luar sistem) untuk mengelektrolisis air hanya energi bebas Gibbs saja sebab perubahan entropi dapat diperoleh dari lingkungan. Oleh karena itu, energi yang dibutuhkan menjadi :
ΔG = ΔH – TΔS
(
2.1)Energi istrik yang diperlukan untuk elektrolisis adalah 231,7 kJ / mol H2
produk. Energi dalam jumlah yang cukup besar ini digunakan untuk mengatasi berbagai hambatan (energi aktivasi, resistansi listrik, resistansi transport dan
resistansi reaksi kimia). Tanpa kelebihan energi, elektrolisis dari air murni akan berlangsung lambat. Hal ini disebabkan oleh kestabilan air secara termokimia yang menyebabkan susahnya air untuk terionisasi sendiri.
Berdasarkan hasil eksperimennya, Michael Faraday menemukan beberapa kaidah perhitungan elektrolisis yang dikenal dengan hukum Faraday.
Hukum I Faraday
“Massa zat terbentuk pada masing-masing elektroda sebanding dengan kuat arus / arus listrik yang mengalir pada elektrolisis tersebut”.
Hukum II Faraday
“Setiap larutan mendapatkan arus listrik yang sama sehingga dari setiap larutan akan dihasilkan massa zat yang akan sebanding dengan berat ekivalen masing-masing zat tersebut”.
Arus listrik satu Faraday (1 F) didefinisikan sebagai jumlah arus listrik yang terdiri dari 1 mol elektron. Untuk menghitung jumlah zat-zat yang terbentuk di katoda dan di anoda, hukum Faraday dirumuskan sebagai berikut :
W = e . F
(
2.2)Dengan : W = massa hasil elektrolisis (gram) e = massa ekuivalen hasil elektrolisis F = jumlah arus lisrik ( Faraday )
(
2.3)( (
F
(
2.4),
(
2.5)Subsitusi Persamaan (2.2), (2.4), dan (2.5), didapatkan :
(
2.6)
(2.7)
Dengan : i = kuat arus ( ampere )
t = waktu lamanya elektrolisis (detik) Berdasarkan hukum Faraday II diperoleh persamaan :
(2.8)
Dengan : m = massa zat ( gram) e = berat ekivalen =
Perhitungan lebih mudah jika dilakukan dalam satuan mol, persamaan di atas bisa dimodifikasi menjadi :
(2.9)
Laju alir produksi hidrogen dan oksigen dihitung dari persamaan berikut : Untuk Hidrogen :
(2.10) Untuk Oksigen :
(2.11)
Elektrolisis air tidak dapat mengkonversi 100 % energi listrik menjadi energi kimia pada hidrogen. Proses ini membutuhkan energi yang jauh lebih besar untuk mengaktifkan air agar dapat terionisasi. Jumlah energi yang diperlukan ini tidak sebanding dengan jumlah hidrogen yang dihasillkan. Dengan menggunakan metode elektrolisis biasa hanya sekitar 4 % produksi hidrogen yang dihasilkan dari air murni.
Proses elektrolisis akan lebih baik jika menggunakan larutan elektrolit. Larutan elektrolit adalah larutan yang dapat menghantarkan listrik. Larutan elektrolit dibagi menjadi tiga golongan :
a. Asam , seperti asam sulfat (H2SO4), asam nitrat (HNO3), asam klorida
(HCl), Asam karboksilat (CH3COOH) , Asam Format (HCOOH), Asam
b. Basa , seperti natrium hidroksida (NaOH), kalium hidroksida (KOH), barium hidroksida [Ba(OH)2], Ammonium Hidroksida (NH4OH), metanol,
etanol.
c. Garam : hampir semua senyawa kecuali garam merkuri, K2CO3.
Karakter elektrolit yang baik dalam elektrolisis lebih ditekankan pada mudah menghantarkan arus listrik serta karakter korosi yang dimilikinya.
Dengan tujuan untuk meningkatkan konduktivitas larutan, elektrolit yang terdiri dari ion-ion dengan mobilitas tinggi secara umum digunakan di elektrolizer. Kalium Hidroksida adalah garam yang secara umum digunakan dalam elektrolisis air karena dapat mencegah korosi besar-besaran yang disebabkan oleh elektron.
Selain itu dengan menggunakan larutan KOH, kemungkinan produksi hidrogen bisa ditingkatkan. Hal ini dikarenakan KOH dapat menyebarkan muatan listrik karena fungsinya sebagai zat dielektrikum, sehingga proses pemecahan air menjadi radikal-radikal yang selanjutnya bereaksi lanjut menghasilkan hidrogen dan oksigen menjadi optimal. Selain itu kalium berbeda dengan natrium yang tidak terurai selama proses elektrolisis, sehingga peran KOH dalam meningkatkan konduktivitas larutan tidak hilang selama reaksi.
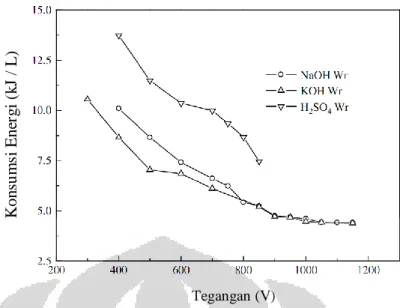
Energi yang dikonsumsi pada proses elektrolisis plasma menggunakan larutan KOH lebih rendah dibandingkan dengan energi yang dikonsumsi oleh larutan NaOH dan H2SO4 seperti pada Gambar 2.1. Hal ini menyebabkan
elektrolisis menggunakan larutan KOH lebih disukai daripada menggunakan larutan NaOH dan H2SO4.
Gambar 2.1. Pengaruh Tegangan Terhadap Konsumsi Energi (daya) Pada Berbagai Elektrolit Dalam Kondisi Konduktivitas = 11,55 mScm-1, Suhu = 337,15 K, Konsentrasi Metanol = 99,5 %
Sumber : (Yan dkk, 2009)
Pada saat aliran listrik mengalir dalam larutan elektrolit KOH akan terjadi reaksi 2.12.
.
Reaksi reduksi terjadi pada air yang terdapat pada katoda yang bermuatan negatif dengan elektron (e-) dari katoda. Kemungkinan reaksi reduksi yang terjadi di katoda adalah reduksi air dan reduksi ion K+.
2H2O(l) + 2e- H2(g) + 2 OH-(aq) Eo = - 0,83 V (2.13)
K+(aq) + e K(s) Eo = - 2,92 V
(2.14)
Pada elektrolisis larutan yang mengandung ion-ion golongan IA (Na+, K+), ion-ion tersebut tidak tereduksi pada katoda tetapi air yang mengalami reduksi karena potensial reduksi air lebih besar dari potensial reduksi K.
Kemungkinan reaksi oksidasi yang terjadi di anoda adalah oksidasi ion OH -dan oksidasi air.
2H2O 4H+ + O2 + 4e- E° = -1.23 V (2.15)
4OH-(aq) O2(g) + 2H2O(l) + 4 e- E° = -0.40 V (2.16)
Tegangan (V) KOH (aq) K+ + OH-
(2.12) K on su m si Ene rg i (k J / L)
Oleh karena potensial oksidasi OH- lebih besar dari potensial oksidasi H2O,
maka oksidasi OH- lebih mudah berlangsung.
Elektrolisis larutan KOH akan menghasilkan gas hidrogen di katoda dan menghasilkan gas oksigen di anoda seperti reaksi di bawah ini :
Katoda (reduksi) : 2H2O(l) + 2e- H2(g) + 2 OH-(aq) (2.17)
Anoda (oksidasi) : 4OH-(aq) O2(g) + 2H2O(l) + 4 e- (2.18)
Reaksi total : ( ( ( (2.19) Eo = -1,23 V ; ΔH = 285, 83 kJ / mol
Proses ionisasi dan pembentukan gas hidrogen dan oksigen pada elektrolisis dapat dilihat dengan jelas pada Gambar 2.2. di bawah.
Gambar 2.2. menunjukkan bahwa di katoda air akan terpisah menjadi gas H2 dan ion OH-. Ion OH- akan bersirkulasi dari katoda menuju anoda dalam
medan listrik yang disediakan oleh sumber daya. Ion OH- akan menuju permukaan anoda dan membentuk gelembung oksigen. Peristiwa pembentukan oksigen akan menghasilkan elektron. Elektron ini akan bermigrasi menuju katoda yang akan dipakai untuk memecah kembali air menjadi ion OH- dan H2.
Gambar 2.2. Fenomena Pembentukan Gas Oksigen dan Hidrogen Dalam Elektrolisis. Sumber : (Ursúa dkk , 2012)
Kinetika dari pembentukan hidrogen dan oksigen akan sangat bervariasi pada tiap-tiap elektroda. Zeng, K & Zhang D (2010) mengatakan bahwa laju reaksi elektrolisis dapat ditentukan dari arus atau densitas arus. Pletcher, D & Li, X (2011) mengatakan bahwa laju dari reaksi pembentukan hidrogen dan oksigen dalam elektrolisis plasma dapat dideskripsikan dengan persamaan Tafel (Persamaan2.25).
| | | | (2.25) Dengan :
= Densitas arus
= adalah pertukaran densitas arus (dengan kata lain densitas arus yang sama dari parsial anoda dan katoda pada kesetimbangan potensial). = overpotensial yang digunakan ( = E - )
= Tafel slope. Nilai tafel slope akan berbeda pada suhu dan densitas arus yang berbeda seperti pada Tabel 2.2. dan Tabel 2.3.
Tabel 2.2. Parameter Kinetika Produksi Hidrogen Dari Berbagai Metal Katoda. Material Metal Elektrolit Suhu (oC) (Am-2) Tafel Slope (mV) Ni 1 M NaOH 20 1,1 x 10-2 121 Fe 2 M NaOH 20 9,1 x 10-2 133 Pb 6 N NaOH 25 4 x 10-2 121 Zn 6 N NaOH 25 8,5 x 10-6 124 Co 0,5 M NaOH 25 4,0 x 10-3 118 Pt 0,1 N NaOH 22 4,0 105 Au 0,1 N NaOH 25 4,0 x 10-2 120 Sumber : (Zeng, K & Zhang D, 2010)
Tabel 2.3. Parameter Kinetika Produksi Oksigen Dari Berbagai Metal Anoda. Metal Elektrolit Suhu
(oC) io (Am-2) Tavel Slope (mV) Pt 30% KOH 80 1,2 x 10-5 46 Ir 1 N NaOH N/A 1,0 x 10-7 40 Rh 1 N NaOH N/A 6,0 x 10-8 42 Ni 50% KOH 90 4,2 x 10-2 95 Co 30% KOH 80 3,3 x 10-2 126 Fe 30% KOH 80 1,7 x 10-1 191
Selain dikenali dari densitas arus nya, laju reaksi dari elektroda juga dipengaruhi oleh :
1. Kondisi atau properties dan perlakuan pada permukaan elektroda.
2. Laju reaksi dipengaruhi oleh komposisi larutan elektrolit yang berdekatan dengan elektroda. Ion tersebut dalam larutan dekat elektroda dengan layer/ batasan di bawah pengaruh elektroda diketahui sebagai double layer. Sebagai contoh untuk katoda, muatan layer dibentuk dari ion hidroksil dan ion kalium berdasarkan muatan elektroda seperti di Persamaan (2.13) dan (2.14).
3. Laju alir yang bergantung dari elektroda potensial, dikenali dari reaksi overpotensial.
2.3.1. Penggunaan Katoda Terhadap Pembentukan Hidrogen.
Mekanisme dari pembentukan hidrogen di katoda secara luas diterima sebagai multiple reaction yang melibatkan pembentukan hidrogen teradsorbsi:
(2.26)
Yang selanjutnya diikuti dengan desorpsi kimia.
(2.27) Atau desorpsi elektrokimia
(2.28)
Dengan huruf kecil “ads” menunjukkan status “adsorbed”.
Adalah penting untuk mengetahui tahap penentu laju (rate determining
step) dalam reaksi pembentukan hidrogen di atas. Jika adsorpsi hidrogen pada
Persamaan 2.26 adalah tahap penentu laju (rate determining step), maka penggunaan material elektroda dengan banyak tepi atau berlubang-lubang akan membuat lebih banyak pusat elektrolisis untuk adsorpsi hidrogen. Jika desorpsi hidrogen pada Persamaan 2.27 dan Persamaan 2.28 adalah tahap penentu laju, maka penggunaan material dengan properties seperti kekasaran permukaan atau perforasi akan meningkatkan area reaksi dan mengurangi pertumbuhan
gelembung sehingga akan meningkatkan laju elektrolisis. Peningkatan tegangan juga akan membuat laju adsorpsi akan lebih besar dari laju desorpsi, sehingga Persamaan 2.26 akan menjadi tahap penentu laju (Zeng, K & Zhang D, 2010). Pembentukan hidrogen juga dipengaruhi oleh properties elektroda, jenis dan konsentrasi elektrolit serta suhu reaksi
Penelitian terhadap katoda selama ini masih bertahan di stabilitas termal dan stabilitas penampakan elektroda (terang, warna, permukaan). Di samping korosi, elektroda akan mengalami perubahan permukaannya pada kondisi ; absorpsi hidrogen dalam struktur katalis ; adsorpsi organik dari kotoran-kotoran dalam air atau elektrolit ; atau ekstraksi dari komponen komponen dalam reaktor – seperti polimer atau membran) menuju ke permukaan katalis ; dan endapan dari metal di permukaan katoda (misalnya besi).
2.3.2. Penggunaan Anoda Terhadap Pembentukan Oksigen.
Mekanisme reaksi pembentukan oksigen lebih komplek jika dibandingkan dengan reaksi yang disarankan untuk pembentukan hidrogen. Beberapa teori yang disajikan dan didiskusikan dalam literatur dan mekanismenya diterima secara umum melibatkan tahapan sebagai berikut :
(2.29)
(2.30)
(2.31)
Salah satu tahapan perpindahan muatan dalam anoda adalah laju pengontrol (rate controlling). Jika Persamaan 2.29 adalah tahap penentu laju, maka reaksi akan berlangsung dalam suhu rendah. Jika Persamaan 2.31 adalah tahap penentu laju, maka reaksi akan berlangsung dalam suhu tinggi pada elektroda nikel (Zeng, K & Zhang D, 2010).
Arus listrik langsung (DC) digunakan unuk menjaga keseimbangan muatan dan aliran elektron dari sumber arus DC (terminal negatif) ke katoda ketika elektron digunakan oleh ion hidrogen (proton) untuk membentuk hidrogen. Untuk menjaga muatan listrik (valensi) dalam keadaan seimbang, ion hidroksida (anion) mengalir melalui larutan elektrolit menuju anoda, yang mana ion hidroksida ini memberikan kembali elektron. Elektron ini akan kembali ke terminal positif dari sumber DC (Ursúa dkk, 2012).
Akan tetapi elektrolisis air yang digunakan sebagai metode untuk menghasilkan hidrogen sampai saat ini mempunyai kelemahan yang cukup signifikan yaitu rendahnya konversi yang dihasilkan dari proses elektrolisis dan kebutuhan arus listrik yang tinggi saat operasi sedang berlangsung
2.4. Plasma
Plasma dapat dikategorikan sebagai bentuk ke-empat dalam klasifikasi material selain padat, cair, dan gas karena plasma memiliki bentuk seperti gas, namun plasma memiliki konduktivitas yang cukup tinggi dalam daerah elektromagnetiknya sama seperti padatan dan cairan. Plasma dapat didefinisikan sebagai gas yang terionisasi sebagian dalam perbandingan antara elektron bebas dibandingkan dengan yang terikat pada atom atau molekul. Plasma juga memiliki kemampuan untuk mengeluarkan arus positif dan negatif sehinga sangat konduktiv dan terpengaruh dengan medan magnet.
Plasma adalah aliran gas terionisasi, yang merupakan campuran dari elektron, ion dan partikel netral, namun muatan keseluruhannya adalah netral. Pada keadaan ini, gas mempunyai viskositas seperti liquid pada tekanan atmosferik dan muatan listrik bebas memberikan konduktivitas listrik relatif tinggi yang besarnya mendekati konduktivitas logam. Tingkat ionisasi plasma adalah proporsi dari atom-atom yang kehilangan atau mendapatkan elektron dan biasanya dikendalikan oleh suhu.
Teknologi plasma melibatkan pembentukan bunga api listrik dengan melewatkan arus listrik melalui suatu gas dalam proses yang disebut pemutusan listrik (electrical breakdown). Sejumlah panas dalam jumlah yang signifikan
dihasilkan oleh tahanan listrik sepanjang sistem. Panas ini mengambil elektron dari molekul-molekul gas menghasilkan suatu aliran gas yang terionisasi atau plasma (Gomez dkk, 2009). Gas yang mengalir ini akan membuat plasma tampak berwarna. Setiap gas yang terionisasi dan membentuk plasma akan menghasilkan warna tersendiri seperti pada Tabel 2.4.
Tabel 2.4. Warna Plasma Yang Timbul Akibat Adanya Aliran Gas Tertentu. Gas yang mengalir Warna plasma yang timbul
CF4 Biru SF6 Biru putih H2 Merah muda O2 Kuning pucat Ne Merah bata Ar Merah tua
N2 Merah menuju kuning
CO2 Keputihan atau biru-putih yang cukup terang
Udara Ungu kemerahmudaan dan makin cerah jika arus bertambah
Sumber : Barros, 2008; http://www.plasma.de/en/glossary-entry-486.html.
2.4.1. Jenis – jenis plasma
Jenis-jenis plasma yang digunakan dalam proses-proses industri meliputi plasma termal dan plasma non-termal.
Plasma termal (plasma suhu tinggi): densitas energi tinggi, kesamaan suhu antara partikel berat (atom, molekul, ion) dan elektron. Karena mobilitas yang jauh lebih tinggi, energi yang diberikan kepada plasma ditangkap oleh elektron yang dipindahkan ke partikel-partikel berat dengan tumbukan elatis.
Jika densitas jumlah elektron tinggi dikaitkan dengan operasi pada tekanan atmosferik, maka frekuensi tumbukan elastis sangat tinggi dan kesetimbangan termal tercapai dengan cepat. Plasma termal membutuhkan listrik dengan tegangan yang sangat tinggi (>1kW) yang menyebabkan kenaikan suhu pada elektron yang sangat tinggi dan
membuat spesi netral menjadi 5.000 – 10.000 K. Oleh karena itu diperlukan pendingin untuk mencegah elektroda menguap pada suhu setinggi itu (Bromberg dkk, 1999). Contoh plasma termal adalah plasma dari arus DC atau radio frequency (RF) inductively coupled discharges (Kogelschatz, 2004).
Plasma non-termal (plasma dingin): densitas energi lebih rendah, terdapat perbedaan suhu besar antara elektron dan partikel yang lebih berat. Elektron dengan energi yang cukup bertumbukan dengan gas latar (background) menghasilkan disosiasi, eksitasi dan ionisasi tingkat rendah tanpa peningkatan entalpi gas yang cukup besar. Hasilnya, suhu elektron melampaui suhu partikel-partikel berat hingga beberapa derajat perpangkatan dan karenanya memungkinkan untuk mempertahankan suhu keluaran (discharge) pada suhu yang jauh lebih rendah, bahkan pada suhu ruang. Plasma jenis ini menghasilkan spesi-spesi aktif yang lebih beragam, dan atau lebih besar energinya dibandingkan dengan spesi yang biasa dihasilkan pada reaktor kimia. Plasma jenis ini dihasilkan dalam berbagai jenis seperti pancaran pijar (glow discharge), corona discharge, dan dielectric barrier discharge yang mempunyai densitas energi berkisar antara 10-4 hingga puluhan watt per cm-3. (Roth, 2001). Pada plasma non-termal ini hanya elektron yang bersuhu tinggi (>5000K), sedangkan suhu bulk tidak naik secara signifikan (Yan dkk, 2006). Karena hanya elektron yang tereksitasi, sehingga energi dibutuhkan hanya beberapa ratus Watt daya listrik (T. Paulmier dan L. Fulcheri, 2005).
Plasma non-termal dikatakan sebagai plasma non-equilibrium karena suhu bulk-nya berbeda jauh dengan suhu elektron. Oleh karena itu, plasma jenis ini lebih cocok digunakan mengingat suhu kerjanya berada tidak jauh dari temperatur ruang, selain itu plasma non-termal ini menghasilkan spesi-spesi radikal yang membuat mekanisme reaksi tidak seperti biasanya, yaitu pengaktifan reaksi dengan pemanasan.
Klasifikasi plasma berdasarkan perbedaan temperatur elektron, ion , dan neutron nya seperti penjelasan diatas secara ringkas dapat dibuat kedalam Tabel 2.5.
Tabel 2.5. Klasifikasi Plasma
Plasma Keadaan Contoh
Plasma Temperatur Tinggi (Equilibrium Plasma)
Te = Ti = Th, Tp = 106
-108 K, ne ≥ 1020 m-3 Laser Fusion Plasma Plasma Temperatur Rendah (Quasi – Equilibrium Plasma) Te ≈ Ti ≈ Th, Tp = 2x103 – 3x104 K, ne ≥ 1020 m-3 Arc plasma ; Atmospheric RF discharge
Plasma Non Termal (Non – Equilibrium Plasma) Te≥Th, Tp ≈ 3 x 102 – 4x102 K, ne ≈ 1010 m-3 Corona Discharge, Contact Glow Discharge, DBD, Microwave Plasma
Keterangan ; Te = Temperature electron, Ti = Temperature ion, Th = Temperatur neutron, Tp = Temperatur plasma, ne= densitas elektron.
Sumber : (Huang & Tang, 2007)
2.4.2. Spesi Aktif Plasma Non-Termal
Spesi aktif yang dihasilkan plasma biasanya dihasilkan dalam jumlah yang lebih besar dan mencapai konsentrasi yang lebih tinggi daripada spesi yang sama yang dihasilkan dalam reaktor kimia konvensional. Spesi aktif ini biasanya dihasilkan dari discharge pijar (torc) atau plasma pancaran (arc) yang terdiri dari foton, spesi netral, dan partikel bermuatan (Roth, 2001).
Foton
Foton dihasilkan dalam spektrum panjang gelombang yang luas pada spektrum elektromagnetik seperti disarikan dalam Tabel 2.6 di bawah. Dalam spektrum elektromagnetik infra merah, energi foton infra merah terlalu rendah untuk berinteraksi dengan gas kerja dan membangkitkan radiasi dari plasma. Foton jenis ini mengandung energi di bawah 1,7 eV dan kebanyakan mempunyai efek umum yang sama dengan dinding panas atau reaksi-reaksi kimia biasa. Foton sinar tampak mempunyai energi yang lebih besar, berkisar antara 1,6 sampai 3,3 eV. Foton ini
dapat memutuskan beberapa ikatan molekular dan mengeksitasi atom-atom dengan resonansi pada spektrum tampak. Foton ultraviolet lebih tinggi energinya, berkisar dari 3,1 sampai 95 eV, dan dapat mengionisasi dan mengeksitasi atom-atom, menggunting molekul-molekul hidrokarbon panjang, dan memutus ikatan-ikatan molekular membentuk potongan-potongan molekular yang lebih kecil.
Tabel 2.6. Energi-Energi Foton Dalam Spektrum Elektromagnetik
Daerah Spektral Kisaran panjang
gelombang (nm)
Kisaran Energi (eV)
Infra merah 730 ≤ λ ≤ 106 0,00124 ≤ E’ ≤ 1,70 Tampak 380 ≤ λ ≤ 730 1,59 ≤ E’ ≤ 3,26 Ultraviolet 13 ≤ λ ≤ 397 3,12 ≤ E’ ≤ 95,3
Sumber : (Roth, 2001)
Spesi Netral
Melalui tumbukan elektron netral dan reaksi kimia dalam plasma, plasma dapat menghasilkan beberapa jenis spesi-spesi netral aktif yang mempunyai energi dan mampu berinteraksi dengan permukaan. Diantaranya adalah atom-atom reaktif; spesi-spesi atomik yang sangat reaktif secara kimiawi seperti H, O, F, Cl, dan lain-lain; monomer yang membentuk cabang-cabang polimerik pada permukaan yang disentuhnya; potongan-potongan molekular yang relatif ringan, yang dapat membentuk senyawa kompleks pada permukaan dan atau mendorong pencabangan atau cross-linking molekul-molekul yang dekat permukaan; atom tereksitasi atau kondisi molekular, dimana eksitasi elektron orbital membuat spesi-spesi menjadi lebih reaktif secara kimiawi daripada keadaan normal; radikal bebas, potongan molekular yang dihasilkan dalam plasma dengan sekurang-kurangnya satu elektron yang tidak berpasangan. Semua spesi aktif ini dapat berinteraksi kuat dengan permukaan.
2.5. Elektrolisis Plasma.
Dalam beberapa tahun terakhir, aplikasi glow discharge plasma sudah dikembangkan secara pesat. Contact Glow Discharge Electrolysis (CGDE) merupakan jenis proses elektrokimia yang plasmanya di sokong oleh arus DC antara elektroda dan permukaan elektrolit.
Fenomena plasma dalam elektrolisis plasma terjadi karena elektrolisis plasma dilakukan pada tegangan tinggi yang menyebabkan loncatan bunga api listrik di dalam larutan. Loncatan bunga api listrik ini disebabkan adanya elektron yang tereksitasi pada larutan yang mempunyai konduktivitas yang cukup tinggi
Karena plasma terbentuk di dalam uap larutan yang berada di sekitar elektroda, komposisi larutan dapat mempengaruhi reaksi plasma di gas selama Glow Discharge Plasma Electrolysis (GDPE) berlangsung. Contohnya adalah perbedaan komposisi penambahan etanol dalam larutan terhadap produksi gas H2
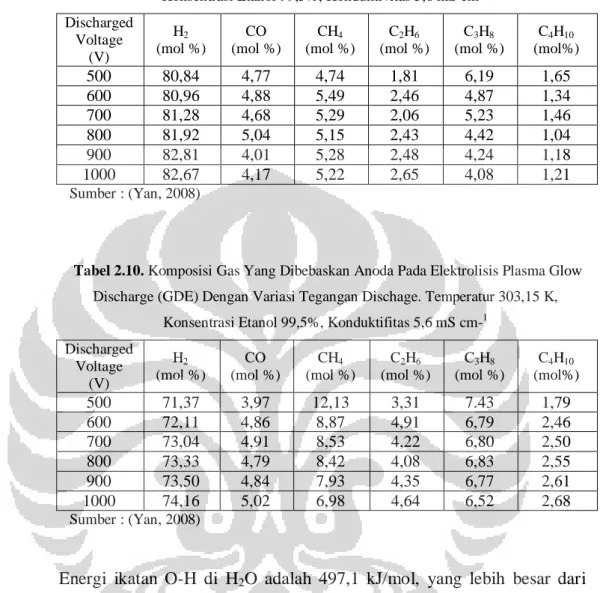
dan gas produk lainnya pada Tabel 2.7. (Yan, 2008).
Tabel 2.7. Komposisi Gas Yang Dihasilkan Dari CGDE Pada Beberapa Konenstrasi Etanol Pada Suhu = 303,15 K, Tegangan Discharge = 1000 V, Konduktivitas = 5,6 mS cm-1. Konsentrasi Etanol (V%) H2 (mol%) CO (mol%) CH4 (mol%) C2H6 (mol%) C3H8 (mol%) CO2 (mol%) C4H10 (mol%) 99,5 81,28 4,68 5,29 2,06 5,23 0,00 1,46 75 81,76 5,03 4,21 2,70 4,85 0,00 1,45 40 83,13 5,20 4,06 2,98 2,90 0,69 1,04 15 84,02 5,61 3,41 3,10 1,30 1,65 0,91 10 85,22 5,74 3,32 2,48 0,54 2,07 0,63 5 85,32 6,03 2,59 2,17 0,20 3,23 0,46 Sumber : (Yan, 2008)
Jumlah oksigen dan hidrogen yang dihasilkan dari elektrolisis plasma melebihi hukum Faraday (elektrolisis konvensional). Biasanya pembentukan plasma dapat dibentuk jika tegangan ditingkatkan hingga 140 V pada suhu yang tinggi (Hickling dan Ingram, 1964).
Produksi hidrogen dalam larutan KOH 0,1 M pada suhu 85 oC dan tegangan 300 V, mengalami peningkatan hingga 13,4 kali lebih besar dibanding
proses elektrolisis Faraday untuk jumlah energi listrik yang sama (Saksono dan Bismo, 2010).
Proses elektrolisis plasma pada dasarnya adalah proses elektrolisis, namun dengan menaikkan tegangan elektroda hingga terbentuk bunga api listrik (plasma) dalam larutan. Plasma menyebabkan disosiasi homolitik molekul air menghasilkan atom hidrogen (H*) dan radikal hidroksil (OH*) yang pada akhirnya akan meningkatkan pemutusan molekul air menjadi H2 dan O2 (air splitting).
2.5.1. Larutan Etanol Sebagai Aditif Pada Elektrolisis Plasma Non-Termal
Konsumsi energi selama elektrolisis air secara signifikan berkurang oleh keadaan campuran pengakitvasi meskipun jumlahnya sedikit oleh pengaruh aktivator ionik.
Peningkatkan efisiensi dengan menggunakan elektrolit untuk meningkatkan transfer ionik dengan menggunakan ditif pada elektrolit masih bisa dilakukan. Di lain hal, penggunaan aditif elektrolit dapat memainkan affinitas antara elektrolit dan elektroda serta membantu memanajemen perilaku gelembung (Zeng, K & Zhang D, 2010).
Etanol (C2H5OH) dapat diaplikasikan sebagai aditif elektrolisis. Reaksi
dekomposisi etanol dari percobaan yang dilakukan Li dkk (2004) dapat dilihat dibawah ini :
(2.29)
(2.30)
(2.31)
(2.32)
Percobaan elektrolisis plasma dengan larutan dielektrikum berupa etanol yang dilakukan Yan, (2008) menghasilkan ion-ion seperti H+, CH3CH2OH+,
Glow Discharge Plasma Electrolysis pada variasi konsentrasi etanol dapat dilihat pada Tabel 2.8.
Tabel 2.8. Produk CGDE Larutan Etanol (Suhu = 303,15 K, Konduktivitas = 5,6 mS cm-1). Konsentrasi Etanol (W%) Tegangan Muatan (V) Polaritas Muatan Produk
99,5 1000 Anoda C, HCHO, CH3CHO, (CH3CHOH)2, CH3COOH, H2, C2H6, CH4, C3H8, C4H10.
75 1000 Anoda H2, C, HCHO, CH3CHO, H2O, HCOOH, CH3COOH, C5H12, C2H6, CH4, C3H8, C4H10, CO.
40 1000 Anoda H2, HCHO, CH3CHO, H2O, HCOOH, CH3COOH, C5H12, C2H6, CH4, C3H8, C4H10,CO2, CO.
99,5 1000 Katoda
H2, C, HCHO, CH3CHO, H2O,
(CH3CHOH)2, CH3COOH, C5H12, C2H6, CH4,
C3H8, C4H10, CO.
75 1000 Katoda H2, C, HCHO, CH3CHO, H2O, HCOOH, CH3COOH, C5H12, C2H6, CH4, C3H8, C4H10, CO.
40 1000 Katoda
H2, HCHO, CH3CHO, H2O, HCOOH, CH3COOH, C5H12, C2H6, CH4, C3H8, C4H10,
CO, CO2.
Sumber : (Yan, 2008)
Ketika level energi elekton untuk menginisiasi dekomposisi etanol meningkat, jalur reaksi molekul etanol akan menjadi lebih kompleks. Pemisahan ikatan C-C pada molekul etanol dapat menghasilkan CH3 radikal
dan kemudian akan membentuk CH4 atau gas paraffin. Tegangan yang
semakin tinggi akan meningkatkan komposisi CH4 yang dihasilkan. Komposisi
gas yang dihasilkan pada variasi tegangan disajikan pada Tabel 2.9. dan Tabel 2.10.
Tabel 2.9. Komposisi Gas Yang Dibebaskan Katoda Pada Elektrolisis Plasma Glow Discharge (GDE) Dengan Variasi Tegangan Discharge. Temperatur 303,15 K,
Konsentrasi Etanol 99,5%, Konduktivitas 5,6 mS cm-1 Discharged Voltage (V) H2 (mol %) CO (mol %) CH4 (mol %) C2H6 (mol %) C3H8 (mol %) C4H10 (mol%) 500 80,84 4,77 4,74 1,81 6,19 1,65 600 80,96 4,88 5,49 2,46 4,87 1,34 700 81,28 4,68 5,29 2,06 5,23 1,46 800 81,92 5,04 5,15 2,43 4,42 1,04 900 82,81 4,01 5,28 2,48 4,24 1,18 1000 82,67 4,17 5,22 2,65 4,08 1,21 Sumber : (Yan, 2008)
Tabel 2.10. Komposisi Gas Yang Dibebaskan Anoda Pada Elektrolisis Plasma Glow Discharge (GDE) Dengan Variasi Tegangan Dischage. Temperatur 303,15 K,
Konsentrasi Etanol 99,5%, Konduktifitas 5,6 mS cm-1 Discharged Voltage (V) H2 (mol %) CO (mol %) CH4 (mol %) C2H6 (mol %) C3H8 (mol %) C4H10 (mol%) 500 71,37 3,97 12,13 3,31 7.43 1,79 600 72,11 4,86 8,87 4,91 6,79 2,46 700 73,04 4,91 8,53 4,22 6,80 2,50 800 73,33 4,79 8,42 4,08 6,83 2,55 900 73,50 4,84 7,93 4,35 6,77 2,61 1000 74,16 5,02 6,98 4,64 6,52 2,68 Sumber : (Yan, 2008)
Energi ikatan O-H di H2O adalah 497,1 kJ/mol, yang lebih besar dari
ikatan C-H di dalam etanol (95,18 kJ/mol) sehingga molekul etanol lebih reaktif daripada molekul air. Etanol dioksidasi oleh radikal hidroksida (OH*) dari elektrolisis plasma menghasilkan HCHO, H2 dan asam format atau CO2
(dengan komposisi yang kecil) seperti Tabel 2.9 dan Tabel 2.10.
2.5.2. Faktor-faktor yang Mempengaruhi Kinerja Elektrolisis Plasma Pijar
Ada beberapa faktor yang mempengaruhi pembentukan radikal OH* dan H* larutan elektrolit dengan teknologi elektrolisis plasma. Faktor-faktor tersebut adalah sebagai berikut:
a. Pengaruh tegangan listrik
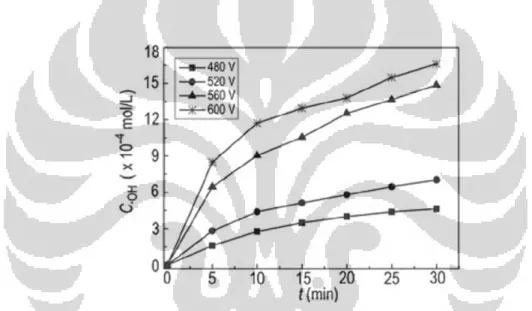
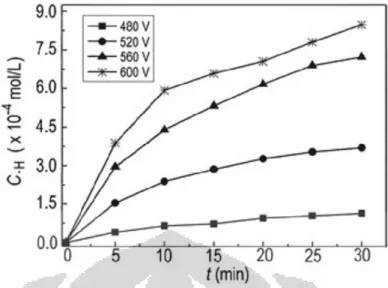
Pengaruh tegangan listrik terhadap pembentukan OH* dan H* dapat dilihat pada Gambar 2.3 dan Gambar 2.4. Gambar 2.3. dan Gambar 2.4. menunjukkan bahwa semakin tinggi tegangan listrik yang digunakan dalam elektrolisis plasma, konsentrasi radikal *OH maupun *H yang terbentuk akan semakin tinggi. Hal ini diakibatkan karena energi yang digunakan untuk mengeksitasi elektron pada tegangan discharge yang tinggi akan meningkatkan jumlah radikal yang dihasilkan. Akibatnya semakin tinggi tegangan listrik yang dipakai, pembentukan radikalnya pun semakin besar.
Gambar 2.3. Pengaruh Tegangan Listrik Terhadap Pembentukan Konsentrasi Radikal OH Berdasarkan Fungsi Waktu Pada Konduktivitas Larutan 4,577 mS/cm dan pH 3,00.
Gambar 2.4. Pengaruh tegangan listrik terhadap pembentukan konsentrasi OH* berdasarkan fungsi waktu pada konduktivitas larutan 4,577 mS/cm dan pH 3,00. Sumber : (Gao Jinzhang dkk, 2008)
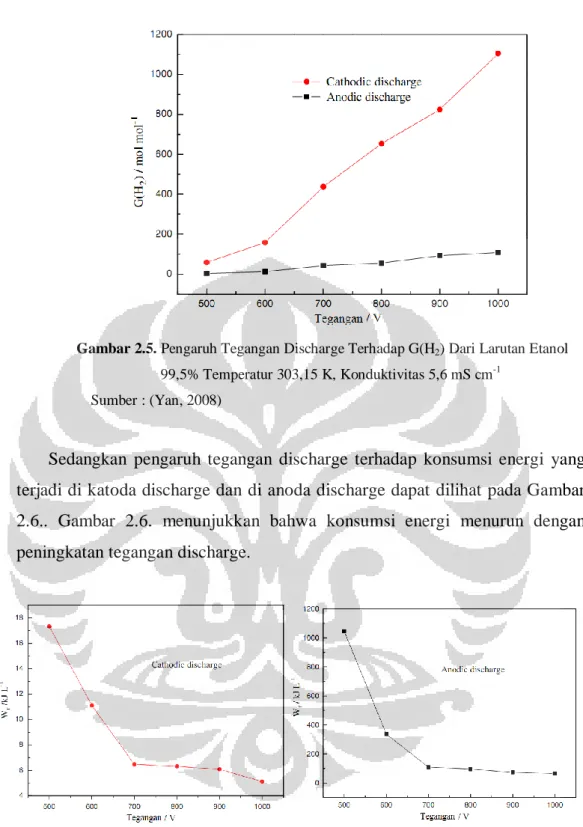
Penelitian serupa yang dilakukan Yan (2008) pada larutan etanol menunjukkan sedikit perbedaan dengan penelitian yang dilakukan oleh Gao Jinzang (2008). Gao Jinzang (2008) melakukan penelitian dengan memvariasikan tegangan discharge. Tegangan discharge membuat plasma terbentuk hanya di katoda atau di anoda. Perbandingan gas hidrogen yang dihasilkan di anoda dengan di katoda pada perbedaan tegangan discharge dapat dilihat di Gambar 2.5.
Gao Jinzang (2008) mendapati bahwa semakin tinggi tegangan discharge elektrolisis plasma, maka jumlah hidrogen yang dihasilkan di katoda akan jauh lebih banyak dibandingkan dengan jumlah hidrogen yang dihasilkan di anoda (Gambar 2.5).
Gambar 2.5. Pengaruh Tegangan Discharge Terhadap G(H2) Dari Larutan Etanol
99,5% Temperatur 303,15 K, Konduktivitas 5,6 mS cm-1 Sumber : (Yan, 2008)
Sedangkan pengaruh tegangan discharge terhadap konsumsi energi yang terjadi di katoda discharge dan di anoda discharge dapat dilihat pada Gambar 2.6.. Gambar 2.6. menunjukkan bahwa konsumsi energi menurun dengan peningkatan tegangan discharge.
Gambar 2.6. Pengaruh Tegangan Discharge Terhadap Wr Dari Larutan Etanol 99,5% Temperatur 303,15 K, Konduktivitas 5,6 mS cm-1
b. Pengaruh konsentrasi etanol
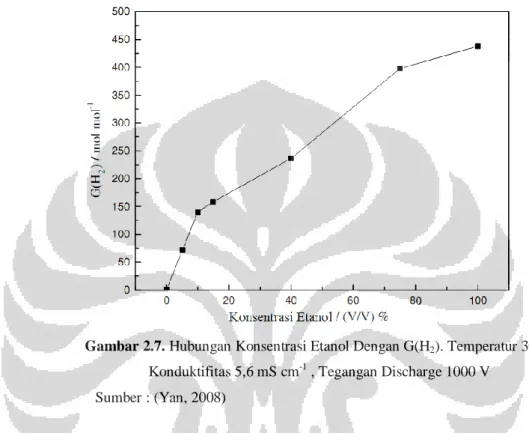
Pengaruh konsentrasi etanol terhadap perbandingan jumlah mol H2 yang
dihasilkan melalui elektrolisis plasma dengan elektrolisis konvensional (G(H2)) dapat dilihat di Gambar 2.7.
Gambar 2.7. Hubungan Konsentrasi Etanol Dengan G(H2). Temperatur 303,15 K,
Konduktifitas 5,6 mS cm-1 , Tegangan Discharge 1000 V Sumber : (Yan, 2008)
Gambar 2.7. menunjukkan bahwa semakin tinggi konsentrasi etanol, maka G (H2) yang dihasilkan akan semakin besar. Konsentrasi etanol dalam larutan
akan membuat konsentrasi air yang melingkupi gas dalam plasma meningkat. Peningkatan konsentrasi uap air di dalam volume plasma akan meningkatkan produksi ion hidroksida dan ion hidrogen. Elektron berenergi tinggi akan memutuskan ikatan hidrogen dan oksigen dalam air dan menghasilkan gas hidrogen dan gas oksigen. Hal ini membuat konsentrasi etanol dapat meningkatkan produksi hidrogen.
Sedangkan pengaruh konsentrasi etanol terhadap konsumsi energi dalam elektrolisis plasma dapat dilihat pada Gambar 2.8. Gambar 2.8 menunjukkan bahwa semakin tinggi konsentrasi etanol, konsumsi energi dalam elektrolisis plasma semakin kecil.
Gambar 2.8. Hubungan Konsentrasi Etanol Dengan Wr. Temperatur 303.15 K, Konduktifitas 5.6 mS cm-1, Tegangan Discharge 1000 V.
Sumber : (Yan, 2008)
c. Pengaruh konduktivitas larutan
Pengaruh konduktivitas larutan terhadap pembentukan OH* dan H* dapat dilihat di Gambar 2.9 dan Gambar 2.10.
Gambar 2.9. Pengaruh Konduktivitas Larutan Terhadap Pembentukan Radikal Hidroksil Terhadap Fungsi Waktu Pada Tegangan 560 V dan pH 3,00. Sumber : (Gao Jinzhang dkk, 2008)
Gambar 2.10. Pengaruh Konduktivitas Larutan Terhadap Pembentukan Radikal Hidrogen Terhadap Fungsi Waktu Pada Tegangan 560 V dan pH 3,00. Sumber : (Gao Jinzhang dkk, 2008)
Gambar 2.9. dan Gambar 2.10. menunjukkan semakin besar konduktivitas larutan, radikal OH* dan H* yang terbentuk semakin besar. Hal ini dikarenakan dengan konduktivitas yang tinggi, elektron - elektron bisa bergerak dengan lebih mudah dibanding larutan yang konduktivitasnya rendah. Akibatnya, peluang/probabilitas terjadinya tumbukan antara elektron dengan elektron pada molekul juga semakin besar, sehingga pembentukan radikal pun juga akan terjadi dengan lebih baik.
d. Pengaruh pH larutan
Pengaruh pH larutan terhadap pembentukan OH* dan H* dapat dilihat pada Gambar 2.11 dan Gambar 2.12 di bawah. Gambar 2.11. dan Gambar 2.12. menunjukkan bahwa pembentukan radikal OH* maupun H* paling tinggi terjadi ketika pH larutan sekitar 3.
Gambar 2.11. Pengaruh pH Awal Terhadap Pembentukan Radikal Hidroksil Terhadap Fungsi Waktu Pada Tegangan 560 Volt dan Konduktivitas 4,577 mS/cm
Sumber : (Gao Jinzhang dkk, 2008)
Gambar 2.12. Pengaruh pH Awal Terhadap Pembentukan Radikal Hidrogen Terhadap Fungsi Waktu Pada Tegangan 560 Volt dan Konduktivitas 4,577 mS/cm
BAB 3
METODE PENELITIAN
Bagian ini membahas berbagai hal yang berhubungan dengan rancangan penelitian yang akan dilakukan, alat dan bahan yang dibutuhkan dalam melakukan penelitian, dan prosedur yang dilakukan untuk penelitian ini.
3.1. Penelitian
Metode yang digunakan dalam penelitian ini adalah eksperimental dengan rangkaian urutan kegiatan sebagai berikut :
Memilih subjek penelitian Melakukan studi literatur
Melakukan perancangan generator hidrogen dan oksigen
Pada tahap ini dilakukan uji kinerja alat yang meliputi: produksi hidrogen dan oksigen, konsumsi listrik, dan stabilitas proses produksi H2 dan O2.
Variabel proses yang akan divariasikan adalah tegangan listrik dan konsentrasi aditif etanol.
Melakukan instalasi alat uji Melakukan pengujian eksperimen
Mengumpulkan dan mengolah data – data yang diperoleh serta mengevaluasinya.
Mempresentasikan hasil penelitian dalam bentuk grafik-grafik dan kemudian melakukan analisis.
Diagram alir penelitian secara keseluruhan dapat dilihat di Gambar 3.1. berikut.
Gambar 3.1. Diagram Alir Riset Keseluruhan Sumber : (Mardiansyah, 2011) telah diolah kembali.
Mardiansyah (2011) sudah melakukan penelitian yang serupa menggunakan variasi konsentrasi larutan KOH 0,05 M dan 0,1 M dengan aditif etanol 5 % dan 10 %, menggunakan tegangan hingga 300 volt. Yang membedakan penelitian ini dengan penelitian sebelumnya adalah menggunakan larutan KOH dengan konsentrasi yang lebih rendah (0,03 M), menggunakan tegangan tinggi (hingga 700 Volt), dan dengan memvariasikan kedalaman katoda di dalam reaktor Glow Discharge Plasma Electrolysis.
Pengaruh Variasi Proses (Variabel bebas): 1. Suhu reaktor Larutan 80-85 oC 2. Tegangan 300-700 V
3. Konsentrasi aditif Etanol (5 %, 10 %, 15 %). 4. Konsentrasi KOH (0,03 M, 0,05 M, 0,1 M) 5. Perbedaan kedalaman katoda
Mulai
Studi Pustaka
Merangkai Reaktor Menyusun Rangkaian Listrik Preparasi Bahan
Uji Pendahuluan Reaktor Elektrolisis Plasma Non-Termal
Pembahasan dan Kesimpulan
Selesai
Mendapatkan data hasil pengujian alat GHO (Variabel terikat) : 1. Laju alir produk H2 + O2
2. Komposisi H2
3.2. Alat dan Bahan Penelitian
Peralatan uji yang digunakan pada penelitian ini antara lain :
3.2.1. Peralatan Reaktor Glow Discharge Elektrolysis
Housing Filter sebagai tempat terjadinya elektrolisis plasma dengan diameter 8 cm dan tinggi 25 cm. House filter ini biasa digunakan untuk proses filtrasi air dengan membran.
Elektroda stainless steel sebagai anoda. Elektroda ini berbentuk pipa dengan tipe SS 316 G dengan diameter dalam 1/4 ” dan diameter luar 10 cm dan panjang 2 meter yang dimanfaatkan juga sebagai pipa pendingin. Air akan mengalir dari dalam pipa dan terjadi proses perpindahan panas antara larutan di dalam reaktor dengan air di dalam pipa. Air yang mengalir akan menjaga suhu reaktor konstan. Pipa stainless stell ini di buat melingkar untuk memperluas permukaan kontak dengan larutan yang panas sehingga kerja nya lebih maksimal.
Elektroda wolfram dengan panjang 13 cm dan diameter 0,5 cm digunakan untuk katoda. Katoda ini diletakkan di dalam, di bagian bawah reaktor. Akrilik silinder sebagai penangkap gas hidrogen dan pembatas ruang
anoda dengan katoda dengan diameter 5 cm dan tinggi 20 cm. Akrilik ini digunakan sebagai pemisah agar gas hidrogen tidak bereaksi dengan gas oksigen di dalam larutan serta mengurangi nilai arus dalam sistem.
Termometer untuk mengukur suhu larutan.
Pompa laju alir rendah untuk memompa air sebagai substansi pendingin larutan di dalam reaktor.
Untuk memaksimalkan produksi hidrogen daripada produksi oksigen, maka konfigurasi reaktor diarahkan pada pembentukan plasma di katoda. (Gao Jinzhang dkk, 2008) dan (Chaffin dkk, 2006) berhasil membentuk plasma di katoda dan anoda ketika luas permukaan katoda dan anoda yang menyentuh elektrolit sama besar. Dengan konfigurasi reaktor seperti pada Gambar 3.2,
cooling dengan batu es. Proses ini diulang pada kondenser yang kedua agar
proses pemisahan lebih efektif.
Pemisahan yang kedua menggunakan absorben silica gel. Absorber berbentuk tabung dengan diameter 5 cm dan tinggi 25 cm. Gas keluaran kondenser akan masuk di bagian bawah absorber kemudian keluar dari atas. Absorber akan menyerap air yang terbawa di aliran gas. Sistem peralatan pemisahan dan pemurnian dapat dilihat di Gambar 3.3.
Gambar 3.3. Peralatan Pemisahan dan Pemurnian Yang Terdiri Dari 2 Buah Tabung Pendingin dan 1 Buah Absorber.
3.2.3. Peralatan Sumber Tegangan.
Peralatan sumber tegangan yang digunakan dalam penelitian ini dapat dilihat di Gambar 3.2. Adapun peralatan sumber tegangan yang digunakan untuk membangkitkan plasma pada larutan di dalam reaktor adalah:
Miniature Circuit Breaker (MCB).
MCB ini memiliki kapasitas 10 Ampere. MCB berfungsi sebagai penjaga agar arus listrik yang mengalir tidak terlalu. MCB ini akan memutuskan hubungan listrik jika arus yang mengalir melebihi 10 A. Slide regulator.
Slide regulator berfungsi untuk mengatur tegangan yang masuk ke reaktor secara manual. Kapasitas slide regulator ini 3 kVA.
Pengambilan data konsumsi listrik, yang terdiri dari :
1. Multimeter. Multimeter ini akan membaca nilai arus yang mengalir ke reaktor untuk membangkitkan plasma. Multimeter dihubungkan melalui kabel dari dioda bridge ke katoda untuk membaca arus DC yang mengalir ke reaktor.
2. Recorder. Arus yang terbaca di multimeter cenderung berubah-ubah setiap satu detik. Recorder digunakan untuk merekam arus yang muncul di multimeter kemudian menghitungnya secara manual untuk mendapatkan arus rata-rata yang mengalir menuju sistem.
Pengambilan data produktivitas hidrogen, yang terdiri dari :
1. Flow meter. Flow meter digunakan untuk mengukur laju alir gas hidrogen dan oksigen produksi elektrolisis plasma.
2. Hidrogen analyzer. Hidrogen analyzer digunakan untuk mengukur komposisi hidrogen yang dihasilkan dari elektrolisis plasma. Hidrogen analyzer yang digunakan adalah model GNL-400F. Alat ini mampu mengukur sampel yang mengandung hidrogen hingga 50 % komposisi volume dengan laju alir maksimal sebesar 400 ml/s. Pengambilan data derajat keasaman larutan, yang terdiri dari
konduktometer.
Pengambilan data konduktivitas larutan, yang terdiri dari pH meter.
a. Konduktimeter b. pH meter c. Multimeter d. Flowmeter dan Hidrogen analyzer Gambar 3.5. Peralatalan Pengambilan Data.
Komponen komponen diatas kemudian di rangkai menurut skema pada Gambar 3.6. di bawah.
Keterangan :
1. Pendingin Media Dielektrik 7. Logam Katoda 13. Slide Regulator 2. Pompa Peristaltik 8. Logam Anoda 14. Outlet Hidrogen 3. Ruang Elektrolisis 9. Dioda Bridge 15. Termometer 4. Outlet Hidrogen 10. Kondenser 16. Sumber Listrik PLN 5. Ruang Katoda 11. Absorber Silika 17. Multimeter
6. Kasa Stainless 12. Hidrogen Analyzer
Gambar 3.6. Konfigurasi Alat Penghasil Gas Hidrogen dan Oksigen Elektrolisis Plasma.
3.2.5. Bahan Larutan Elektrolisis
Air akuades (H2O)
Kalium hidroksida (KOH) sebagai zat elektrolit dalam larutan Etanol sebagai aditif
3.3. Variabel Penelitian
1. Variabel Bebas
Variabel bebas adalah variabel yang diubah dalam suatu pengamatan, dalam hal ini adalah perbedaan jarak katoda terhadap permukaan larutan, konsentrasi KOH, konsentrasi aditif etanol, serta tegangan.
2. Variabel Terikat
Variabel terikat merupakan variabel yang besarnya didapatkan dari pengukuran (data yang diinginkan) akibat pengaruh dari variabel bebas. Variabel terikat pada penelitian ini adalah laju alir gas produk hasil elektrolisis plasma, komposisi gas hasil elektrolisis plasma dan arus. 3. Variabel Kontrol.
Variabel ini adalah variabel yang diatur pada harga tertentu. Variabel kontrol yang ditentukan dalam penelitian ini adalah suhu.
3.4. Preparasi Bahan
Bahan yang digunakan adalah larutan dengan variasi komposisi etanol dan KOH. Berikut adalah preparasi larutan KOH 0,05 M dengan aditif etanol 5 %. Tahapan dalam preparasi larutan dapat dilihat di halaman Lampiran 5.
Melarutkan 2,404 gram KOH dan 43 mL etanol ke dalam labu erlenmeyer 1000 mL.
Menambahkan aquadest hingga mencapai volume 1000 mL.
Melakukan hal yang sama untuk variasi larutan dengan komposisi 0,03 M KOH; 0,05 M KOH; 0,1 M KOH dan variasi aditif etanol 5 %, 10 %, 15 %.
3.5. Prosedur Penelitian
3.5.1. Prosedur percobaan.
Prosedur penelitian di bagi menjadi empat tahap yaitu :
1. Melakukan prosedur untuk mengetahui bagaimana pengaruh perbedaan konsentrasi larutan elektrolit KOH terhadap produksi hidrogen dan oksigen serta energi yang digunakan dari elektrolisis plasma.
2. Melakukan prosedur untuk mengetahui bagaimana pengaruh perbedaan konsentrasi aditif etanol terhadap produksi hidrogen dan energi yang digunakan dari elektrolisis plasma.
3. Melakukan prosedur untuk mengetahui bagaimana pengaruh variasi jarak katoda dengan permukaan larutan terhadap produksi hidrogen dan energi yang digunakan dari elektrolisis plasma.
4. Melakukan prosedur untuk mengetahui pengaruh elektolisis plasma pada tegangan tinggi terhadap produksi hidrogen dan energi yang digunakan.
Pada tahapan ke tiga di atas (untuk mengetahui bagaimana pengaruh variasi jarak katoda dengan permukaan larutan terhadap produktifitas hidrogen dan energi yang digunakan dari elektrolisis plasma), maka rangkaian percobaan dibuat seperti Gambar 3.7.di bawah.
Gambar 3.7. Gambar Percobaan Pada Variabel Perbedaan Jarak Katoda Dengan Permukaan Larutan.
(a). Permukaan katoda berada di permukaan larutan (jarak katoda dengan permukaan larutan adalah 0 cm).
(b). Permukaan katoda berada pada 3 cm di bawah permukaan larutan. (c). Permukaan katoda berada pada 6,6 cm di bawah permukaan larutan
Empat tahap di atas akan melalui tahap berikut. Membuat larutan uji.
Mengukur konduktivitas larutan uji. Mengukur pH larutan uji.
Memasukkan larutan uji ke dalam reaktor. Menyusun rangkaian listrik.
Menghidupkan multimeter.
Peralatan elektrolisis plasma dihubungkan ke sumber tegangan listrik (PLN) dan dengan menggunakan slide regulator menaikkan tegangannya secara perlahan-lahan hingga mencapai tegangan AC yang diinginkan (300, 400, 500 Volt). Dengan menggunakan Dioda Bridge, arus AC akan diubah menjadi DC.
Ketika suhu larutan mencapai 80 o
C mengukur arus yang mengalir, laju alir gas H2 dan O2 , serta komposisi H2 dalam gas produk.
Ketika suhu larutan mencapai 85 o
C, aliran pendingin dinyalakan untuk mendapatkan kondisi suhu reaktor di rentang 80-85 oC.
Menurunkan tegangan listrik dengan cara memutar slide regulator hingga mencapai angka 0.
Melepaskan steker dari sumber tegangan listrik. Mematikan hidrogen analyzer.
Mematikan pompa pendingin.
Mengukur konduktivitas larutan hasil elektrolisis plasma. Mengukur pH larutan hasil elektrolisis plasma.
3.5.2. Metode Pengujian
Metode pengujian dilakukan dalam empat kategori : Uji karakteristik larutan elektrolisis plasma.
Pengujian arus yang mengalir di sistem. Pengujian laju alir.
Pengujian konsentrasi hidrogen yang dihasilkan
3.5.2.1. Uji karakteristik larutan elektrolisis plasma
Uji karakteristik larutan elektrolisis plasma dibagi menjadi dua bagian, yaitu uji konduktivitas dan uji derajat keasaman.
a. Uji konduktivitas
Uji konduktivitas larutan dilakukan sebelum proses elektrolisis plasma dan setelah proses elektrolisis plasma dengan menggunakan