WEEK II
TEORI ATOM
Gagasan tentang atom sudah dimulai sejak
abad ke-5 SM.
Democratus mengungkapkan bahwa semua
materi terdiri atas partikel yang sangat kecil
dan tidak dapat dibagi lagi yang dinamakan
atomos (= sesuatu yang tidak dapat dibagi
lagi).
Gagasan dari democratus ini kemudian
menjadi dasar dari penyelidikan tentang atom
pada masa modern.
TEORI ATOM DALTON
Merupakan awal teori atom modern.
Dikemukakan oleh John Dalton pada tahun 1808.
Teori atom Dalton dapat dirangkum sebagai berikut;
1. Unsur terdiri dari partikel terkecil yang disebut atom. Atom satu unsur adalah identik, yaitu mempunyai ukuran, massa dan sifat kimia yang sama. Atom satu unsur tertentu berbeda dari unsur atom yang lain.
2. Senyawa tersusun atas atom-atom dari dua unsur atau lebih. Dalam setiap senyawa perbandingan antara jumlah atom dari setiap unsur yang ada bisa merupakan bilangan bulat atau pecahan sederhana. 3. Yang terjadi dalam reaksi kimia hanyalah pemisahan,
PENJELASAN
Teori pertama menunjukkan sifat yang identik walaupun belum mampu mendefinisikan secara pasti bagaimana gambaran struktur atom.
Teori atom yang ke-2 menunjukkan adanya hukum perbandingan tetap (law of define proportion) dan hukum perbandingan berganda (law of multiple proportion). Hukum yang terakhir menyatakan bahwa jika dua unsur dapat bergabung membentuk lebih dari satu senyawa maka perbandingan massa dari salah satu unsur, dimana massa unsur yang lain tetap, adalah sebagai bilangan bulat yang kecil.
CONTOH HUKUM PERBANDINGAN
TETAP
Misalkan molekul C dg rumus molekul AB2
terbentuk dari dari 1 atom A dan 2 atom B. Maka perbandingan jumlah atom A : B = 1 : 2 ini tetap.
Jumlah molekul C Jumlah atom A Jumlah atom B
1
1
2
CONTOH HUKUM PERBANDINGAN
BERGANDA
Dalam
3,66 gram karbon dioksida (CO
2)
ditemukan
2,66 gram karbon
dan
1 gram
oksigen
. Sedangkan dalam karbonmonoksida
(CO)
yang bermassa
2,33 gram
terdapat
1,33
gram karbon
dan
1 gram oksigen
. Massa
oksigen dijaga tetap. Dapat ditunjukkan bahwa
perbandingan massa karbon dlm karbon
dioksida dg massa karbon dlm karbon
monoksida adalah
2,66:1,33=2:1
(bulat dan
STRUKTUR ATOM
Teori Dalton
bahwa atom tidak dapat dibagi lagi
gugur karena serangkaian percobaan yang
dilakukan oleh ilmuwan mulai tahun 1850-an yg
menunjukkan bahwa atom sesungguhnya
memiliki struktur internal yang lebih kecil lagi
yang disebut dengan
sub atom
.
Partikel sub atom tersebut terdiri atas;
ELEKTRON DAN MODEL ATOM JJ
THOMSON
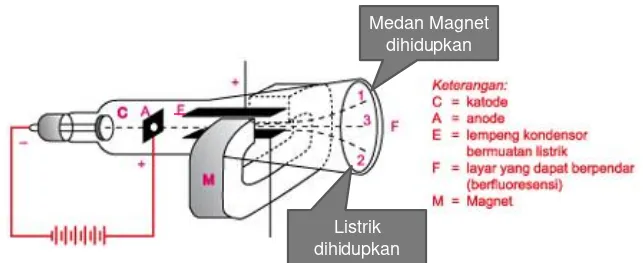
Diawali dengan penelitian radiasi (pemancaran dan perambatan energi) melalui ruang dalam bentuk gelombang. Penyelidikan lebih lanjut atom menggunakan tabung sinar katoda.
Percobaan tabung sinar katoda pertama kali dilakukan William Crookes (1875). Hasil eksperimennya adalah ditemukannya seberkas sinar yang muncul dari arah katoda
menuju ke anoda yang disebut sinar katoda.
Joseph John Thomson (1897) melanjutkan eksperimen William Crookes yaitu pengaruh medan listrik dan medan magnet dalam tabung sinar katoda
Hasil percobaannya membuktikan bahwa ada partikel bermuatan negatif dalam suatu atom karena sinar tersebut dapat dibelokkan ke arah kutub positif medan listrik.
Partikel tersebut disebut oleh thomson dengan corpuscle. oleh G. Johnstone Stoney partikel tersebut disebut dengan
Gambar Model Tabung Katoda Thomson
Medan Magnet dihidupkan
THOMSON
AKHIRNYA
BERKESIMPULAN BAHWA;
Atom sebenarnya tidak berbentuk masiv
(berbentuk bulatan yang pejal) akan tetapi tersusun atas komponen-komponen penyusun atom
Di alam atom berada dalam keadaan yang stabil dan memiliki muatan yang netral, dengan demikian Thomson lebih lanjut mengasumsikan bahwa di dalam atom itu sendiri pasti terdapat bagian yang bermuatan positif
PROTON, INTI DAN MODEL ATOM
RUTHERFORD
Pada tahun 1909 Hans Geiger dan Ernest Marsden dengan petunjuk dari Ernest Rutherford (murid dari thomson) melakukan eksperimen di Laboratorium Fisika Universitas Manchester untuk membuktikan kebenaran dari teori atom yang dikemukakan oleh Thomson.
Eksperimen ini melibatkan penembakan partikel alfa (inti atom helium atau ion helium dengan muatan positip) yang diemisikan oleh unsur Radium pada
lempengan logam emas tipis dan kemudian
mendeteksi partikel alfa yang telah melewati
lempengan logam emas tersebut dengan
menggunakan layar yang dilapisi seng sulfida (ZnS) sebagai detektor.
Akan tetapi hasil eksperimen Rutherford sangat mengejutkan, walaupun sebagian besar berkas partikel alfa melewati lempengan logam emas, terdapat banyak berkas partikel alfa yang didefleksi dengan sudut yang besar (lebih dari 90o), bahkan terdapat berkas partikel alfa yang direfleksi kembali kearah sumber tanpa pernah menyentuh layer detector (perhatikan gambar). Setelah merunut pola-pola partikel alfa yang
ditembakkan ke lempeng logam emas, maka
RUTHERFORD MENYIMPULKAN BAHWA
Sebagian besar berkas partikel alfa yang dapat melewati lempengan logam emas menunjukan bahwa partikel alfa ini melewati ruang kosong yang ada di dalam atom sehingga dengan mudah partikel alfa ini melewati ruang kosong tersebut tanpa hambatan yang berarti.
Berkas partikel alfa yang didefleksi menunjukan bahwa partikel alfa tersebut berada pada posisi yang dekat dengan inti atom yang bermuatan positif. Muatan positif dengan muatan positif akan saling tolak menolak, hal inilah yang menyebabkan partikel alfa dibelokan dengan sudut yang besar.
NEUTRON
Prediksi dari Rutherford memacu W. Bothe dan H. Becker (1930) melakukan eksperimen penembakan partikel alpha pada inti atom berilium (Be). Ternyata dihasilkan radiasi partikel berdaya tembus tinggi.
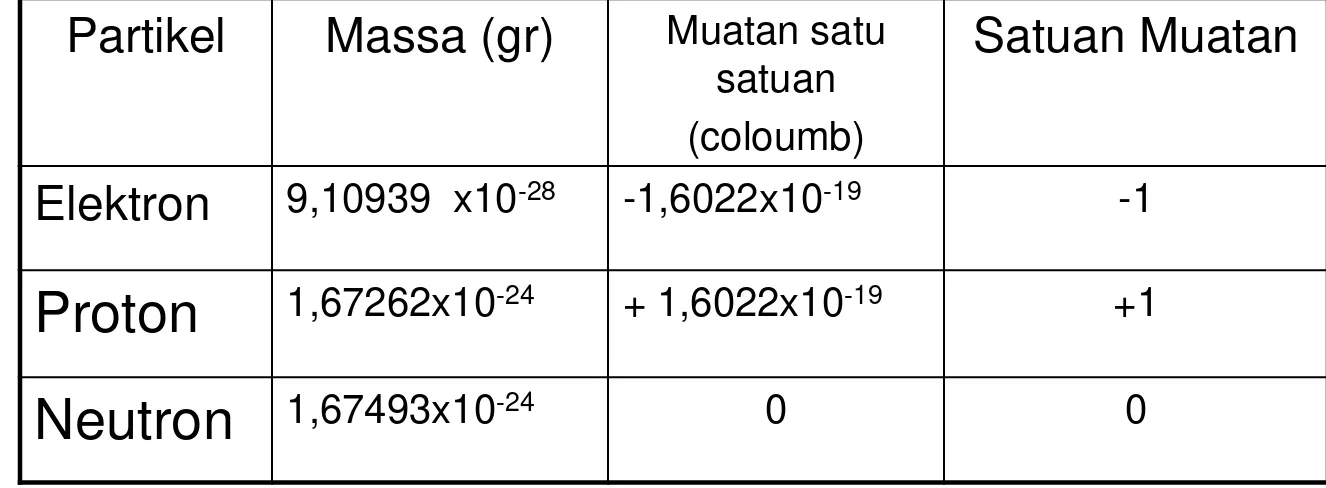
Partikel Massa (gr) Muatan satu satuan (coloumb)
Satuan Muatan
Elektron 9,10939 x10-28 -1,6022x10-19 -1
Proton
1,67262x10-24 + 1,6022x10-19 +1Neutron
1,67493x10-24 0 0NOMOR ATOM, NOMOR MASSA DAN
ISOTOP
Suatu atom memiliki sifat dan massa yang
khas satu sama lain. Dengan penemuan
partikel penyusun atom dikenal istilah
nomor
atom (Z)
dan
nomor massa (A).
Jumlah proton dalam suatu atom disebut
nomor atom.
Atom bersifat
netral
memiliki jumlah
proton
sama dengan jumlah elektronnya
sehingga
nomor atom juga menunjukan jumlah elektron.
NOMOR MASSA
Seperti diuraikan sebelumnya massa elektron sangat kecil, dianggap nol sehingga massa atom ditentukan oleh inti atom yaitu proton dan neutron.
Atom oksigen mempunyai nomor atom 8 dan nomor
massa 16, sehingga atom oksigen mengandung 8 proton dan 8 neutron.
Nomor Massa (A) = Jumlah Proton + Jumlah Neutron
Atau
Jumlah neutron = Nomor massa – Nomor atom
x
Nomor massa Fe 56 dan nomor atomnya 26 sehingga
Jumlah protonnya 26 Jumlah elektron 26
ISOTOP
Atom yang mempunyai nomor atom yang sama tetapi memiliki
nomor massa yang berbeda disebut dengan isotop.
Setiap isotop satu unsur memiliki sifat kimia yang sama karena jumlah elektronnya sama.
Isotop-isotop unsur ini dapat digunakan untuk menentukan massa atom relatif (Ar), atom tersebut berdasarkan kelimpahan isotop
TABEL PERIODIK
Tabel periodik adalah tabel yang berisi pengelompokan unsur-unsur berdasar sifat dan kimia, dimana
unsur-unsur yang memiliki kemiripan dikelompokkan
bersama.
Dalam tabel periodik unsur-unsur disusun berdasarkan nomor atomnya dalam baris horizontal yang disebut periode.
Sedangkan berdasarkan kemiripan sifat kimianya unsur disusun dalam kolom yang disebut golongan atau group.
MOLEKUL DAN ION
Molekul adalah agregat (kumpulan) yang terdiri dari sedikitnya dua atom dalam susunan tertentu yang terikat bersama oleh gaya-gaya kimia (=disebut juga ikatan kimia)
Kumpulan atom bisa berasal dari atom yang berbeda (senyawa) atau atom yang sejenis.
Molekul yang mengandung 2 atom disebut dengan
molekul diatomik. Unsur-unsur yang ada pada golongan 7A dan unsur (F,Cl,Br,I,At) termasuk dalam kategori molekul diatomik. Contoh lain molekul diatomik adalah HCl,CO dan lain-lain.
ION
Ion adalah sebuah atom atau sekelompok atom yang mempunyai muatan total positif atau negatif.
Jumlah proton yang bermuatan positif dalam inti suatu atom tetap selama selama proses peubahan kimia (reaksi kimia), tetapi elektron yang bermuatan negatif bisa hilang dan bertambah.
Atom netral yang kehilangan satu atau lebih elektronnya akan menghasilkan kation (=ion dengan muatan total positif). Contoh Natrium (Na) dapat dengan mudah kehilangan satu elektronnya untuk menjadi kation natrium, yang ditulis sebagai Na+
Atom Na ion Na+
11 proton 11 proton
Kebalikan dari kation adalah anion yang muatan totalnya adalah negatif akibat adanya kenaikan jumlah elektron. Misalkan atom klorin (Cl) dapat memperoleh tambahan satu elektron untuk menjadi ion klorida (Cl-), Sehingga
Atom Cl Ion Cl
-17 proton 17 proton
17 elektron 18 elektron
Natrium klorida (NaCl) atau garam dapur disebut sebagai senyawa ionik karena dibentuk dari kation dan anion.
Atom dapat kehilangan atau memperoleh satu atau lebih elektron.
Sebagai tambahan dua atom atau lebih dapat bergabung membentuk sebuah ion yang mempunyai muatan total positif atau negatif
RUMUS KIMIA
Rumus kimia adalah tanda yang digunakan untuk menyatakan komposisi (unsur dan rasio) dari senyawa baik senyawa molekul maupun senyawa ion.
Rumus kimia menunjukkan:
• Cara atom-atom berikatan
• Jumlah atom relatif suatu unsur di dlm unit rumus • Jumlah mol relatif bermacam-macam unsur
• Prosentase massa yg dapat dihitung darinya
Rumus kimia ada 2 macam yaitu
• rumus molekul • rumus empiris.
Rumus molekul adalah rumus yang menunjukkan jumlah eksak dari atom-atom setiap unsur di dalam unit terkecil.
Contoh H2O adalah rumus molekul untuk air
Rumus empiris adalah
rumus yang
menunjukkan komposisi penyusun molekul
pada perbandingan angka bulat yang paling
sederhana.
Contoh H
2O
2adalah rumus molekul dari
PENAMAAN SENYAWA
Selain menggunakan rumus kimia senyawa juga disebut dengan nama.
Penamaan senyawa ini menurut aturan yang telah dibuat oleh kimiawan.
Aturan penamaan senyawa berdasarkan kategori senyawa, dimana senyawa dapat dikategorikan dalam 3 bagian besar, yaitu
• Senyawa ionik
• Senyawa molekular
ATURAN PENAMAAN SENYAWA IONIK
NaCl berarti natrium klorida
ZnI2 rumus dari Seng Iodida
KBr lambang untuk Kalium Bromida dll
Untuk senyawa tersier (tersusun dari 3 jenis atom) kata ‘ida” juga digunakan untuk nama anionnya.
Contoh LiOH lambang dari Litium Hidroksida.
Jika logam yang membentuk kation bisa membentuk lebih dari satu kation maka digunakan aturan sistem stok dimana setelah nama logam diberi angka romawi sesuai jumlah muatannya.
Contoh Fe bisa kehilangan 2 atau 3 atomnya sehingga
Fe2+ disebut besi (II)
ATURAN PENAMAAN SENYAWA MOLEKULAR
Senyawa molekuler adalah senyawa yang mengandung unit molekular yang terpisah. Biasanya senyawa ini disusun atas unsur-unsur non logam. Penamaan senyawa molekular hampir sama dengan senyawa ionik, pertama untuk unsur pertama disebut nama unsurnya dan yang kedua disebut nama dasar unsur dan ditambah “ida”.
Contoh
HCl berarti Hidrogen klorida SiCrumus dari Silikon Karbida
Jika senyawa terbentuk dari atom yang jumlahnya lebih dari satu maka di depan nama ditambah dengan awalan yang menunjukkan jumlah dengan angka yunani (kecuali 1 biasanya awalan mono dihilangkan).
Contoh CO2 rumus dari karbon dioksida
N2O4 rumus dari Dinitrogen tetroksida (awalan huruf akhir “a” jika digandeng dengan oksida “a” dihilangkan).
ATURAN PENAMAAN ASAM BASA
Asam adalah zat yang menghasilkan ion hidrogen (H+)
ketika dilarutkan dalam air. Rumus untuk asam tersusun satu atau lebih atom hidrogen dan sebuah gugus anion.
Penamaan asam adalah dengan memberi nama “asam” di awal kemudian ditambah dengan nama anion diakhiri dengan “ida”
Contoh HCl (Asam Klorida)
HBr(Asam Bromida)
Asam yang mengandung hidrogen, oksigen dan unsur lain(=disebut unsur pusat) disebut asam okso. Rumus asam okso biasanya dimulai dari H,unsur pusat dan O.
Contoh HNO3 rumus untuk Asam nitrat
H2SO4 rumus dari asam sulfat
Seringkali jumlah Oksigen dalam asam okso berbeda, aturan yang digunakan
Penghilangan ion H+
Asam okso
Aturan penamaanna anion dari asam okso (=disebut anion okso seperti gambar sebelah kiri
CONTOH
HClO3 adalah asam klorat jika atom O bertambah satu HClO4 maka namanya asam perklorat
HNO3 adalah asam nitrat HNO2 adalah asam nitrit
H3PO4 asam fosfat PO4 adalah fosfat