PURIFIKASI PARSIAL DAN KARAKTERISASI
ENZIM MANANASE DARI Bacillus pumilus
ASHIF IRVAN YUSUF
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2012
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis berjudul “Purifikasi parsial dan karakterisasi enzim mananase dari Bacillus pumilus” merupakan karya saya bersama komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan oleh penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Oktober 2012
Ashif Irvan Yusuf P051090181
ABSTRACT
ASHIF IRVAN YUSUF. Partial Purification and Characterization of Mannanase Enzyme from Bacillus pumilus. Under direction of ANJA MERYANDINI and YOPI
Bacillus pumilus isolate is one of bacterial collection from Biotechnology
Culture Collection (BTCC) LIPI, isolated from Pari island waters was examined to determine the ability of bacteria to degrade mannan from Locust Bean Gum (LBG). Based on qualitative analysis, this isolate showed the abilities to degrade mannan while the quantitative analysis showed the highest mannanase activity was obtained on the third day of incubation time at 3,2 U/mL with 0,9 U/mg specific activity. Initial purification using ultrafiltration 5000 WMCO showed mannanase activity at 5,1 U/mL with 1,44 U/mg specific activity. Enzyme purification by gel filtration produced a peak in fraction no.31 with mannanase activity at 4,2 U/mL with 4,00 U/mg specific activity. Analysis of hydrolitic products by thin layer chromatography showed that the main products from
Locust Bean Gum are manobiose, manotetraose and manohexaose. Maximum
activity of the mannanase enzyme produced by B. pumilus isolate occurred at pH 5,0 and temperature of 40°C. This enzyme has 30,17 kDa single protein band when running with SDS PAGE with Michaelis Menten (Km) and maximum velocity (Vmax) at 0,076 mg/mL and 0,02 U/mg respectively.
RINGKASAN
ASHIF IRVAN YUSUF. Purifikasi Parsial dan Karakterisasi Enzim Mananase dari Bacillus pumilus. Dibimbing oleh ANJA MERYANDINI dan YOPI.
Manan sebagai fraksi penyusun hemiselulosa pada tanaman mempunyai beberapa fungsi yang diantaranya sebagai bahan utama penyusun dinding sel tanaman dan sumber energi bagi benih tanaman yang sedang tumbuh. Manan dapat dihidrolisis menjadi manosa ataupun manooligosakarida dengan bantuan enzim. Mananase adalah enzim pendegradasi manan yang mampu menghidrolisis rantai utamanya. Pemanfaatan mananase di bidang industri berkembang pesat terutama dalam bidang pakan, pangan dan pemutihan kertas.
Mikroorganisme darat telah banyak dilaporkan sebagai penghasil enzim mananase beserta karakteristiknya masing-masing. Sebaliknya masih sedikit sekali informasi yang ada mengenai mikroorganisme dari perairan khususnya bakteri laut sebagai penghasil enzim mananase. Daerah perairan laut dengan kondisi lingkungan yang sangat berbeda dari daratan seperti kondisi kadar garam yang tinggi, tekanan tinggi, temperatur rendah dan kondisi cahaya yang berbeda tentu mempengaruhi keragaman genetik dan biokimia mikroba laut dalam menghasilkan enzim, khususnya mananase.
Penelitian ini bertujuan untuk menganalisis salah satu isolat bakteri yang diisolasi dari perairan laut untuk mendapatkan informasi mengenai kemampuan isolat tersebut sebagai kandidat penghasil enzim mananase. Untuk itu perlu dilakukan suatu identifikasi secara kualitatif dan kuantitatif dari isolat sebagai penghasil enzim serta memurnikan dan mengkarakterisasi enzim mananase yang dihasilkan isolat tersebut.
Isolat yang digunakan adalah Bacillus pumilus hasil isolasi dari pantai pulau Pari, Jakarta. Langkah awal adalah identifikasi isolat secara kualitatif dengan metoda pewarnaan merah kongo dan secara kuantitatif dengan metoda asam dinitrosalisilat (DNS). Analisis produk hidrolisis menggunakan metoda kromatografi lapis tipis, dan pemurnian dilakukan dengan ultrafiltrasi dan kromatografi gel filtrasi. Hasil uji kualitatif dan kuantitatif akan menunjukkan potensi isolat menghasilkan enzim mananase, sehingga bisa dimanfaatkan sebagai sumber penghasil enzim mananase.
Isolat B. pumilus kemudian ditumbuhkan pada media dengan substrat spesifik untuk mengetahui pola pertumbuhan isolat dan saat optimum panen enzim mananase. Enzim mananase hasil optimasi tersebut digunakan sebagai sampel enzim yang akan dimurnikan serta dikarakterisasi.
Pemurnian enzim dilakukan terhadap enzim ekstrak kasar hasil produksi isolat B. pumilus. Pemurnian awal enzim dilakukan dengan metoda ultrafiltrasi untuk memekatkan enzim ekstrak kasar sebelum dilakukan pemurnian
menggunakan kromatografi gel filtrasi. Hasil pemurnian menunjukkan aktivitas spesifik enzim mananase sebesar 4,00 U/mg dengan tingkat kemurnian sebesar 4,38 x dibanding dengan enzim ekstrak kasar dan tingkat perolehan (yield) sebesar 4,44 %.
Analisis terhadap reaksi hidrolisis yang dilakukan enzim mananase perlu dilakukan untuk mengetahui tipe kerja enzim. Hasil kromatografi lapis tipis menunjukkan enzim bekerja secara endo dengan cara memotong secara acak rantai utama manan sehingga menghasilkan manooligosakarida berupa manobiosa manotetraosa dan manoheksaosa. Hasil SDS PAGE dengan pewarnaan perak didapat sebuah pita protein tunggal dari enzim hasil pemurnian dengan berat molekul sekitar 30,17 kDa.
Karakterisasi dilakukan terhadap enzim hasil pemurnian tersebut untuk mengetahui kondisi yang optimal untuk memproduksi enzim mananase dari isolat
B. pumilus. Karakterisasi dilakukan pada kondisi pH dan suhu yang berbeda.
Kondisi pH optimum didapat pada pH 5,0 sedangkan suhu optimum pada suhu 40 °C. Analisis kinetika reaksi menggunakan substrat sepesifik manan yaitu locust
bean gum didapat nilai konstanta Michaelis Menten (Km) sebesar 0,10 mg/mL
dan nilai kecepatan reaksi maksimum (Vmax) sebesar 0,02 U/mg.
Hasil ini menunjukkan kemampuan mikroba laut untuk menghasilkan enzim mananase. Nilai yang kecil menunjukkan perlunya dilakukan optimasi terhadap media tumbuh isolat, substrat spesifik yang digunakan dan optimasi terhadap kondisi inkubasi saat produksi enzim, sehingga bisa diketahui kemampuan maksimal dari isolat dalam memproduksi enzim mananase.
Hak Cipta milik IPB, tahun 2012
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis dalam bentuk apa pun tanpa izin IPB
PURIFIKASI PARSIAL DAN KARAKTERISASI
ENZIM MANANASE DARI Bacillus pumilus
ASHIF IRVAN YUSUF
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Bioteknologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2012
F
F
Penguji Luar Komisi:
HALAMAN PENGESAHAN
Judul Tesis : Purifikasi Parsial dan Karakterisasi Enzim Mananase dari
Bacillus pumilus
Nama : Ashif Irvan Yusuf NRP : P051090181
Disetujui, Komisi Pembimbing
Prof. Dr. Anja Meryandini, MS Ketua
Dr. Yopi Anggota
Diketahui:
Ketua Program Studi Bioteknologi Dekan Sekolah Pascasarjana
Prof. Dr. Suharsono, DEA Dr. Ir. Dahrul Syah, M.Sc.Agr
PRAKATA
Bismillahirrahmanirrohiim, puji dan syukur penulis panjatkan kepada Allah
SWT atas segala karunia-Nya sehingga penulis mampu menyelesaikan penulisan karya ilmiah ini. Tema penelitian yang dilaksanakan sejak bulan Maret 2011 ini ialah produksi enzim, dengan judul Purifikasi Parsial dan Karakterisasi Enzim Mananase dari Bacillus pumilus.
Ucapan terima kasih pertama kali penulis sampaikan kepada Prof. Dr. Anja Meryandini, MS. dan Dr. Yopi selaku komisi pembimbing yang telah banyak memberikan masukan dan arahan selama penyelesaian tesis ini. Rasa terima kasih juga penulis sampaikan kepada Prof. Dr. Suharsono selaku Ketua Program Studi Bioteknologi yang telah banyak membantu selama penulis melaksanakan studi di Program Studi Bioteknologi. Tak lupa terima kasih penulis haturkan kepada Dr. Nisa Rachmania Mubarik MSi. selaku dosen penguji luar komisi yang telah bersedia memberikan masukan dan tambahan wawasan untuk perbaikan karya ilmiah ini.
Terima kasih juga penulis sampaikan kepada LIPI yang telah memberikan kesempatan kepada saya untuk melakukan penelitian di Pusat Penelitian Bioteknologi LIPI. Terima kasih juga penulis sampaikan kepada Ibu Nanik, Ade, Lia dan Alex yang telah banyak membantu dalam pelaksanaan penelitian, rekan-rekan Bioteknologi Angkatan 2009, serta semua pihak yang telah membantu dalam penyelesaian tesis ini. Semoga Allah SWT membalas semua amal baik yang telah diberikan.
Bogor, Oktober 2012 Ashif Irvan Yusuf
RIWAYAT HIDUP
Penulis dilahirkan di Jambi pada tanggal 12 November 1980, putra kedua dari 3 bersaudara anak pasangan Bapak Muhammad Yusuf dan Ibu Zulfa Ahmad. Penulis menyelesaikan pendidikan dasar hingga menengah atas (SMU) di Jambi, dan menempuh pendidikan tinggi pada jenjang S1 di Fakultas Peternakan, Universitas Padjadjaran, Bandung dari tahun 1998 hingga 2003. Program magister dilanjutkan di Program Studi Bioteknologi, Institut Pertanian Bogor pada tahun angkatan 2009 atas biaya sendiri.
Pengalaman kerja penulis diawali pada tahun 2003 sebagai karyawan pada PT. Charoen Phokpand Jaya Farm yang bertanggung jawab di bidang produksi. Penulis bekerja hingga tahun 2009 sebelum melanjutkan pendidikan di Institut Pertanian Bogor.
DAFTAR ISI
Halaman
DAFTAR TABEL ... xxi
DAFTAR GAMBAR ... xxiii
DAFTAR LAMPIRAN ... xxv PENDAHULUAN Latar Belakang ... 1 Tujuan Penelitian ... 3 Manfaat Penelitian ... 3 TINJAUAN PUSTAKA Manan ... 5 Enzim ... 8 Enzim Mananase ... 9
Sumber Enzim Mananase ... 11
Kromatografi ... 12
SDS-PAGE ... 14
Spektrofotometri Protein ... 15
BAHAN DAN METODE Waktu dan Tempat Penelitian ... 17
Alat dan Bahan ... 17
Metode Penelitian Isolat dan Kondisi Kultur ... 18
Peremajaan B. pumilus ... 18
Analisis Kualitatif Isolat Penghasil Enzim Mananase ... 18
Aktivitas Enzim Mananase ... 19
Optimasi Waktu Produksi ... 19
Produksi Enzim Ekstrak Kasar ... 20
Pemekatan Enzim ... 20
Kromatografi Lapis Tipis ... 21
Kromatografi Gel Filtrasi ... 21
SDS-PAGE ... 22
HASIL DAN PEMBAHASAN Hasil
Analisis Kualitatif Bacillus pumilus ... 25
Optimasi Waktu Produksi ... 25
Produksi dan Pemekatan Enzim Mananase ... 26
Kromatografi Lapis Tipis ... 27
Kromatografi Gel Filtrasi ... 28
SDS-PAGE ... 29
Pengaruh pH dan Suhu ... 30
Kinetika Reaksi (Km dan Vmax) ... 30
Pembahasan ... 31
SIMPULAN DAN SARAN ... 37
DAFTAR PUSTAKA ... 39
DAFTAR TABEL
Halaman
1 Struktur kimia dan fungsi manan pada tanaman ... 7
2 Sifat beberapa gel sephadex ... 13
3 Pemurnian enzim mananase dari B. pumilus ... 29
4 Data perhitungan penentuan nilai Km dan Vmax ... 31
5 Perbandingan karakter beberapa enzim mananase asal bakteri ... 34
6 Perbandingan nilai Km dan Vmax beberapa enzim mananase asal bakteri ... 35
DAFTAR GAMBAR
Halaman 1 Struktur umum manan dan heteromanan ... 6 2 Reaksi enzimatis pada struktur galaktoglukomanan ... 10 3 Struktur locust bean gum dan tara gum ... 11 4 Struktur guar gum ... 11 5 Proses polimerisasi dari akrilamida ... 15 6 Hasil peremajaan dan zona bening isolat B. pumilus pada media
ASW padat dengan substrat spesifik manan ... 25 7 Kurva aktivitas enzimatis dan turbiditas B. pumilus ... 26 8 Hasil KLT enzim mananase dengan substrat LBG ... 27 9 Kurva fraksi hasil kromatografi gel filtrasi ... 28 10 SDS PAGE pemurnian enzim mananase dari B. pumilus ... 29 11 Pengaruh pH dan suhu terhadap aktivitas enzim mananase ... 30 12 Persamaan linear antara 1/[S] terhadap 1/Vi ... 31
DAFTAR LAMPIRAN
Halaman 1 Standar manosa ... 45 2 Komposisi bufer ... 46 3 SDS-PAGE ... 48
1
PENDAHULUAN
Latar Belakang
Dinding sel tanaman adalah salah satu sumber karbon organik terbanyak di bumi. Bahan utama penyusun dinding sel primer tanaman adalah selulosa, hemiselulosa dan pektin, sedangkan dinding sel sekunder sering diperkuat dengan adanya lignin, polimer aromatik heterogen (Gilbert 2010). Hemiselulosa adalah polisakarida heterogen yang memiliki bentuk linear dan mempunyai grup cabang yang terikat dengan ikatan hidrogen pada serat mikroselulosa di dinding sel tanaman (Shallom & Shoham 2003).
Manan dan heteromanan adalah bagian dari fraksi penyusun hemiselulosa pada dinding sel tanaman. Fungsi fisiologis manan dan heteromanan adalah media penyimpanan polisakarida sebagai sumber energi bagi benih yang sedang tumbuh, dan sebagai komponen struktural jaringan selulosa-hemiselulosa yang fungsinya mirip dengan xyloglukan (Dhawan & Kaur 2007, Schröder et al. 2009). Manan dan heteromanan dapat ditemukan pada benih legum dan dinding sel tanaman seperti locust bean gum (LBG), daging kopra, biji kopi dan benih kelapa. Heteromanan memiliki rantai utama β-1,4 yang terikat dengan unit manosa dan glukosa, serta rantai samping yaitu unit α-1,6-galaktosa yang terikat pada rantai utama manosa (Schröder et al. 2009).
Manan dapat dihidrolisis jadi manosa atau manooligosakarida melalui pemotongan endo oleh β-mananase dan pemotongan ekso oleh β-manosidase (Dhawan & Kaur 2007). Mananase adalah enzim yang mampu menghidrolisis secara acak ikatan β-1,4 pada tulang punggung polimer manan (Schröder et al. 2009). Mananase sebagai enzim pendegradasi manan sangat menarik untuk dipelajari karena fungsi dan pemanfaatannya pada berbagai proses industri, terutama untuk meningkatkan kualitas pangan dan pemutihan enzimatis dari bubur kayu lunak pada industri kertas (Dhawan & Kaur 2007).
Perairan dunia menutupi lebih dari 70% permukaan planet bumi, sehingga tidak terhitung jumlah mikroorganisme laut yang memiliki rahasia biokimia yang mampu memberikan pandangan dan pengertian baru terhadap enzim. Mikroorganisme perairan semakin menarik perhatian sebagai sumber baru enzim
2
karena enzim dari mikroorganisme laut relatif lebih stabil dan aktif dibanding dengan enzim yang sama berasal dari tanaman atau hewan (Bull et al. 2000). Lingkungan perairan laut sangat berbeda jika dibandingkan dengan lingkungan darat sehingga mikroorganisme laut memiliki struktur genetik berbeda akibat dari habitat hidup yang unik. Lingkungan perairan laut memiliki keragaman kondisi dari daerah yang kaya nutrisi hingga lokasi yang minim nutrisi dimana hanya ada beberapa organisme saja yang mampu bertahan. Kompleksitas kondisi lingkungan perairan laut melibatkan kadar garam yang tinggi, tekanan tinggi, temperatur rendah, dan kondisi cahaya yang khusus, sehingga memberikan kontribusi terhadap perbedaan antara enzim yang dihasilkan oleh mikroorganisme laut dengan enzim sejenis dari mikroorganisme darat (Chen & Kim 2010). Hal ini memacu perkembangan teknologi enzim asal mikroorganisme laut akhir-akhir ini untuk menghasilkan produk yang bermanfaat.
Samudra sebagai habitat kehidupan yang sangat luas sehingga memiliki berbagai bentuk kehidupan dan menyebabkan kompetisi pemanfaatan ruang dan nutrisi yang sangat tinggi. Kondisi tersebut membuat mikroorganisme laut memiliki berbagai jenis sistem enzim agar dapat beradaptasi dan bertahan hidup di lingkungan perairan laut yang kompleks (Chen & Kim 2010). Penelitian mengenai enzim yang dihasilkan dari mikroorganisme laut masih sangat sedikit sehingga mikroorganisme dari laut dianggap sebagai sumber penghasil enzim yang cukup menjanjikan dengan potensi aplikasi yang belum dapat diperkirakan.
Penelitian mengenai mikroorganisme penghasil enzim mananase dari mikroorganisme yang diisolasi dari darat sudah banyak diketahui, tapi masih sedikit sekali informasi mengenai pemanfaatan mikroorganisme laut sebagai penghasil enzim mananase. Peneliti akhir-akhir ini telah mampu mengisolasi enzim mananase dari bakteri laut, actinomycetes, jamur dan mikroorganisme laut lain dan beberapa produk dari hasil isolat tersebut diharapkan mampu diterapkan di dunia industri. Toshiyoshi dan Manabu (1978) menunjukkan bakteri golongan
Vibrio Sp. dan Pseudomonas di daerah pantai dan genus Aeromonas di sungai dan
kolam adalah bakteri dominan pendegradasi manan. Wang et al. (2010) mengkonstruksi pustaka genom, mengkloning dan mengekspresikan gen mananase dari bakteri laut Pantoea agglomerans yang merupakan isolat dari
3
koleksi kultur laut China. Hasil karakterisasi dan purifikasi enzim mananase dari
Pantoea agglomerans menunjukkan karakter stabil pada jarak pH 4 – 10, toleran
pada temperatur di bawah 60°C dan menunjukkan aktivitas optimal pada larutan NaCl. Karakter tersebut menunjukkan bahwa P. agglomerans merupakan isolat yang potensial untuk dimanfaatkan di bidang industri khususnya pangan. Politz et
al. (2000) juga berhasil mengkarakterisasi bakteri laut Rhodothermus marinus
sebagai bakteri penghasil enzim thermostabil mananase.
Mikroorganisme laut memiliki keragaman genetik dan biokimia yang sangat besar, tetapi masih sedikit sekali yang berhasil diidentifikasi. Bakteri laut saat ini dilihat sebagai sumber enzim, khususnya mananase, yang menjanjikan dengan potensi aplikasi yang beragam. Analisa yang lebih mendalam perlu dilakukan untuk mengidentifikasi dan mengetahui karakter dari isolat bakteri laut sebagai penghasil enzim mananase, serta pemurnian enzim mananase yang dihasilkan dari isolat bakteri laut tersebut.
Tujuan Penelitian
Penelitian ini bertujuan untuk memurnikan dan mengkarakterisasi enzim mananase yang dihasilkan dari bakteri yang diisolasi dari laut.
Manfaat Penelitian
Manfaat dari penelitian ini adalah (i) informasi dasar dari enzim mananase yang dihasilkan dari isolat bakteri laut, serta (ii) diperolehnya sumber daya genetik bakteri laut yang memiliki kemampuan menghasilkan enzim mananase.
5
TINJAUAN PUSTAKA
Manan
Analisis struktural terhadap polisakarida penyusun dinding sel tanaman menunjukkan dinding sel tanaman dikotil tersusun atas 3 kelas utama polisakarida yaitu selulosa, hemiselulosa dan lignin dan membentuk biomassa lignoselulosa (Moreira & Filho 2008, Gilbert 2010). Hemiselulosa merupakan bagian dari polisakarida penyusun dinding sel tanaman yang tidak larut dalam air atau agen pengkelat, tetapi dapat larut dalam larutan alkali (Selvendran & O’neill 1985). Rantai utama hemiselulosa adalah berbagai polimer gula yang linear ataupun bercabang dengan unit penyusun seperti xilosa, L-arabinosa, manosa, D-galaktosa dan D-glukosa serta grup asetil dengan struktur yang bercabang. Struktur penyusun tersebut membuat hemiselulosa memiliki bentuk amorf sehingga lebih mudah untuk dihidrolisis (Gilbert 2010).
Komponen yang termasuk ke dalam hemiselulosa adalah manan, xilan, galaktan dan arabinan. Manan bersama xilan adalah unsur utama hemiselulosa penyusun dinding sel tanaman (Vries & Visser 2001, Dhawan & Kaur 2007, Schröder et al. 2009). Hemiselulosa sebagai biomassa terletak di antara lignin dan kumpulan serat selulosa. Hemiselulosa berinteraksi membentuk ikatan kovalen dengan lignin dan interaksi non-kovalen dengan selulosa dengan fungsi menjaga integritas in situ selulosa dan melindungi terjadinya degradasi selulosa (Puls & Schuseil 1993).
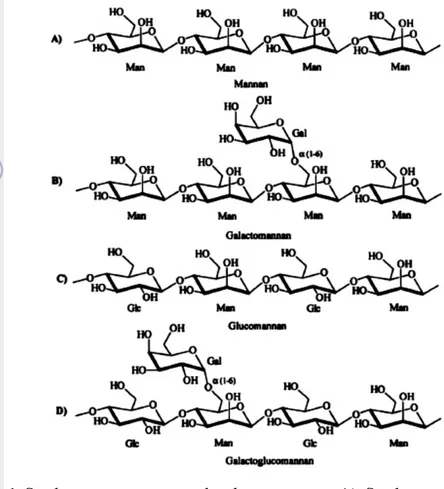
Manan dikategorikan menjadi 4 berdasarkan struktur rantai utama yang memiliki unit manosa dan unit glukosa serta keberadaan rantai samping galaktosa (Gambar 1). Manan murni memiliki karakteristik tidak larut di air dingin pada pH netral. Ketika beberapa unit manosa diganti oleh unit glukosa pada rantai utama seperti pada glukomanan, atau dengan adanya galaktosa sebagai rantai samping seperti pada galaktomanan dan glukogalaktomanan, akan meningkatkan kelarutan polimer manan di air (Tabel 1). Pola keberadaan unit glukosa dan manosa di rantai utama sering kali acak dan terkadang terjadi asetilasi dari beberapa unit penyusunnya.
6
Gambar 1 Struktur umum manan dan heteromanan. A) Struktur umum manan, rantai utama ikatan β-1,4 unit manosa (Man); B) Struktur utama galaktomanan, rantai utama ikatan β-1,4 unit manosa dengan ikatan unit galaktosa (Gal) terikat pada beberapa unit (Man); C) Struktur utama glukomanan, rantai utama ikatan β-1,4 unit manosa (Man) dan unit glukosa (Glc); D) Struktur utama galaktoglukomanan, rantai utama ikatan β-1,4 unit manosa (Man) dan unit glukosa (Glc) dengan ikatan α-1,6 unit galaktosa (Gal) yang terikat pada beberapa unit (Man) (Dhawan & Kaur 2007).
Manan mempunyai galaktosa terikat pada posisi O-6 di beberapa unit manosa dan unit β-D-glukosa yang tergabung pada rantai utama. Asetilasi dapat terjadi pada unit manosa pada posisi C-2 dan C-3. Tingginya jumlah substitusi galaktosa pada (1-4)-β-D-manan pada galaktomanan mampu mencegah penguatan rantai yang mempengaruhi kelarutan dan bentuk kristal pada manan dan glukomanan. Tanpa rantai samping galaktosa, rantai utama manan akan terpisah karena reaksi intermolekuler antar bagian yang tidak memiliki cabang pada
7
heteromanan (Dhawan & Kaur 2007), sehingga derajat hidrolisis galaktomanan akan menurun dengan peningkatan substitusi oleh galaktosa (Hilge et al. 1998)
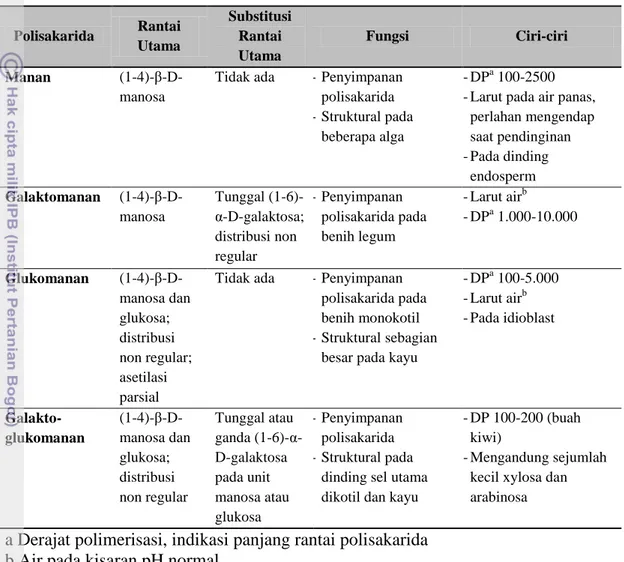
Tabel 1 Struktur kimia dan fungsi manan di tanaman (Schröder et al. 2009)
a Derajat polimerisasi, indikasi panjang rantai polisakarida b Air pada kisaran pH normal
Manan dan heteromanan terdistribusi luas di alam sebagai bagian dari hemiselulosa di kayu keras (hardwoods) dan kayu lunak (softwoods) (Capoe et al. 2000), benih tanaman legum (Buckeridge et al. 2000, Handford et al. 2003) dan pada kacang (Lundqvist et al. 2002). Manan pada kayu keras tersusun atas ikatan β-1,4 dengan unit manopiranosa dan glukopiranosa, sedangkan pada kayu lunak tersusun atas dua tipe yang berbeda dari asetilasi galaktoglukomanan. Manan terdiri atas glukosa, manosa dan galaktosa dengan rasio 1:3:1 pada kayu keras dan 1:4:0,1 pada kayu lunak (Lundqvist et al. 2002).
Polisakarida Rantai Utama Substitusi Rantai Utama Fungsi Ciri-ciri Manan (1-4)-β-D-manosa
Tidak ada - Penyimpanan polisakarida - Struktural pada
beberapa alga
- DPa 100-2500 - Larut pada air panas,
perlahan mengendap saat pendinginan - Pada dinding endosperm Galaktomanan (1-4)-β-D-manosa Tunggal (1-6)-α-D-galaktosa; distribusi non regular - Penyimpanan polisakarida pada benih legum - Larut airb - DPa 1.000-10.000 Glukomanan (1-4)-β-D-manosa dan glukosa; distribusi non regular; asetilasi parsial
Tidak ada - Penyimpanan polisakarida pada benih monokotil - Struktural sebagian
besar pada kayu
- DPa 100-5.000 - Larut airb - Pada idioblast Galakto-glukomanan (1-4)-β-D-manosa dan glukosa; distribusi non regular Tunggal atau ganda (1-6)-α-D-galaktosa pada unit manosa atau glukosa - Penyimpanan polisakarida - Struktural pada
dinding sel utama dikotil dan kayu
- DP 100-200 (buah kiwi)
- Mengandung sejumlah kecil xylosa dan arabinosa
8
Manan berfungsi sebagai cadangan makanan dan polisakarida struktural pada dinding sel tanaman. Manan, galaktomanan (keduanya dalam benih) dan glukomanan (dalam bulbs atau tubers) adalah bentuk umum penyimpanan cadangan makanan di dalam dinding sel utama. Bentuk ini akan didegradasi oleh embrio atau shoot yang sedang tumbuh. Pada benih, proses ini terjadi pada periode tertentu setelah imbibisi.
Enzim
Enzim adalah protein yang memiliki kemampuan mengkatalis atau meningkatkan rata-rata reaksi kimia (Smith 1997, Grisham et al. 1999) pada metabolisme sel dan proses-proses biologis lainnya. Sebagian besar proses yang terjadi di sel biologis memerlukan enzim agar mendapatkan produk dengan hasil yang signifikan. Enzim sebagai katalis bekerja dengan menurunkan energi aktivasi reaksi tapi tidak digunakan oleh reaksi yang dikatalisnya ataupun mengubah keseimbangan reaksi.
Enzim secara umum merupakan protein globular dengan beberapa pengecualian sejumlah kecil RNA katalitik dan kompleks RNA/protein, mempunyai ukuran mulai dari 62 asam amino (monomer dari 4-oxalocrotonate tautomerase) (Chen et al. 1992) hingga lebih dari 2500 asam amino pada enzim pensintesis asam lemak hewan. Bentuk enzim berbasis RNA yang paling umum ditemukan adalah ribosom dengan sisi katalitik yang bernama ribozyme. Aktivitas dari enzim ditentukan oleh struktur 3 dimensinya (Anfinsen 1973). Meskipun struktur enzim menentukan fungsinya, memperkirakan aktivitas enzim hanya dari strukturnya merupakan masalah yang sangat sulit dan belum bisa dipecahkan (Dunaway 2008).
Aktivitas enzim adalah jumlah mikromol substrat yang diubah menjadi produk per unit waktu pada kondisi suhu dan pH yang optimal, karena aktivitas enzim adalah ukuran kuantitas keadaan aktif enzim dan tergantung pada kondisi yang harus spesifik. Satuan internasional (SI) unitnya adalah katal dengan satuan 1 mol s-1 untuk tiap unitnya. Nilai yang lebih praktis dan sering digunakan ialah enzim unit (U) dimana 1 U = 1 μmol min-1. 1 U setara dengan 16,67 nanokatal (Bintang 2010).
9
Aktivitas spesifik enzim adalah unit umum lainnya dimana aktivitas spesifik adalah aktivitas dari enzim untuk tiap miligram protein. Aktivitas spesifik mengukur kemurnian dari enzim yaitu jumlah dari produk yang dibentuk oleh enzim pada waktu tertentu dengan kondisi per miligram enzim. Aktivitas spesifik setara dengan rataan dari reaksi dikali dengan volume reaksi dibagi dengan berat dari enzim. SI unit nya adalah katal Kg-1, tapi unit yang lebih praktis adalah μmol mg-1 min-1.
Enzim Mananase
Hidrolisis manan atau heteromanan menjadi gula sederhana membutuhkan kerja beberapa jenis enzim untuk menghidrolisis rantai utama dan rantai samping dari heteromanan, serta memotong ujung asetil jika heteromanan memiliki unit asetil. Kompleks enzim penghidrolisis manan terdiri atas endo-1,4-β-mananase (EC 3.2.1.78, manan endo-1,4-manosidase), α-galaktosidase (EC 3.2.1.22), β-manosidase (EC 3.2.1.25), β-glukosidase (EC 3.2.1.21) dan asetil manan esterase (EC 3.1.1.6).
Enzim β-mananase bersifat endo-enzim berarti enzim bekerja secara acak menghidrolisis ikatan β-(1,4) antar unit manosa pada rantai utama polimer manan, menghasilkan rantai pendek oligosakarida dengan panjang rantai utama yang bervariasi (Politz et al. 2000, Shallom & Shoham 2003, Schröder et al. 2009). Oligosakarida kemudian dihidrolisis lebih lanjut oleh α-galaktosidase yang memotong rantai samping unit galaktosa. Kerjasama enzim manosidase dan β-glukosidase memotong unit manosa dan unit glukosa berturut-turut (Stålbrand et
al. 1993; Franco et al. 2004) (Gambar 2). β-manosidase dan β-Glukosidase adalah
enzim dengan tipe ekso, dimana akan menghidrolisis ikatan β-(1,4) dari unit manosa dan glukosa pada ujung nonreducing dari oligosakarida glukomanan dan galaktoglukomanan hasil hidrolisis β-mananase. α-galaktosidase mengkatalis hidrolisis ikatan α-1,6-D-galaktopiranosil rantai samping dari galaktomanan dan glukogalaktomanan. Asetil manan esterase (EC 3.1.1.6) akan menghidrolisis grup asetil dari galaktoglukomanan (Dhawan & Kaur 2007, Moreira & Filho 2008). Hasil akhir kerja kompleks enzim tersebut adalah gula sederhana yaitu manosa, glukosa dan galaktosa.
10
Gambar 2 Reaksi enzimatis pada struktur galaktoglukomanan (Moreira & Filho 2008)
Mananase termasuk enzim yang bersifat indusibel pada fungi dan bakteri. Manan yang masih berbentuk polisakarida tidak mampu melakukan penetrasi dinding sel sehingga perlu dipecah menjadi molekul yang lebih sederhana. Manan akan menginduksi mikroba untuk memecah polimer menjadi molekul yang lebih kecil. Molekul kecil ini berupa monomer dan oligomer hasil hidrolisis enzim yang dihasilkan oleh sel (Moreira & Filho 2008). Kemampuan mikroba menghasilkan mananase sangat dipengaruhi oleh jenis substrat manan seperti glukomanan, galaktomanan dan glukogalaktomanan. Sarat utama substrat adalah polisakarida yang memiliki rantai utama β-(1,4) yang terikat pada unit manosa (Schröder et al. 2009). Hasil ekstraksi dari tanaman umum digunakan sebagai substrat saat produksi enzim mananase ekstraselular (Moreira & Filho 2008). Substrat dari tanaman yang sering digunakan untuk studi mananase adalah galaktomanan dari
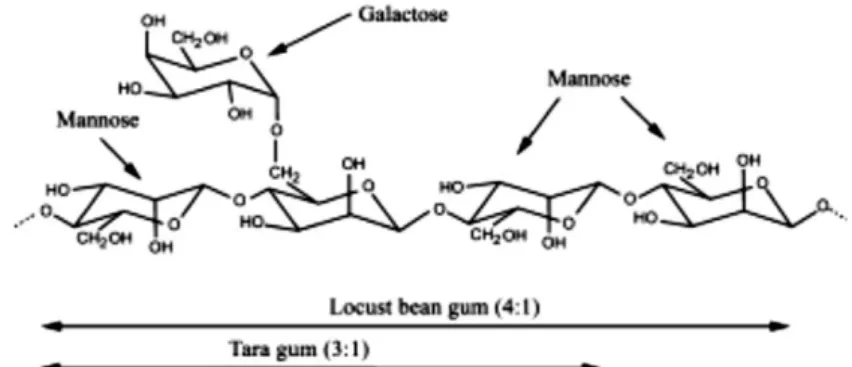
locust bean gum (LBG) hasil ekstraksi tanaman Ceratonia siliqua dengan
perbandingan manosa dan galaktosa 1:4 (Gambar 3). Tara gum (Gambar 3) dan guar gum (Gambar 4) adalah substrat galaktomanan yang sering digunakan.
11
Gambar 3 Struktur locust bean gum dan tara gum (Moreira & Filho 2008).
Gambar 4 Struktur guar gum. Rantai utama disubstitusi tiap 2 unit oleh galaktosa pada C-6 dengan ikatan glikosida 1-6 (Duffaud et al. 1997).
Sumber Enzim Mananase
Enzim mananase tersedia di alam dan dihasilkan oleh hampir seluruh mikroorganisme yang diisolasi dari lingkungan alami. Mikroorganisme dari golongan bakteri, aktinomisetes, khamir dan fungi diketahui sebagai pendegradasi manan (Talbot & Sygusch 1990, Puchart et al. 2004). Diantara bakteri, degradasi manan banyak dilakukan oleh bakteri gram positif termasuk berbagai spesies Bacillus (Sun et al. 2003, Yanhe et al. 2004) dan spesies Clostridia (Nakajima dan Matsuura 1997, Kataoka & Tokiwa 1998, Perret et al. 2004). Tetapi bakteri gram negatif juga telah dilaporkan misal Vibrio (Tamaru et al. 1995), Pseudomonas (Braithwaite et al. 1995) dan Bacteroides (Gherardini et al. 1987).
Enzim mananase umumnya dihasilkan secara ekstraseluler dimana enzim akan disekresikan keluar sel apabila ada induksi dari lingkungan tumbuhnya.
Vibrio sp. strain MA-138 (Tamaru et al. 1995), Bacillus sp. N16-5 (He et al.
2008) dan Rhodotermus marinus (Gomes & Stainer 1998) adalah contoh bakteri penghasil enzim mananase ekstraseluler. Bakteri penghasil mananase intraselular
12
juga ditemukan pada Sporocytophaga coccoids dan Aerobacter mannolyticus (Dekker & Richards 1976).
Kromatografi
Pemurnian enzim bertujuan untuk memisahkan enzim dari protein lain yang terdapat pada ekstrak kasar. Pemurnian diperlukan untuk mempelajari karakteristik fisik dan biologis suatu enzim. Metode dan tingkat pemurnian yang diharapkan tergantung pada target pemanfaatan enzim selanjutnya. Tingkat kemurnian tinggi tidak terlalu dibutuhkan jika hanya untuk mempelajari aktivitas biologis enzim. Enzim dengan tingkat kemurnian tinggi hingga 100 % biasanya diperlukan ketika mempelajari struktur enzim.
Tahap awal pemurnian enzim adalah pengendapan atau pemekatan enzim ekstrak kasar hasil ekstraksi atau isolasi enzim dari sumber penghasilnya. Pembiakan enzim tergantung kepada sumber enzim (tanaman, hewan, mikroorganisme), letak enzim (ekstraseluler, intraseluler) dan biosintesis enzim (konstitutif, induktif). Produksi enzim ekstraseluler dari mikroorganisme cenderung lebih mudah dilakukan. Ekstraksi enzim dapat dilakukan dengan menggunakan sentrifugasi, sehingga dapat dipisahkan sel mikroorganisme dari media yang mengandung enzim.
Kromatografi adalah suatu tehnik analisis biokimia pemisahan protein dimana tidak memerlukan waktu lama pada pengerjaannya. Pemisahan dilakukan berdasarkan fase gerak dan fase diamnya. Fase gerak berupa cairan atau gas, sedangkan fase diam dapat berupa padatan atau cairan. Pemisahan dilakukan dengan melewatkan campuran melalui medium alir baik cair maupun gas, sehingga menyebabkan perpindahan yang berbeda dari tiap-tiap komponen individunya. Aliran biasanya menggunakan tekanan atau gravitasi (Rosenberg 1996, Bintang 2010).
Kromatografi gel filtrasi bertujuan untuk pemisahan molekul berdasarkan ukurannya. Gel yang digunakan tersusun dalam bentuk butiran sehingga mudah dalam membuat kolom. Gel merupakan butiran dalam bentuk ikatan silang jaringan molekular tiga dimensi dengan pori-pori sehingga molekul dengan ukuran lebih kecil dari ukuran maksimal pori dapat lewat. Kemampuan molekul
13
melewati pori tergantung pada bentuknya dan berat molekulnya. Metode ini efektif untuk memisahkan enzim dari pelarut penggumpal, larutan garam dan bufer yang tidak dikehendaki.
Bahan gel yang penting adalah dekstran (polimer gula) yang mengalami ikatan silang dengan bantuan epikhlorhidrin sehingga dekstran tidak larut dalam air. Daya serap ini tergantung pada jumlah ikatan silang yang terbentuk, semakin banyak ikatan maka daya serap terhadap air semakin rendah. Gel dekstran dikenal dengan istilah sephadex (Tabel 2) dengan sifat-sifat tahan terhadap garam atau basa pada konsentrasi tinggi tetapi rusak oleh asam (di bawah pH 2) dan oksidator kuat.
Kromatografi lapis tipis adalah tehnik pemisahan molekul menggunakan plat silika. Sampel diteteskan pada plat dan batas migrasi pelarut ditandai. Posisi senyawa yang ada dalam campuran sampel dapat dilihat dengan reaksi pewarnaan setelah plat dikeringkan. Rasio jarak yang ditempuh senyawa dan jarak yang ditempuh pelarut disebut nilai Rf (retention factor). Nilai Rf dipengaruhi ketebalan plat. Silika adalah bahan yang paling banyak digunakan untuk pemisahan senyawa. Atmosfer kamar (chamber) pemisah harus jenuh oleh pelarut dengan cara penggunaan wadah yang sekecil mungkin (Bintang 2010).
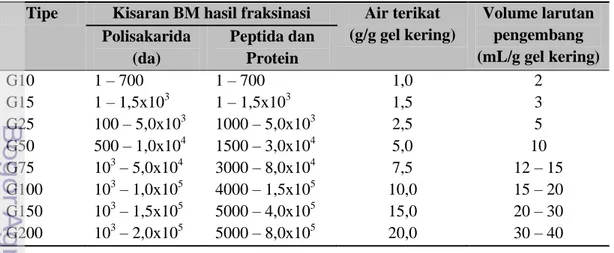
Tabel 2 Sifat beberapa gel sephadex (Bintang 2010)
Tipe Kisaran BM hasil fraksinasi Air terikat
(g/g gel kering) Volume larutan pengembang (mL/g gel kering) Polisakarida (da) Peptida dan Protein G10 1 – 700 1 – 700 1,0 2 G15 1 – 1,5x103 1 – 1,5x103 1,5 3 G25 100 – 5,0x103 1000 – 5,0x103 2,5 5 G50 500 – 1,0x104 1500 – 3,0x104 5,0 10 G75 103 – 5,0x104 3000 – 8,0x104 7,5 12 – 15 G100 103 – 1,0x105 4000 – 1,5x105 10,0 15 – 20 G150 103 – 1,5x105 5000 – 4,0x105 15,0 20 – 30 G200 103 – 2,0x105 5000 – 8,0x105 20,0 30 – 40
14
SDS-PAGE
Elektroforesis adalah suatu proses pemisahan fraksi campuran berdasarkan pergerakan partikel bermuatan karena pengaruh medan listrik. Mobilitas elektroforesis dipengaruhi oleh medium serta bentuk dan muatan molekul (Bintang 2010). Elektroforesis gel poliakrilamid (PAGE) adalah salah satu cara untuk menganalisis protein yang sering digunakan. Informasi yang bisa diperoleh dari tehnik PAGE adalah penentuan berat molekul, kemurnian protein, struktur sub unit, aktivitas enzim dan urutan asam amino (Rosenberg 1996)
Protein setelah didenaturasi akan bereaksi dengan SDS yang merupakan detergen anionik sehingga membentuk kompleks dengan muatan negatif. Protein bermuatan negatif ini akan dipisahkan berdasarkan muatan dan ukurannya pada matriks gel poliakrilamid. Berat molekul protein dapat ditentukan menggunakan protein standar yang telah diketahui berat molekulnya dengan membandingkan nilai mobilitas relatifnya (Rf). Keuntungan dari metode ini dengan adanya denaturasi protein menjadi utas tunggal akan mempermudah ketika melewati pori pada akrilamida. Keuntungan lainnya adalah pemisahan berdasarkan ukuran polipeptida sehingga bisa diperoleh hasil yang cukup jelas untuk komponen yang dipisahkannya (Scopes 1994, Walker 1996)
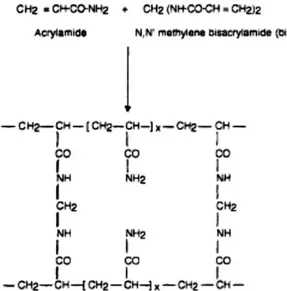
Monomer akrilamida ketika dicampur dengan N,N’-metilene-bis-akrilamida (bisN,N’-metilene-bis-akrilamida) akan membentuk ikatan silang ketika ditambahkan dengan agen polimerisasi amonium persulfat (APS). Proses polimerisasi dapat dipercepat dengan penambahan N,N,N’,N’-tetrametilene-diamina (TEMED) (Gambar 5). Ukuran pori gel ditentukan oleh perbandingan konsentrasi akrilamida dengan bisakrilamida. Semakin rendah konsentrasi maka ukuran pori gel akan semakin besar (Rosenberg 1996, Walker 1996).
Merkaptoetanol dan SDS digunakan untuk merusak struktur tiga dimensi protein. Merkaptoetanol merusak jembatan disulfida yang menahan struktur tersier protein sehingga terbentuk gugus sulfidril yang dapat mengikat SDS. SDS adalah detergen anionik mengikat kuat serta mendenaturasi protein. Protein di dalam sampel akan terdenaturasi sempurna dan terbuka menjadi struktur seperti batang dengan sejumlah molekul SDS bermuatan negatif sepanjang rantai polipeptida. Muatan asli alami pada molekul akan tergantikan seluruhnya oleh
15
molekul SDS (Bintang 2010). Bromophenol Blue berfungsi sebagai pewarna pelacak sehingga jalannya elektroforesis bisa di monitor. Sukrosa atau gliserol akan memberikan kepadatan kepada larutan sampel sehingga sampel mudah masuk ke dalam sumur gel.
Gambar 5 Proses polimerisasi dari akrilamida (Walker 1996)
Terdapat berbagai metode pendeteksi protein yang dipisahkan dengan tehnik SDS-PAGE, salah satunya pewarnaan perak. Semua prosedur pewarnaan perak tergantung reduksi ionik perak menjadi bentuk metalnya. Kation perak membentuk kompleks dengan grup amino protein (Dunn 1996). Pewarnaan perak cukup sensitif, 10 – 20 kali lebih sensitif dibanding pewarnaan menggunakan
Coomassie Blue sehingga mampu mendeteksi protein dalam jumlah nanogram
(Scopes 1994, Rosenberg 1996). Pewarnaan ini biasanya menghasilkan warna monokromatik coklat gelap.
Spektrofotometri Protein
Berbagai metoda telah dikembangkan untuk mengukur kandungan total protein dalam larutan, salah satunya dengan menggunakan spektrofotometri ultra violet. Keuntungan dari metoda ini adalah mudah, biaya rendah, volume sampel sedikit dan sampel dapat digunakan kembali. Kerugian dari metoda ini adalah
16
gangguan dari chromopores dan tidak bisa digunakan untuk mengukur diterjen dan agen denaturasi.
Penyerapan radiasi ultraviolet oleh protein tergantung pada kandungan triptofan (trp) dan tirosin (tyr) (dan sejumlah kecil kandungan fenilalanin (phe) dan ikatan disulfida). Trp, tyr dan phe memiliki cincin aromatik yang mampu menyerap sejumlah besar cahaya pada panjang gelombang 280nm sehingga protein dengan unit amino tersebut memiliki molar penyerapan yang tinggi. Nilai molar penyerapan protein pada 280 nm (extinction coefficient) biasanya ditampilkan sebagai E1% (10 mg/mL) atau E1mg/mL.
Adanya chromophores non protein (misal heme dan pyrodoxal) dapat menaikkan nilai A280. Adanya asam nukleat juga bisa mengganggu karena
memiliki cincin purin dan pirimidin. Asam nukleat memiliki nilai serapan tertinggi pada 260 nm dengan pertimbangan penyerapan memanjang hingga 280 nm. Nilai konsentrasi protein dapat diperkirakan dengan rumus berikut dengan koreksi untuk menghilangkan penyerapan oleh nukleotida di 280 nm dengan mengukur di A260 (Aitken & Learmonth 1996, Wilson & Walker 2000).
17
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian dilakukan di laboratorium Biorekayasa Lingkungan, Bidang Bioproses, Pusat Penelitian Bioteknologi LIPI Cibinong. Penelitian dilakukan dari Maret 2011 – April 2012.
Alat dan Bahan
Alat yang di gunakan dalam penelitian ini adalah laminar air flow (Bioclean Bench Sanyo MCV-B131F), inkubator bergoyang (ThermolyneROSI 1000™), neraca analitik (Persico 303A dan Sartorius TE 15025), penangas air (CV Klaten Engineriing Type F St.02.2007), spektrofotometer UV-VIS (Shimadzu UV-Pharmaspec 1700), pengaduk magnetik (IKA RH basic 2), vortex (Mixer Fisher Scientific), membran dialisis (membran selulosa), alat elektroforesis (Atto Pagerun AE-6531), kolom kromatografi dan autoklaf (Everlight TA-630), serta peralatan umum yang digunakan di laboratorium seperti pipet ukur, microtube eppendord, thermometer, kuvet, timer, gelas ukur, tabung reaksi, erlenmeyer dan gelas piala. Sentrifuse yang digunakan adalah HIMAC CT15RE (rotor T15A61 kecepatan max 15.000 rpm/21.500 x g) dan Eppendorf Centrifuge 5415R (kecepatan max 13.200 rpm/16.110 x g).
Bahan yang digunakan dalam penelitian ini adalah isolat Bacillus pumilus koleksi BTCC-LIPI. Media kultur terdiri atas Marine Art® SF-1 Artificial Sea
Water (ASW), locust bean gum (LBG), ekstrak khamir, agar-agar dan pepton.
Reagen dinitrosalisilat (DNS) terdiri atas DNS, NaOH, KNa-Tartrat. Bufer fosfat, bufer sitrat, bufer glisin NaOH. Sephadex G-75 dan bufer fosfat 0,02M pH 7,2 untuk kromatorafi gel filtrasi. Bahan Kromatografi lapis tipis terdiri atas Plat KLT (silica gel 60 F254, Merck), asam asetat dan pelarut anilin hidrogen phtalat. Bahan
elektroforesis terdiri atas akrilamid, bis akrilamid, tetrametiletilendiamina (TEMED), amonium persulfat (APS), metanol, asam asetat glasial, bufer Tris HCl, sodium doudecyl sulphates (SDS), 2-merkaptoetanol, gliserol, bromophenol blue, Marker PageRuller™ Unstained Protein Ladder (Fermentas). Pewarna merah kongo, larutan NaCl dan etanol.
18
Metode Penelitian Isolat dan Kondisi Kultur
Isolat Bacillus pumilus yang digunakan adalah hasil isolasi dari perairan pulau Pari, Jakarta. Isolat ditumbuhkan pada media Marine Art® SF-1 Artificial
Sea Water (ASW) 3,8% (b/v) dengan penambahan ekstrak khamir 0,1% (b/v),
pepton 0,5% (b/v) dan penggunaan substrat spesifik manan Locust Bean Gum (LBG) 0,5% (b/v). Untuk media padat, ditambahkan agar-agar sebanyak 1,5% (b/v) pada media ASW. Kultur isolat diinkubasi pada suhu ruang (±30°C) di atas inkubator bergoyang dengan kecepatan 150 rpm.
Peremajaan B. pumilus
Isolat B. pumilus dari gliserol stok diremajakan dengan menumbuhkan isolat pada media ASW padat mengandung substrat LBG di dalam cawan Petri. Isolat gliserol di tetes pada media padat lalu disebar menggunakan batang penyebar dan diinkubasi selama 72 - 96 jam pada suhu ruang.
Analisis Kualitatif Isolat Penghasil Enzim Mananase
Analisis kualitatif dilakukan untuk mengetahui kemampuan isolat untuk mendegradasi substrat spesifik. Uji kualitatif menggunakan metode pewarnaan merah kongo. Koloni isolat hasil peremajaan ditotolkan menggunakan tusuk gigi steril pada media ASW padat yang mengandung substrat LBG lalu diinkubasi pada suhu ruang selama 72 jam. Isolat yang tumbuh pada media padat diwarnai dengan menggunakan pewarna merah kongo 0,2 % (b/v) dengan cara digenangkan di atas media hingga isolat terendam lalu diinkubasi selama 30 menit lalu dibilas menggunakan NaCl 2% (b/v) sebanyak 3 – 5 kali setiap 15 menit hingga zona bening jelas terlihat. Zona bening merupakan indikator adanya aktivitas enzim mananase yang diukur dengan indeks mananolitik dengan membandingkan selisih antara diameter zona bening dan koloni bakteri dengan diameter koloni.
19
Aktivitas Enzim Mananase
Aktivitas enzim mananase diukur menggunakan metode Miller (1959) yang telah dimodifikasi dengan menggunakan larutan asam dinitrosalisilat (DNS), KNa-tartrat dan NaOH. Sampel dibuat dengan cara menambahkan 0,25 mL enzim ekstrak kasar ke dalam 0,25 mL larutan substrat mengandung 0,5% (b/v) LBG yang dilarutkan di dalam bufer fosfat 0,02 M pH 7,2 lalu diinkubasi pada suhu 30°C selama 30 menit. Reaksi enzimatis dihentikan dengan penambahan 0,75 mL DNS lalu dipanaskan pada suhu 95°C selama 20 menit. Sebagai kontrol 0,75 mL DNS ditambahkan kedalam 0,25 mL substrat sebelum ditambahkan 0,25 mL enzim ekstrak kasar dan dipanaskan pada suhu 95°C selama 20 menit. Aktivitas enzim diukur menggunakan spektrofotometer pada panjang gelombang 540 nm.
Aktivitas enzim mananase dinyatakan dalam U/mL dimana 1 unit enzim mananase adalah jumlah enzim yang dibutuhkan untuk memecah 1 µmol manan menjadi manosa untuk tiap menit reaksi pada kondisi yang telah ditentukan. Aktivitas spesifik enzim didefinisikan sebagai unit aktivitas enzim per mg protein. Sebagai standar digunakan kurva standar manosa. Pembuatan standar dilakukan dengan mengukur berbagai tingkat konsentrasi manosa (ppm) pada panjang gelombang 540 nm. Sebanyak 1 mL manosa direaksikan dengan 1,5 mL DNS lalu dipanaskan pada suhu 95°C selama 20 menit sebelum di ukur menggunakan spektrofotometer (Lampiran 1).
( ⁄ ) ( )
Keterangan Xs = jumlah gula tereduksi sampel Xk = jumlah gula tereduksi kontrol p = pengenceran
t = waktu inkubasi BM = berat molekul manosa
Optimasi Waktu Produksi
B. pumilus ditumbuhkan di dalam erlenmeyer pada media ASW cair
20
dalam 500 mL media ASW cair lalu diinkubasi pada inkubator bergoyang pada kecepatan 150 rpm dan suhu ruang. Sampel kultur diambil setiap 24 jam selama 5 hari dimana saat penambahan isolat ke dalam media dihitung sebagai jam ke-0. Aktivitas enzimatis dan jumlah sel dihitung. Jumlah sel tiap sampel kultur di ukur menggunakan spektrofotometer pada panjang gelombang 660 nm. Enzim ekstrak kasar diperoleh dengan mensentrifugasi sampel kultur pada kecepatan 11.000 rpm selama 15 menit, suhu 4 °C. Aktivitas enzim diukur menggunakan metode Miller (1959). Aktivitas enzim tertinggi digunakan sebagai patokan waktu optimum inkubasi pada saat perbanyakan produksi enzim mananase.
Produksi Enzim Ekstrak Kasar
Enzim ekstrak kasar diperoleh dari media hasil kultur isolat yang ditumbuhkan di media cair ASW menggunakan LBG sebagai substrat dengan waktu inkubasi disesuaikan dengan waktu produksi optimum. Media hasil kultur disentrifugasi pada kondisi 11.000 rpm dan 4°C selama 15 menit. Supernatan yang didapat adalah enzim ekstrak kasar yang digunakan untuk tahap selanjutnya disimpan pada suhu 4 °C. Aktivitas enzim dihitung menggunakan metode Miller (1959). Kadar protein diukur menggunakan spektrofotometer UV-VIS pada panjang gelombang 280 nm (Wilson & Walker 2000). Aktivitas spesifik enzim didapat dengan membandingkan antara aktivitas enzim dengan kadar proteinnya.
Pemekatan Enzim
Enzim ekstrak kasar didialisis untuk menghilangkan senyawa pengotor. Enzim dimasukkan ke dalam membran dialisis lalu kedua ujung membran diikat kuat. Membran disimpan di dalam bufer fosfat 0,02M pH 7,2 dan diaduk perlahan menggunakan pemutar bermagnet selama 24 jam di dalam ruangan dingin (4°C). Enzim hasil dialisis dipekatkan dengan menggunakan ultrafiltrasi GE Healthcare Vivaspin™ 5000 MWCO. Sebanyak 10 mL enzim hasil dialisis disentrifugasi menggunakan ultrafiltrasi pada kecepatan 6000 rpm selama 30 menit pada suhu 4°C. Enzim pada bagian atas ultrafiltrasi yang tidak tersaring adalah enzim hasil pemekatan yang kemudian dihitung aktivitas enzimatis dan kandungan protein.
21
Enzim hasil pemekatan disimpan pada ruangan bersuhu 4°C untuk digunakan pada tahap uji berikutnya.
Kromatografi Lapis Tipis
Enzim direaksikan dengan substrat 0,5% LBG pada berbagai waktu inkubasi (30, 60, 90 menit, 2, 6, 24 jam) dengan perbandingan substrat enzim sebesar 2 : 1. Hasil inkubasi dipanaskan pada suhu 100 °C selama 20 menit untuk menghentikan reaksi, kemudian disentrifugasi dengan kecepatan 11.000 rpm pada suhu 4 °C selama 10 menit. Sebagai standar digunakan manosa, manobiosa, manotriosa, manopentosa dan manoheksosa dengan masing-masing konsentrasi 1000 ppm disatukan di satu tabung dengan konsentrasi perbandingan yang sama.
Plat KLT dipotong sesuai kebutuhan lalu ditandai menggunakan pensil 2B sebagai batas awal penotolan (1 cm dari bagian bawah plat) dan batas akhir untuk elusi plat (1 cm dari bagian atas plat). Sebanyak 6 µL sampel dan 4 µL campuran standar ditotolkan pada plat dengan jarak 4 mm antar sampel, lalu dikeringkan dengan menggunakan pengering rambut untuk tiap kali penotolan. Plat KLT kemudian dimasukkan ke dalam chamber glass yang berisi eluen (n-butanol : asam asetat : aquades dengan perbandingan 2:1:1). Pergerakan eluen diamati hingga batas akhir eluen pada plat. Plat kemudian dikeluarkan dari dalam
chamber glass dan dibiarkan mengering di dalam lemari asam. Plat disemprot
secara merata dengan pelarut anilin hidrogen phtalat untuk memunculkan noda, kemudian plat kembali di keringkan di dalam lemari asam. Plat yang sudah kering dimasukkan ke dalam oven dengan suhu 100 °C untuk memunculkan noda selama ± 20 menit.
Kromatografi Gel Filtrasi
Sebanyak 15 gram matriks Sephadex G-75 dilarutkan ke dalam 1000 mL bufer fosfat 0,02 M pH 7,2 sambil diaduk menggunakan batang pengaduk dan dipanaskan di atas hot plate selama kurang lebih 2 jam. Matriks kemudian didinginkan dan disimpan semalam di ruang dingin (4 °C). Dekantasi dilakukan untuk menghilangkan serbuk yang terapung. Matriks kemudian dimasukkan ke dalam kolom kromatografi (ukuran diameter 2 cm dan tinggi 15 cm) secara
22
perlahan agar tidak terbentuk gelembung udara. Matriks dibilas menggunakan bufer fosfat 0,02 M pH 7,2 sebanyak 3 kali volume kolom.
Sampel hasil pemekatan ultrafiltrasi diaplikasikan ke dalam kolom sebanyak 1 mL. Kolom dielusi menggunakan bufer fosfat 0,02 M pH 7,2 dengan kecepatan laju alir 1 mL/menit. Fraksi hasil pemisahan dikoleksi menggunakan
microtube (eppendorf) sebanyak 100 tabung dengan volume masing-masing
tabung 1 mL. Aktivitas enzimatis dan kandungan protein masing-masing fraksi dihitung untuk menentukan fraksi dengan kemampuan enzimatis dan kadar protein tertinggi. Fraksi-fraksi yang menunjukkan aktivitas mananase tertinggi dikumpulkan dan dianggap sebagai enzim mananase murni yang akan digunakan pada uji selanjutnya.
SDS-PAGE
Analisis SDS-PAGE menggunakan poliakrilamid sebesar 4% untuk gel penahan dan 12,5% untuk gel pemisahnya. Enzim murni sebanyak 15 µL ditambah 5 µL loading buffer didenaturasi dengan pemanasan pada suhu 100 °C selama 10 menit. Sampel kemudian dimasukkan ke dalam sumur gel penahan. Proses runing elektroforesis berlangsung selama 4 jam pada kondisi tegangan 60 volt dan hambatan 30 mA.
Setelah running gel direndam di dalam larutan fiksasi (metanol 50%, asam asetat 10%) selama semalam sambil diagitasi. Gel dibilas dengan ddH2O sebelum
dimasukkan ke dalam larutan pembilas (20% etanol) sebanyak 3 kali masing-masing 20 menit. Gel kemudian dibilas dengan ddH2O sebelum dimasukkan ke dalam larutan sensitize (0,05 g Na2S2O3 dalam 250 ml aquades) selama 1 menit.
Gel kembali di bilas dengan ddH2O sebelum diwarnai dengan perak nitrat 1%
(b/v) selama 20 menit pada suhu 4°C. Gel dibilas dengan ddH2O sebelum
dimasukkan ke dalam larutan developing (5% Na2CO3; 0,05% formalin; 0,0004%
Na2S2O3 hingga pita protein jelas terlihat. Reaksi dihentikan dengan penambahan stop solution (12% asam asetat) sebelum gel kembali dibilas dengan ddH2O.
23
Karakterisasi Enzim Mananase
Karakterisasi enzim mananase meliputi pH optimum, suhu optimum dan kinetika reaksi enzimatis. Karakterisasi dilakukan dengan menguji aktivitas enzim mananase dengan menggunakan substrat LBG 0,5 % (b/v). Nilai pH diukur dari pH 3,0 sampai pH 9,0 dengan selang 0,5 unit. Bufer yang digunakan adalah bufer sitrat (pH 3,0 – 5,0), bufer fosfat (pH 5,5 – 8,0) dan bufer glycine-NaOH (pH 8,5 – 9,0). Karakterisasi suhu dilakukan dengan membedakan suhu inkubasi enzim substrat dari suhu 30 – 80 °C dengan selang 10 °C.
Kinetika reaksi mengukur nilai konstanta Michaelis Menten (Km) dan kecepatan reaksi maksimum (Vmax). Perhitungan dilakukan dengan menghitung aktivitas enzim pada kondisi pH dan suhu optimum pada berbagai konsentrasi LBG sebagai substrat (0,10%, 0,25%, 0,50%, 0,75% dan 1,00%) dengan waktu inkubasi berbeda (15, 30, 45 dan 60 menit). Hasil yang didapat akan di plot pada persamaan linear dengan menggunakan persamaan :
(
)
Keterangan : Vi = Kecepatan awal
Km = Konstanta Michaelis-Menten Si = Konsentrasi substrat
25
HASIL DAN PEMBAHASAN
Hasil Analisis Kualitatif Bacillus pumilus
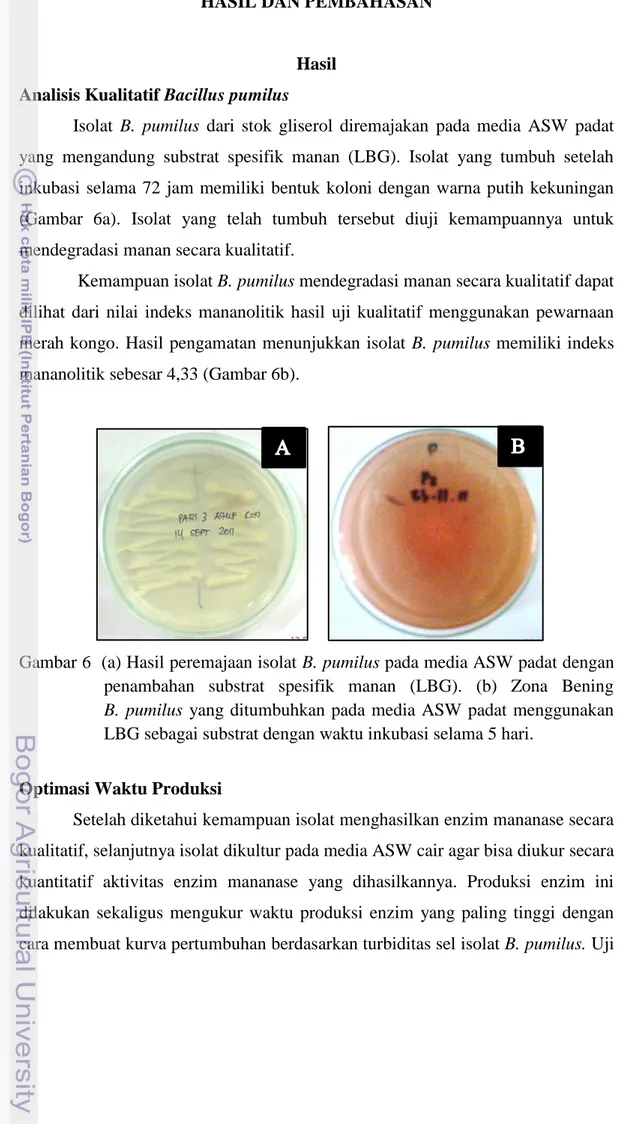
Isolat B. pumilus dari stok gliserol diremajakan pada media ASW padat yang mengandung substrat spesifik manan (LBG). Isolat yang tumbuh setelah inkubasi selama 72 jam memiliki bentuk koloni dengan warna putih kekuningan (Gambar 6a). Isolat yang telah tumbuh tersebut diuji kemampuannya untuk mendegradasi manan secara kualitatif.
Kemampuan isolat B. pumilus mendegradasi manan secara kualitatif dapat dilihat dari nilai indeks mananolitik hasil uji kualitatif menggunakan pewarnaan merah kongo. Hasil pengamatan menunjukkan isolat B. pumilus memiliki indeks mananolitik sebesar 4,33 (Gambar 6b).
Gambar 6 (a) Hasil peremajaan isolat B. pumilus pada media ASW padat dengan penambahan substrat spesifik manan (LBG). (b) Zona Bening
B. pumilus yang ditumbuhkan pada media ASW padat menggunakan
LBG sebagai substrat dengan waktu inkubasi selama 5 hari.
Optimasi Waktu Produksi
Setelah diketahui kemampuan isolat menghasilkan enzim mananase secara kualitatif, selanjutnya isolat dikultur pada media ASW cair agar bisa diukur secara kuantitatif aktivitas enzim mananase yang dihasilkannya. Produksi enzim ini dilakukan sekaligus mengukur waktu produksi enzim yang paling tinggi dengan cara membuat kurva pertumbuhan berdasarkan turbiditas sel isolat B. pumilus. Uji
26
kuantitatif terhadap kemampuan B. pumilus menghasilkan enzim mananase dapat dilihat dari kurva aktivitas enzim dan turbiditas sel bakteri (Gambar 7).
Gambar 7 Kurva aktivitas enzim dan turbiditas B. pumilus yang diinokulasi pada media ASW pH 7 pada suhu 30°C dengan LBG 0,5 % (b/v) sebagai substrat. (-▲-) Pengukuran OD sel pada panjang gelombang 660nm. (-♦-) Aktivitas enzim mananase (U/mL).
Aktivitas enzim mananase dari jam ke-0 terus mengalami peningkatan tiap 24 jam hingga aktivitas enzimatis tertinggi didapat pada jam ke-72 sebesar 7,7 U/mL. Setelah jam 72 aktivitas enzimatis kembali menurun hingga jam ke-120. Jumlah sel hasil pengukuran OD sel pada panjang gelombang 660 nm juga menunjukkan peningkatan dari jam ke-0 hingga jam ke-96. Fase eksponensial pertumbuhan isolat terlihat dimulai dari jam ke-24 hingga jam ke-96 sebelum memasuki fase stasioner. Dengan membandingkan antara grafik aktivitas enzimatis dengan kurva pertumbuhan, ditentukan waktu optimal untuk inkubasi isolat yang akan digunakan pada saat produksi enzim mananase adalah pada jam ke-72.
Produksi dan Pemekatan Enzim Mananase
Enzim mananase diproduksi pada skala 1 liter yang akan digunakan untuk pemurnian dan karakterisasi. Isolat dikultur pada media ASW cair dengan substrat LBG dengan menggunakan hasil optimasi waktu produksi sebagai patokan waktu inkubasi. Hasil perhitungan aktivitas enzim ekstrak kasar hasil produksi pada
0.000 0.050 0.100 0.150 0.200 0.250 0.300 0.00 2.00 4.00 6.00 8.00 10.00 0 24 48 72 96 120 OD sel 660 n m A kt iv itas (U/m L) Jam ke-
27
skala 1 liter sebesar 3,24 U/mL dengan jumlah protein sebesar 3,55 mg/ml. Aktivitas spesifik enzim ekstrak kasar sebesar 0,91 U/mg.
Enzim ekstrak kasar didialisis untuk mengurangi garam – garam yang ada di media. Enzim hasil dialisis dipekatkan menggunakan ultrafiltrasi dan didapat nilai aktivitas enzimatis sebesar 5,1 U/mL dengan jumlah protein sebesar 3,54 mg/ml. Aktivitas spesifik enzim mananase hasil pemekatan dengan ultrafiltrasi sebesar 1,44 U/mg.
Kromatografi Lapis Tipis
Kromatografi lapis tipis (KLT) adalah uji kualitatif yang dilakukan untuk mengetahui pola pemotongan enzim mananase isolat B. pumilus terhadap substrat manan tertentu. Noda dari sampel enzim mananase yang telah direaksikan dengan LBG pada berbagai waktu inkubasi yang berbeda dibandingkan dengan standar yang ada (Gambar 8). Hasil hidrolisis enzim mananase terhadap LBG tidak menunjukkan terbentuknya monomer manosa (M). Spot noda yang terbentuk menunjukkan pola pemotongan yang menghasilkan dimer dan oligomer manosa yaitu manobiosa, manotetraosa hingga manoheksaosa.
Gambar 8 Hasil KLT enzim mananase dengan substrat LBG (1:2) menggunakan standar manosa (M), manobiosa (M2), manotriosa (M3), manotetraosa (M4) dan manoheksaosa (M6). Perlakuan dengan perbedaan waktu inkubasi enzim yaitu 30 menit (1), 60 menit (2), 90 menit (3), 2 jam (4), 6 jam (5) dan 24 jam (6).
1 2 3 4 5 6 M M2 M3 M4 M6 M M2 M3 M4 M6
28
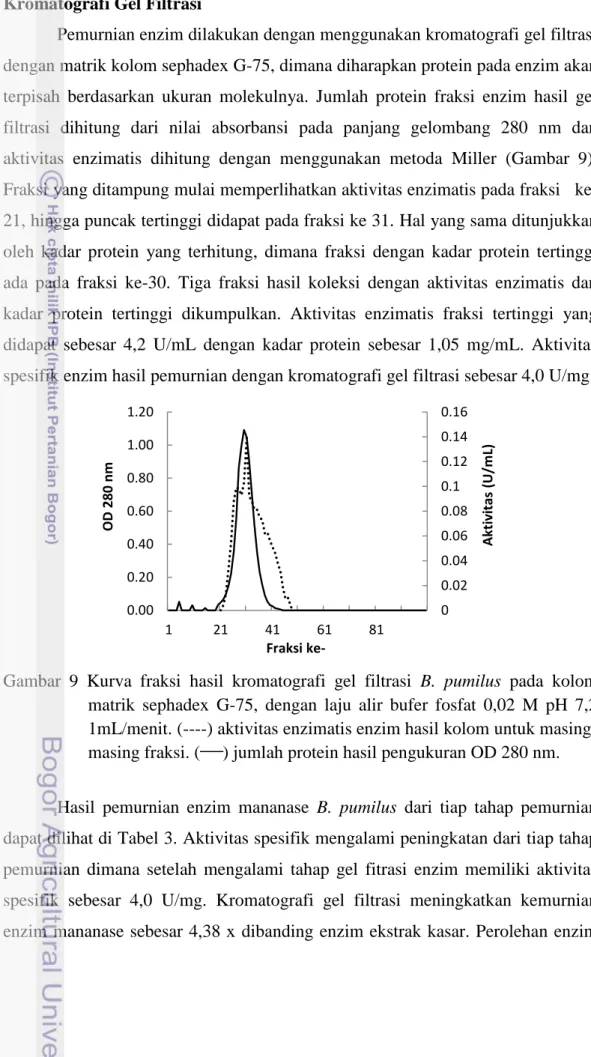
Kromatografi Gel Filtrasi
Pemurnian enzim dilakukan dengan menggunakan kromatografi gel filtrasi dengan matrik kolom sephadex G-75, dimana diharapkan protein pada enzim akan terpisah berdasarkan ukuran molekulnya. Jumlah protein fraksi enzim hasil gel filtrasi dihitung dari nilai absorbansi pada panjang gelombang 280 nm dan aktivitas enzimatis dihitung dengan menggunakan metoda Miller (Gambar 9). Fraksi yang ditampung mulai memperlihatkan aktivitas enzimatis pada fraksi ke-21, hingga puncak tertinggi didapat pada fraksi ke 31. Hal yang sama ditunjukkan oleh kadar protein yang terhitung, dimana fraksi dengan kadar protein tertinggi ada pada fraksi ke-30. Tiga fraksi hasil koleksi dengan aktivitas enzimatis dan kadar protein tertinggi dikumpulkan. Aktivitas enzimatis fraksi tertinggi yang didapat sebesar 4,2 U/mL dengan kadar protein sebesar 1,05 mg/mL. Aktivitas spesifik enzim hasil pemurnian dengan kromatografi gel filtrasi sebesar 4,0 U/mg.
Gambar 9 Kurva fraksi hasil kromatografi gel filtrasi B. pumilus pada kolom matrik sephadex G-75, dengan laju alir bufer fosfat 0,02 M pH 7,2 1mL/menit. (----) aktivitas enzimatis enzim hasil kolom untuk masing-masing fraksi. ( ) jumlah protein hasil pengukuran OD 280 nm.
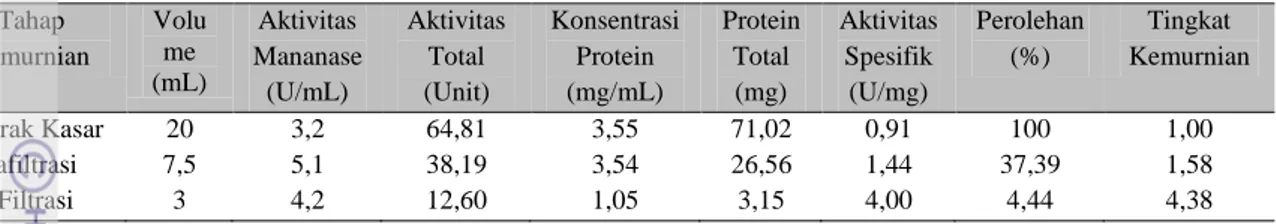
Hasil pemurnian enzim mananase B. pumilus dari tiap tahap pemurnian dapat dilihat di Tabel 3. Aktivitas spesifik mengalami peningkatan dari tiap tahap pemurnian dimana setelah mengalami tahap gel fitrasi enzim memiliki aktivitas spesifik sebesar 4,0 U/mg. Kromatografi gel filtrasi meningkatkan kemurnian enzim mananase sebesar 4,38 x dibanding enzim ekstrak kasar. Perolehan enzim
0 0.02 0.04 0.06 0.08 0.1 0.12 0.14 0.16 0.00 0.20 0.40 0.60 0.80 1.00 1.20 1 21 41 61 81 A kt iv itas (U/m L) OD 280 n m Fraksi ke-
29
hasil pemurnian menggunakan kromatografi gel filtrasi sebesar 4,44% dari enzim ekstrak kasarnya.
Tabel 3 Pemurnian enzim mananase dari B. pumilus
Tahap Pemurnian Volu me (mL) Aktivitas Mananase (U/mL) Aktivitas Total (Unit) Konsentrasi Protein (mg/mL) Protein Total (mg) Aktivitas Spesifik (U/mg) Perolehan (%) Tingkat Kemurnian Ekstrak Kasar 20 3,2 64,81 3,55 71,02 0,91 100 1,00 Ultrafiltrasi 7,5 5,1 38,19 3,54 26,56 1,44 37,39 1,58 Gel Filtrasi 3 4,2 12,60 1,05 3,15 4,00 4,44 4,38 SDS-PAGE
Berat molekul protein enzim mananase hasil pemurnian kromatografi gel filtrasi ditentukan menggunakan metode SDS-PAGE dengan pewarnaan perak untuk menampilkan hasilnya. Hasil pemisahan protein dapat dilihat pada gambar 10. Kolom A adalah penanda protein dengan ukuran 10-200 kDa, kolom B adalah hasil pemurnian dengan kromatografi, kolom C enzim hasil pemekatan dengan ultrafiltrasi dan kolom D enzim ekstrak kasar. Terdapat 1 pita yang jelas dengan beberapa pita yang smear. Menggunakan perbandingan nilai Rf dengan penanda maka diperkiraan ukuran pita protein tersebut 30,17 kDa.
Gambar 10 SDS PAGE (12,5% poliakrilamid) pemurnian enzim mananase dari
B. pumilus. A adalah penanda protein dengan ukuran 200 kDa. B
adalah enzim mananase hasil pemurnian kromatografi gel filtrasi (4,72 µg/mL). C enzim mananase hasil ultrafiltrasi (3,96 µg/mL). D enzim ekstrak kasar (0,72 µg/mL). Penanda protein yang digunakan sebanyak 15 µL sedangkan untuk sampel B, C dan D digunakan 20 µL sampel. 20 0 50 25 10 10 0 A B C D
30
Pengaruh pH dan Suhu
Karakterisasi terhadap enzim dilakukan untuk mengetahui kondisi optimum enzim mananase isolat B. pumilus hasil pemurnian pada substrat LBG. Pengaruh pH terhadap aktivitas enzim dapat dilihat pada gambar 11a sedangkan pengaruh suhu pada gambar 11b. Enzim memperlihatkan aktivitas tertinggi pada pH 5,0 (Gambar 11a). Aktivitas tertinggi enzim pada suhu 40°C, walaupun masih menunjukkan aktivitas yang baik hingga suhu 60°C (Gambar 11b).
Gambar 11 Pengaruh pH (A) dan suhu (B) terhadap aktivitas enzim mananase dari
B. pumilus hasil kromatografi gel filtrasi. (A) Reaksi enzimatis di
lakukan pada pH antara 3,0 – 9,0 ( 0,02 M sitrat pH 3,0 – 5,5; 0,02 M fosfat pH 6,0 – 8,0; 0,02 glycine-NaOH pH 8,5 – 9,0) pada suhu 30°C selama 30 menit. (B) Reaksi enzimatis dilakukan pada berbagai temperatur dari 30°C hingga 80°C selama 30 menit pada pH 7,2.
Kinetika Reaksi (Km dan Vmax)
Konstanta Michaelis Menten (Km) dan kecepatan reaksi maksimum (Vmax) didapat dengan mereaksikan enzim mananase hasil kromatografi gel filtrasi pada kondisi pH dan suhu optimumnya. Reaksi enzimatis dilakukan menggunakan substrat spesifik manan (LBG) pada berbagai tingkatan konsentrasi. Data perhitungan untuk berbagai tingkat konsentrasi substrat (Tabel 4) kemudian diplot kedalam persamaan garis regresi antara nilai 1/[S] terhadap nilai 1/V sehingga diperoleh persamaan linearnya (Gambar 12).
Persamaan regresi yang didapat Y = 4,558X + 46,585 dengan nilai R2 = 0,8309 diplot ke dalam resiprokal Lineweaver-Burk untuk mendapatkan nilai Km dan Vmax. Menggunakan plot resiprokal Lineweaver-Burk didapat nilai konstanta Michaelis (Km) dan kecepatan reaksi maksimum (Vmax) sebesar 0,10 mg/mL dan 0,02 U/mg secara berurutan.
0.0 2.0 4.0 6.0 8.0 10.0 3.0 3.5 4.0 4.5 5.0 5.5 6.0 6.5 7.0 7.5 8.0 8.5 9.0 Ak tiv it a s (U/m L ) pH 0.0 2.0 4.0 6.0 8.0 10.0 30 40 50 60 70 80 Ak tiv it a s (U/m L ) Suhu
B
A
31
Tabel 4 Data perhitungan penentuan nilai Km dan Vmaks
No [S] 1/[S] Vi 1/Vi Persamaan Regresi 1 0,10 10,0 0,0113 88,50 Y=0,0113x + 0,923 2 0,25 4,0 0,0134 74,63 Y=0,0185x + 0,923 3 0,50 2,0 0,0170 58,82 Y=0,0170x + 2,315 4 0,75 1,3 0,0185 54,05 Y=0,0134x + 1,929 5 1,00 1,0 0,0247 40,49 Y=0,0247x + 4,784
Gambar 12 Persamaan linear antara 1/[S] terhadap 1/Vi
Pembahasan
B. pumilus adalah salah satu spesies Bacillus yang banyak terdapat di
lautan (Parvathi et al. 2009), karena B. pumilus memiliki daya tahan yang tinggi terhadap kondisi lingkungan ekstrim seperti ketersediaan nutrisi rendah, intensitas sinar tinggi, kandungan H2O2 dan paparan bahan kimia (Nicholson et al. 2000). Bacillus pumilus mampu menghasilkan enzim protease pada kondisi garam tinggi
(NaCl 4 M, KCl 4 M) dan tetap mempertahankan aktivitasnya hingga 80% (Suhartono et al. 1997).
Isolat B. pumilus yang digunakan sebagai mikroorganisme penghasil enzim mananase adalah hasil isolasi dari pulau Pari di Teluk Jakarta dengan tujuan untuk mengetahui kemampuan bakteri laut menghasilkan enzim mananase (Djohan 2012). Hasil penapisan awal secara kualitatif menunjukkan kemampuan isolat ini untuk mendegradasi manan. Araujo dan Ward (1990), Aurora et al. (2003) sebelumnya juga telah melaporkan kemampuan B. pumilus dari isolat darat
y = 4.558x + 46.585 R² = 0.8309 0 20 40 60 80 100 0 2 4 6 8 10 1 /Vi 1/[S]