BIOETANOL
MOTTO MANURUNG
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
RINGKASAN
MOTTO MANURUNG. Sakarifikasi dan Fermentasi Simultan (SFS) dari Limbah Ekstraksi Alginat untuk Pembuatan Bioetanol. Dibimbing oleh IRIANI SETYANINGSIH dan BAGUS SEDIADI BANDOL UTOMO
Bioetanol merupakan salah satu bahan bakar alternatif yang digunakan untuk mengurangi ketergantungan terhadap minyak yang dapat dibuat dari bahan baku yang mengandung selulosa. Rumput laut merupakan salah satu bahan baku berupa biomasa yang mengandung selulosa, memiliki produksi yang tinggi dan diimbangi dengan produksi limbah yang tinggi juga. Oleh karena itu perlu dilakukan penelitian mengenai pemanfaatan limbah dari pengolahan rumput laut sebagai bahan baku untuk memproduksi bioetanol sebagai sumber energi alternatif. Tujuan penelitian ini melihat pengaruh perbedaan suhu dan pH terhadap bioetanol yang dihasilkan dengan menggunakan metode sakarifikasi dan fermentasi simultan.
Penelitian ini terdiri dari 2 tahapan, yaitu tahap persiapan kultur mikroorganisme dan tahap sakarifikasi dan fermentasi simultan. Tahap pertama meliputi persiapan kultur mikroorganisme yaitu Trichoderma viride yang ditumbuhkan dalam media PDA selama 7 hari serta Saccharomyces cereviceae yang ditumbuhkan dalam media PDA dan yeast extract selama 3 hari. Tahap kedua meliputi proses sakarifikasi dan fermentasi simultan dimana limbah ekstraksi alginat, air dan media andreoti dicampur ke dalam erlemeyer 2 L, kemudian dilakukan penetapan pH 4, 4,5 dan 4,8 serta disterilisasi pada suhu 1210C selama 15 menit. Media yang telah disterilisasi dilakukan penambahan 10% (v/v) suspensi T. viride dan S. cereviceae, selanjutnya dilakukan proses sakarifikasi dan fermentasi simultan selama 4 hari dengan suhu yang digunakan 30, 34 dan 380C. Analisis yang dilakukan meliputi pengukuran OD α = 600 nm, pH, total gula pereduksi setiap 24 jam dan konsentrasi etanol.
Komposisi limbah rumput laut hasil ekstraksi alginat memiliki kandungan selulosa sebesar 30,26 ± 0,02% yang digunakan oleh Trichoderma viride dan
Saccharomyces cereviceae dalam pembentukan etanol. Limbah ekstraksi alginat
sebagai bahan baku yang digunakan dalam penelitian ini memiliki kadar air 10,42 ± 0,92 %.
Proses sakarifikasi dan fermentasi simultan pada suhu 30 dan 340C pada pH 4, 4,5 dan 4,8 tidak menghasilkan etanol (0% etanol), sedangkan pada suhu 380C dengan pH 4,5, pada hari ke-3 dan ke-4 dihasilkan etanol berturut-turut sebesar 0,07% dan 0,22% (b/b), dan pada hari ke-4 dengan pH 4,8 etanol yang dihasilkan sebesar 0,22% (b/b). Kadar etanol yang tinggi dalam penelitian ini dihasilkan pada pH 4,8 dan 4,5 hari ke- 4 dengan suhu 380 C
BIOETANOL
MOTTO MANURUNG
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan
Institut Pertanian Bogor
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
Judul Skripsi : Sakarifikasi dan Fermentasi Simultan (SFS) dari Limbah Ekstraksi Alginat untuk Pembuatan Bioetanol
Nama Mahasiswa : Motto Manurung NRP : C34070038
Program Studi : Teknologi Hasil Perairan Menyetujui Pembimbing I Pembimbing II
Dr. Ir. Iriani Setyaningsih, MS Dr. Ir. Bagus S B Utomo, MAppSc NIP. 19600925 198601 2 002 NIP. 19551008 198203 1 003
Mengetahui
Ketua Departemen Teknologi Hasil Perairan.
Dr. Ir. Ruddy Suwandi, MS, M.Phil NIP. 1958 0511 1985 03 1 002
Dengan ini saya menyatakan bahwa skripsi dengan judul “Sakarifikasi dan Fermentasi Simultan (SFS) dari Limbah Ekstraksi Alginat untuk Pembuatan Bioetanol” adalah benar karya saya sendiri dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir skripsi ini.
Bogor, November 2011
Motto Manurung
NRP C34070038
RIWAYAT HIDUP
Penulis dilahirkan di Tanjungbalai, Sumatera Utara pada tanggal 19 Mei 1989 dari Ayah bernama O. Manurung dan Ibu yang bernama J. Doloksaribu. Penulis merupakan anak pertama dari lima bersaudara.
Penulis menempuh pendidikan formal dimulai dari TK Budimurni Tanjungbalai kemudian melanjutkan ke SD Methodist 1 Tanjungbalai dan lulus pada tahun 2001. Pada tahun yang sama penulis malanjutkan sekolah di SMP Swt Katolik Tritunggal Tanjungbalai, dan lulus pada tahun 2004. Pendidikan selanjutnya ditempuh di SMA Negeri 1 Tanjungbalai dan lulus pada tahun 2007. Penulis diterima sebagai mahasiswa Institut Pertanian Bogor (IPB) pada tahun 2007 melalui jalur Undangan Saringan Masuk IPB (USMI) diterima sebagai mahasiswa Departemen Teknologi Hasil Perairan (THP), Fakultas Perikanan dan Ilmu Kelautan.
Selama aktif perkuliahan, penulis aktif dalam berbagai organisasi kemahasiswaan, seperti Kordinator Pelayanan Komisi Pelayan Siswa UKM PMK IPB 2009-2010, dan Himpunan Mahasiswa Teknologi Hasil Perairan (HIMASILKAN) divisi Sosial Kemasyarakatan periode 2009-2010. Penulis juga aktif sebagai asisten luar biasa mata kuliah Iktiologi pada tahun 2009-2010, asisten mata kuliah Penanganan Hasil Perairan pada tahun 2009-2010, asisten mata kuliah Mikrobiologi Hasil Perairan 2009-2010, Asisten mata kuliah Diversifikasi Hasil Perairan dan Pengembangan Produk Perairan 2010-2011, Asisten mata kuliah Teknologi Pemanfaatan hasil Samping dan Limbah Industri Perairan 2010-2011 dan Asisten mata kuliah Agama Kristen Protestan 2010-2011. Penulis melakukan penelitian dan menyusun skripsi sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan, dengan judul “Sakarifikasi dan Fermentasi Simultan (SFS) dari
LImbah Ekstraksi Alginat untuk Pembuatan Bioetanol”, dibimbing oleh Dr.
Puji dan syukur penulis panjatkan kepada Tuhan Yesus Kristus atas kasih dan anugerah yang diberikanNya kepada penulis dalam penyusunan skripsi yang berjudul “Sakarifikasi dan Fermentasi Simultan (SFS) dari Limbah Ekstraksi
alginat untuk Pembuatan Bioetanol” merupakan salah satu syarat untuk
memperoleh gelar sarjana pada Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Penulis mengucapkan terima kasih kepada seluruh pihak yang telah membantu dalam penyelesaian skripsi ini, diantaranya kepada:
1) Dr.Ir. Iriani Setyaningsih, MS dan Dr. Ir. Bagus Sediadi Bandol Utomo, MAppSc sebagai komisi pembimbing atas segala saran, kritik, arahan, perbaikan dan motivasi, serta semua ilmu yang telah diberikan.
2) Desniar, S.Pi, M.Si sebagai dosen penguji atas segala saran, kritik, arahan, perbaikan dan motivasinya serta ilmu yang telah diberikan.
3) Dr. Ir. Ruddy Suwandi, MS, M.Phil selaku Ketua Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
4) Dr. Ir. Agoes Mardiono Jacoeb, Dipl. Biol selaku komisi pendidikan Departemen Teknologi hasil Perairan.
5) Kedua orang tua saya O. Manurung dan J. br Doloksaribu serta adik-adikku Erwin, Dedi Midian, Jefri dan Muller atas segala doa dan apapun yang telah diberikan kepadaku yang tak terhitung banyaknya.
6) Krisna Alfiani atas doa dan dukungannya selama pengerjaan skripsi ini. 7) Andreas Romulo, Hadasa Prabawati dan Fanny Aprilta atas kenangan,
kebersamaan yang tak terlupakan selama melayani di Komisi Pelayanan Siswa.
8) Teman-teman Komisi Pelayanan Siswa (KPS) UKM PMK IPB dan para Penghuni Sekret KPS yang telah untuk kenangan yang berharga dan tidak terlupakan.
9) Bu Ida, Mas Made, Mas Gunawan, Mba. Putri, Mba Ericka, Mba Wiwi, Mba Iis, Mba Nur, Pak Taufik, Mas Aris, Pak Darwin, Pak Tommy
viii
seluruh staf Balai Besar Riset Pengolahan Produk dan Bioteknologi Kelautan Perikanan, terimakasih atas bantuan dan bimbingan selama menjalankan penelitian dan juga Feli yang telah bayak membantu dan berjuang pada penelitian ini.
10) Rekan-rekan THP 44 terkhusus buat Yunny kosasih dan Tri Utami Ratna Puri dan 43 yang selalu memberikan bantuan tenaga, pikiran, motivasi dan doa untuk membantu penulis dari penelitian hingga penyelesaian skripsi ini.
Penulis menyadari bahwa dalam penulisan skripsi ini masih banyak kekurangannya. Penulis mengharapkan saran dan kritik yang bersifat membangun untuk perbaikan skripsi ini. Semoga skripsi ini bermanfaat bagi semua pihak yang memerlukannya. Bogor, November 2011 Motto Manurung
Halaman
DAFTAR ISI ... ix
DAFTAR GAMBAR ... xi
DAFTAR TABEL ... xii
DAFTAR LAMPIRAN ... xiii
1 PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Tujuan ... 2
2 TINJAUAN PUSTAKA ... 3
2.1 Klasifikasi dan Deskripsi Sargassum Sp... 3
2.2 Alginat dan Ekstraksi Alginat ... 5
2.3 Limbah Rumput Laut ... 6
2.4 Hidrolisis Enzim ... 7
2.5 Sakarifikasi dan Fermentasi Simultan ... 9
2.6 Mikroba Penghasi Etanol ... 9
2.7 Bioetanol ... 11
3 METODOLOGI ... 12
3.1 Waktu dan Tempat Penelitian ... 12
3.2 Bahan dan Alat ... 12
3.2.1 Bahan... 12
3.2.2 Alat ... 12
3.3 Tahapan Penelitian ... 13
3.4 Analisa Kimia... 16
3.4.1 Kadar air... 16
3.4.2 Total gula pereduksi ... 17
3.4.3 Pertumbuhan mikroorganisme ... 17
3.4.4 Derajat keasaman (pH) ... 18
x
Halaman
4 HASIL DAN PEMBAHASAN ... 19
4.1 Kadar Air ... 19
4.2 Kadar Selulosa ... 20
4.3 Kultur Trichoderma Viride ... 21
4.4 Kultur Saccharomyces cereviceae ... 22
4.5 Kinerja Proses Sakarifikasi dan Fermentasi Simultan ... 23
4.5.1 Proses sakarifikasi dan fermentasi simultan pada suhu 30 0C. 23
4.5.2 Proses sakarifikasi dan fermentasi simultan pada suhu 34 0C. 27
4.5.3 Proses sakarisikasi dan fermentasi simultan pada suhu 38 0C . 30
5 KESIMPULAN DAN SARAN ... 36
5.1 Kesimpulan ... 36
5.2 Saran ... 36
DAFTAR PUSTAKA ... 37
Nomor Halaman
1 Rumput laut coklat (Sargassum sp) ... 3
2 Skema kultur Trichoderma viride ... 14
3 Skema kultur Saccharomyces cereviceae ... 14
4 Skema sakarifikasi dan fermentasi simultan ... 16
5 a. Rumput laut coklat yang belum diekstraksi ... 20
b. Limbah hasil ekstraksi yang telah dikeringkan ... 20
6 Karakter fisik Trichoderma viride selama 7 hari ... 21
7 Karakter fisik Saccharomyces cereviceae pada hari ke 3 ... 22
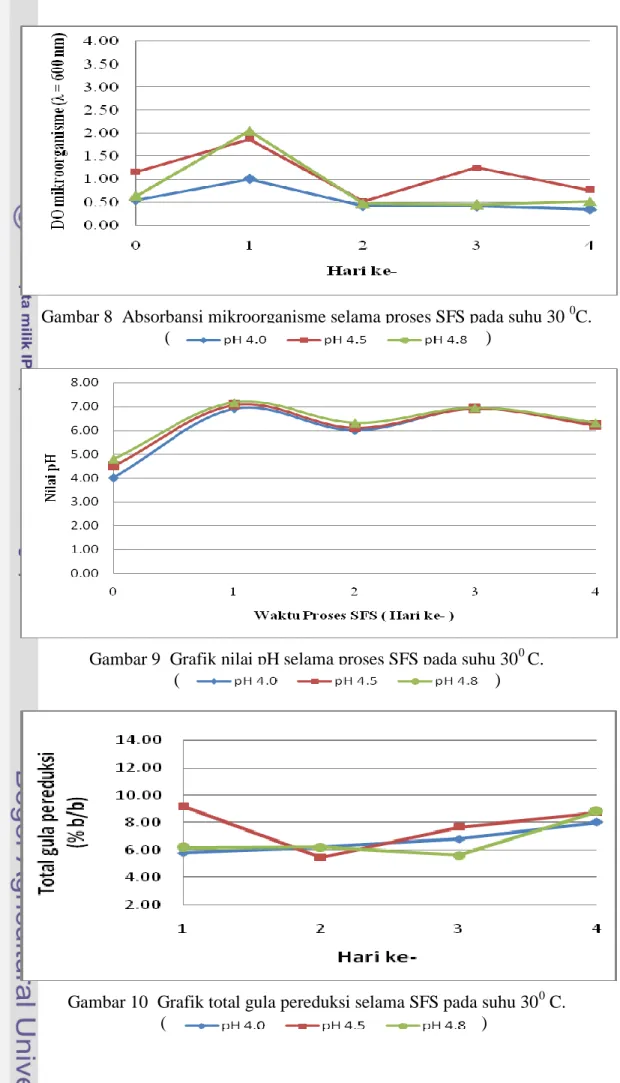
8 Absorbansi mikroorganisme selama proses SFS pada suhu 30 0C ... 24
9 Grafik nilai pH pada proses SFS pada suhu 30 0C ... 24
10 Grafik total gula pereduksi selama SFS pada suhu 30 0C ... 24
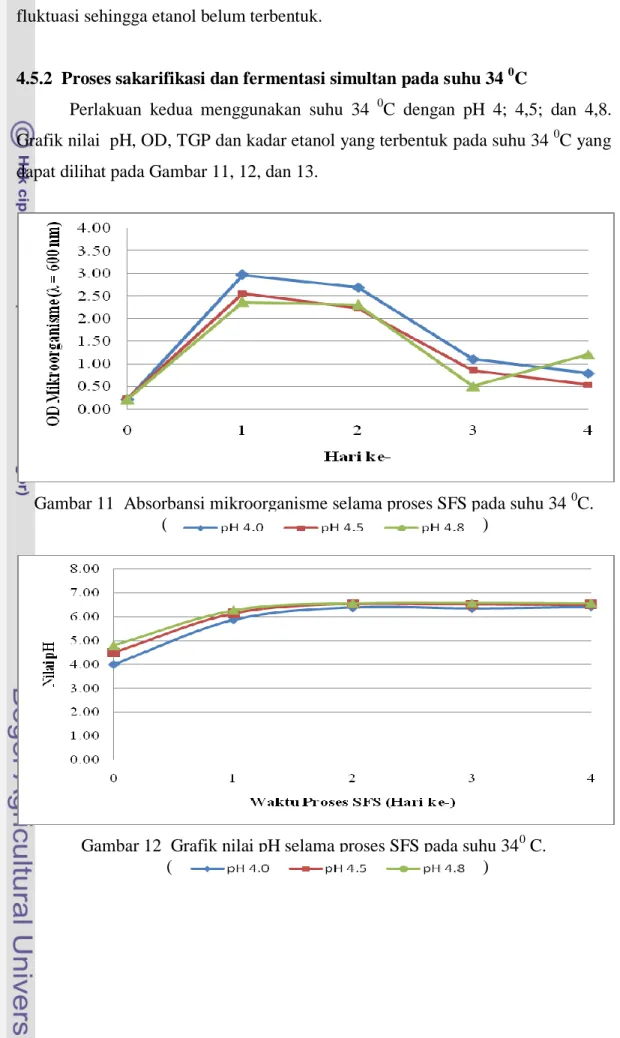
11 Absorbansi mikroorganisme selama proses SFS pada suhu 34 0C ... 27
12 Grafik nilai pH pada proses SFS pada suhu 34 0C ... 27
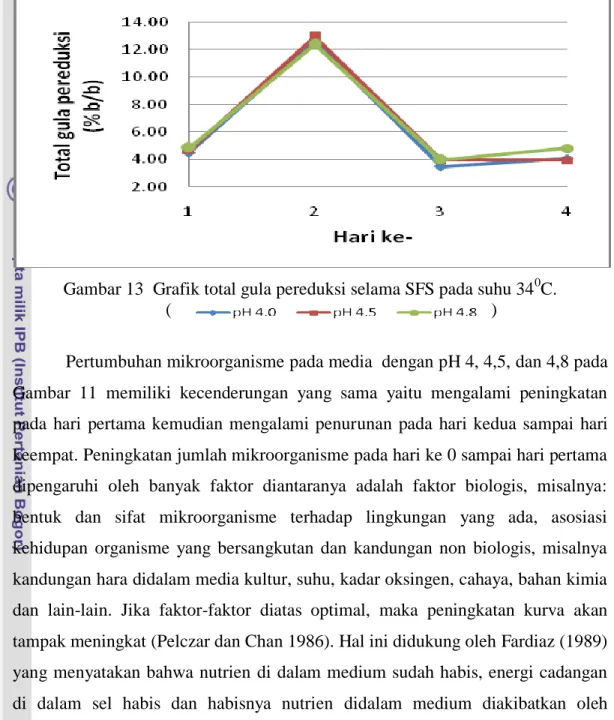
13 Grafik total gula pereduksi selama SFS pada suhu 34 0C ... 28
14 Absorbansi mikroorganisme selama proses SFS pada suhu 38 0C ... 31
15 Grafik nilai pH pada proses SFS pada suhu 38 0C ... 31
16 Grafik total gula pereduksi selama SFS pada suhu 38 0C... 32
17 Kurva glukosa standar ... 49
18 Glukosa standar ... 49
19 Rekaman uji etanol ... 50
DAFTAR TABEL
Nomor Halaman
1 Komposisi kimia Sargassum sp dari Kepulauan Seribu ... 5 2 Konsentrasi etanol pada suhu 380 C ... 34
Nomor Halaman
1 Jumlah mikroorganisme pada OD α = 600 nm pada suhu 300 C ... 43
2 Jumlah mikroorganisme pada OD α = 600 nm pada suhu 340C ... 44
3 Jumlah mikroorganisme pada OD α = 600 nm pada suhu 380C ... 45
4 Total gula pereduksi pada suhu 300C ... 46
5 Total gula pereduksi pada suhu 340C ... 47
6 Total gula pereduksi pada suhu 380C ... 48
7 Kurva glukosa standar dengan metode DNS ... 49
1 PENDAHULUAN
1.1 Latar Belakang
Kebutuhan manusia akan energi akan terus meningkat setiap tahun terkait dengan perkembangan kegiatan ekonomi dan pertambahan jumlah penduduk. Hal tersebut ditunjukkan oleh kian bertambah output serta beragam aktivitas ekonomi yang dilakukan oleh masyarakat, sehingga peningkatan kebutuhan energi adalah suatu hal yang tak bisa dihindari (Syariep 2005). Kementerian Energi dan Sumberdaya Mineral (2006) mencatat bahwa terjadinya pertumbuhan yang cukup substansial dalam permintaan energi final di Indonesia pada kurun waktu 1990-2005, yaitu dengan rata-rata pertumbuhan konsumsi sebesar 4,08% per tahun. Pada akhir tahun 2005, konsumsi energi final di Indonesia mencapai angka sekitar 816.762 SBM (Setara Barel Minyak) dan minyak menjadi jenis energi yang paling dominan sebesar 524.045 SBM.
Seiring dengan bertambahnya penduduk dan pertumbuhan ekonomi di Indonesia, serta menipisnya cadangan minyak bumi, maka dicari energi alternatif untuk menunjang kebutuhan akan energi. Salah satu alternatif penyediaan energi dengan mengkonversi biomasa menjadi bioetanol. Kekayaan Indonesia yang berlimpah akan sumber daya hayati termasuk mikroorganisma, sangat memungkinkan untuk pemanfaatan biomasa lignoselulosa menjadi bioetanol, yang sampai saat ini belum dikembangkan secara optimal. Penelitian pembuatan bioetanol telah lama dilakukan, umumnya menggunakan bahan dasar molases yang merupakan produk samping dari pabrik gula. Selain itu digunakan juga bahan berpati, antara lain singkong dan jagung yang berpotensi juga sebagai bahan pangan (Anindyawati 2009).
Bioetanol merupakan hasil proses fermentasi glukosa dari bahan yang mengandung komponen pati atau selulosa. Bioetanol diproduksi dengan menggunakan teknologi biokimia, melalui proses fermentasi gula dari bahan baku karbohidrat menggunakan bantuan mikroorganisme. Etanol yang diproduksi dipisahkan dengan air melalui proses distilasi dan dehidrasi. Bioetanol diproduksi dari bahan baku berupa biomasa (jagung, singkong, sorghum, kentang, gandum,
tebu) atau limbah biomasa (tongkol jagung, limbah jerami, limbah rumput laut, dan limbah sayuran lainnya (Prihandana et al. 2007).
Salah satu sumberdaya hayati laut Indonesia yang cukup potensial adalah rumput laut atau yang dikenal dengan sebutan ganggang laut atau alga laut. Beberapa diantaranya banyak dimanfaatkan dalam pembuatan agar, karagenan, alginat dan produk hasil ekstraksinya digunakan sebagai bahan makanan rumah tangga dan juga sebagai bahan tambahan dalam industri makanan, farmasi, kosmetik, tekstil, kertas dan cat. Penggunaan dan pengolahan rumput laut tersebut dapat meningkatkan tingginya produksi limbah, sehingga hal tersebut memberikan potensi yang baik untuk pengembangan sumberdaya alternatif sebagaimana yang sedang berkembang saat ini (Anggadiredja et al. 2006). Oleh karena itu perlu dilakukan penelitian mengenai pemanfaatan limbah dari pengolahan rumput laut sebagai bahan baku untuk memproduksi bioetanol sebagai sumber energi alternatif dan meningkatkan penerapan Zero Waste terhadap limbah rumput laut.
Proses pembuatan bioetanol dalam penelitian ini dilakukan dengan menggunakan dua biakan mikroorganisme, yaitu Trichoderma viride dan
Saccharomyces cereviceae melalui metode sakarifikasi dan fermentasi simultan
dengan substrat limbah ekstraksi alginat. Sakarifikasi dan fermentasi simultan merupakan metode yang menggabungkan dua tahap menjadi satu tahap yang bertujuan untuk mempersingkat waktu proses dan meningkatkan rendemen etanol (Hermiati et al 2010) dan belum diketahui suhu dan pH yang baik dalam proses sakarifikasi dan fermentasi simultan, sehingga perlu dilakukan penelitian pembuatan bioetanol dengan menggunakan metode sakarifikasi dan fermentasi simultan dengan suhu dan pH yang berbeda.
1.2 Tujuan Penelitian
Tujuan penelitian ini adalah melihat pengaruh perbedaan suhu dan pH terhadap bioetanol yang dihasilkan dengan menggunakan metode sakarifikasi dan fermentasi simultan dari limbah ekstraksi alginat.
2 TINJAUAN PUSTAKA
2.1 Klasifikasi dan Deskripsi Sargassum sp
Sargassum adalah salah satu genus dari kelompok rumput laut coklat yang
merupakan genera terbesar dari family sargassaceae. Klasifikasi Sargassum sp (Anggadiredja et al. 2006) adalah sebagai berikut :
Divisio : Thallophyta
Kelas : Phaeophyceae
Bangsa : Fucales
Suku : Sargassaceae
Marga : Sargassum
Jenis : Sargassum polyfolium
Sargassum crassifolium
Sargassum merupakan alga coklat yang terdiri dari kurang lebih 400 jenis
di dunia. Jenis-jenis Sargassum sp yang dikenal di Indonesia ada sekitar 12 spesies, yaitu : Sargassum duplicatum, S. histrix, S. echinocarpum, S. gracilimun,
S. obtusifolium, S. binderi, S. policystum, S. crassifolium, S. microphylum, S. aquofilum, S. vulgare, dan S. polyceratium (Rachmat 1999). Bentuk Sargassum sp
dapat dilihat pada Gambar 1.
Gambar 1 Rumput laut coklat (Sargassum sp) Sumber : Kadi (2010).
Sargassum sp. memiliki bentuk thallus gepeng, banyak percabangan yang
menyerupai pepohonan di darat, bangun daun melebar, lonjong seperti pedang, memiliki gelembung udara yang umumnya soliter, batang utama bulat agak kasar, dan holdfast (bagian yang digunakan untuk melekat) berbentuk cakram. Pinggir daun bergerigi jarang, berombak, dan ujung melengkung atau meruncing (Anggadiredja et al. 2008). Sargassum biasanya dicirikan oleh tiga sifat yaitu adanya pigmen coklat yang menutupi warna hijau, hasil fotosintesis terhimpun dalam bentuk laminaran dan alginat serta adanya flagel (Tjondronegoro et al. 1989). Sargassum tersebar luas di Indonesia, tumbuh di perairan yang terlindung maupun yang berombak besar pada habitat batu. Di Kepulauan Seribu (Jakarta) alga ini biasa disebut oseng. Zat yang dapat diekstraksi dari alga ini berupa alginat yaitu suatu garam dari asam alginik yang mengandung ion sodium, kalsium dan barium (Aslan 1999). Pada umumnya Sargassum tumbuh di daerah terumbu karang (coral reef) seperti di Kepulauan Seribu, terutama di daerah rataan pasir (sand flat ). Daerah ini akan kering pada saat surut rendah, mempunyai dasar berpasir dan terdapat pula pada karang hidup atau mati. Pada batu-batu ini tumbuh dan melekat rumput laut coklat (Atmadja dan Soelistijo 1988).
Rumput laut jenis Sargassum umumnya merupakan tanaman perairan yang mempunyai warna coklat, berukuran relatif besar, tumbuh dan berkembang pada substrat dasar yang kuat. Bagian atas tanaman menyerupai semak yang berbentuk simetris bilateral atau radial serta dilengkapi bagian sisi pertumbuhan. Umumnya rumput laut tumbuh secara liar dan masih belum dimanfaatkan secara baik.. Rumput laut coklat memiliki pigmen yang memberikan warna coklat dan dapat menghasilkan algin atau alginat, laminarin, selulosa, fikoidin dan manitol yang komposisinya sangat tergantung pada jenis (spesies), masa perkembangan dan kondisi tempat tumbuhnya (Maharani dan Widyayanti 2010).
Komponen utama dari alga adalah karbohidrat sedangkan komponen lainnya yaitu protein, lemak, abu (sodium dan potasium) dan air 80-90% (Chapman 1970). Komposisi kimia Sargassum menurut Yunizal (2004) dapat dilihat pada Tabel 1.
5
Tabel 1 Komposisi Kimia Sargassum sp dari Kepulauan Seribu
Komposisi Kimia Persentase (%)
Karbohidrat 19,06 Protein 5,53 Lemak 0,74 Air 11,71 Abu 34,57 Serat Kasar 28,39 Sumber : Yunizal 2004
2.2 Alginat dan Ekstraksi Alginat
Alginat adalah fikokoloid atau hidrokoloid yang diekstraksi dari Phaeophyceae (alga coklat). Senyawa alginat merupakan suatu polimer linier yang terdiri dari dua satuan monomerik, ß -D -asam manuronat dan α -L -asam guluronat (Horn 2000). Rumput laut coklat yang potensial untuk digunakan sebagai sumber penghasil alginat diantaranya adalah jenis Macrocystis,
Turbinaria, Padina dan Sargassum sp. Kandungan alginat pada rumput laut coklat
tergantung musim, tempat tumbuh, umur panen dan jenis rumput laut.
Alginat terdapat pada semua jenis alga coklat sebagai komponen penyusun dinding sel seperti hal selulose dan pektin. Secara kimia, asam alginat adalah senyawa komplek yang termasuk karbohidrat koloidal hidrofilik hasil polimerisasi D asam Mannuronat dengan rumus kimianya (C6H8O6)n dimana nilai n diantara
80 sampai 83 (Maharani dan Widyayanti 2010).
Pada prinsipnya ekstraksi alginat dilakukan dengan memasak ganggang coklat dalam suasana basa dengan larutan Na2CO3 atau NaOH, kemudian larutan
alginat kasar ini ditambahkan asam mineral kuat sehingga asam alginat mengendap. Beberapa proses pemurnian produk ini melibatkan proses penjernihan, pemucatan, dan pengendapan kalsium alginat. Produk akhir umumnya dijadikan bentuk garam alginat yang dapat larut dalam air, terutama natrium alginat (Maharani dan Widyayanti 2010).
Proses pembuatan alginat menurut Rasyid (2010) dimulai dengan perendaman rumput laut dengan HCl 5% selama 1 jam untuk menghilangkan
sisa-sisa kotoran yang masih menempel sehingga mempermudah proses pembentukan asam alginat, kemudian dicuci dengan akuades untuk menghilangkan sisa asam. Sampel yang sudah dicuci ditambahkan larutan natrium karbonat 4% untuk pembentukan natrium alginat sambil diaduk sampai menjadi pasta. Pasta yang terbentuk diencerkan dengan aquades sambil diaduk kemudian disaring. Selanjutnya dipucatkan dengan menambahkan larutan hidrogen peroksida 25% ke dalam filtrat dan kemudian ditambahkan larutan kalsium klorida 5% sehingga terbentuk endapan berwarna putih. Ke dalam endapan yang terbentuk ditambahkan larutan asam klorida 5%. Asam alginat yang terbentuk ditandai dengan timbulnya gumpalan di bagian atas cairan. Setelah disaring, residu yang diperoleh ditambah dengan larutan natrium hidroksida 10%. Untuk proses pemurnian dan memudahkan penyaringan, ke dalam campuran ditambahkan isopropanol 95%. Endapan bersama kertas saring yang telah diketahui bobotnya dikeringkan dalam oven suhu 600C. Endapan yang telah kering ditimbang bersama kertas saring untuk penentuan kadar natrium alginat. Hasil yang diperoleh adalah natrium alginat, selanjutnya dihaluskan dan dianalisis kadar natrium alginat, kadar air dan nilai viskositasnya.
2.3 Limbah Rumput Laut
Berdasarkan catatan statistik Departemen Kelautan dan Perikanan 2007 (DKP 2008) produksi rumput laut nasional pada tahun 2004 baru mencapai 410.570 ton. Pada tahun 2005 jumlah produksi tersebut meningkat menjadi 910.636 ton, kemudian pada tahun 2006 terus meningkat hingga mencapai 1.079.850 ton. Pada tahun 2007, tercatat sebanyak 1.343.700 ton rumput laut dihasilkan dalam waktu satu tahun. Nilai produksi yang sangat besar ini dikarenakan permintaan rumput laut sebagai bahan baku industri sangat besar baik di dalam maupun di luar negeri. Peningkatan ini didukung oleh kegiatan intensif budi daya rumput laut yang dilakukan oleh pemerintah dan masyarakat. Indonesia memiliki potensi sebanyak 540 jenis rumput laut tetapi sampai saat ini, jenis rumput laut yang banyak dibudidayakan hanya berkisar kurang dari 10 jenis,
Pengolahan dari 100% rumput laut segar menghasilkan limbah olahan yang belum diolah dan dioptimalkan dengan baik di Indonesia. Besarnya potensi dan
7
prospek pengolahan rumput laut masih belum diimbangi dengan penanganan pengolahan limbahnya. Sehingga limbah pengolahan rumput laut cenderung terbuang dan hanya menjadi sampah organik. Pada tahun 2008 limbah dari pengolahan rumput laut sekitar 1.682.542 ton. Jumlah yang besar ini sangat disayangkan jika tidak diolah dan dimanfaatkan dengan baik (Harvey 2009). Perlu adanya pemanfaatan dan pengolahan limbah sehingga dapat menerapkan prinsip “zero waste industry”. Produk olahan limbah tersebut dapat menjadi suatu produk yang memiliki nilai tambah yang jauh lebih tinggi jika dibandingkan dengan nilai produk awalnya. Limbah hasil olahan rumput laut tersebut masih mengandung selulosa dan kadar selulosa yang dikandung oleh limbah mencapai 15-25%. Selulosa tersebut merupakan bahan baku yang berpotensi untuk pembuatan bioetanol (Kim et al. 2007).
2.4 Hidrolisis Enzim
Hidrolisis adalah reaksi kimia yang memecah molekul air (H2O) menjadi
kation hydrogen (H+) dan anion hidroksida (OH-) melalui suatu proses kimia. Proses ini biasanya digunakan untuk memecah polimer tertentu, contohnya polimer organik yang memiliki rantai karbon. Ada tiga metode hidrolisis yang biasa digunakan, yaitu 1) hidrolisis asam encer (dilute acid hydrolysis), 2) hidrolisis asam pekat (concentrated acid hydrolisis) dan 3) hidrolisis enzim (enzyme hydrolysis). Hidrolisis selulosa menjadi gula-gula sederhana dapat dilakukan menggunakan tiga metode di atas. Namun dari beberapa penelitian melaporkan bahwa proses hidrolisis secara enzimatis lebih menguntungkan dari pada menggunakan asam yaitu tidak menimbulkan korosi, proses dapat berlangsung pada kondisi mild (pH 4,8 dan suhu 500C) dan rendemen lebih tinggi (Duff dan Murray 1996).
Proses hidrolisis selulosa secara enzimatis menghasilkan gula pereduksi (glukosa). Selanjutnya glukosa tersebut digunakan sebagai substrat dalam produksi etanol melalui proses fermentasi. Selulase adalah enzim yang dapat mengkatalis terjadinya reaksi hidrolisis selulosa menjadi glukosa. Tiga enzim utama yang terdapat dalam selulase kompleks adalah endoglukonase, eksoglukonase, dan selobiase (β-glukosidase). Endoglukonase menghidrolisis
ikatan 1,4-β-glikosidik secara acak pada daerah amorf selulosa menghasilkan glukosa, selubiosa dan selodekstrin. Eksoglukanase menghidrolisis selodektrin dengan memutus unit selubiosa dari ujung rantai polimer, sedangkan selobiose menghidrolisis selubiosa dan selo-oligosakarida menjadi glukosa (Syamsudin 2006).
Hemiselulase adalah kelompok enzim yang mempunyai kemampuan menghidrolisis hemiselulosa. Hidrolisis dari hemiselulosa dapat dipantau dari jumlah D-xilosa, L-arabinosa, D-glukosa, D-mannosa, D-galaktosa dan L-amnosa yang dihasilkan. Karena kemampuannya dalam menghidrolisis xilan, maka hemiselulase biasa disebut juga dengan xilanase.
Trichoderma viride merupakan salah satu mikroorganisme yang dapat menghasilkan enzim selulase untuk memecah selulosa menjadi gula-gula sederhana. T. viride termasuk dalam genus Trichoderma, famili Moniliceae dan ordo Moniliales. Kapang ini mudah dilihat karena penampakannya berserabut seperti kapas namun jika spora telah timbul akan tampak berwarna hijau tua (Domsch dan Gams 1972). T. viride mampu memproduksi kompleks enzim selulase yang lengkap yaitu endoselulase dan eksoselulase yang dapat menghidrolisis selulosa kristalin dan selulosa non kristalin. Pada enzim selulosa dapat terjadi sinergisme antara endoselulase dan eksoselulase, dan juga antar eksoselulase.
Pertumbuhan T. viride optimal pada pH sekitar 4 sedangkan untuk produksi enzim selulase mendekati pH 3. Selama produksi enzim, pH harus dipertahankan dalam kisaran 3-4 karena inaktivasi enzim akan terjadi di bawah pH 2. Suhu optimum pertumbuhan sekitar 32 – 350 C dan produksi enzim sekitar 25 – 300 C. Karakteristik dari enzim selulase adalah memiliki pH optimum 4 dan akan tetap stabil pada pH 3 – 7. Suhu optimum adalah 500 C dan aktivasinya akan menurun jika suhunya lebih dari 500 C (Waluyo 2004).
Trichoderma viride selain mampu memproduksi enzim selulase, juga dapat
menghasilkan enzim endo-1,4-xilanase yang dapat mendegradasi xilan. Berat molekul xilanase yang dihasilkan dari Trichoderma viride adalah sebesar 22.000 dalton. T. viride mampu secara simultan melakukan proses detoksifikasi dan produksi enzim secara simultan pada hidrolisat asam yang mengandung
senyawa-9
senyawa inhibitor seperti furfural dan hydroxymethylfurfural. Kapang ini juga mampu memetabolisme gula dari golongan pentosa maupun heksosa dan tidak terlalu sensitif terhadap material-material lignoselulosik.
2.5 Sakarifikasi dan Fermentasi Simultan
Secara umum sintesa bioetanol yang berasal dari biomassa terdiri atas dua tahap utama, yaitu hidrolisis dan fermentasi. Pada metode terdahulu proses hidrolisis dan fermentasi dilakukan secara terpisah dan yang terbaru adalah proses sakarifikasi dan fermentasi simultan.
Sakarifikasi dan fermentasi simultan (SFS) adalah kombinasi antara hidrolisis enzim dan fermentasi yang dilakukan dalam suatu reaktor. Proses ini memiliki keuntungan yaitu polisakarida yang terkonversi menjadi monosakarida tidak kembali menjadi polisakarida karena monosakarida langsung difermentasi menjadi etanol (Samsuri et al. 2007). Pada proses SFS, hidrolisis selulosa dan fermentasi gula tidak dilakukan secara terpisah atau bertahap, tetapi secara simultan. Mikrob yang digunakan pada proses SFS biasanya adalah jamur penghasil enzim selulase, seperti T. reesei, T.viride, dan khamir S. cerevisiae. Suhu optimal proses SFS adalah 38°C, yang merupakan perpaduan suhu optimal hidrolisis (45–50°C) dan suhu optimal fermentasi (30°C). Proses SFS memiliki keunggulan dibandingkan dengan proses hidrolisis dan fermentasi bertahap. Beberapa keunggulan tersebut adalah: 1) meningkatkan kecepatan hidrolisis dengan mengonversi gula yang terbentuk dari hasil hidrolisis selulosa yang menghambat aktivitas enzim selulase, 2) mengurangi kebutuhan enzim, 3) meningkatkan rendemen produk, 4) mengurangi kebutuhan kondisi steril karena glukosa langsung dikonversi menjadi etanol, 5) waktu proses lebih pendek, dan 6) volume reaktor lebih kecil karena hanya digunakan satu reaktor (Sun dan Cheng 2002).
2.6 Mikroba Penghasil Etanol
Fermentasi adalah suatu proses perubahan kimia pada substrat organik, baik karbohidrat, protein, lemak atau lainnya, melalui kegiatan katalis biokimia yang dikenal sebagai enzim dan dihasilkan oleh jenis mikroba yang spesifik (Prescot
dan Dunn 1981). Menurut Oura di dalam Dellweg (1983), secara sederhana proses fermentasi alkohol dari bahan baku yang mengandung gula (glukosa) terlihat pada reaksi berikut :
C6H12O6 2C2H5OH + 2 CO2
Dari reaksi di atas, 70% energi bebas yang dihasilkan dibebaskan sebagai panas. Secara teoritis 51,5% karbohidrat diubah menjadi etanol dan 48,9% menjadi CO2.
Khamir yang sering digunakan dalam proses fermentasi etanol adalah
Saccharomyces cereviceae, karena jenis ini dapat berproduksi tinggi, toleran
terhadap etanol yang cukup tinggi (12-18% v/v), tahan terhadap kadar gula tinggi dan tetap aktif melakukan fermentasi pada suhu 4-320 C (Harrison dan Graham 1970)
Saccharomyces cereviceae merupakan salah satu mikroorganisme penghasil
bioetanol melalui proses fermentasi. S. cereviceae termasuk ke dalam kelas
Ascomucetes yang dicirikan dengan pembentukan askus yang merupakan tempat
pembentukan askopora. S. cereviceae memperbanyak diri secara aseksual yaitu dengan bertunas (Pelezar dan Chan 1986). Saccharomyces cereviceae sering digunakan dalam fermentasi etanol karena sangat tahan dan toleran terhadap kadar etanol yang tinggi (12-18% v/v), tahan pada kadar gula yang cukup tinggi dan tetap aktif melakukan fermentasi pada suhu 4-320C. S. cereviceae mempunyai aktivitas optimum pada suhu 30-340C dan tidak aktif pada suhu lebih dari 400C. S.
cereviceae dapat memfermentasi glukosa, sukrosa, galaktosa serta rafinosa
(Kunkee dan Mardon 1970). Biakan S. cerviceae mempunyai kecepatan fermentasi optimum pada pH 4,48 (Harrison dan Graham 1970).
Rendemen alkohol dari heksosa dalam fermentasi menggunakan khamir dari genus Saccharomyces dapat mencapai 90% (Boyles 1984 diacu dalam Arnata 2009). Proses fermentasi oleh Saccharomyces adalah proses pengubahan sebagian besar energi dari gula ke dalam bentuk etanol. Efisiensi pengubahan energi tersebut dapat mencapai 97% (Campbel 1983). Mekanisme pembentukan etanol oleh khamir melalui jalur Embden-Meyerhorf-Parnas Pathway (EMP) atau glikolisis. Hasil dari EMP adalah memecah glukosa menjadi 2 molekul piruvat. Setelah melalui tahap glikolisis, piruvat yang terbentuk kemudian dirubah menjadi
11
asetaldehid dan CO2 oleh enzim piruvat decarboksilase, setelah itu oleh enzim
alkohol dehidrogenase dirubah menjadi etanol (Zaldivar et al. 2001)
2.7 Bioetanol
Etanol merupakan produk fermentasi yang dapat dibuat dari substrat yang
mengandung karbohidrat (gula, pati, atau selulosa). Etanol adalah salah satu senyawa alkohol dengan rumus kimia C2H5OH yang berupa cairan yang tidak
berwarna, jernih, mudah menguap, memiliki bau yang sangat halus dan rasa yang pedas (Hambali et al. 2007).
Bioetanol merupakan salah satu bahan bakar alternatif untuk mengurangi ketergantungan terhadap minyak. Karena masyarakat kita sudah sangat familiar dengan bahan cair yaitu BBM maka bioetanol diharapkan dapat mensubsitusi kebutuhan terhadap bensin. Bioetanol bersifat multi-guna karena dicampur dengan bensin pada komposisi berapapun memberikan dampak yang positif. Campuran anatara gasoline (bensin) dengan alkohol(bioetanol) disebut gasohol (Prescott dan Dunn 1981).
Proses pembentukan bioetanol dengan bahan baku tanaman yang mengandung selulosa, dilakukan melalui proses penguraian selulosa menjadi gula (glukosa) larut air. Proses pembuatan glukosa dibantu oleh hidrolisis asam dan enzim. Hidrolisis asam salah satunya dengan menggunakan asam sulfat, kurang dapat berkembang sehingga yang umum saat ini digunakan adalah penambahan air dan enzim. Kemudian dilakukan proses fermentasi gula menjadi bioetanol dengan penambahan ragi (yeast) (Nurdyastuti 2008). Pembuatan bioetanol dengan bahan baku selulosa terdiri dari beberapa proses yaitu proses hidrolisis enzim, proses fermentasi dan proses pemurnian bioetanol (Irawati 2006 dan Subekti 2006).
3.1 Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan April sampai bulan Juli 2011. Pengujian dilaksanakan di Laboratorium Mekanisasi Proses, Laboratorium Bioteknologi dan koleksi kultur, Laboratorium Kimia dan Laboratorium instrument Balai Besar Riset Pengolahan Produk dan Bioteknologi Kelautan dan Perikanan, Jakarta, laboratorium Kimia Hasil Hutan-THH IPB dan Laboratorium Saraswanti, Bogor.
3.2 Bahan dan Alat 3.2.1 Bahan
Bahan baku yang digunakan adalah limbah ekstraksi alginat dari rumput laut coklat (Sargassum sp), kapang Trichoderma viride dan khamir
Saccharomyces cereviceae.
Bahan-bahan kimia yang digunakan dalam pembuatan media adalah pepton, tween 80, (NH4)2SO4, Urea (H2NCONH2), KH2PO4.3H2O, CaCl2.2H2O,
MgSO4.7H2O dan mineral stok yang terdiri dari HCl 37%, FeSO4.7H2O, ZnCl2,
CoCl2.6H2O.
Bahan kimia yang digunakan dalam pembuatan reagen DNS (asam 3, 5-dinitrosalisilat) adalah DNS, NaOH, Na-K tartrat, phenol dan Na-Metabisulphite. Sedangkan bahan kimia lain yang digunakan dalam penelitian ini adalah media
Potato Dextro Agar (PDA), buffer sitrat 0,2 M, asam sitrat, trisodium sitrat, HCl,
NaOH, Na2CO3, glukosa monohidrat dan yeast ekstrak. 3.2.2 Alat
Alat yang digunakan untuk penelitian meliputi : erlemeyer 2 L, water bath, pH meter, bulb, mikropipet 100-1000 µL, tabung reaksi, labu ukur, batang pengaduk, autoklaf, inkubator, dan gelas ukur.
Alat-alat yang digunakan untuk analisa meliputi : cawan, oven, furnace, desikator, alumunium foil, erlemeyer, ruang laminar, timbangan digital, waterbath, gelas piala, vortex, penangas air, spektrometer UV/VIS Perkin Elmer, kompor listrik, kuvet, corong pisah, pH meter, dan GC (Gas Chromatography)
13
3.3 Tahapan Penelitian
Sakarifikasi dan fermentasi simultan (SFS) dengan kultur biakan T. viride dan S. cereviceae dari limbah ekstraksi alginat untuk pembuatan bioetanol terdiri dari dua tahap penelitian yaitu persiapan kultur mikroorganisme dan proses sakarifikasi dan fermentasi simultan. Dua tahap penelitian ini merupakan modifikasi dari Arnata (2009) dan Sari (2010). Tahapan penelitian antara lain meliputi : 1) persiapan kultur dan 2) proses sakarifikasi dan fermentasi simultan (SFS) selama 4 hari dengan dua kali pengulangan.
1) Persiapan kultur
Persiapan kultur pada penelitian ini meliputi persiapan kultur kapang
T.viride, dimana kultur kapang T. viride sebelum digunakan disegarkan dulu agar
dapat memproduksi enzim selulase dengan optimal. Media yang digunakan adalah PDA (Potato Dextrose Agar) yang dibuat miring. Tahapan persiapannya sebagai berikut : PDA ditambah akuades (39g/L), kemudian dipanaskan di atas hotplate dan diaduk sampai larutan berwarna kuning jernih, lalu dituangkan kedalam tabung reaksi sebanyak 7 ml tiap tabung reaksi dan ditutup rapat, kemudian dilakukan sterilisasi dengan autoklaf pada suhu 1210C dan tekanan 1,5 atm selama 15 menit. Tabung reaksi dimiringkan selama 1 hari. Keesokan harinya dilakukan inokulasi dengan cara menggores secara zig zag menggunakan jarum ose yang dimulai dari dasar tabung. Semua dilakukan dalam kondisi aseptis. Selanjutnya
T.Viride diinkubasi pada suhu 25-280C selama 7 hari. Skema persiapan kultur
T.viride dapat dilihat pada Gambar 2. Persiapan kultur S.cereviceae yang
dilakukan dengan cara membiakkan S. cereviceae pada media PDA yang telah ditambah yeast extract dan aquades, kemudian dipanaskan di atas hotplate lalu diaduk sampai larut. Proses persiapan kultur S. cereviceae selanjutnya sama seperti persiapan kultur T.viride. Skema persiapan kultur S. cereviceae dapat dilihat pada Gambar 3.
Gambar 2 Skema persiapan biakan Trichoderma viride.
Gambar 3 Skema persiapan biakan Saccharomyces cereviceae. Penambahan media PDA sebanyak 39 g dalam
1 L aquades
Pemanasan di atas hotplate dan pengadukan sampai larutan
berwarna kuning Penuangan ke dalam tabung reaksi
sebanyak 7 mL
Sterilisasi ke dalam autoklaf pada suhu 1210 C dan tekanan 1,5 atm
Inokulasi kultur Trichoderma
viride secara zig-zag
Inkubasi selama 7 hari (25-270C)
Pemanasan di atas hotplate dan pengadukan
Penuangan ke dalam tabung reaksi sebanyak 7 mL
Sterilisasi ke dalam autoklaf pada suhu 1210 C dan tekanan 1,5 atm
Penggoresan kultur Saccharomyces
cereviceae secara zig-zag
Penginkubasian selama 3 hari (25-270C) Penambahan media PDA sebanyak 39 g, yeast
15
2) Proses sakarifikasi dan fermentasi simultan
Proses sakarifikai dan fermentasi simultan dilakukan dengan cara memasukkan limbah ekstraksi alginat ke dalam erlemeyer 2 L dan dicampur dengan air sambil diaduk sampai berbentuk bubur (dikuantifikasi jumlah aquades yang diperlukan). Setelah itu dilakukan penambahan media andreoti, pepton dan tween 80 dan dilakukan pengecekan pH media setelah itu ditentukan pHnya menjadi 4; 4,5; dan 4,8 dengan penambahan HCL 3M atau NaOH 3M dan pH dijaga dengan larutan buffer Na-sitrat 0,2 M. Kemudian dilakukan proses sterilisasi pada suhu 1210C selama 15 menit. Setelah suhu medianya 25-300C, ditambahkan kultur T. viride dan kultur S. cereviceae diinkubasi dalam waterbath pada suhu 30, 34 dan 380 C. Pengambilan sampel dilakukan setiap 24 jam selama proses fermentasi dan sakarifikasi simultan berlangsung dengan melakukan pemisahan antara padatan dan cairan (filtrat) selama 4 hari. Skema proses sakarifikasi dan fermentasi simultan dapat dilihat pada Gambar 4.
Limbah rumput laut sebanyak 100 gr
Pencampuran sampai berbentuk bubur Air dengan volume 1 L
Penentuan pH 4; 4,5; 4,8 dengan penambahan HCL 3M atau NaOH 3M dan pH
dijaga dengan larutan Buffer Na-sitrat Pengadukan Pemasukkan dalam erlemeyer dengan kapasitas 2 L Pengadukan Penambahan media andreoti, pepton, tween
80 dan dicek pH
Pemanasan untuk sterilisasi pada suhu 1210C, 15 Menit
Pendinginan sampai suhu 25-300C
Gambar 4 Skema sakarifikasi dan fermentasi simultan.
3.4 Analisis Kimia
Analisis yang dilakukan pada penelitian ini dengan mengukur beberapa parameter meliputi kadar air, total gula pereduksi, pertumbuhan mikroorganisme, pH, dan konsentrasi crude etanol.
3.4.1 Kadar air ( Sari 2010)
Pengkuran kadar air pada penelitian ini merupakan modifikasi dari AOAC (1984) yang diacu dalam Sari (2010) yaitu sampel sebanyak 2 g dimasukkan dalam cawan yang telah diketahui bobotnya. Kemudian dikeringkan dalam oven bersuhu 100-1050C sampai bobot konstan. Setelah itu didinginkan dalam desikator dan ditimbang.
Bobot awal – Bobot akhir
Kadar Air = X 100% Bobot contoh
Sakarifikasi dan fermentasi simultan selama 4 hari, pada suhu 300C, 340C dan 380C dalam
waterbath
Analisa pertumbuhan jumlah mikroorganisme dengan mengukur
OD λ = 600 nm, Total Gula Pereduksi (TGP) setiap 24 jam dan
konsentrasi etanol. Penambahan 10% (v/v) dari
jumlah sel suspensi T. viride dan
S. cereviceae per 100 ml media
Pengukuran suhu, OD, dan pH setiap 24 jam
17
3.4.2 Penetapan total gula pereduksi metode DNS (Miller 1959 diacu dalam Subekti 2006)
Prinsip metode ini adalah dalam suasana alkali gula pereduksi akan mereduksi asam 3,5-dinitrosalisilat (DNS) membentuk senyawa yang dapat diukur absorbansinya pada panjang gelombang 550 nm.
Penyiapan pereaksi DNS
Pereaksi DNS dibuat dengan melarutkan 10,6 g asam 3, 5-dinitrosalisilat dan 19,8 g NaOH dalam 1416 mL air. Setelah itu ditambahkan 306 g Na-K Tartrat, 7,6 g fenol yang dicairkan pada suhu 500C dan 8,3 g Na-Metasulfit. Larutan ini diaduk rata, kemudian 3 mL larutannya dititrasi dengan HCL 0,1 N dengan indikator fenolftalein. Banyaknya titrasi berkisar antara 5-6 mL. Jika kurang dari itu harus ditambahkan 2 g NaOH untuk setiap ml kekurangan HCL 0,1 N.
Penentuan kurva standar
Kurva standar dibuat dengan mengukur nilai gula pereduksi pada glukosa dengan selang 0,2-0,5 mg/L. Kemudian nilai gula pereduksi dicari dengan metode DNS. Hasil yang didapatkan diplotkan pada grafik secara linear.
Penetapan total gula pereduksi
Pengujian gula pereduksi menggunakan kurva standar DNS dengan cara: 1 mL sampel dimasukkan ke dalam tabung reaksi, ditambahkan 3 mL pereaksi DNS. Larutan tersebut ditempatkan dalam air mendidih selama 5 menit. Dibiarkan sampai dingin pada suhu ruang. Kemudian diukur absorbansinya pada panjang gelombang 550 nm. DNS akan menjaga kestabilan hasil hidrolisis enzim dan mengikat gula pereduksi sebagai indikator terjadinya aktivitas enzim.
3.4.3 Pertumbuhan Trichoderma viride dan Saccharomyces cereviceae
Penentuan pertumbuhan sel fungi atau yeast dilakukan dengan analisis spektrofotometri dengan prinsip turbidimetri. Prinsip turbidimetri ini adalah analisis konsentrasi suatu zat berdasarkan kekeruhannya dibandingkan dengan sampel blanko yang dianggap nilai 0 absorban atau full scale transmitan atau tidak mengandung konsentrasi zat yang dianalisis (Sari 2010).
Pada penentuan konsentrasi sel fungi atau yeast, kekeruhan disebabkan oleh suspensi sel fungi atau yeast. Blanko yang digunakan adalah larutan medium yang persis sama dengan medium hidrolisis atau fermentasi yang belum digunakan sebagai medium pertumbuhan fungi atau yeast. Analisis dilakukan dengan mengambil data absorbansi dengan menggunakan spektrometer UV/VIS Perkin Elmer dengan α = 600 nm.
3.4.4 Derajat keasaman (pH)
Pengukuran pH dilakukan dengan menggunakan pH meter dimana data pH selama proses fermentasi di ukur setiap 24 jam.
3.4.5 Konsentrasi etanol (Subekti 2006)
Pengukuran konsentrasi etanol dilakukan dengan menggunakan Gas
Chromatography (GC). Konsentrasi etanol diperoleh dari perhitungan rasio Area
dimana Luas area etanol sampel dibagi dengan luas area n-propanol sampel. Kemudian hasil rasio area tersebut dibagi dengan slope hasil kurva kalibrasi etanol.
4 HASIL DAN PEMBAHASAN
Limbah hasil ekstraksi alginat yang digunakan pada penelitian ini dikeringkan sebelum digunakan sebagai bahan baku pembuatan bioetanol. Analisis yang dilakukan terhadap limbah ekstraksi alginat meliputi kadar air dan kadar selulosa.
4.1 Kadar air
Limbah ekstraksi alginat sebagai bahan baku yang digunakan dalam penelitian ini memiliki kadar air 10,42 ± 0,92%. Fardiaz (1989) menyatakan bahwa air dibutuhkan sebagai reaktan dalam berbagai reaksi biokimia. Penelitian Cuevas et al. (2010) melaporkan bahwa S. cereviceae dapat tumbuh dengan kadar air berkisar antara 8-10% dari bahan baku olive-pruning debris, sedangkan pada hasil penelitian Ahmed (2010) dilaporkan bahwa T. viride dapat tumbuh pada kadar air 5% pada bahan baku jerami gandum. Kadar air pada penelitian ini masih berada pada kisaran dimana mikroorganisme T. viride dan S. cereviceae tersebut dapat tumbuh. Kadar air limbah ekstraksi alginat berkisar antara 5-10%.
Hasil analisis limbah ekstraksi alginat memiliki kadar air yang tergolong aman untuk pertumbuhan mikroorganisme yang digunakan pada penelitian ini. Loebis (2008) menyatakan bahwa kandungan air juga berpengaruh pada substrat pertumbuhan kapang, aktivitas enzim, laju transfer massa oksigen dan karbondioksida. Kapang membutuhkan aktifitas air untuk germinasi spora dan pertumbuhannya relatif lebih rendah dibandingkan bakteri. Winarno (2010) menyatakan bahwa kadar air dari bahan juga sangat mempengaruhi laju reaksi enzimatik. Kadar air bebas yang rendah akan menyebabkan terjadinya halangan dan rintangan sehingga difusi enzim atau substrat terhambat. Akibatnya hidrolisis hanya terjadi pada bagian substrat yang langsung berhubungan dengan enzim. Kadar air dapat digunakan untuk mengetahui daya simpan dari bahan dan sangat berpengaruh terhadap mutu. Semakin tinggi kadar air suatu bahan maka daya simpannya semakin rendah dan mutu dari bahan tersebut menjadi rendah.
Penampakan fisik dari rumput laut coklat (Sargassum sp) yang belum diekstraksi dan limbah hasil ekstraksi alginat yang telah dikeringkan dapat dilihat pada Gambar 5.
a b
Gambar 5 a) Rumput laut coklat yang belum diekstrkasi dan b) limbah rumput laut hasil ekstraksi yang telah dikeringkan.
4.2 Kadar Selulosa
Selulosa adalah karbohidrat paling melimpah di alam, namun pemanfaatannya belum optimum. Selulosa terdiri atas monomer glukosa yang dihubungkan dengan ikatan β-1,4-glikosida, sehingga dapat menghidrolisis ikatan glikosida menjadi glukosa, yang kemudian dapat digunakan untuk berbagai tujuan, seperti produksi bioetanol (Kamara et al. 2006). Limbah hasil ekstraksi alginat pada penelitian ini yang digunakan sebagai media hidrolisis enzim mengandung crude selulosa sebesar 30,26 ± 0,02% dari limbah ekstraksi alginat. Kadar crude selulosa yang digunakan pada penelitian ini lebih tinggi dibandingkan hasil penelitian yang dilakukan oleh Sari (2010), yaitu pada rumput laut coklat jenis Sargassum sp yang telah dibuat menjadi tepung memiliki kadar selulosa sebesar 15,80 ± 0,79%. Subaryono (2009) menyatakan bahwa dinding sel rumput laut coklat tidak hanya terdiri dari selulosa namun juga terdapat komponen-komponen seperti alginat dengan jumlah yang cukup besar yaitu 33,93% dari Sargassum sp kering, sedangkan Roswiem (1991) menyatakan bahwa komposisi kimia Sargassum sp memiliki kadar air sebesar 11,71%, kadar abu sebesar 34,57%, kadar protein sebesar 5,53%, kadar lemak sebesar 0,74% dan kadar karbohidrat sebesar 19,06%.
21
4.3 Kultur Trichoderma viride
Inkubasi T. viride dilakukan selama 7 hari. Pertumbuhan T. viride
ditentukan dengan pengamatan secara penampakan fisik setiap 24 jam. Kultivasi
T. viride dilakukan selama 7 hari, karena mengacu pada hasil penelitian Arnata
(2009) yang menyatakan bahwa waktu tercapainya aktifitas maksimum T. viride untuk menghasilkan enzim selulase adalah 7 hari setelah diinkubasi dan memiliki aktivitas enzim selulase (CMCase) sebesar 5,05 ± 0,42 IU/mL. Enari (1983) menyatakan bahwa pengukuran aktivitas enzim selulase dimaksudkan untuk mengetahui kerja endo-glukanase dan glukanohidrolase. Kedua enzim ini merupakan bagian dari enzim selulase yang dapat menghidrolisis selulosa yang telah direnggangkan dengan asam posfat dan selulase yang telah disubsitusi seperti CMC (Carboksil Metil Celulase). Irawadi (1991) menyatakan bahwa CMC adalah turunan selulosa dapat larut yang digunakan sebagai substrat bagi enzim endoglukanase. Enzim yang dapat menghidrolisis CMC ini sering disebut CMCase.
Trichoderma viride merupakan salah satu mikroorganisme yang
digunakan untuk mendapatkan enzim selulase (Winarno 2010). Enzim selulase digunakan dalam proses hidrolisis dimana proses hidrolisis ini memiliki kelebihan pada tingkat efektivitas dan efisiensi proses, yaitu tanpa proses netralisasi dibandingkan dengan hidrolisis asam, sehingga pada tahap hidrolisis ini akan memanfaatkan aktivitas enzim selulase yang dihasilkan oleh kapang T. viride yang memiliki aktivitas tinggi sehingga dapat diperoleh randemen gula yang cukup baik (Kamara 2006). Adapun karakter fisik dari T. viride dapat dilihat pada Gambar 6.
Hari ke 1 Hari ke 2 Hari ke 3 Hari ke 4 Hari ke 5 Hari ke 6 Hari ke 7
Kondisi pertumbuhan T. viride dapat dilihat pada Gambar 6. Pada hari pertama spora mengalami germinasi membentuk miselium berwarna putih. Pembentukan miselium semakin cepat sampai hari ketiga dan mulai terjadi perubahan warna menjadi agak kehijauan. Hari keenam sampai hari ketujuh terjadi perubahan dari warna putih menjadi warna hijau yang semakin jelas.
T.viride adalah kapang yang berwarna hijau terang karena terbentuknya bola-bola
konidia yang melekat satu sama lain. Hal ini sesuai dengan Fardiaz (1989) yang menyatakan bahwa ciri-ciri spesifik kapang T. viride adalah mempunyai miselium septat, memiliki koniofora bercabang banyak, septat, dan ujung percabangannya merupakan sterigma, membentuk konidia bulat atau oval, berwarna hijau terang, dan berbentuk bola-bola berlendir.
4.4 Kultur Saccharomyces cereviceae
Kultur Saccharomyces cereviceae dilakukan selama 3 hari. Mikroorganisme
S. cereviceae yang akan memfermentasi dan mengubah sebagian besar energi dari
gula ke dalam bentuk etanol. Efisiensi pengubahan energi tersebut dapat mencapai 97% (Campbel 1983). Penampakan secara fisik S. cereviceae ada yang membentuk film atau lapisan pada permukaan medium, umumnya kering dan berlendir, berwarna putih atau krem serta tidak berbau. Penampakan fisik
S.cereviceae setelah dikultivasi selama 3 hari dapat dilihat pada Gambar 7.
23
4.5 Kinerja proses sakarifikasi dan fermentasi simultan
Pembuatan bioetanol dari limbah hasil ekstraksi alginat dilakukan dengan menggunakan metode sakarifikasi dan fermentasi simultan, yang menggunakan dua biakan mikroorganisme dengan suhu dan pH yang berbeda. Biakan yang digunakan adalah T. viride dan S. cereviceae. Kinerja proses dari sakarifikasi dan fermentasi simultan ini dapat dilihat dari beberapa parameter, yaitu pH, pengukuran OD mikroorganisme dengan panjang gelombang (λ) 600 nm, total gula pereduksi dan kadar etanol.
Proses sakarifikasi dan fermentasi simultan, hidrolisis selulosa dan fermentasi gula tidak dilakukan secara terpisah atau bertahap, tetapi secara simultan. Mikroorganisme yang digunakan pada proses sakarifikasi dan fermentasi simultan biasanya jamur penghasil enzim selulase, seperti T. reesei, T.
viride, dan khamir S. cerevisiae. Suhu optimal proses sakarifikasi dan fermentasi
simultan adalah 38°C, yang merupakan perpaduan suhu optimal hidrolisis (45– 50°C) dan suhu optimal fermentasi (30°C) (Sun dan Cheng 2002). Proses sakarifikasi dan fermentasi simultan juga tidak menggunakan peralatan yang mahal dan mengurangi kemungkinan kontaminasi oleh organisme yang tidak diinginkan (Wyman et al. 1992). Karakter proses sakarifikasi dan fermentasi simultan menurut Samsuri et al. (2007) adalah polisakarida yang terkonversi menjadi monosakarida tidak kembali menjadi polisakarida karena monosakarida langsung difermentasi menjadi etanol. Shen et al. (2007) dan Hari Khrisna et al. (2001) menyatakan bahwa sakarifikasi dan fermentasi simultan adalah sebuah metode yang dapat meningkatkan kinerja enzim karena pengurangan dari penghambat produk. Hal itu memerlukan lebih sedikit enzim yang dapat meningkatkan hasil dan produksinya.
4.5.1. Proses sakarifikasi dan fermentasi simultan pada suhu 30 0C
Perlakuan pertama pada penelitian ini menggunakan suhu 30 0C dengan pH 4; 4,5; dan 4,8. Kondisi ini memungkinkan kapang Trichoderma viride dan
Saccaromyces cereviceae untuk tumbuh dengan baik. Grafik nilai pH, OD, dan
Gambar 8 Absorbansi mikroorganisme selama proses SFS pada suhu 30 0C. ( )
Gambar 9 Grafik nilai pH selama proses SFS pada suhu 300 C. ( )
Gambar 10 Grafik total gula pereduksi selama SFS pada suhu 300 C. ( )
25
Pertumbuhan dapat didefenisikan sebagai pertambahan secara teratur semua komponen di dalam sel hidup (Fardiaz 1989). Mikroorganisme akan tumbuh dan mempunyai aktifitas fisiologis sebagai respon terhadap lingkungannya. Pola pertumbuhan dan penghasilan suatu produk menggambarkan kemampuan sel dalam merespon lingkungan (Wang et al. 2006). Pertumbuhan
T.viride dan S. cereviceae pada medium dengan pH 4; 4,5; dan pH 4,8 yang dapat
dilihat pada Gambar 8 mempunyai kecenderungan pola pertumbuhan yang sama pada setiap pH yaitu hari ke-0 sampai dengan hari pertama mengalami fase logaritmik yang ditandai dengan meningkatnya jumlah mikroorganisme pada hari pertama. Kenaikan jumlah mikroorganisme tersebut dipengaruhi juga oleh suhu pertumbuhan mikroorganisme, dimana suhu optimum Trichoderma viride untuk tumbuh 28-300C (Waluyo 2004) dan suhu optimum Saccharomyces cereviceae 30-340C (Kunkee dan Mardon 1970).
Lamanya fase logaritmik bervariasi tergantung dari jumlah dan pengaruh medium yang digunakan, lingkungan pertumbuhan dan jumlah inokulum dimana jumlah awal sel yang tinggi akan mempercepat fase logaritmik. Hari pertama sampai hari keempat pertumbuhan kedua mikroorganisme tersebut mengalami penurunan. Hal ini diduga terjadi karena zat nutrisi di dalam medium sudah sangat berkurang karena dipakai oleh kedua mikroorganisme tersebut untuk pertumbuhannya. Hal ini sesuai dengan pernyataan Fardiaz (1989) bahwa penurunan jumlah mikroorganisme disebabkan oleh zat nutrisi di dalam medium sudah sangat berkurang dan juga disebabkan oleh adanya hasil-hasil metabolisme yang mungkin beracun atau dapat menghambat pertumbuhan jasad renik. Peningkatan dan penurunan jumlah mikroorganisme akan mempengaruhi pH media. Nilai pH media selama proses sakarifikasi dan fermentasi simultan selama 4 hari pada suhu 300 C dengan pH media awal 4; 4,5; dan 4,8 yang dapat dilihat pada Gambar 9 berturut-turut berkisar antara 4,00-6,90, 4,5-7,06 dan 4,8-7,17. Kenaikan pH pada perlakuan ini diduga disebabkan oleh munculnya senyawa-senyawa amoniakal akibat metabolit sekunder dari mikroorganisme tersebut dan juga diakibatkan oleh penggunaan karbon oleh mikroorganisme sehingga menaikkan pH media.
Gula pereduksi adalah gula yang mempunyai kemampuan untuk mereduksi. Gula pereduksi dihitung dengan menggunakan metode DNS. Gula pereduksi akan menghasilkan warna kuning sampai kemerah-merahan sesuai dengan kandungan gula sederhana yang terdapat di dalam cairan media SFS. Hal ini dikarenakan adanya gugus keton dan aldehid (-CHO). Contoh gula pereduksi adalah glukosa, manosa, fruktosa, laktosa, maltose dan lain-lain (Subekti 2006). Pengukuran total gula pereduksi pada penelitian ini dimulai dari hari pertama karena pada hari ke 0 diasumsikan belum terjadi hidrolisis enzim untuk menghasilkan gula pereduksi. Total gula pereduksi yang dihasilkan dari proses sakarifikasi dan fermentasi simultan pada suhu 300C dapat dilihat pada Gambar 10 yang berada pada kisaran 5,48 – 9.18% (b/b), dimana dari hari pertama sampai hari keempat cenderung meningkat. Peningkatan total gula pereduksi menurut Sari (2010) disebabkan adanya enzim selulase yang menghidrolisis selulosa menjadi gula pereduksi. Peningkatan total gula pereduksi juga diduga disebabkan oleh ketidakmampuan S. cereviceae untuk menggunakan total gula pereduksi untuk menghasilkan bioetanol, sehingga total gula pereduksi tetap tinggi. Tamada
et al. (1987) menyatakan bahwa ada hubungan antara aktivitas selulase dan
produksi glukosa karena selulase digunakan untuk pemecahan selulosa menjadi glukosa.
Etanol yang terbentuk selama proses sakarifikasi dan fermentasi simultan merupakan produk hasil metabolit sekunder dari pertumbuhan mikroorganisme. Pada proses sakarifikasi dan fermentasi simultan pada suhu 300 C tidak menghasilkan kadar etanol (0% etanol) yaitu pada pH awal 4; 4,5 dan 4,8. Etanol tidak terbentuk diduga karena kondisi sampel yang memiliki pH mencapai 7 yang dapat mengakibatkan mikroorganisme tersebut tidak menghasilkan aktivitas enzim yang maksimal. Fardiaz (1989) menyatakan bahwa bahwa kebanyakan khamir lebih menyukai tumbuh pada keadaan asam, yaitu pH 4-4,5 dan tidak dapat tumbuh dengan baik pada medium alkali, kecuali jika telah beradaptasi.
Etanol belum dihasilkan pada perlakuan suhu 300C diduga disebabkan oleh kurangnya waktu proses SFS. Kondisi ini didukung oleh hasil pengukuran total gula pereduksi (TGP) yang mana TGP terbentuk setiap harinya meningkat atau dapat dikatakan hanya terjadi proses hidrolisis enzim dan tidak terjadi proses
27
fermentasi. Hasil pengukuran OD mikroorganisme menunjukkan bahwa mikroorganisme tersebut belum memasuki fase stasioner dan masih mengalami fluktuasi sehingga etanol belum terbentuk.
4.5.2 Proses sakarifikasi dan fermentasi simultan pada suhu 34 0C
Perlakuan kedua menggunakan suhu 34 0C dengan pH 4; 4,5; dan 4,8. Grafik nilai pH, OD, TGP dan kadar etanol yang terbentuk pada suhu 34 0C yang dapat dilihat pada Gambar 11, 12, dan 13.
Gambar 11 Absorbansi mikroorganisme selama proses SFS pada suhu 34 0C. ( )
Gambar 12 Grafik nilai pH selama proses SFS pada suhu 340 C. ( )
Gambar 13 Grafik total gula pereduksi selama SFS pada suhu 340C. ( )
Pertumbuhan mikroorganisme pada media dengan pH 4, 4,5, dan 4,8 pada Gambar 11 memiliki kecenderungan yang sama yaitu mengalami peningkatan pada hari pertama kemudian mengalami penurunan pada hari kedua sampai hari keempat. Peningkatan jumlah mikroorganisme pada hari ke 0 sampai hari pertama dipengaruhi oleh banyak faktor diantaranya adalah faktor biologis, misalnya: bentuk dan sifat mikroorganisme terhadap lingkungan yang ada, asosiasi kehidupan organisme yang bersangkutan dan kandungan non biologis, misalnya kandungan hara didalam media kultur, suhu, kadar oksingen, cahaya, bahan kimia dan lain-lain. Jika faktor-faktor diatas optimal, maka peningkatan kurva akan tampak meningkat (Pelczar dan Chan 1986). Hal ini didukung oleh Fardiaz (1989) yang menyatakan bahwa nutrien di dalam medium sudah habis, energi cadangan di dalam sel habis dan habisnya nutrien didalam medium diakibatkan oleh pemakaian ke dua jenis mikroorganisme untuk pertumbuhannya dan mempengaruhi pH media.
Nilai pH media pada suhu 340 C yang dapat dilihat pada Gambar 12 dengan pH media awal 4; 4,5; dan 4,8 berturut-turut diperoleh nilai perubahan pH berkisar 4,0 - 6,42; 4,5 – 6,51 dan 4,8 – 5,59. Kenaikan pH pada suhu 34 0C menurut Yulianto (2001) juga disebabkan oleh yeast extract yang digunakan dapat mengalami deaminasi hingga mengakibatkan pH media meningkat dan perubahan naik turunnya pH kultur dipengaruhi oleh besar kecilnya perbandingan antara senyawa organik yang bersifat asam dengan ammonia yang bersifat basa dan juga
29
diduga disebabkan oleh penggunaan karbon yang digunakan untuk pertumbuhan sehingga menghasilkan senyawa amoniakal melalui proses metabolit sekunder. Jumlah mikroorganisme mengalami penurunan dari hari pertama sampai dengan hari selanjutnya. Hal ini diduga glukosa mempengaruhi pertumbuhan mikroorganisme. Petrik et al. (1982) konsentrasi glukosa yang terlalu tinggi dapat menyebabkan depresi pada sistem metabolisme mitokondria dan sintesis sel atau sering disebut dengan glucose effect.
Total gula pereduksi yang dihasilkan dari proses sakarifikasi dan fermentasi simultan pada suhu 340C dapat dilihat pada Gambar 13 berkisar antara 3,49-12,95% (b/b). Total gula pereduksi pada awal proses mengalami kenaikan. Hasil penelitian Resita (2006) menunjukkan bahwa peningkatan total gula pereduksi tersebut disebabkan oleh mikroorganisme T. viride yang menghidrolisis selulosa menjadi gula pereduksi menggunakan enzim selulase yang dihasilkannya sehingga pada hari pertama sampai hari kedua total gula pereduksi naik. Peningkatan gula pereduksi yang dihasilkan menunjukkan bahwa cukup nutrisi bagi T. viride untuk menghasilkan enzim selulase dan juga dapat dilihat OD mikroorganisme meningkat yang berarti mikroorganisme tersebut dapat tumbuh dengan baik.
Hari ketiga total gula pereduksi mengalami penurunan, hal ini disebabkan gula pereduksi digunakan mikroorganisme untuk pertumbuhan sel dan pembentukan produk. Hal ini menurut Putri dan Sukandar (2008) disebabkan oleh gula pereduksi yang terdapat dalam media digunakan sebagai sumber karbon bagi sel khamir untuk mensintesis energi melalui fermentasi etanol. Adanya enzim selulase yang dihasilkan mampu melonggarkan dan menghidrolisis ikatan-ikatan selulosa, sehingga Saccharomyces cereviceae lebih mudah memanfaatkan glukosa hasil hidrolisis untuk menghasilkan etanol.
Pada proses sakarifikasi dan fermentasi simultan pada suhu 34 0C tidak menghasilkan etanol yaitu dengan pH awal 4; 4,5; dan 4,8. Horn (2000) menyatakan bahwa hal tersebut diduga oleh masih adanya komponen-komponen lain yang dapat menghambat pembentukan etanol seperti alginat, fukoidan, protein dan polyphenol. Adanya polyphenols yang mudah larut sehingga mengganggu
proses degradasi protein serta bentuk phenol yang kompleks dengan protein tidak dapat diakses untuk didegradasi oleh mikroorganisme.
Etanol tidak terbentuk pada penelitian ini juga diduga karena kondisi sampel yang memiliki pH mencapai 7 yang dapat mengakibatkan mikroorganisme tersebut tidak menghasilkan aktivitas enzim yang maksimal karena menurut Harrison dan Graham 1970 menyatakan bahwa biakan S. cereviceae mempunyai kecepatan fermentasi optimum pada pH 4,48. Fardiaz (1989) juga menyatakan bahwa kebanyakan khamir lebih menyukai tumbuh pada keadaan asam, yaitu pH 4 – 4,5 dan tidak dapat tumbuh dengan baik pada medium alkali, kecuali jika telah beradaptasi.
Faktor lain yang menyebabkan tidak terbentuknya etanol antara lain karena penggunaan nutrien oleh Trichoderma viride untuk mengubah selulosa menjadi glukosa yang mengakibatkan kepada pertumbuhan Saccharomyces
cereviceae menjadi terganggu dan tidak dapat memprodukasi etanol. Etanol tidak
terbentuk pada perlakuan ini juga diduga diakibatkan kurangnya waktu proses SFS untuk mengubah glukosa menjadi etanol. Hal tersebut dapat dilihat bahwa total gula pereduksi masih meningkat walaupun pada hari ketiga mengalami penurunan dan juga OD mikroorganisme belum memasuki fase stasioner dan masih mengalami fluktuasi sehingga etanol belum terbentuk. Shofiyanto (2008) menyatakan bahwa disamping kondisi lingkungan seperti suhu dan pH, kebutuhan nutrient dan kofaktor juga memegang peranan penting bagi kehidupan khamir. Kebutuhan relatif nutrien sebanding dengan komponen utama sel khamir, yaitu mencakup karbon, oksigen, nitrogen dan hidrogen. Pada jumlah lebih rendah, fosfor, sulfur, potasium, dan magnesium juga harus tersedia untuk sintesis komponen-komponen minor. Beberapa mineral (Mn, Co, Cu dan Zn) dan faktor pertumbuhan organik (asam amino, asam nukleat, dan vitamin) diperlukan dalam jumlah kecil. Substrat yang digunakan untuk memproduksi etanol dalam jumlah besar biasanya mengandung nutrien yang diperlukan untuk pertumbuhan khamir.
4.5.3 Proses sakarifikasi dan fermentasi simultan pada suhu 380 C
Perlakuan ketiga menggunakan suhu 38 0C dengan pH 4; 4,5; dan 4,8. Grafik nilai pH, OD, TGP dan kadar etanol yang terbentuk pada suhu 38 0C yang
31
dapat dilihat pada Gambar 14, 15, dan 16. Hasil pengamatan pertumbuhan
Trichoderma viride dan Saccharomyces cerevieae pada suhu 380 C dapat dilihat pada Gambar 14.
Gambar 14 Absorbansi mikroorganisme selama proses SFS pada suhu 38 0C. ( )
Gambar 15 Grafik nilai pH selama proses SFS pada suhu 380 C.
Gambar 16 Grafik total gula pereduksi selama SFS pada suhu 380 C. ( )
Pertumbuhan kedua mikroorganime pada suhu 380 C memiliki kecenderungan meningkat pada hari pertama sampai hari ke empat untuk pH 4, 4,5 dan 4,8. Mikroorganisme T. viride dan S. sereviceae pada suhu 380 C mengalami fase lag, yaitu masa penyesuaian mikroorganisme sejak inokulum diinokulasi kedalam media fermentasi, kemudian mengalami peningkatan jumlah sel setiap hari. Jumlah sel mikroorganisme pada setiap perlakuan pH mengalami peningkat pada hari ke 0 sampai hari keempat. Lambatnya pertumbuhan jumlah sel dari ke dua jenis mikroorganisme pada suhu 38 0C tersebut menurut Taherzadeh et al. (1999) disebabkan oleh adanya senyawa furfural dapat menyebabkan lambatnya laju pertumbuhan spesifik dari mikroorganisme dan laju produksi etanol baik pada kondisi anaerob maupun aerob pada sistem kultivasi dan fermentasi.
Pola pertumbuhan mikroorganisme pada suhu 380C tidak sama dengan pola pertumbuhan mikroorganisme pada suhu 30 dan 340C. Perbedaan pola
pertumbuhan tersebut disebabkan oleh suhu optimum pertumbuhan
mikroorganisme yang digunakan, dimana Trichoderma viride memiliki suhu optimum untuk pertumbuhan hidupnya pada suhu 28-300C (Waluyo 2004), sedangkan suhu optimum pertumbuhan Saccharomyces cereviceae adalah pada suhu 30 -340C (Kunkee dan Mardon 1970) sehingga pada suhu 30 dan 340C pola pertumbuhannya meningkat di hari pertama dan menurun pada hari selanjutnya. Pertumbuhan pada suhu 380C sangat lambat, hal ini disebabkan karena kedua