BAB II
METODE PERBANYAKAN Vanilla planifolia Andrews
A. Vanilla planifolia Andrews
Panili merupakan sejenis tumbuhan famili Orchidaceae yang berasal dari Mexico dan kini banyak ditanam di kawasan tropika (Gambar 2.1). Tanaman panili muncul di Indonesia pada 1819 dibawa masuk oleh Merchal dan kemudian meluas ke sebagian Indonesia dan mulai ditanam di Pulau Jawa kemudian ke Bali, Aceh dan Sumatera Barat. Panili dari Pulau Jawa istimewa karena terkenal dengan kualitasnya yang mengandung kadar vanilin tinggi dan dikenal sebagai Java Vanilla Bean (Ackerman, 2003).
Gambar 2.1 Daerah Penyebaran Tanaman Panili. (Sumber : www.vanillareview.com)
Klasifikasi tanaman panili menurut Correll, (1953) adalah : Kingdom : Plantae
Divisi : Liliopsida Ordo : Aspargales Family : Orchidacheae Sub Family : Vanilloideae Genus : Vanilla
Spesies : Vanilla planifolia Andrews
Tanaman ini memiliki batang monopodial dan habitusnya berupa semak yang merambat pada pohon berkayu yang ada disekitarnya (Gambar 2.2).
Batang panili berbentuk silindris, lunak, beruas-ruas, tumbuh akar berupa akar adventitif yang berwarna putih dan muncul pada ruasnya, diameter batang ± 1,5 cm, berwarna hijau berbintik putih (Gambar 2.3) (Ackerman, 2003).
. Gambar 2.3 Morfologi Batang Panili yang Beruas-Ruas dengan Akar yang
Tumbuh pada Tiap Ruasnya. (Sumber: www.uni-graz.at)
Anatomi batang menunjukkan, berkas pembuluh terletak menyebar di daerah meristem. Tidak mempunyai kambium vaskular sehingga tidak mempunyai jaringan sekunder. Pembuluh di jaringan ini disebut tipe berkas kolateral tertutup. Batasan antara empulur dan korteks tidak bisa dibedakan. Jaringan penguat terdiri dari serabut-serabut dengan dinding lignin yang tebal. Berkas Pengangkut terdiri atas xilem dan floem. Xilem terdiri atas serabut-serabut, trakeid dan parenkima. Xilem selalu terletak dalam berkas menghadap ke tengah batang. Floem terdiri atas sel tapisan dan sel pengiringnya kecil (biasanya persegi atau segi empat pada penampang
melintang) Sel floem terletak dengan pola yang teratur di luar xilem. Berkasnya biasanya dikelilingi oleh serabut lignin dan membentuk sarung pembuluh (Gembong, 2005).
Anatomi akar menunjukkan, pada jaringan akar terdapat epidermis, korteks (bagian terdalam korteks disebut endodermis, pada endodermis terdapat pita kaspari), perisikel, dan berkas pembuluh. Stele akar pada monokotil, floem terpisah berselang-seling dan terletak di luar xilem tapi tidak sampai ke tengah akar sehingga dijumpai adanya empulur. Empulur akar ini merupakan derivat prokambium (Gembong, 2005). Daun panili termasuk daun tunggal, bentuknya lonjong, berseling, pangkal membulat dan ujungnya meruncing, panjang 15-19 cm dengan lebar 5-8 cm, pelepah pendek, tepi daun rata, pertulangan sejajar, dan warnanya hijau (Gambar 2.4). Anatomi daun terdiri atas: epidermis (pada epidermis terdapat stomata yang dilindungi sel penutup), mesofil (terdiri dari parenkim palisade dan parenkim spon) (Ackerman, 2003).
Gambar 2.4 Morfologi Daun Panili (Sumber: www.uni-graz.at)
Bunga panili merupakan bunga majemuk, letaknya di ketiak daun, memiliki tangkai berbentuk silindris, panjangnya kurang lebih 0,5 cm, bermahkota, bunganya berwarna putih (Gambar 2.5). Kandungan vanilin berada dalam buah yang merupakan hasil dari penyerbukan bunga panili. Satu bunga hanya akan membentuk satu buah (Ackerman, 2003).
Gambar 2.5 Morfologi Bunga Panili (Sumber: www.uni-graz.at)
Bunga panili berumah satu dimana alat kelamin jantan (benang sari) dan alat kelamin betina (putik) berada dalam satu bunga. Terdapat selaput yang memisahkan kedua organ tersebut sehingga penyerbukan bunga secara alami sangat sulit dilakukan (Ackerman, 2003)..
Penyerbukan bunga secara alami hanya dapat dilakukan dengan bantuan lebah Melipone yang hanya hidup di Mexico. Untuk itu satu-satunya cara penyerbukan bunga panili yang bisa dilakukan di negara lain yaitu hanya melalui penyerbukan buatan dengan bantuan tangan manusia (Ackerman, 2003).
Buah panili termasuk buah polong dan bentuknya lonjong (Gambar 2.6), ketika masih muda buahnya berwarna hijau dan setelah tua akan berubah warna menjadi kuning kemerah-merahan. Buah panili yang sudah matang pada pohonnya lama-kelamaan akan membuka dan pada akhirnya mengering. Di dalamnya terkandung senyawa fenol yang menyebabkan timbulnya aroma khas pada buah panili (Ackerman, 2003).
Gambar 2.6 Morfologi Buah Panili (Sumber: www.uni-graz.at)
Dalam buah panili terkandung serbuk biji panili. Disebut serbuk karena ukurannya yang sangat kecil, bijinya berbentuk bulat, agak pipih dan berwarna hitam (Gambar 2.7). Seperti halnya biji pada kelompok anggrek-anggrekan yang lain, biji panili tidak dapat berkecambah tanpa bantuan fungi (Ackerman, 2003).
Gambar 2.7 Morfologi Biji Panili. (A) Biji Dalam Buah Panili Kering. (B) Kumpulan Biji yang Sudah Dipisahkan. (C) Struktur Biji Panili di Bawah Mikroskop. (Sumber
www.javaorganicvanillabean.blogspot.com)
Pada sayatan melintang buah panili (Gambar 2.8), terlihat epidermisnya mengandung kloroplas. Pada sel epidermis ini terkandung kristal kalsium oksalat yang merupakan penyusun dinding buah. Buah panili dipanen pada usia sekitar 8-10 bulan dimana buah masih berwarna hijau dan kandungan vanilinnya relatif sedikit. Untuk meningkatkan kadar vanilin, diperlukan proses pengeringan sekitar kurang lebih 3-6 bulan (Frenkel, 2004).
Gambar 2.8 Sayatan Melintang (x 20) Buah Panili Segar. (Sumber : Frenkel, 2004)
Pada sayatan melintang buah panili (Gambar 2.9) plasenta menyerupai rambut yang mengandung enzim untuk memproduksi vanilin. Sel ini juga menghasilkan lemak berbentuk globular (Gambar 2.9.a). Terdapat pula sel parenkim (Gambar 2.9.b) yang nantinya akan membentuk penyusun dinding buah berwarna putih sementara jaringan buah yang lainnya akan menghasilkan enzim-enzim lain untuk produksi vanillin (Frenkel, 2004).
Gambar 2.9 Sayatan Melintang (x 400) Buah Panili. (a) Plasenta, (b) Parenkim (Sumber : Frenkel, 2004)
Vanilla planifolia Andrews merupakan tumbuhan CAM (Crassulacean Acid Metabolism). Tumbuhan ini membuka stomata pada malam hari dan menutupnya pada siang hari. Tujuan menutup stomata pada siang hari adalah mencegah karbondioksida masuk ke dalam daun. Selama malam hari, tumbuhan mengambil karbondioksida dan memasukkannya ke dalam berbagai asam organik. Sel mesofil tumbuhan CAM menyimpan asam organik yang dibuatnya selama malam hari di dalam vakuola hingga pagi, ketika stomata tertutup. Pada siang hari, ketika reaksi terang dapat memasok ATP dan NADPH untuk siklus Calvin, karbondioksida
dilepaskan dari asam organik yang dibuat pada malam hari sebelum dimasukkan dalam kloroplas (Gembong, 2005).
B. Perbanyakan Panili
Perbanyakan tanaman panili umumnya dilakukan secara vegetatif melalui stek batang ataupun melalui kultur jaringan. Penggunaan metode perbanyakan panili secara vegetatif menjadi salah satu metode perbanyakan tanaman panili yang paling umum dilakukan karena tanaman ini memerlukan waktu 3 hingga 4 tahun untuk menghasilkan bunga, dan bunganya pun hanya muncul sekali dalam setahun (Frenkel, 2004).
Sejauh ini perbanyakan tanaman panili melalui metode kultur jaringan sudah banyak diupayakan dimana pada awalnya kultur panili menggunakan tunas aksilar sebagai eksplan (George, 1997). Seiring dengan berkembangnya metode kultur jaringan, saat ini perbanyakan tanaman panili secara in vitro sudah memanfaatkan eksplan lain berupa kultur kalus, protocorm, akar, dan organ lainnya (Ravishankar, 2004).
Sementara itu perbanyakan tanaman panili secara generatif sangat sulit untuk dilakukan tanpa bantuan serangga dan manusia. Sulitnya perbanyakan tanaman secara generatif dikarenakan struktur bunga panili yang tidak memungkinkan tanaman ini untuk melakukan penyerbukan sendiri. Sementara penyerbukan dengan bantuan serangga tidak mungkin dilakukan di luar negara asal hewan penyerbuknya yaitu di Mexico karena lebah penyerbuknya hanya hidup di sana. Berdasarkan hal tersebut
maka di negara-negara lain metode penyerbukan bunga panili dilakukan dengan cara polinasi buatan yaitu dengan bantuan tangan manusia (Gambar 2.10) (Elizabeth, 2002).
Gambar 2.10 Penyerbukan bunga panili dengan bantuan tangan manusia. (Sumber : www.vanillareview.com)
Panili banyak dimanfaatkan dalam bidang industri dan merupakan komoditas ekspor penghasil devisa negara, 95 % diusahakan oleh perkebunan rakyat dan berpotensi besar untuk dikembangkan. Panili banyak digunakan sebagai pengharum dalam industri makanan, minuman dan confectionary products yang digunakan dalam bentuk utuh, bubuk, atau ekstrak. Untuk keperluan farmasi digunakan dalam bentuk tincture, sedang untuk parfum dalam bentuk tincture dan absolut (Nurjanah dan Rusli, 1998). Panili yang dikenal dengan julukan ”mas hijau” memang benar, karena harga polong kering dipasaran dalam negeri sangat tinggi yaitu Rp. 1,5 – 2,5 juta/kg. Volume ekspor panili tahun 2000 sebesar 350 ton dengan nilai US$ 8.503 juta (Ditjenbun, 2002).
C. Kultur Jaringan
Menurut Suryowinoto (1991 dalam Hendaryono & Wijayani, 1994), kultur jaringan dalam bahasa asing disebut sebagai tissue culture, weefsel cultuus atau gewebe kultur. Kultur adalah budidaya dan jaringan adalah sekelompok sel yang mempunyai bentuk dan fungsi yang sama. Kultur jaringan berarti membudidayakan suatu jaringan tanaman menjadi tanaman kecil yang mempunyai sifat seperti induknya.
Metode kultur jaringan dikembangkan untuk membantu memperbanyak tanaman, khususnya untuk tanaman yang sulit dikembangbiakkan secara generatif yang akan dieksploitasi secara besar-besaran (seperti vanilla, lada, jahe, pisang, jati, kapolaga, abaka), berbagai tanaman obat dan tanaman hortikultura, pada tanaman tahunan penyerbuk silang, (seperti jambu mente, cengkeh, melinjo, asam dan kapuk), pada berbagai tanaman tahunan seperti tanaman kehutanan (jati, cendana) dan tanaman buah-buahan (Hendaryono & Wijayani, 1994).
Teknik ini dilakukan dengan cara mengisolasi bagian tanaman seperti biji, daun, akar atau mata tunas, yang kemudian ditumbuhkan ke dalam media buatan secara aseptik yang kaya nutrisi dan zat pengatur tumbuh dalam wadah tertutup yang tembus cahaya sehingga bagian tanaman dapat memperbanyak diri dan bergenerasi menjadi tanaman lengkap. Prinsip utama dari teknik kultur jaringan adalah perbayakan tanaman dengan menggunakan bagian tanaman menggunakan media buatan yang dilakukan di tempat steril. Keunggulan dari teknik kultur jaringan, antara lain bibit yang dihasilkan mempunyai sifat yang identik dengan induknya, dapat
diperbanyak dalam jumlah yang besar sehingga tidak terlalu membutuhkan tempat yang luas, mampu menghasilkan bibit dengan jumlah besar dalam waktu yang singkat, kesehatan dan mutu bibit lebih terjamin, dan kecepatan tumbuh bibit lebih cepat dibandingkan dengan perbanyakan konvensional (Hendaryono & Wijayani, 2000).
D. BIJI
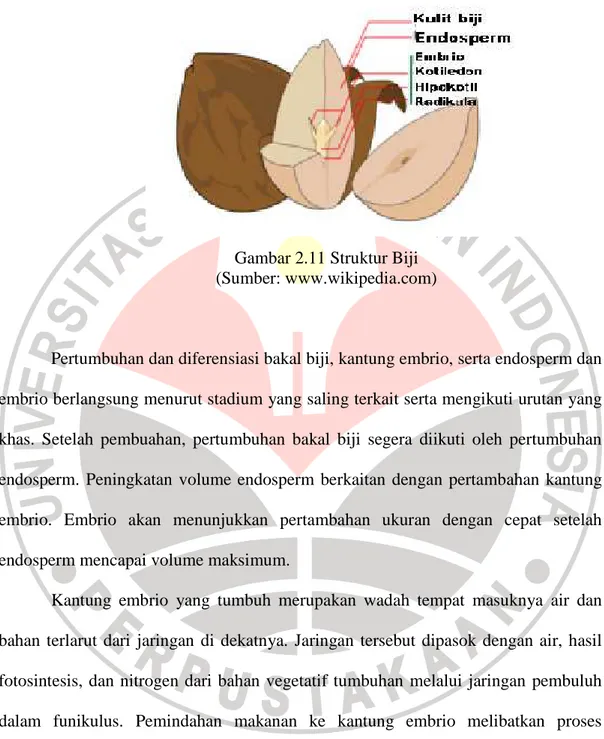
Biji merupakan sumber makanan yang penting bagi hewan dan manusia. Biji dibentuk dengan adanya perkembangan bakal biji. Struktur biji terbagi menjadi tiga, yang pertama berupa plumula yang terdiri atas dua daun embriogenik, yang akan menjadi daun-daun sejati yang pertama tumbuhan bibit dan tunas terminal (apikal). Tunas ini ialah meristem dan padanyalah akan terjadi pertumbuhan batang yang selanjutnya. Kedua hipokotil atau radikula, yang masing-masing akan tumbuh menjadi batang dan akar primer. Selanjutnya struktur kotiledon yang menyimpan makanan untuk digunakan biji yang berkecambah (Kimball, 1983).
Biji masak terdiri dari tiga bagian yaitu embrio, endosperm, serta kulit biji (Gambar 2.11). Embrio adalah sporofit muda yang tidak segera melanjutkan pertumbuhannya melainkan memasuki masa istirahat (dorman). Saat itu biji biasanya tahan stress seperti kekurangan air, panas atau dingin yang berlebihan, penekanan, dan serangan kimiawi. Embrio senantiasa diiringi oleh cadangan makanan baik organik maupun anorganik yang berada di sekeliling embrio atau di dalam jaringannya sendiri (Kimball, 1983)
Gambar 2.11 Struktur Biji (Sumber: www.wikipedia.com)
Pertumbuhan dan diferensiasi bakal biji, kantung embrio, serta endosperm dan embrio berlangsung menurut stadium yang saling terkait serta mengikuti urutan yang khas. Setelah pembuahan, pertumbuhan bakal biji segera diikuti oleh pertumbuhan endosperm. Peningkatan volume endosperm berkaitan dengan pertambahan kantung embrio. Embrio akan menunjukkan pertambahan ukuran dengan cepat setelah endosperm mencapai volume maksimum.
Kantung embrio yang tumbuh merupakan wadah tempat masuknya air dan bahan terlarut dari jaringan di dekatnya. Jaringan tersebut dipasok dengan air, hasil fotosintesis, dan nitrogen dari bahan vegetatif tumbuhan melalui jaringan pembuluh dalam funikulus. Pemindahan makanan ke kantung embrio melibatkan proses pencernaan sebagian besar jaringan bakal biji. Jadi, embriogenesis juga merupakan persiapan bagi masa perkecambahan yang sukses. Pada saat embriogenesis, jaringan hara di luar embrio dan di dalam embrio sendiri akan mensintesis dan menyimpan
sejumlah besar bahan makanan. Pada waktu perkecambahan, sel yang sama akan membalikkan proses metabolisme dan akan menghidrolisis zat hara yang tersimpan. Dalam pembalikan metabolisme yang mendasar itu diduga terlibat aktivasi dan deaktivasi gen (Hidayat, 1995).
E. Organogenesis dan Embriogenesis
Organogenesis secara in vitro telah dicapai pada lebih dari 1000 jenis tanaman melalui seleksi empiris pada eksplan, komposisi medium, kontrol lingkungan fisik. Pada semua percobaan, proses organogenik dimulai dengan perubahan sel parenkim tunggal atau sekelompok kecil sel, dimana selanjutnya membelah menghasilkan suatu masa sel globuler atau meristemoid, besifat kenyal dan berkembang menjadi primordium pucuk atau akar. Kejadian ini dapat terjadi langsung pada eksplan atau tidak langsung melalui pembentukan kalus. Perubahan struktur ini menggambarkan adanya aktifitas gen selektif dari sel-sel tersebut (George & Sherrington, 1984).
Organogenesis langsung untuk perbanyakan tunas dapat diinisiasi langsung dari tunas adventif. Pembentukan tunas secara langsung ini tergantung pada bagian tanaman yang digunakan sebagai eksplan dan jenis tanaman yang dikulturkan. Pada beberapa jenis tanaman tunas adventif dapat terbentuk dari berbagai organ tanaman seperti daun, batang, akar atau petal, sementara jenis tanaman lainnya hanya dari organ tertentu seperti potongan umbi, embrio atau kecambah. Perbanyakan tanaman melalui pembentukan tunas langsung dapat dilakukan dengan tahap inisiasi yang dilanjutkan dengan multiplikasi tunas. Ke dua tahap ini dapat terjadi pada medium
yang sama tanpa melalui pemindahan ke medium baru. Tahap multiplikasi juga merupakan tahap pembentukan tunas adventif dan tunas aksiler yang tumbuh dari mata tunas adventif bersama-sama (George & Sherrington, 1984).
Organogenesis tidak langsung untuk inisiasi tunas melalui kalus. Di sini tunas adventif maupun akar akan terbentuk dengan diawali terjadinya kalus. Kultur kalus memiliki potensial morfogenetik bervariasi. Kalus dari beberapa jenis tanaman atau dari beberapa eksplan, sering gagal beregenerasi membentuk tunas atau hanya membentuk akar. Perbanyakan tanaman melalui kalus akan menghasilkan tanaman dengan genetik yang bervariasi, dan ini sangat dikehendaki oleh pemulia tanaman sebagai sumber keragaman genetik (George & Sherrington, 1984).
Embriogenesis adalah proses perkembangan embrio yang berasal dari zigot. Tetapi banyak tanaman yang mempunyai kemampuan untuk membentuk embrio aseksual dari jaringan ovular tanpa terjadinya fusi sel atau inti, yang dikenal dengan apomiksis atau embrio somatik. Pembentukan embrio somatik dapat melalui beberapa cara yaitu dari sel-sel somatik diploid dalam kantung embrio atau dari sel-sel nucelus (diploid) (George & Sherrington, 1984).
Secara in vitro embrio somatik dapat terjadi dari sel-sel somatik dari eksplan yang dikulturkan. Embrio somatik yang dihasilkan secara in vitro dapat berasal dari embriogenesis langsung, seperti kultur antera/organ/jaringan dan embriogenesis tidak langsung melalui kultur suspensi sel atau kultur kalus (George & Sherrington, 1984).
Embriogenesis langsung secara in vitro umumnya terjadi pada eksplan yang masih muda (juvenil). Embrio yang dihasilkan dari kecambah kadang terbentuk dari
sel-sel epidermal, namun ada juga dari jaringan petiola atau sel-sel korteks. Embrio somatik juga dapat terbentuk dari pucuk atau akar tanaman. Embrio dari jaringan nucelus terbentuk dari jaringan nucelus dari kultur ovul. Kemampuan embriogenetik dari nucelus tertingi bila jaringan tersebut lebih dahulu diinduksi menjadi kalus (George & Sherrington, 1984).
Embriogenesis tidak langsung, embrio somatik terbentuk dari kalus dan kultur suspensi telah banyak dilakukan. Kalus yang diperoleh dari inisiasi awal akan memiliki kemampuan untuk beregenerasi membentuk embrio somatik yang tinggi dibanding kalus hasil subkultur. Seperti pada embriogenesis langsung, kemampuan ini tergantung pada eksplan awal yang dikulturkan. Eksplan memiliki kemampuan untuk menghasilkan embriogenesis langsung (misalnya nucelus poliembrionik pada Citrus), tetapi dapat juga membentuk kalus embrionik. Kadang embriogenesis dapat diinduksi dari kalus atau kultur suspensi yang telah disukkultur beberapa kali tanpa mengalami organogenesis (George & Sherrington, 1984).
Embriogenesis pada kultur kalus adalah kalus yang terbentuk dari eksplan pada tahap inisiasi. Kalus embriogenik biasanya diperoleh dari embrio benih, nucelus atau jaringan meristematik lainnya seperti primordia bunga. Untuk inisiasi emrio diperlukan auksin tinggi, sedangkan untuk perkembangan selanjutnya auksin tidak diperlukan. Embrio somatik dapat dihasilkan dalam jumlah besar dari kultur kalus, tetapi jumlahnya dapat ditingkatkan melalui inisiasi embriogenik dari kultur suspensi yang berasal dari kalus primer (George & Sherrington, 1984).
Embriogenesis dari kultur kalus sekunder tidak mempunyai kemampuan untuk morfogenetik, tetapi dapat diinduksi melalui subkultur ke medium yang menginduksi morfogenesis. Kalus yang dihasilkan dari eksplan daun muda yang tidak memiliki daya morfogenesis, bila di subkultur ke medium yang tepat, maka beberapa sel akan membentuk kalus dengan laju yang cepat dan dapat diinduksi membentuk struktur yang menyerupai embrioid dan selanjutnya membentuk planlet setelah subkultur. Hasil perbanyakan dengan cara ini ternyata seragam, dan secara morfologi maupun sitologi normal, tetapi perubahan genetik mungkin dapat terjadi saat pembentukan kalus, sehingga perlu diusahakan memperoleh kalus embriogenik primer langsung dari eksplan (George & Sherrington, 1984).
Embriogenesis dari kultur suspensi yang diinisiasi dari kalus embriogenik maupun kalus non embriogenik sel-selnya tetap mampu beregenerasi membentuk embrio somatik. Kultur yang berasal dari kalus non embrionik, embriogenesis dapat diinduksi pada kultur suspensi untuk beberapa jenis tanaman. Induksi ini terjadi segera setelah diisolasi ke dalam kultur suspensi dan kemungkinan untuk memperoleh sel embrionik akan menurun bila umur kultur bertambah (George & Sherrington, 1984).
Berhasilnya pertumbuhan tunas terutama bergantung pada sumber jaringan, kadar medium hara, dan jenis serta kadar hormon pertumbuhan yang digunakan. Untuk penelitian morfogenik, kalus dari eksplan harus disimpan dalam medium agar yang mengandung sitokinin kadar tinggi dengan sedikit auksin. Dalam hal ini, kalus akan lebih mudah menginduksi tunas (Wetter, 1991).
Kultur embrio (embryo culture), yaitu penanaman embrio dewasa pada media buatan secara aseptis. Aplikasi kultur embrio ini antara lain perbanyakan tanaman, pematahan dormansi untuk mempercepat program pemuliaan serta perbanyakan tanaman yang sulit berkecambah secara alami, misalnya anggrek dan vanilla. Embryo culture atau kultur embrio adalah isolasi steril dari embrio muda (immature embryo) atau embrio dewasa/tua (mature embryo) secara in-vitro dengan tujuan untuk memperoleh tanaman yang lengkap.
Budidaya embrio muda lebih sulit dibandingkan dengan budidaya embrio yang telah dewasa. Embrio yang terdapat dalam biji belum sepenuhnya berkembang dan belum membentuk radicula dan plumula yang sempurna. Selain itu, biji belum memiliki endosperm atau cadangan makanan yang memadai dalam mendukung perkembangan dan perkecambahan embrio. Berdasarkan hal tersebut, perlu disediakan media kultur yang memadai bagi perkembangan embrio muda ini. Pada beberapa kasus kadangkala dijumpai embrio masih dorman sehingga perlu ditambahkan hormon tanaman yang bisa memecahkan dormansi biji ini, misalnya Giberellin (Taji et al., 2002).
F. Medium
Keberhasilan dalam teknologi serta penggunaan metode in vitro terutama disebabkan pengetahuan yang lebih baik tentang kebutuhan hara sel dan jaringan yang dikulturkan. Hara terdiri dari komponen yang utama dan komponen tambahan. Komponen utama meliputi garam mineral, sumber karbon (gula), vitamin, dan
pengatur tumbuh. Komponen lain seperti senyawa nitrogen organik, berbagai asam organik, metabolit dan ekstrak tambahan tidak mutlak, tetapi dapat menguntungkan ketahanan sel dan perbanyakannya (Wetter & Constabel, 1991).
Medium yang dikembangkan oleh Murashige dan Skoog (MS) merupakan salah satu medium kultur yang dilaporkan cocok digunakan pada berbagai macam tanaman (Bhojwani & Razdan, 1983). Keistimewaan medium MS adalah kandungan nitrat, kalium, dan amoniumnya yang tinggi, selain itu jumlah hara anorganik pada medium ini nampaknya layak untuk memenuhi kebutuhan banyak jenis sel tanaman dalam kultur (Wetter & Constabel, 1991).
Untuk tanaman panili sendiri, pada umumnya medium yang cocok digunakan adalah medium MS. Phillip & Nainar (Kalimuthu, 2006) melaporkan dengan menggunakan medium dasar yang berbeda-beda, hanya medium Murashige & Skoog (MS) yang paling cocok untuk pertumbuhan optimal tunas panili.
1. Air Kelapa
Di dalam medium dasar untuk induksi kalus sering ditambahkan air kelapa karena mengandung komponen aktif seperti mio-inositol, leukoantosianin dan sitokonin. Di dalam air kelapa terkandung pula Diphenil urea yang mempunyai aktivitas seperti sitokinin, yaitu mempunyai aktivitas pembelahan sel. Air kelapa adalah endosperm cair yang terbentuk setelah terjadi pembuahan atau peleburan diri antara inti sperma dengan inti sel telur, sehingga menghasilkan sebuah zygot atau embrio yang kelak akan menjadi tanaman baru. Zygot ini biasanya akan beristirahat dahulu selama beberapa waktu. Selanjutnya terjadi penggabungan antara inti sperma
yang lain dengan inti polar sehingga akan terjadi endosperm (endospermium). Endosperm ini mengandung zat makanan dan segera setelah endosperm terbentuk, maka inti endosperm akan membelah diri berulang kali dengan cepat sehingga endosperm dapat menjadi bertambah besar (Hendaryono & Wijayani, 1994).
Pertumbuhan embrio di dalam biji pada permulaannya berjalan dengan sangat lamban. Tetapi, setelah embrio itu dapat menyerap zat makanan yang tertimbun di dalam endosperm, maka pertumbuhannya akan menjadi bertambah cepat. Pada beberapa jenis tumbuh-tumbuhan dapat disaksikan bahwa makin banyak embrio tersebut menyerap zat makanan, akan makin besar ukurannya dan makin kecil endospermnya. Pengambilan zat makanan oleh embrio dari endosperm dapat dimulai pada waktu biji masih kecil atau masih muda. Pada buah kelapa, perubahan endosperm bagian pinggir menjadi daging buah, sedangkan bagian tengahnya menjadi air kelapa. Endosperm buah kelapa ini sangat kaya akan makanan, maka jika air kelapa tersebut ditambahkan dalam medium kultur jaringan, eksplan yang kita tanam dapat tumbuh dengan baik. Air kelapa yang baik untuk digunakan adalah dari buah kelapa yang daging buahnya tidak terlalu lunak, tetapi juga belum terlalu keras (umur 210-240 hari) (Hendaryono & Wijayani, 1994).
Hasil penelitian menunjukkan bahwa air kelapa kaya akan potasium (kalium) hingga 17 %. Selain kaya mineral, air kelapa juga mengandung gula antara 1,7 sampai 2,6 % dan protein 0,07 hingga 0,55 %. Mineral lainnya antara lain natrium (Na), kalsium (Ca), magnesium (Mg), ferum (Fe), cuprum (Cu), fosfor (P) dan sulfur (S). Disamping kaya mineral, air kelapa juga mengandung berbagai macam vitamin
seperti asam sitrat, asam nikotinat, asam pantotenal, asam folat, niacin, riboflavin, dan thiamin. Terdapat pula dua hormon alami yaitu auksin dan sitokinin sebagai pendukung pembelahan sel embrio kelapa (Sunaryo, 2006).
Air kelapa mengandung makronutrien, mikronutrien, protein, mineral, dan vitamin baik pada air kelapa yang berada dalam kelapa dewasa dan air kelapa yang berada dalam kelapa yang masih muda (Lampiran).
2. Medium Tomat
Seperti yang telah diuraikan diatas, dalam metode perbanyakan tanaman dengan teknik kultur jaringan, media menjadi salah satu faktor yang paling penting. Salah satu media tanam yang dapat digunakan sebagai alternatif yaitu medium alami. Medium seperti medium tomat, pisang, touge, dan kentang dapat berguna untuk tempat tumbuh dan menyediakan unsur hara, mineral, asam amino, zat pengatur tumbuh yang dibutuhkan bahan tanam (biji, akar, jaringan tumbuh tanaman) untuk tumbuh.
Berdasarkan hasil penelitian yang dilakukan oleh LaRue (1949) medium kultur jaringan yang mengandung sari buah tomat mampu memaksimalkan pertumbuhan dibandingkan dengan medium kultur alami lainnya seperti sari buah anggur, sari buah jeruk, dan lainnya.
Pada buah tomat yang matang, terdapat sitokinin aktif yang mempercepat pertumbuhan eksplan terutama biji dan merespon pertumbuhan ke arah pembentukan kalus (Bhojwani, 1983) Dari Tabel 2.4, dapat dilihat kandungan tomat yang kaya akan vitamin A, vitamin C, mineral, serat dan zat fitonutrien (Sutomo, 2008).
Tabel 2.1 Kandungan Gizi Tomat Per 100 g Kandungan Gizi Tomat / 100 g
Kalori 20 kal Protein 1.0 g Lemak 0.3 Karbohidrat 4.2 Kalsium 5 Vitamin A 1500 SI Vitamin C 40 mg
G. Zat Pengatur Tumbuh (ZPT)
Seperti halnya pada hewan, berbagai fungsi dan kinerja sel pada tumbuhan juga dipengaruhi oleh berbagai macam hormon. Hormon-hormon tersebut diproduksi pada suatu jaringan tanaman dan kemudian diangkut ke lokasi yang berbeda di dalam tubuh tumbuhan dimana nantinya hormon-hormon yang membawa pesan kimiawi tersebut akan mempengaruhi berbagai proses pertumbuhan dan perkembangan pada tumbuhan (Wetherell, 1976).
Konsep zat pengatur tumbuh diawali dengan konsep hormon tanaman. Hormon tanaman adalah senyawa-senyawa organik tanaman yang dalam konsentrasi yang rendah mempengaruhi proses-proses fisiologis. Proses-proses fisiologis ini terutama proses pertumbuhan, diferensiasi dan perkembangan tanaman (Wetherell, 1976). .
Dengan berkembangnya pengetahuan biokimia dan dengan majunya industri kimia maka ditemukan banyak senyawa-senyawa yang mempunyai pengaruh fisiologis yang serupa dengan hormon tanaman. Senyawa-senyawa sintetik ini pada umumnya dikenal dengan nama zat pengatur tumbuh tanaman (ZPT). Zat Pengatur
Tumbuh adalah senyawa organik bukan nutrisi yang dalam konsentrasi rendah (<1mM) mendorong, menghambat atau secara kualitatif mengubah pertumbuhan dan perkembangan tanaman (Wetherell, 1976). .
Dalam kultur jaringan sangat diperlukan zat pengatur tumbuh untuk merangsang pertumbuhan dan morfogenesis dalam kultur sel, jaringan dan organ. Pada umumnya zat pengatur tumbuh yang digunakan adalah sitokinin dan auksin. Sitokinin yang biasa digunakan adalah Benzil Amino Purin (BAP) dan kinetin, sedangkan auksin yang digunakan adalah Indol Asam Asetat (IAA), Naftalen Asam Asetat (NAA) dan Indol Buterik Asetat (IBA) (Yekti & Zamroni, 2005).
Zat pengatur tumbuh ini diperlukan untuk pertumbuhan eksplan. Menurut Hendaryono dan Wijayanti (2000) pembentukan kalus, jaringan pucuk dan jaringan akar ditentukan oleh penggunaan zat pengatur tumbuh yang tepat baik macam maupun konsentrasinya.
1. Auksin
Auksin merupakan salah satu hormon tanaman yang dapat meregulasi banyak proses fisiologi, seperti pertumbuhan, pembelahan, dan diferensiasi sel serta sintesis protein. Auksin diproduksi dalam jaringan meristematik yang aktif (yaitu tunas, daun muda dan buah). Dari tempat diproduksinya kemudian auksin menyebar luas dalam seluruh tubuh tanaman, penyebarluasannya dengan arah dari atas ke bawah hingga titik tumbuh akar, melalui jaringan pembuluh tapis (floem) atau jaringan parenkim (Taiz, 1991).
Auksin pertama kali diisolasi pada tahun 1928 dari biji-bijian dan tepung sari bunga yang tidak aktif. Dari hasil isolasi didapatkan rumus kimia auksin (IAA = Asam Indolasetat) atau C10H9O2N. Setelah ditemukan rumus kimia auksin, maka terbuka jalan untuk menciptakan jenis auksin sintetis seperti Hidrazil atau 2, 4-D (asam 2, 4-Diklorofenoksiasetat), NAA (asam α-Nattalenasetat), Bonvel D (asam 3, 6-Dikloro-O-anisat/dikambo), Amiben atau Kloramben (Asam 3-amino 2, 5-diklorobenzoat) dan Pikloram/Tordon (asam 4-amino-3, 5, 6-trikloro-pikonat) (Hendaryono & Wijayani 2000).
Auksin sintetis ini sudah digunakan secara luas dan komersil di bidang pertanian. Batang, pucuk dan akar tumbuh-tumbuhan memperlihatkan respon terhadap auxin, yaitu peningkatan laju pertumbuhan terjadi pada konsentrasi yang optimal dan penurunan pertumbuhan terjadi pada konsentrasi yang terlalu rendah atau terlalu tinggi. (Siti, 2002)
Fungsi auksin yaitu mempengaruhi pertumbuhan tanaman dalam pemanjangan sel dan morfogenesis. Auksin juga mempengaruhi pertumbuhan sekunder dengan cara menginduksi pembelahan sel pada kambium vaskuler dan dengan mempengaruhi diferensiasi xilem sekunder. Auksin yang ada di tunas apikal juga dapat menghambat pertumbuhan dan perkembangan tunas lateral (tunas samping), sehingga pucuk batang terus tumbuh memanjang dan menghambat pembentukan cabang. Dominansi pertumbuhan pucuk batang dan terhambatnya
pertumbuhan tunas lateral oleh pengaruh auksin yang diproduksi tunas apikal ini dikenal dengan istilah dominansi apikal (McMahon et al, 2002).
2. Sitokinin
Sitokinin merupakan nama generik untuk substansi pertumbuhan yang khususnya merangsang pembelahan sel (sitokinesis). Selanjutnya dijelaskan bahwa sitokinin disintesis dalam akar muda, biji dan buah yang belum masak dan jaringan pemberi makan (misalnya endosperm cair). Buah jagung, pisang, apel, air kelapa muda dan santan kelapa yang belum tua merupakan sumber yang kaya akan sitokinin (McMahon et al, 2002).
Sebenarnya sudah sejak tahun 1892 ahli fisologi I. D. Wiesner, menyatakan bahwa aktivitas pembelahan sel membutuhkan zat yang spesifik dan adanya keseimbangan antara faktor-faktor endogenous. Secara pasti baru tahun 1955 sitokinin ditemukan oleh Miller, Skoog, Slastea dan Strong dan dinyatakan sebagai zat yang sangat aktif sebagai promotor mitosis dan pembelahan sel kalus. Kata sitokinin berasal dari pengertian cytokinesis yang berarti pembelahan sel. Sitokinin alami ditemukan oleh Lethan dan Miller tahun 1963 diisolasi dalam bentuk kristal dari biji jagung yang belum matang yang disebut zeatin (Aslamsyah, 2002).
Sitokinin sesuai dengan namanya yang berasal dari sitokinase adalah hormon tumbuh yang mempengaruhi pembelahan sel. Menurut Kimball (1983), sitokinin bila bereaksi bersama dengan auxin, dengan kuat merangsang mitosis dalam jaringan meristematik. Ledakan sintesis RNA yang nyata terjadi bila sel-sel tumbuhan atau nukleus-nukleus yang terisolasi diberi perlakuan dengan sitokinin.
3. Growmore
Growmore adalah pupuk daun lengkap dalam bentuk kristal berwarna biru, sangat mudah larut dalam air. Dapat diserap dengan mudah oleh tanaman baik itu melalui penyemprotan daun mau pun disiram ke dalam tanah, mengandung hara lengkap dengan konsentrasi yang berbeda sesuai dengan kebutuhan.
Formula ini terutama untuk tanaman muda agar tanaman segera menjadi kuat dan cepat pertumbuhannya. Juga diperlukan bagi tanaman yang saat-saat akhir kurang memerlukan unsur phospat dan kalium yang tinggi.
Semua produk growmore dianjurkan dipakai pada tanaman anggrek, semangka, melon, jeruk, apel, mangga, durian, kopi, coklat, lada, padi, palawija (jagung, kedele, kacang-kacangan), sayuran (tomat, kentang, kubis, bawang, cabe, brokoli).
Adapun petunjuk penggunaan produk growmore adalah sebagai berikut: larutkan 1-2 gram dalam 1 liter air. Semprotkan pada seluruh bagian tanaman terutama daunnya. Semprotkan pada pagi atau sore hari, lakukan secara teratur dengan selang 5 - 10 menurut keperluannya. Dosis dapat dipertinggi jika terlihat gejala defisiensi atau kemarau panjang (Anonymous, 2009).