AKTIVITAS ENZIM ALANIN AMINOTRANSFERASE PADA
JARINGAN JANTUNG TIKUS YANG DIINDUKSI HIPOKSIA
SISTEMIK
Hanifah Rahmani Nursantia, Ani Retno Prijantib, Mohamad Sadikinb a.Pendidikan Dokter Fakultas Kedokteran Universitas Indonesia
b. Departemen Biokimia dan Biologi Molekuler FKUI E-mail: hanifah.rn@gmail.com
Abstrak
Adaptasi terhadap hipoksia kronik disebut memiliki efek protektif terhadap penyakit jantung koroner. Salah satu bentuk adaptasi terhadap hipoksia adalah pergeseran metabolisme energi dari jalur fosforilasi oksidatif menuju glikolisis anaerob. Laju glikolisis anaerob yang tinggi dibutuhkan untuk mendapatkan jumlah energi setara dengan metabolisme aerobik. Akibatnya, kebutuhan glukosa meningkat pesat, terutama pada jaringan dengan kebutuhan energi besar seperti jantung. Untuk memenuhi kebutuhan tersebut, diduga jalur glukoneogenesis, salah satunya dari prekursor alanin, teraktivasi. Tujuan penelitian ini adalah menganalisa respon metabolik jaringan jantung terhadap hipoksia dengan menilai aktivitas spesifik alanin aminotransferase (ALT) pada jaringan jantung 25 tikus jantan Sprague Dawley yang diinduksi hipoksia sistemik (10% O2 dan 90% N2) selama
1, 3, 7, dan 14 hari dibandingkan kontrol normoksia. Distribusi data tidak normal sehingga analisis dilakukan dengan uji Kruskal-Wallis dilanjutkan uji post-hoc Mann-Whitney. Hasilnya, aktivitas spesifik ALT menunjukkan tren yang cenderung meningkat seiring bertambahnya durasi hipoksia. Dibandingkan dengan kelompok normoksia, perbedaan bermakna hanya didapatkan pada kelompok tikus hipoksia 14 hari (p = 0.047). Dapat disimpulkan, aktivitas ALT jaringan jantung dipengaruhi kondisi hipoksia. Aktivitas ALT berperan mempertahankan laju glikolisis anaerob sehingga kebutuhan energi jantung dapat terpenuhi.
Kata kunci: alanin aminotransferase; glukoneogenesis; hipoksia; jantung
ACTIVITY OF ALANINE AMINOTRANSFERASE IN CARDIAC TISSUE OF SYSTEMIC HYPOXIA INDUCED RATS
Abstract
Adaptation to chronic hypoxia is said to provide protective effects against coronary artery disease. One of adaptation form is a shift in energy metabolism from oxidative phosphorylation towards anaerobic glycolysis. High rate anaerobic glycolysis is needed to obtain same amount of energy as aerobic metabolism. Therefore, glucose demands rapidly increased, especially in tissue with large energy demands such as cardiac tissue. To meet those needs, it is suspected that gluconeogenesis pathway is activated, one of which from alanine precursor. This study is aimed to analyze metabolic responses of cardiac tissue towards hypoxia by evaluating alanine aminotransferase (ALT) specific activity in cardiac tissues of twenty five males Sprague Dawley induced by systemic hypoxia (10% O2 and 90% N2) for 1, 3, 7, and 14 days, compare with normoxic group. Because its abnormal distribution, data were analyzed using Kruskal-Wallis test, then post-hoc Mann-Whitney. The results showed relative increasing trend of median ALT specific activity as hypoxia duration increased. But, comparing to the normoxic group, significant difference only found in group induced by systemic hypoxia for 14 days (p=0.047). In conclusion, ALT activity of cardiac tissue is affected by hypoxic conditions. ALT activity plays a role in maintaining anaerobic glycolysis rate to meet energy demands.
PENDAHULUAN
Kondisi hipoksia atau menurunnya suplai oksigen di jaringan terjadi pada banyak kasus penyakit, salah satunya pada penyakit jantung koroner (PJK).1 Pada penyakit ini, terjadi obstruksi pembuluh arteri yang mensuplai oksigen dan nutrisi ke otot jantung. Akibatnya jaringan otot jantung yang berada di daerah distal obstruksi mengalami iskemia dan sel-sel yang menyusunnya mengalami hipoksia. Selanjutnya dapat terjadi nekrosis sel karena regenerasi adenosine trifosfat (ATP) dari proses oksidasi bahan bakar yang menurun.2
Adaptasi jantung terhadap keadaan hipoksia disebut menjadi faktor proteksi terhadap infark miokard, yaitu kematian sel otot jantung akibat iskemia.1 Menurut Faeh et.al (2009), di daerah dataran tinggi seperti Switzerland, di mana kadar oksigen lingkungannya rendah, angka mortalitas akibat PJK dan stroke lebih rendah dibandingkan dengan populasi umum.3
Salah satu bentuk adaptasi terhadap kondisi hipoksia adalah pergeseran metabolisme energi yang diregulasi faktor transkripsi HIF-1.1,4,5 Metabolisme energi berubah dari fosforilasi oksidatif menjadi glikolisis anaerob yang menghasilkan energi dalam jumlah jauh lebih sedikit. Untuk menghasilkan energi setara dengan keadaan aerobik, metabolisme energi pada kondisi anaerobik harus berjalan lebih cepat dan membutuhkan substrat, yaitu glukosa, dalam jumlah lebih banyak.2
Peningkatan laju metabolisme dicapai dengan meningkatkan jumlah enzim glikolitik di antaranya laktat dehidrogenase (LDH) yang diketahui ekspresi gennya diinduksi oleh HIF-1a.1,2 Sedangkan mekanisme adaptasi sel untuk meningkatkan jumlah glukosa di berbagai organ belum diketahui pasti. Kemungkinan terjadi peningkatan asupan glukosa atau glukoneogenesis, yaitu pembentukan glukosa dari bahan bakar lain. Namun, glukoneogenesis membutuhkan energi dalam jumlah yang tidak sedikit. Alanin aminotransferase (ALT) termasuk enzim yang berperan dalam glukoneogenesis prekursor alanin.2
Untuk menilai apakah pada organ jantung terdapat keterlibatan enzim ALT dalam mekanisme adaptasi hipoksia, maka pada penelitian ini dilakukan pengukuran aktivitas spesifik ALT pada jaringan jantung tikus yang diinduksi hipoksia selama 1 hari, 3 hari, 7 hari, dan 14 hari untuk kemudian dibandingkan dengan jaringan jantung tikus yang tidak diinduksi hipoksia (normoksia).
TINJAUAN PUSTAKA
Hipoksia merupakan keadaan berkurangnya kadar oksigen pada tingkat sel atau jaringan.5 Pada tingkat seluler, adaptasi terhadap hipoksia berkaitan dengan efisiensi proses
produksi energi dan penurunan proses yang mengonsumsi energi.6 Proses adaptasi ini diatur oleh faktor transkripsi HIF-1 yang teraktivasi saat kadar oksigen di dalam sel menurun.1,5–7 Gen-gen yang diinduksi transkripsinya oleh HIF-1 antara lain tirosin hidroksilase yang terlibat dalam sintesis dopamin, enzim-enzim glikolitik, transporter glukosa, VEGF dan PDGF yang menginduksi angiogenesis, nitrit oksida sintetase (NOS) untuk vasodilatasi, eritropoietin dan reseptor transferin untuk peningkatan produksi eritrosit.2,6 Terdapat lebih dari 70 gen yang diinduksi oleh HIFs.2
Lebih dari 60% energi yang digunakan otot jantung berasal dari asam lemak, sedangkan sekitar 20% hingga 40% nya berasal dari glukosa dan laktat.2,8 Pada kondisi fisiologis, proses pembentukan energinya 98% melalui fosforilasi oksidatif, hanya 2% yang berasal dari glikolisis.2 Namun, pada keadaan hipoksia kronik, aktivitas enzim yang mengoksidasi asam lemak menurun, sehingga metabolisme energi beralih ke penggunaan glukosa melalui glikolisis anaerob.8
Glikolisis berlangsung di sitosol dengan total energi yang dihasilkan pada glikolisis adalah 2 ATP dan 2 NADH.2 Pada kondisi aerob, glikolisis kemudian dilanjutkan dengan proses dekarboksilasi oksidatif, siklus asam sitrat, dan fosforilasi oksidatif di mitokondria dan menghasilkan sekitar 32 molekul ATP untuk setiap satu molekul glukosa2 atau ada beberapa sumber yang menyebutkan 38 ATP. NADH di sitosol direoksidasi menjadi NAD+, kemudian elektron ditransfer ke rantai respirasi di mitokondria.9
Pada kondisi anaerob, NADH dari proses glikolisis direoksidasi oleh laktat dehidrogenase (LDH) dengan mereduksi piruvat menjadi laktat. Karena tidak membutuhkan oksigen untuk mereoksidasi NADH, proses ini disebut dengan glikolisis anaerob. Energi yang dihasilkan melalui glikolisis anaerob jauh lebih kecil dari glikolisis aerob yaitu, 2 mol ATP setiap 1 mol glukosa. Hal ini terjadi karena elektron dari NADH di sitosol tidak masuk ke rantai transpor elektron dan piruvat tidak dioksidasi menjadi asetil ko-A sehingga tidak masuk ke dalam siklus krebs untuk dioksidasi seluruhnya menjadi CO2.2,9 Laktat yang dihasilkan dari proses glikolisis anaerobik digunakan oleh jaringan lainnya terutama hati, jantung dan otot rangka.2
Untuk dapat mengimbangi hasil energi yang didapatkan dari glikolisis aerob, proses glikolisis anaerob harus berlangsung sekitar 15 kali lebih cepat dan membutuhkan glukosa 15 kali lipat lebih banyak. Untuk dapat mencapai hal tersebut, selama keadaan hipoksia sel mengekspresikan enzim glikolitik dalam laju yang tinggi dan berbagai bentuk simpanan energi digunakan untuk mensuplai substrat glikolisis. Meningkatnya laktat yang merupakan hasil akhir dari glikolisis anaerob tanpa diimbangi dengan pembuangan menyebabkan
peningkatan H+ intraseluler. Penurunan pH menyebabkan terganggunya pembentukan ATP melalui glikolisis.2
Ketika tidak ada asupan sumber energi seperti saat berpuasa atau pun tidur, tubuh menggunakan bahan bakar simpanan untuk mensintesis glukosa. Proses sintesis glukosa dari senyawa selain karbohidrat ini adalah glukoneogenesis. Proses ini berlangsung terutama pada hati dengan prekursor utamanya laktat, gliserol dan asam amino khususnya alanin. Proses glukoneogenesis secara umum merupakan kebalikan dari proses glikolisis, kecuali pada tiga tahapan yang ireversibel pada glikolisis yaitu konversi (1) piruvat menjadi PEP, (2) fruktosa 1,6 bifosfat menjadi froktosa 6 fosfat, (3) glukosa 6-fosfat menjadi glukosa.2,10
Pada intinya sumber karbon untuk masuk ke dalam proses glukoneogenesis diubah terlebih dahulu menjadi piruvat, senyawa intermediet siklus asam sitrat atau senyawa intermediet pada jalur glikolisis dan glukoneogenesis. Pada hati, piruvat terutama diproduksi dari prekursor laktat dan alanin. Laktat dehidrogenase mengoksidasi laktat menjadi piruvat, menghasilkan NADH dan alanin aminotransferase mengubah alanin menjadi piruvat. Reaksi glukoneogenesis ini membutuhkan energi setidaknya sebanyak 6 molekul ATP untuk setiap dua molekul piruvat yang menjadi substrat.2
METODE PENELITIAN
Penelitian ini merupakan studi eksperimental in vivo pada hewan coba yaitu tikus putih jantan Sprague Dawley. Dilaksanakan sejak bulan Maret 2011 hingga bulan Juni 2013 di Laboratorium Biokimia dan Biologi Molekuler Fakultas Kedokteran Universitas Indonesia. Hewan coba diinduksi hipoksia secara sistemik kemudian kadar protein dan aktivitas enzim alanin aminotransferase (ALT) pada jaringan jantungnya diukur. Sebanyak 25 ekor tikus digunakan dalam penelitian ini. Tikus dibagi dalam 5 kelompok yaitu kelompok tikus yang diinduksi hipoksia selama 1 hari, 3 hari, 7 hari dan 14 hari, serta kelompok kontrol yaitu tikus yang tidak diinduksi hipoksia (normoksia). Usia tikus kurang lebih 3 bulan dengan berat badan berkisar 150-200 g. Tikus yang memiliki kelainan atau penyakit tidak digunakan dalam penelitian. Hingga akhir perlakuan tidak ada tikus yang mati. Perlakuan terhadap hewan coba telah mendapat persetujuan etik dari Medical Research Unit FKUI.
Induksi hipoksia diberikan dengan menempatkan tikus di dalam bilik hipoksia yang disuplai oksigen 10% dan nitrogen 90% hingga waktu perlakuan yang ditentukan. Sebelumnya tikus diadaptasi selama satu minggu dengan ditempatkan pada bilik biasa (pasokan udara bebas) bersama kelompok tikus normoksia. Seluruh kelompok tikus diberi
makan ad libitum dalam jumlah yang sama. Setelah masa perlakuan yang ditentukan berakhir, tikus dieutanasia dengan éter, kemudian dilakukan pembedahan untuk mengambil organ-organ dalam tikus, termasuk jantung. Organ-organ-organ dalam tersebut disimpan dalam
deepfreezer (-800C) hingga pengerjaan selanjutnya.
Setiap sampel diambil jaringan jantungnya sebanyak 100 gram, lalu dicampurkan dengan 1 ml larutan buffer dalam test tube. Jaringan dihomogenisasi dengan larutan buffer menggunakan homogenizer dalam kondisi dingin. Kemudian, disentrifugasi dengan kecepatan 5000 rpm selama 10 menit untuk diambil supernatannya. Kadar protein diukur dengan membandingkan serapan larutan supernatan pada panjang gelombang 280 nm terhadap kurva standar. Sedangkan aktivitas ALT diukur dengan menggunakan kit Rx-AL 2360. Aktivitas ALT dibagi dengan kadar protein jaringan untuk mendapatkan aktivitas spesifik ALT.
Untuk menguji hipotesis dilakukan uji non-parametrik, Kruskal-Wallis, karena distribusi data yang tidak normal berdasarkan uji normalitas Shapiro-Wilk. Data aktivitas enzim dan kadar protein disajikan sebagai data numerik sedangkan lama waktu hipoksia dan kelompok normoksia sebagai data kategorik. Analisa post-hoc dilakukan dengan menggunakan uji Mann-Whitney dengan adanya perbedaan dinyatakan bila p<0.05.
HASIL
Hasil perhitungan kadar protein jaringan jantung setiap kelompok disajikan pada tabel 1. Terlihat bahwa median kadar protein cenderung meningkat dari perlakuan hipoksia 1 hari hingga 7 hari kemudian turun pada kelompok tikus hipoksia 14 hari. Namun, berdasarkan uji Kruskal-Wallis yang dilakukan tidak terdapat perbedaan bermakna antara kelompok tikus normoksia dan hipoksia.
Tabel 1. Kadar Protein Jaringan Jantung (mg/ml)
Kelompok n Median (min-maks) P
Normoksia 5 13.26 (7.96 - 18.83) 0.092
Hipoksia 1 hari 5 8.96 (7.43 - 20.99)
3 hari 5 14.84 (10.27 - 15.84)
7 hari 5 15.68 (8.22 - 20.72)
*Uji Kruskal-Wallis. Uji post-hoc Mann-Whitney: kontrol vs 14 hari p=0.047; 1 hari vs 14 hari p=0.047; 7 hari vs 14 hari p=0.009; pasangan kelompok lainnya p>0.05.
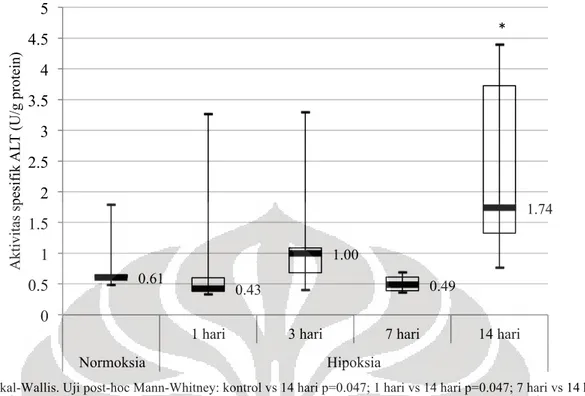
Gambar 1. Grafik Aktivitas Spesifik ALT pada Jaringan Jantung Tikus
Sedangkan besar aktivitas spesifik ALT setiap kelompok disajikan pada gambar 1. Tampak terdapat variasi aktivitas spesifik ALT antarkelompok. Tikus yang diberikan perlakuan induksi hipoksia sistemik selama 14 hari memiliki median aktivitas spesifik ALT tertinggi, yaitu 1.74 (0.77-4.4) U/g protein jaringan. Bila dibandingkan dengan kelompok kontrol, aktivitis spesifik enzim meningkat pada kelompok yang diinduksi hipoksia selama 3 hari dan 14 hari, dan sedikit menurun pada kelompok yang diinduksi hipoksia selama 1 hari dan 7 hari. Berdasarkan uji Kruskal-Wallis, perbedaan aktivitas spesifik ALT didapatkan pada kelompok normoksia dengan hipoksia 14 hari; kelompok hipoksia 1 hari dengan 14 hari; dan kelompok hipoksia 7 hari dengan 14 hari.
PEMBAHASAN
Kadar protein jaringan pada kondisi hipoksia seharusnya cenderung menurun akibat inhibisi sintesis protein-protein yang tidak vital untuk menghemat energi.7 Hasil analisa kadar protein yang menunjukkan perbedaan tidak bermakna antar kelompok hipoksia dan normoksia menandakan adaptasi jantung yang sedikit berbeda dengan jaringan lainnya. Hasil serupa dilaporkan pada beberapa penelitian terdahulu, yaitu aktivitas sintesis protein pada jantung yang cenderung meningkat atau tidak banyak berubah pada keadaan hipoksia
0.61 0.43 1.00 0.49 1.74 0 0.5 1 1.5 2 2.5 3 3.5 4 4.5 5
1 hari 3 hari 7 hari 14 hari
Normoksia Hipoksia Aktivitas spesifik AL T (U/g protein) *
kronik.11,12,13 Proses adaptasi yang sedikit berbeda ini berkaitan dengan peran vital jantung dan aliran darah ke jantung yang tetap diutamakan meski tubuh mengalami stress.13
Meski tidak ada perbedaan yang bermakna, dapat diperhatikan pada tabel 4.1 bahwa kadar protein jaringan cenderung meningkat dari hipoksia 1 hari hingga 7 hari. Hal ini kemungkinan berkaitan dengan ekspresi HIF-1 yang cenderung meningkat pada awal hipoksia lalu menurun mengalami stabilisasi dengan penghambatan degradasi pada hipoksia kronik,14 Seperti yang dilaporkan oleh Wanandi et.al (2009) pada penelitiannya bahwa kadar mRNA relatif H-1a pada jantung meningkat seiring lamanya induksi hipoksia yang kemudian mencapai nilai maksimumnya pada hari ke-7.11
Untuk aktivitas ALT, dapat dilihat pada gambar 4.2 bahwa aktivitas spesifik ALT bervariasi pada setiap kelompok namun cenderung semakin meningkat seiring bertambahnya durasi hipoksia sistemik. Peningkatan aktivitas ALT yang signifikan yaitu hampir tiga kali lipat dibandingkan kelompok tikus normoksia terjadi setelah induksi hipoksia 14 hari (p<0.05). Aktivitas ALT yang tinggi ini diduga berkaitan dengan peningkatan produksi alanin yang menjadi prekursor glukoneogenesis pada kondisi hipoksia.
Dugaan aktivitas ALT ke arah pembentukan alanin pada jaringan jantung akibat induksi hipoksia diperkuat oleh penelitian sebelumnya terhadap biopsi jantung pasien dengan dilatasi ventrikel kiri akibat regurgitasi mitral. Venturini et. al (2009) melaporkan terjadi peningkatan kadar alanin dan penurunan kadar glutamat pada jaringan biopsi setelah jantung dihentikan selama 10 menit (cardioplegic arrest). Pada penelitian ini, stres iskemik yang terjadi pada cardioplegic arrest ditandai dengan peningkatan kadar laktat selama reperfusi.15
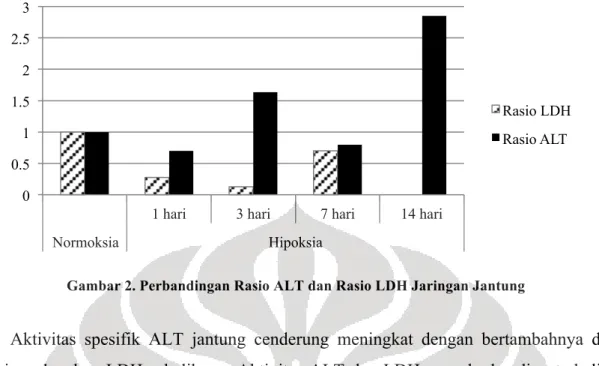
Peningkatan aktivitas ALT ternyata tidak hanya berkaitan dengan glukoneogenesis. Tetapi juga berkaitan dengan penurunan akumulasi laktat yang dapat menurunkan laju glikolisis dan menurunkan pH intrasel. Produksi laktat menurun karena piruvat yang sebelumnya diubah menjadi laktat oleh LDH ditransaminasi oleh ALT menjadi alanin yang kemudian langsung dilepas ke darah untuk diangkut ke hati.16,17 Di hati baru kemudian alanin akan diubah menjadi glukosa dan diekskresi sebagai urea.2 Perbandingan antara ALT dan LDH pada jaringan jantung dapat dilihat pada gambar 2. Data aktivitas LDH didapatkan dari penelitian oleh Ismail FM (2013) terhadap sampel jaringan jantung yang sama dengan sampel yang digunakan pada penelitian ini.18
Gambar 2. Perbandingan Rasio ALT dan Rasio LDH Jaringan Jantung
Aktivitas spesifik ALT jantung cenderung meningkat dengan bertambahnya durasi hipoksia sedangkan LDH sebaliknya. Aktivitas ALT dan LDH yang berbanding terbalik ini kemungkinan berkaitan dengan penggunaan substrat yang sama, yaitu piruvat. Sehingga pada jantung, piruvat cenderung diubah menjadi alanin daripada laktat. Dengan itu, glikolisis dapat terus berjalan meski aktivitas LDH rendah dan akumulasi laktat dapat ditekan. Akumulasi laktat yang sangat tinggi menghambat laju glikolisis dan dapat menyebabkan kematian sel.15 Rasio ALT/LDH yang besar menurut Kotoh et. al (2008) dapat menunjukkan derajat kerusakan sel akibat hipoksia yang rendah.19
Untuk peningkatan ALT yang tidak signifikan sebelum induksi 14 hari dapat berkaitan dengan besar akumulasi laktat. Akumulasi laktat merupakan salah satu pemicu peningkatan aktivitas ALT.8,16 Hal ini seiring dengan hasil penelitian lainnya yang menunjukkan kadar alanin yang relatif rendah pada otot jantung yang mengalami iskemia akut. Sebaliknya, kadar alanin yang tinggi ditemukan pada kondisi hipoksia kronik yaitu pada pasien angina stabil.8
KESIMPULAN
Kadar protein jantung antar kelompok tikus yang diinduksi hipoksia dan kelompok normoksia tidak berbeda bermakna (p=0.092). Sedangkan aktivitas spesifik ALT pada jaringan jantung meningkat secara signifikan setelah induksi hipoksia sistemik selama 14 hari. (p = 0.047 antara kelompok hipoksia 14 hari dengan kelompok normoksia, dan hipoksia 1 hari; p = 0.009 antara kelompok 7 dengan 14 hari ).
0 0.5 1 1.5 2 2.5 3
1 hari 3 hari 7 hari 14 hari
Normoksia Hipoksia
Rasio LDH Rasio ALT
SARAN
Untuk keperluan penelitian selanjutnya dapat dilakukan pengukuran kadar alanin dan glutamat pada jaringan jantung dan aktivitas ALT pada jaringan hati untuk mengetahui proses glukoneogenesis pada kondisi hipoksia secara menyeluruh. Penelitian terhadap rasio ALT/LDH memiliki peluang untuk dikembangkan karena kemungkinan dapat memperkirakan kemampuan jaringan bertahan pada kondisi hipoksia.
DAFTAR PUSTAKA
1. Semenza GL. Oxygen Sensing, Homeostasis, and Disease. N. Engl. J. Med. 2011;365:537–47.
2. Liebermen M, Marks A, Peet A. Marks’ basic medical biochemistry : a clinical approach. 4th ed. Philadelphia: Lippincott Williams & Wilkins; 2013. p 396-416, 562-79, 711-30, 778.
3. Faeh D, Gutzwiller F, Bopp M. Lower Mortality From Coronary Heart Disease and Stroke at Higher Altitudes in Switzerland. Circulation. 2009;120:495–501.
4. Hyvarinen J, Hassinen IE, Sormunen R, Maki JM, Kivirikko KI, Koivunen P, et al. Hearts of Hypoxia-inducible Factor Prolyl 4-Hydroxylase-2 Hypomorphic Mice Show Protection against Acute Ischemia-Reperfusion Injury. J. Biol. Chem. 2010;285:13646– 57.
5. Ke Q, Costa M. Hypoxia-Inducible Factor-1 (HIF-1). Mol. Pharmacol. 2006;70:1469– 80.
6. Michiels C. Physiological and Pathological Responses to Hypoxia. Am. J. Pathol. 2004;164:1875–82.
7. Liu L, Simon MC. Regulation of Transcription and Translation by Hypoxia. Cancer Biol. Ther. 2004;3:489–94.
8. Stanley WC, Recchia FA, Lopaschuk GD. Myocardial Substrate Metabolism in the Normal and Failing Heart. Physiol. Rev. 2005;85:1093–129.
9. Bender DA, Mayes PA. Glikolisis & Oksidasi Piruvat. Biokimia Harper. 27th ed. Jakarta: EGC; 2009. p. 158–65.
10. Bender DA, Mayes PA. Glukoneogenesis & Kontrol Glukosa Darah. Biokimia Harper. 27th ed. Jakarta: EGC; 2009. p. 174–83.
11. Wanandi SI, Dewi S, Paramita R. Ekspresi Relatif mRNA Hif-1α Pada Jantung, Otak dan Darah Tikus Selama Induksi Hipoksia Sistemik. Makara Sci. Ser. 2009;13(2):185-8
12. Fan C, Iacobas DA, Zhou D, Chen Q, Lai JK, Gavrialov O, et al. Gene expression and phenotypic characterization of mouse heart after chronic constant or intermittent hypoxia. Physiol. Genomics. 2005;22:292–307.
13. Martínez ML, Landry C, Boehm R, Manning S, Cheek AO, Rees BB. Effects of long-term hypoxia on enzymes of carbohydrate metabolism in the Gulf killifish, Fundulus grandis. J. Exp. Biol. 2006;209:3851–61.
14. Bohuslavová R, Kolář F, Kuthanová L, Neckář J, Tichopád A, Pavlinkova G. Gene expression profiling of sex differences in HIF1-dependent adaptive cardiac responses to chronic hypoxia. J. Appl. Physiol. 2010;109:1195–202.
15. Venturini A, Ascione R, Lin H, Polesel E, Angelini GD, Suleiman M-S. The importance of myocardial amino acids during ischemia and reperfusion in dilated left ventricle of patients with degenerative mitral valve disease. Mol. Cell. Biochem. 2009;330:63–70. 16. Arsenian M. Potential cardiovascular applications of glutamate, aspartate, and other
amino acids. Clin. Cardiol. 1998;21:620–4.
17. Rumsey WL, Abbott B, Bertelsen D, Mallamaci M, Hagan K, Nelson D, et al. Adaptation to hypoxia alters energy metabolism in rat heart. Am. J. Physiol. - Heart Circ. Physiol. 1999;276:71–80.
18. Ismail FM. Aktivitas Enzim Laktat Dehidrogenase pada Jaringan Jantung Tikus yang Diinduksi Hipoksia Sistemik [Skripsi S1]. Jakarta: Fakultas Kedokteran Universitas Indonesia. 2013.
19. Kotoh K, Enjoji M, Kato M, Kohjima M, Nakamuta M, Takayanagi R. A new parameter using serum lactate dehydrogenase and alanin aminotransferase level is useful for predicting the prognosis of patients at an early stage of acute liver injury: A retrospective study. Comp. Hepatol. 2008;7:6.