BAB. III
Analisis Keragaman Genetik Galur-galur Jagung Pulut (waxy corn) Berbasis MarkaSimple Sequence Repeats(SSRs) dan Korelasinya dengan Karakter
Morfologi ABSTRAK
Program pemuliaan jagung untuk mendapatkan hibrida berpotensi hasil tinggi diperlukan informasi pasangan populasi yang memiliki kelompok heterotik berbeda. Percobaan bertujuan untuk memperoleh informasi hubungan genetik, tingkat keragaman genetik galur jagung pulut berdasarkan marka Simple Sequence Repeats (SSRs) dan korelasinya dengan karakter morfologi. Percobaan dilaksanakan di laboratorium molekuler Balitsereal Maros dan KP. Cikemeuh BB-Biogen Bogor periode Januari hingga April 2008. Materi genetik terdiri dari 39 galur dan 20 primer SSRs. Tingkat polimorfisme primer dihitung menggunakan formulapolymorphism information content (PIC) dan tingkat kemiripan genetik dengan koefisien Jaccard. Hasil penelitian menunjukkan bahwa dua puluh primer yang digunakan memiliki tingkat polimorfisme 0,62 dan total alel 64 dengan rata-rata 3,20 alel/lokus dan nilai koefisien korelasi kofenitik (r) 0,87 tergolonggood fit pada kelompok galur jagung pulut yang ditangani, pengelompokan galur berdasarkan marka SSRs diperoleh tiga klaster atau kelompok heterotik, dengan satu kelompok memiliki satu kelompok pedigree mengelompok tersendiri, namun galur lain dengan pedigree yang mirip terbagi menjadi dua kelompok. Korelasi antara matrik kemiripan berdasarkan SSRs dengan matrik kemiripan berdasarkan morfologi, berdasarkan kriteriagoodness of fit maka nilai korelasi tersebut tergolong sangat lemah.
Kata kunci: jagung pulut, keragaman genetik, Simple Sequence Repeats (SSRs), korelasi
Genetik diversity analysis of waxy corn lines based onSimple Sequence Repeats (SSRs) markers and its correlation to morphological characters
ABSTRACT
New maize (Zea mays L.) inbreeds are usually developed within a heterotic group. However, breeders sometimes use commercial hybrids as a nonconventional (i.e., interheterotic group) source of new inbreeds. The effects of disrupting heterotic patterns in maize, by selfing from commercial hybrids, are not well understood. The study aimed to get information of genetic relation, genetic diversity level of waxy corn lines based on Single Sequence Repeats (SSRs) marker or microsatellite and its correlation to the morphological characters. The research was carried out in ICERI biology molecular laboratory, Maros, South Sulawesi and Cikeumeuh BB-Biogen Experimental Farm, Bogor, West Java from January to April 2008. Genetic materials consist of 39 lines and 20 SSRs Primer. The data was analyzed by polymorphism information content (PIC)
and Jaccard’scoefficient.The resultsshowed thatthe used of 20 primers had 0.62 of polymorphism level and total of 64 alleles with mean of 3,20 alleles per locus and confenetic correlation (r)0.87 categorized good fit on line group of waxy corn handled. Line grouping based on SSRs marker was obtained three clusters or heterotic group in which one group have one pedigree group setting separately, but the other lines with similar pedigree were divided in two groups. While correlation between similarity matrices SSR - based and similarity matrices morphological–based using goodness of fit criteria is very weak.
PENDAHULUAN
Pengetahuan tentang keragaman inbrida jagung pulut (waxy corn) dan pola hubungan kekerabatan di antara materi genetik pemuliaan sangat penting untuk perencanaan persilangan dalam rangka perakitan varietas hibrida. Hal tersebut juga bermanfaat untuk manajemen konservasi plasma nutfah (Munn dan Dudley 1994). Dalam program pembentukan hibrida, diperlukan pasangan galur murni yang memiliki latar belakang genetik jauh agar hibrida yang dihasilkan memiliki tingkat heterosis tinggi. Robinson (2000) mengemukakan bahwa metode seleksi yang umum digunakan dalam pembentukan tetua hibrida adalah metode silsilah (pedigree). Informasi pedigree dan karakter-karakter morfologi telah banyak memberi manfaat dalam pembentukan sejumlah varietas hibrida sejak tahun 1950an. Karakter morfologi kurang dapat menjelaskan hubungan genetik antar individu dengan tepat karena adanya interaksi dengan lingkungan. Untuk itu diperlukan marka molekuler sebagai alat bantu yang langsung melihat perbedaan genetik di antara galur-galur. Karakterisasi keragaman genetik di antara koleksi galur jagung pulut yang didukung oleh data molekuler belum pernah dilakukan di Indonesia.
MarkaSimple Sequence Repeats(SSRs) atau mikrosatelit, telah digunakan secara ekstensif sebagai marka pada studi genetik jagung seperti pada konstruksi pemetaan keterpautan gen dan pemetaan QTL (Romero-Severson 1998; Frova et al. 1999) atau analisis keragaman genetik dan evolusi (Senior et al. 1998; Pejic et al. 1998; Lu dan Bernardo 2001; Matsuoka 2002). SSRs banyak juga digunakan dalam membedakan genotipe, evaluasi kemurnian benih, pemetaan gen, sebagai alat bantu seleksi, studi genetik populasi, dan analisis diversitas genetik. Pabendon (2008) telah berhasil memanfaatkan marka SSRs pada studi analisis keragaman genetik 39 inbrida elit koleksi Balitsereal. Mikrosatelit lebih banyak digunakan untuk karakterisasi dan pemetaan genetik pada tanaman, diantaranya pada tanaman jagung, padi, anggur, kedelai, jewawut, gandum, kelapa, dan tomat (Gupta et al. 1996; Powel et al. 1996; Rivera et al. 1999; Perera et al. 2000; dan Teulat et al. 2000). Marka mikrosatelit banyak digunakan dalam studi genetik karena terdistribusi secara melimpah dan merata dalam genom, variabilitasnya sangat tinggi (banyak alel dalam lokus), dan sifatnya yang kodominan dengan lokasi genom yang telah diketahui.
Program perakitan varietas hibrida yang berpotensi hasil tinggi sangat membutuhkan pasangan populasi yang memiliki kelompok heterotik yang berbeda. Oleh karena itu, dalam pembentukan varietas hibrida, pemilihan tetua perlu perhatian khusus karena untuk mendapatkan peluang munculnya heterosis pada generasi turunanya (F1) diperlukan tetua penyusun varietas hibrida yang memiliki jarak genetik jauh untuk karakter yang dituju.
Untuk mempelajari hubungan kekerabatan dari suatu populasi organism dapat dilakukan dengan menggunakan penanda sebagai alat bantu untuk melakukan karakterisasi genetik (Moritz dan Hillis 1990). Namun karakterisasi genetik yang didasarkan pada penanda fenotip biasanya dipengaruhi oleh lingkungan makro dan mikro, serta umur suatu individu. Kesulitan lain akan terjadi apabila karakter kuantitatif yang diatur oleh banyak gen tersebut terekspresi pada akhir pertumbuhan, seperti karakter hasil (Weising et al. 1995). Oleh karena itu karakterisasi fenotip perlu didukung oleh karakterisasi yang dilakukan melalui penanda molekuler. Penanda molekuler dapat memberi gambaran hubungan kekerabatan yang akurat antar spesies maupun kerabat jauhnya, karena analisis DNA sebagai material genetik tidak dipengaruhi oleh kondisi lingkungan (Lefebvreet al. 2001).
Variasi genetik dapat dilihat melalui polimorfisme DNA. Hubungan kekerabatan genetik pada tanaman dapat dikalikan dengan menggunakan data dari sifat morfologi (Tatineni et al. 1996; Rahaman et al. 1997; Suskandari 2002), kandungan senyawa kimia (Hsiao dan Lin 1995), dan penanda Deoxyribose Nucleic Acid (DNA). Marka mikrosatelit atau biasa juga disebut marka SSRs dapat digunakan untuk mengidentifikasi, memverifikasi dan melihat keragaman genetik suatu varietas tanaman (Vosman et al. 2001; Nunome et al. 2003). Sejumlah penelitian telah dilakukan untuk mengetahui tingkat perbedaan genetik pada tanaman dengan menggunakan mikrosatelit. Penelitian ini bertujuan untuk mengetahui hubungan kekerabatan atau jarak genetik galur jagung pulut berdasarkan pola pita DNA memanfaatkan marka SSRs, dan korelasi antara matrik rata-rata jarak taksonomi berdasarkan penampilan morfologi dan koefisien kemiripan berdasarkan pola pita DNA berbasis marka SSRs.
BAHAN DAN METODE
Penelitian dilaksanakan di KP. Cikeumeuh BB-Biogen dan Laboratorium Molekuler, Balai Penelitian Tanaman Serealia (Balitsereal) Maros dari Januari hingga April 2008. Penelitian terdiri dari percobaan di Laboratorium dan percobaan Lapangan.
Percobaan 1: Hubungan kekerabatan galur jagung pulut (waxy corn) berdasarkan marka SSRs.
Bahan Genetik:
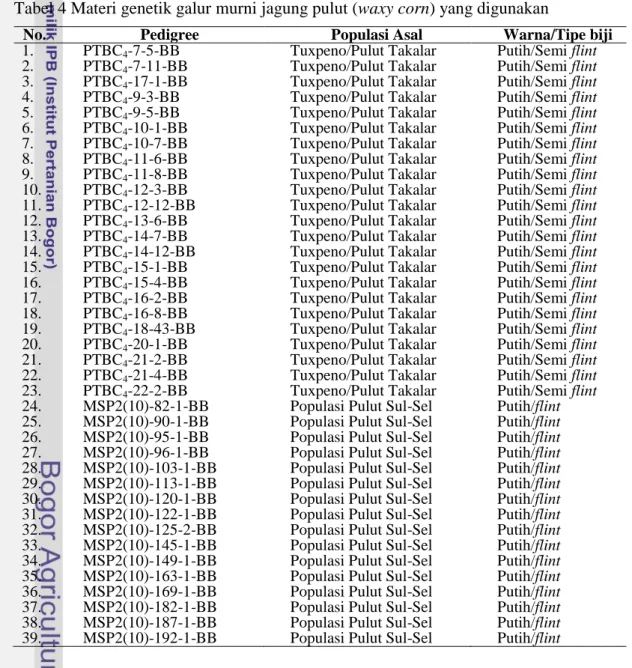
Sebanyak 39 galur jagung pulut koleksi Balitsereal (Tabel 4).
Tabel 4 Materi genetik galur murni jagung pulut (waxy corn) yang digunakan
No. Pedigree Populasi Asal Warna/Tipe biji
1. PTBC4-7-5-BB Tuxpeno/Pulut Takalar Putih/Semiflint 2. PTBC4-7-11-BB Tuxpeno/Pulut Takalar Putih/Semiflint 3. PTBC4-17-1-BB Tuxpeno/Pulut Takalar Putih/Semiflint 4. PTBC4-9-3-BB Tuxpeno/Pulut Takalar Putih/Semiflint 5. PTBC4-9-5-BB Tuxpeno/Pulut Takalar Putih/Semiflint 6. PTBC4-10-1-BB Tuxpeno/Pulut Takalar Putih/Semiflint 7. PTBC4-10-7-BB Tuxpeno/Pulut Takalar Putih/Semiflint 8. PTBC4-11-6-BB Tuxpeno/Pulut Takalar Putih/Semiflint 9. PTBC4-11-8-BB Tuxpeno/Pulut Takalar Putih/Semiflint 10. PTBC4-12-3-BB Tuxpeno/Pulut Takalar Putih/Semiflint 11. PTBC4-12-12-BB Tuxpeno/Pulut Takalar Putih/Semiflint 12. PTBC4-13-6-BB Tuxpeno/Pulut Takalar Putih/Semiflint 13. PTBC4-14-7-BB Tuxpeno/Pulut Takalar Putih/Semiflint 14. PTBC4-14-12-BB Tuxpeno/Pulut Takalar Putih/Semiflint 15. PTBC4-15-1-BB Tuxpeno/Pulut Takalar Putih/Semiflint 16. PTBC4-15-4-BB Tuxpeno/Pulut Takalar Putih/Semiflint 17. PTBC4-16-2-BB Tuxpeno/Pulut Takalar Putih/Semiflint 18. PTBC4-16-8-BB Tuxpeno/Pulut Takalar Putih/Semiflint 19. PTBC4-18-43-BB Tuxpeno/Pulut Takalar Putih/Semiflint 20. PTBC4-20-1-BB Tuxpeno/Pulut Takalar Putih/Semiflint 21. PTBC4-21-2-BB Tuxpeno/Pulut Takalar Putih/Semiflint 22. PTBC4-21-4-BB Tuxpeno/Pulut Takalar Putih/Semiflint 23. PTBC4-22-2-BB Tuxpeno/Pulut Takalar Putih/Semiflint 24. MSP2(10)-82-1-BB Populasi Pulut Sul-Sel Putih/flint 25. MSP2(10)-90-1-BB Populasi Pulut Sul-Sel Putih/flint 26. MSP2(10)-95-1-BB Populasi Pulut Sul-Sel Putih/flint 27. MSP2(10)-96-1-BB Populasi Pulut Sul-Sel Putih/flint 28. MSP2(10)-103-1-BB Populasi Pulut Sul-Sel Putih/flint 29. MSP2(10)-113-1-BB Populasi Pulut Sul-Sel Putih/flint 30. MSP2(10)-120-1-BB Populasi Pulut Sul-Sel Putih/flint 31. MSP2(10)-122-1-BB Populasi Pulut Sul-Sel Putih/flint 32. MSP2(10)-125-2-BB Populasi Pulut Sul-Sel Putih/flint 33. MSP2(10)-145-1-BB Populasi Pulut Sul-Sel Putih/flint 34. MSP2(10)-149-1-BB Populasi Pulut Sul-Sel Putih/flint 35. MSP2(10)-163-1-BB Populasi Pulut Sul-Sel Putih/flint 36. MSP2(10)-169-1-BB Populasi Pulut Sul-Sel Putih/flint 37. MSP2(10)-182-1-BB Populasi Pulut Sul-Sel Putih/flint 38. MSP2(10)-187-1-BB Populasi Pulut Sul-Sel Putih/flint 39. MSP2(10)-192-1-BB Populasi Pulut Sul-Sel Putih/flint
Primer mikrosatelit yang digunakan sebanyak 20 primer (forward dan reverse), diperoleh dari Research Genetik, Inc, dan dari Invitrogen. Primer-primer tersebut diseleksi berdasarkan tingkat polimorfisme pada jagung (referensi dari CIMMYT) (Tabel 5).
Tabel 5 Sekuen dari 20 marka mikrosatelit yang digunakan dalam penelitian
No. Primer No
Kromosom Motif Sekuen 5’–3’Primer F Primer R 1. phi109275 1.03 AGCT CGGTTCATGCTAGCTCTGC //
GTTGTGGCTGTGGTGGTG 2. phi96100 2.01 ACCT AGGAGGACCCCAACTCCTG //
TTGCACGAGCCATCGTAT 3. phi374118 3.02 ACC TACCCGGACATGGTTGAGC //
TGAAGGGTGTCCTTCCGAT
4. phi079 4.05 AGATG TGGTGCTCGTTGCCAAATCTACGA // GCAGTGGTGGTTTCGAACAGACAA 5. phi109188 5.03 AAAG AAGCTCAGAAGCCGGAGC //
GGTCATCAAGCTCTCTGATCG 6. phi299852 6.07 AGC GATGTGGGTGCTACGAGCC //
AGATCTCGGAGCTCGGCTA 7. phi328175 7.04 AGG GGGAAGTGCTCCTTGCAG // CGGTAGGTGAACGCGGTA 8. phi233376 8.09 CCG CCGGCAGTCGATTACTCC //
CGAGACCAAGAGAACCCTCA
9. phi065 9.03 CACTT AGGGACAAATACGTGGAGACACAG // CGATCTGCACAAAGTGGAGTAGTC 10. umc1196 10.07 CACACG CGTGCTACTACTGCTACAAAGCGA //
AGTCGTTCGTGTCTTCCGAAACT 11. phi109642 2.03-2.04 ACGG CTCTCTTTCCTTCCGACTTTCC //
GAGCGAGCGAGAGAGATCG 12. phi101049 2.10 AGAT CCGGGAACTTGTTCATCG //
CCACGTCCATGATCACACC 13. phi102228 3.06 AAGC ATTCCGACGCAATCAACA //
TTCATCTCCTCCAGGAGCCTT
14. phi093 4.08 AGCT AGTGCGTCAGCTTCATCGCCTACAAG // AGGCCATGCATGCTTGCAACAATGGATACA 15. umc1153 5.09 (TCA)4 CAGCATCTATAGCTTGCTTGCATT //
TGGGTTTTGTTTGTTTGTTTGTTG 16. phi423796 6.01 AGATG CACTACTCGATCTGAACCACCA //
CGCTCTGTGAATTTGCTAGCTC 17. phi114 7.03 GCCT CCGAGACCGTCAAGACCATCAA //
AGCTCCAAACGATTCTGAACTCGC 18. phi420701 8.00 CCG GATGTTTCAAAACCACCCAGA //
ATGGCACGAATAGCAACAGG 19. phi448880 9.06-9.07 AAG CGATCCGGAGGAGTTCCTTA //
CCATGAACATGCCAATGC
20. phi96342 10.02 ATCC GTAATCCCACGTCCTATCAGCC // TCCAACTTGAACGAACTCCTC * Sumber: Applied Biotechnology Center at CIMMYT, Mexico
Pelaksanaan Percobaan di Laboratorium
Biji ditanam sebanyak 10 individu untuk masing-masing galur pada baki menggunakan media tanah. Materi tanaman yang digunakan untuk ekstraksi DNA adalah tanaman yang berumur 10 sampai 15 hari setelah tanam. Bagian tanaman yang diambil adalah daun muda yang telah membuka sempurna sebanyak 5 - 10 individu tanaman dipotong-potong kecil, dicampur kemudian ditimbang 0.4 g per sampel, dimasukkan ke dalam mortal dan ditambahkan larutan buffer CTAB 1,7 ml sebagai pengganti nitrogen cair mengikuti prosedur Khanet al. (2004).
Isolasi DNA
Sampel digerus sampai halus, masukkan ke dalam tabung mikro, tambahkan 2-mercaptoethanol 10µl, masukkan ke dalam water bath (CTAB panas) dengan suhu berkisar 60º-65º C selama 60 menit dan setiap 15 menit membolak-balik tabung atau cukup menjentikkannya dengan jari agar larutan tecampur dengan baik agar proses perusakan sel berjalan sempurna. Protein diekstraksi menggunakan chloroform-isoamil alkohol dan kompleks CTAB-DNA diendapkan menggunakan isopropanol 700 µl. Protein diekstraksi dengan menggunakan chloroform-isoamil alkohol dan kompleks CTAB-DNA diendapkan dengan menggunakan isopropanol atau etanol absolut. Pelet DNA dihasilkan melalui sentrifuge, kemudian dicuci, dikeringkan dan dilarutkan kembali. Pemurnian dilakukan untuk memisahkan DNA dari RNA, polisakarida, polifenol, dan kotoran-kotoran lain yang ikut di dalamnya. Prosedur pemurnian dengan perlakuan RNAse dan pengendapan ammonium asetat sehingga akan mengeluarkan RNA dan beberapa polisakarida. Kuantitas dan kualitas DNA hasil ekstraksi diukur berdasarkan standar λ-DNA melalui proses elektroforesis horizontal, dengan menggunakan gel agarose 0,9%.
Amplifikasi dan Visualisasi Pola Pita DNA
Komposisi reaksi PCR, konsentrasi akhir, dan volume (Lampiran 1). Reaksi PCR (coctail) dibuat pada mikroplate mikrotiter 96-sumur dengan menggunakan mesin PCR dari Biorad. Reaksi PCR diambil 8,5 μl dengan pipet mikro (multichannel) dan dimasukkan ke dalam sumur yang telah berisi DNA dari genotipe-genotipe yang diuji masing-masing 1,5 μl. Larutan tersebut masing-masing ditutup dengan satu tetes
mineral oil, kemudian mikroplate ditutup dengan plester aluminium. Proses amplifikasi terdiri atas beberapa tahap (Lampiran 2) yaitu tahap denaturasi 1 menit pada 94oC yang diikuti oleh touch downprofil. Profil ini dimulai dengan 2 siklus selama 1 menit pada 94oC, 1 menit pada 65oC, dan 2 menit pada 72oC. Temperatur annealing kemudian diturunkan dari 1oC setiap dua siklus hingga berakhir pada saat temperatur annealing tercapai. Siklus terakhir diulang 29 kali dan berakhir dengan siklus pemanjangan pada 4oC. Setelah amplifikasi selesai maka dikeluarkan dari mesin PCR. Reaksi dihentikan dengan memasukkan 4lloading dyeataustop solution (70% glicerol, 20 mM EDTA, 0,2% SDS, 0,6 mg/ml bromphenol blue) pada masing-masing sumur. Proses amplifikasi, pemisahan DNA pada PAGE 4,5% (Polyacrylamide Gel Electrophoresis) menggunakan sistem sequigen 38 x 40 cm dan protokol Bio-Rad Laboratories Inc. Hercules, CA, USA. Pita-pita DNA dideteksi melalui proses silver staining menggunakan protokol sistem sekuensing DNAPromega Silver Sequence.
Pengamatan Data Molekuler
Analisis data molekuler dilakukan berdasarkan hasil skoring pita DNA yang muncul pada plate. Pita DNA diberi skor berdasarkan penampilan pita DNA ditransformasi ke dalam kode data biner dengan cara: jika ada pita diberi skor satu (1) dan jika tidak ada pita diberi skoring nol (0). Pita yang tidak sempurna dan tidak jelas diberi skor 9 (missing data). Jika ada galur yang menghasilkan banyak pita maka pita yang paling jelas diberi skor ‘1’sedangkan yang lainnya diberi skor ‘9’.Data pada kolom menunjukkan inbrida sedangkan baris menunjukkan lokus SSRs.
Analisis Data Genotipik
Analisis data molekuler dilakukan berdasarkan hasil skoring pita DNA yang muncul pada plate,hasil skoring dalam bentuk data biner. Tingkat polimorfisme (PIC = Polimorphism Information Content) dari primer yang digunakan dihitung untuk masing-masing marka SSRs (Smithet al. 1997), dengan formula:
n i f PIC 1 2 1 i =
1,2,3,………n , dimana fi2 adalah frekuensi alel ke-i. Koefisien korelasi kofenitik (r) dihitung dengan menggunakan program NTSYS 2.1.
Analisis Tingkat Heterosigositas
Salah satu kelebihan dari metode SSRs adalah deteksinya kodominan sehingga lokus yang heterozigot akan dapat dibedakan dari lokus homozigot. Lokus yang homozigot akan mucul hanya satu pita/alel per primer per genotipe. Jika lebih dari satu alel berarti lokus tersebut heterozigot. Analisis ini penting untuk menghindari terseleksinya genotipe-genotipe dengan tingkat heterosigositas yang tinggi dimana pada pengamatan secara fenotipik tidak terdeteksi karena pengaruh faktor lingkungan. Tingkat heterosigositas untuk setiap genotipe dapat diketahui dengan formula:
100% x digunakan yang SSRs lokus Total t heterozigo lokus Jumlah sitas heterozigo Persentase
Untuk memperoleh hasil analisis data yang lebih akurat, maka dalam penelitian ini hanya genotipe yang mempunyai tingkat heterozigositas <20% yang dianalisis lebih lanjut.
Estimasi Kekerabatan Genetik dan Analisis Klaster
Tingkat kemiripan genetik (GS=genetik similarity) diestimasi dengan menggunakan koefisien Jaccard (Rohlf 2000) dengan formula:
u n m S , dimana m
= jumlah pita (alel) DNA yang sama posisinya, n = total pita (alel) DNA, dan u = jumlah pita (alel) DNA yang tidak sama posisinya. Kemiripan genetik dianalisis dengan menggunakan software NTSYS-pc versi 2.1 (Rohlf 2000). Analisis matriks jarak genetik diperoleh dari hasil analisis kemiripan genetik (Lee 1998), dengan formula: S = 1 –GS, dimana S = jarak genetik, GS = Kemiripan genetik (genetik similarity). Analisis Boot-Strapping dilakukan untuk mengetahui tingkat kepercayaan pengelompokan dengan menggunakan program WinBoot. Koefisien korelasi kofenetik (r) juga dihitung yang dilanjutkan dengan uji Mantel (Mantel 1967) untuk melihat goodness of fit dari hasil analisis klaster. Principal Coordinate Analysis(PCA) (Dillon and Goldstein 1984), dilakukan untuk mengetahui posisi relatif dari galur yang dianalisis pada ruang dua dimensi.
Analisis Komponen Utama (Principal Component Analysis= PCA)
Analisis komponen utama digunakan untuk menggambarkan posisi relatif dari genotipe yang diidentifikasi melalui program NTSYS. Namun jika ada missing data maka yang digunakan adalah analisis koordinat utama (Principal Coordinate Analysis = PCOORDA) (Prasanna 2002), yang merupakan bagian dari analisis komponen utama. Selain itu analisis komponen utama digunakan untuk mengetahui primer-primer yang berperanan dalam pembentukan dendrogram. Komponen utama dari peubah data asal diperoleh dari matriks varians-kovarians peubah asalnya. Skor komponen utama untuk setiap pengamatan dihitung melalui persamaan:
x x Y a
x xa
Yh1 1 h ,... hk k h dimana Yh1 = skor komponen ke-1 dari obyek pengamatan ke-h, a1= vektor pembobot komponen utama ke-1 dan Xh= vector data pengamatan dari obyek ke-h dan X = vektor nilai rata-rata dari variabel asal (Dillon dan Goldstein, 1984).
Percobaan 2: Korelasi Antara Tingkat Kemiripan Berdasarkan Penampilan Morfologi dengan Kemiripan Genetik Berdasarkan Pola Pita DNA.
Bahan Genetik:
Materi genetik yang terseleksi memiliki nilai jarak genetik jauh berdasarkan hasil analisis keragaman genetik di Laboratorium sebanyak 10 galur
No. Materi genetik Populasi Asal Warna/Tipe biji Jarak Genetik 1. PTBC4-7-5-BB Tuxpeno/Pulut Takalar Putih/Semiflint 0,58 2. PTBC4-9-3-BB Tuxpeno/Pulut Takalar Putih/Semiflint 0,54 3. PTBC4-17-1-BB Tuxpeno/Pulut Takalar Putih/Semiflint 0,60 4. PTBC4-10-1-BB Tuxpeno/Pulut Takalar Putih/Semiflint 0,59 5. PTBC4-15-1-BB Tuxpeno/Pulut Takalar Putih/Semiflint 0,65 6. PTBC4-20-1-BB Tuxpeno/Pulut Takalar Putih/Semiflint 0,71 7. PTBC4-22-2-BB Tuxpeno/Pulut Takalar Putih/Semiflint 0,62 8. MSP2(10)-82-1-BB Populasi Pulut Sul-Sel Putih/flint 0,73 9. MSP2(10)-113-1-BB Populasi Pulut Sul-Sel Putih/flint 0,66 10. MSP2(10)-125-2-BB Populasi Pulut Sul-Sel Putih/flint 0,66
Pelaksanaan di Lapangan:
Materi genetik 10 galur jagung pulut di tanam di Lapangan masing-masing galur pada barisan terpisah menggunakan jarak tanam 0,75 x 0,20 m panjang 5 m dan di ulang
sebanyak tiga kali, benih sebelum ditanam diberikan perlakuan dengan metalaksil untuk mencegah penyakit bulai (Perenosclerospora maydis), saat tanam lubang tanam diberi karbofuran untuk mencegah serangan ulat bibit, penanaman dilakukan dengan menggunakan sistem tugal, pemupukan pertama diberikan saat tanaman berumur tujuh hari setelah tanam dengan takaran pemupukan 150 kg/ha Urea, 200 kg/ha SP36, dan 100 kg/ha KCL, dengan menugal disamping tanaman, pemupukan kedua diberikan saat tanaman berumur 30 hari setelah tanam dengan takaran pemupukan 150 kg/ha Urea.
Pengamatan Data Morfologi
Pengamatan utama morfologi dilakukan meliputi 10 variabel pengamatan meliputi: tinggi tanaman (cm), tinggi letak tongkol (cm), diameter batang (cm), lingkar batang (cm), luas daun (cm), panjang daun (cm), dan lebar daun (cm).
Analisis Korelasi Antara Tingkat Kemiripan Berdasarkan Penampilan Morfologi dengan Kemiripan Genetik Berdasarkan Pola Pita DNA
Data hasil pengamatan morfologi diperoleh data-data yang akan digunakan untuk menghitung kesamaan matriks jarak dari dua genotipe yang dibandingkan. Untuk mengurangi pengaruh skala pengukuran dan kategori yang berbeda dari karakter-karakter yang berbeda digunakan prosedur standarisasi, dengan mentransformasi data melalui prosedur STAND pada program NTSYS, yang pada prinsipnya adalah nilai observasi setiap karakter dikurangi nilai rata-rata karakter tersebut dibagi standard deviasi (Beer et al. 1993; Antrique et al. 1996; Tatineni et al. 1996; Rohfl 1993; Suskandari 2002).
Keselarasan antara penampilan morfologi dengan pola pita DNA, matrik rata-rata jarak taksonomi dan matrik kemiripan genetik dibandingkan melalui uji korelasi product-moment dari Pearson fungsi MXCOMP pada program NTSYS (Smouse et al. 1986 dikutip Beer et al. 1993). Korelasi antara pasangan dua matrik diuji dengan statistik Mantel (Mantel 1967dikutipBeeret al.1993) yang dihitung sebagai berikut:
j kxjkyjk
Z , Keterangan xjk : elemen baris matrik ke j dan kolom ke k dari Xnxn
yjk : elemen baris matrik ke j dan kolom ke k dari Ynxn
Pada fungsi MXCOMP, distribusi Z untuk nilai x dan y tertentu diturunkan dengan menghitung Z untuk setiap permutasi matrik yang mungkin sehingga persentil Z observasi dapat diestimasi. Nilai Z kemudian ditransformasi melalui normalisasi statistik Mantel yang ekuivalen dengan koefisien korelasi product-moment Pearson untuk x dan y (Smouse et al. 1986 dikutip Beer et al. 1993 dikutip Suskandari 2002) dengan rumus:
j k jk jk y xZ , Keterangan xjk : hasil transformasi xjk yjk : hasil transformasi yjk
Jika baik x maupun y berdistribusi normal dan koefisien korelasi populasi sama dengan 0 maka nilai tr(n-2)1/2/(1r2)1/2 berdistribusi sebagai Student’st(Snedecordan Cochran 1989dikutipBeeret al. 1993).
Hipotesis :
H0: nilai xjktidak berkorelasi dengan nilai yjk H1: nilai xjkberkorelasi dengan nilai yjk Dasar pengambilan keputusan:
1. Jika probabilitas > 0.05, maka H0diterima Jika probabilitas≤ 0.05,maka H0ditolak 2. Jika t hitung < t (n-2;α/2),maka H0diterima
Jika t hitung > t (n-2;α/2),maka H0ditolak
Keselarasan pengelompokan ditentukan dari kriteria goodness of fit berdasarkan nilai korelasi menurut Rohlf (2000) yang disajikan pada Tabel 6.
Tabel 6 Kriteriagoodness of fitberdasarkan nilai korelasi
Level Kriteriagoodness of fit
0.9≤ r 0.8≤ r< 0.9 0.7≤ r< 0.8 r < 0.7 Sangat baik Baik Lemah Sangat lemah
HASIL DAN PEMBAHASAN
Analisis keragaman ini merupakan studi untuk menduga keragaman genetik galur jagung pulut (waxy corn) sebagai kandidat tetua hibrida yang kemungkinan menghasilkan heterosis tinggi. Fuzatto et al. (2002) menyatakan bahwa heterosis dan kemampuan daya gabung khusus dari dua populasi persilangan tergantung pada keberadaan gen dengan aksi dominan yang mengontrol karakter, dan keragaman di antara populasi. Pada saat tetua diseleksi pada sejumlah populasi, preferensi harus diberikan pada tetua-tetua yang berbeda dan sudah beradaptasi.
Profil marka mikrosatelit. Kegiatan ini merupakan studi untuk memprediksi galur jagung pulut (waxy corn) yang kemungkinan menghasilkan heterosis tinggi. Gambar 3 adalah salah satu lokus SSRs yang memperlihatkan variasi genetik dari inbrida yang dikarakterisasi. Untuk menghasilkan data dengan validasi tinggi maka primer yang menghasilkan missing data >10% dikeluarkan. Hal yang sama juga dilakukan terhadap galur-galur yang menghasilkan tingkat heterosigositas >20% dikeluarkan. Pada kegiatan ini tidak terdapat primer yang menghasilkan missing data >10%. Terdapat satu galur dalam kondisi heterosigous >20% yaitu MSP2(10)-105-1-B sehingga galur tersebut tidak diikutkan dalam analisis lebih lanjut.
Gambar 3 Visualisasi pola pita DNA menggunakan marka SSRs phi109188 melalui elektroforesis vertikal 4,5% PAGE (Polyacrylamide Gel Electrophoresis).
No.1,2,3,…39 adalah galuryang dikarakterisasidengan kisaran 200-151 bp.
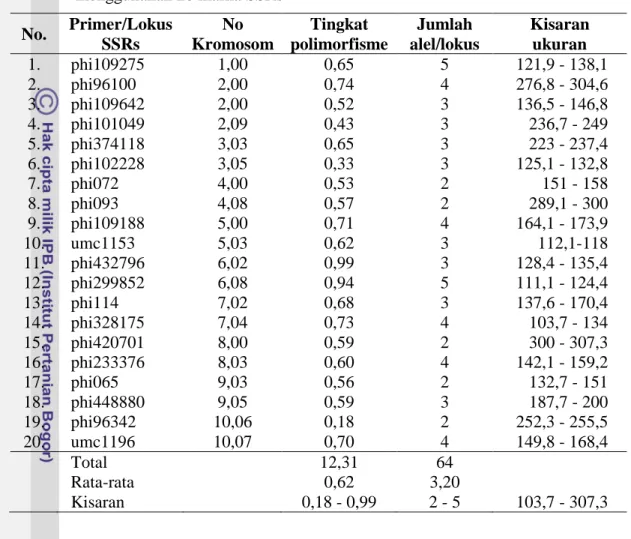
Profil data 20 marka mikrosatelit untuk galur jagung pulut menunjukkan tingkat polimorfisme dari 0,18–0,99 dengan rata-rata 0,62. Total alel yang diperoleh sebanyak 64 berkisar dari 2 - 5 dengan nilai rata-rata 3.20 alel/lokus. Koefisien korelasi kofenetik (r) sebesar 0,87 tergolong cukup baik (good fit) terhadap matriks kemiripan genetik. Kisaran basa berkisar dari 103,7 sampai 307,3 bp (Tabel 7). Menunjukkan keragaman
phi109188
genetik yang tinggi berdasarkan kode pedigree terhadap Koleksi galur yang dikarakterisasi.
Tabel 7 Profil data marka mikrosatelit hasil karakterisasi pada galur jagung pulut menggunakan 20 marka SSRs No. Primer/Lokus SSRs No Kromosom Tingkat polimorfisme Jumlah alel/lokus Kisaran ukuran 1. phi109275 1,00 0,65 5 121,9 - 138,1 2. phi96100 2,00 0,74 4 276,8 - 304,6 3. phi109642 2,00 0,52 3 136,5 - 146,8 4. phi101049 2,09 0,43 3 236,7 - 249 5. phi374118 3,03 0,65 3 223 - 237,4 6. phi102228 3,05 0,33 3 125,1 - 132,8 7. phi072 4,00 0,53 2 151 - 158 8. phi093 4,08 0,57 2 289,1 - 300 9. phi109188 5,00 0,71 4 164,1 - 173,9 10. umc1153 5,03 0,62 3 112,1-118 11. phi432796 6,02 0,99 3 128,4 - 135,4 12. phi299852 6,08 0,94 5 111,1 - 124,4 13. phi114 7,02 0,68 3 137,6 - 170,4 14. phi328175 7,04 0,73 4 103,7 - 134 15. phi420701 8,00 0,59 2 300 - 307,3 16. phi233376 8,03 0,60 4 142,1 - 159,2 17. phi065 9,03 0,56 2 132,7 - 151 18. phi448880 9,05 0,59 3 187,7 - 200 19. phi96342 10,06 0,18 2 252,3 - 255,5 20. umc1196 10,07 0,70 4 149,8 - 168,4 Total 12,31 64 Rata-rata 0,62 3,20 Kisaran 0,18 - 0,99 2 - 5 103,7 - 307,3
Struss dan Plieske (1998) mengemukakan bahwa tingginya tingkat polimorfisme juga dipengaruhi oleh tingkat polimorfisme marka SSRs yang digunakan. Oleh karena itu pemilihan marka polimorfisme yang tinggi mempunyai kontribusi terhadap nilai Polimorphism Information Content (PIC). Penggunaan primer yang lebih banyak dengan tingkat plimorfisme tinggi diharapkan dapat memberikan pengelompokan yang lebih konprehensif. Chen et al. (2000) menyatakan bahwa data molekuler sangat tergantung pada pemilihan primer yang digunakan.
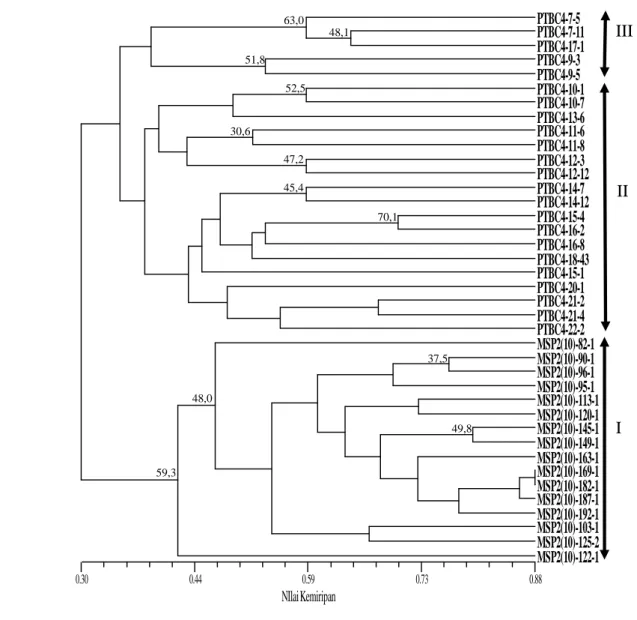
Hasil analisis menggunakan program NTSYS 2.1 berdasarkan UPGMA menghasilkan dendrogram seperti pada Gambar 4. yang menunjukkan terdapat tiga klaster yang dicirikan oleh galur dengan kode pedigree hampir sama. Setiap klaster memperlihatkan bahwa inbrida tersebut dibentuk dari populasi yang sama sehingga
tingkat kekerabatannya sangat dekat. Dominasi inisial inbrida yang sama membentuk klaster besar dan dapat dikatakan bahwa terdapat kesesuaian antara data molekuler dengan kode pedigree.
Gambar 4 Dendogram 39 galur jagung pulut menggunakan 20 marka SSRs dan dikonstruksi berdasarkan koefisien kemiripan Jaccard
Analisis keragaman genetik berguna untuk mengetahui pola pengelompokan populasi genotipe yang dimiliki dan untuk mengetahui karakter penciri setiap kelompok genotipe yang terbentuk sehingga dapat digunakan dalam kegiatan seleksi tetua untuk perakitan varietas unggul baru. Tingkat keakuratan pengelompokan dalam penelitian ini cukup tinggi, ditunjukkan dengan nilai koefisien korelasi kofenetik (r) sebesar 0,88
NIlaiKemiripan 0.30 0.44 0.59 0.73 0.88 MSP2(10)-103-1 PTBC4-7-5 PTBC4-7-11 PTBC4-17-1 PTBC4-9-3 PTBC4-9-5 PTBC4-10-1 PTBC4-10-7 PTBC4-13-6 PTBC4-11-6 PTBC4-11-8 PTBC4-12-3 PTBC4-12-12 PTBC4-14-7 PTBC4-14-12 PTBC4-15-4 PTBC4-16-2 PTBC4-16-8 PTBC4-18-43 PTBC4-15-1 PTBC4-20-1 PTBC4-21-2 PTBC4-21-4 PTBC4-22-2 MSP2(10)-82-1 MSP2(10)-90-1 MSP2(10)-96-1 MSP2(10)-95-1 MSP2(10)-113-1 MSP2(10)-120-1 MSP2(10)-145-1 MSP2(10)-149-1 MSP2(10)-163-1 MSP2(10)-169-1 MSP2(10)-182-1 MSP2(10)-187-1 MSP2(10)-192-1 MSP2(10)-103-1 MSP2(10)-125-2 MSP2(10)-122-1 III II I 63,0 48,1 51,8 52,5 30,6 47,2 45,4 70,1 37,5 48,0 49,8 59,3
yang tergolong good fit untuk kelompok galur jagung pulut yang ditangani. Hal ini menggambarkan bahwa tingkat akurasi pengelompokan secara genetik dengan jumlah primer yang digunakan sangat akurat atau semua primer polimorfis. Pejic et al. (1998) mengemukakan bahwa nilai r menggambarkan akurasi pengelompokan secara genotipeik, yang dapat dihasilkan berdasarkan pendugaan kemiripan genetik di antara galur yang dikarakterisasi dengan jumlah primer yang digunakan. Vaz Patto et al. (2004) menyatakan bahwa indeks yang ideal untuk korelasi kofenetik yang menggambarkan keakuratan kelompok heterotik adalah >0,56.
Semakin tinggi tingkat kepercayaan pengelompokan berarti semakin kuat kemiripan genetik dari galur dalam kelompok tersebut. Dengan demikian peluang inbreeding akan semakin tinggi jika dilakukan persilangan satu dengan yang lain dalam kelompok. Oleh karena itu sebaiknya tidak dilakukan persilangan dalam kelompok yang sama tersebut. Menurut Warburton et al. (2005) galur-galur tidak terklaster berdasarkan fenotipe, adaptasi lingkungan, tipe atau warna biji, umur panen, atau respon heterotik, tapi galur-galur yang berkerabat secara pedigree biasanya berada pada klaster yang sama.
Dendrogram 39 galur jagung pulut menggunakan 20 marka SSRs, menghasilkan tiga klaster. Klaster yang sama dicirikan oleh galur dengan kodepedigreehampir sama. Hal tersebut memperlihatkan bahwa galur tersebut dibentuk dari populasi yang sama sehingga tingkat kekerabatannya lebih dekat. Klaster I merupakan kelompok kedua terbesar, terdiri dari 16 galur dan didominasi oleh galur dengan inisial pedigree MSP2. Klaster II merupakan kelompok terbesar, terdiri dari 18 galur dan didominasi oleh galur dengan inisial pedigree PTBC4. Klaster III merupakan kelompok terkecil, terdiri dari 5 galur dan didominasi oleh galur dengan inisial pedigree PTBC4. Nilai matriks jarak genetik cukup tinggi. Hal ini mengindikasikan bahwa materi genetik berasal dari materi populasi dasar dengan variasi genetik cukup luas dan memberikan peluang besar untuk mendapatkan pasangan tetua hibrida potensial.
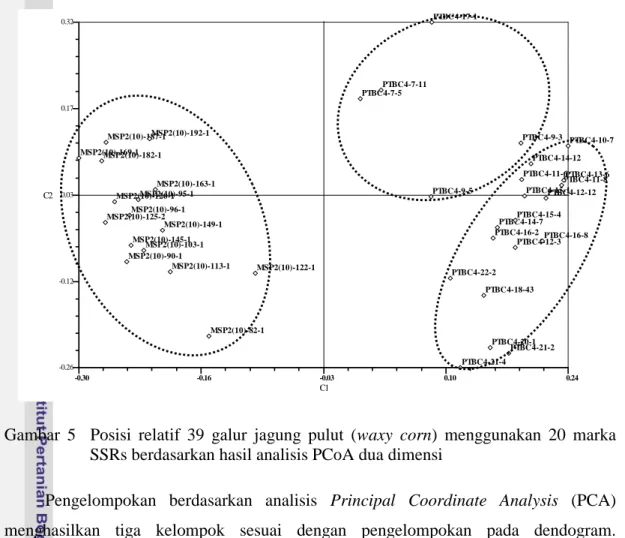
Posisi Relatif Galur Jagung Pulut
Posisi relatif dari masing-masing galur yang dianalisis pada ruang dua dimensi (Gambar 5) memperkecil peluang untuk memasangkan galur satu dengan lainnya dimana galur yang menggerombol bersama dihindari untuk dipasangkan.
Gambar 5 Posisi relatif 39 galur jagung pulut (waxy corn) menggunakan 20 marka SSRs berdasarkan hasil analisis PCoA dua dimensi
Pengelompokan berdasarkan analisis Principal Coordinate Analysis (PCA) menghasilkan tiga kelompok sesuai dengan pengelompokan pada dendogram. Kelompok-kelompok yang terbentuk disebut kelompok heterotik artinya galur yang berada dalam satu kelompok jika disilangkan dengan galur di luar kelompoknya akan memunculkan heterosis.
Dalam proses mencari pasangan tetua hibrida potensial dengan bantuan informasi marka molekuler, pasangan-pasangan tidak potensial dihindari lebih awal untuk efisiensi waktu, tenaga dan dana. Pengujian pasangan-pasangan heterotik di lapangan lebih difokuskan pada potensi genetik dari galur yang terpilih. Analisis gerombol juga digunakan untuk mengetahui hubungan kekerabatan genotipe-genotipe yang diuji (Sumertajayaet al. 2003). Analisis biplot digunakan untuk mengetahui peubah penciri setiap gerombol genotipe. Sumertajaya et al. 2003 juga menyebutkan bahwa analisis biplot dapat digunakan untuk mengetahui kemiripan atau kedekatan relatif antar obyek pengujian (gerombol genotipe) dan keragaman setiap peubah.
Untuk melihat keselarasan antara data karakter morfologi dengan pola pita SSRs, dilakukan pengujiangoodness of fitdengan menggunakan analisis korelasi antara matrik
C1 -0.30 -0.16 -0.03 0.10 0.24 C2 -0.26 -0.12 0.03 0.17 0.32 PTBC4-7-5PTBC4-7-11 PTBC4-17-1 PTBC4-9-3 PTBC4-9-5 PTBC4-10-1 PTBC4-10-7 PTBC4-11-6 PTBC4-11-8 PTBC4-12-3 PTBC4-12-12 PTBC4-13-6 PTBC4-14-7 PTBC4-14-12 PTBC4-15-1 PTBC4-15-4 PTBC4-16-2 PTBC4-16-8 PTBC4-18-43 PTBC4-20-1 PTBC4-21-2 PTBC4-21-4 PTBC4-22-2 MSP2(10)-82-1 MSP2(10)-90-1 MSP2(10)-95-1 MSP2(10)-96-1 MSP2(10)-103-1 MSP2(10)-113-1 MSP2(10)-120-1 MSP2(10)-122-1 MSP2(10)-125-2 MSP2(10)-145-1 MSP2(10)-149-1 MSP2(10)-163-1 MSP2(10)-169-1MSP2(10)-182-1 MSP2(10)-187-1MSP2(10)-192-1
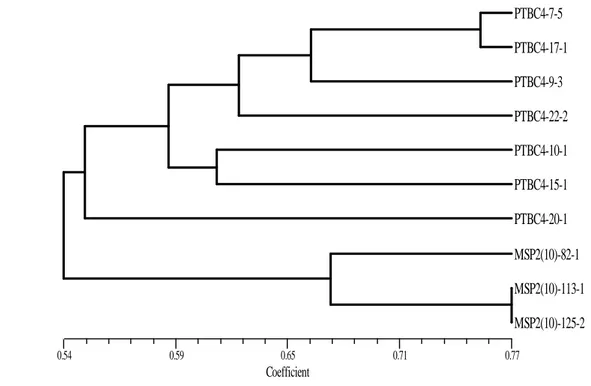
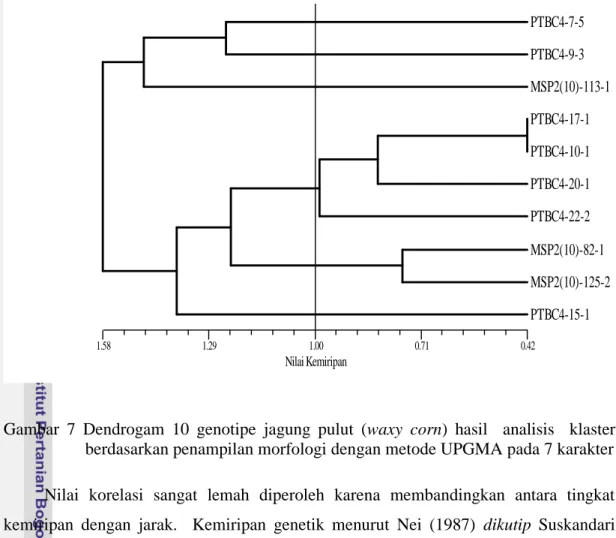
jarak morfologi dengan matrik tingkat kemiripan genetik. Analisis dilakukan pada 10 genotipe. Dengan membandingkan antara dendrogram berdasarkan pola pita SSRs (Gambar 6) dengan dendogram berdasarkan morfologi (Gambar 7) terhadap 10 genotipe dengan hasil pengelompokan yang tidak konsisten. Genotipe dengan kode pedigree yang sama berdasarkan morfologi tidak berada pada satu kelompok, sedang berdasarkan pola pita SSRs masing-masing mengelompok sendiri sesuai dengan kodepedigree.
Coefficient 0.54 0.59 0.65 0.71 0.77 MSP2(10)-113-1 PTBC4-7-5 PTBC4-17-1 PTBC4-9-3 PTBC4-22-2 PTBC4-10-1 PTBC4-15-1 PTBC4-20-1 MSP2(10)-82-1 MSP2(10)-113-1 MSP2(10)-125-2
Gambar 6 Dendrogram 10 galur jagung pulut (waxy corn) hasil analisis klaster berdasarkan pola pita DNA dengan metode UPGMA menggunakan 20 praimer SSRs.
Perbedaan kelompok beberapa genotipe antara dendrogram berdasarkan morfologi dan pola pita DNA tersebut kemungkinan terjadi karena persentase genom yang terwakili masih sedikit atau masing-masing penanda mengungkap daerah genom yang berbeda. Apabila kedua matrik jarak taksonomi dikorelasikan dengan matrik tingkat kemiripan berdasarkan pola pita DNA (Tabel 8) dan diuji dengan statistik Z Mantel dihasilkan korelasi (r) yang digunakan untuk melihat kesesuaian atau keselarasan dua dendrogram. Korelasi antara matrik kemiripan berdasarkan pola pita DNA dengan matrik kemiripan berdasarkan morfologi data kualitatif biner adalah 0,071. Berdasarkan kriteriagoodness of fitmaka nilai korelasi tersebut tergolong sangat lemah.
Nilai Kemiripan 0.42 0.71 1.00 1.29 1.58 MSP2(10)-113-1 PTBC4-7-5 PTBC4-9-3 MSP2(10)-113-1 PTBC4-17-1 PTBC4-10-1 PTBC4-20-1 PTBC4-22-2 MSP2(10)-82-1 MSP2(10)-125-2 PTBC4-15-1
Gambar 7 Dendrogam 10 genotipe jagung pulut (waxy corn) hasil analisis klaster berdasarkan penampilan morfologi dengan metode UPGMA pada 7 karakter
Nilai korelasi sangat lemah diperoleh karena membandingkan antara tingkat kemiripan dengan jarak. Kemiripan genetik menurut Nei (1987) dikutip Suskandari (2002) adalah merupakan kebalikan dari jarak genetik yang secara luas menunjukkan kemiripan sifat dari dua aksesi tanaman.
Menurut Beer et al. (1993) dikutip Suskandari (2002) rendahnya nilai korelasi menunjukkan bahwa hubungan antara dua peubah lemah dan tidak linier. Beberapa peneliti telah menguji keselarasan pengelompokan antara penanda morfologi dengan penanda molekuler dalam mengevaluasi aksesi plasma nutfah. Secara umum sebagian besar gagal memperoleh pengelompokan yang selaras. Sebagai contoh nilai korelasi yang rendah diperoleh antara pengelompokan berdasarkan penanda morfologi dengan penanda molekuler pada tanaman gandum yaitu 0.47, p < 0.01 (Autrique et al. 1996), tanaman Oat (Avena sterilis)–0.35, p≤ 0.005 (Beeret al. 1993), dan tanaman buncis (Phaseolus vulgaris L.) 0.386, p < 0.001 (Johnset al. 1997).
Tabel 8 Matrik rata-rata jarak taksonomi diantara genotipe jagung pulut berdasarkan penampilan morfologi (di bawah diagonal) dan matrik tingkat kemiripan genetik berdasarkan pola pita DNA (di atas diagonal).
Genotipe 1 2 3 4 5 6 7 8 9 10 PTBC4-7-5BB 0,57 0,85 0,38 0,42 0,42 0,09 0,75 0,22 0,61 PTBC4-9-3BB 1,24 0,09 0,85 0,85 0,42 0,38 0,25 0,74 0,90 PTBC4-17-1BB 1,58 1,39 0,85 0,38 0,14 0,61 0,75 0,22 0,66 PTBC4-10-1BB 1,66 1,22 0,41 0,61 0,38 0,90 0,00 0,98 0,14 PTBC4-15-1BB 1,40 1,61 1,10 1,35 0,38 0,61 0,50 0,22 0,42 PTBC4-20-1BB 1,25 1,06 0,90 0,74 1,48 0,61 0,25 0,22 0,66 PTBC4-22-2BB 2,09 1,59 1,02 0,80 1,54 1,12 0,00 0,71 0,14 MSP2(10)-82-1BB 2,30 1,79 1,05 1,08 1,65 1,71 1,56 0,10 0,00 MSP2(10)-113-1BB 1,59 1,34 1,21 1,24 1,74 1,52 1,98 1,28 0,67 MSP2(10)125-2BB 1,98 1,64 0,81 0,93 1,12 1,39 1,26 0,75 1,54 Keterangan: (1) 7-5BB, (2) 9-3BB, (3) 17-1BB, (4) 10-1BB, (5) PTBC4-15-1BB, (6) PTBC4-20-1BB, (7) PTBC4-22-2BB, (8) 82-1BB, (9) MSP2(10)-113-1BB, dan (10) MSP2(10)125-2BB
Menurut Tatineniet al. (1996)dikutipSuskandari (2002) nilai korelasi yang tinggi diperoleh jika penanda morfologi yang digunakan merupakan karakter yang mempunyai daya waris yang tinggi dan stabil. Selain itu genom yang terwakili oleh masing-masing penanda dalam mengungkap polimorfisme diperoleh hasil yang sebagian besar sama. Namun demikian, walaupun morfologi yang diamati memiliki nilai heritabilitas yang tinggi dan stabil, apabila genom yang terungkap diperoleh polimorfisme yang berbeda, tidak akan diperoleh pengelompokan yang selaras. Selain itu menurut Ladizinsky (1992) studi taksonomi dilakukan berdasarkan pada morfologi, namun afinitas diantara taksa tidak selalu berkorelasi dengan kemiripan morfologi karena adanya suatu fenomena bahwa dua spesies yang secara genetis berbeda, dapat memiliki morfologi yang sama atau dua spesies yang memiliki morfologi yang sama dapat dimiliki oleh dua spesies yang secara genetis berbeda. Lebih lanjut Birchler et al. (2003) menyatakan bahwa yang menjadi tantangan dalam pengembangan model molekuler untuk heterosis adalah membuat korelasi yang benar antara karakter morfologi dan karakter genotipeik pada galur. Berdasarkan hasil pengujian goodness of fit diperoleh nilai korelasi antara matrik jarak morfologi dengan matrik tingkat kemiripan genetik sangat lemah maka pengambilan keputusan harus memperhatikan kedua karakter tersebut.
KESIMPULAN
1. Rata-rata tingkat polimorfisme dari 20 marka SSRs yang digunakan adalah 0,62 dan diperoleh total alel 64 dengan rata-rata 3,20 alel/lokus serta nilai koefisien korelasi kofenitik (r) 0,87 yang tergolong good fit (kelompok galur jagung pulut yang ditangani).
2. Pengelompokan galur berdasarkan marka SSRs memperoleh tiga klaster atau kelompok heterotik. Satu kelompok memiliki kode pedigree sama mengelompok tersendiri, galur lain dengan kode pedigree yang mirip terbagi menjadi dua kelompok.
3. Pengelompokan galur berdasarkan marka SSRs dan pengelompokan berdasarkan kemiripan morfologi memiliki nilai korelasi sangat lemah.
4. Galur yang dapat direkomendasikan untuk dipasangkan dengan galur lainnya adalah galur pada posisi klaster yang berbeda.