brasiliensis
KLON PB 260
RESTI ARIANTARI
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2009
RESTI ARIANTARI. Ekspresi Gen ACC Oksidase akibat Pemberian Etilena
Eksogen dan Pelukaan pada
Hevea brasiliensis
Klon PB 260. Dibimbing oleh
EDY DJAUHARI P K dan TETTY CHAIDAMSARI.
Tingginya permintaan dunia akan karet alam menyebabkan para peneliti
melakukan upaya dalam meningkatkan produksi karet alam maupun mencari atau
menghasilkan klon-klon unggul yang tahan terhadap penyakit dan mempunyai
produksi yang tinggi. Pada penelitian ini klon yang digunakan adalah PB 260
yang berasal dari hasil persilangan klon primer dan klon sekunder. Klon ini
memiliki laju metabolisme lateks yang tinggi tetapi kurang responsif terhadap
stimulan. Upaya meningkatkan produksi karet alam adalah dengan perlakuan
penyadapan dan penggunaan stimulan etefon.
Etefon adalah senyawa 2-
chloro-ethylposphonic acid
(CEPA) yang digunakan sebagai stimulan atau perangsang
untuk meningkatkan produksi hormon etilena endogen pada tanaman karet. Gen
Hb
ACO1
akan diuji ekspresinya terhadap pemberian etefon dan pengaruh
pelukaan pada kulit batang dan lateks tanaman karet.
Penelitian ini bertujuan
mempelajari pola ekspresi gen
Hb
ACO1 terhadap pengaruh pelukaan dan
pemberian stimulan akibat penyadapan pada berbagai tahap perkembangan
tanaman. Hasil penelitian menunjukkan gen
Hb
ACO1 hanya berekspresi pada
kulit batang tanaman karet, tidak pada lateks. Perlakuan yang baik untuk kulit
batang tanaman karet adalah 2 hari sekali penyadapan dan 3 kali dalam setahun
pemberian stimulan. Ekspresi gen
Hb
ACO1 lebih dipengaruhi oleh penyadapan
RESTI ARIANTARI. Expression Gene of ACC Oksidase effect of Etilena
Eksogen and Tapping at
Hevea brasiliensis
Clone of PB 260. Under the direction
of EDY DJAUHARI P K and TETTY CHAIDAMSARI.
High request of natural rubber on the world have made researcher to do
increase natural rubber product and also look for or yield good clones holding to
disease and have high production. This research used clone PB 260 coming from
result of cross of primary clone and secondary clone. This clone have fastly of
high latex metabolism but less responsive to stimulan. Effort to increase natural
rubber product with treatment of tapping and usage of etephon stimulan. Etephon
is compound 2-chloro-ethylposphonic acid (CEPA) as incentive or stimulant to
increase produce hormone of ethilene endogen at rubber crop. Gene of HbACO1
will be test its expression of etefon and influence of tapping at bark and latex of
rubber crop. This research aim to study gene expression of HbACO1 to influence
of tapping and giving stimulant at various phase growth of crop. Result of
research show gene of HbACO1 only have expression at bark of rubber crop not
in latex. Treatment which good to bark of rubber crop is 2 day once tapping and 3
times in one year giving stimulant.
brasiliensis
KLON PB 260
RESTI ARIANTARI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Program Studi Biokimia
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Nama : Resti Ariantari
NIM :
G44104028
Disetujui,
Komisi Pembimbing
Drs. Edy Djauhari P.K, M.Si. Dr. Tetty Chaidamsari, M.Si.
Ketua Anggota
Diketahui
Dr. drh. Hasim DEA.
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Puji dan syukur penulis panjatkan kehadirat Allah SWT atas segala rahmat
dan karunia-Nya sehingga penulis dapat menyelesaikan skripsi ini. Skripsi ini
berjudul Ekspresi Gen ACC Oksidase akibat Pemberian Etilena Eksogen dan
Pelukaan pada
Hevea brasiliensis
Klon PB 260.
Penulis mengucapkan terima kasih kepada Bapak Drs. Edy Djauhari P.K,
M.Si selaku pembimbing utama, Ibu Dr. Tetty Chaidamsari, M.Si pembimbing
anggota, Bapak Dr. Darmono Taniwiryono, M.Sc sebagai Kepala Balai Penelitian
Bioteknologi Perkebunan Indonesia dan seluruh staf di Laboratorium Biologi
Molekuler dan Rekayasa Genetika, Balai Penelitian Bioteknologi Perkebunan
Indonesia. Terima kasih juga penulis ucapkan kepada teman-teman Biokimia 41
yang telah memberikan banyak dukungan dan perhatiannya. Tak lupa penulis
ucapkan terima kasih kepada orang tua dan adik-adik yang selalu memberikan
dukungan, perhatian, kritik, saran, dan dukungan baik secara moril maupun
materil.
Penulis menyadari masih banyak kekurangan dan kesalahan yang harus
diperbaiki, namun penulis berharap semoga skripsi ini dapat memberikan manfaat
bagi yang membacanya.
Bogor, September 2009
RIWAYAT HIDUP
Penulis dilahirkan di Bogor pada tanggal 10 Januari 1986 sebagai putri
pertama dari 6 bersaudara pasangan Tukimin Sanari dan Yeni Sutaryani. Tahun
2004 penulis lulus dari SMU Negeri 6 Bogor dan pada tahun yang sama lulus
seleksi masuk IPB melalui jalur Undangan Seleksi Masuk IPB pada progran studi
Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.
Selama menjadi mahasiswa aktif di IPB, penulis aktif di beberapa
organisasi kemahaiswaan sebagai anggota Unit Kegiatan Mahasiswa Komunitas
Peduli Tanaman Obat (KPTO) Zingiber periode 2005-2006, anggota Biokimia
Medis Community of Research and Education in Biochemistry (CREBs) periode
2005-2006, anggota Biokimia Tumbuhan Community of Research and Education
in Biochemistry (CREBs) periode 2006-2007, dan Unit Kegiatan Mahasiswa
Lingkung Seni Sunda Gentra Kaheman periode 2004-2008. Selain di IPB penulis
aktif pula di organisasi luar kampus, yaitu Daya Mahasiswa Sunda (DAMAS).
DAFTAR ISI
Halaman
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... ix
PENDAHULUAN ... 1
TINJAUAN PUSTAKA
Karet ... 1
Lateks ... 3
Etefon ... 3
Biosintesis Etilena ... 3
ACC Oksidase ... 5
Reverse Transcriptase Polymerase Chain Reaction
(RT-PCR) ... 5
BAHAN DAN METODE
Bahan dan Alat ... 6
Metode Penelitian ... 6
HASIL DAN PEMBAHASAN
Pemilihan Sampel RNA ... 8
Ekspresi
Gen
Hb
ACO1 pada Kulit Batang dan Lateks Tanaman Karet ... 9
Perlakuan Penyadapan terhadap Ekspresi Gen
Hb
ACO1 pada Kulit Batang 9
Perlakuan Pemberian Stimulan terhadap Ekspresi Gen
Hb
ACO1 pada Kulit
Batang ... 9
SIMPULAN DAN SARAN
Simpulan
...
10
Saran
...
10
DAFTAR PUSTAKA ... 10
DAFTAR GAMBAR
Halaman
1 Tanaman karet ... 2
2 Biosintesis etilena pada tanaman ... 4
3 Proses RT-PCR ... 5
4 Elektroforegram RNA total kulit batang dan lateks ... 8
5 Ekspresi gen
Hb
ACO1 pada sampel kulit batang ... 9
6 Perbandingan ekspresi gen
Hb
ACO1 dengan waktu penyadapan ... 9
7 Perbandingan ekspresi gen
Hb
ACO1 dengan waktu pmberian etefon ... 10
DAFTAR LAMPIRAN
Halaman
1 Tahapan penelitian ... 13
2 Pembuatan larutan stok dan pereaksi ... 14
3 Prosedur
elektroforesis gel agarosa ... 15
4 Analisis kuantitatif hasil isolasi RNA kulit batang ... 16
5 Analisis kuantitatif hasil isolasi RNA lateks ... 18
6 Analisis kualitatif hasil isolasi RNA kulit batang dan lateks ... 20
7 Hasil uji ekspresi gen
Hb
ACO1 pada kulit batang tanaman karet ... 21
8 Analisis semikuantitatif ekspresi gen
Hb
ACO1 kulit batang tanaman karet
pada proses penyadapan ... 22
9 Analisis semikuantitatif ekspresi gen
Hb
ACO1 kulit batang tanaman karet
pada perlakuan pemberian stimulan ... 23
PENDAHULUAN
Karet merupakan salah satu komoditi pertanian yang penting di Indonesia dalam penunjang perekonomian negara. Saat ini, Indonesia menduduki peringkat ke-2 penghasil karet terbesar di dunia. Hal ini terbukti dengan tersebar luasnya perkebunan karet yang terdapat di Indonesia. Namun luasnya perkebunan tidak diimbangi oleh produktivitas dan mutu yang dihasilkan. Tanaman karet (Hevea brasiliensis) sebagai penghasil karet
alam merupakan salah satu komoditas perkebunan penting bagi Indonesia dillihat dari banyaknya petani, tenaga kerja, dan pengusaha yang terlibat dalam pengusahaan karet alam (Nurhaimi-Haris et al. 2003).
Tingginya permintaan dunia akan karet alam menyebabkan para peneliti melakukan upaya dalam meningkatkan produksi karet alam maupun mencari atau menghasilkan klon-klon unggul yang tahan terhadap penyakit dan mempunyai produksi yang tinggi. Salah satu klon unggul yang digunakan adalah PB 260 yang berasal dari hasil persilangan klon primer dan klon sekunder (Tim Penulis PS 1999). Klon ini memiliki laju metabolisme lateks yang tinggi tetapi kurang responsif terhadap stimulan. Upaya meningkatkan produksi karet alam, umumnya dikenal dengan lateks, adalah penggunaan stimulan etefon.
Etefon adalah senyawa 2- chloro-ethylposphonic acid atau sering disingkat
CEPA yang digunakan sebagai stimulan atau perangsang untuk meningkatkan produksi hormon etilena endogen pada tanaman karet (Balai Penelitian Perkebunan Sembawa 1982; Sumarmadji et al 2004). Etilena merupakan
faktor stimulan utama untuk meningkatkan produksi karet alam pada Hevea brasiliensis.
Enzim yang berperan dalam biosintesis etilena ini salah satunya adalah asam aminosiklopopana-1-karboksilat oksidase (ACO). ACO merupakan katalisator dalam perubahan asam aminosiklopopana-1-karboksilat menjadi etilena. Terdapat tiga gen spesifik penyandi enzim asam aminosiklopopana-1-karboksilat oksidase diantaranya HbACO1, HbACO2, HbACO3.
Pada penelitian ini gen yang digunakan adalah
HbACO1 yang akan diuji ekspresinya
terhadap pemberian etefon dan pengaruh pelukaan.
Penggunaan etefon yang berlebihan dapat menginduksi penyimpangan proses metebolisme, seperti, terjadinya nekrosis, penebalan kulit batang, terbentuknya retakan pada kulit, dan timbulnya bagian yang tidak
produktif pada irisan sadap (Paranjothy et al
1979). Efek samping terhadap perlakuan dan pemberian etefon yang diberikan juga akan menyebabkan terjadinya kering alur sadap (KAS).
Penelitian ini bertujuan mempelajari pola ekspresi gen HbACO1 terhadap pengaruh
pelukaan dan pemberian stimulan pada berbagai tahap perkembangan tanaman dengan hipotesis untuk melihat ekspresi gen HbACO1
dalam lateks dan kulit batang tanaman karet (Hevea brasiliensis) klon PB260 akan lebih
tinggi bila diberi perlakuan pelukaan dan pemberian etilena.
TINJAUAN PUSTAKA
Karet (Hevea brasiliensis)
Tanaman karet merupakan pohon yang tumbuh tinggi dan berbatang cukup besar. Pada awalnya, tanaman karet merupakan tanaman liar yang tumbuh di pedalaman Amerika. Tahun 1898 adalah awal dirintisnya perkebunan karet di Asia oleh perusahaan The Nort Borneo Trading Company. Tanaman yang menghasilkan lateks ini dimanfaatkan oleh masyarakat untuk pembuatan bola tenis, alas kaki, tempat air, bola karet, pakaian tahan air, dan karet penghapus sebagai penghasilan tambahan.
Hevea brasiliensis yang tumbuh liar
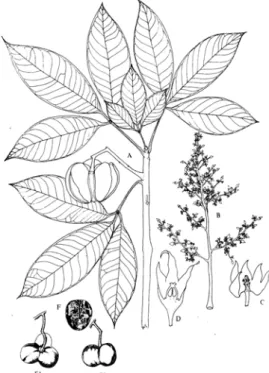
tingginya dapat mencapai 40 m dan hidup lebih dari 100 tahun. Sedangkan untuk tanaman karet dewasa yang dibudidayakan mempunyai tinggi 15-25 m dengan umur relatif singkat, yaitu 25-35 tahun (Webster & Baukwil 1989 dalam Putri 2005). Batang tanaman biasanya tumbuh lurus dan memiliki percabangan yang tinggi. Daun karet berwarna hijau. Apabila rontok warna daun menjadi kuning atau merah. Tanaman karet umumnya rontok pada musim kemarau. Daun karet terdiri atas tangkai utama dan tangkai anak daun. Tangkai utama memiliki panjang 3-20 cm dan tangkai anak daun memiliki panjang 3-10 cm (Tim Penulis Penebar Swadaya 1999). Bunga karet terdiri atas bunga jantan dan betina. Bunga betina berambut vilt dan ukurannya lebih besar dari bunga jantan (Gambar 1). Selain itu, bunga betina mengandung bakal buah yang beruang tiga. Kepala putik yang akan dibuahi dalam posisi duduk berjumlah tiga buah. Bunga jantan mempunyai sepuluh benang sari yang tersusun menjadi suatu tiang. Kepala sari terbagi dalam dua karangan dengan susunan satu lebih tinggi dari yang lain. Paling ujung adalah bakal buah yang tidak tumbuh sempurna.
Buah karet memiliki pembagian ruang yang jelas. Seperti terlihat pada Gambar 1, masing-masing ruang berbentuk setengah bola yang terdiri dari 3-6 ruang. Biji karet terdapat dalam setiap ruang buah. Jumlah biji sesuai dengan jumlah ruang pada buah karet. Ukuran biji umumnya besar dan berkulit keras. Warnanya cokelat kehitaman dengan bercak berpola khas. Adapun klasifikasi tanaman ini sebagai berikut, kingdom Plantae, divisio Spermatopytha, kelas Dicotyledonae, ordo Euphorbiales, famili Euphorbiaceae, genus Hevea, dan spesies Hevea Brasiliensis (Tim
Penulis Penebar Swadaya 1999).
Hevea brasiliensis merupakan sumber
penghasil karet alam (cis-1,4-polisoprena) di
dunia. Selain itu, Hevea brasiliensis dikenal
sebagai tanaman komersil karena setiap bagian yang dimilikinya mempunyai nilai ekonomi terutama lateks. Oleh karena itu, tanaman ini merupakan penghasil devisa negara terbesar bagi Indonesia. Saat ini Indonesia menduduki peringkat ke-2 terbesar penghasil karet alam (Budiman 2005).
Klon adalah tanaman yang dapat dihasilkan dari perbanyakan vegetatif atau aseksual, bukan dikembangkan dengan biji. Klon memiliki kelebihan dibandingkan dengan tanaman yang dikembangkan melalui biji. Selain kelebihan, klon juga memiliki kekurangan seperti daya tahan masing-masing klon terhadap penyakit tidak sama dan faktor lingkungan yang mempengaruhi pertumbuhan klon. Sehingga klon membutuhkan adaptasi terhadap lingkungannya.
Klon-klon unggul yang diinginkan dari tanaman karet diharapkan memiliki sifat-sifat ideal diantaranya, produksi lateks tinggi dan mempunyai kemampuan menaikkan produksi; resisten terhadap penyakit, hama, dan pengaruh angin; batang tumbuh lurus, selanjutnya membentuk as yang silindris serta tumbuh jagur semasa prasadap dan penyadapan; cabang-cabang yang dimiliki relatif lebih kecil dan menyebar rata sekeliling batang. Tajuk pohon relatif sempit dan pendek, simetris dengan daun-daun yang sehat dan banyak tetapi tidak terlalu rimbun. Selain itu, pertautan antara batang atas dan bawah tidak terlalu nyata yang biasa disebut dengan kaki gajah; memiliki respon yang baik terhadap stimulasi dan intensitas sadap rendah, kulitnya yang halus dan tebal (Tim Penulis Penebar Swadaya 1999).
Menurut Lasminingsih et al (1994)
terdapat klon anjuran dapat diklasifikasikan sebagai klon anjuran berskala besar dan klon anjuran berskala kecil. Klon anjuran berskala besar, yaitu kelompok klon yang telah teruji
daya adaptasinya, mempunyai produktivitas tinggi, dan dapat ditanam secara luas dengan ketentuan menggunakan paling sedikit 3 klon dalam setiap kali penanaman, contohnya adalah AVROS 2037, BPM 1, BPM 24, dan GT 1. Klon anjuran berskala kecil, yaitu klon yang berpotensi untuk dipromosikan menjadi klon skala besar setelah diuji daya adaptasinya secara luas dan dapat ditanam secara terbatas sebesar 20-40% dari areal penanaman. Contohnya adalah BPM 107, PB 217, PB 260, PR 302, PR 311, dan PR 314. Selain itu, klon yang dianjurkan untuk ditanam terbagi atas klon primer, sekunder, dan tersier. Klon sekunder dan tersier dikenal sebagai klon modern karena cara pemuliaan yang dilakukan sudah lebih maju. Salah satu klon primer yang disilangkan dengan klon sekunder adalah PB 260 (Tim Penulis Penebas Swadaya 1999).
Gambar 1 Tanaman karet (Hevea brasiliensis);
A. percabangan yang terdapat buah (x ½); B. susunan bunga (x ½); C. bunga jantan yang diiris terbuka (x 3); D. bunga betina dengan irisan melintang (x 3); E1 dan E2. buah (x ¼); F. Biji (x ½ ) (Purseglove 1968, diacu dalam Webster & Baullkwill 1989).
Lateks
Lateks berupa cairan getah seperti susu, merupakan emulsi kompleks yang mengandung protein, alkaloid, pati, gula, minyak, tanin, resin, dan gum. Umumnya
lateks lengket dan berwarna putih seperti susu namun ada pula yang berwarna kuning, jingga, dan merah. Lateks termasuk ke dalam hormon isoprenoid seperti giberelin maupun asam absisat. Proses polimerisasi rangkai isoprena merupakan proses alami yang umum dan proses ini terdapat pada proses pembentukan karet alam.
Lateks diperoleh dengan cara penyadapan atau pelukaan pada bagian kulit batang tanaman karet. Proses sadap akan membuka pembuluh lateks pada kulit pohon agar lateks dapat mengalir cepat. Kecepatan aliran lateks berkurang apabila takaran cairan lateks pada kulit berkurang. Kesalahan proses sadap akan mengurangi produksi lateks. Adapun syarat lateks yang baik sebagai berikut, disaring dengan saringan berukuran 40 mesh, tidak terdapat kotoran atau benda-benda lain seperti daun atau kayu, tidak bercampur dengan bubur lateks, air, ataupun serum lateks, warna putih dan berbau karet segar, serta bermutu dengan kadar karet kering untuk mutu 1 adalah 28% dan mutu 2 dengan kadar karet kering 20% (Tim Penulis Penebar Swadaya 1999).
Menurut Hess dalam Dalimunthe (2004), terdapat 2000 spesies tanaman yang menghasilkan lateks tetapi hanya beberapa spesies yang memiliki kualitas baik terutama famili Apocynaceae, Asclepiadaceae, Compositae, Euphorbiaceae dan Moraceae.
Selain itu, lateks merupakan hasil fotosintesis dalam bentuk sukrosa yang ditranslokasikan dari daun melalui pembuluh tapis ke dalam pembuluh lateks. Di dalam pembuluh lateks terdapat enzim seperti invertase yang akan mengatur proses perombakan sukrosa untuk pembentukan karet. Biosintesis lateks berlangsung dalam sel-sel pembuluh lateks dengan bahan dasar berupa sukrosa yang ditranport dari daun sebagai hasil fotosintesis yang telah mengalami perubahan secara enzimatik melalui asam mevalonat, asam fospat, asam mevalonat-5-pirofospat, sehingga isopentenil pirofospat (IPP) merupakan sumber penting produksi lateks (Dalimunthe 2004).
Latek memiliki tiga bagian utama dari hasil sentrifugasi, yaitu fraksi atas (partikel karet), fraksi tengah (serum C/sitosol), dan fraksi dasar (partikel lutoid). Fraksi atas berwarna putih dan mengandung sekitar 36% hidrokarbon karet berupa molekul cis
-1,4-poliisoprena yang berbentuk bulat berukuran 5 nm-3 μm. Fraksi ini mengandung bahan yang bukan karet, seperti fosfolipid, lemak, lilin, protein, logam, dan enzim rubber transferase
yang berfungsi dalam pembentukan partikel karet. Fraksi tengah merupakan cairan bening
yang kaya akan kandungan protein dan mudah teroksidasi sehingga warnanya dapat berubah menjadi cokelat. Lutoid merupakan fraksi dasar lateks yang banyak mengandung kation. Apabila lutoid pecah kation-kation ini akan bereaksi dengan partikel karet yang bermuatan negatif sehingga terjadi koagulasi (Junaidi et al 2007). Fraksi dasar ini bersifat kental
seperti gelatin dan diselubungi oleh membran semipermeabel yang berisi cairan serum B. Cairan ini mengandung ion-ion kalsium dan magnesium yang bermuatan positif (d’ Auzac & Jacob 1989 dalam Putri 2005)
Etefon
Etefon (Ethrel®) (CEPA, asam-2-kloro-etilfosfonat) merupakan stimulan atau perangsang tanaman karet. Etefon secara umum telah terbukti dapat mendorong peningkatan produksi lateks selama periode tertentu. Pengaruh pemberian etefon yang spesifik pada tanaman karet memiliki kaitan yang luas dengan reaksi-reaksi enzimatis yang kompleks (Sumarmadji et al 2004).
Stimulasi etefon yang merupakan generator bagi etilena dapat menginduksi ekspresi protein tertentu pada tanaman karet. Kemudian protein akan menginduksi reaksi berantai yang bermuara pada bentuk peningkatan produksi lateks. Etilena dari etefon, baik secara endogen ataupun eksogen berperan sebagai penginduksi perubahan fisiologis dalam sistem sel pembuluh lateks. Perlakuan etefon yang berakibat penundaan penggumpalan lateks justru meningkatkan ekspresi protein (Sumarmadji et al 2004).
Pemakaian etefon yang berlebihan dapat mengakibatkan penyimpangan proses metabolisme, seperti penebalan kulit batang, nekrosis, terbentuknya retakan pada kulit, dan timbulnya bagian yang tidak produktif pada irisan sadap (Paranjothy et al 1979). Selain
itu, pemakaian etefon yang berlebihan juga dapat menghentikan aliran lateks yang disebabkan oleh koagulasi partikel yang dikenal dengan kering alur sadap (KAS) (Tistama & Siregar 2005)
Biosintesis Etilena
Etilen adalah salah satu hormon yang mempengaruhi proses pertumbuhan tanaman dan pematangan buah terutama buah yang tergolong klimaterik, respon terhadap cekaman biotik dan abiotik, mempengaruhi proses perkecambahan biji, serta pemanjangan akar tanaman dan mempengaruhi lama aliran lateks pada tanaman karet (Jones et al 1999;
Bleecker et al 2000; Michelle et al 1999;
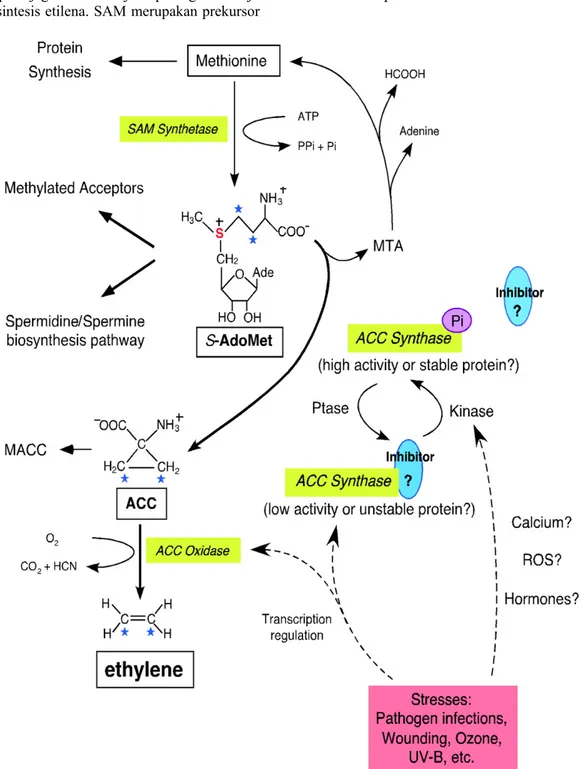
Biosintesis etilena pada tanaman dibagi dalam tiga tahap utama, yaitupembentukan S-adenosil metionin (SAM) dari metionin dengan bantuan SAM sintetase (EC 2.5.1.6) yang membutuhkan 1 molekul ATP. Tahap kedua adalah perubahan SAM menjadi asam 1-aminosiklopropana-1-karboksilat (ACC) yang dikatalisis oleh ACC sintase (EC 4.4.1.14). Pada tahap ini juga dihasilkan metiltioadenosin (MTA) yang akan digunakan kembali untuk pembentukan metionin, sehingga konsentrasi metionin selular dapat tetap terjaga ketika terjadi peningkatan laju biosintesis etilena. SAM merupakan prekursor
dalam lintasan biosintesis poliamin (spermidin atau spermin) dan juga donor bagi molekul-molekul selular contohnya asam nukleat, protein, dan lipid. Tahap terakhir adalah oksidasi ACC menjadi etilena yang dikatalisis oleh enzim ACC oksidase atau dikenal juga sebagai ethylene forming enzyme (EFE).
Untuk mencegah efek toksik dari akumulasi sianida yang terbentuk dalam tahap ini, sianida akan diubah menjadi β-sianoalanin oleh β -sianoalanin sintase (β-CAS, EC 4.4.1.9) (Wang et al 2002). Proses biosintesis dapat
dilihat pada Gambar 2.
ACC Oksidase (ACO)
ACC oksidase merupakan enzim yang berperan dalam biosintesis etilena pada tanaman. Pembentukan etilena pada tanaman karet mempengaruhi perkembangan dari tanaman karet, produksi lateks, dan regenerasi. Selain menghasilkan etilena, enzim ACC oksidase juga memproduksi sianida. Sianida ini diproduksi dengan cara didetiksifikasi dengan mengubahnya menjadi asam β -sianoalanin yang dapat berubah menjadi asparagin.
Menurut Kuswanhadi et al. 2007, pada
genom Hevea brasiliensis klon PB 260
terdapat tiga anggota dari kelompok mulgenik yang menyandikan ACC oksidase. Ketiga anggota kelompok mulgenik tersebut yaitu
HbACO1, HbACO2, dan HbACO3 yang
memberikan ekspresi yang berbeda-beda pada kalus, plantlet, lateks, dan tanaman karet klon PB 260 di lapangan. Ketiga gen tersebut masing-masing memiliki susunan basa yang berbeda, yaitu 1115 bp, 1183 bp, 1348 bp. Gen pada Hevea brasiliensis yang
mengode enzim spesifik pada pembentukan etilena adalah ACC oksidase. Gen ini merupakan target gen yang bisa dimanipulasi menjadi gen antisense ACC oksidase yang dapat menunda proses pematangan buah.
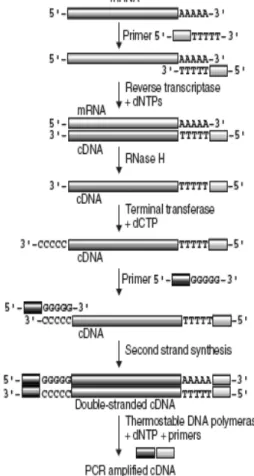
Reverse Transcriptase Polimerase Chain Reaction (RT-PCR)
Teknik RT-PCR adalah pengembangan dari teknik PCR untuk melakukan analisis terhadap RNA hasil transkripsi yang terdapat di dalam sel. Tenik PCR ini ditemukan oleh Karry B Mullis pada tahun 1985. Terdapat beberapa teknik yang dikembang dari PCR selain RT-PCR, diantaranya Real Time PCR,
PCR koloni, symmetric PCR, assymetric PCR,
nested PCR, dan AP-PCR. RT-PCR
merupakan metode yang digunakan untuk amplifikasi sekuen yang telah diketahui dari sel atau RNA jaringan. Reaksi PCR ini dilakukan menggunakan reverse transcriptase
untuk mensintesis mRNA menjadi cDNA. Molekul cDNA digunakan sebagai cetakan untuk proses PCR selanjutnya. Kegunaan RT-PCR antara lain expression profiling,
mengetahui ekspresi gen atau mengidentifikasi sekuen suatu transkripsi RNA, termasuk permulaan transkripsi dan daerah terminasi, diagnosis agensia infektif maupun penyakit genetik. Hal ini dapat dilakukan jika sekuen DNA genom adalah gen yang diketahui untuk menggambarkan lokasi dari ekson dan intron dalam gen
Tahapan umum dari teknik PCR dibagi ke dalam beberapa tahap, yaitu tahap denaturasi,
penempelan (annealing) primer, dan
pemanjangan basa nukleotida. Tahap denaturasi dilakukan pada suhu 91-97 ºC yang bertujuan memutuskan ikatan hidrogen diantara basa komplementer, sehingga akan didapat DNA dalam bentuk utas tunggal. Tahap selanjutnya, menentukan suhu optimum untuk penempelan primer pada utas tunggal DNA. Tahap terakhir adalah pemanjangan rantai oleh suatu DNA polimerase yang bersifat termostabil (Taq Pol.). Satu siklus
dalam teknik PCR yang terdiri atas ketiga tahapan tersebut akan menghasilkan dua molekul DNA target, sehingga apabila dilakukan 30 siklus maka akan dihasilkan sekitar satu miliar molekul DNA target.
Metode RT-PCR menggunakan enzim transkriptase balik. Enzim transkriptase balik adalah enzim yang digunakan untuk mensintesis cDNA dengan menggunakan RNA sebagai cetakan. cDNA yang disintesis akan bersifat komplementer dengan RNA cetakan. Beberapa enzim transkriptase yang dapat digunakan antara lain mesofilik viral reverse transcriptase (RTase) yang dikode oleh virus
avian myoblastosis (AMV) dan oleh virus moloney murine leukemia (M-Mul V), dan Tth
DNA polymerase (Yowono T 2006 dalam Farieh 2007).
BAHAN DAN METODE Bahan dan alat
Bahan-bahan yang diperlukan untuk isolasi RNA adalah sampel lateks dan kulit batang (bark) klon PB 260, N2 cair, PVP
(polivinyl pyrrolidone), buffer ekstraksi, β
-merkaptoetanol, larutan kloroform: isoamilalkohol (Ch:IAA, 24:1), larutan fenol:kloroform:isoamilalkohol (Ph:Ch:IAA, 25:24:1), LiCl 8 M, DEPC.ddH2O, natrium asetat 3 M pH 5.8, etanol absolut, dan etanol 70%. Sedangkan bahan-bahan yang digunakan untuk elektroforesis gel agarosa antara lain agarosa (Sigma), buffer TBE 0.5 X, etidium bromida 1% (w/v), loading buffer (brom fenol
biru 2.5%, sukrosa 40%), dan marker 1 kb plus (invitrogen).
Bahan-bahan untuk sintesis first strand
menggunakan Transcriptor First Strand cDNA Synthesis kit (Roche) yang terdiri atas transcriptor reverse transcriptase (20 U/μl),
transcriptor RT reaction buffer (5 X),
protector Rnase inhibitor (40 U/μl), dNTP,
ddH2O, dan primer oligo(dT). Sedangkan untuk amplifikasi (RT-PCR) bahan-bahan yang dibutuhkan adalah primer HbACO1-F
(forward) dan HbACO1-R (reverse), buffer incomplete, MgCl2, cDNA sebagai cetakan, Taq (Bioron), dNTP, dan ddH2O.
Peralatan yang digunakan untuk isolasi RNA antara lain mortar, ruang asam, sentrifus
Beckman Allegra 64R, sentrifus Eppendorf
5417R, penangas air, autoklaf, pipet
Eppendorf, Decby freezer -40 °C, dan Sansio freezer -20 °C. Sedangkan untuk uji kualitatif
dan kuantitatif digunakan spektrofotometer UV-VIS Beckman Coulter-DU 530. Peralatan
yang digunakan untuk elektroforesis adalah sisir dan cetakan agar, bak elektroforesis, adaptor 100 volt, UV T2201 (sigma), gel doc
yang dilengkapi dengan UV transiluminator.
Proses sintesis first strain dan amplifikasi digunakan mesin PCR (Biometra). Selain itu, digunakan peralatan gelas lainnya seperti gelas piala, pipet Mohr, dan labu erlenmeyer.
Metode Penelitian
Pemilihan Sampel Kulit Batang Tanaman Karet (Hevea brasiliensis)
Sampel yang digunakan adalah tanaman karet klon PB 260 dengan sistem perlakuan eksploitasi stimulasi, yaitu sistem kombinasi antara penyadapan dan penggunaan stimulasi atau perangsang. Sistem eksploitasi (penyadapan) dan pemberian stimulan terdiri atas enam perlakuan, seperti terlihat pada Tabel 1 (Balai Penelitian Perkebunan Sembawa 1982).
Tabel 1 Sistem eksploitasi dan pemberian stimulan pada tanaman karet
Perlakuan Sistem Eksploitasi dan Pemberian Stimulan Keterangan I s2/d2 Sadapan setengah spiral; disadap dua hari sekali II s2/d4 Sadapan setengah spiral; disadap empat hari sekali III s2/d6 Sadapan setengah spiral; disadap enam hari sekali IV s2/d4
E3/tahun setengah spiral; Sadapan disadap empat
hari sekali; pemberian etefon tiga kali dalam setahun*. V s2/d4
E6/tahun setengah spiral; Sadapan disadap empat hari sekali; pemberian etefon enam kali dalam setahun*. VI s2/d4
E12/tahun setengah spiral; Sadapan disadap empat
hari sekali; pemberian etefon dua belas
kali dalam setahun*.
* konsentrasi etefon 2.5%; pemberian stimulan pada kulit di bawah irisan sadap (bark application)
Isolasi RNA Karet
Isolasi sampel karet menggunakan metode yang dikembangkan oleh Chaidamsari (2005). Sampel bark ditimbang sebanyak 1.6 gram. Sebanyak 15 ml larutan buffer ekstrak ditambahkan dengan 150 μl β-merkaptoetanol dalam ruang asam dan diinkubasi dalam penangas air. Sampel bark ditambahkan PVP dan N2 cair di dalam mortar. Sampel digerus hingga halus dan dijaga agar tetap dalam keadaan dingin. Hasil gerusan ditambahkan larutan buffer ekstrak yang sudah diinkubasi dalam penangas air, kemudian sampel tersebut diinkubasi selama 1 jam pada suhu 65 °C,
setiap 15 menit sampel dikocok kuat. Setelah 1 jam, sampel dipindahkan dalam tabung sentrifus dan ditambahkan Ch:IAA sebanyak 15 ml. Usahakan berat sampel seimbang, lalu disentrifus dengan kecepatan 15000 rpm pada suhu 25 °C selama 15 menit.
Supernatan yang dihasilkan dipindahkan dengan mikropipet 100-1000 μl secara hati-hati (diukur volume supernatan yang dipindahkan) ke dalam tabung sentrifus yang baru. Supernatan yang didapat diekstrak berulang-ulang dengan Ph:Ch:IAA, Ch:IAA, Ch:IAA sebanyak 1 volume, dikocok dengan sangat perlahan kemudian disentrifus dengan kecepatan 15000 rpm pada suhu 25 °C selama 15 menit. Lapisan atas yang dihasilkan dari hasil sentrifugasi akhir dipindahkan dalam tabung sentrifus baru dan ditambahkan LiCl 10 M hingga 2 M, didiamkan semalam pada suhu 4 °C.
Larutan yang diinkubasi selama semalam disentrifus dengan kecepatan 12000 rpm pada suhu 4 °C selama 30 menit. Pelet diambil, dilarutkan dengan ddH2O.DEPC 750 μl dan dipindahkan ke dalam tabung sentrifus mikro (vial) 2 ml. Larutan tersebut diekstraksi dengan fenol sebanyak 1 volume dan disentrifus dengan menggunakan mikrosentrifus pada kecepatan 12000 rpm selama 15 menit, 4 °C. Supernatan yang dihasilkan dipindahkan ke dalam vial dengan menggunakan mikropipet 20-200 μl. Supernatan tersebut diekstraksi secara berulang dengan Ph:Ch:IAA dan Ch:IAA sebanyak 1 volume, lalu disentrifus dengan kecepatan 12000 rpm pada suhu 4 °C selama 15 menit.
Supernatan dari hasil ekstraksi ditambahkan dengan Na-asetat 1/10 volume dan etanol absolut 3 volume, diinkubasi dalam freezer (-40 °C) selama 3 jam. Setelah 3 jam, disentrifus kembali dengan kecepatan 12000 rpm pada suhu 4 °C selama 30 menit. Pelet yang dihasilkan dibilas dengan etanol dingin 70%. Pelet dikeringanginkan dan dilarutkan dengan miliQ DEPC sebanyak 30 μl. Hasil isolasi ini disimpan pada suhu -20 °C sebagai stock RNA.
Sampel lateks dipanaskan terlebih dahulu pada suhu 50 °C selama 1 jam, kemudian disentrifus pada kecepatan 15000 rpm, 20 °C, selama 30 menit. Supernatan yang diperoleh selanjutnya diekstrak berulang dengan Ph :Ch:IAA dan Ch:IAA masing-masing 1 V dan disentrifus kembali pada kecepatan 10000 rpm, 4 °C, selama 10 menit. Lapisan bagian atas yang diperoleh dipindahkan ke dalam tabung sentrifus baru dan ditambahkan LiCl 8 M hingga konsentrasi larutan menjadi 2M. Selanjutnya disimpan semalam dalam freezer
bersuhu 4 °C. Prosedur pengerjaan selanjutnya hampir sama dengan isolasi RNA dari sampel kulit batang. Perbedaannya adalah digunakan 450 μl DEPC.ddH2O untuk melarutkan pelet, larutan tidak diekstrak dengan fenol tetapi diekstrak berulang dengan Ph :Ch:IAA dan Ch:IAA 1 V dan disentrifus pada kecepatan 10000 rpm, 4 °C, selama 10 menit.
Analisis Kualitatif dan Kuantitatif Hasil Isolasi RNA
Analisis kualitatif dan kuantitatif hasil isolasi RNA dapat dilihat melalui hasil elektroforesis gel agarosa dan pengukuran konsentrasi serapan RNA. Proses pembuatan gel agarosa 1%, sebanyak 0.3 gram agarosa ditambah dengan 30 ml lalu dilarutkan dalam
microwave selama satu menit. Setelah larut
dengan sempurna campuran tersebut dibiarkan sampai hangat-hangat kuku ditambahkan dengan EtBr 1.5 μl lalu dituangkan ke dalam cetakan yang dilengkapi dengan sisir hingga menjadi gel. Gel tersebut kemudian dimasukkan ke dalam alat elektroforesis dan direndam dengan buffer TBE 0.5×. Parafilm dan bahan untuk elektroforesis sampel disiapkan lalu di atas parafilm dicampurkan 1 µl loading buffer dan 5 µl sampel. Setelah dicampurkan, sampel disuntikkan ke dalam sumur elektroforesis lalu dirunning dengan daya 100 V. Pengamatan dilakukan menggunakan gel doc yang dilengkapi dengan UV transiluminator.
Pengukuran konsentrasi serapan, sebanyak 2 μl sampel (stock RNA) dipindahkan dalam vial baru dan ditambahkan ddH2O.DEPC 198
μl. Larutan tersebut dipindahkan ke dalam kuvet (tabung spektro) dan diukur nilai serapannya pada panjang gelombang 230 nm, 260 nm, dan 280 nm.
Sintesis First Strain cDNA
Sintesis cDNA dilakukan dengan menyiapkan sebanyak 2 μg RNA ditambah 1
μl oligo(dT) primer, dan ddH2O.DEPC hingga total volume menjadi 13 μl ke dalam vial 1.5 ml. Campuran dihomogenkan selama 3-5 detik kemudian dimasukan ke dalam mesin PCR yang temperaturnya diatur pada 65 °C selama 10 menit. Setelah 10 menit tabung diangkat, dimasukkan ke dalam esuntuk beberapa saat, ditambahkan buffer mix (4 μl buffer RT, 0.5 μl
RNase Inhibitor, 2.5 μl dNTPs 10 mM, 0.5 μl
enzim Reverse Transcriptase) kemudian
dimasukkan kembali ke dalam mesin PCR dan progran dijalankan kembali dengan suhu 55 °C selama 30 menit. Stok cDNA yang dihasilkan sebanyak 20 μl diangkat, selanjutnya disimpan dalam es.
Amplifikasi cDNA Bark dan Lateks
Amplifikasi cDNA dilakukan dengan menyiapkan sebanyak 1 μl cDNA, 3 μl ddH2O.DEPC ditambahkan dengan buffer mix (2.5 μl buffer incomplete, 0.5 μl MgCl2 100
mM, 1 μl dNTPs 10 mM, primer HbACO1-F, primer HbACO1-R, 14.25 μl MW dan 1 μl Taq
polimerase). Larutan tersebut dimasukkan ke dalam thermal cycler PCR (Biometra) dengan
kondisi pemanasan awal 94 °C selama 3 menit, denaturasi 94 °C selama 30 detik, annealing 55
°C selama 1 menit, dan pemanjangan pada 72 °C selama 1 menit. Kondisi ini diulang sebanyak 35 siklus. Setelah 35 siklus dilakukan pemanasan akhir selama 7 menit pada temperatur 72 °C. Hasil amplifikasi dapat dilihat dengan dielektroforesis pada gel agarosa, lalu divisualisasikan menggunakan
gel dock yang dilengkapi dengan UV
transiluminator.
HASIL DAN PEMBAHASAN
Pemilihan Sampel RNA
Hasil isolasi RNA total lateks dan kulit batang tanaman karet dapat diketahui kualitasnya baik secara kuantitatif maupun kualitatif. Secara kuantitatif, Tabel 2 menunjukkan hasil isolasi RNA pada kulit batang lebih murni dibandingkan pada lateks. Hal ini dibuktikan dengan nilai rasio pada kulit batang lebih dari 1.8 dengan konsentrasi yang dihasilkan cukup seragam. Sedangkan pada lateks nilai rasio serapan yang dihasilkan, terdapat beberapa sampel yang masih dibawah 1.8 dengan konsentrasi antara 108 hingga 1688 ng/μl. Ketidakmurnian yang dihasilkan RNA lateks menunjukkan bahwa masih banyak terdapat kontaminasi protein di dalamnya karena fase fenolik terbawa pada saat pengekstrakkan.
Perbandingan rasio serapan terukur pada panjang gelombang 260 nm dan 280 nm menunjukan kemurnian RNA terhadap kontaminasi protein. Pada rasio serapan ini dikatakan murni dan hanya sedikit mengandung protein apabila nilainya berkisar antara 1.80-2.00. Jika rasio serapan kurang dari 1.80, maka dapat dikatakan terdapat kontaminasi protein pada RNA yang dihasilkan. Bila nilai rasionya lebih dari 2.00, maka diperkirakan RNA hasil isolasi tersebut masih terkontaminasi oleh DNA (Boyer 1986 dalam Febrimarsa 2007). Berdasarkan rasio serapan dapat memperlihatkan nilai konsentrasi beragam dari setiap sampel. Keragaman nilai tersebut diperoleh dari hasil perkalian antara A260, faktor pengenceran, dan 40 ng/µl. Angka 40 adalah perbandingan
nilai absorbansi 1 pada panjang gelombang 260 sama dengan RNA yang dimiliki konsentrasi 40 μg/ml (Sambrook et al. 1989).
Kualitas RNA hasil isolasi menggambarkan hasil yang berbeda dari kuantitasnya. Seperti terlihat pada Gambar 4, RNA hasil isolasi kulit batang dan lateks menggambarkan hasil yang baik, artinya tidak terkontaminasi oleh protein ataupun DNA. Intensitas pita yang dihasilkannya pun cukup seragam karena konsentrasi yang digunakan sama, yaitu 250 ng/μl. Hasil elektroforesis RNA dikatakan berhasil, dibuktikan pula dengan terbentuknya 2 pita. Menurut Farrel 1993, dua buah pita yang dihasilkan dari proses elektroforesis berada pada ukuran 28 S dan 18 S.
Tabel 2 Konsentrasi RNA total kulit batang No. sampel 260 280 260/280 ng/µl [ ] B U6 0.108 0.048 2.244 432 B V6 0.141 0.068 2.067 564 B W6 0.109 0.063 1.730 436 B X6 0.120 0.064 1.885 480 B Y6 0.111 0.056 2.000 444 B Z6 0.127 0.065 1.951 508 B A7 0.147 0.059 2.497 588 L Y3 0.278 0.149 1.859 1112 L Z3 0.315 0.179 1.762 1260 L A4 0.280 0.170 1.651 1120 L H4 0.422 0.265 1.591 1688 L C4 0.027 0.018 1.464 108 L D4 0.180 0.094 1.927 720 Keterangan:
B = Bark/ Kulit batang L = Lateks
(a)
(b)
Gambar 4 Elektroforegram RNA total (a) kulit batang dan (b) lateks.
Ekspresi Gen HbACO1 pada Kulit Batang dan Lateks Tanaman Karet
Ekspresi gen HbACO1 secara kualitatif
dapat dilihat melalui hasil elektroforesis gel
172 173 174 175 176 177 178 Y3 Z3 A4 H4 C4 D4 18S U6 V6 W6 X6 Y6 Z6 A7 18S 28S 28S
agarosa dengan melihat intensitas pitanya. Semakin kuat intensitas pita maka semakin kuat pula ekspresi gen tersebut dalam suatu jaringan, jika intensitas pita lemah maka gen tersebut akan terekspresi lemah. Ekspresi yang dihasilkandari gen HbACO1 pada kulit batang
terlihat kurang sempurna karena masih terdapat pita atau pola ekspresi yang berada di luar ukuran yang diinginkan, yaitu 397 bp. Penyebabnya dapat dikarenakan primer yang digunakan kurang spesifik atau suhu annealing yang terlalu rendah sehingga hasilnya seperti yang terlihat pada Gambar 5.
Penelitian Kuswanhadi et al (2006)
menyatakan bahwa gen HbACO1 hanya
berekspresi pada kulit batang dan lateks tanaman karet untuk sementara waktu, yaitu pada 2, 8, dan 24 jam setelah pemberian stimulan etefon dan tidak terekspresi kembali setelah penyadapan apapun jenis stimulannya. Tetapi pada penelitian ini, HbACO1 tidak
terekspresi pada lateks baik pada penyadapan dan pemberian etefon. Pada lateks gen
HbACO1 tidak dapat terekspresi dikarenakan
gen HbACO1 pada lateks merupakan gen
transien. .
Gambar 5 Ekspresi gen HbACO1.
Perlakuan Penyadapan terhadap Ekspresi Gen HbACO1 pada Kulit Batang
Gen HbACO1 yang terekspresi dapat
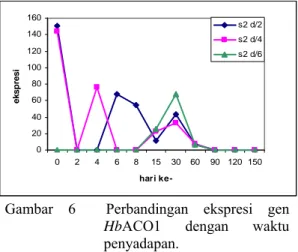
dihitung konsentrasinya secara semikuantitatif yang terlampir pada lampiran 8. Berdasarkan kurva yang dihasilkan dari kuantifikasi kulit batang tanaman karet dengan perlakuan penyadapan, gen HbACO1 pada hari pertama
penyadapan (hari ke-0) yang dilakukan dua hari sekali (d/2) ataupun empat hari sekali (d/4) menunjukkan ekspresi yang sangat tinggi. Tetapi penyadapan pada hari ke-2 hingga hari ke-150 dengan perlakuan yang sama, ekspresi penyadapan terlihat rendah bahkan sampai tidak terekspresi. Namun berbeda dengan penyadapan yang dilakukan enam hari sekali (d/6) dimana gen HbACO1
baru terekspresi pada hari ke-15 tetapi pada hari tersebut ekspresi yang ditunjukkan belum optimal dan penyadapan yang optimum terlihat pada hari ke-30.
Waktu optimum pada perlakuan penyadapan ini ditunjukkan pada hari pertama (hari ke-0) dengan perlakuan dua hari sekali
penyadapan diperoleh konsentrasi sebesar 150.3008 ng/µl. Dengan demikian, perlakuan penyadapan yang baik dilakukan untuk melihat ekspresi gen HbACO1 adalah pada
penyadapan dua hari sekali. Hal tersebut sesuai dengan hipotesis bahwa semakin sering pohon karet disadap, maka gen HbACO1 cenderung
berekspresi lebih tinggi karena cekaman dari luar yang lebih sering akan meningkatkan produksi etilena endogenous dan salah satu gen yang berperan dalam memproduksi etilena tersebut adalah gen HbACO1.
0 20 40 60 80 100 120 140 160 0 2 4 6 8 15 30 60 90 120 150 hari ke-ek sp re s i s2 d/2 s2 d/4 s2 d/6
Gambar 6 Perbandingan ekspresi gen
HbACO1 dengan waktu
penyadapan.
Perlakuan Pemberian Stimulan terhadap Ekspresi Gen HbACO1 pada Kulit Batang
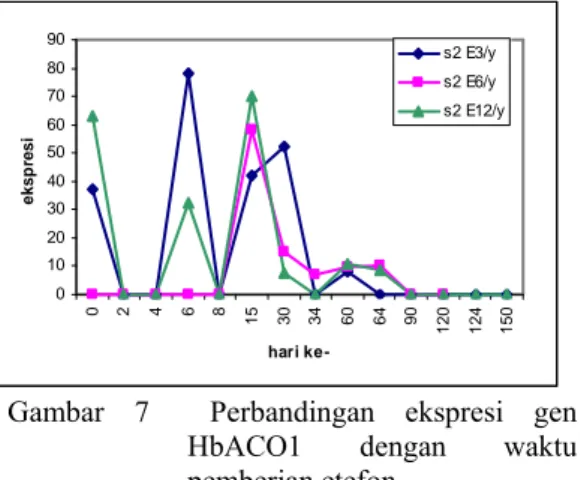
Pemberian etefon dilakukan 2 hari setelah penyadapan pertama dan sampel diambil pada 48 jam setelah pemberian stimulan. Tanaman karet yang diberi perlakuan etefon disadap 4 hari sekali karena pada metode perkebunan karet di Indonesia, penyadapan 4 hari sekali adalah penyadapan yang umum dilakukan. Ekspresi gen HbACO1 dapat terdeteksi pada
hari ke-1 dan hari ke-3 sebelum dilakukan perangsangan dan hari ke-4 setelahnya. Gambar 7, terlihat gen HbACO1 tidak terekspresi pada 48 jam (hari ke-4) setelah pemberian etefon, melainkan pada hari ke-6 (E3/y) dan hari ke-15 (E6/y dan E12/y) gen tersebut terekspresi cukup tinggi. Hal ini berbeda dengan sampel yang hanya disadap empat hari sekali karena sampel tersebut sangat rendah ekspresinya jika dibandingkan dengan sampel yang diberi etefon.
Ekspresi gen HbACO1 tertinggi
ditunjukkan pada sampel yang diberi perlakuan etefon 3 kali dalam setahun dengan konsentrasi ekspresi 78.17275 ng/μl diikuti dengan perlakuan pemberian etefon 12 kali dalam setahun. Pada hari ke-30 ekspresi gen menurun hingga tidak berekspresi lagi pada hari ke-150 dikarenakan pemberian etefon untuk kedua dan ketiga kalinya tidak berpengaruh terhadap
peninggkatan ekspresi dan semakin sering pemberian etefon maka ekspresi gen HbACO1
semakin rendah. 0 10 20 30 40 50 60 70 80 90 0 2 4 6 8 15 30 34 60 64 90 12 0 12 4 15 0 hari ke-eksp re si s2 E3/y s2 E6/y s2 E12/y
Gambar 7 Perbandingan ekspresi gen HbACO1 dengan waktu pemberian etefon.
SIMPULAN DAN SARAN
Simpulan
Gen HbACO1 hanya berekspresi pada
kulit batang tanaman karet, tidak pada lateks. Perlakuan yang baik untuk kulit batang tanaman karet adalah 2 hari sekali penyadapan dan 3 kali dalam setahun pemberian stimulan. Ekspresi gen HbACO1 lebih dipengaruhi oleh
penyadapan dibanding dengan pemberian etefon.
Saran
Perlu dilakukan penelitian lebih lanjut untuk melihat pengaruh penyadapan dan pemberian etefon pada kulit batang dan lateks dengan waktu yang sudah didapat agar diperoleh marka seleksi yang diinginkan.
DAFTAR PUSTAKA
Balai Penelitian Perkebunan Sembawa. 1982.
Penyadapan Tanaman Karet (Seri
Pedoman No. 1). Palembang: Balai
Penelitian Perkebunan Sembawa.
Bleecker AB, Kende H. 2000. Ethylene: a gaseous signal molecule in plants [abstrak]. Di dalam: Annual Review Cell Division
Biology; Wisconsin. hlm 16. abstr no
PMID: 11031228.
Budiman AFS. 2005. Perkembangan global karet alam dan tantangan bagi Indonesia.
Warr Perkaretan 24: 1-7.
Chaidamsari T. 2005. Biotechnology for Cacao Pod Borer Resistance in Cacao Plant
Research International. Netherlands:
Wagenigen University.
Dalimunthe A. 2004. Biosintesis Lateks. USU
digital library.
Febrimarsa. 2007. Deteksi dan Karakterisasi Daerah Ujung 5’ Gen EGAD1 dari Kalus
dan Buah Kelapa Sawit [Skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan, Institut Pertanian Bogor.
Jones ML, Woodson WR. 1999. Differential expression of three members of the 1-aminocyclopropane-1-carboxylate synthase gene family in carnation. Plant Physiol
199:755-764.
Junaidi, Sumarmadji, Karyudi. 2007. Aplikasi Stimulan Gas Let 200 untuk Meningkatkan Produktivitas Tanaman Karet (Hevea brasiliensis Muell. Arg.). Balai Penelitian
Sengei Putih.
Kuswanhadi et al. 2005. Isolation and
characterization of three members of the multigenic family encoding ACC oxidase from H. brasiliensis during plant
development. International Workshop on Tapping Panel Dryness, RRII, Kottayam, India 686 009.
Lasminingsih et al. 1994. Deskripsi Klon Karet Anjuran pada Tanaman Muda.
Palembang: Balai Penelitian Sembawa. Li N et al. 1996. A Novel bifunctional fusion
enzyme catalyzing ethylen synthesis via 1-aminocyclopropane-1-carboxylic acid. J Biol ang Chem, 271(42): 25738-25741. Michele L, Jones R, William R, Woodson.
1999. Differential expression of three members of the 1-aminocyclopropane-1-carboxylate synthase gene family in carnation. J Plant Physiol 18: 263-268.
Nurhaimi-Haris et al. 2003. Kemiripan genetik
klon karet (Hevea brasiliensis Muell. Arg.)
berdasarkan metode Amplifies Fragment Length. Men Perk 71: 1-15.
Putri FDRS. 2005. Optimasi penetapan kadar protein antigen lateks karet alam (Hevea brasiliensis) dan produk jadinya [Skripsi].
Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Reece RJ. 2004. Analyses of Genes and Genomes. England: John Willey & Sons.
Salisbury FB, Ross CW. 1995. Fisiologi
Tumbuhan Jilid 3. R. Lukman dan
Sumaryono, penerjemah. Bandung: Penerbit ITB. Terjemahan dari: Plant Phsiology, 4th Edition.
Sambrook J, Fritsch EF, Maniatis T. 1989.
Molecular Cloning a Laboratory
Manual. New York: Cold Spring
Harbor Laboratory.
Sumarmadji, Tistama R, Siswanto. 2004. Protein-protein spesifik yang diinduksi oleh etefon pada beberapa klon tanaman karet. J Pnlit Krt 22: 57-69.
Tim Penulis Penebar Swadaya. 1999. Karet: Budi Daya dan Pengolahan, Strategi Pemasaran. Jakarta: Penebar Swadaya.
Wang KLC, Li H, Ecker JR. 2002. Ethylene biosynthesis and signaling networks. Plant Cell 14: 131-151.
Lampiran 1 Tahapan penelitian
Pemilihan sampel RNA yang baik
Analisis ekspresi gen
Hb
ACO1
Penentuan waktu sadap optimum
(disadap dengan perlakuan d/2, d/4, dan d/6)
Analisis ekspresi gen
Hb
ACO1
Pengaruh pemberian stimulan
(waktu pemberian stimulan E3/y, E6/y, dan E12/y)
Kulit batang
Lateks
Lampiran 2 Pembuatan larutan stok dan pereaksi
Buffer ekstraksi DNA
CTAB
10%
10
ml
EDTA 0.5 M pH 8.0
2 ml
Tris-HCl 1 M pH 8.0
5 ml
NaCl 5 M
12.6 ml
ddH2O
DEPC
20.4
ml
Buffer Tris-HCl 1 M pH 8.0
Tris-base 12.11
gram
HCl pekat
4.2 ml
Akuades 80
ml
Atur pH larutam hingga 8.0; tepatkan volume hingga 100 ml
Larutan EDTA 0.5 M pH 8.0
EDTA
18.61 gram
Akuades 80
ml
Kocok perlahan dengan menggunakan stirrer
Atur pH dengan penambahan NaOH hingga 8.0
Tepatkan volume hingga 100 ml
Larutan NaCl 5 M
NaCl
29.22
gram
Akuades hingga volumenya mencapai 100 ml
Buffer TBE 5 × (500 ml)
Tris-base
27
gram
Boric
acid
13.75
gram
EDTA 0.5 M pH 8.0
10 ml
ditepatkan dengan ddH2O hingga 500 ml
Saat pemakaian dalam pembuatan gel agarosa, buffer TBE 5X ini diencerkan
menjadi 0.5X.
Lampiran 3 Prosedur elektroforesis gel agarosa (Sambrook
et al
1989)
0.3 gram agarosa ditimbang dan dilarutkan dalam 30 ml bufer TBE 0.5X dengan
bantuan
oven microwave
selama satu menit 110
0C.
Setelah larut, larutan dibiarkan pada suhu kamar sebentar hingga cukup hangat
dan segera ditambahkan EtidiumBromida sebanyak 1.5
μ
l dan dipindahkan
kedalam cetakan gel yang telah disusun bersama sisirnya.
Gel ditunggu hingga memadat dan sisirnya diangkat.
DNA dilarutkan dengan loading bufer dengan perbandingan 1 : 5 dan
dimasukkan ke dalam sumur yang terbentuk pada gel.
Gel diletakkan dalam bak elektroforesis yang telah diisi dengan bufer TBE 0.5X.
Kemudian dihubungkan dengan adaptor dengan potensial listrik sebesar 100 Volt.
Setelah loading bufer berada + 1 cm dari dasar gel, adaptor dimatikan dan gel
diangkat. Gel diletakkan di bawah sinar UV untuk melihat ada tidaknya pita yang
Lampiran 4 Analisis kuantitatif hasil isolasi RNA kulit batang
No. Sample 260 280 230 260/280 260/230 [RNA] ng/ul F2 0.220 0.198 0.200 1.110 1.103 880 T2 0.094 0.079 0.086 1.183 1.096 376 U2 0.111 0.091 0.099 1.227 1.124 444 V2 0.205 0.171 0.175 1.200 1.172 820 W2 0.106 0.085 0.091 1.177 1.181 424 Y2 0.092 0.081 0.092 1.052 0.996 368 L3 0.144 0.113 0.117 1.269 1.223 576 M3 0.136 0.115 0.119 1.182 1.142 544 N3 0.128 0.101 0.106 1.259 1.203 512 O3 0.126 0.106 0.109 1.187 1.146 504 U4 0.054 0.036 0.038 1.487 1.399 216 V4 0.049 0.027 0.028 1.829 1.724 196 X2 0.035 0.024 0.026 1.487 1.353 140 E5 0.082 0.046 0.051 1.784 1.618 328 F5 0.079 0.046 0.052 1.726 1.530 316 G5 0.105 0.067 0.077 1.574 1.365 420 G4 0.031 0.020 0.023 1.541 1.345 124 H4 0.063 0.052 0.053 1.287 1.180 252 I4 0.088 0.073 0.079 1.200 1.112 352 J4 0.096 0.060 0.065 1.612 1.493 384 K4 0.151 0.097 0.110 1.559 1.372 604 L4 0.164 0.076 0.084 1.358 1.237 416 P3 0.176 0.133 0.140 1.322 1.257 704 Q3 0.162 0.123 0.128 1.318 1.269 648 B7 0.128 0.071 0.076 1.794 1.680 512 C7 0.110 0.073 0.078 1.620 1.511 440 D7 0.101 0.108 0.114 1.678 1.586 404 E7 0.080 0.043 0.038 1.869 2.127 320 F7 0.122 0.080 0.079 1.530 1.541 488 M7 0.074 0.060 0.057 1.233 1.300 296 N7 0.079 0.050 0.046 1.586 1.733 316 P 0.045 -0.017 -0.025 -2.611 -1.812 180 Q 0.087 0.036 0.035 2.448 2.500 348 R 0.116 0.053 0.056 2.175 2.089 464 S 0.049 0.017 0.015 2.893 3.239 196 T 0.073 0.039 0.046 1.847 1.572 292 U 0.083 0.041 0.042 2.022 1.957 332 V 0.107 0.054 0.051 1.976 2.114 428 L1 0.052 0.027 0.027 1.933 1.933 208 M1 0.082 0.028 0.023 2.974 3.593 328 N1 0.033 0.009 0.007 3.584 4.846 132 O1 0.068 0.033 0.030 2.037 2.273 272 P1 0.068 0.034 0.037 2.016 1.835 272 Q1 0.188 0.097 0.101 1.935 1.857 752 T1 0.173 0.100 0.120 1.734 1.445 692 G2 0.074 0.056 0.064 1.335 1.153 296 I2 0.200 0.135 0.136 1.487 1.476 800 J2 0.186 0.111 0.117 1.682 1.594 744 L2 0.182 0.103 0.110 1.794 1.659 728 Y3 0.236 0.135 0.147 1.749 1.600 944 R5 0.233 0.128 0.137 1.814 1.697 932 H5 0.078 0.050 0.056 1.567 1.402 312 I5 0.116 0.066 0.067 1.763 1.743 464 J5 0.159 0.083 0.084 1.907 1.899 636 Z5 0.111 0.075 0.102 1.478 1.085 444
Lanjutan lampiran 4
No. Sample 260 280 230 260/280 260/230 [RNA] ng/ul A6 0.049 0.035 0.040 1.402 1.208 196 B6 0.068 0.041 0.044 1.665 1.551 272 C6 0.180 0.158 0.154 1.139 1.173 729 D6 0.156 0.088 0.093 1.783 1.678 624 F6 0.120 0.072 0.081 1.674 1.477 480 O6 0.079 0.044 0.044 1.790 1.799 316 P6 0.073 0.047 0.045 1.568 1.650 292 Q6 0.026 0.005 0.000 5.012 130.500 104 U6 0.108 0.048 0.056 2.244 1.911 432 V6 0.141 0.068 0.077 2.067 1.837 564 W6 0.109 0.063 0.077 1.730 1.413 436 X6 0.120 0.064 0.070 1.885 1.706 480 Y6 0.111 0.056 0.073 2.000 1.526 444 Z6 0.127 0.065 0.088 1.951 1.443 508 A7 0.147 0.059 0.079 2.497 1.863 588 B7 0.128 0.071 0.076 1.794 1.680 512 C7 0.110 0.073 0.078 1.620 1.511 440 D7 0.101 0.108 0.114 1.678 1.586 404 E7 0.080 0.043 0.038 1.869 2.127 320 F7 0.122 0.080 0.079 1.530 1.541 488 M7 0.074 0.060 0.057 1.233 1.300 296 N7 0.079 0.050 0.046 1.586 1.733 316 X 0.107 0.054 0.051 1.976 2.114 428
Keterangan:
260 = panjang gelombang untuk konsentrasi RNA
280 = panjang gelombang untuk konsentrasi protein
230 = panjang gelombang untuk konsentrasi polisakarida
260/280 = rasio kemurnian RNA dari kontaminasi protein
260/230 = rasio kemurnian RNA dari kontaminasi polisakarida
No. Sampel A260 A280 A230 (260/280) (260/230) [RNA](ng/ul)* A 0.235 0.116 - 2.026 - 1410 B 0.352 0.176 - 2.000 - 2112 J 0.309 0.159 - 1.943 - 1854 D 0.354 0.176 - 2.132 - 2124 L 0.247 0.121 - 2.041 - 1482 F 0.328 0.165 - 1.988 - 1968 N 0.294 0.153 - 1.921 - 1764 Y 0.092 0.050 - 1.840 - 552 V 0.207 0.111 - 1.865 - 1242 F1 0.304 0.158 - 1.924 - 1824 A1 0.249 0.126 - 1.976 - 1494 B1 0.239 0.114 - 2.096 - 1434 C1 0.459 0.243 - 1.888 - 2754 D1 0.560 0.278 - 2.014 - 3360 Q1 0.367 0.187 - 1.962 - 2202 R1 0.396 0.204 - 1.941 - 2376 S1 0.457 0.232 - 1.969 - 2742 T1 0.633 0.321 - 1.972 - 3798 U1 0.257 0.132 - 1.947 - 1542 V1 0.126 0.066 - 1.909 - 756 I2 0.236 0.114 0.115 2.065 2.047 944 R2 0.364 0.220 0.196 1.658 1.854 1456 S2 0.475 0.308 0.291 1.546 1.632 1.900 N2 0.373 0.198 0.215 1.881 1.734 1492 M2 0.091 0.046 0.041 1.986 2.229 364 O2 0.383 0.206 0.219 1.864 1.753 1532 P2 0.479 0.297 0.285 1.615 1.678 1916 D3 0.278 0.159 0.142 1.750 1.964 1112 E3 0.348 0.202 0.182 1.723 1.915 1392 F3 0.274 0.154 0.152 1.775 1.799 1096 G3 0.267 0.147 0.132 1.814 2.018 1068 H3 0.334 0.194 0.170 1.715 1.959 1336 I3 0.168 0.088 0.085 1.918 1.984 672 V3 0.043 0.031 0.036 1.382 1.207 172 Y3 0.278 0.149 0.156 1.859 1.779 1112 Z3 0.315 0.179 0.168 1.762 1.869 1260 A4 0.280 0.170 0.161 1.651 1.743 1120 H4 0.422 0.265 0.244 1.591 1.726 1688 C4 0.027 0.018 0.019 1.464 1.449 108 D4 0.180 0.094 0.090 1.927 2.013 720 Q4 0.055 0.029 0.022 1.918 2.513 220 T4 0.062 0.032 0.030 1.916 2.042 248 W4 0.264 0.150 0.146 1.761 1.806 1056 X4 0.126 0.068 0.059 1.845 2.131 504 Y4 0.330 0.195 0.208 1.694 1.585 1320 Z4 0.336 0.192 0.173 1.752 1.946 1344 A5 0.353 0.210 0.229 1.679 1.541 1412 B5 0.317 0.178 0.236 1.782 1.339 1268 O5 0.288 0.167 0.199 1.725 1.448 1152 R5 0.257 0.135 0.137 1.895 1.872 1028
Lanjutan lampiran 5
No. Sampel A260 A280 A230 (260/280) (260/230) RNA(ng/ul)* S5 0.189 0.096 0.100 1.966 1.887 756 T5 0.173 0.093 0.103 1.854 1.676 692 U5 0.264 0.145 0.131 1.824 2.006 1056 B6 0.141 0.076 0.067 1.861 2.107 564 C6 0.240 0.128 0.124 1.875 1.937 960 J6 0.066 0.035 0.031 1.893 2.111 264 K6 0.207 0.108 0.112 1.918 1.848 828 L6 0.171 0.090 0.089 1.909 1.928 684
Keterangan:
260 = Panjang gelombang untuk konsentrasi RNA
280 = Panjang gelombang untuk konsentrasi protein
230 = Panjang gelombang untuk konsentrasi polisakarida
260/280 = Kemurnian RNA dari kontaminan protein
260/230 = Kemurnian RNA dari kontaminan polisakarida
* = Konsentrasi RNA hasil perhitungan
RNA kulit batang
W F1 G1 H1 I1 J1 L M X1 Z1A2 B2 C2 D2 K L M O U E1
RNA lateks
Lampiran 7 Hasil uji ekspresi gen HbACO1 pada kulit batang tanaman karet
F2 Y2 G4 Z5 A6 C6 F2 T2 U2 V2 W2 Y2 L3 M3N3O3 U4 V4 X2 E5 F5 G5 G4 H4 I4 J4 K4 L4 P3Q3 B7 C7 D7 E7 F7 M7 N7 U P Q R S T X L1 M1 N1 O1 P1 Q1 T1 G2 I2 J2 L2 Y3 R5 H5 I5 J5 Z5 A6 B6 C4 D4 E4 O6 P6 Q6 Y2 A6 X U Z5 E7 M1 P R V4 Q6 I5 Q P6 R5 X2 H5 B6 G2 A6 L1 N1 O6 S C6 J5 C7 O1 E5 D6 P1 Y3 I2 E6 D7 M7 A B J D L F N Y V F1 A1 B1 C1 D1 Q1 R1 S1 T1 U1 V1 I2 R2 S2 N2 M2 O2 P2 D3 E3 F3 G3 H3 I3 V3 Q4 T4 W4 X4 Y4 Z4 A5 B5 O5 R5 S5 T5 V5 B6 C6 J6 K6 L6Keterangan :
d/2, d/4, d/6 = disadap 2 hari sekali, 4 hari sekali, dan 6 kali sehari
E4, E12, E6 = perlakuan dengan etefon 4 kali, 12 kali dan 6 kali dalam setahun Jumlah siklus = 35
Suhu denaturasi, annealing, dan polimerisasi = 95ºC, 55ºC, dan 72ºC
Bark1 rtpcr2, H5 35 siklus, 379 bp H N I J K L M K1 W F1 G1 H1 I1 J1 X1 Z1 A2 B2 C2 D2 Mk K2 N2 O2 P2 Q2 R2 S2 F3 G3 H3 I3 Mk d2 d2 d4 d6 d4 d4 d4 d2 d4 d6 d4 E4 E12 E6 E4
H5 – ACO
Ann. 55
oC, 35 siklus
Marker : SL
J3 K3 X3 A4 B4 C4 D4 E4 F4 S4 T4 Mk d4 d4 d4 d2 d4 d6 d4 d4 d4 d4 d4 E12 E6 E12 E4 E12 E6 E12 E6H5 – ACO
Ann. 55
oC, 35 siklus
Marker : SL
L4 A7 B7 F7 N7 M L4 A7 B7 F7 N7 L4 A7 B7 F7 N7 M d4 d2 d4 d4 d4 d4 d2 d4 d4 d4 d4 d2 d4 d4 d4 E6 E6 E6 E6 E6 E6 E6 E6 E6O48 – ACO, H4 – ACO, H5 ACO
Ann. 55
oC, 35 siklus
Lampiran 8 Analisis semikuantitatif ekspresi gen
Hb
ACO1 kulit batang tanaman
karet pada proses penyadapan
Ekspresi pada perlakuan s2 d/2
0 20 40 60 80 100 120 140 160 0 2 4 6 8 15 30 60 90 120 150 hari ke-eks p res i s2 d/ 2
Ekspresi pada perlakuan s/2 d/4
0 20 40 60 80 100 120 140 160 0 2 4 6 8 15 30 60 90 120 150 hari ke-ek sp re si s2 d/ 4
Ekspresi pada perlakuan S/2 d/6
0 10 20 30 40 50 60 70 80 0 2 4 6 8 15 30 60 90 120 150 hari ke-e ksp resi s2 d/ 6
Keterangan :
S/2 = pohon disadap dengan diameter setengah lingkaran batang
d/2, d/4, d/6 = disadap 2, 4, dan 6 hari sekali
no
sampel hari ke- [ ] (ng/ul)
I 0 150.3008 W 2 0 G1 4 0 Z1 6 67.2999 K2 8 54.4984 N2 15 11.2312 F3 30 43.3041 A4 60 6.7289 Y4 90 0 T5 120 0 U6 150 0 no
sampel hari ke- [ ] (ng/ul)
J 0 143.8399 H1 4 76.4669 A2 6 0 O2 15 23.0232 G3 30 32.6277 B4 60 7.5099 Z4 90 - U5 120 - V6 150 -
no sampel hari ke- [ ] (ng/ul) K 0 0 B2 6 - P2 15 - H3 30 0 C4 60 - A5 90 25.6848 V5 120 67.6731 W6 150 6.7584
Lampiran 9 Analisis semikuantitatif ekspresi gen
Hb
ACO1 lateks tanaman karet
pada perlakuan pemberian etefon
Ekspresi pada perlakuan E3 d/4
0 10 20 30 40 50 60 70 80 90 0 2 4 6 8 15 30 34 60 64 90 120 124 150 hari ke-eksp resi s2 E3/ y
Ekspresi pada perlakuan E6 d/4
0 10 20 30 40 50 60 70 0 2 4 6 8 15 30 34 60 64 90 120 124 150 hari ke-ek sp resi s2 E6/ y
Ekspresi pada perlakuan E6 d/4
0 10 20 30 40 50 60 70 80 0 2 4 6 8 15 30 34 60 64 90 120 124 150 hari ke-eks p resi s2 E12/ y
Keterangan :
E4, E12, E6 = perlakuan dengan etefon 4, 12, dan 6 kali dalam setahun
no
sampel hari ke- [ ] (ng/ul)
L 0 37.1435 I1 4 0 C2 6 78.1727 Q2 15 42.2502 I3 30 52.5241 D4 60 8.0638 B5 90 0 W5 120 0 L6 124 0 X6 150 0 no
sampel hari ke- [ ] (ng/ul) M 0 0 J1 4 - D2 6 0 R2 8 0 J3 30 - X3 34 58.3255 E4 60 14.9572 S4 64 6.9762 C5 90 9.6451 Q5 94 10.015 X5 120 0 M6 124 0 Y6 150 0 no
sampel hari ke-
[ ] (ng/ul) N 0 63.2987 F1 4 - X1 6 32.1879 S2 15 70.3127 K3 30 7.3118 F4 60 10.5351 T4 64 0 D5 90 8.6158 Y5 120 0 N6 124 0 Z6 150 0

![Tabel 2 Konsentrasi RNA total kulit batang No. sampel 260 280 260/280 [ ] ng/µl B U6 0.108 0.048 2.244 432 B V6 0.141 0.068 2.067 564 B W6 0.109 0.063 1.730 436 B X6 0.120 0.064 1.885 480 B Y6 0.111 0.056 2.000 444 B Z6](https://thumb-ap.123doks.com/thumbv2/123dok/2439140.2756736/17.892.479.766.476.1040/tabel-konsentrasi-rna-total-kulit-batang-no-sampel.webp)