BAB 3
METODE PENELITIAN
3.1 Jenis dan Desain Penelitian
Jenis penelitian adalah eksperimental laboratoris dengan desain penelitian
pre-post test only control group design. Eksperimental laboratoris yaitu kegiatan percobaan yang bertujuan mengungkapkan suatu gejala atau pengaruh yang timbul akibat adanya perlakuan tertentu. Desain penelitian pre-post test only control group design, terdapat 1 kelompok sebelum diberi perlakuan, 1 kelompok sesudah diberi perlakuan, yang dipilih berdasarkan kriteria inklusi dan ekslusi kemudian dilakukan uji pada kelompok kelompok kontrol dan perlakuan (Budiharto, 2008; Setiawan, 2009).
3.2 Lokasi dan Waktu Penelitian 3.2.1 Lokasi Penelitian
a. Pengambilan sampel dilakukan di Instalasi Ortodonsia Rumah Sakit Gigi dan Mulut Fakultas Kedokteran Gigi Universitas Sumatera Utara.
b. Pengujian sampel dilakukan di Laboratorium Mikrobiologi Fakultas Kedokteran Universitas Sumatera Utara dan Balai Besar Perbenihan dan Proteksi Tanaman Perkebunan Medan.
3.2.2 Waktu Penelitian
Penelitian dilaksanakan pada bulan Februari 2016 sampai dengan April 2017.
3.3 Populasi dan Sampel Penelitian 3.3.1 Populasi Penelitian
3.3.2 Sampel Penelitian
Pemilihan sampel menggunakan Purposive sampling berdasarkan kriteria eksklusi dan inklusi terhadap cetakan alginat yang diperoleh dengan melakukan pencetakan pasien yang datang ke Instalasi Prostodonsia Rumah Sakit Gigi dan Mulut Fakultas Kedokteran Gigi Universitas Sumatera Utara.
Penentuan besar sampel minimal adalah berdasarkan rumus berikut: (Hanafia, 2003)
Keterangan: t = banyaknya kelompok perlakuan n = jumlah sampel
Dalam penelitian ini akan digunakan t=6 karena jumlah perlakuan sebanyak 6 perlakuan yaitu cetakan alginat direndam sodium hipoklorit0,5% selama 1, 3, 5 menit dengan pengujian pertumbuhan bakteri dan surface detail. Jumlah sampel (n) tiap kelompok sampel dapat ditentukan sebagai berikut:
(t-1) (n-1) ≥ 15 (6-1) (n-1) ≥ 15 5 (n-1) ≥ 15
n ≥ n = 5
Jumlah sampel minimal untuk masing-masing kelompok pada penelitian ini adalah 5 maka jumlah sampel untuk 6 kelompok adalah 30 sampel. Sampel dipilih berdasarkan kriteria inklusi dan eksklusi dengan pembagian sebagai berikut:
Kriteria inklusi:
a. Pasca hemimaksilektomi dengan pertumbuhan Klebsiella pneumoniae
b. Terdapat defek pada rahang atas c. Kesehatan umum baik
d. Bersedia menandatangani informed consent
Kriteria eksklusi:
a. Terdapat tanda-tanda inflamasi pada rongga mulut b. Sedang mendapat pengobatan antibiotik
3.4 Variabel dan Defenisi Operasional
Tabel 3.1 Variabel bebas
Variabel bebas Definisi operasional Skala ukur Alat ukur Satuan ukur Perendaman
cetakan alginat dengan sodium hipoklorit 0,5%
Merendam cetakan alginat hingga seluruh bagian permukaan alginat terendam dalam larutan sodium hipoklorit 0,5%
- - -
Tabel 3.2 Variabel terikat
Variabel terikat Definisi operasional Skala ukur Alat ukur Satuan ukur Pertumbuhan
Klebsiella pneumoniae
Bakteri Gram negatif, mukoid, bentuk batang, dan non motil yang terdapat pada cetakan alginat
pneumoniae pada cetakan alginat 2. Surface detail cetakan alginat
Variabel terkendali
1. Merek alginat yang digunakan
2. Perbandingan bubuk alginat dengan air 3. Teknik pencampuran alginat
4. Suhu aquabidestilata
5. Konsentrasi sodium hipoklorit
6. Waktu perendaman sodium hipoklorit 0,5% 7. Suhu sodium hipoklorit 0,5%
8. Suhu inkubator
9. Lama pengkulturan bakteri 24 jam 10. Suhu water bath
3.5 Metode Pengumpulan Data
Data penelitian diperoleh melalui beberapa metode dalam penelitian ini, yaitu: a. Subjek yang sesuai dengan kriteria inklusi, diberikan informasi mengenai penjelasan tujuan penelitian. Subjek yang setuju untuk menjadi subjek penelitian, diminta menandatangani lembar persetujuan menjadi subjek penelitian.
b. Perhitungan jumlah koloni Klebsiella pneumoniae pada MacConkey agar
secara manual.
c. Pengujian surface detail cetakan alginat dengan menggunakan stereomikroskop.
3.6 Alat dan Bahan Penelitian 3.6.1 Alat Penelitian
Alat-alat yang digunakan dalam penelitian ini adalah a. Sendok cetak rahang atas (Smic, China) (Gambar 3.1)
Gambar 3.1 Sendok cetak rahang atas (Smic, China)
b. Cotton swab steril (Citotest, Indonesia) (Gambar 3.2)
c. Biosafety cabinet (Class II BSC merk ESCO) (Gambar 3.3)
Gambar 3.3 Biosafety cabinet (Class II BSC merk ESCO, USA) d. Inkubator (Binder, USA) (Gambar 3.4)
Gambar 3.4 Inkubator (Binder, USA)
e. Stereomikroskop (Olympus SZX16, Japan) (Gambar 3.5)
Gambar 3.5 Stereomikroskop (Olympus SZX16, Japan)
f. Automatic alginate mixer (Blendex, USA) (Gambar 3.6)
g. Kaca mulut (SMIC, China)
h. Timbangan digital (Mettler Toledo Carat Scale, USA) i. Gelas ukur (Pyrex, USA)
j. Wadah 600 ml (Lionstar, Indonesia) k. Water bath (Clifton, Hongkong) l. Stopwatch (Casio, Japan)
3.6.2 Bahan Penelitian
Bahan-bahan yang digunakan dalam penelitian ini adalah a. Aquabidestilata steril (Kimia Farma, Indonesia) b. Larutan sodium hipoklorit 0,5%
c. Alginat (Alginoplast, Germany) d. Blood Agar
e. MacConkey Agar
3.7 Prosedur Penelitian
Prosedur pada penelitian ini terdiri dari beberapa tahap yaitu sterilisasi alat, persiapan pengambilan cetakan alginat, pengambilan cetakan alginat, pengkulturan sampel, penghitungan jumlah koloni Klebsiella pneumoniae dan pengujian surface detail cetakan alginat.
3.7.1 Sterilisasi Alat
Alat-alat yang disterilisasi adalah tabung reaksi, gelas ukur, kaca mulut, dan sendok cetak. Semua alat tersebut dicuci dan dikeringkan terlebih dahulu. Kemudian, dibungkus dengan aluminium foil dan disterilisasi dalam autoklaf pada suhu 121ºC dengan tekanan 2 atm selama 15 menit.
3.7.2 Persiapan Pengambilan Cetakan Alginat
menjadi subjek penelitian kemudian dilakukan pengambilan cetakan alginat (Egusa, 2008).
3.7.3 Pengambilan Cetakan Alginat
a. Satu subjek penelitian dilakukan tiga kali pencetakan pada rahang atas dengan interval waktu 1 minggu (Gambar 3.7).
Gambar 3.7 Rahang atas pasien pasca hemimaksilektomi (Dok)
b. Subjek penelitian duduk tegak dan dilatih untuk bernafas dari hidung. c. Pemilihan dan penyesuaian sendok cetak rahang atas.
d. Bubuk alginat 23 g dan aquabidestilata 23ºC 50 ml (sesuai petunjuk pabrik) dicampurkan dalam Automatic alginate mixer (Blendex, USA) selama 10 detik.
e. Selanjutnya keluarkan adonan dan aplikasikan pada sendok cetak rahang atas (Gambar 3.8).
f. Masukkan sendok cetak rahang atas ke dalam rongga mulut subjek penelitian.
g. Dengan menggunakan jari telunjuk dan jari manis tangan kanan operator menekan sendok cetak ke atas, dimulai bagian posterior lalu anterior.
h. Waktu mengeras bahan cetak 60 detik (sesuai petunjuk pabrik). i. Lepaskan sendok cetak dari rahang atas.
j. Keluarkan sendok cetak dari dalam rongga mulut (Gambar 3.8).
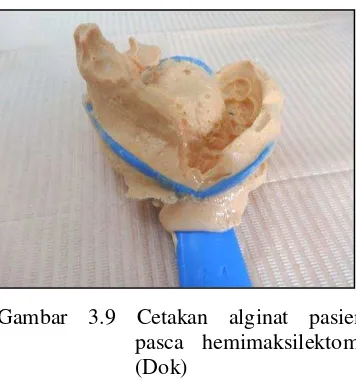
Gambar 3.9 Cetakan alginat pasien pasca hemimaksilektomi (Dok)
3.7.3.1Pembilasan Cetakan Alginat dengan Aquabidestilata
a. Cetakan alginat dibilas dengan aquabidestilata selama 15 detik untuk mensimulasi pembilasan yang dilakukan oleh dokter gigi dan digoyang-goyangkan untuk menghilangkan air yang melekat.
b. Cotton swab steril diusapkan secara menggulung (untuk memastikan pemerataan koloni di cotton swab) pada daerah defek cetakan alginat dengan luas 1 cm×1 cm, ditransfer perlahan dan hati-hati ke blood agar dan MacConkey agar,
Gambar 3.10 (a) Cotton swab diusapkan pada daerah defek cetakan; (b) Hasil swab langsung dikultur pada MacConkey agar (Dok)
3.7.3.2Perendaman Cetakan Alginat Dengan Sodium Hipoklorit 0,5% a. Masukkan cetakan alginat ke dalam wadah yang sudah berisi sodium hipoklorit 0,5 % selama 1 menit (Gambar 3.11).
Gambar 3.11 Cetakan direndam dalam wadah yang sudah berisi sodium hipoklorit 0,5% (Dok)
b. Bilas dengan aquabidestilata selama 15 detik dan digoyang-goyangkan untuk menghilangkan air yang melekat.
c. Cotton swab steril diusapkan pada sisi defek secara menggulung (untuk memastikan pemerataan koloni Klebsiella pneumoniae di cotton swab) pada daerah defek cetakan alginat dengan luas 1 cm×1 cm, ditransfer perlahan dan hati-hati ke
blood agar dan MacConkey agar, diberi label, disimpan dalam cool box untuk dibawa ke laboratorium dan diinkubasi selama 24 jam dengan suhu 37ºC.
d. Perendaman cetakan alginat dalam sodium hipoklorit juga dilakukan untuk perlakuan 3 dan 5 menit
3.7.4 Identifikasi Pertumbuhan Koloni pada Blood Agar dan MacConkey Agar
a. Semua cawan petri yang telah diinkubasi dalam inkubator pada suhu 37ºC selama 24 jam dikeluarkan dari inkubator. Dilihat keadaan koloni yang tumbuh, dan diambil dengan ose steril untuk selanjutnya dilakukan pewarnaan Gram untuk melihat warna, bentuk, dan ciri-cirinya di bawah mikroskop.
b. Pewarnaan gram dilakukan dengan cara mengambil koloni bakteri menggunakan ose, lalu dioleskan pada kaca preparat dan difiksir di atas api (lampu spiritus). Kemudian kaca preparat ditetesi zat warna kristal violet dan dibiarkan selama 3-5 menit lalu dibilas dengan air. Selanjutnya kaca preparat ditetesi lagi dengan larutan lugol, biarkan selama 1 menit lalu bilas dengan air. Setelah dibilas dengan air, tetesi alkohol 96% selama 10 detik hingga zat warna tidak terlihat di atas kaca preparat dan bilas kembali dengan air. Kemudian kaca preparat ditetesi lagi safranin, diamkan selama 1-2 menit lalu bilas dengan air hingga mengering. Preparat yang telah kering diamati di bawah mikroskop cahaya untuk mengamati warna dan bentuk bakteri. Bakteri Gram positif akan tampak berwarna ungu sedangkan bakteri Gram negatif akan berwarna merah.
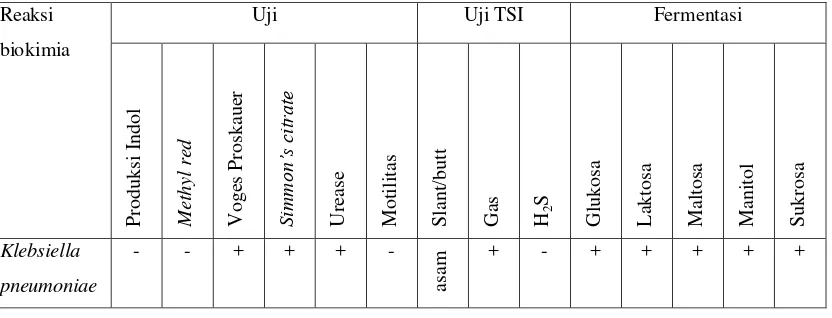
c. Reaksi biokimia diperlukan untuk mengidentifikasi koloni Klebsiella
pneumoniae. Reaksi biokimia terdiri dari uji indol, uji methyl red, uji
Tabel 3.3 Reaksi biokimia Klebsiella pneumoniae padauji identifikasi primer(Kumar, 2013)
d. Identifikasi secara otomatis dilakukan dengan Vitek untuk mengidentifikasi jenis bakteri Klebsiella pneumoniae dari koloni yang sudah murni. Sistem Vitek merupakan sistem otomatis yang melakukan identifikasi bakteri dengan analisis biokimia menggunakan kolorimetri.
3.7.5 Penghitungan Jumlah Koloni Klebsiella pneumoniae
a. Jumlah koloni Klebsiella pneumoniae pada MacConkey agar dihitung secara manual dan diperoleh data dalam satuan Colony Forming Unit (CFU).
b. Jumlah koloni Klebsiella pneumoniae setiap sampel digunakan untuk menentukan persentase selisih jumlah koloni Klebsiella pneumoniae.
c. Rumus persentase penurunan jumlah koloni Klebsiella pneumoniae
umla koloni setela perlakuan umla koloni se elum perlakuan)
umla koloni se elum perlakuan) 1
3.7.6 Pengujian Surface Detail Cetakan Alginat 3.7.6.1 Pembuatan Cetakan Alginat
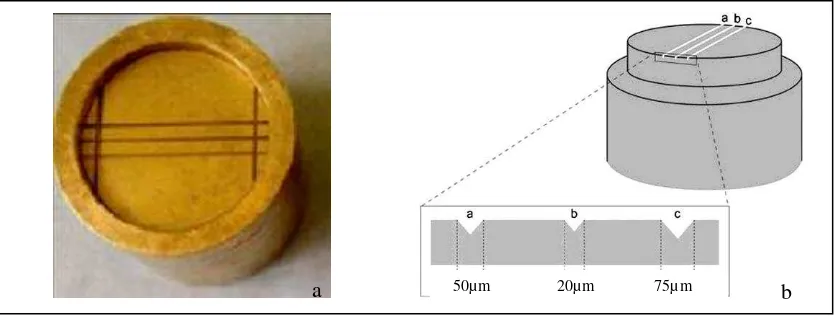
a. Untuk menyamakan keadaan klinis, pembuatan cetakan dengan menggunakan Stainless steel test die, impression mould berdasarkan ANSI/ADA
Gambar 3.12 (a) Stainless steel test die dan impression mould berdasarkan ANSI/ADA
Specification No. 18 (Culhaoglu, 2014); (b) Pandangan secara cross sectional
garis-garis horizontal pada Stainless steel test die (Suprono, 2012)
b. Bubuk alginat 23 gram dan aquabidestilata 23ºC 50 ml (sesuai petunjuk pabrik) dicampurkan dalam alginate mixing machine selama 10 detik.
c. Selanjutnya adonan dikeluarkan dan diaplikasikan pada impression mould
yang sudah dipasang pada Stainless steel test die.
d. Glass plate dan beban 1 kilogram diletakkan di atas impression mould
sebagai simulasi tekanan jari operator.
e. Stainless steel test die, impression mould, glass plate dan beban 1 kg diletakkan dalam water bath 35±1°C sebagai simulasi temperatur rongga mulut selama 90 detik (Gambar 3.13.a).
f. Stainless steel test die, impression mould, glass plate dan beban 1 kg dikeluarkan dari water bath, impression mould dilepaskan dari die.
g. Permukaan cetakan alginat diamati secara manual apakah telah mereproduksi garis 20, 50, 75 µm dengan panjang 25 mm, bila belum maka dilakukan pengulangan (Gambar 3.13.b).
Gambar 3.13 (a) Cetakan berada dalam water bath; (b) Permukaan cetakan alginat diamati secara manual apakah telah mereproduksi garis 20, 50, 75 µm dengan panjang 25 mm (Dok)
3.7.6.2Pembilasan Cetakan Alginat dengan Aquabidestilata
a. Cetakan alginat dibilas dengan aquabidestilata selama 15 detik untuk mensimulasi pembilasan yang dilakukan oleh dokter gigi dan digoyang-goyangkan untuk menghilangkan air yang melekat.
b. Pengamatan dilakukan secara visual dan dengan mempergunakan stereomikroskop (Gambar 3.14) dan diberi skor 1-4 dengan memodifikasi scoring
menurut Culhaoglu (2014)
Skor 1: garis dan detail tidak tampak sama sekali Skor 2: garis terputus, detail buruk
Skor 3: garis tidak terputus, detail kurang jelas Skor 4: garis tidak terputus, detail jelas
Gambar 3.14 Cetakan alginat diuji dengan stereomikroskop dan diberi skor 1-4 (Dok)
3.7.6.3Perendaman Cetakan Alginat dengan Sodium Hipoklorit 0,5% a. Masukkan cetakan alginat ke dalam wadah yang sudah berisi sodium hipoklorit 0,5 % selama 1 menit (Gambar 3.15).
Gambar 3.15 Cetakan alginat direndam dalam sodium hipoklorit 0,5% (Dok)
b. Bilas dengan aquabidestilata selama 15 detik dan digoyang-goyangkan untuk menghilangkan air yang melekat.
c. Cetakan diuji dengan stereomikroskop dan diberi skor 1-4.
3.8 Analisis Data
Pada penelitian ini analisis data menggunakan SPSS 24.
a. Analisis Univarian untuk mengetahui nilai rata-rata dan standar deviasi masing-masing kelompok.
b. Data yang diperoleh dilakukan uji Kruskal-Wallis dengan tingkat kemaknaan (=0,05) untuk melihat pengaruh perendaman cetakan alginat dengan
sodium hipoklorit 0,5% selama 1, 3, 5 menit terhadap jumlah Klebsiella pneumoniae
BAB 4
HASIL PENELITIAN
4.1 Bakteri Klebsiella pneumoniae Sebagai Bakteri Dominan Pada Pasien Pasca Hemimaksilektomi di Rumah Sakit Gigi dan Mulut Fakultas Kedokteran Gigi Universitas Sumatera Utara
Penelitian ini menggunakan sampel cetakan alginat yang berasal dari pasien pasca hemimaksilektomi yang memenuhi kriteria inklusi dan ekslusi sebanyak 6 orang. Usapan dilakukan pada daerah defek cetakan alginat. Hasil usapan dikultur pada blood agar, MacConkey agar dan diinkubasi dalam suasana aerob pada suhu 37ºC selama 24 jam. Hasil kultur menunjukkan pertumbuhan koloni yang beragam warna, ukuran dan bentuk, yang mengindikasi terdapat perbedaan jenis mikroorganisme yang terdapat pada permukaan alginat pasien pasca hemimaksilektomi. Tidak ditemukan pertumbuhan koloni pada blood agar dan
MacConkey dari kontrol negatif pada typodont steril, yang mengindikasikan prosedur sterilisasi yang adekuat.
Koloni Staphylococcus aureus tumbuh dengan morfologi koloni bulat, cembung, dan dikelilingi zona bening hemolysis pada blood agar. Hasil pewarnaan
Gram di bawah mikroskop menunjukkan bahwa morfologi sel berwarna ungu, berbentuk kokus dan susunan seperti buah anggur (berkelompok). Koloni
Staphylococcus aureus dikultur pada Mannitol Salt Agar (MSA) dalam cawan petri dan diinkubasi dalam suasana aerob pada suhu 37ºC selama 24 jam. Hasil kultur menunjukkan terdapat koloni Staphylococcus aureus berwarna kuning dengan yellow zone. Identifikasi Staphylococcus aureus menggunakan latex slide agglutination yang menunjukkan hasil positif ditandai dengan aglutinasi atau penggumpalan dari kombinasi Latex Reagent dengan koloni bakteri yang diamati selama 20 detik.
Pseudomonas aeruginosa dikultur pada media Eosin Methylene Blue (EMB) dalam cawan petri dan diinkubasi dalam suasana aerob pada suhu 37ºC selama 24 jam. Hasil kultur menunjukkan terdapat koloni Pseudomonas aeruginosa yang tumbuh sebagai koloni yang berwarna pink pada media Eosin Methylene Blue (EMB). Hasil identifikasi dengan mesin Vitek menunjukkan bahwa terdapat koloni Pseudomonas aeruginosa.
Koloni Escherichia coli tumbuh sebagai koloni bulat, sedang-besar, bright pink halo, dan pertumbuhan koloni berwarna merah pink. Hasil pewarnaan gram di bawah mikroskop menunjukkan bahwa morfologi sel Escherichia coli terlihat berwarna merah, berbentuk batang lurus berpasangan atau tunggal. Kultur koloni
Escherichia coli pada media Eosin Methylene Blue (EMB) dalam cawan petri dan diinkubasi dalam suasana aerob pada suhu 37ºC selama 24 jam. Hasil kultur menunjukkan terdapat koloni Escherichia coli tumbuh sebagai koloni yang besar dengan metallic green sheen pada media Eosin Methylene Blue (EMB).
Koloni Klebsiella pneumoniae tumbuh sebagai koloni yang mukoid, cembung, berwarna merah muda-merah bata dan koloni memfermentasikan laktosa pada MacConkey agar. Hasil pewarnaan gram di bawah mikroskop menunjukkan bahwa morfologi sel Klebsiella pneumoniae terlihat berwarna merah, berbentuk batang lurus berpasangan atau tunggal, pendek, dan memiliki kapsul secara mikroskopik (Gambar 4.1 a). Kultur koloni Klebsiella pneumoniae pada media Eosin Methylene Blue (EMB). Koloni Klebsiella pneumoniae akan tumbuh sebagai koloni yang besar, mukoid, koloni berwarna pink keunguan tanpa metallic green sheen pada media Eosin Methylene Blue (EMB) (Gambar 4.1 b).
Gambar 4.1 (a) Hasil pewarnaan Gram Klebsiella pneumoniae; (b) Koloni Klebsiella
pneumoniae pada media Eosin Methylene Blue (EMB) (Dok).
Hasil reaksi biokomia sel tersebut memfermentasi glukosa, laktosa, maltosa, manitol, sukrosa. Pada uji indol tidak terbentuk cincin merah. Pada uji methyl red
media tidak berubah warna menjadi merah. Pada uji Voges Proskauer media berubah menjadi warna merah. Pada uji citrate media berubah menjadi warna biru. Pada uji urease media berubah menjadi warna merah. Pada uji motilitas terlihat pertumbuhan bakteri hanya terbatas pada tempat tusukan, uji Triple Sugar Iron (TSI) terlihat warna kuning pada dasar tabung dan bagian yang miring terdapat gelembung gas (Gambar 4.2). Identifikasi dengan Vitek menunjukkan bahwa terdapat koloni tersebut adalah
Klebsiella pneumoniae. Klebsiella pneumoniae yang didapat merupakan bakteri patogen biasa yang belum banyak resisten terhadap antibiotik.
Gambar 4.2 Hasil reaksi biokimia Klebsiella pneumoniae (G: Glukosa, L: Laktosa, M: Maltosa, M: Manitol, S: Sukrosa, I: Indol, MR: Methyl Red, VP: Voges Proskauer, C: Citrate, U: Urease, Motilitas, TSI: Triple Sugar Iron)(Dok). Sampel cetakan alginat yang didapat dari 6 pasien pasca hemimaksilektomi yang tidak didisinfeksi ditemukan koloni Staphylococcus aureus pada 5 pasien (83,33%), Escherichia coli pada 1 pasien (16,67%), Pseudomonas aeruginosa 1 pasien (16,67%) dan Klebsiella pneumoniae pada 5 pasien (83,3%) yang tumbuh pada blood agar dan MacConkey agar (Tabel 4.1).
Tabel 4.1 Pertumbuhan koloni bakteri di blood agar dan MacConkeyagar dari hasil usapan pada daerah defek cetakan alginat pasien pasca hemimaksilektomi
Nama Jenis lesi Pertumbuhan koloni bakteri
Sampel 1
2. Staphylococcus aureus
1. Pseudomonas aeruginosa
2. Staphylococcus aureus
Penelitian ini menggunakan sampel hasil usapan daerah defek pada cetakan alginat yang berasal dari 6 orang pasien pasca hemimaksilektomi. Pasien pasca hemimaksiletomi yang datang ke Rumah Sakit Gigi dan Mulut Fakultas Kedokteran Gigi Universitas Sumatera Utara yang dijadikan sampel sesuai dengan kriteria inklusi dan ekslusi. Squamous cell carcinoma merupakan jenis lesi yang banyak menjadi indikasi dilakukan hemimaksilektomi.
Pertumbuhan koloni bakteri pada blood agar dan MacConkey agar dari hasil usapan pada daerah defek enam cetakan alginat pasien pasca hemimaksilektomi yang tidak didisinfeksi paling banyak diisolasi adalah koloni Klebsiella pneumoniae
sebanyak 5 (lima) sampel (83,3%). Koloni lain yang dapat diisolasi adalah
Tabel 4.2 Pertumbuhan koloni bakteri pada blood agar dan MacConkey agar dari hasil usapan pada daerah defek 6 (enam) cetakan alginat pasien pasca hemimaksilektomi tanpa disinfeksi
Koloni n Persentase
Klebsiella pneumoniae Staphylococcus aureus Escherichia coli
Pseudomonas aeruginosa
5 5 1 1
83,33 83,33 16,67 16,67
4.2 Pengaruh perendaman cetakan alginat pasien pasca hemimaksilektomi dengan larutan sodium hipoklorit 0,5% selama 1, 3, dan 5 menit terhadap pertumbuhan bakteri Klebsiella pneumoniae
Penelitian ini menggunakan sampel cetakan alginat yang berasal dari lima pasien pasca hemimaksilektomi yang terdapat bakteri Klebsiella pneumoniae
sebanyak. Pencetakan setiap pasien dilakukan tiga kali dengan rentang waktu satu minggu sehingga jumlah sampel yang didapat sebanyak 15 sampel dengan perincian 5 sampel yang akan didisinfeksi dengan sodium hipoklorit 0,5% selama 1 menit, 5 sampel yang akan didisinfeksi dengan sodium hipoklorit 0,5% selama 3 menit dan 5 sampel yang akan didisinfeksi dengan sodium hipoklorit 0,5% selama 5 menit. Cetakan alginat pasien pasca hemimaksilektomi dilakukan usapan pada daerah defek cetakan alginat sebelum dan sesudah disinfeksi dengan larutan sodium hipoklorit 0,5% selama 1 menit. Hasil usapan dikultur pada MacConkey agar pada cawan petri dan diinkubasi dalam inkubator selama 24 jam. Setelah 24 jam dilakukan penghitungan jumlah Klebsiella pneumoniae pada cawan petri MacConkey agar
dengan satuan Colony Forming Unit (CFU) (Gambar 4.3).
Gambar 4.3 Koloni Klebsiella pneumoniae pada MacConkey agar (a) sebelum didisinfeksi sodium hipoklorit 0,5%; (b) sesudah disinfeksi sodium hipoklorit 0,5% selama 1 menit (Dok).
Pencetakan kedua dilakukan 1 minggu kemudian, dilakukan usapan pada daerah defek cetakan alginat pasien pasca hemimaksilektomi sebelum dan sesudah disinfeksi dengan larutan sodium hipoklorit 0,5% selama 3 menit. Hasil usapan dikultur pada MacConkey agar pada cawan petri dan diinkubasi dalam inkubator selama 24 jam. Setelah 24 jam dilakukan penghitungan jumlah Klebsiella pneumoniae dengan satuan Colony Forming Unit (CFU) (Gambar 4.4).
Gambar 4.4 Koloni Klebsiella pneumoniae pada MacConkey agar (a) sebelum didisinfeksi sodium hipoklorit 0,5%; (b) sesudah didisinfeksi sodium hipoklorit 0,5% selama 3 menit (Dok).
Pencetakan ketiga dilakukan satu minggu kemudian, dilakukan usapan pada daerah defek cetakan alginat pasien pasca hemimaksilektomi sebelum dan sesudah disinfeksi dengan larutan sodium hipoklorit 0,5% selama 5 menit. Hasil usapan dikultur pada MacConkey agar dan diinkubasi dalam inkubator selama 24 jam. Setelah 24 jam dilakukan penghitungan jumlah Klebsiella pneumoniae satuan Colony Forming Unit (CFU) (Gambar 4.5).
\\
Gambar 4.5 Koloni Klebsiella pneumoniae pada MacConkey agar (a) sebelum didisinfeksi sodium hipoklorit 0,5%; (b) sesudah didisinfeksi selama 5 menit (Dok).
a b
Jumlah koloni Klebsiella pneumoniae yang dihitung setelah cetakan didisinfeksi sodium hipoklorit 0,5% 1, 3, 5 menit dibandingkan dengan jumlah koloni pada cetakan sebelum didisinfeksi (hanya dibilas dengan air). Hasil penurunan jumlah koloni Klebsiella pneumoniae berupa persentase. Penurunan jumlah koloni Klebsiella pneumoniae pada kelompok sampel disinfeksi 1 menit dengan nilai rerata 34,01% dan standar deviasi 21,46%. Penurunan jumlah koloni Klebsiella pneumoniae pada kelompok disinfeksi 3 menit dengan nilai rerata 86,11% dan standar deviasi 3,25%. Penurunan jumlah koloni Klebsiella pneumoniae pada kelompok disinfeksi 5 menit dengan rerata 100% dan standar deviasi 0 (Tabel 4.3).
Tabel 4.3 Jumlah koloni Klebsiella pneumoniae sebelum dan sesudah perendaman cetakan alginat pasien pasca hemimaksilektomi dengan larutan sodium hipoklorit 0,5% selama 1, 3, 5 menit
Perlakuan Sampel Sebelum (CFU)
Tabel 4.4 Pengaruh perendaman cetakan alginat pasien pasca hemimaksilektomi dengan larutan sodium hipoklorit 0,5% selama 1, 3, 5 menit terhadap penurunan jumlah koloni Klebsiella pneumoniae
Perlakuan n p
Disinfeksi sodium hipoklorit 0,5% 1 menit Disinfeksi sodium hipoklorit 0,5% 3 menit Disinfeksi sodium hipoklorit 0,5% 5 menit
5 5 5
0,009
Keterangan : Signifikan (p < 0,05)
4.3 Pengaruh Perendaman Cetakan Alginat Dengan Larutan Sodium Hipoklorit 0,5% Selama 1, 3, Dan 5 Menit Terhadap Surface Detail Cetakan Alginat
Penelitian ini menggunakan sampel cetakan yang didapat dengan melakukan pencetakan pada test die sebanyak 15 sampel dengan perincian 5 sampel yang akan didisinfeksi dengan sodium hipoklorit 0,5% selama 1 menit, 5 sampel yang akan didisinfeksi dengan sodium hipoklorit 0,5% selama 3 menit dan 5 sampel yang akan didisinfeksi dengan sodium hipoklorit 0,5% selama 5 menit. Surface detail cetakan alginat merupakan permukaan cetakan yang berupa reproduksi garis 20, 50, 75 µm dari test block. Setelah cetakan alginat setting, cetakan dilepas dan dianalisa dengan stereomikroskop (Olympus SZX16, Japan) dengan pembesaran 7x. Sebelum cetakan alginat dianalisa dengan stereomikroskop, masing-masing cetakan dianalisa secara visual, cetakan harus mereproduksi diameter garis 50 µm sepanjang 25 mm. Bila spesimen gagal mereproduksi garis maka cetakan tersebut tidak dapat dianalisa dan dibuat lagi spesimen baru. Hasil analisa dinilai dengan skor 1-4 (cara baca halaman 46).
50 µm
20 µm
75 µm
50 µm
20 µm
75 µm
alginat pada kelompok sebelum dan setelah disinfeksi 1 menit menunjukkan reproduksi garis dengan diameter 20, 50, 75 µm dengan skor 4: garis tidak terputus, detail jelas (Tabel 4.5).
Gambar 4.6 Reproduksi garis 20, 50, 75 µm pada cetakan alginat kelompok kontrol dan yang direndam larutan sodium hipoklorit 0,5% selama 1, 3, dan 5 menit dengan stereomikroskop pembesaran 7x (Dok).
Hasil uji normalitas Shapiro-Wilk menunjukkan data skor surface detail
reproduksi garis dengan diameter 20, 50, 75 µm tidak terdistribusi normal untuk kelompok disinfeksi dengan sodium hipoklorit 0,5% 1 menit, 3 menit, 5 menit. Skor reproduksi surface detail untuk garis 20 µm untuk kelompok sebelum dan sesudah
75 µm 75 µm
20 µm
50 µm 50 µm
20 µm
Sebelum disinfeksi sodium hipoklorit 0,5% 1 menit
Sebelum disinfeksi sodium hipoklorit 0,5% 3 menit
Sebelum disinfeksi sodium hipoklorit 0,5% 5 menit
Sesudah disinfeksi sodium hipoklorit 0,5% 1 menit
Sesudah disinfeksi sodium hipoklorit 0,5% 3 menit
Sesudah disinfeksi sodium hipoklorit 0,5% 5 menit
disinfeksi 1 menit dengan nilai median 4, kelompok sebelum dan sesudah disinfeksi 3 menit dengan nilai median 4 dan kelompok sebelum dan sesudah disinfeksi 5 menit dengan nilai median 4. Skor reproduksi surface detail untuk garis 50 µm untuk kelompok sebelum dan sesudah disinfeksi 1 menit dengan nilai median 4, kelompok sebelum dan sesudah disinfeksi 3 menit dengan nilai median 4 dan kelompok sebelum dan sesudah disinfeksi 5 menit dengan nilai median 4. Skor reproduksi
surface detail untuk garis 75 µm untuk kelompok sebelum dan sesudah disinfeksi 1 menit dengan nilai median 4, kelompok sebelum dan sesudah disinfeksi 3 menit dengan nilai median 4 dan kelompok sebelum dan sesudah disinfeksi 5 menit dengan nilai median 4. Hasil uji Kruskal-Wallis menunjukkan tidak terdapat pengaruh perendaman cetakan alginat dalam sodium hipoklorit 0,5% selama 1, 3, 5 menit terhadap surface detail pada cetakan p=1 (p>0,05) (Tabel 4.6).
Tabel 4.5 Reproduksi surface detail garis 20, 50, 75 µm cetakan alginat yang direndam larutan sodium hipoklorit 0,5% selama 1, 3, 5 menit dengan stereomikroskop pembesaran 7x.
Perlakuan Sampel Skor untuk surface detail cetakan alginat
Garis 20 µ m Garis 50 µ m Garis 75 µ m Sebelum Sesudah Sebelum Sesudah Sebelum Sesudah Disinfeksi
Tabel 4.6 Pengaruh perendaman cetakan alginat dengan larutan sodium hipoklorit 0,5% selama 1, 3, 5 menit terhadap surface detail cetakan alginat
Keterangan: Signifikan (p < 0,05)
Perlakuan n Median untuk surface detail cetakan alginat p Garis 20 µm Garis 50 µm Garis 75 µm
BAB 5 PEMBAHASAN
5.1 Bakteri Klebsiella pneumoniae sebagai Bakteri Dominan pada Pasien Pasca Hemimaksilektomi di Rumah Sakit Gigi dan Mulut Fakultas Kedokteran Gigi Universitas Sumatera Utara
Bahan cetak alginat mudah terkontaminasi bakteri karena komposisi, struktur, dan mekanisme hidrofilik setting, sehingga mudah terjadi perlekatan mikroorganisme ke permukaan cetakan (Anusavice, 2013). Pada pasien pasca hemimaksilektomi terjadi hubungan antara rongga hidung ke antrum dan nasofaring menjadi terbuka. Pasien pasca hemimaksilektomi terdapat kerusakan mukosa rongga mulut sehingga saliva dapat bercampur dengan darah. Selama pembuatan cetakan, saliva dan darah masuk ke bahan cetak saat bahan cetak setting. Bahan cetak alginat yang berkontak dengan saliva dan darah berpotensi terkontaminasi berbagai macam mikroorganisme dari rongga mulut (Alwahab, 2012). Cetakan dan model yang diperoleh dengan mencetak rahang atas pasien terkontaminasi sejumlah mikroorganisme, termasuk
Candida, MRSA, dan Pseudomonas aeruginosa, yang diketahui merupakan patogen oportunistik yang berperan pada infeksi nosokomial dan/atau membahayakan nyawa pasien dengan imunitas yang rendah (Egusa, 2008). Pada penelitian ini, cetakan pasien hemimaksilektomi terkontaminasi dengan sejumlah mikroorganisme yaitu
Staphylococcus aureus, Escherichia coli, Pseudomonas aeruginosa, dan Klebsiella pneumoniae. Hasil ini menunjukkan bahwa cetakan yang didapat dari pasien mampu mempertahankan mikroorganisme patogen. Organisme yang terdeteksi pada dasarnya patogen oportunistik, yang bersifat sementara yang ditemukan di rongga mulut.
ditemukan pada rongga mulut dan hidung menunjukkan klon identik atau kerabat dekat (Ohara-Nemoto, 2008).
Staphylococcus aureus tersebar melalui udara dan debu, dan selalu ada di lingkungan rumah sakit. Jalur transmisi biasanya melalui tangan dan ujung jari dengan tingkat pembawa paling tinggi pada pasien dan staf rumah sakit.
Staphylococcus aureus merupakan patogen umum menyebabkan angular cheilitis
(bersama dengan jamur Candida) pada sudut mulut dan infeksi sistemik yang fatal/berat. Staphylococcus aureus memproduksi sejumlah toksin dan enzim sebagai
virulence factor. Resistensi antibiotik terhadap Staphylococcus merupakan masalah di seluruh dunia yang telah menyebabkan munculnya Methicillin-resistant Staphylococcus aureus (MRSA), Vancomycin-resistant Staphylococcus aureus
(VRSA), dan antibiotic-‘tolerant’ isolates (Samaranayake, 2012). Staphylococcus aureus mempunyai membran sel yang tersusun dari lapisan peptidoglikan yang tebal, sebuah mikrokapsul (lapisan mukus yang tipis pada membran sel), dan ketahanan tinggi terhadap faktor lingkungan (tahan terhadap suhu tinggi sampai 70°C, disinfektan, dan larutan antiseptik) sehingga dapat bertahan selama 3 hari pada model gips (Zilinskas, 2014).
Escherichia coli adalah bagian dari mikroflora normal pada usus besar (Samaranayake, 2012). Namun, akibat kebersihan yang buruk Escherichia coli dapat memasuki rongga mulut dan dapat menyebabkan proses inflamasi supuratif.
Escherichia coli merupakan bakteri yang tidak mempunyai kapsul menyebabkannya lebih rentan terhadap kondisi lingkungan yang tidak menguntungkan sehingga hanya dapat bertahan selama 2 hari pada model gips (Zilinskas, 2014).
Pseudomonas aeruginosa merupakan kontaminan nosokomial dan epidemi dapat ditemukan pada instrumen di lingkungan rumah sakit. Pseudomonas aeruginosa merupakan bakteri yang dapat tumbuh pada suhu ruangan. Pseudomonas aeruginosa resisten terhadap banyak antimikroba, sensitif terhadap aminoglycosides
antibiotik yang rasional (untuk mencegah bahaya dari isolat-isolat resisten) (Samaranayake, 2012).
Pada penelitian ini bakteri Klebsiella pneumoniae merupakan bakteri yang paling banyak ditemukan pada pasien pasca hemimaksilektomi di Rumah Sakit Gigi dan Mulut Fakultas Kedokteran Gigi Universitas Sumatera Utara. Klebsiella pneumoniae merupakan bakteri yang diisolasi dari orofaring pada 5% orang sehat dan isolasi yang lebih tinggi pada orang yang dirawat di rumah sakit. Klebsiella pneumoniae dapatmenyebabkan infeksi padabeberapa bagian tubuh manusia, seperti paru-paru, kandung kemih, hati, otak, dan aliran darah. Klebsiella pneumoniae
menyebabkan infeksi yang luas, termasuk pneumonia, infeksi saluran kemih, abses hati, meningitis, dan bakteremia. Bila Klebsiella pneumoniae masuk ke saluran pernapasan bagian bawah dapat menyebabkan pneumonia. Klebsiella pneumoniae
dapatmenyebabkan penyakit berat pada pasien dengan daya tahan tubuh yang lemah, khususnya yang dirawat di rumah sakit (infeksi nosokomial) (Paczosa, 2016).
Klebsiella pneumoniae mempunyai lapisan mukus yang tebal berasal dari polisakarida membentuk kapsul yang menjamin untuk bertahan hidup 5 hari pada model gips (Zilinskas, 2014).
Penggunaan antibiotik spektrum luas yang sering pada pasien yang dirawat di rumah sakit telah menyebabkan peningkatan pengangkutan Klebsiella pneumoniae dan, selanjutnya, pengembangan strain multidrug resistant yang menghasilkan beta-laktamase spektrum luas (extended-spectrum beta-lactamase/ ESBL). Infeksi dari
Klebsiella pneumoniae menyebabkan bakteremia dan peningkatan mortalitas yang signifikan. Selain penggunaan antibiotik sebelumnya, faktor risiko infeksi meliputi adanya kateter, feeding tube, atau kateter vena sentral; status kesehatan yang buruk; dan perawatan di unit perawatan intensif (intensive care unit) (Samaranayake, 2012).
pasca hemimaksilektomi dengan pencetakan rahang atas terdapat Klebsiella pneumoniae dan perlu didisinfeksi secara tepat untuk mencegah infeksi silang dari pasien ke dokter gigi, asisten, perawat, dan tekniker gigi. Membilas cetakan dengan air akan membantu untuk menyingkirkan saliva, darah, dan debris tetapi tidak efektif menyingkirkan bakteri patogen dan sejumlah bakteri akan tetap bertahan pada permukaan cetakan. Oleh karena itu tidak adekuat hanya membilas cetakan tanpa penggunaan disinfektan (Egusa, 2008). Penelitian Haralur (2012) yang hanya melakukan pembilasan cetakan alginat menunjukkan penurunan rerata jumlah bakteri aerob menjadi 74,82 CFU bila dibandingkan dengan tanpa dibilas dengan air terdapat rerata jumlah bakteri aerob 105,64 CFU, pembilasan dengan air merupakan tindakan yang masih dilakukan oleh kebanyakan klinisi. Centers for Disease Control and Prevention (CDC) (2003) dan British Dental Association (BDA) (2009) mempublikasikan bahwa cetakan harus dibersihkan dan disinfeksi.
5.2 Pengaruh Perendaman Cetakan Alginat Pasien Pasca Hemimaksilektomi dengan Larutan Sodium Hipoklorit 0,5% Selama 1, 3, dan 5 Menit terhadap Pertumbuhan Jumlah Klebsiella pneumoniae pada Cetakan Alginat
Pada tabel 4.3 persentase penurunan jumlah koloni Klebsiella pneumoniae
semua bakteri yang terdapat pada cetakan alginat sehingga tidak terdapat lagi
Klebsiella pneumoniae pada cetakan alginat. Mekanisme kerja sodium hipoklorit terhadap mikroorganisme adalah berdasarkan kemampuan penetrasi ke dalam sel mikroorganisme melalui dinding sel dan membran plasma dengan menghambat aktivitas enzim yang penting untuk pertumbuhan mikroorganisme dan merusak membran plasma dan DNA mikroorganisme (Fukuzaki, 2006). Lama waktu perendaman merupakan salah satu faktor yang memengaruhi efektivitas bakteri
Klebsiella pneumoniae. Bahan cetak alginat harus ditangani dengan hati-hati untuk mencegah distorsi selama prosedur disinfeksi. Cetakan alginat dengan waktu kontak paling singkat akan menyebabkan distorsi lebih sedikit selama proses disinfeksi (Haralur, 2012).
Pada tabel 4.4 uji Kruskal-Wallis terdapat pengaruh perendaman cetakan alginat pasien pasca hemimaksilektomi dengan sodium hipoklorit 0,5% selama 1,3,5 menit terhadap jumlah Klebsiella pneumoniae p=0,009 (p<0,05). Hal ini mengindikasikan bahwa perendaman cetakan alginat pasien pasca hemimaksilektomi dengan menggunakan sodium hipoklorit 0,5% selama 1,3,5 menit dapat membunuh jumlah Klebsiella pneumoniae pada cetakan sehingga terjadi penurunan jumlah bakteri Klebsiella pneumoniae. Perendaman cetakan alginat pasien pasca hemimaksilektomi dengan menggunakan sodium hipoklorit 0,5% selama 5 menit paling baik dan dapat efektif membunuh jumlah Klebsiella pneumoniae pada cetakan sehingga tidak terdapat lagi bakteri Klebsiella pneumoniae. Cetakan harus selalu didisinfeksi untuk mencegah infeksi silang. Cetakan alginat setelah dikeluarkan dari rongga mulut sebaiknya dibilas dengan air terlebih dahulu untuk menghilangkan darah, saliva, atau debris yang dapat menghalangi permukaan cetakan dari paparan disinfektan (Al Jabrah, 2007). Cetakan alginat yang tidak didisinfeksi secara adekuat akan terkontaminasi bakteri. Model yang dibuat dari cetakan tersebut akan terdapat jumlah bakteri yang signifikan (Haralur, 2012). Sodium hipoklorit merupakan disinfektan tingkat sedang (intermediate-level disinfectant) yang tidak dapat menginaktivasi spora tetapi dapat membunuh bakteri Gram positif dan Gram negatif,
Penelitian ini menunjukkan bahwa disinfeksi cetakan pasien pasca hemimaksilektomi penting dilakukan dengan tepat untuk mencegah infeksi silang di klinik dan laboratorium dental.
5.3 Pengaruh Perendaman Cetakan Alginat dengan Larutan Sodium Hipoklorit 0,5% Selama 1, 3, dan 5 Menit terhadap Surface Detail Cetakan Alginat
Disinfeksi cetakan dengan perendaman dalam larutan sodium hipoklorit 0,5% saat ini dipercaya efektif untuk kontrol infeksi. Perendaman cetakan dalam sodium hipoklorit 0,5% telah diterima sebagai metode disinfeksi dengan efek yang minimal pada cetakan dan model (Amin, 2009). Disinfeksi cetakan alginat secara umum tidak berpengaruh pada cetakan dan model meskipun signifikan berbeda secara statistik (Kotsiomiti, 2008).
Spesifikasi ISO 1563 menyatakan cetakan alginat harus dapat mereproduksi garis 50 µm tanpa cacat jika cetakan tersebut akan diuji untuk reproduksi surface detail. Gambar 4.6 semua sampel secara visual mampu mereproduksi garis 20, 50, 75 µm dan tampak lebih jelas dengan pembesaran 7× menggunakan stereomikroskop dengan skor 4 (garis tidak terputus, detail jelas). Pada penelitian ini, tidak ada pengaruh pada reproduksi dari garis 20, 50, 75 µm sebelum dan sesudah cetakan alginat didisinfeksi dengan sodium hipoklorit 0,5% selama 1,3,5 menit. Hal ini disebabkan bahan cetak yang diaduk dengan menggunakan alat centrifuge mixing