BAB III
METODE PENELITIAN
3.1 Desain Penelitian
Penelitian ini merupakan penelitian observasional dan dilakukan secara prospektif untuk mengetahui dan menentukan mutasi gen Mycobacterium tuberculosis penyebab resistensi terhadap Rifampicin, Isoniazid, dan Etambutol pada pasien MDR-TB yang memenuhi kriteria periode bulan Agustus sampai November 2016 di RSUP Haji Adam Malik Medan.
3.2 Waktu dan Tempat Penelitian
Penelitian ini dilakukan sejak bulan Agustus sampai November 2016 di poli MDR-TB RSUP Haji Adam Malik Medan. Penentuan mutasi gen Mycobacterium tuberculosis penyebab resistensi terhadap Rifampicin, Isoniazid, dan Etambutol menggunakan metode molekuler PCR dilakukan di laboratorium Terpadu Fakultas Kedokteran Universitas Sumatera Utara.
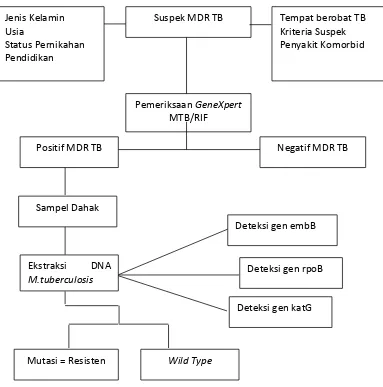
3.3 Kerangka Konsep
Gambar 3.1 Kerangka Konsep
Populasi terjangkau dalam penelitian ini adalah suspek MDR-TB RSUP Haji Adam Malik Medan selama periode bulan Agustus sampai November 2016.
Suspek MDR TB
Positif MDR TB Negatif MDR TB
Sampel Dahak
3.4.3 Sampel Penelitian
Sampel penelitian harus memenuhi kriteria sebagai berikut : a. semua penderita MDR-TB.
b. penderita positif GeneXpert MTB/RIF resisten rifampisin. c. kategori semua gender
d. penyakit Komorbid pada pasien MDR-TB e. pasien MDR-TB dari etnis/suku tertentu. 3.4.4 Teknik Pengambilan Sampel
Pengambilan sampel sebagai subjek penelitian dilakukan dengan metode purposive sampling. Pemilihan sampel berdasarkan karakteristik tertentu yang mempunyai kaitan dengan karakteristik populasi yang sudah diketahui sebelumnya.
3.4.5 Jumlah Sampel
Perhitungan jumlah sampel didasarkan pada Teorema Limit Central (Pierre Simon Laplace, 1749-1827) seperti dikutip dalam Notoatmodjo (2011), yaitu sebuah teorema yang menyatakan bahwa kurva distribusi sampling (untuk ukuran sampel 30 atau lebih) akan berpusat pada nilai parameter populasi dan akan memiliki semua sifat-sifat distribusi normal. Sampel dalam penelitian ini berjumlah 31 orang berdasarkan teori diatas.
3.5 Cara Pengumpulan Data
Pengumpulan data pada penelitian ini, dilakukan sebagai berikut:
keluarga dengan informed consent tertulis dari keluarga dan selanjutnya diikutsertakan dalam penelitian.
b. data riwayat pengobatan, umur, jenis kelamin, status pernikahan, penyakit komorbid dicatat
c. sampel yang digunakan dalam penelitian ini adalah isolat klinik (sputum) yang diperoleh dari pasien poli MDR-TB
d. identifikasi mutasi gen pada sampel sputum yang mengandung Mycobacterium tuberculosis dilakukan di Laboratorium Terpadu Fakultas Kedokteran Universitas Sumatera Utara.
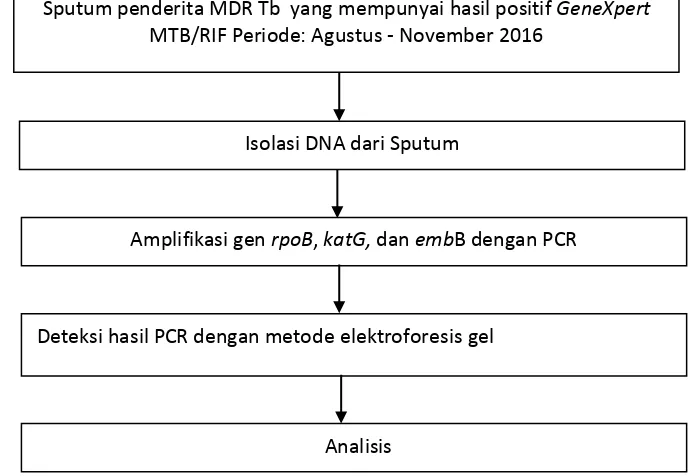
3.6 Alur Penelitian
Alur penelitian disajikan pada Gambar 3.2:
Gambar 3.2 Alur Penelitian
Sputum penderita MDR Tb yang mempunyai hasil positif GeneXpert MTB/RIF Periode: Agustus - November 2016
Isolasi DNA dari Sputum
Amplifikasi gen rpoB, katG, dan embB dengan PCR
Deteksi hasil PCR dengan metode elektroforesis gel
3.7 Etika Penelitian
Etika pada penelitian ini terdiri dari:
a. prosedur penelitian harus mendapat ijin dari Komite Etik Fakultas Kedokteran Universitas Sumatera Utara/RSUP H. Adam Malik.
b. prosedur untuk diikutsertakan dalam penelitian akan dimintakan dari pasien/keluarga dalam bentuk informed consent tertulis.
c. pasien/keluarga berhak menolak untuk diikutsertakan dalam penelitian dengan alasan apapun serta berhak untuk keluar dari penelitian setiap saat.
d. data identitas yang diperoleh dari hasil penelitian akan dirahasiakan.
e. semua biaya yang keluar sebagai akibat ikut serta penelitian akan ditanggung oleh peneliti.
3.8 Prosedur Penelitian
3.8.1 Pengambilan Sampel Sputum (R. Gandasoebrata, 1992)
a. pengambilan sputum sebaiknya dilakukan pada pagi hari, dimana kemungkinan untuk mendapat sputum bagian dalam lebih besar. Atau juga bisa diambil sputum sewaktu. Pengambilan sputum juga harus dilakukan sebelum pasien menyikat gigi.
b. agar sputum mudah dikeluarkan, pasien dianjurkan mengonsumsi air yang banyak kira-kira 2 gelas pada malam sebelum pengambilan sputum.
c. dijelaskan pada pasien yang dimaksud dengan sputum agar yang dibatukkan benar-benar sputum, bukan air liur/saliva ataupun campuran antara sputum dan saliva. Selanjutnya, dijelaskan cara mengeluarkan sputum.
e. sputum diambil dari batukan pertama (first cough)
f. cara membatukkan sputum yaitu ditarik nafas dalam dan kuat (dengan pernafasan dada) batukkan kuat sputum pada mulut wadah penampung. Wadah penampung berupa pot steril bermulut besar dan berpenutup (Screw Cap Medium)
g. diperiksa sputum yang dibatukkan, bila ternyata yang dibatukkan adalah air liur/saliva, maka harus diulangi.
h. sputum yang dipilih sebaiknya mengandung unsur-unsur khusus seperti,: butir keju, darah, dan unsur-unsur lain.
i. bila sputum susah keluar dilakukan perawatan mulut. Perawatan mulut dilakukan dengan obat gliseril guayakolat (expectorant) 200 mg atau dengan mengonsumsi air teh manis saat malam sebelum pengambilan sputum.
j. bila sputum juga tidak bisa didahakkan, sputum dapat diambil secara: i. Aspirasi transtracheal
ii. Bronchial lavage iii. Lung biopsy
3.8.2 Dekontaminasi sampel dengan NaOH (Lisdawati, 2010) a. bahan dan alat
Sarung tangan, masker, tabung falcon, autoclave, vortex mixer, inkubator, pengatur waktu/timer, mesin sentrifugasi rotor conical tube 50 ml 3000xg, sputum,NaOH 4%, buffer fosfat steril pH 6,8.
b. cara kerja
Sampel dalam pot dibuka lalu didekontaminasi dengan larutan NaOH 4% sebanyak 2 ml untuk menghilangkan kontaminasi silang, lalu dipindahkan kedalam tabung falcon, kemudian dihomogenkan menggunakan vortex mixer selama 5-20 detik, lalu dibiarkan selama 15 menit. Ditambahkan buffer fosfat steril pH 6,8 lalu spesimen dipekatkan menggunakan sentrifuse 3000x g selama 15 menit. Larutan supernatan dibuang dan endapan diresuspensi dengan buffer fosfat sebanyak 2 ml. Sampel disimpan pada inkubator suhu 37°C selama 15 menit, kemudian sampel disiapkan untuk proses ekstraksi DNA.
3.8.3 Ekstraksi DNA M.tuberculosis dari sputum dan strain standar H37RV
(PureLink™ Genomic DNA, 2007)
a. bahan dan alat
Sarung tangan, masker, mikropipet, Waterbath atau heat block, tabung ependorf 1,5ml, tip biru 1000 µl, tip kuning 200 µl, mesin sentrifugasi, pengatur waktu/timer, kit ekstraksi DNA PureLink™ Genomic DNA.
b. cara kerja
Waterbath atau heat block diset pada suhu 55 ° C dan 20 µl Proteinase K ditambahkan ke tabung efendorf steril. Suspensi sel (sampai dengan 5 x 106 sel) diambil secara sentrifugasi, media pertumbuhan dibuang lalu sel diresuspensi dalam 200 µl PBS (Phospat Buffer Saline), dan ditambahkan kedalam tabung yang sudah berisi 20 µl Proteinase K. 20 µl RNase A ditambahkan ke lisat, aduk dengan vortexing singkat, dan inkubasi pada suhu kamar selama 2 menit. 200 µl PureLink ™ Genomic Lysis/Binding Buffer ditambahkan ke dalam lysat dan
diaduk dengan vortexing untuk mendapatkan larutan yang homogen setelah itu tube diinkubasi pada 55 ° C selama 10 menit untuk meningkatkan protein digesti. 200 µl etanol 96-100% ditambahkan ke dalam tube lalu vortex selama 5 detik untuk menghasilkan larutan homogen.
3.8.4 Purifikasi DNA (PureLink™ Genomic DNA, 2007) a. bahan dan alat
Sarung tangan, masker, mikropipet, tabung ependorf 1,5ml, tip biru 1000 µl, tip kuning 200 µl, mesin sentrifugasi, pengatur waktu/timer, kit ekstraksi DNA PureLink™ Genomic DNA, Spin Kolom PureLink™.
b. cara kerja
ditambahkan 500 µl Wash Buffer 2 yang dipreparasi dengan etanol ke kolom, kemudian disentrifugasi kecepatan maksimum selama 3 menit pada suhu kamar. Collection Tube dibuang lalu spin kolom ditempatkan dalam tabung microcentrifuge 1,5 ml steril dan ditambahkan 50 µl PureLink ™ Genomic Elution Buffer ke kolom, inkubasi pada suhu kamar selama 1 menit, kemudian disentrifugasi kecepatan maksimum selama 1 menit pada suhu kamar, tabung berisi DNA genomik murni.
Langkah elusi kedua dapat dilakukan untuk mendapatkan DNA lebih menggunakan volume elusi buffer sama dengan elusi pertama, kolom disentrifugasi pada kecepatan maksimum selama 1,5 menit pada suhu kamar. Tabung berisi DNA genomik murni, kolom diambil dan dibuang. DNA dapat diaplikasikan sesuai yang diinginkan atau simpan purified DNA pada - 4°C (jangka pendek) atau -20 ° C (jangka panjang).
3.8.5 Amplifikasi gen rpoB kodon 516, 526, dan 531 Multiplex-PCR (P.Farnia, 2012)
a. bahan dan alat
Sarung tangan, masker, mikropipet, tabung ependorf 1,5ml, tip biru 1000 µl, tip kuning 200 µl, tip putih 10 µl, PCR tube, mesin PCR / Thermal cycler, mesin sentrifugasi, GoTaq® Green Master mix, DMSO, nuclease free water, DNA M.tuberculosis sampel dan standar H37RV, primer RIRm, rpoB 516, rpoB 526, dan rpoB 531 (Tabel 3.1).
b. cara kerja
PCR tube, kemudian amplifikasi fragmen gen rpoB pada mesin PCR/ Thermal cycler pada kondisi seperti Tabel 3.2. Produk PCR diperiksa dengan elektroforesis gel, Wild type M.tuberculosis H37RV akan membentuk pita DNA berukuran 218 bp, 185 bp, dan 170 bp dan suatu sampel dikatakan mutan jika tidak terbentuk pita DNA di daerah 218 bp, 185 bp, dan 170 bp atau salah satu dari pita DNA tersebut. Tabel 3.1 : Primer yang digunakan untuk amplifikasi gen rpoB kodon 516, 526,
dan 531 Multiplex-PCR dan deteksi MDR strains M. tuberculosis.
Target Primer Sequence (5’-3’) Product size (base pair) rpoB 516 rpoB 516 CAGCTGAGCCAATTCATGGA 218
RIRm TTGACCCGCGCGTACAC
rpoB 526 rpoB 526 CTGTCGGGGTTGACCCA 185
RIRm TTGACCCGCGCGTACAC
rpoB 531 rpoB 531 CACAAGCGCCGACTGTC 170
RIRm TTGACCCGCGCGTACAC
Tabel 3.2 : Kondisi Multiplex PCR Thermal cycler gen rpoB
Initial denaturation 5 menit 95°C
b. cara kerja
5 µ L ekstrak DNA ditambahkan 12,5 µL GoTaq® Green Master mix; 0,5 µ L DMSO; 3 µ L nuclease free water dan primer masing-masing 1 µ L dalam PCR tube, kemudian amplifikasi fragmen gen rpoB pada mesin PCR/ Thermal cycler pada kondisi seperti Tabel 3.2. Produk PCR diperiksa dengan elektroforesis gel, Wild type M.tuberculosis H37RV akan membentuk pita DNA berukuran 244 bp, 213 bp, dan 163 bp dan suatu sampel dikatakan mutan jika tidak terbentuk pita DNA di daerah 244 bp, 213 bp, dan 163 bp atau salah satu dari pita DNA tersebut. Tabel 3.3 : Primer yang digunakan untuk amplifikasi gen rpoB kodon 507, 518
dan 533 Multiplex-PCR dan deteksi MDR strains M. tuberculosis.
Target Primer Sequence (5’-3’)
Product size (base
pair) rpoB 507 rpoB 507 GCGATCAAGGAGTTCGG 244
RIRm TTGACCCGCGCGTACAC
rpoB 518 rpoB 518 TGAGCCAATTCATGGACCAGA 213
RIRm TTGACCCGCGCGTACAC
rpoB 533 rpoB 533 CGCCGACTGTCGGCGCT 163
RIRm TTGACCCGCGCGTACAC
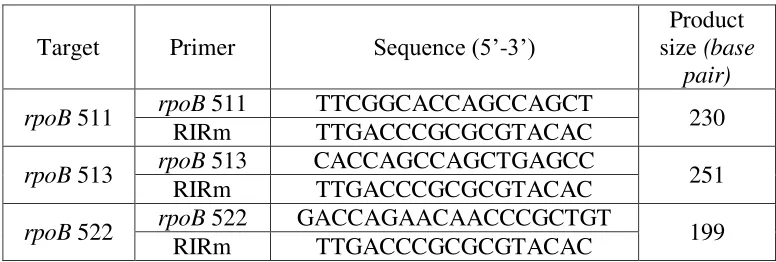
3.8.7 Amplifikasi gen rpoB kodon 511, 513, dan 522 Multiplex-PCR (P.Farnia, 2012)
a. bahan dan alat
b. cara kerja
5 µ L ekstrak DNA ditambahkan 12,5 µL GoTaq® Green Master mix; 0,5 µ L DMSO; 3 µ L nuclease free water dan primer masing-masing 1 µ L dalam PCR tube, kemudian amplifikasi fragmen gen rpoB pada mesin PCR/ Thermal cycler pada kondisi seperti Tabel 3.2. Produk PCR diperiksa dengan elektroforesis gel, Wild type M.tuberculosis H37RV akan membentuk pita DNA berukuran 230 bp, 251 bp, dan 199 bp dan suatu sampel dikatakan mutan jika tidak terbentuk pita DNA di daerah 230 bp, 251 bp, dan 199 bp atau salah satu dari pita DNA tersebut. Tabel 3.4 : Primer yang digunakan untuk amplifikasi gen rpoB kodon 511, 513,
dan 522 Multiplex-PCR dan deteksi MDR strains M. tuberculosis.
Target Primer Sequence (5’-3’)
Product size (base
pair) rpoB 511 rpoB 511 TTCGGCACCAGCCAGCT 230
RIRm TTGACCCGCGCGTACAC
rpoB 513 rpoB 513 CACCAGCCAGCTGAGCC 251
RIRm TTGACCCGCGCGTACAC
rpoB 522 rpoB 522 GACCAGAACAACCCGCTGT 199
RIRm TTGACCCGCGCGTACAC
3.8.8 Amplifikasi gen katG kodon 315 Multiplex-PCR (P.Farnia, 2012) a. bahan dan alat
b. cara kerja
5 µ L ekstrak DNA ditambahkan 12,5 µL GoTaq® Green Master mix; 0,5 µ L DMSO; 5 µ L nuclease free water dan primer masing-masing 1 µ L dalam PCR tube, kemudian amplifikasi fragmen gen katG pada mesin PCR/ Thermal cycler pada kondisi seperti Tabel 3.6. Produk PCR diperiksa dengan elektroforesis gel, Wild type M.tuberculosis H37RV akan membentuk pita DNA berukuran 292 bp dan suatu sampel dikatakan mutan jika tidak terbentuk pita DNA di daerah 292 bp.
Tabel 3.5 : Primer yang digunakan untuk amplifikasi PCR gen katG kodon 315 dan deteksi MDR strains M. tuberculosis.
Target Primer Sequence (5’-3’) Product size (base pair)
katG315 katG5R ATACGACCTCGATGCCGC 292
katGOF GCAGATGGGGCTGATCTACG
Tabel 3.6 : Kondisi Multiplex PCR Thermal cycler gen katG Initial denaturation 5 menit 95°C
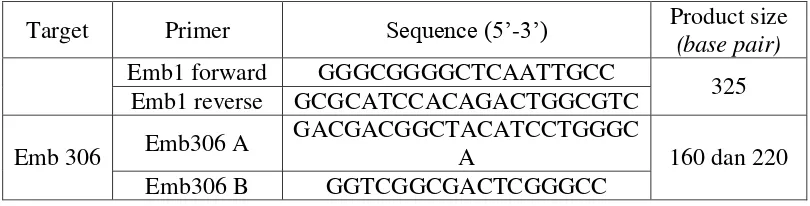
3.8.9 Amplifikasi gen embB kodon 306 dengan Nested Allele Specific-PCR (P.Farnia, 2012)
a. bahan dan alat
b. cara kerja
5 µ L Ekstrak DNA ditambahkan 12,5 µ L GoTaq® Green Master mix, 5,5 µ L nuclease free water dan 2 µ L primer Emb1 forward dan Emb2 reverse pada PCR tube, kemudian amplifikasi fragmen gen embB pada mesin PCR/ Thermal cycler pada kondisi seperti Tabel 3.8. Produk PCR pertama diambil 5 µl ditambahkan 12,5 µ L GoTaq® Green Master mix; 4,5 µ L nuclease free water dan primer emb306A, emb306B, dan Emb2 reverse masing –masing sebanyak 1 µ L, amplifikasi kembali dengan kondisi seperti pada tabel 3.8, kemudian produk PCR dielektroforesis. Wild type M.tuberculosis H37RV akan membentuk pita DNA berukuran 325 bp dan 160 bp atau 220 bp, sedangkan suatu sampel dikatakan mutan jika tidak terbentuk pita DNA berukuran 325 bp dan 160 bp atau 220 bp. Tabel 3.7 : Primer yang digunakan untuk amplifikasi gen embB kodon 306
dengan Nested Allele Specific-PCR dan deteksi MDR strains M. tuberculosis.
Target Primer Sequence (5’-3’) Product size (base pair)
Tabel 3.8 : Kondisi Nested Allele Specific-PCR Thermal cycler gen embB
3.8.10 Deteksi hasil PCR dengan elektroforesis gel agarosa (Made, 2014) a. bahan dan alat
Sarung tangan, masker, mikropipet,erlenmeyer, tip putih 10 µl, perangkat gel elektroforesis, gel documentation system, gel agarosa, buffer TAE 10 x, etidium bromida, BenchTop 1000 bp DNA ladder (Promega).
b. cara kerja
Sebanyak 3,9 g agarosa dalam 130 mL trisasetat EDTA (TAE) 10x dipanaskan hingga larut, kemudian larutan didiamkan hingga hangat dan ditambahkan 1 μL etidium bromida (EtBr). Campuran tersebut dikocok hingga
homogen kemudian dituang ke dalam cetakan dan dibiarkan hingga membeku sempurna. Sebanyak 5 μL sampel hasil PCR dan marker dimasukkan ke dalam
sumur gel agarosa 3%. Proses elektroforesis dilakukan dengan beda potensial sebesar 80 V, 400 A selama 70 menit. DNA hasil amplifikasi yang telah dielektroforesis divisualisasi dengan menggunakan Gel Documentation. Pita DNA akan terlihat dan dapat diketahui ukurannya berdasarkan penanda ukuran molekul yang dinyatakan dengan base pair.
3.9 Analisis Data
BAB IV
HASIL DAN PEMBAHASAN
3.1 Karakteristik Subjek Penelitian
Telah dilakukan penelitian observasional terhadap 31 pasien MDR TB yang akan menjalani pengobatan dan yang telah menjalani pengobatan selama 1 bulan tetapi masih positif BTA. Penelitian dilakukan pada bulan Agustus sampai November 2016 di Rumah Sakit Umum Pusat H. Adam Malik Medan dan Laboratorium Terpadu Fakultas Kedokteran Universitas Sumatera Utara.
Seluruh subjek penelitian yang diikutsertakan dalam penelitian berdasarkan purposive sampling. Semua subjek menandatangani pernyataan persetujuan (informed consent). Penelitian ini telah mendapat persetujuan dari Komisi Etik Penelitian Bidang Kesehatan FK USU.
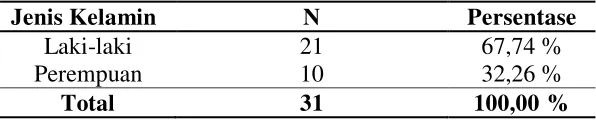
4.1.1 Jenis Kelamin
Karakteristik subjek penelitian berdasarkan jenis kelamin dapat dilihat pada Tabel 4.1:
Tabel 4.1 Distribusi subjek penelitian berdasarkan jenis kelamin
Jenis Kelamin N Persentase
Laki-laki 21 67,74 %
Perempuan 10 32,26 %
Total 31 100,00 %
di Rumah Sakit Dr. Hasan Sadikin Bandung yang menunjukkan bahwa penderita MDR TB lebih banyak pada laki-laki dibandingkan perempuan (56,8%: 43,2%) dan penelitian Susanty pada tahun 2015 di RSUP. H. Adam Malik Medan, bahwa penderita MDR TB laki-laki lebih banyak (71,43%) dibandingkan dengan perempuan (28,57%). Menurut Nofizar (2012), WHO melaporkan prevalensi TB paru 2,3 kali lebih banyak pada laki-laki dibandingkan perempuan terutama pada negara yang sedang berkembang karena laki-laki dewasa lebih sering melakukan aktivitas sosial, sedangkan perempuan lebih sering terlambat berobat atau datang ke fasilitas kesehatan karena berhubungan dengan rasa malu yang lebih dibandingkan dengan laki-laki serta adanya rasa khawatir akan dikucilkan dari keluarga dan lingkungan sekitarnya akibat penyakitnya.
Penelitian yang dilakukan Rifat pada tahun 2014 di Banglades menunjukkan perbandingan prevalensi TB paru antara laki-laki dan perempuan sama hingga umur remaja tetapi setelah remaja prevalensi laki-laki lebih tinggi dari perempuan. Hal ini diduga karena hingga umur remaja kontak hanya terjadi pada lingkungan yang lebih kecil tetapi setelah dewasa laki-laki banyak kontak dengan lingkungan yang lebih besar di luar rumah dibandingkan dengan perempuan di samping faktor biologi, sosial budaya termasuk stigma TB sehingga dapat disimpulkan bahwa jenis kelamin bukan merupakan faktor risiko untuk terjadinya MDR TB.
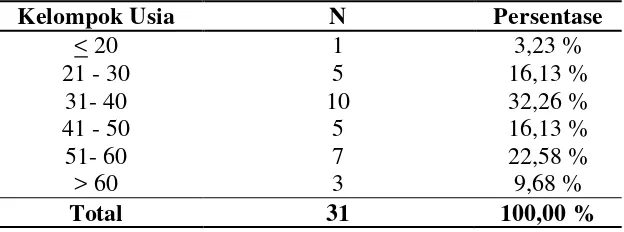
4.1.2 Usia penderita MDR-TB
yaitu sebanyak 10 penderita (32,26%), kemudian rentang usia 51-60 tahun (22,58%) serta rentang usia 21-30 tahun dan 41-50 tahun masing-masing sebesar 16,13%.
Tabel 4.2 Distribusi frekuensi usia penderita MDR-TB RSUP Haji Adam Malik Medan
Kelompok Usia N Persentase
< 20 1 3,23 %
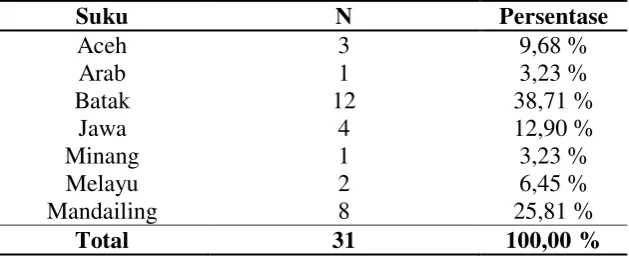
4.1.3 Suku penderita MDR-TB
Karakteristik subjek penelitian berdasarkan suku dapat dilihat pada Tabel 4.3 terbanyak berasal dari suku batak sebanyak 12 sampel (38,71%) dan paling sedikit berasal dari suku arab dan suku minang dengan masing-masing 1 sampel (3,23%). Meskipun ada beberapa bukti untuk mendalilkan predisposisi genetik host sebagai dasar untuk faktor risiko MDR-TB, seperti penelitian dari India, pasien dengan HLA-DRB1*13 dan -DRB1*14 ditemukan memiliki dua kali lipat peningkatan risiko MDR-TB dan pasien di Korea sangat terkait dengan HLA DRB1*08032-DQB1*0601 haplotype. Peran faktor-faktor ini tidak diketahui secara pasti, sangat mungkin bahwa lokus atau alel terkait mempunyai peran permisif dalam memberikan peningkatan kerentanan OAT untuk pengembangan MDR-TB (Sharma dan Mohan, 2004). Hal ini sesuai dengan pernyataan WHO pad global TB report tahun 2014 yang menyatakan bahwa TB paru adalah penyakit yang dapat menyerang semua ras dan suku di seluruh dunia. Tabel 4.3 Distribusi frekuensi suku penderita MDR TB RSUP Haji Adam Malik
Medan
(80,65%). Hasil penelitian Susanty juga mendapatkan bahwa distribusi penderita MDR TB pada tahun 2015 lebih banyak pada penderita yang sudah menikah yaitu sebesar 90,45%, serupa dengan penelitian Bintang (2013) di RSUP H.Adam malik penderita yang sudah menikah, sebanyak 9 orang (64,29%). Sedangkan yang tidak atau belum menikah sebanyak 5 orang (35,71%).
Tabel 4.4 Distribusi subjek penelitian berdasarkan status pernikahan
Status Pernikahan N Persentase
Menikah 25 80,65 %
Belum Menikah 6 19,35 %
Total 31 100,00 %
4.1.5 Status pendidikan penderita MDR-TB
Distribusi status pendidikan penderita MDR-TB pada penelitian ini (Tabel 4.5) paling banyak adalah pendidikan sarjana sebanyak 9 orang (29,03%), dan yang paling sedikit adalah pendidikan pasca sarjana sebanyak 1 orang (3,23%). Tabel 4.5 Distribusi frekuensi status pendidikan penderita MDR-TB RSUP Haji
Adam Malik Medan
Status Pendidikan N Persentase
SD 6 19,35 %
diikuti SD/sederajat, belum bisa disimpulkan bahwa tingkat pendidikan rendah cenderung menjadi faktor risiko terjadinya MDR-TB, karena faktor konseling dari tenaga medis kepada pasien serta dukungan dari keluarga sangat berperan besar dalam kepatuhan pasien dalam mengkonsumsi obat secara tepat.
4.1.6 Tempat Berobat TB Sebelumnya penderita MDR-TB
Berdasarkan frekuensi distribusi tempat berobat TB sebelum penderita MDR-TB masuk ke RSUP Haji Adam Malik Medan dapat dilihat pada Tabel 4.6, dari 31 sampel, penderita MDR-TB yang berobat TB sebelumnya ke praktek dokter swasta 2 orang (6,45%), ke rumah sakit 10 orang (32,26%), ke puskesmas 17 orang (54,84%), ke klinik paru 1 orang (3,23%), dan ke RSU Paru 1 orang (3,23%). Jadi, persentase tertinggi tempat berobat TB sebelum penderita MDR-TB masuk ke RSUP Haji Adam Malik Medan adalah ke puskesmas sebanyak 17 penderita (54,84%).
Tabel 4.6 Distribusi frekuensi tempat berobat TB sebelumnya penderita MDR-TB RSUP Haji Adam Malik Medan
Tempat berobat TB sebelumnya N Persentase
Puskesmas 17 54,84 %
dimanfaatkan oleh penderita untuk diagnosis dan pengobatan TB paling banyak adalah di puskesmas yaitu 47,6%; pasien berhenti setelah minum obat 2-5 bulan sebanyak 39,6%; dan pasien tidak minum obat 57,1%. Ketidakpatuhan berupa kontrol tidak teratur dan mangkir/putus obat merupakan faktor risiko bagi pasien MDR-TB, komunikasi, informasi, dan edukasi yang disampaikan oleh dokter merupakan faktor resiko dari sisi dokter dan sebagian besar pasien tidak meminum obat OAT sesuai panduan yang benar merupakan faktor resiko dari obat pada penderita MDR-TB (Nofizar, 2012).
4.1.7 Penyakit Komorbid penderita MDR-TB
Penyakit komorbid yang diamati pada penelitian ini adalah diabetes melitus dan HIV/AIDS. Dari 31 sampel, 7 orang (22,58%) memiliki penyakit komorbid diabetes melitus, 24 orang (77,42%) tidak mempunyai penyakit komorbid, sedangkan penyakit komorbid HIV/AIDS pada penderita MDR-TB yang dijadikan subjek penelitian tidak ditemukan (Tabel 4.7).
Tabel 4.7 Distribusi frekuensi penyakit komorbid penderita MDR-TB RSUP Haji Adam Malik Medan
Penyakit Komorbid N Persentase
Diabetes Melitus 7 22,58 %
HIV/AIDS 0 0,00 %
Tidak ada penyakit komorbid 24 77, 42 %
Total 31 100,00 %
berhubungan dengan MDR TB yang mempengaruhi outcome pengobatan TB dan merupakan penyakit penyebab gagalnya pengobatan serta menurunnya imunitas penderita terhadap TB karena DM meningkatkan kesensitifan terhadap strain yang resisten terhadap obat. Perubahan metabolik pada penderita DM akan mempengaruhi farmakokinetik OAT melalui perubahan absorbsi, distribusi, metabolisme, dan ekskresi. Efektivitas OAT dipengaruhi oleh kadar obat di dalam plasma sehingga pada kasus DM terjadi penurunan efektifitas OAT dan berakibat terhadap kesembuhan pasien TB. Kadar OAT yang rendah dalam plasma dapat menginduksi resistensi terhadap OAT sehingga menimbulkan komplikasi.
4.1.8 Kriteria Suspek Penderita MDR TB
Berdasarkan kriteria suspek MDR-TB (Tabel 4.8), dari 31 sampel 5 orang (16,13%) terindikasi karena gagal pengobatan ketegori 2, kriteria suspek MDR-TB karena gagal pengobatan kategori 1 sebanyak 6 orang (19,35%), kriteria suspek karena kambuh kategori 1 dan kategori 2 sebanyak 13 orang (41,94%), kriteria suspek MDR-TB karena lalai/default pengobatan kategori 1 atau 2 sebanyak 7 orang (22,58%). Persentase tertinggi kriteria suspek MDR-TB adalah kriteria nomor 6 yaitu karena kambuh kategori 1 dan kategori 2 sebanyak 13 orang (41,94%).
Tabel 4.8 Distribusi frekuensi kriteria suspek penderita MDR-TB RSUP Haji Adam Malik Medan
Kriteria Suspek MDR TB N Persentase
1. Kronik/gagal pengobatan kategori 2 5 16,13 % 2. Pasien dengan hasil pemeriksaan dahak tetap positif
setelah bulan ke 3 pengobatan kategori 2 0 0,00 % 3. Pasien TB yang pernah diobati OAT MDR TB
(Fluorokuinolon dan kanamisin) 0 0,00 %
4. Gagal pengobatan kategori 1 6 19,35 %
5. Pasien dengan hasil pemeriksaan dahak tetap positif
setelah sisipan pada pengobatan kategori 1 0 0,00 %
7. Pengobatan setelah lalai/default pada pengobatan
kategori 1 atau 2 7 22,58 %
Lanjutan Tabel 4.8
Kriteria Suspek MDR TB N Persentase
8. Suspek TB dengan keluhan yang tinggal dekat dengan pasien MDR TB terkonfirmasi termasuk petugas kesehatan yang bertugas di bangsal MDR TB
0 0,00 %
Total 31 100,00 %
Hasil penelitian ini sesuai dengan penelitian Susanty (2015) di RSUP H. Adam Malik Medan bahwa penderita kriteria suspek MDR TB terbanyak yaitu pasien TB kasus kambuh (relaps) kategori 1 dan 2 yaitu sebanyak 40,48% serta penelitian yang dilakukan Sharma (2011) di India yang menunjukkan bahwa dari 40 pasien TB MDR, 29 orang (72,5%) merupakan pasien TB relaps atau kambuh. Tetapi berbeda dengan penelitian yang dilakukan Nofizar di RSUP Persahabatan Jakarta (2012) yang menunjukkan bahwa kriteria suspek MDR-TB terbanyak dikarenakan kasus kronik /gagal pengobatan kategori 2 sebanyak 36%.
3.2 Distribusi mutasi gen rpoB M.tuberculosis pada subjek penelitian
Tabel 4.9 Distribusi mutasi gen rpoB M.tuberculosis pada subjek penelitian
Kodon Termutasi N Persentase
507 24 77,42 %
Lingala di India dengan persentase mutasi rpoB terbanyak pada kodon 531(37,8%), 526 (23%), dan 516 (9,46%).
Resistensi rifampisin dihubungkan dengan mutasi pada gen rpoB, yang mengkode β-subunit RNA polymerase M. tuberculosis (Li e al, 2012). Dengan GeneXpert MTB/RIF yang resistensi terhadap rifampisin dideteksi sebagai gagalnya satu atau lebih rpoB-molecular beacon spesifik untuk menghibridisasi amplikon polimorfisme rpoB, dan yang paling sering terjadi yaitu pada kodon 516, 526, dan 531. Beberapa penelitian menunjukkan bahwa 95% M. tuberculosis yang resisten terhadap rifampisin mengalami mutasi pada gen 81 bp rpoB pada kodon 507 sampai 533 (Li et al, 2012; Castan et al, 2014). Diperkirakan sebanyak 5% M. tuberculosis yang resisten terhadap rifampisin mengalami mutasi di luar hot spot region rpoB (Li et al, 2012).
Gambar 4.1 Elektroforesis produk PCR 213 bp dan 163 bp fragmen gen rpoB M.tuberculosis dengan primer rpoB518, rpoB533, dan RIRm dalam agarose 3%.
Keterangan :
- Lane A : 1000 bp DNA Ladder/Marker - Lane 1 dan 28 : kontrol negatif
Gambar 4.2 Elektroforesis produk PCR 251 bp dan 230 bp fragmen gen rpoB M.tuberculosis dengan primer rpoB511, rpoB513, dan RIRm dalam agarose 3%.
Keterangan:
- Lane A : 1000 bp DNA Ladder/Marker - Lane 1 dan 28 : kontrol negatif
Gambar 4.3 Elektroforesis produk PCR 218 bp, 185 bp dan 170 bp fragmen gen rpoB M.tuberculosis dengan primer rpoB516, rpoB526, rpoB531 dan RIRm dalam agarose 3%.
Keterangan :
- Lane A : 1000 bp DNA Ladder/Marker - Lane 1 dan 28 : kontrol negatif
Gambar 4.4 Elektroforesis produk PCR 244 bp dan 199 bp fragmen gen rpoB M.tuberculosis dengan primer rpoB507, rpoB522, dan RIRm dalam agarose 3%.
Keterangan :
- Lane A : 1000 bp DNA Ladder/Marker - Lane 3 dan 29 : kontrol negatif
- Lane 1,2 dan 27-28 : hasil PCR H37RV wild type (kontrol positif) - Lane 4-26 dan 30-37 : hasil PCR sampel 1-31
berikatan dengan RNAP. Selain hal itu, konformasi RIF yang kaku diduga juga mengakibatkan RIF tidak dapat beradaptasi terhadap mutasi yang merubah bentuk dan lingkungan kimia tapak pengikatnya. Jika RIF terikat lemah dengan RNAP mengakibatkan perubahan posisi RIF, terutama pada kondisi enzim yang bersifat dinamis dan juga dipengaruhi oleh adanya molekul air. Bila posisi RIF berubah sedemikian rupa sehingga tidak lagi menghalangi jalur perpanjangan RNA, maka kemungkinan proses transkripsi akan terus berjalan dan bakteri akan resisten terhadap RIF (Ubyaan, 2012).
Tabel 4.10 Distribusi perubahan asam amino gen rpoB yang termutasi
Kodon Termutasi Perubahan Nukleotida Perubahan asam amino
511 CTG → CCG Leu → Pro
3.3 Distribusi mutasi gen katG M.tuberculosis pada subjek penelitian
Distribusi mutasi gen katG M.tuberculosis pada Tabel 4.11 dan hasil elektroforesis produk PCR ditunjukkan pada Gambar 4.5. Berdasarkan uji yang dilakukan 26 sampel dari 31 sampel (83,87%) mengalami mutasi pada gen katG M.tuberculosis terjadi pada kodon 315 yang berarti 26 orang mengalami resistensi terhadap INH dan juga mengalami resistensi terhadap rifampisin. Pada penelitian Susanty (2015) didapatkan 42 dari 48 sampel yang resisten terhadap rifampisin juga
resisten terhadap isoniazid berdasarkan hasil uji kepekaan metode proporsi media LJ
atau terdapat 87,5% penderita yang resisten terhadap rifampisin juga resisten terhadap
Tabel 4.11 Distribusi mutasi gen katG 315 M.tuberculosis pada subjek penelitian
Distribusi Mutasi N Persentase
Mutan 26 83,87 %
Wild type 5 16,13 %
Total 31 100,00 %
Gambar 4.5 Elektroforesis produk PCR 270 bp fragmen gen katG M.tuberculosis dengan primer katG5R dan KatGOF dalam agarose 3%.
Keterangan Gambar :
- Lane A : 1000 bp DNA Ladder/Marker - Lane 1 dan 23 : kontrol negatif
- Lane 2 dan 24 : hasil PCR H37RV wild type (kontrol positif) - Lane 3-22 dan 25-35 : hasil PCR sampel 1-31
carrier protein (ACP) reduktase yang dikenal sebagai inhA sehingga memblokade aktivitas sintesis asam lemak serta menghambat sintesis asam mikolat yang diperlukan untuk dinding sel mikobakterium. Kehilangan aktivitas katalase peroksidase (katG) akan menyebabkan resistensi terhadap INH, yang disebabkan oleh adanya mutasi pada gen katG. Kebanyakan peristiwa mutasi dijumpai antara kodon 138 dan 328, dan yang paling sering pada kodon 315 dari gen tersebut. (Rattan, 1998)
Beberapa varian mutasi pada kodon 315 gen katG M.tuberculosis yaitu Ser315Thr (AGC→ACC), Ser315Thr (AGC→ACA), Ser315Asn (AGC→AAC),
Ser315Ilo (AGC→ATC), Ser315Arg (AGC→CGC), Ser315Arg (AGC→AGA),
dan Ser315Gly (AGC→GGC), tetapi mutasi paling banyak adalah mutasi
Ser315Thr (AGC→ACC) dan menyebabkan perubahan asam amino serin menjadi treonin yang akan mengekspresikan protein katalase-peroksidase mutan. (Ramaswamy, 2003).
3.4 Distribusi mutasi gen embB M.tuberculosis pada subjek penelitian
Tabel 4.12 Distribusi mutasi gen embB 306 M.tuberculosis pada subjek penelitian
Distribusi Mutasi N Persentase
Mutan 9 29, 03 %
Wild type 22 70,97 %
Total 31 100,00 %
Gambar 4.6 Elektroforesis produk PCR 325 bp, 160 bp dan 220 bp fragmen gen embB M.tuberculosis dengan primer embB306A dan embB306B serta primer emb1F dan emb2R dalam agarose 3%.
Keterangan Gambar :
- Lane A : 1000 bp DNA Ladder/Marker - Lane 1 dan 23 : kontrol negatif
- Lane 2 dan 24 : hasil PCR H37RV wild type (kontrol positif) - Lane 3-22 dan 25-35 : hasil PCR sampel 1-31
genetika dengan bakteri yang sensitif. Apabila populasi bakteri beradaptasi dengan kehadiran antibiotika, sel-sel yang sensitif secara perlahan akan digantikan oleh bakteri yang resisten yang membawa gen untuk memacu sifat resisten. Pada paparan OAT yang tidak adekuat, bakteri yang sensitif akan mati dan mutan akan berkembang biak dengan pesat tanpa adanya persaingan yang berarti dalam hal nutrisi. Tuberkulosis pada kasus MDR cenderung akan berkembang menjadi kasus kronik dan kondisi ini semakin mempermudah penyebaran M. tuberculosis galur MDR. Mutasi terhadap OAT terjadi 10-9 kali per pembelahan sel. Oleh sebab itu OAT diberikan secara kombinasi untuk memperkecil kemungkinan terjadinya mutasi hingga 10-18 per pembelahan sel (Rinanda,2015).
Ethambutol (EMB), digunakan dalam kombinasi dengan obat lain dan spesifik terhadap mikobakterium yang sedang mengalami diferensiasi mampu menghambat arabinosyl transferase (embB) yang terlibat pada biosintesis dinding sel bakteri. Berbagai studi berhasil mengidentifikasi lima macam mutasi pada kodon 306 [(ATG‐GTG), (ATG‐CTG), (ATG‐ATA), (ATG‐ATC) dan (ATG‐ ATT)] yang menghasilkan substitusi asam amino (Val, Leu, dan Ile) pada isolat resisten EMB.
Dari hasil penelitian didapatkan bahwa 4 dari 31 sampel (12,90%) mengalami monoresisten rifampisin (R), 18 dari 31 sampel (58,06%) mengalami resisten terhadap rifampisin dan isoniazid (RH), 8 dari 31 sampel (25,81%) mengalami resisten terhadap rifampizin, isoniazid dan etambutol (RHE), serta 1 sampel lainnya (3,23%) mengalami polyresisten terhadap rifampisin dan etambutol (RE). Beberapa penelitian di Indonesia juga menunjukkan angka monoresisten yang rendah seperti yang dilaporkan oleh Aditama dalam Sihombing (2012) yang mendapatkan angka 0,50% pada monoresisten rifampisin dan hasil penelitian Sihombing di RSUP Haji Adam Malik Medan pada tahun 2012 yang mendapatkan monoresisten rifampisin hanya ada 1 kasus (1,18%) dari 18 kasus monoresisten primer. Penelitian Bintang (2015) diperoleh resistensi pada rifampisin dan INH (RH) sebanyak 4 orang (28,58%), resitensi terhadap rifampisin, INH, etambutol (RHE) dan sebesar 2 orang (14,28%).
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Berdasarkan hasil penelitian dan pembahasan, dapat disimpulkan
a. karakteristik pasien MDR-TB di RSUP Haji Adam Malik berdasarkan jenis kelamin lebih banyak pada laki-laki yaitu 21 orang ( 67,74%). Berdasarkan usia penderita MDR terbanyak yaitu 31-40 tahun sebanyak 10 orang (32,26%). Berdasarkan suku paling banyak suku batak sebanyak 12 orang (38,71%). Berdasarkan status pernikahan paling banyak penderita sudah menikah yaitu 25 orang (80,65 %). Berdasarkan tingkat pendidikan paling banyak penderita mempunyai pendidikan Sarjana yaitu 9 orang (29,03%), berdasarkan tempat berobat TB penderita sebelumnya paling banyak di puskesmas yaitu sebanyak 17 orang (54,84%), berdasarkan penyakit komorbid yang dijumpai yaitu diabetes melitus sebanyak 7 orang (22,58%), dan berdasarkan kriteria suspek MDR TB paling banyak yaitu pasien TB kasus kambuh (relaps) kategori 1 dan kategori 2 sebanyak 13 orang (41,94%.).
c. sebanyak 83,87% dari sampel mengalami mutasi gen katG M.tuberculosis di kodon 315 yang mengakibatkan resistensi terhadap INH dan juga mengalami resistensi rifampisin.
d. sebanyak 29,03% dari sampel mengalami mutasi gen embB M.tuberculosis di kodon 306A sehingga menimbulkan resistensi terhadap etambutol.
e. kodon yang bermutasi pada isolat klinis pasien MDR-TB pada RSUP Haji Adam Malik Medan sesuai dengan yang dilaporkan untuk strain dari bagian lain dunia, terutama mutasi umum yang mencerminkan pola global
f. dari hasil penelitian didapatkan bahwa 4 sampel (12,90%) mengalami monoresisten rifampisin (R), 18 sampel (58,06%) mengalami resisten terhadap rifampisin dan isoniazid (RH), 8 sampel (25,81%) mengalami resisten terhadap rifampizin, isoniazid, dan etambutol (RHE), serta 1 sampel lainnya (3,23%) mengalami polyresisten terhadap rifampisin dan etambutol (RE).
5.2 Saran
Berdasarkan hasil penelitian disarankan:
a. penelitian lebih lanjut untuk memastikan asam amino mana yang termutasi dengan cara sequensing DNA yang dihasilkan dari penelitian ini.
b. memeriksa varian mutasi pada gen rpoB selain pada 81 bp untuk memastikan mutasi gen rpoB selain pada RRDR penyebab resistensi rifampisin
c. memeriksa varian mutasi gen ahpC, inhA, kasA dan ndh untuk memastikan mutasi selain gen katG penyebab resistensi INH.
e. dilakukan penyuluhan oleh tenaga kesehatan kepada masyarakat luas mengenai bahaya MDR-TB disertai cara penularan penyakit, pencegahan, serta penanggulangan jika telah menderita MDR-TB.