1 Larutan (Solutions)
Termodinamika telah dipelajari adalah termodinamika yang diterapkan pada sistem kimia yang murni atau material yang komposisinya tetap. Misal sistem PVT pada sistem GAS.
Pada kuliah ini termodinamika akan diterapkan pada sistem suatu campuran. Misal sistem termodinamika pada Larutan.
Larutan adalah suatu campuran yang bersifat homogen.
Tabel 1.1. Contoh beberapa jenis larutan dan komponen pembentuknya.
1.1 Termodinamika dari campuran gas-ideal.
Proses Pencampuran, melibatkan antaraksi pelarut-pelarut, terlarut-terlarut dan pelarut-terlarut.
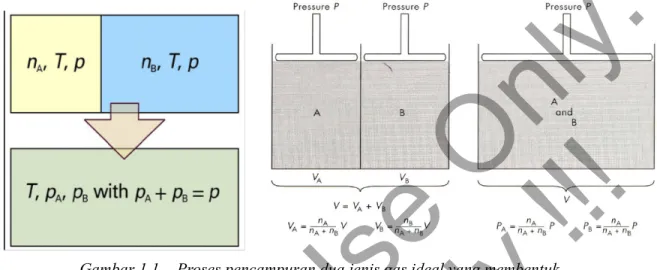
Gambar 1.1 Dua gas saling bercampur yang akan saling mengisi ruang gas lawannya.
Sifat termodinamika dari campuran senyawa diturunkan dari perubahan sifat yang diamati saat senyawa dicampurkan. Proses pembentukkan campuran gas ideal yang hasilnya merupakan gas yang ideal juga dan memenuhi Hukum Dalton yaitu, “Tekanan yang diperlukan untuk menjaga agar campuran gas berada dalam wadahnya adalah merupakan jumlah total tekanan gas yang diperlukan untuk menjaga masing-masing komponen tersebut dalam wadah yang sama”
Gambar 1.1. Proses pencampuran dua jenis gas ideal yang membentuk campuran gas ideal pada tekanan dan suhu tetap.
Pada suatu sistem seperti pada 1.1 akan berlaku hubungan : V =VAVB P=PAPB VA= nA nAnB V PA= nA nAnB P VB= nB nAnB V Pb= nb nAnB P
Proses pencampuran gas A yang memiliki nA dengan volume VA dan gas B yang memiliki VB dengan
volume VB. Keduanya berada pada P dan T yang sama. Dari persamaan gas ideal diketahui bahwa V =nRT
P , sehingga saat gas belum dicampur akan berlaku VA= nART
P dan VB= nBRT
P . Dengan demikian jumlah volum semua gas sebelum proses pencampuran dilakukan adalah
nART P nBRT P =nAnB RT P .
Setelah dilakukan proses pencampuran, volum total gas adalah sama dengan sebelum pencampuran yaitu nAnB
RT
P , namun volum ini sekarang tersedia untuk semua gas. Sehingga untuk gas A yang awalnya memiliki volume VAsetelah proses pencampuran gas A akan berekspansi /mengambil tempat yang awalnya dimiliki oleh gas B, sehingga volum gas A akan menjadi VAVB, demikian juga
berlaku untuk dengan gas B.
Akibatnya gas A dan B akan mengalami ekspansi dan tekanan masing-masing gasnya akan turun, sehingga tekanan gas setelah turun menjadi tekanan parsial masing masing gas. Dalam proses ini tekanan gas A turun dari P menjadi PAdan tekanan gas B juga mengalami penurunan dari P menjadi PB . Proses ini juga mengakibatkan Energi Bebas Gibbs dari masing masing gas ikut turun.
Dari hubungan Maxwell diketahui: dU =TdS−PdV dH =TdS VdP dG=−SdT VdP dA=−SdT −PdV (1.1) Sehingga
dG dP
T =V , maka dG =V dP∫
dG=∫
V dP G =∫
nRT P dP =nRT∫
dP P =nRT lnP2 P1 (1.2) Perbedaan energi bebas A dan B dalam keadaan campuran adalahGA campuran−GA murni=nART ln PA P =nART ln xA GB campuran −GB murni=nBRT lnPB P =nBRT ln xB (1.3)
Perubahan energi bebas campuran, Gcampuran, untuk pencampuran sejumlah mol nAdan nBadalah:
Gcampuran=
[
GAcampuranGBcampuran]
−[
GA murniGBmurni ]
=RT
[
nAln xAnBln xB]
(1.4)Sehingga perubahan energi bebas untuk pembentukkan 1 mol larutan yang dibentuk dari 1 mol total gas A dan gas B diperoleh dengan membagi perubahan energi bebas dengan jumlah total mol gas-gas pembentuknya.
Gcampuran=RT
[
xAln xAxbln xB] (1.5) Terlihat bahwa xA dan xB masing masing bernilai lebih kecil dari satu, sehingga ln xA dan ln xBakan bernilai negatif. Ini membuktikan bahwa pada proses pencampuran gas ideal, besarnya perubahan energi bebasnya adalah negatif dan berarti proses pencampuran gas ideal akan berlangsung secara spontan.
Persamaan 1.4 dan 1.5 yang diturunkan dari sistem biner dapat diperluas untuk sistem multi komponen. Ungkapan matematiknya adalah:
Gcampuran=RT
∑
njln xj (1.6)dan
Gcampuran=
∑
RT xjln xj (1.7)Definisi larutan ideal
Energi bebas pada persamaan 1.4 hingga 1.7 diturunkan dari Hukum Dalton untuk campuran gas-ideal. Bagaimana pengaruh persamaan ini terhadap perubahan volum, perubahan entalpi dan perubahan entropi dari suatu proses pencampuran.
1. Perubahan volum pada proses pencampuran.
Perubahan volum diturunkan dari persamaan ∂G /∂ P T=V . Bila diterapkan pada energi bebas
produk terhadap energi bebas pereaksi untuk suatu proses pencampuran, ungkapannya adalah
[
∂ Gcampuran/∂P]
T = Vcampuran., karena Gcampuran adalah bukan merupakan fungsi daritekanan, maka
Vcampuran=0 (larutan ideal) (1.8)
2. Perubahan entalpi pada proses pencampuran.
Perubahan entalpi diturunkan dari
[
∂G /T /∂T]
=−H /T2. Karena Gcampuran/T tidak melibatkan temperatur, maka untuk pencampuran suatu larutan ideal berlakuHcampuran=0 (larutan ideal) (1.9)
3. Perubahan entropi pada proses pencampuran.
Perubahan entropi diturunkan dari
[
∂Gcampuran/∂T ]P
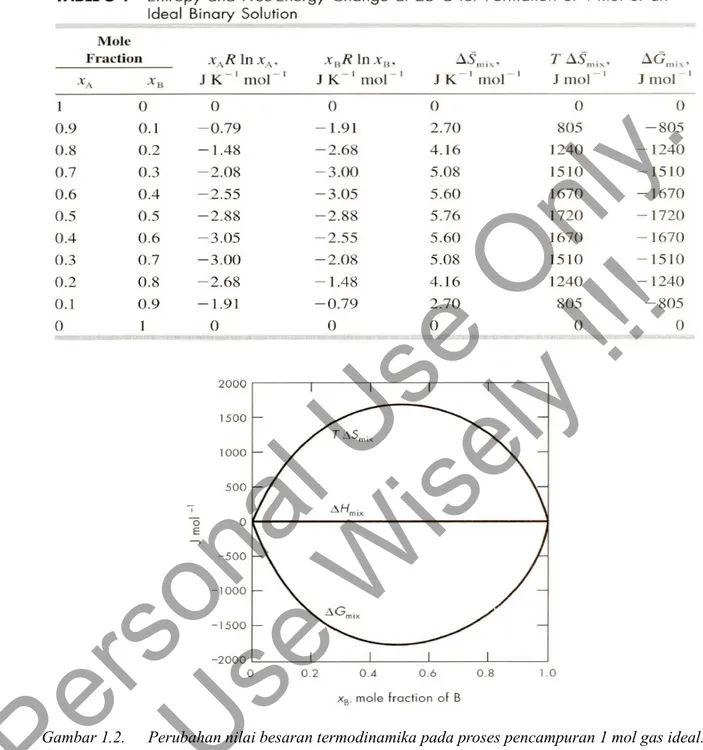
=−Scampuran, dengan nilai Hcampuran=0 dan Gcampuran=Hcampuran−T Scampuran diperoleh : Scampuran=−R xAln xA−xBln xB ( 1mol, larutan ideal) (1.10) 1.2 dan 1.2 memperlihatkan memperlihatkan harga termodinamika dari proses pencampuran. Saat gas ideal bercampur, energi bebas berkurang dan entropi bertambah. Hal ini terjadi karena volume untuk tiap komponen bertambah.
Proses pencampuran gas mengikuti perilaku gas ideal ini, ke-idealan hilang bila kondisi berada pada tekanan tinggi atau suhu rendah. Untuk campuran larutan, sifat gas-ideal dapat dilakukan sebagai titik awal. Beberapa larutan cair mengikuti perilaku gas ideal, sebagaian mengalami penyimpangan. Dapat di amati bahwa volume campuran suatu larutan tidak selalu sama dengan jumlah volum dari masing-masing pelarutnya.
Tabel 1.2. Perubahan entropi dan energi bebas pada suhu 250 C untuk 1 mol larutan ideal.
Gambar 1.2. Perubahan nilai besaran termodinamika pada proses pencampuran 1 mol gas ideal.
1.2 Sifat komponen dari suatu campuran
Sifat termodinamika dari suatu komponen dalam campurannya dikenal sebagai sifat “kuantitas molar parsial” (partial molar quantity) dan didefinisikan sebagai perubahan sifat dalam suatu campuran untuk setiap perubahan jumlah komponen tersebut.
Mengapa ‘partial molar quantity’ ini penting ? Kita amati sifat volum suatu campuran nyata dengan campuran ideal. Bila suatu campuran A dan B. yang menjadi pertanyaan adalah berapa banyak masing-masing komponen dalam campurannya. Ekperimen menunjukkan bahwa volume total dari suatu campuran larutan tidak selalu merupakan jumlah total volume dari masing-masing.
Contoh: Bila 50 mL air dicampur dengan 50 mL etanol hasilnya tidak 100 mL etanol, tetapi 95 mL etanol. Atau bila 1 g magnesium sulfat dilarutkan dalam 100 mL air, ditemukan bahwa volume akhir air ternyata kurang dari 100 mL. Hal ini terjadi karena terdapat ketidak-idealan saat proses pencampuran terjadi.
Untuk mengatasi keadaan ideal dan non ideal didefinisikan suatu besaran termodinamika baru yaitu, volume molar. Volum molar suatu komponen dalam suatu larutan adalah besarnya perubahan volum larutan yang terjadi akibat penambahan 1 mol komponen tersebut ke dalam sejumlah larutan yang memiliki volum yang besar sekali.
Misalkan ada nA mol senyawa A dan nB mol senyawa B dicampurkan. Seandainya volume campuran
larutan adalah V maka, volum molar yang didiberikan oleh komponen A dalam larutan adalah
∂V∂V nA
NB,T , P.
∂V∂nA
adalah ‘partial molar volume’ atau volum molar parsial dari A dalam larutan. Biasa ‘partial molar volum’ ini disimbolkan sebagai VA. Volum molar parsial suatu komponen dalam larutan tergantung pada fraksi mol zat terlarut dalam larutan tersebut.Konsep partial molar quantity dapat diperluas terhadap besaran-besaran termodinamika lainnya.
Sifat molar parsial dari komponen sistem yang ideal.
Ungkapan spesifik untuk sifat-sifat termodinamika sistem biner dapat diturunkan dari ungkapan energi bebas Gibbsl
Glarutan=Gsenyawa murniGcampuran
Dengan ungkapan pencampuran ideal dari Persamaan 1.3 akan dapat diperoleh : Glarutan=
[
nAGA0nBG0B]
RT
nAlnnA nAnBnBln nb nAnB
Hlarutan=[
nAH0AnBHB0]
Slarutan=[
nAS0AnBS0B]
−R
nAln nA nAnB nBln nb nAnB
Vlarutan=[
nAV0AnBV0B]
(1.11)Dari ungkapan pada persamaan 1.11, sifat termodinamika dari komponen dapat diperoleh dengan melakukan diferensial parsial, sehingga diperoleh sifat molar parsial. Misalnya GA=
∂G
∂nA
. Dan dengan hubungan turunan d ln y dx =
1y
dydx maka akan diperoleh:
̄ GA=
(
∂G ∂nA)
T , B = ̄G0A + RT ln xA ̄ HA=(
∂H ∂nA)
T , B = ̄HA 0 ̄ SA=(
∂S ∂nA)
T , B ̄ S0A −RT ln xA ̄ VA=(
∂V ∂d na)
= ̄VA 0 (Larutan ideal) (1.12)Dengan demikian dengan menggunakan turunan yang mendefinisikan sifat molar parsial, dapat diperoleh ungkapan untuk sifat dari komponen dari larutan ideal. Persamaan 1.12 hanya berlaku bagi larutan ideal.
Penentuan volum molar parsial
Konsep tentang volum molar parsial sekarang akan digunakan untuk menggambarkan bagaiman sifat larutan dapat dicari dari sifat komponen pembentuknya.
Data yang dapat digunakan untuk mencari/menggambarkan volum adalah densitas dari larutan.
Informasi ini kemudian digunakan untuk larutan yang memiliki berbagai jenis komponen yang terlarut yang berada dalam sejumlah tetap tertentu pelarut.
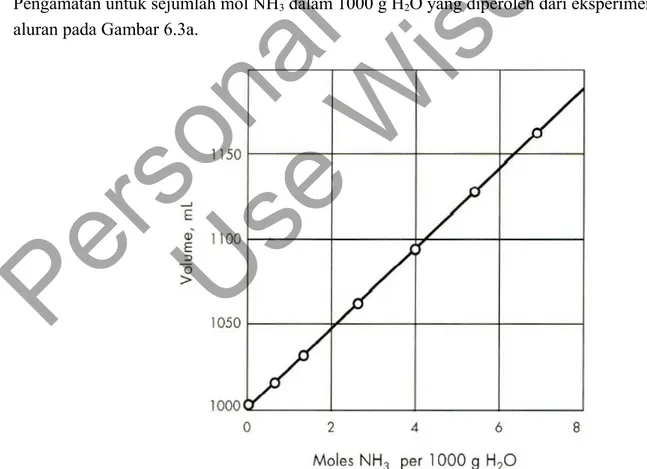
Pengamatan untuk sejumlah mol NH3 dalam 1000 g H2O yang diperoleh dari eksperimen memberikan
aluran pada Gambar 6.3a.
Gambar 1.3. Volume larutan yang mengandung 1000 g air dan berbagai
konsentrasi NH3
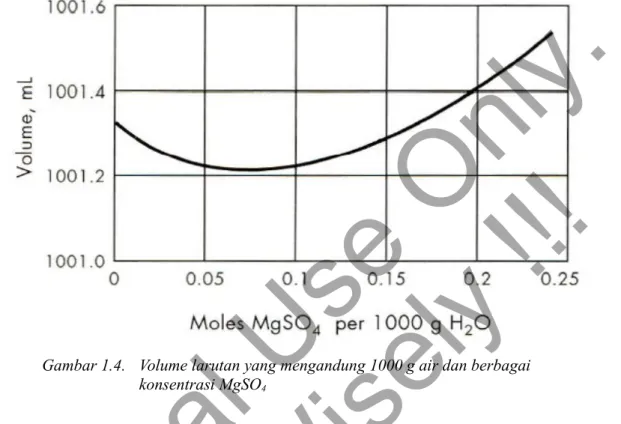
Gambar 1.4. Volume larutan yang mengandung 1000 g air dan berbagai konsentrasi MgSO4
Dari Kedua plot tersebut akan diperoleh volum molar parsial pada dengan melihat kemiringan kurva pada jumlah tertentu pelarut. Pada Gambar 1.3 terlihat bahwa garis kurva merupakan garis lurus dengan kemiringan 22.9 mL per mol NH3. Sehingga volum molar parsial untuk NH3 pada kondisi eksperimen diatas adalah 22.9 mL. Pada Gambar 1.4. volum molar parsial bagi larutan MgSO4 sangat tergantung pada konsentrasi dari Larutan tersebut.
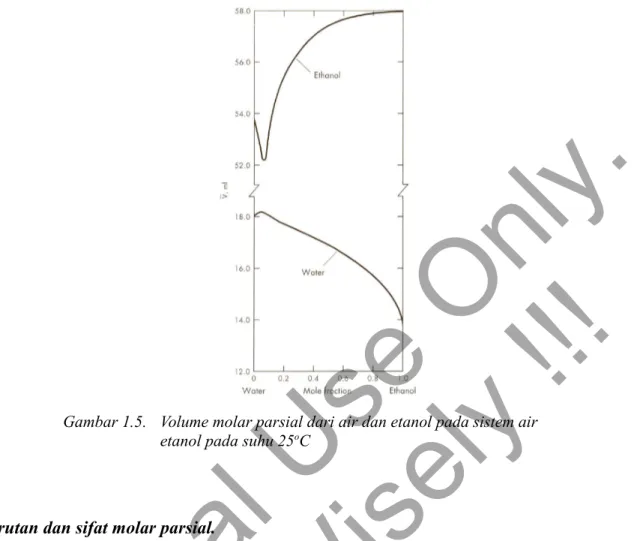
Bila komponen pelarut dan terlarut saling larut satu sama lain, contohnya sistem air-etanol, volum molar parsial bagi masing-masing komponen dapat dicari dengan menggunakan data seperti pada Gambar 1.5
Gambar 1.5. Volume molar parsial dari air dan etanol pada sistem air etanol pada suhu 25oC
Sifat larutan dan sifat molar parsial.
Sifat larutan biner bergantung pada jumlah mol komponen dalam larutan dan sifat molar parsial dari komponen dalam larutan. Berubahnya sifat akan terjadi bila komposisi dari komponen larutan tersebut berubah. Hal ini diperlihatkan dengan menggunakan persamaan diferensial total dari sifat yang menjadi pengamatan tersebut. Misal pada volum larutan:
dV =∂V ∂nAdnA
∂V
∂nBdnB= VAdnA VBdnB (T,P tetap) (1.13)
Setiap perubahan dalam komposisi akan menghasilkan perubahan volum total dari larutan
Dapat diperkirakan bahwa sifat dari suatu larutan, juga perubahan sifatnya dapat di ungkapkan melalui suatu persamaan yang melibatkan kuantitas molar parsial. Misal suatu campuran biner A dan B dibuat dengan menambahkan sebanyak nA mol A dan sebanyak nB mol B. Pada larutan ini kemudian
ditambahkan sejumlah nA mol A lagi dan sejumlah nB mol B lagi.Penambahan yang kedua kalinya ini
tidak merubah komposisi dari larutan. Tetapi penambahan ini akan menyebabkan bertambah volume sebesar
nAd ̄VA+nBd ̄VB=V (1.14)
Ungkapan yang mirip juga dapat diturunkan untuk sifat termodinamika lainnya seperti entalpi, entropi dan energi bebas.
Persamaan Hubungan Gibbs-Duhem
Sifat molar parsial juga berlaku untuk sifat termodinamika lainnya. Volum suatu larutan campuran A dan B diberikan oleh persamaa:
V =nAV̄A+nBV̄B (1.15)
Setiap perubahan jumlah (mol) yang ada pada baik A maupun B akan merubah volum total dari larutan. Untuk perubahan yang tak terhingga, perubahan volume diberikan oleh:
dV =nAd ̄VA+ ̄VAdnA+ nBd ̄VB+ ̄VBdnB
Perubahan pada volum campuran A dan B seoertu yang ditunjukkan oleh (1.13) diberikan oleh ungkapan diferensial total
dV = ̄VAdnA+ ̄VBdnB
Agar bagi kedua ungkapan dV dapat berlaku, perubahan dalam volum larutan harus
nAd ̄VA+ nBd ̄VB=0 (1.16)
Persamaan ini memperlihatkan bahwa bagi sistem campuran 2 komponen pada temperatur dan tekanan tetap akan berlaku bahwa bila ada perubahan pada ̄VA akan mengakibatkan perubahan pada ̄VB dan besarnya perubahan ini berkaitan melalui persamaan (1.16). Persamaan ini memberikan hubungn Gibbs-Duhem.
Misal pada volum molar parsial campuran air-etanol seperti pada Gambar 1.5, pada situasi ini persamaan 1.16 dapat diterapkan sehingga,
nair d ̄Vair d xetanol +netanoldVetanol̄ d xetanol =0 Atau nair d ̄Vair d xetanol =−netanol dVetanol̄ d xetanol Sehingga akhirnya d ̄Vair d xetanol =netanol nair dVetanol̄ d xetanol
Hasil akhir menunjukkan bahwa slope dari kedua kurva harus berlawanan tanda dan dan kemiringannya tergantung pada fraksi mol tiap komponennya.
1.3 Energi bebas larutan dan komponennya
Energi Bebas komponen dalam suatu campuran, memainkan peranan penting dalam menentukan hubungan sifat termodinamika campuran dengan komponennya.
Potensial kimia
Energi bebas molar parsial dari suatu komponen adalah “potensial kimia” dari komponen tersebut. Terdapat korelasi antara besarnya energi bebas dengan potensial untuk suatu sistem mekanik. Dalam suatu sistem kimia, energi bebas akan berkurang dengan berjalannya reaksi. Hal yang sama terjadi pada sistem mekanik yang juga akan berlangsung bila terjadi penurunan energi potensialnya. Simbol untuk potensial kimia bagi komponen A adalah μA. Maka μA= ̄GA
Potensial kimia untuk larutan dan uapnya.
Suatu larutan A yang mudah menguap dan sedang dalam keadaan kesetimbangannya pada suatu temperatur tetap. Untuk kasus ini tekanan uap pada kesetimbangan bagi larutan murni A disimbolkan
P*A
, dan energi bebas molar parsial (potensial kimia) disimbolkan, μA
*
. Karena larutan dan uapnya dalam keadaan setimbang, maka potensial kimia dari larutan dan uapnya adalah sama.
Bila larutan sekarang dibentuk dari komponen A dan komponen B. Tekanan uap kesetimbangan untuk A adalah PA . Potensial kimia untuk A dalam fasa larutan atau dalam fasa uapnya adalah μA. Perlu
diperhatikan bahwa jika B juga merupakan senyawa yang mudah menguap, maka akan terdapat uap B. Dan dalam kasus ini tekanan yang diberikan oleh A merupakan tekanan parsial.
Untuk membedakan potensial kimia bagi larutan dan uap, maka indeks v (v=vapour, uap) dan l (l= liquid, larutan) digunakan
Besarnya potensial kimia fasa uap bagi larutan A sebagai fungsi tekanan diberikan oleh: μAv=μa*+ RT lnPA
p*A 1.17)
Karena uap larutan berada dalam kesetimbangan dengan larutan cair nya. Maka potensial kimia bagi A dalam larutan cair akan sama dengan potensial kimia bagi uap untuk larutan tersebut, Sehingga
μAv=μlA . Dan kaitannya dengan tekanan gas menjadi μAl=μ*A+RT lnPA
P*A (1.18)
Larutan Ideal dan Hukum Raoult
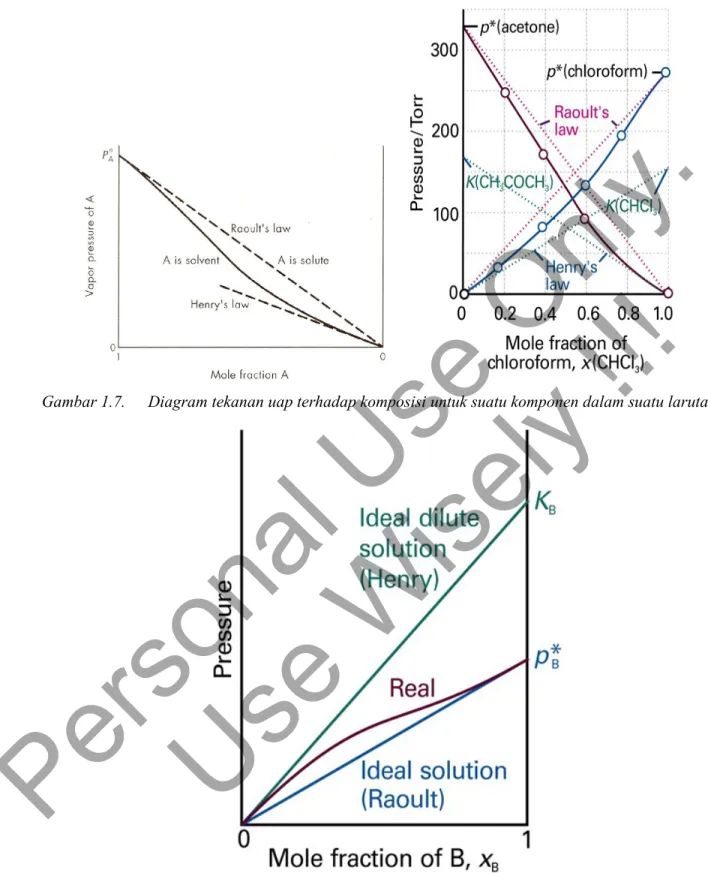
Larutan 2 komponen yang bercampur dan akan memiliki tekanan uap total dan tekanan uap parsial seperti yang ditunjukkan oleh Gambar 6.5. Suatu komponen dari suatu larutan mengikuti Hukum Raoult bila tekanan uap dari komponen tersebut adalah sebanding dengan fraksi mol komponen tersebut dalam larutannya.
Tekanan gas akan mengikuti Hukum Raoult
PA=xAP*A (1.19)
Sehingga untuk komponen yang mengikuti hukum Raoult maka berlaku PA/P*A=xA sehingga
persamaan 1.17 menjadi
Al=*ART ln xA (1.20)
Perubahan Energi Bebas 1 1 mol larutan dengan menggunakan energi potensial adalah Gmurni=xAμ*A+ xBμ*B dan Glarutan=xAμA+xBμB
Untuk proses pencampuran, persamaan di atas memberikan ΔGmix=Glarutan−Gmurni
=xA(μ*A+RT ln xA)+ xB(μ*A+RT ln xB)−(xAμ*A+xBμBln xB) =RT
[
xAln xA+ xBln xB]
(1.21)
Tekanan Uap larutan tidak ideal
Tekanan uap dapat digunakan dalam persamaan 1.18 untuk memperoleh potensial kimia dari tiap komponen dalam suatu larutan cair. Namun data tekanan uap umumnya berbeda dari gambar 6.5, yaitu data tekanan uap dari suatu larutan ideal. Contoh tekanan uap yang tidak mengikuti pola ideal adalah sistem kloroform dan aseton.
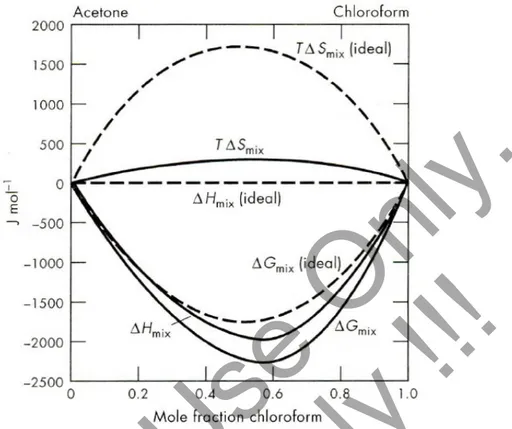
Tekanan uap sistem kloroform-aseton pada suhu 35 °C. Fungsi energi bebas untuk larutan adalah
Glarutan=xAμA+ xBμB
Sehingga perubahan energi bebas pada proses pencampuran adalah ΔGpencampuran=Glarutan−Gmurni
=Glarutan−(xAμA * + xBμB*) =
(
xAμ*A+ xART lnPA P*A)
+(
xBμb * + xBRT lnPB PB*)
−(xAμA * + xBμ*B) =RT[
xAlnPA P*A+ xBln PB P*B]
(1.22)Energi bebas yang diakibatkan oleh proses pencampuran kloroform-aseton ditunjukkan pada Gambar
Perubahan entalpi, energi dalam dan entropi pada sistem kloroform-aseton
Dari gambar terlihat bahwa walaupun tekanan uap lebih rendah dari yang diberikan oleh Hk Raoult, Besarnya energi bebas pencampuran adalah lebih negatif dari yang ditunjukkan oleh larutan ideal. Gambar juga memperlihatkan harga entalpi pencampuran kloroform-etanol, yang diperoleh dari percobaan dengan menggunakan kalorimeter
Besarnya perubahan entropi pada proses pencampuran kemudian dapat dicari melalui persamaan ΔG = ΔH – T ΔS , karena proses adalah proses pencampuran maka, ΔGmix = ΔHmix – T ΔSmix , atau T ΔSmix = ΔHmix – ΔGmix
Contoh kloroform-aseton ini menunjukkan bahwa interaksi antara molekul dari komponen yang berbeda adalah berbeda dari interaksi antara molekul yang sejenis. Pada saat proses pencampuran terjadi komponen-komponen ini akan saling berinteraksi, dan dalam kasus kloroform-aseton akan
Perubahan Entalpi pada proses pencampuran
Gaya antar molekul yang dapat muncul dalam larutan setelah proses pencampuran terjadi. Penyimpangan dari ketidak-idealan dapat terjadi karena:
1.4 Pelarut dan zat terlarut (Solvent and solute)
Hukum Raoult dan Henry digunakan untuk menggambarkan besarnya potensial kimia dari pelarut dan zat terlarut.
Tekanan uap dari komponen suatu larutan cair nyata dapat memberikan gambaran tentang besarnya potensial kimia dari kompenen pembentuk campuran tersebut.
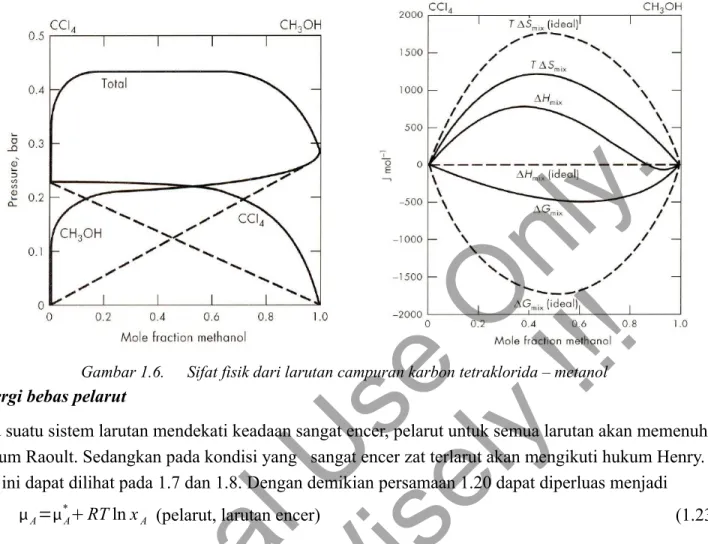
1.6 Menggambarkan hubungan antara sifat fisik/kimia dari suatu campuran pada berbagai komposisi.
Gambar 1.6. Sifat fisik dari larutan campuran karbon tetraklorida – metanol
Energi bebas pelarut
Bila suatu sistem larutan mendekati keadaan sangat encer, pelarut untuk semua larutan akan memenuhi hukum Raoult. Sedangkan pada kondisi yang sangat encer zat terlarut akan mengikuti hukum Henry. Hal ini dapat dilihat pada 1.7 dan 1.8. Dengan demikian persamaan 1.20 dapat diperluas menjadi
A=*ART ln xA (pelarut, larutan encer) (1.23)
Aktivitas dan koefisien aktivitas untuk pelarut
Persamaan 1.23 hanya dapat berlaku pada daerah yang sangat encer untuk itu perlu dibuat suatu ungkapan yang dapat mewakili daerah yang bukan pada daerah yang sangat encer. Hal ini dapat dilakukan dengan menggunakan aktivitas (activity) , a, dan didefinisikan sebagai aA=PA/PA
*
. Dengan demikian potensial kimia dapat ditulis sebagai
A=*ART ln aA (1.24)
Karena aA akan mendekati xA pada pengenceran tak hingga (infinite dilution). Maka koefisien
keaktifan (activity coefficient), digunakan, dengan =aA
XA
atau aA=xA (1.25)
Karena pelarut untuk semua larutan yang mengalami pengenceran yang cukup akan mengikuti hukum Raoult , maka nilai untuk pelarut akan mendekati nilai 1 saat konsentrasi larutan mendekati nol. Variasi dari harga koefisien keaktifan akan menunjukka penyimpangan dari keidealan untuk pelarut. Data tekanan uap seperti pada 1.6 memberikan informasi yang memadai untuk menghitung aktiitas dari pelarut melalui hubungan aA=P / PA
*
dan A=aA/xA
Gambar 1.7. Diagram tekanan uap terhadap komposisi untuk suatu komponen dalam suatu larutan.
Gambar 1.8.Korelasi antara konsentrasi dengan Hukum Raoult dan Hukum Henry.
Energi bebas zat terlarut
Notasi B, telah umum digunakan untuk menyatakan zat terlarut. Jumlah relatif zat terlarut B dalam larutan diberikan dalam fraksi mol,
x
B . Juga lebih umum/memudahkan lagi bila dilakukan dalam molalitas,m
, molalitas B adalah jumlah mol B dalam 1000 g A. Karena untuk larutan yang sangat encer, jumlah mol zat terlarut dalam 1000 g pelarut akan mendekati jumlah mol total mol dalam larutan, sehingga molalitas akan mendekati/sebanding dengan fraksi mol.Dari hasil pengukuran tekanan-uap. William Henry membuktikan proposionalitas antara tekanan uap zat terlarut denga molalitas atau fraksi mol dari zat terlarut tersebut. Dengan demikian untuk suatu zat terlarut dalam larutan yang sangat encer hukum Henry dapat dinyatakan sebagai:
PB=k ' m atau PB=k xB (1.26)
Nilai konstanta Henry ini harus ditentukan secara dengan suatu eksperimen untuk tiap jenis larutan dan temperatur.
Aktivitas dan koefisien aktifitas zat terlarut.
Sifat termodinamika dari zat terlarut dirujuk pada keadaan standar yaitu 1 m. Keadaan ini dapat dilakukan bila hukum Henry dapat berlaku pada 1 m atau keadaan standar ini adalah keadaan hipotesis yang diperoleh dengan cara ekstrapolasi pada daerah tempat hukum Henry berlaku. Dalam keadaan ini potensial kimia dari zat terlarut dapat diungkapkan sebagai
B=*BRT lnPB P1 mB
atau dalam bentuk hukum Henry PB=k ' m , maka aktifitas dapat ditulis sebagai
B=oBRT lnm 1 m=B
o
RT ln m (1.27)
dengan m ditulis dalam 1 m menggambarkan perbadingan m/1 m
Untuk memudahkan kembali digunakan koefisien aktifitas, aB, yaitu perbandingan antara tekanan uap
parsial B terhadap tekanan total yang dimiliki oleh zat terlarut sebanyak 1 m dalam larutannya. Pada keadaan ini tekanan uap adalah k '×1 m . sehingga keaktifan zat terlarut adalah
aB=PB/k '×1 m , atau
aB=PB/k ' (1.28)
Dengan keadaan standar 1 m , atau seandainya hukum Henry tidak dapat dipenuhi pada keadaan tersebut, kita miliki
B=BoRT ln aB (1.29)
Untuk dapat memenuhi pada keadaan hukum Henry tidak terpenuhi. Maka digunakan koefisien keaktifan, yaitu
=aB
m atau aB=m (1.30)
Sehingga apabila Hukum Henry dipenuhi, atau dapat diperoleh data tekanan-uap, maka potensial kimia dari zat terlarut dapat ditentukan/
1.5 Kesetimbangan dalam larutan
Dari harga energi bebas untuk komponen dari suatu campuran gas ideal, akan dapat disimpulkan besarnya tetapan kesetimbangan untuk reaksi fasa gas.
Harga energi bebas molar (potensial kimia), dari zat terlarut dapat ditulis dalam ungkapan fraksi mol atau kemolalan dari zat terlarut. Ungkapan energi bebas ini akan/dapat digunakan untuk mencari besarnya perubahan energi bebas saat reaksi berlangsung.
Energi bebas suatu larutan yang didalamnya terdapat zat terlarut yang ikut bereaksi.
Kasus : Suatu larutan mengandung zat terlarut yang terlibat dalam reaksi. Pereaksi tersebut
diidentifikasi sebagai j, sedangkan pelarutnya adalah s. Besarnya energi bebas dari larutan tergantung pada berbagai macam spesi yang ada dan mengikuti
ΔGlarutan=
∑
(njμj)+nsμs (1.31)Besarnya nj sangat tergantung pada extent dari reaksi. Perubahan pada nj akan mengakibatkan
perubahan pada jumlah mol dalam larutan dan akan merubah fraksi mol dari semua komponen dalam larutan tersebut. Dengan demikian turunan dari Glarutan seperti yang diberikan pada persamaan 1.31
bila melibatkan extent reaksi pada suhu dan tekanan tertentu akan memberikan Glarutan d ξ =
∑
(
nj d μj d ξ)
+∑
(
μj d nj d ξ)
+ns d μs d ξ (1.32)Persamaan ini dapat disederhanakan dengan menggunakan persamaan Gibbs-Duhem seperti pada persamaan 1.14 yang ditulis
∑
(njd μj)+nsd μs=0 atau∑
(
njd μj d ξ)
+ ns d μs d ξ =0 (1.33)Dengan memasukkan ke persamaan 1.32 maka persamaan tersebut menjadi Glarutan
d ξ =
∑
(
μj d njd ξ
)
(1.34)Derivatif d nj/d yang tersisa dari nj=ninitj j maka persamaan 1.34 menjadi
Glarutan
d ξ =
∑
(μjνj) (1.35)Pada saat kesetimbangan penyelesaian energi bebas akan bernilai minimum, sehingga dGlarutan/d =0
maka pada kesetimbangan,
∑
(μjνj)=0 (pada kesetimbangan) (1.36)Untuk larutan yang encer, saat larutan memenuhi hukum Henry, potensial kimia dari zat terlarut dapat diungkapkan dalam bentuk molalitas dan ditulis dalam
μj=μoj+RT ln mj (1.37)
Persamaan kesetimbangan 1.36 dapat ditulis ulang sebagai
∑ [
(μjo
+RT ln mj)νj
]
=0atau
∑
(νjμoj)=−RT∑
(νjln mj) (1.38)Notasi ΔG° dapat digunakan untuk suku sebelah kiri untuk menggantikan
∑
(νjμj o) dan suku logaritmik dapat diganti dengan jumlah logaritmik sehingga
Go
=−RT ln
[∏
mjj]
atau
G0=−RT ln K dengan K =
∏
mjj (1.39) 1.6 Sifat koligatifSifat koligatif adalah suatu sifat larutan yang tergantung pada jumlah zat terlarut bukan pada jenisnya. Sifat koligatif dari larutan adalah :
• Penurunan Tekanan Uap • Kenaikkan Titik Didih • Penurunan Titik Beku • Tekanan Osmosis
Penurunan Tekanan Uap
Bila pada suatu larutan murni ditambahkan sejumlah tertentu zat terlarut, maka akan terjadi perubahan pada tekanan uapnya. Besarnya tekanan uap ini mengikuti hukum Raoult
PA=xAPA
*
Tekan uap PA dari larutan A dalam larutan akan lebih tendah dari tekanan murni uap A. Peran zat terlarut B dalam larutan yang terkait dengan pelarut A dihubungkan melalui persamaan xA=1− xB,
dengan menyusun ulang persamaan Raoult akan di peroleh
P*A−PA=xBP*A
Dari persamaan ini terlihat bahwa turunnya tekanan uap suatu pelarut, P*A−PA, adalah hanya murni
tergantung pada banyaknya zat yang terlarut dalam pelarut.
Kenaikan Titik Didih
Suatu pelarut murni atau suatu larutan dikatakan mendidih bila tekanan uapnya adalah sama dengan tekanan luar (tekanan yang ada/diberikan di atas permukaan larutan tersebut).
Titik didih normal/standar diukur pada saat tekanan uapnya adalah sama dengan 1 atm. Pada saat suatu larutan mendidih, besarnya potensial kimia dari senyawa tersebut pada fasa cairnya adalah sama dengan potensial kimia senyawa tersebut pada fasa uapnya.
Telah diketahui juga bahwa potensial kimia dari fasa padat, cair dan gas untuk suatu komponen murni merupakan fungsi dari temperatur.
Akibat penambahan suatu senyawa yang tak mudah menguap pada suatu pelarut murni maka akan mengakibatkan terjadi penurunan besarnya potensial kimianya.
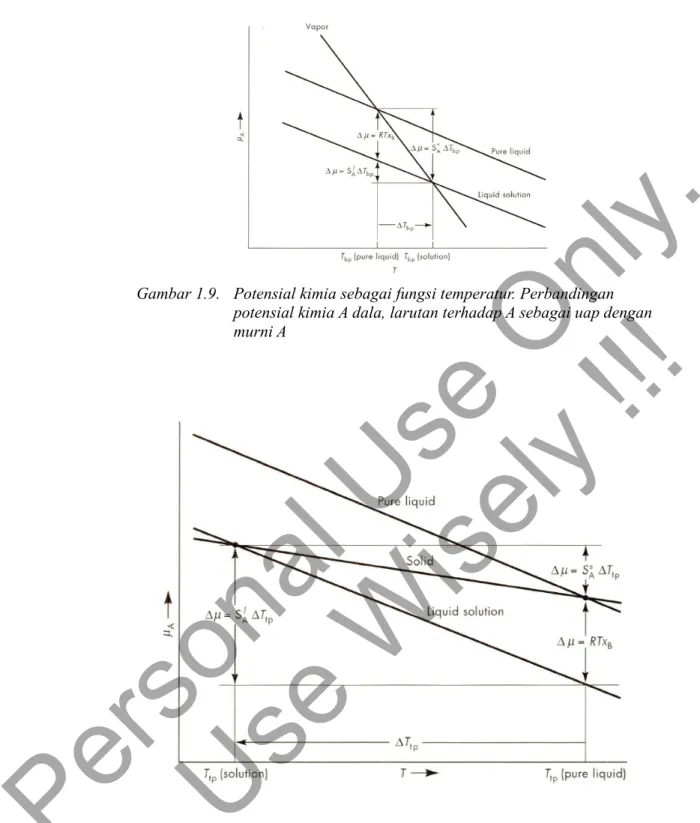
Gambar 1.9. Potensial kimia sebagai fungsi temperatur. Perbandingan potensial kimia A dala, larutan terhadap A sebagai uap dengan murni A
Potensial kimia dari A dalam larutan lebih kecil dari A murni pada titik didih Tbp adalah
μ*A−μA=−RTbpln xA, untuk xb≪1 akan berlaku ln xA=ln1− xB=xB, sehingga besarnya
perubahan potensial kimia karena terjadi penambahan zat terlarut adalah −RTbpxB.
Dari Hubungan Maxwell akan diperoleh
(
∂G∂T
)
P=−S yang memperlihatkan ungkapan pada Gambar 1.9, Dengan menyetarakan perubahan potensial kimia pada kedua jalur dari gambar 1.9 akan diperoleh:
S0ATbp=SlATbpRTbpxB
atau dengan penyusunan ulang diperoleh
S0A−SAl
Tbp=RTbpxB (1.40)Dengan Hvap=Svap/T persamaan 1.40 kemudian menjadi. Tbp=
RTbp2
Hvap
xB (1.41)Dari persamaan 1.41 terlihat bahwa besarnya kenaikkan titik didih adalah suatu sifat koligatif karena Tbp hanya tergantung pada sifat pelarut, sedangkan zat terlarut perannya hanya pada banyaknya zat tersebut larut dalam larutaannya.
Pada prakteknya jumlah zat terlarut untuk suatu larutan yang encer di ungkapkan dalam kemolalan, m . Untuk suatu larutan yang encer fraksi mol dan kemolalan sangat berkaitan. Fraksi mol adalah
xB=nb/nAnB . Dan untuk suatu larutan yang sangat encer akan berlaku kecil. nb≪nA, dan NAnB≈nA, sehingga fraksi mol zat terlarut B, xB=nb/nA.
Untuk suatu cuplikan yang mengandung 1 kg pelarut dan m mol zat terlarut dengan massa molar adalah mA, maka nA adalah 1 kg/MA atau 1/MA, sehingga nB dapat diberikan dari m. Dengan demikian berlaku
xB≈nb nA
≈ m
1 /MA
=MAm
Maka dengan demikian perubahan titik didih menjadi Tbp=
RTbp 2 MA Hvap
Tbp=Kbpm dengan Kbp=
RTbp 2 M A Hvap
Ungkapan yang berada dalam tanda kurung dikenal sebagai konstanta kenaikkan titik didih, Kbp
Beberapa konstanta untuk beberapa senyawa terdapat pada Tabel dibawah.
Penurunan titik beku
Dengan penurunan dengan cara yang sama akan diperoleh:
Tfp=−Kfpm dengan Kfp=
RTfp2
MA
Hfus
Tabel berikut memberikan besarnya harga konstanta titik beku.
Tekanan Osmotik
Fenomena tekanan osmotik terjadi karena dua buah larutan yang memiliki sifat (konsentrasi)
dipisahkan oleh sebuah dinding yang bersifat semipermiabel. Dinding semipermpermiabel hanya dapat melewatkan salah satu komponen dari larutan tersebut dan mencegah terjadinya perpindahan dari komponen yang lainnya.
Membran sel dan tumbuhan banyak yang bersifat semipermiabel. Palladium foil juga bersifat
permeabel karena dapat melewatkan gas hidrogen tapi tidak gas lainnya (nitrogen dan oksigen). Sifat permeabilitas dari dinding palladium bermanfaat untuk mempelajari sifat osmotik dalam fasa gas. Sifat Osmotik dapat ditunjukkan secara skematis melalui 1.9. Karena terjadi perbedaan potensial kimia antara larutan terhadap pelarut murni yang mengakibatkan sistem akan mencoba mengurangi
perbedaan potensial kimia ini. Akibat antara pelarut dengan larutan dipisahkan oleh membran semipermiabel maka satu-satunya cara yang ditempuh adalah dengan pindahnya pelarut ke larutan. Proses ini akan berlangsung terus hingga tinggi larutan dalam kolom menghalangi proses pindahnya
1.9. Representasi skematik dari suatu perangkat tekanan osmotik..
Untuk mengamati karakteristik dari sifat tekanan osmotik secara termodinamika maka, sifat termodinamika diturunkan dari suatu persamaan fungsi energi bebas terhadap tekanan,
∂G∂P
T=V . Atau dalam bentuk besaran molarnya yaitu :
∂A ∂P
= VA (1.32)
Gambar 1.10. Potensial kimia sebagai fungsi dari tekanan untuk suatu pelarut murni dan suatu larutan. Seperti yang terlihat pada 1.10, penambahan tekanan akan mengakibatkan bertambahnya potensial
kimia dari komponen A dalam larutan hingga suatu nilai yang setara dengan potensial kimia dari pelarut murni A. Persamaan yang menggambarkan keadaan pada 1.10 yang menggambarkan keadaan tekanan osmotik adalah ;
VA=RT xB (1.42)
Bila Persamaan 1.42 dikalikan dengan nA yaitu jumlah mol dari A yang untuk suatu larutan yang encer besarnya mendekati nAnB maka akan diperoleh;
nAVA=RT nAxB≈nbRT (1.43)
Bila naVA=V maka akan berlaku V =nbRT
atau dengan M sebagai kemolaran ;
=MRT (1.44)