VALIDASI METODE ANALISIS HORMON PERTUMBUHAN
TANAMAN DALAM MEDIA KULTUR IN VITRO DENGAN
KROMATOGRAFI CAIR KINERJA TINGGI (KCKT)
SKRIPSI
LILYANA RIZKI
PROGRAM STUDI KIMIA
FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH
JAKARTA
VALIDASI METODE ANALISIS HORMON PERTUMBUHAN TANAMAN DALAM MEDIA KULTUR IN VITRO DENGAN
KROMATOGRAFI CAIR KINERJA TINGGI (KCKT)
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains Program Studi Kimia
Fakultas Sains dan Teknologi
Universitas Islam Negeri Syarif Hidayatullah Jakarta
PROGRAM STUDI KIMIA
FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH
JAKARTA
2021 M / 1442 H
Oleh:LILYANA RIZKI 11140960000005
iii
VALIDASI METODE ANALISIS HORMON PERTUMBUHAN TANAMAN DALAM MEDIA KULTUR IN VITRO DENGAN
KROMATOGRAFI CAIR KINERJA TINGGI (KCKT)
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains Program Studi Kimia
Fakultas Sains dan Teknologi
Universitas Islam Negeri Syarif Hidayatullah Jakarta
Menyetujui,
Pembimbing I Pembimbing II
Nurhasni, M.Si Nurlaila, M.Si
NIP. 19740618 200501 2 005 NIP.19740704 199612 2 001
Mengetahui,
Ketua Program Studi Kimia
Dr. La Ode Sumarlin, M.Si NIP.19750918 200801 1 007
Oleh:
LILYANA RIZKI 11140960000005
iv
PENGESAHAN UJIAN SKRIPSI
Skripsi yang berjudul “Validasi Metode Analisis Hormon Pertumbuhan
Tanaman dalam Media Kultur In Vitro dengan Kormatografi Cair Kinerja Tinggi (KCKT)”. Setelah diuji dan dinyatakan lulus pada Sidang Munaqosah
Fakultas Sains dan Teknologi Universitas Islam Negeri Syarif Hidayatullah Jakarta pada hari Senin, 26 April 2021. Skripsi telah diterima sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains (S1) Program Studi Kimia.
Menyetujui,
Pembimbing I Pembimbing II
Nurhasni, M.Si Nurlaila, M.Si
NIP. 19740618 200501 2 005 NIP.19740704 199612 2 001
Penguji I Penguji II
Dr. Sandra Hermanto, M.Si Dr. Hendrawati, M.Si
NIP. 19750810 200501 1 005 NIP.19720815 200312 2 001
Mengetahui,
Dekan Fakultas Sains dan Teknologi Ketua Program Studi Kimia
Ir. Nashrul Hakiem, Ph.D Dr. La Ode Sumarlin, M.Si NIP. 19710608 200501 1 005 NIP.19750918 200801 1 007
vi
ABSTRAK
LILYANA RIZKI,Validasi Metode Analisis Hormon Pertumbuhan Tanaman
dalam Media Kultur In Vitro dengan Kromatografi Cair Kinerja Tinggi (KCKT). Dibawah bimbingan NURHASNI dan NURLAILA.
Validasi metode merupakan suatu proses analisis untuk membuktikan bahwa metode tersebut memenuhi persyaratan untuk digunakan. Salah satu instrumen analisis hormon pertumbuhan dalam media kultur in vitro adalah Kromatografi Cair Kinerja Tinggi (KCKT). Parameter yang digunakan dalam validasi metode meliputi uji kesesuaian sistem, presisi, akurasi, linieritas, batas limit deteksi (LOD), batas limit kuantifikasi (LOQ) dan ketahanan (robustness). Berdasarkan hasil penelitian, pada uji kesesuaian sistem semua standar uji memenuhi syarat dimana nilai jumlah pelat teoritis (N) ≥ 1000, nilai HETP <1 dan resolusi (R) > 1,5. Uji presisi masing-masing standar menunjukkan %RSD (Relative Standar Deviation) ≤ 2% dan uji linieritas memenuhi syarat sebesar r2 0,999. Hasil uji presisi sampel memenuhi syarat %RSD dan rerata konsentrasi tertinggi pada hormon ABA sebesar 0,78 ppm. Peroleh kembali (Recovery) menunjukkan hasil yang tidak sesuai dengan persyaratan yaitu 90% - 107%. Kekuatan dari metode ini cukup kuat dimana %RSD ≤ 2%. Tingkat sensitifitas tertinggipada alat KCKT mampu mendeteksi hormon pertumbuhan, penentuan batas deteksi (LOD) 0,73 ppm pada IBA dan batas kuantitasi (LOQ) 2,46 ppm pada IBA.
vii
ABSTRACT
LILYANA RIZKI. Validation Analiytical Method of Plant Growth Hormone In Vitro Culture Media using High Performance Liquid Chromatography (HPLC)
Instruments. Supervise by NURHASNI and NURLAILA.
Method validation is an analysis process to prove that the method meets the requirements for use. One of the growth hormone analysis methods in In Vitro culture media is the High Performance Liquid Chromatography (HPLC) instruments. The parameters used in the validation of the method include system suitability test, precision, accuracy, linearity, detection limit of detection (LOD), limit of quantification (LOQ) and robustness. Based on the results of the study, in the system suitability test all test standards met the requirements where the value of the theoretical plate count (N) ≥ 1000, the value HETP < 1 and the resolution (R)> 1.5. The precision test for each standard shows% RSD (Relative Standard Deviation) ≤ 2% and the linearity test meets the requirements of r2 0.999. The results of the sample precision test met the %RSD requirements and the highest average concentration of the ABA hormone was 0,78 ppm. Recovery shows results that are not in accordance with the requirements, namely 90% - 107%. The strength of this method is quite strong where %RSD ≤ 2%. The sensitivity level of the HPLC device was able to detect growth hormones determination of detection limits (LOD)0,73 ppm on IBA and limits of quantitation (LOQ) 2,46 on IBA.
viii
KATA PENGANTAR
Assalamualaikum Wr. Wb
Alhamdulillahirobbil’alamin, segala puji dan syukur hanya dipanjatkan kepada Allah SWT. Shalawat serta salam senantiasa kita panjatkan kepada Nabi Muhammad SAW, keluarga dan para sahabat. Dengan rahmat dan karunia-Nya kepada penulis, skripsi yang berjudul “Validasi Metode Analisis Zat Pengatur Tumbuh (ZPT) dalam Media Kultur In Vitro Menggunakan Kromatografi Cair Kinerja Tinggi (KCKT)” telah dilaksanakan. Dalam pelaksanaan penyusunan skripsiini, penulis mendapat banyak bantuan, bimbingan, dan arahan dari berbagai pihak. Oleh karena itu penulis ini mengucapkan terimakasih kepada:
1. Nurhasni, M.Si, selaku Pembimbing I dan Sekretaris Program Studi Kimia yang telah memberikan berbagai saran dan masukan dalam penulisan skripsi.
2. Nurlaila, M.Si, selakuPembimbing II telah memberikan bimbingan melalui diskusi dan arahan secara teknis penelitian.
3. Dr. La Ode Sumarlin, M.Si., selaku Ketua Program Studi Kimia.
4. Dr. Sandra Hermanto, M.Si. dan Dr. Hendrawati, M.Si., selaku penguji Program Studi Kimia Fakultas Sains dan Teknologi UIN Syarif Hidayatullah Jakarta
5. Ir. Nashrul Hakiem, Ph.D., selaku Dekan Fakultas Sains dan Teknologi UIN Syarif Hidayatullah Jakarta.
ix
7. Alfinatul Jannah selaku rekan kerja, dan Nafa Fujiama Ragesta dan teman-teman yang telah membantu perihal teknis dalam penyusunan skripsi ini.
Semoga arahan, motivasi dan bantuan yang telah diberikan menjadi amal ibadah bagi keluarga, bapak, dan rekan-rekan, sehingga memperoleh balasan yang lebih baik dari Allah SWT dan penelitian ini dapat bermanfaat bagi perkembangan ilmu pengetahuan
Wassalamua’laikum wr wb.
Tangerang, April 2021 Penulis
x
DAFTAR ISI
Halaman
KATA PENGANTAR ... viii
DAFTAR ISI ... x
DAFTAR GAMBAR ... xiii
DAFTAR TABEL ... xiv
DAFTAR LAMPIRAN ... xv BAB I PENDAHULUAN ... 1 1.1. Latar Belakang ... 1 1.2. Rumusan Masalah ... 6 1.3. Hipotesis ... 6 1.4. Tujuan Penelitian ... 6 1.5. Manfaat Penelitian ... 7
BAB II TINJAUAN PUSTAKA ... 8
2.1 Validasi Metode Analisis ... 8
2.1.1 Uji Kesesuaian Sistem ... 8
2.1.2 Akurasi ... 9
2.1.3 Presisi ... 10
2.1.4 Ketahanan (Robustness) ... 12
2.1.5 Linieritas ... 12
2.1.6 Batas Deteksi (Limit Of Detection, LOD) ... 13
2.1.7 Batas Kuantifikasi (Limit Of Quantifiation, LOQ) ... 14
2.2 Media Kultur In Vitro ... 14
2.3 Hormon Pertumbuhan ... 15
2.4 Kromatografi Cair kinerja tinggi (KCKT) ... 16
2.4.1 Prinsip Kerja KCKT ... 17
2.4.2 Teknik Pemisahan KCKT ... 23
BAB III METODE PENELITIAN ... 24
3.1 Waktu dan Tempat ... 24
3.2 Alat dan Bahan ... 24
xi 3.2.2 Bahan ... 24 3.3 Diagram alir ... 25 3.4 Prosedur Kerja ... 26 3.4.1 Preparasi Eluen ... 26 3.4.2 Preparasi Standar ... 26 3.4.3 Preparasi Sampel ... 26 3.4.4 Kondisi Operasi KCKT ... 27
3.4.5 Validasi Metode Analisis ... 27
3.4.5.1 Penentuan Kesesuaian Sistem ... 27
3.4.5.2 Penentuan Presisi ... 27
3.4.5.3 Penentuan Linieritas ... 28
3.4.5.4 Penentuan Ketahanan (Robustness) ... 30
3.4.5.5 Penentuan Akurasi... 30
3.4.5.6 Penentuan Batas Deteksi dan Kuantifikasi... 30
BAB IV HASIL DAN PEMBAHASAN ... 32
4.1 Hasil Ekstraksi ... 32
4.2 Hasil Validasi Metode Analisis ... 33
4.2.1 Hasil Uji Kesesuaian Sistem ... 33
4.2.2 Hasil Uji Presisi Standar Hormon Pertumbuhan ... 34
4.2.3 Hasil Uji Linieritas Larutan Standar Hormon Pertumbuhan ... 35
4.2.4 Hasil Uji Presisi Standar Campuran dan Konsentrasi Sampel Hormon Pertumbuhan ... 36
4.2.5 Hasil Uji Akurasi ... 38
4.2.6 Hasil Uji Robustness Standar Hormon Pertumbuhan ... 40
4.2.7 Hasil Limit Deteksi (LOD) dan Limit Kuantifikasi (LOQ) standar Hormon Pertumbuhan ... 41
4.2.8 Hasil Analisis Kualitatif dan Kuantitatif Hormon Tumbuh dalam Sampel Media In Vitro ... 42
BAB V PENUTUP ... 46
5.1 Simpulan ... 46
5.2 Saran ... 46
xii
xiii
DAFTAR GAMBAR
Halaman
Gambar 1. Diagram sistem KCKT ... 18
Gambar 2. Skema pompa piston resiprok tunggal ... 20
Gambar 3. Skema pompa dual-piston dengan pompa paralel ... 21
Gambar 4. Diagram alir preparasi sampel, standar hormon dan validasi metode penelitian ... 25
Gambar 5. Kromatogram standar campuran dengan pengulangan injeksi tujuh kali ... 33
Gambar 6. Kromatorgram standar hormon pertumbuhan campuran ... 43
Gambar 7. Kromatogram sampel media in vitro ... 43
Gambar 8. Spektrum DAD standar ABA ... 45
xiv
DAFTAR TABEL
Halaman
Tabel 1. Persentasi perolehan kembali (recovery) yang diterima ... 10
Tabel 2. Nilai RSD yang diperbolehkan menurut Horwitz dan AOAC PVM ... 12
Tabel 3. Model elusi (Gradien) ... 27
Tabel 4. Komposisi uji linieritas Kinetin ... 29
Tabel 5. Komposisi uji linieritas ABA ... 29
Tabel 6. Komposisi uji linieritas IBA ... 29
Tabel 7. Komposisi uji linieritas IAA ... 29
Tabel 8. Komposisi uji linieritas NAA ... 30
Tabel 9. Hasil uji kesesuaian sistem ... 33
Tabel 10. Hasil uji presisi standar hormon pertumbuhan ... 35
Tabel 11. Hasil uji Linieritas standar hormon pertumbuhan ... 35
Tabel 12. Hasil uji presisi standar campuran hormon pertumbuhan ... 37
Tabel 13. Hasil presisi konsentrasi sampel media in vitro ... 38
Tabel 14. Hasil uji akurasi sampel media in vitro ... 39
Tabel 15. Hasil uji Robustness ... 40
Tabel 16. Hasil limit deteksi dan limit kuantifikasi hormon pertumbuhan ... 41
xv
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Data Uji Kesesuaian Sistem ... 51
Lampiran 2. Data Presisi masing-masing Standar Hormon Pertumbuhan ... 58
Lampiran 3. Data Linieritas Standar Hormon Pertumbuhan ... 61
Lampiran 4. Data Linieritas Standar Hormon Pertumbuhan ... 64
Lampiran 5. Data Presisi Standar campuran Hormon Pertumbuhan... 67
Lampiran 6. Data Presisi Sampel Media In Vitro ... 70
Lampiran 7. Data Akurasi Analit pada Sampel Media In Vitro ... 73
Lampiran 8. Data Robustness Standar ... 76
Lampiran 9. Data Limit Deteksi (LOD) dan Limit Kuantifikasi (LOQ) Standar Hormon Pertumbuhan ... 79
Lampiran 10. Data Persamaan Garis Limit Deteksi dan Limit Kuantifikasi Standar Hormon Pertumbuhan ... 81
1
BAB I PENDAHULUAN
1.1 Latar Belakang
Pengembangan metode analisis didasarkan pada literatur yang sudah ada dengan menggunakan instrumen yang sama maupun berbeda. Pengembangan suatu metode perlu adanya pendekatan dengan menghubungkan atau membandingkan metode yang akan dikembangkan dengan metode yang telah ada atau dengan metode standar, baik standar nasional maupun metode standar internasional. Metode analisis dapat dioptimasi dengan berbagai variabel yang akan ditentukan seperti resolusi, waktu retensi, faktor asimetri (dalam teknik kromatografi cair kinerja tinggi) telah disesuaikan dengan kriteria yang diharapkan, maka metode analisis yang telah dikembangkan selanjutnya akan divalidasi untuk memastikan bahwa analisis sesuai dengan tujuannya (fit for
purpose) (Rohman, 2014).
International Conference on Harmonization (ICH) dalam Rohman (2014)
metode analisis harus divalidasi untuk melakukan verifikasi bahwa parameter-parameter kinerja cukup mampu untuk mengatasi problem analisis dan metode yang sudah baku direvisi untuk menyesuaikan perkembangan atau disebabkan munculnya suatu masalah yang mengarah pada perevisian metode baku, penjaminan mutu yang mengindikasikan bahwa metode baku telah berubah seiring berjalannya waktu, metode baku digunakan di laboratorium dan dikerjakan oleh analis yang berbeda atau dikerjakan dengan alat yang berbeda dan untuk mendemonstrasikan kesetaraan dua metode, seperti antara metode baru dan metode baku.
2 Al Qur’an surat Al Mutaffifin, menerangkan mengenai manusia yang berbuat curang dalam menimbang dan menakar.
○ َنوُف ْوَتْسَي ساَّنلا ىَلَع اوُلاَتْكا اَذ إ َني ذَّلا ○ َني ف فَطُمْل ل لْي َو
○ َنو ُر سْخُي ْمُهوُن َز َو ْوَأ ْمُهوُلاَك اَذ إ َو
“Celakalah bagi orang-orang yang curang (dalam menakar dan menimbang)(1), (Yaitu) orang-orang yang apabila menerima takaran dari orang lain mereka minta dicukupkan (2), dan apabila mereka menakar atau menimbang (untuk orang lain), mereka mengurangi(3)” (QS.Al Mutaffifin ayat 1-3).Ayat tersebut menjelaskan bahwa Allah SWT melarang umatnya untuk melakukan kecurangan dalam menakar, sehingga dalam penentuan validitas ini data yang diperoleh dan ditunjukkan merupakan data yang sesungguhnya dari hasil penelitian. Pada penelitian analisa kimia tidak diperbolehkan melakukan manipulasi, hal tersebut dapat mempengaruhi hasil dalam jangka waktu panjang. Karena metode analisa akan dipergunakan oleh peneliti lain sebagai acuan dalam proses penelitian dan tidak dapat melihat kekurangan dari penelitian tersebut. Sudah sewajarnya dalam penelitian ilmiah akan terjadi kesalahan baik pada data maupun pada proses analisa.
Proses validasi analisa pada hormon pertumbuhan bertujuan untuk melihat besarnya kadar konsentrasi yang diserap oleh tanaman dari media pertumbuhan. Dari hasil proses validasi, akan menjadi acuan bagi peneliti lain dalam melakukan analisa hormon pertumbuhan, mengingat hormon pertumbuhan tanaman sangat penting khususnya dalam bidang pertanian yang menggunakan metode in vitro yang tidak bergantung pada kondisi cuaca sekitar.
Analisa hormon pertumbuhan pada media agar bertujuan untuk mengetahui kandungan hormon yang tersisa pada media tanam setelah dilakukan
3 penanaman selama 8 minggu. Sedangkan validasi metode Analisa kadar hormon bertujuan untuk mengetahui apakah metode Analisa ini cocok untuk menganalisa secara kuantitatif kadar hormon dalam media agar secara simultan.
Tanaman dapat berkembang biak secara generatif dan vegetatif, salah satunya dengan teknik kultur jaringan secara vegetatif dengan menggunakan media agar yang telah diberikan hormon pertumbuhan. Konsep dari teknik ini adalah perbanyakan tanaman dengan menggunakan bagian dari tanaman yang aktif dan di tumbuhkan pada media buatan (Rahardja dan Wiryana, 2003)
Media kultur in vitro merupakan salah satu faktor penentuan keberhasilan perbanyakan tanaman secara kultur jaringan. Berbagai macam komposisi media kultur telah diformulasikan dengan baik yang dapat mengoptimalkan pertumbuhan dan perkembangan tanaman yang dikulturkan (Yusnita, 2003). Kultur jaringan (tissue culture) merupakan suatu cara memperbanyak tanaman dengan teknik mengisolasi pada bagian tertentu dari tanaman seperti sel, protoplasma, jaringan dan organ dan menumbuhkannya pada media yang telah diberi nutrisi pertumbuhan sehingga bagian tersebut dapat memperbanyak diri dan bergenerasi menjadi tanaman yang lengkap (Hendaryono dan Wijayani, 1994). Keberhasilan penggunaan metode kultur sangat bergantung pada jenis media. Media tidak hanya mengandung unsur hara makro maupun mikro, namun beberapa hal penting seperti zat pengatur tumbuh. Analisa media kultur in vitro bertujuan untuk melihat persentase konsentrasi hormon pertumbuhan yang diserap oleh tanaman untuk tumbuh yang berasal dari media kultur in vitro. Media kultur yang digunakan adalah media agar. Media agar tidak memiliki unsur hara secara alami dalam proses penumbuhan tanaman, sehingga perlu adanya penambahan
4 hormon pertumbuhan sintetis dengan konsentrasi yang beragam sehingga dapat membantu proses pertumbuhan.
Hormon pertumbuhan yang sering digunakan pada golongan auksin adalah
Indole-3-Acetic Acid (IAA), 1-Naphtalentacetic (NAA), Indole-3-Butiric Acid
(IBA) dan golongan sitokinin adalah Kinetin. Hormon tanaman merupakan regulator penting yang diproduksi oleh tumbuhan, dan dapat terdeteksi pada konsentrasi rendah dan dapat mengatur beberapa proses seperti pertumbuhan, metabolisme, morfogenesis (Wu et al., 2009) dan dapat menjadi respon pelindung terhadap tekanan biotik dan abiotik seperti anti patogen, serangga, kekeringan, dingin dan panas (Forcat et al., 2008 dan Santner and Estelle, 2009).
Proses penentuan jenis hormon pertumbuhan, terdapat beberapa prosedur analitik telah dikembangkan, di antaranya menggunakan teknik kromatografi cair
kinerja tinggi (KCKT). Pada penelitian Li et al(2014) validasi metode Ultra High
Performance Liquid Chromatography-Fluorometric Detection (HPLC-FLD) menggunakan Dispersive Liquid-Liquid Microextraction (DLLME) pada buah-buahan yang berasal dari toko buah lokal di Cina diambil secara acak. HPLC-FLD memiliki tingkat selektifitas dan sensitifitas yang baik untuk menganalisis hormon tanaman, ditambah dengan penggunaan DLLME yang dapat mengekstraksi secara mikro sehingga dapat menghemat waktu dan lebih selektif terhadap hormon yang diinginkan.
Isabel et al (2011) melakukan validasi metode analisis hormon tanaman pada sayuran Zukini yang diperoleh dari rumah kaca yang terletak di provinsi Almera (Spanyol Tenggara) menggunakan metode Ultra High Performance Liquid Chromatography-Mass Spectrometry/Mass Spectrometry
(UHPLC-5 MS/MS). Penggunaan UHPLC-MS/MS akan meningkatkan sensitifitas yang tinggi dibandingan dengan HPLC-UV, sehingga analis memilih metode tersebut. Prosedur yang dikembangkan menggunakan tujuh sampel Zukini. Hasil dari metode tersebut menunjukkan %recovery berkisar pada 75-110% dengan variasi konsentrasi (50, 100 dan 250 ppm) dan dari tujuh sampel sayur Zukini ditemukan beberapa hormon tanaman salah satunya adalah NAA.
Perbedaan HPLC dengan UHPLC dapat dilihat dari tingkat resolusi, tekanan, biaya dan jenis kolom yang digunakan. UHPLC memberikan tingkat resolusi yang lebih baik dibandingkan dengan HPLC karena panjang kolom yang lebih pendek dan partikel berukuran submikron. Sistem HPLC lebih terjangkau dibandingkan UHPLC dan proses preparasi HPLC lebih mudah dilakukan dibanding UHPLC. Pemanasan gesekan yang disebabkan oleh tekanan balik yang tinggi terjadi pada UHPLC sehingga dapat menurunkan kualitas kolom lebih cepat (Saul, 2018).
Penelitian Nehela et al (2016), analisis hormon tanaman menggunakan metode Gas Chromatography - Mass Spectrometry (GC-MS) yang dimodifikasi dengan proses derivatisasi pada sampel daun dan akar jeruk manis (Citrus sinensis
(L.) Osbeck). Ekstrak jaringan tanaman yang bersifat asam seperti auksin dan
ABA diderivatisasi dengan Methyl Chloroformate (MCF), sedangkan untuk sitokinin dan GAS diderivatisasi dengan N-Methyl-N-(trimethylsilyl) trifluoroacetamide(MSTFA) dengan suhu 85°C selama 45 menit kemudian dilakukan pengukuran analisis dengan GC-MS.
Penggunaan metode KCKT-UV lebih mudah, akurat untuk validasi metode hormon tanaman dan aman dari kerusakan hormon yang bersifat labil
6 pada suhu tinggi dan proses preparasi yang mudah dibandingkan dengan metode UHPLC-MS/MS dengan ionisasi ESI selain instrumen yang masih jarang ditemukan di Indonesia, preparasi dan metode tersebut terbilang sulit untuk dilakukan terutama dalam proses analisis validasi meskipun tingkat sensitifitasnya tinggi. Metode KCKT memiliki kelebihan pada proses preparasi yang lebih mudah dibanding menggunakan instrument yang lebih rumit. Tingkat sensitifitas metode ini juga terbilang tinggi, sehingga analisa sekecil hormon pertumbuhan tanaman dapat dianalisa dengan preparasi yang mudah.
1.2 Rumusan Masalah
1. Apakah metode KCKT-UV mampu mendeteksi keberadaan hormon pertumbuhan tanaman dalam media in vitro?
2. Bagaimana tingkat validitas metode ini dalam penentuan hormon pertumbuhan dalam media kultur in vitrodengan instrumen KCKT?
1.3 Hipotesis
1. Semua jenis hormon tanaman seperti auksin, sitokinin, yang terkandung dalam media kultur dan dapat terdeteksi dengan metode KCKT-UV. 2. Validasi metode ini dapat digunakan sebagai acuan penentuan hormon
pengatur tumbuh dengan beberapa parameter seperti batas deteksi, batas kuantifikasi, presisi, akurasi, linieritas dan ketahanan.
1.4 Tujuan Penelitian
1. Menentukan kemampuan metode KCKT-UV dalam pengukuran hormon pertumbuhan yang ada dalam media in vitro.
7
2. Menguji tingkat validitas metode KCKT-UV dalam penentuan hormon
pertumbuhan dalam media kultur in vitroberdasarkan parameter seperti, batas deteksi, batas kuantifikasi, presisi, akurasi, linieritas dan ketahanan.
1.5 Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan acuan dalam
pengembangan metode validasi hormon pertumbuhan pada media kultur in
8
BAB II
TINJAUAN PUSTAKA
2.1 Validasi Metode Analisis
Validasi metode analisis bertujuan untuk diperolehnya data yang sesuai dengan tujuannya. Data yang valid sangat dibutuhkan oleh analis sehingga harus memperhatikan proses-proses analisis (Rohman, 2014). Validasi diartikan sebagai kegiatan konfirmasi melalui pengujian dan pengadaan bukti yang objektif. Validasi metode merupakan suatu proses analisis tertentu untuk membuktikan bahwa metode tersebut memenuhi persyaratan untuk digunakan. Validasi metode juga dapat dilakukan jika terjadi perubahan kondisi antara analisis dan validasi metode atau perubahan metode standar (Harmita, 2004). Kegiatan validasi bermanfaat untuk mengevaluasi kerja suatu metode dan menjamin keakuratan data pada prosedur analisis serta mengurangi penyimpangan (Wulandari, 2007). Menurut ISO 17025: 2005, sebagai standar internasional untuk laboratorium dan kalibrasi suatu metode analisis harus divalidasi jika:
1. Metode tidak baku, artinya belum diakui secara luas 2. Metode yang dikembangkan oleh laboratorium 3. Metode standar yang digunakan diluar lingkupnya 4. Perubahan dari metode standar
5. Gabungan dari dua metode atau lebih
Proses validasi meliputi pengujian beberapa parameter yaitu presisi, akurasi, batas deteksi (LOD), batas kuantifikasi (LOQ), spesifisitas, linieritas, kekasaran (Ruggedness) dan ketahanan (Robustness). Pada penelitian ini, 6
9 parameter yang akan menjadi acuan yaitu akurasi, presisi, linieritas, robustness (ketahanan),limit of detection (LOD), limit of quantification (LOQ).
2.1.1 Uji Kesesuaian Sistem
Uji kesesuian sistem digunakan untuk memverifikasi bahwa sistem kromatografi dapat diterapkan dalam analisis (Kuncoro et al., 2014). Uji kesesuaian sistem yang digunakan dalam penelitian ini meliputi jumlah pelat teoritis (N), High Equivalentof Theoretical Plate(HETP) dan Resolusi (R).Hasil uji keseuaian sistem memenuhi standar apabila nila N ≥ 1000 (USP, 2012) HETP < N, dan R > 1,5 (Synder et al., 1997).
Jumlah pelat teoritis (N) merupakan paramater yang digunakan untuk menghitung efisiensi kromatografi. Efisiensi merupakan ukuran tingkat penyebaran puncak dalam kolom. Efisiensi kolom dapat ditunjukkan dari jumlah lempeng teoritikal atau theoritical plates (N) pada persamaan 1. Kolom dapat dikatakan efisiensi jika kolom mampu menghasilkan pita sempit dan dapat memisahkan analit dengan baik. Nilai lempeng akan semakin tinggi jika ukuran kolom semakin panjang sehingga hal tersebut memperlihatkan proses pemisahan yang semakin baik. Hubungan antara nilai lempeng dengan panjang kolom disebut dengan nilai HETP seperti pada persamaan 2 (Synder et al., 1997).
𝑁 = 16 (𝑡𝑅
𝑤)
2 ... (1)
Keterangan: tR : waktu retensi analit w : lebar pada dasar puncak HETP = L
N ... (2)
Keterangan: L : panjang kolom (mm) N : jumlah pelat teoritis
10 𝑅 =2(tR2−tR1)
(w1+w2) ... (3)
Keterangan: tR : waktu retensi analit w : lebar pada dasar puncak
2.1.2 Akurasi
Akurasi merupakan kedekatan antara nilai terukur (measured value) dengan nilai sebenarnya yang diterima, baik nilai sebenarnya, maupun nilai rujukan (Rohman, 2014). Menurut Ahuja dan Ramusses (2007), akurasi sebuah metode analisis yang mencerminkan nilai atau harga dari yang diperoleh saat penelitian dengan data yang sesungguhnya ditentukan dengan % recovery.
Akurasi memiliki tiga pendekatan yang umum digunakan, yaitu menggunakan Standart Reference Material(SRM), melakukan spiking terhadap plasebo atau metode simulasi, dan menggunakan metode penambahan standar (standar addition method) (Rohman, 2014). Dalam metode simulasi, sejumlah zat bahan murni, ditambahkan kedalam campuran bahan pembawa sediaan farmasi (plasebo) dan kemudian campuran tersebut dianalisis hasilnya dan dibandngkan dengan kadar zat yang sebenarnya sesuai pada persamaan 4. Dalam metode penambahan standar atau baku, sampel yang dianalisis dengan jumlah tertentu dan diketahui zatnya kemudian ditambahkan ke dalam sampel yang kemudian dianalisis lagi (Harmita, 2004).
Perhitungan perolehan kembali dapat juga ditetapkan dengan rumus: % Perolehan kembali = (Cf−CA)
Ca X 100%.... ... (4)
Keterangan: Cf : konsentrasi total sampel yang diperoleh dari pengukuran CA : konsentrasi sampel sebenarnya
11 Akurasi yang dapat diartikan sebagai nilai perolehan kembali yang telah umum kurang lebih 98-102 %. Jika perolehan kembali di luar kisaran yang telah ditetapkan seperti pada Tabel 1, maka metode analisis harus diinvestigasi kembali.
Tabel 1. Persentasi perolehan kembali (recovery) yang diterima. (Gonzales et al.,
2010)
Analit (%) Satuan konsentrasi Rata-rata perolehan kembali (%)
100 100 % 98-102 10 10 % 98-102 1 1 % 97-102 0,1 0,1 % 95-105 0,01 100 ppm 90-107 0,001 10 ppm 80-110 0,0001 1 ppm 80-110 0,00001 100 ppb 80-110 0,000001 10 ppb 60-115 0,0000001 1 ppb 40-120 2.1.3 Presisi
Presisi merupakan ukuran keterulangan metode analisis dan dapat dideskripsikan sebagai simpangan baku relatif (Relative Standard Deviation, RSD) atau sering disebut dengan koefisien variasi (KV). Keseksamaan atau keterulangan merupakan presisi yang dilakukan pada kondisi percobaan yang sama secara berulang baik dari segi praktikan, peralatan, lokasi maupun waktu. Dapat dikatan seksama jika metode menghasilkan simpangan baku relatif atau KV 2% atau kurang. Nilai KV tergantung pada kadar zat yang dianalisis. Terdapat dua pilihan pengujian yang telah diakui oleh International Conference on
Harmonization (ICH) untuk mengamati keterulangan, yaitu pertama suatu
pengukuran sebanyak paling sedikit sembilan kali yang mencangkup kisaran yang digunakan dalam prosedur analisis dan pengukuran sebanyak paling sedikit enam kali pada konsentrasi 100% dari konsentrasi uji (Rohman, 2014).
12 Menurut Rohman (2014) keterulangan presisi yang dilakukan pada kondisis percobaan yang sama (berulang), baik praktikan, peralatannya, lokasi, maupun waktu. Pengujian yang telah diizinkan oleh penggunaannya oleh ICH untuk mengamati keterulangan yaitu, suatu pengukuran minimal sebanyak sembilan kali yang mencangkup kisaran yang digunakan dalam prosedur analisis (seperti dengan tiga konsentrasi yang berbeda pada kisaran konsentrasi, dengan masing-masing dilakukan replikasi sebanyak tiga kali) dan suatu pengukuran minimal sebanyak enam kali pada konsentrasi 100% dari konsentras uji. Harmita (2004) menyebutkan untuk menetapkan presisi bahan campuran, formula berikut ini dapat digunakan untuk menentukan metode ketertiruan yang tepat.
Rumus simpangan baku :
𝑆𝐷 =√( Σ(x –x ′rata−rata)^2 n−1 ...(5) Rumus %RSD: %RSD = 𝑆𝐷 𝑅𝑒𝑟𝑎𝑡𝑎 𝑎𝑟𝑒𝑎𝑋 100%...(6)
Keterangan: c : konsentrasi analit sebagai fraksi desimal (contoh: 0,1% = 0,001) x : banyaknya hasil analisis
x’: rata-rata dari jumlah hasil analisis
Menurut ketentuan Horwitzh dan AOAC PVM pada Tabel 2 merupakan nilai RSD berdasarkan level analitnya. Sesuai dengan persentase perolehan kembali yang telah diperbolehkan, nilai persentase RSD sebagai gambaran presisi yang merupakan fungsi dari level analit dalam sampel.
13
Tabel 2. Nilai RSD yang diperbolehkan menurut Horwitz dan AOAC PVM
(Gonzales dan Herrador, 2007)
Analit (%) Horwizt (% RSD) AOAC PVM (% RSD)
100 2 1,3 10 2,8 1,8 1 4 2,7 0,1 5,7 3,7 0,01 8 5,3 0,001 11,3 7,4 0,0001 16 11 0,00001 22,6 15 0,000001 32 21 0,0000001 45,3 30 2.1.4 Ketahanan (Robustness)
Ketahanan merupakan metode yang berfungsi sebagai ketahanan dalam pengaruh oleh adanya variasi paramater metode yang kecil. Ketahanan dapat dievaluasi dengan melakukan variasi dari beberapa parameter metode seperti pelarut organik, pH dan sebagainya. Validasi metode yang baik adalah dapat mengevaluasi ketahanan dengan memvariasikan parameter-parameter penting secara sistematis dan mengukur pengaruh pada pemisahan (Rohman, 2014).Godswill et al (2014) menyebutkan robustness harus diperhatikan dalam pengembangan metode karena untuk mengukur besaran ketahanan terhadap pengaruh oleh variasi metode parameter yang kecil.
2.1.5 Linieritas (Harmita, 2004)
Linieritas merupakan kemampuan metode analisis yang memberikan respon yang secara langsung atau dengan bantuan transformasi matematik yang baik, proporsional terhadap konsentrasi analit dalam sampel. Perlakuan matematik dalam pengujian linieritas adalah melalui persamaan garis lurus dengan metode kuadrat terkecil antara hasil analisis terhadap konsentrasi analit. Jumlah sampel
14 yang dianalisis sekurang-kurangnya delapan buah sampel blanko. Sebagai parameter hubungan linier digunakan koefisien korelasi r pada analisis regresi linier y = a + bx. Hubungan linier yang ideal dicapai jika nilai b = 0 dan r = +1 atau -1 bergantung pada arah garis. Nilai a menunjukkan kepekaan analisis terutama instrumen yang digunakan.
Rohman (2014) menyebutkan linieritas dapat ditunjukkan secara langsung dengan mengencerkan larutan baku yang dilakukan secara serial. Penyiapan konsentrasi yang berbeda dengan menggunakan berat baku yang berbeda akan menimbulkan kesalahan yang besar terhadap hasil analisis linieritas. Linieritas yang baik dapat dievaluasi dengan pengamatan visual terhadap suatu plot yang menyatkan hubungan antara fungsi konsentrasi analit dengan beberapa fungsi lainnya (adsorbansi, luas puncak, tinggi puncak, luas bawah kurva dan sebagainya). Uji linieritas menggunakan sedikitnya 5 konsentrasi yang berbeda.
2.1.6 Batas Deteksi (Limit of Detection, LOD) (Harmita, 2004)
Limit deteksi adalah jumlah terkecil suatu zat dalam sampel yang dapat dideteksi yang masih memberikan respon signifikan dibandingkan dengan blanko (Harmita, 2004). Menurut Abdul (2014) batas deteksi dan batas kuantifikasi merupakan suatu parameter yang digunakan untuk menggambarkan tingkat sensitivitas suatu metode analisis. LOD biasanya menggunakan rasio 2 atau 3 banding 1 yang diekspresikan sebagai suatu konsentrasi pasa rasio sinyal terhadap derau (signal to noise ratio). Limit ini dapat diukur secara statistik melalui garis regresi linier dari kurva kalibrasi pada persamaan 7.
LOD =3( 𝑠𝑦
𝑥)
15 Keterangan: LOD :Limit of Detection
(sy/x) :Simpangan baku residual
b :Arah garis linear dari kurva antara respon terhadap konsentrasi = slope (b pada persamaan garis y = a+bx)
2.1.7 Batas Kuantifikasi (Limit of Quantification, LOQ)
Batas kuantifikasi (LOQ) didefinisikan sebagai konsentrasi analit terendah dalam sampel yang dapat ditentukan dengan presisi dan akurasi yang dapat diterima pada kondisi oprasional metode yang digunakan (Rohman, 2014). Adapun menurut Harmita (2006) dan Gandjar (2009) batas kuantifikasi merupakan parameter pada analisis renik dan diartikan sebagai kuantitas terkecil suatu zat tertentu dalam sampel yang masih dapat memenuhi kriteria cermat dan seksama. Limit ini dapat diukur berdasarkan regresi linier dan kurva kalibrasi. LOQ dapat diartikan sebagai konsentrasi (dengan akurasi yang sesuai) dengan rasio signal to noise 10:1 merupakan aturan yang umum digunakan seperti pada persamaan 8.
LOQ = 10( 𝑠𝑦
𝑥)
𝑏 ...(8)
Keterangan: LOQ :Limit of Quantification (sy/x) :Simpangan baku residual
b :Arah garis linear dari kurva antara respon terhadap konsentrasi = slope (b pada persamaan garis y = a+bx)
2.2 Media Kultur In Vitro
Kultur in vitro merupakan metode yang berfungsi mengisolasi bagian-bagian tanaman seperti sel, jaringan ataupun organ yang ditumbuhkan pada sebuah media secara aseptik, sehingga tanaman tersebut dapat memperbanyak diri dan meregenerasi. Sebuah teori yang dikemukakan oleh ahli biologi yang berasal
16 dari German yaitu Schleiden dan Schwann bahwa prinsip pada kultur in vitro terdapat pada teori sel. Teori tersebut menyatakan sel bersifat autonom yang berarti dapat melakukan metabolisme, tumbuh dan berkembang secara berkembang secara mandiri jika diisolasi tunas dari jaringan induknya, dan totiopotensi diartikan sebagai kemampuan sel untuk tumbuh dan meregenerasi menjadi tanaman yang lengkap (Indrianto, 2003).
Menurut Nurheti (2010) kultur in vitro memiliki keuntungan yaitu pengadaan bibit tidak bergantung pada musim dan bibit yang dihasilkan sama dan bebas terhadap penyakit. Adapun tujuan dari kultur in vitro adalah untuk memperbanyak tanaman dengan waktu yang relatif singkat.
2.3 Hormon Pertumbuhan
Hormon pertumbuhan sangat penting dalam membantu mempercepat pertumbuhan dan perkembangan tanaman baik secara in vitro maupun alami yang disebut dengan Phytohormone.Hormon tanaman (Phytohormones) berasal dari bahasa yunani yatu “phytos” yang artinya tanaman dan “hormanein” yang artinya zat perangsang sehingga fitohormon dapat didefinisikan sebagai zat-zat yang dapat merangsang pertumbuhan dan mengatur proses fisiologi tanaman. Hormon pertumbuhan dapat dibagi menjadi 6 kelompok yaitu auksin, sitokinin, etilen, giberelin brasinosteroid dan asam absisat (Teale et al., 2006).
Auksin berfungsi merangsang pertumbuhan akar, mengatur pembesaran sel dan memicu perpanjangan sel tanaman, serta meningkatkan dominansi apikal dan diferensi xylem. Auksin banyak ditemukan pada embrio benih dan jaringan merismatik yang aktif tumbuh seperti tunas tanamana, ujung akar dan pucuk
17 ranting atau daun. Menurut Tsavkelova et al (2005) fitohormon auksin yang banyak terdapat di alam dan paling aktif adalah Indole-3-Acetic Acid (IAA). Selain auksin alami, terdapat auksin sintetik seperti Napthalene-3-Acetic Acid (NAA), 2,4-Dicholrophenoxyacetic acid (2,4 D) dan Indole-3-Butyric Acid (IBA). Sitokinin berperan penting dalam pengaturan pembelahan sel morfogenesis. Sitokinin yang pertama kali ditemukan adalah kinetin. Kinetin berkerjasama dengan auksin memberikan pengaruh interaksi terhadap diferensiasi jaringan. Kinetin adalah N6-furfuril adenin suatu turunan dari basa adenin. Zeatin merupakan salah satu jenis sitokinin yang terdapat pada hasil isolasi biji jagung yang berfungsi sebagai unsur hara yang diperlukan oleh tanaman (Damiska et al., 2015). Salah satu sitokinin sintesis adalan 6-Benzyl amino purine (BAP) (Alitalia, 2008). BAP merupakan sitokinin yang sering digunakan karena lebih efektif dan lebih stabil (Yusnita, 2003). Wattimena (1988) menambahan bahwa BAP merupakan turunan adenin yang disubtitusi pada posisi 6 yang strukturnya serupa dengan kinetin.
Asam absidik (Abscisic Acid, ABA) merupakan memiliki peranan dalam proses pertumbuhan dan perkembangan tanaman. ABA berinteraksi dengan zat-zat pengatur tumbuh tanaman yang lain pada proses tersebut, biasanya interaksi ini bersifat menghambat.
2.4 Kromatografi Cair Kinerja Tinggi (KCKT)
Kromatografi Cair kinerja tinggi (KCKT) atau biasa disebut juga dengan
High Perfomance Liquid Chromatography (HPLC) merupakan teknik pemisahan
18 berprinsip pada perbedaan molekul-molekul komponen diantara dua fasa, fasa gerak dan fasa diam yang memiliki sifat kepolaran yang berbeda. Apabila molekul komponen saling berinteraksi secara lemah dengan fasa diam, maka komponen tersebut akan bergerak lebih cepat meninggalkan fasa diam. Oleh karena itu, keberhasilan pemisahan bergantung pada daya interaksi antar komponen campuran dengan fasa diam dan fasa gerak (Effendy, 2004). Menurut Rohman (2007), penggunaan kromatografi cair membutuhkan penggabungan secara tepat dari berbagai aspek seperti fase gerak, jenis kolom, panjang dan diameter kolom, kecepatan alir fasa gerak, suhu kolom hingga ukuran sampel.
KCKT termasuk kromatografi kolom, sampel yang melalui kolom akan mengalami pemisahan senyawa-senyawa didalamnya (Harvey, 2000). Effandy (2004) menyebutkan bahwa, teknologi kolom didasarkan atas penggunaan kolom yang berlubang dengan diameter 2 µm hingga 5µm dan isi kolom berupa partikel kecil berukuran 3µm hingga 5 µm yang memungkinkan tercapainya keseimbangan secara cepat antara fasa diam dan fasa gerak. Sistem pompa bertekanan tinggi kepada fase gerak akan berpengaruh pada pencapaian laju alir hingga beberapa mL per menit, sehingga metode tersebut dinamakan kromatografi cair dengan kinerja tinggi.
2.4.1 Prinsip kerja KCKT
Prinsip kerja KCKT adalah fasa gerak yang dialirkan dengan bantuan pompa melalui kolom dektektor yang di dalamnya sudah di masukkan sampel dengan cara disuntik. Adanya perbedaan kekuatan interaksi antara solut-solut terhadap fasa diam, sehingga terjadi pemisahan komponen-komponen cairan. Menurut Gandjar dan Rohman (2007), pemisahan senyawa dalam KCKT diatur
19 oleh distribusi senyawa dalam fasa gerak dan fasa diam. Komponen dalam suatu campuran, akan dideteksi oleh detektor dalam bentuk kromatogram.
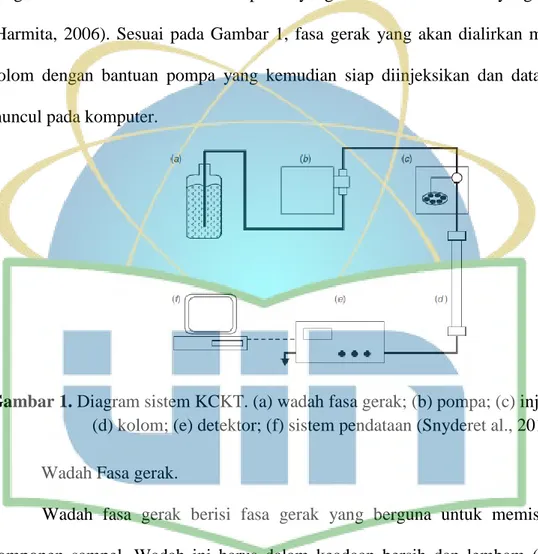
Analisis menggunakan KCKT relatif lebih cepat, daya pemisahan yang baik, tingkat sensitifitas yang tinggi hingga nanogram/mililiter, pemilihan kolom yang bervariasi, kolom dapat digunakan kembali, dapat menganalisis senyawa dengan ukuran bervariasi dan campuran yang memiliki titik didih yang tinggi (Harmita, 2006). Sesuai pada Gambar 1, fasa gerak yang akan dialirkan menuju kolom dengan bantuan pompa yang kemudian siap diinjeksikan dan data akan muncul pada komputer.
Gambar 1. Diagram sistem KCKT. (a) wadah fasa gerak; (b) pompa; (c) injektor;
(d) kolom; (e) detektor; (f) sistem pendataan (Snyderet al., 2010). a. Wadah Fasa gerak.
Wadah fasa gerak berisi fasa gerak yang berguna untuk memisahkan komponen sampel. Wadah ini harus dalam keadaan bersih dan lembam (inert). Dalam penentuan pelarut fasa gerak, sangat dianjurkan menggunakan pelarut dengan tingkat kemurnian yang tinggi karena jika adanya zat pengotor, partikel yang kecil akan terkumpul dalam kolom sehingga dapat mengakibatkan kekosongan pada kolom yang kemudian dapat menyebabkan gangguan pada sistem pembacaan kromatografi (Gandjar dan Rohman, 2007).
20 b. Fasa Gerak
Fasa gerak KCKT berupa zat cair atau disebut juga eluent atau pelarut. Menurut Gandjar dan Rohman (2007), fasa gerak atau eluent biasanya terdiri dari atas campuran pelarut yang dapat bercampur yang secara keseluruhan berperan dalam daya elusi dan resolusi. Diperkuat oleh Kazakevich dan Lo Brutto (2007), fasa gerak pada KCKT menggunakan fasa terbalik yaitu campuran hidro organik. Senyawa organik yang umumnya digunakan adalah asetonitril dan metanol atau campuran keduanya.
Persyaratan fasa gerak KCKT:
1. Zat cair harus bertindak sebagai pelarut yang baik untuk sampel yang akan dianalisis.
2. Zat cair harus murni sekali
3. Zat cair mudah diperoleh, murah, tidak mudah terbakar, dan tidak beracun 4. Zat cair tidak kental. Kekentalan tidak > 0,5 cp
5. Sesuai dengan detektor
6. Zat cair harus jernih sekali untuk menghindari penyumbatan pada kolom. Biasanya pelarut disaring dengan saringan nilon berukuran diameter pori 0,45 µl.
Konsentrasi dari larutan organik dalam fase gerak merupakan faktor dominan yang mempengaruhi retensi analit dalam sistem KCKT. Pertimbangan dalam memilih solven fasa gerak meliputi kompabilitas antar solven, kelarutan sampel dalam eluen, polaritas, transmisi cahaya, viskositas, stabilitas dan pH.
Pemilihan zat cair sebagai fasa gerak ini merupakan hal yang kritis dalam keberhasilan pemisahan. Hingga saat ini pemilihan fasa gerak berdasarkan
21 eksperimen trial dan error karena belum ada teori yang pasti. Trial error dilakukan hingga diperoleh kromatogram yang sesuai harapan analit.
c. Pompa
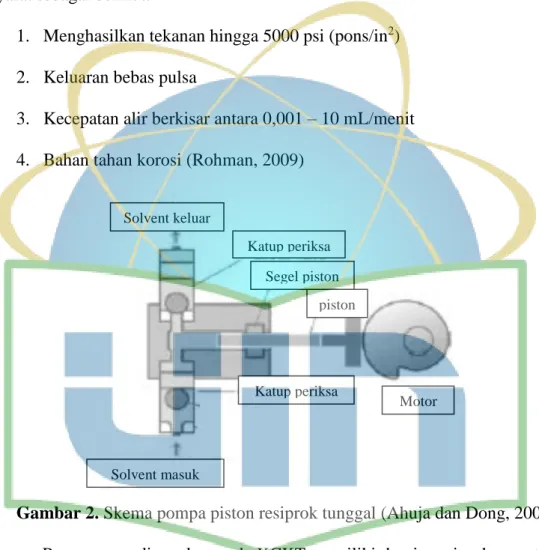
Pompa berfungsi untuk mengalirkan fasa gerak cair melalui kolom yang berisi serbuk halus. Pompa yang dapat digunakan dalam KCKT harus memiliki syarat sebagai berikut:
1. Menghasilkan tekanan hingga 5000 psi (pons/in2) 2. Keluaran bebas pulsa
3. Kecepatan alir berkisar antara 0,001 – 10 mL/menit 4. Bahan tahan korosi (Rohman, 2009)
Gambar 2. Skema pompa piston resiprok tunggal (Ahuja dan Dong, 2005)
Pompa yang digunakan pada KCKT memiliki desain resiprok seperti pada Gambar 2. Pada gambar tersebut dapat dilihat terdapat cam bermotor yang dapat menjalankan piston kearah depan dan belakang untuk mengalirkan solven melalui suatu vulva inlet dan outlet (Ahuja dan Dong, 2005).
Solvent keluar Motor Katup periksa piston Segel piston Solvent masuk Katup periksa
22
Gambar 3. Skema pompa dual-piston dengan pompa paralel (Ahuja dan Dong,
2005)
Perkembangan model pompa yang telah dimodifikasi pada desain
dual-piston yang kini banyak digunakan seperti pada Gambar 3. Pompa ini memiliki
dua piston dijalankan oleh dua motor yang terpisah (Ahuja dan Dong, 2005). d. Injektor
Sampel cair yang telah siap dianalisis disuntikan secara langsung kedalam fasa gerak yang mengalir di bawah tekanan menuju kolom. Pada proses injeksi hindari memasukkan sampel dalam jumlah yang banyak yang dapat mengakibatkan ketidaktepatan pengukuran KCKT karena adanya keterulangan pemasukkan. Maka disarankan untuk menggunakan sampel sedikit mungkin (Gandjar dan Rohman, 2007).
e. Kolom
Kolom yang digunakan terbuat dari stainless steel atau gelas yang berdinding tebal. Menurut Harvey (2000), kolom merupakan bagian KCKT yang berisi fasa diam. Fasa diam pada KCKT berupa lapisan film cair yang terikat pada basis partikel silika yang bertujuan untuk mencegah kemungkinan terjadinya kebocoran cairan fasa. Partikel silika direaksikan dengan organochlorosilane atau Si(CH3)2RCl, di mana R merupakan suatu alkil atau gugus alkil terdistribusi.
Kepolaran dari fasa diam bergantung pada jenis R, fasa diam dan gugus fungsi harus memiliki sifat kepolaran yang sama.
23 f. Detektor
Detektor berfungsi sebagai mendeteksi sampel yang terdapat didalam kolom analitik. Syarat suatu detektor harus memiliki tingkat sensitifitas yang tinggi, stabil, cepat, reprodusibel dan mempunyai volume yang kecil sehingga mampu meminimalkan pelebaran pita yang dihasilkan, kemudian tidak sensitif terhadap perubahan suhu kecepatan alir fasa gerak (Rohman, 2009). Terdapat tiga detektor, detektor umum memberi respon terhadap fasa gerak yang dimodulasi dengan adanya sampel. Detektor spesifik memberi respon terhadap sampel yang tidak dimiliki oleh fasa gerak. Detektor yang bersifat umum terhadap sampel setelah fasa gerak dihilangkan dengan pengumpan. Menurut Kar (2005), salah satu detektor yang populer digunakan adalah detektor UV-Vis. Prinsip dasar detektor ini pada adanya penyerapan ultraviolet (UV) dan sinar tampak (Visible) dengan kisaran panjang gelombang 190-800 nm yang dapat mendeteksi gugus-gugus kromoforik.
Gandjar dan Rohman (2007) mengatakan, analisis kualitatif KCKT berupa pengamatan waktu retensi (tR) pada senyawa baku yang baku dan senyawa dalam
suatu sampel yang belum diketahui dan membandigkannya dengan cara kromatografi secara bergilir dengan kondisi alat yang stabil dengan rentang perbedaan waktu pengoprasian antar keduanya sekecil mungkin. Analisis kuantitatif pada KCKT dengan mengukur tinggi puncak sebagai garis dasar ke puncak maksimum. Sedangkan luas puncak diukur sebagai hasil kali tinggi puncak dan lebar pada setengah tinggi (W1/2). Menurut Harmita (2006), analisis
kualitatif KCKT dilihat dari kekhasan waktu retensi namun tidak spesifik, artinya terdapat lebih dari satu komponen zat yang mempunyai waktu retensi yang sama
24 sehingga membutuhkan uji kemurnian puncak spektrofotometri dengan menggunakan waktu relatif. Sedangkan untuk analisis kuantitatif spektrum hasil dari serapan komponen-komponen campuran yang memiliki gugus kromofor dengan memperhatikan panjang gelombang maksimum untuk menetapkan komponen dan fasa gerak. Dasar perhitungan kuantitatif dengan mengukur luas atau tinggi puncaknya.
2.4.2 Teknik Pemisahan KCKT
a. Sistem Isokratik
Merupakan suatu teknik pemisahan dimana komposisi fasa gerak dan fasa diam tidak berubah sehingga polaritas dari eluen tersebut stabil hingga akhir analisis.
b. Sistem Gradien
Merupakan suatu teknik pemisahan dimana terjadi perubahan komposisi fasa gerak sehingga teknik ini dilakukan dengan bertujuan memisahkan campuran dengan polaritas yang beragam (Harmita, 2006).
24
BAB III
METODE PENELITIAN
3.1Waktu dan Tempat
Penelitian ini dilakukan pada bulan November 2019 hingga Agustus 2020 di Balai Bioteknologi BPPT Puspiptek, Serpong. Media kultur in vitro berasal dari Laboratorium Mikropropagasi Tanaman Balai Bioteknologi BPPT Puspiptek, Serpong.
3.2 Alat dan Bahan 3.2.1 Alat
Alat yang digunakan pada penelitian ini adalah neraca analitik (Denver), tabung sentrifugasi, gelas beker, gelas ukur, mikropipet 1000 µL; 200 µL dan 20 µL, kertas saring (Waltman 45), evaporator (Heidolph Laborota 4000), micro
tube, pH meter (Mettler Toledo), konsentrator (Sakuma Ec-2000), dan instrumen
KCKT (Hitachi L-2130), kolom Phenomenex® Luna C18, 5 µm (250 x 4.6 mm), sonikator (Tomy MX-301) dan hot plate (MTOPS).
3.2.2 Bahan
Bahan yang digunakan adalah sampel media agar yang berasal dari perkebunan Balai Bioteknoogi, akuabides, etil asetat (Emsure), metanol untuk analisis (Merck), asam format(APS Finechem), trietilamin (Sigma-Aldrich) dan beberapa hormon standar seperti kinetin (Sigma), indole-3-asam asetat (Sigma), asam absidik (Sigma), indol-3-asam butirik (Sigma), dan 1-naftalen asetat (Sigma).
25
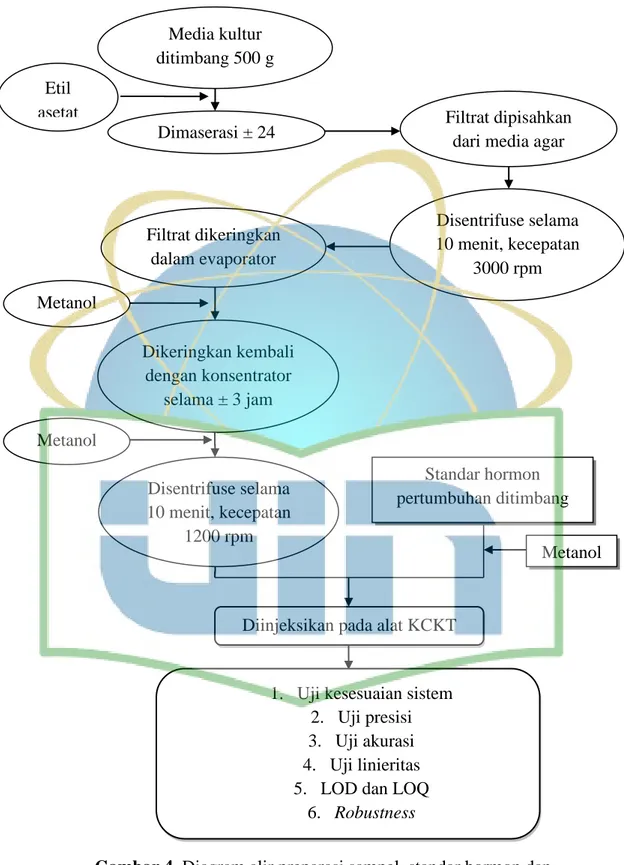
3.3 Diagram Alir
Diinjeksikan pada alat KCKT
1. Uji kesesuaian sistem 2. Uji presisi 3. Uji akurasi 4. Uji linieritas 5. LOD dan LOQ
6. Robustness
Gambar 4. Diagram alir preparasi sampel, standar hormon dan
validasi metode penelitian
Standar hormon pertumbuhan ditimbang Metanol Media kultur ditimbang 500 g Dimaserasi ± 24 jam Etil
asetat Filtrat dipisahkan
dari media agar
Disentrifuse selama 10 menit, kecepatan 3000 rpm Filtrat dikeringkan dalam evaporator Metanol Dikeringkan kembali dengan konsentrator selama ± 3 jam Metanol Disentrifuse selama 10 menit, kecepatan 1200 rpm
26
3.4 Prosedur Kerja
3.4.1 Preparasi Eluen (Li et al., 2016)
Larutan asam format 0,1 % pH 3,2 sebanyak 2 liter dibuat dengan mengambil 2 mL asam format dalam 2 liter aquabides yang kemudian dilakukan pengukuran pH dengan merubah sistem setting pada alat dengan mode manual agar pH yang diinginkan dapat terukur dengan baik. Menambahkan trietilamin (TEA) beberapa tetes hingga tercapai pH 3,2.
3.4.2 Preparasi Standar
Standar hormon tanaman masing-masing dibuat sebagai acuan dalam pengukuran menggunakan konsentrasi 1000 ppm dengan cara menimbang setiap standar (kinetin, IAA, ABA, IBA dan NAA) sebanyak 0.0010 g/mL dalam 1 mL metanol. Kemudian dilakukan pengenceran kembali sebanyak lima kali, sehingga mendapatkan konsentrasi 200 ppm.
3.4.3 Preparasi Sampel (Li et al., 2016)
Sampel media kultur in vitro dimaserasi menggunakan etil asetat hingga sampel terendam, kemudian diaduk menggunakan magnetic stirer (dengan kondisi suhu tidak menyala) selama kurang lebih 24 jam. Hasil maserasi disaring, kemudian filtrat tersebut disentrifugasi selama 10 menit dengan kecepatan 3000 rpm. Filtrat yang telah disentrifugasi dipisahkan kemudian dievaporasi hingga kering. Ekstrak hormon pertumbuhan yang telah kering kemudian dilarutkan dengan metanol sebanyak 5 mL, lalu dipekatkan kembali dengan konsentrator kurang lebih 3 jam hingga metanol habis. Hasil pemekatan kemudian ditambahkan dengan metanol sebanyak 500 µL dan disentrifuse dengan kecepatan 1200 rpm selama 10 menit agar tidak ada gumpalan yang dapat menghambat
27 proses pada alat KCKT. Ekstrak sampel hormon pertumbuhan siap diinjeksikan pada KCKT.
3.4.4 Kondisi Operasi KCKT(Li et al., 2016)
Analisis dilakukan dengan menggunakan KCKT HITACHI L 2130 dengan kondisi sebagai berikut:
Fase gerak : (A) metanol : (B)0.1% asam format pH 3.2
Detektor : UV 200 nm
Kolom : Phenomenex® Luna C18, 5 µm (250 x 4.6 mm) Laju alir : 1.44 mL/min
Model elusi : gradient (10 : 90) Volum injeksi : 10 µL
Panjang gelombang : 200 nm
Tabel 3. Model elusi (Gradien)
MeOH (%) 0,1% Asam Format pH 3,2 (%) Waktu retensi (min) 10 90 0 10 90 5 30 70 10 30 70 20 45 55 35 45 55 60 10 90 63 10 90 75
3.4.5 Validasi Metode Analisis (Rohman, 2014 dan Harmita, 2004) 3.4.5.1 Penentuan Kesesuian Sistem
Uji kesesuaian sistem dilakkukan dengan menghitung pelat teoritis (N),
High Equivalent of Theoritical Plate (HETP) dan resolusi (R) sebanyak 7 kali
pengulangan injeksi pada standar masing masing hormon tanaman dengan kondisi yang telah disesuaikan, hingga diperoleh hasil dengan persyaratan tertentu pada
28 masing-masing parameter. Rumus perhitungan nilai pelat teoritis (N), HETP dan resolusi (R) menggunakan rumus (1), (2) dan (3).
3.4.5.2 Penentuan Presisi
Standar hormon tanaman masing-masing diinjeksikan sebanyak 7 kali pengulangan untuk mengetahui presisi pada masing-masing hormon tanaman. Standar hormon campuran diinjeksikan juga sebanyak 10 kali dan sampel daun anggrek diberi perlakuan jumlah injeksi yang sama yang selanjutnya dilakukan perhitungan presisi menggunakan rumus (5) dan (6). Keberhasilan nilai RSD pada penentuan presisi, dapat dilihat pada tabel 2 sebagai acuan (Harmita, 2014).
Konsentrasi standar hormon yang digunakan sebesar 200 ppm hasil pengenceran dari larutan baku 1000 ppm. Penggunaan konsentrasi diharapkan sekecil mungkin dikarenakan hormon dalam sampel memiliki kemungkinan konsentrasi yang sangat rendah.
Proses injeksi menggunkan alat KCKT dibutuhkan waktu 75 menit setiap standar hormon dan proses penentuan presisi harus dilakukan dalam satu waktu yang sama setiap jenis hormon untuk mencegah pergeseran rentan waktu.
3.4.5.3 Penentuan Linieritas
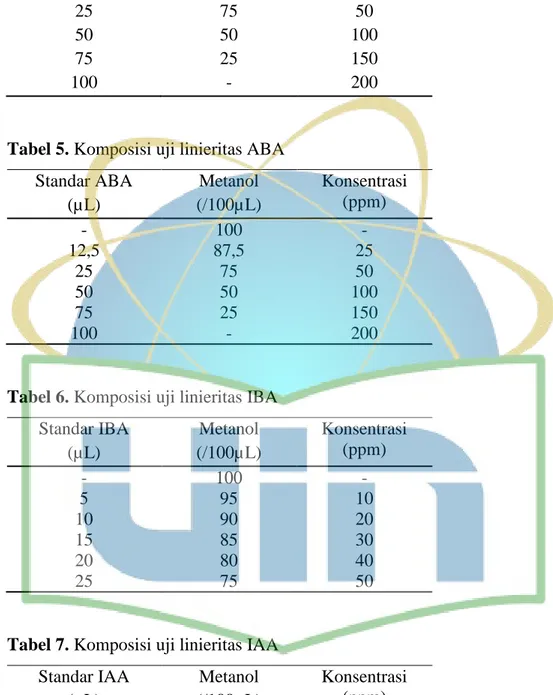
Pengujian lineritas terhadap 5 standar hormon tanaman dapat diperoleh hasil dengan mengukur deret standar yang dibuat dengan melakukan pengenceran larutan standar induk. Pengukuran dilakukan satu persatu standar hormon tanaman yaitu, kinetin, IAA, IBA, ABA dan NAA dengan konsentrasi induk sebesar 200 ppm dan dilakukan pengenceran dengan konsentrasi yang beragam seperti pada Tabel 4-8.
29
Tabel 4. Komposisi uji linieritas Kinetin
Standar Kinetin (µL) Metanol (/100µL) Konsentrasi (ppm) - 100 - 12,5 87,5 25 25 75 50 50 50 100 75 25 150 100 - 200
Tabel 5. Komposisi uji linieritas ABA
Standar ABA (µL) Metanol (/100µL) Konsentrasi (ppm) - 100 - 12,5 87,5 25 25 75 50 50 50 100 75 25 150 100 - 200
Tabel 6. Komposisi uji linieritas IBA
Standar IBA (µL) Metanol (/100µL) Konsentrasi (ppm) - 100 - 5 95 10 10 90 20 15 85 30 20 80 40 25 75 50
Tabel 7. Komposisi uji linieritas IAA
Standar IAA (µL) Metanol (/100µL) Konsentrasi (ppm) - 100 - 10 90 20 20 80 40 40 60 80 62,5 37,5 125 100 - 150
30
Tabel 8. Komposisi uji linieritas NAA
Standar NAA (µL) Metanol (/100µL) Konsentrasi (ppm) - 100 - 2,5 97,5 5 5 95 10 7,5 92,5 15 10 90 20 12,5 87,5 25
3.4.5.4 Penentuan Ketahanan (Robustness)
Memvalidasi ketahanan suatu metode perlu dibuat perubahan metode yang kecil dan terus menerus dan mengevaluasi respon analitik dan efek presisi dan akurasi. Uji robustness dilakukan dengan mengubah komposisi perbandingan terhadap fase gerak. Pada kondisi normal, fase gerak menggunakan perbandingan metanol : asam format 0,1% pH 3,2 (10:90) yang kemudian dirubah dengan perbandingan (15:85).
3.4.5.5 Penentuan Akurasi
Penentuan akurasi dilakukan dengan menambahkan spike (adisi standar) terhadap sampel dengan perbandingan 50:50. Komposisi spike yang digunakan terdiri dari kinetin 100 µL, IAA 100µL, GA 100 µL, BAP 100µL, 100 IBA 100 µL, ABA 100 µL, DPA 100 µL dan NAA 100 µL kemudian standar campuran tersebut digunakan sebanyak 10µL dan larutan sampel 10 µL sehingga menghasilkan faktor pengenceran sebanyak dua kali. Akurasi dinyatakan sebagai persen perolehan kembali (recovery) analit yang ditambahkan. Kriteria akurasi bergantung kepada konsentrasi analit dalam matriks sampel dan pada keseksamaan metode (RSD). Selisish kadar pada berbagai penentuan (Xd) harus
31 perolehan kembali (4). Keberhasilan akurasi suatu metode dapat dilihat pada tabel 1 sebagai acuan.
3.4.5.6 Penentuan Batas Deteksi(LOD) dan Batas Kuantifikasi (LOQ)
Penentuan batas deteksi dan kuantifikasi dapat dihitung secara statistik melalui garis regresi linier dari kurva kalibrasi menggunakan rumus (4) dan (5). Nilai pengukuran akan sama dengan nilai b pada persamaan garis linier y = a + bx, sedangkan simpangan baku blanko sama dengan simpangan baku residual (Sy/x)
32
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Ekstraksi
Prepasi sampel merupakan satu hal yang penting dalam prosedur analisis karena akan berpengaruh pada hasil analisis. Proses ekstraksi menggunakan metode maserasi disebabkan atas sensitivitas senyawa hormon pertumbuhan terhadap suhu tinggi sehingga proses maserasi dilakukan dalam suhu ruang. Prinsip ekstraksi dengan metode maserasi adalah terjadinya proses difusi larutan penyari ke dalam sel tumbuhan yang mengandung senyawa aktif. Difusi tersebut mengakibatkan tekanan osmosis dalam sel menjadi berbeda dengan keadaan diluar sel. Sehingga senyawa yang memiliki kepolaran yang sama dengan pelarut kemudian terdorong keluar karena adanya perbedaan tekanan osmosis didalam sel dan di luar sel (Dean, 2009).
Pelarut yang digunakan dalam proses maserasi adalah etil asetat hingga sampel terendam dengan sempurna. Pemilihan pelarut etil asetat yang memiliki sifat semi polar diharapkan dapat mengikat hormon pertumbuhan. Filtrat yang telah didapatkan dilanjutkan dengan evaporasi pada suhu 80°C menggunakan alat
rotary vacum evaporator bertujuan memisahkan hormon pertumbuhan dengan
pelarut etil asetat yang memiliki titik didih 77,1°C. Penggunaan metanol dapat melarutkan hormon pertumbuhan yang menempel pada labu evaporator yang kemudian dimasukkan kedalam alat konsentrator yang akan mempekatkan hasil ektraksi hormon pertumbuhan. Hasil dari konsentrator yang kemudian ditambahkan metanol sebanyak 200 µL. Larutan hasil sentrifugasi dipisahkan dari endapan dan siap dilakukan analisis pada alat KCKT.
33
4.2 Hasil Validasi Metode Analisis 4.2.1. Hasil Uji kesesuaian Sistem
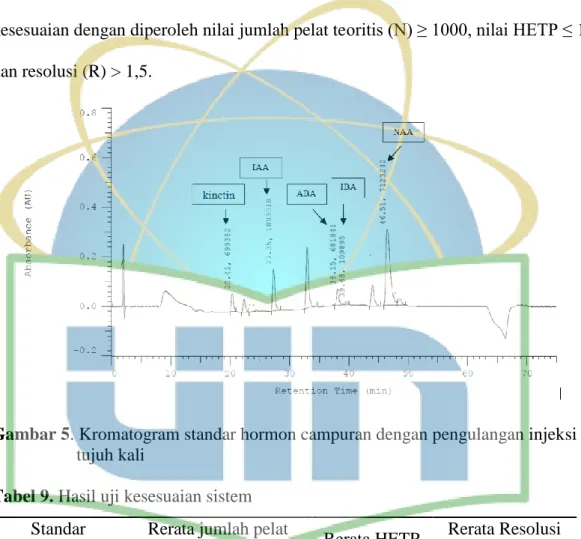
Pengujian kesesuian sistem dilakukan hingga 7 kali pengulangan sehingga diperoleh nilai yang sesuai dengan standar pada masing-masing parameter. Berdasarkan hasil uji kesesuaian sistem pada gambar 5 dengan pengulangan injeksi sebanyak tujuh kali, lima standar hormon tanaman memenuhi standar uji kesesuaian dengan diperoleh nilai jumlah pelat teoritis (N) ≥ 1000, nilai HETP ≤ 1 dan resolusi (R) > 1,5.
Gambar 5. Kromatogram standar hormon campuran dengan pengulangan injeksi
tujuh kali
Tabel 9. Hasil uji kesesuaian sistem
Standar Hormon
Rerata jumlah pelat
teoritis (N) Rerata HETP
Rerata Resolusi (R) Kinetin 429.693 0,002 59,78 IAA 802.771 0,00037 88,25 ABA 1.577.660 0,00046 12,58 IBA 1.653.510 0,00012 23,78 NAA 222.657 0,0015
34
Nilai HETP (High Equivalent of Theoretical Plate) merupakan hubungan antara panjang kolom dengan nilai N sebagai nilai efisiensi kolom. Faktor keberhasilan yang diperoleh terdapat pada panjang kolom yang digunakan dimana N akan semakin tinggi jika ukuran semakin panjang (Synder et al., 1997) dan faktor resolusi dapat ditingkatkan dengan ukuran kolom yang semakin panjang sehingga dapat mempengaruhi faktor pemisahan yang semakin baik (Crowfod, 2019).Kromatogram dan contoh perhitungan dapat dilihat pada lampiran 1.
Hasil penelitian pada tabel 9 menunjukkan rerata jumlah pelat teoritis dari masing-masing standar hormon dan uji kesesuaian lainnya memenuhi standar dikarenakan proses analisis menggunakan kolom sepanjang Phenomenex Luna C18 250 mm x 4,60 mm x 5 micron sehingga proses pemisahan semakin baik. Tabel 8 menunjukkan hasil resolusi antara dua puncak yang saling berdampingan dengan melibatkan lebar dasar puncak dengan waktu retensi. Rerata resolusi dengan hasil > 1,5 akan memnuhi syarat.
4.2.2. Hasil Uji Presisi Standar Hormon Pertumbuhan
Pengujian presisi standar pada hormon tanaman kinetin, IAA, ABA, IBA dan NAA bertujuan untuk mengetahui kesesuaian dan efektifitas kondisi operasional. Presisi dilakukan pada setiap standar hormon tanaman sebanyak tujuh kali pengulangan injeksi sehingga dapat diperoleh hasil yang kemudian dihitung nilai Relative Standard Deviation (%RSD) dengan standar ketelitian RSD ≤ 2% (Sugihartini et al.,2014). Perolehan data dari masing-masing standar hormon menunjukkan persyaratan tersebut terpenuhi seperti pada tabel 10. Data dan contoh perhitungan pada lampiran 2.
35
Tabel 10. Hasil uji presisi standar hormon pertumbuhan
Standar Hormon Rata-Rata Luas Area Parameter SD % RSD Kinetin 12.041.005 24.395 0,20 IAA 22.450.928 334.473 1,49 ABA 2.837.012 13.208 0,47 IBA 3.237.541 19.318 0,60 NAA 2.067.531 16.258 0,79
4.2.3. Hasil Uji Linieritas Larutan Standar Hormon Pertumbuhan
Menurut Wirasnita (2010) linieritas menggambarakan kemampuan metode analisis untuk memberikan respon terhadap konsentrasi analit dalam sampel. Pengujian ini dilakukan dengan mengukur larutan standar menggunakan HPLC pada berbagai konsentrasi mulai dari konsetrasi terkecil hingga konsentrasi terbesar. Luas area dan konsentrasi diaplikasikan untuk memperoleh kurva linieritas standar yang kemudian dibentuk persaman garis dan harga koefisien relasi (r).
Tabel 11. Hasil uji linieritas standar hormon pertumbuhan
Standar Hormon Pertumbuhan Rata-rata Luas Area Nilai Koefisien Determinasi (r2) Kinetin 10.281.198 0,999 IAA 7.852.113 0,999 ABA 2.087.629 0,999 IBA 4.181.526 0,999 NAA 2.401.448 0,999
Standar hormon tanaman masing-masing dibuat sebanyak enam deret standar dimana koefisien determinasi masing-masing standar hormon tanaman memiliki nilai koefisien determinasi (r2) yang baik yaitu 0,999 dapat dilihat pada Tabel 11. Nilai r2 tersebut menunjukkan bahwa metode analisis ini memiliki
perbandingan yang proposional dan bertujuan untuk menunjukkan hubungan secara langsung atau tidak antara respon detektor dengan perubahan konsentrasi analit. Pengukuran linieritas dilakukan secara individu, dimana masing-masing
36 standar memiliki konsentrasi linieritas yang berbeda. Hal tersebut disebabkan karena besar puncak yang akan muncul berbeda beda, sehingga konsentrasi tidak bisa disama ratakan satu sama lain. Jika pengolahan data linieritas menggunakan standar campuran, dikhawatirkan pada konsentrasi tertentu terdapat standar hormon pertumbuhan yang tidak muncul.
Pada penelitian Isabel et al (2011) menggunakan matriks bunga zukini dengan metode UHPLC-MS, memperoleh nilai koefisien determinasi (r2) dimana larutan standar hormon IAA dan NAA memperoleh 0,999. Penelitian Ngin et al (2014) melakukan penelitian analisis hormon tanaman pada air buah kelapa menggunakan metode Capillary Electrophoresis–Mass Spectrometry (CE-MS/MS) menghasilkan koefisien determinasi (r2) pada standar IAA, ABA, IBA dan NAA memperoleh rentang 0,991-0,994. Hasil penelitian Almaeda et al(2014) menggunakan sampel bunga spesiesarabidopsis thaliana dengan metode HPLC-MS/MS menunjukkan koefisien determinasi (r2) pada standar hormon tanaman ABA adalah 0,998. Metode yang memiliki linieritas baik apabila persamaan kurva memiliki koefisien korelasi r > 0,995 atau r2> 0,990 (Njoman dan Adarwulan, 2016), sehingga dapat disimpulkan uji linieritas ini memenuhi syarat standar linieritas.
4.2.4. Hasil Uji Presisi Standar Campuran dan Konsentrasi Sampel Hormon Pertumbuhan
Menurut Harmita (2014) presisi atau keseksamaan merupakan ukuran yang dapat memunculkan derajat kesesuaian antara hasil uji individual dan diukur melalui penyebaran hasil individual dari rata-rata jika prosedur tersebut diterapkan secara berulang pada sampel-sampel yang diambil dari campuran yang homogen.
37 Keseksamaan dapat diukur sebagai simpangan baku atau simpangan relatif (koefisien variasi).
Pada penelitian ini, keseksamaan dinyatakan sebagai keterulangan (repeatability) yang dilakukan berulang kali oleh analis dan kondisi yang sama dalam interval waktu yang pendek. Keterulangan dapat dinilai melalui pelaksaan penetapan terpisah lengkap terhadap sampel identik yang terpisah dari batch yang sama sehingga memberikan ukuran keseksamaan pada kondisi yang normal (Harmita, 2014).
Proses pengujian presisi dilakukan sebanyak tujuh kali dengan konsentrasi yang sama yaitu masing-masing 200 ppm sehingga terjadi sembilan kali pengenceran. Hasil yang diperoleh pada uji presisi kemudian dilakukan perhitungan %RSD. Penelitian memperoleh hasil nilai %RSD dari masing-masing standar hormon pada rentang 0,69-3,68% pada tabel 12.
Tabel 12. Hasil uji presisi standar campuran hormon pertumbuhan
Standar Hormon Rata-rata Luas Area Parameter
SD %RSD Kinetin 705.771 8.570 1,21 IAA 1.879.845 12.929 0,69 IBA 692.044 6.001 0,87 ABA 106.511 3.915 3,68 NAA 7.115.091 86.753 1,22
Terdapat ketidak sesuaian hasil presisi pada standar hormon campuran yaitu ABA dengan %RSD 3,68 tentu tidak sesuai dengan standar %RSD ≤ 2%. Penyebab ketidak sesuaian dengan beragam kemungkinan seperti kesalahan pengukuran pada human error, standar hormon yang sudah tidak segar atau konsentrasi pada pelarut yang sudah tidak stabil. Pada penelitian Marilia et al
38 (2014) hasil uji presisi %RSD pada ABA menggunakan HPLC-MS sebesar 8,91%. Data dan contoh perhitungan pada lampiran 5.
Tabel 13. Hasil presisi konsentrasi sampel media in vitro
Sampel Standar Rata rata Konsentrasi (ppm) Parameter SD %RSD Media pertumbuhan Kinetin 0,0151 0,000206 1,36 IAA 0,0123 0,001158 9,35 ABA 0,7777 0,005518 0,71 IBA 0,1575 0,000531 0,34
Hasil dari presisi sampel pada tabel 13 menunjukkan hormon IAA memiliki %RSD sebesar 9,35 yang tidak memenuhi persyaratan. Penyebab ketidak berhasilan hasil %RSD pada IAA diduga standar IAA sudah tidak stabil, sehingga luas area yang dihasilkan tidak konsisten. Parameter %RSD hasil dari rata-rata sampel memenuhi syarat. Penelitian Nehela et al (2016) dengan menggunakan GC-MS dengan sampel daun jeruk menunjukkan %RSD pada IAA, IBA dan ABA dengan masing-masing 0,049%, 0,098% dan 0,077%. Jurnal tersebut menyebutkan bahwa ABA terdeteksi dalam daun dan akar.
4.2.5. Hasil Uji Akurasi
Konsentrasi standar campuran sebesar 25 ppm yang disebabkan oleh faktor pengenceran, dimana dalam wadah terpisah dari sampel hormon standar campuran masing-masing 200 ppm standar hormon dimasukkan sebanyak 100 µL, sehingga terjadi pengenceran sebanyak delapan kali. Sehingga masing masing standar hormon memiliki konsentrasi yang sama saat dimasukkan kedalam sampel.