PHARMACY, Vol.07 No. 01 April 2010 ISSN 1693-3591
PROFIL DISOLUSI IN VITRO TABLET LEVOFLOKSASIN GENERIK DAN LEVOFLOKSASIN NON GENERIK
Frisky Almuksiti*, Ika Yuni Astuti*, Didik Setiawan*
Fakultas Farmasi Universitas Muhammadiyah Purwokerto, Jl. Raya Dukuhwaluh, PO Box 202, Purwokerto 53182
ABSTRAK
Levofloksasin merupakan antibiotik berspektrum luas golongan kuinolon. Levofloksasin digunakan untuk mengobati infeksi bakteri yang terjadi di saluran pernafasan, saluran kencing dan kulit. Hingga saat ini Levofloksasin belum terdaftar dalam monografi USP, sehingga belum memiliki metode disolusi yang pasti. Uji disolusi in vitro sangat penting untuk memastikan kualitas suatu produk obat dengan cara melihat profil pelepasan obat dalam medium pembawanya dan untuk memperkirakan profil disolusi obat yang terjadi didalam tubuh. Penelitian ini bertujuan untuk membandingkan profil disolusi tablet Levofloksasin dalam medium HCl 0,1 N dan dalam medium dapar fosfat pH 7,4, serta untuk membandingkan profil disolusi antara tablet Levofloksasin generik dengan non generik. Uji disolusi menggunakan metode pengaduk tipe dayung, medium HCl 0,1 N atau dapar fosfat pH 7,4 sebanyak 900 ml, suhu dijaga pada 37±0,5°C, dengan kecepatan perputaran 50 rpm. Sampel diambil (5 ml) pada menit ke 5, 10, 20, 30 dqn 45 dan volume yang diambil digantikan dengan medium yang baru. Sampel kemudian dibaca serapannya dengan spektrofotometer pada λ maksimum. Hasil uji disolusi menunjukkan bahwa konsentrasi obat Levofloksasin yang dilepaskan mencapai lebih dari 80% pada menit ke 45. Profil disolusi Levofloksasin dalam medium HCl 0,1 N lebih baik dari pada profil disolusi Levofloksasin dalam medium dapar fosfat pH 7,4, dan tidak ada perbedaan yang signifikan antara tablet Levofloksasin generik dengan non generik.
Kata kunci : profil disolusi, in vitro, levofloksasin
ABSTRACT
Levofloxacine is an antibiotic broad spectrum of quinolon. It has been used to treat bacterial infections in respiratory tract, urinary tract, and skin. Till in this time Levofloxacine no in monograph in USP, hence not yet owned definitive dissolution method. The in vitro dissolution testing very important to ensure quality of drug product with show that drug release in this solvent and to the prediction of in vivo performance. This research was proposed to compare dissolution profile Levofloxacine tablet in HCl 0.1 N medium and Phosphat buffer of pH 7.4, and also to compare profile dissolution of generic Levofloxacine with non generic one. In the dissolution testing used paddle methode. Medium was 900 ml of HCl 0.1 N and Phosphat buffer of pH 7.4 at 37± 0.5°C with a speed 50 rpm. Sample aliquots (5 mL) were withdrawn at 5, 10, 20, 30 and 45
PHARMACY, Vol.07 No. 01 April 2010 ISSN 1693-3591
minutes and replaced with equal volumes of fresh medium. Sample was absorbed with spectrophotometrically at λ max. The results of dissolution showed that the drug concenrations of Levofloxacine reaching more than 80% is released over 45 minutes. Dissolution profile of Levofloxacine in HCl 0.1 N medium better than Levofloxacine in Phosphat buffer of pH 7.4 medium and no significantly differences between generic Levofloxacine with non generic Levofloxacine.
Key words : dissolution profile, in vitro, levofloxacine.
Pendahuluan
Levofloksasin adalah antibiotik golongan kuinolon yang mempunyai spektrum kerja luas terhadap bakteri Gram positif dan bakteri Gram negatif,
dengan cara menghambat
topoisomerase II pada DNA bakteri. Produk Levofloksasin ada yang generik dan non generik, digunakan dalam terapi untuk mengobati infeksi saluran pernafasan, infeksi saluran kemih dan infeksi kulit (Sultana, 2004). Sediaan yang bermutu dapat dilihat dari berbagai aspek, salah satunya harus memenuhi kriteria yang dipersyaratkan dalam Farmakope (Harianto, 2006).
Levofloksasin merupakan obat baru yang telah mendapat izin untuk diplublikasikan oleh FDA (Food and Drugs Administration) pada tahun 1996, akan tetapi hingga saat ini belum terdaftar dalam Farmakope Indonesia. Obat baru yang diperdagangkan harus menempuh uji bioavaibilitas dan bioekuivalen (BABE) untuk memberikan
jaminan kepada masyarakat bahwa produk tersebut memenuhi standar efikasi, keamanan dan mutu yang dibutuhkan (BPOM, 2005).
Syarat dalam Farmakope dan uji dalam BABE yang berkaitan dengan obat baru bentuk padat peroral berupa tablet atau kapsul yaitu melakukan uji disolusi dan mengamati profil disolusinya. Disolusi merupakan proses dimana suatu zat padat melarut dalam media pembawanya menghasilkan suatu larutan homogen. Sediaan padat peroral (tablet atau kapsul) yang memiliki laju disolusi yang baik dan cepat dari suatu sediaan maka akan membantu pada proses absorbsinya. Obat yang terabsorbsi akan memberikan respon farmakologi dan terapetik, maka bioavaibilitasnya juga baik (Sutriyo, 2005).
Penelitian tentang disolusi tablet Levofloksasin telah dilakukan. Beberapa diantaranya FDA (2008) dan Thakkar (2009) menggunakan metode
PHARMACY, Vol.07 No. 01 April 2010 ISSN 1693-3591
pengaduk tipe dayung (paddle), dengan medium asam berupa larutan asam hidroklorida (HCl) 0,1 N sebanyak 900 ml. Suhu dijaga 37 ± 0.5 °C, dengan kecepatan perputaran paddle 50 rpm. Sultana (2004) melakukan penelitian tentang disolusi Levofloksasin dengan menggunakan metode paddle juga, akan tetapi menggunakan medium yang bervariasi pH (pH 1,2; pH 7,4 dan pH 9,0) dan penambahan elemen logam (Ca, Mg, Cr, fe, Co, Ni, Cu, Cd dan Zn), yang bertujuan untuk melihat pembentukan kompleks logam dengan Levofloksasin yang dapat menyebabkan terganggunya proses disolusi.
Pada penelitian ini akan melihat dan menentukan medium mana yang memberikan profil disolusi tablet Levofloksasin yang paling baik, medium asam (HCl 0,1 N) yang dikonversikan sebagai medium yang mengikuti pH lambung (gastrik) atau pada medium basa (dapar fosfat pH 7,4) yang dikonversikan sebagai medium yang mengikuti pH usus (intestinal). Hal tersebut akan dilihat dari profil disolusinya, yaitu kecepatan melepas dan melarutnya zat aktif dalam medium pembawanya pada waktu tertentu. Dalam penelitian ini akan dibandingkan tablet Levofloksasin generik dengan non
generik dari segi profil disolusinya untuk menjamin tidak adanya perbedaan efikasi, sehingga permasalahan mutu dan harga tidak lagi diperdebatkan.
Metode Penelitian
Bahan: baku pembanding Levofloksasin (PT Indofarma), tablet Levofloksasin, HCl p.a (E. Merck), KH2PO4 p.a (E. Merck), Na2HPO4 p.a (E.
Merck), NaCl p.a (E. Merck) dan aquabidestilata (PT Otsuka).
Alat: Dissolution tester (LID-6D, INC-USA), spektrofotometer UV-Vis (Shimadzu UVPC-1601), pH meter, timbangan analitik dan alat-alat gelas yang lazim digunakan di laboratorium analisis.
Cara Kerja
1. Pembuatan Larutan Stok Levofloksasin
a. Larutan Stok Levofloksasin dalam Larutan HCl 0,1 N
Levofloxacin baku ditimbang dengan seksama 100 mg, dilarutkan dalam 1000 ml larutan HCl 0,1 N (Thakkar, 2009).
b. Larutan Stok Levofloksasin dalam Larutan Dapar Fosfat pH 7,4
PHARMACY, Vol.07 No. 01 April 2010 ISSN 1693-3591
Levofloksasin baku ditimbang dengan seksama 100 mg, dilarutkan dalam 1000 ml larutan dapar fosfat pH 7,4 (Sultana, 2004).
2. Penentuan Panjang Gelombang Maksimum
Larutan Levofloksasin (HCl 0,1 N atau dapar fosfat pH 7,4) dengan konsentrasi 1 mg% dibaca serapannya Spektrofotometer pada panjang gelombang antara 200-400 nm. Dilihat panjang gelombang mana yang memberikan serapan maksimum (Purwati, 2005).
3. Uji Linieritas (pembuatan kurva baku)
Dibuat seri kadar 0,1-1,0 mg% dari larutan stok Levofloksasin 10 mg% (Thakkar, 2009). Masing-masing kadar dibaca serapannya pada panjang gelombang maksimum. Hasil yang diperoleh dicatat dan dibuat kurva baku persamaan garis regresi linier, serapan terhadap konsentrasi Levofloksasin. Dihitung koefisien korelasinya.
4. Uji Keseksamaan (presisi)
Uji keseksamaan ini dilakukan secara berulang kali dengan metode yang sama, kondisi sama dan interval waktu yang pendek.
Sehingga presisi uji disolusi ini dilakukan dengan cara melakukan disolusi terhadap sediaan tablet, sampel yang digunakan paling sedikit enam replika. Kemudian data yang dihasilkan diolah, diukur simpangan baku dan simpangan baku relatifnya untuk menunjukkan derajat kesesuaian hasil yang satu dengan yang lainnya jika prosedur diterapkan secara berulang (Harmita, 2004).
5. Uji Disolusi
Disolusi menggunakan metode pengaduk tipe dayung (peddle), dengan medium (HCl 0,1 N atau dapar fosfat pH 7,4) sebanyak 900 ml. Suhu dijaga 37 ± 0.5 °C, dengan kecepatan perputaran pedle 50 rpm Thakkar (2009). Sampel larutan diambil pada menit ke 5, 10, 20, 30, 45 sebanyak 5 ml, dengan penggantian medium yang baru (Anonim, 2008). Baca serapan
sampel menggunakan
spektrofotometer pada panjang gelombang maksimum (Thakkar, 2009).
6.
Analisis Data
Untuk melihat ada tidaknya perbedaan profil disolusi antara sampel pada medium HCl 0,1 N
PHARMACY, Vol.07 No. 01 April 2010 ISSN 1693-3591
dengan medium dapar fosfat pH 7,4, serta membandingkan antara tablet Levofloksasin generik dengan non generik, maka data dianalis secara statistik melalui uji t.
Hasil dan Pembahasan
Disolusi merupakan salah satu syarat yang ditentukan dalam Farmakope Indonesia yang harus dilakukan pada sediaan padat berupa tablet atau kapsul. Disolusi adalah proses melarutnya zat aktif bercampur dengan medium pembawanya. Disolusi yang baik dan cepat dari suatu sediaan maka akan membantu pada proses absorbsinya. Obat yang terabsorbsi akan memberikan respon farmakologi dan terapetik (Sutriyo, 2005).
Penelitian ini menggunakan dua medium. Medium pertama bersifat
asam berasal dari larutan HCl 0,1 N. Medium HCl 0,1 N ini menggambarkan pH lambung (gastrik). Medium kedua bersifat basa lemah berupa dapar fosfat pH 7,4, menggambarkan pH usus (intestinal). Tujuan dari membedakan pH medium yaitu untuk mengamati
apakah pH medium akan
mempengaruhi profil disolusi tablet Levofloksasin. Medium yang telah dibuat, kemudian dibaca serapannya menggunakan spektrofotometer UV-Vis pada panjang gelombang 200-400 nm. Pencarian panjang gelomabang pelarut ini dimaksudkan untuk mengetahui serapan pelarut, sehingga apabila membaca serapan analit nantinya harus berada diatas panjang gelombang pelarut.
PHARMACY, Vol.07 No. 01 April 2010 ISSN 1693-3591
Hasil spektra medium HCl 0,1 N dan medium dapar fosfat pH 7,4 tidak ditemukan adanya serapan dalam rentang panjang gelombang daerah ultraviolet yaitu 200 hingga 400 nm, menandakan kedua pelarut tersebut tidak mengabsorbsi sinar pada daerah ultraviolet. Sebelum melakukan analisis atau validasi metode apapun, dilakukan penentuan panjang gelombang maksimum. Penentuan panjang gelombang maksimum perlu dilakukan untuk melihat pada panjang gelombang berapakah Levofloksasin memberikan serapan yang maksimum. Levofloksasin dapat diidentifikasi dengan spektrofotometer UV karena Levofloksasin memiliki elektron σ pada ikatan C-C, memiliki elektron π pada ikatan rangkap karbon yaitu adanya gugus kromofor, yang dapat menyerap dalam daerah ultraviolet (Roth, 1998).
Levofloksasin dalam medium HCl 0,1 N memiliki panjang gelombang maksimum 294 nm, sedangkan Levofloksasin dalam medium dapar fosfat pH 7,4 memiliki panjang gelombang maksimum pada 287,5 nm. Hasil ini sesuai dengan hasil dari penentuan panjang gelombang pada penelitian sebelumnya.
Levofloksasin memiliki panjang gelombang yang lebih besar dalam medium HCl 0,1 N, dikarenakan mengalami pergeseran merah atau batokromik. Pergeseran merah atau batokromik yaitu pergeseran panjang gelombang ke arah yang lebih panjang. Hal ini disebabkan karena adanya transisi π π* dengan bertambahnya kepolaran pelarut. Levofloksasin merupakan senyawa basa lemah, apabila berada pada daerah yang lebih asam akan terjadi ionisasi, proses ionisasi inilah yang menyebabkan seolah-olah gugus kromofor pada struktur Levofloksasin semakin banyak, sehingga dapat menyerap panjang gelombang lebih besar pada daerah ultraviolet. Selain itu, Levofloksasin juga mempunyai gugus auksokrom berupa – NHCH3 yang akan memperlebar sistem
kromofor dan menggeser maksimum absorbsi kearah panjang gelombang yang lebih besar (Roth, 1998).
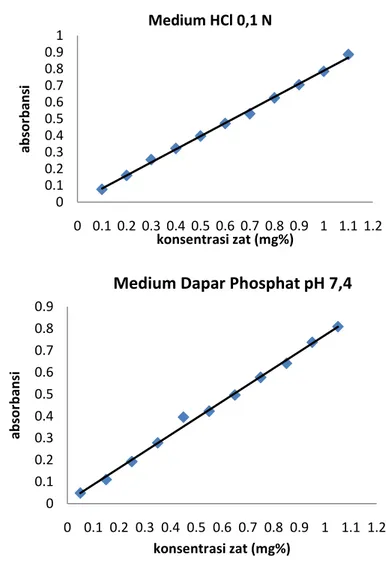
Kurva Baku Levofloksasin
Hubungan antara konsentrasi Levofloksasin dengan serapan digambarkan dalam suatu kurva dengan persamaan untuk medium HCl 0,1 N Y = 0,7844 X + 0,0038 (r = 0,9990) dan untuk medium dapar fosfat pH 7,4 Y = 0,7597 X + 0,0103 (r = 0,9980).
PHARMACY, Vol.07 No. 01 April 2010 ISSN 1693-3591
Gambar 3. Kurva Baku Levofloksasin
Nilai r penelitian ini mendekati 1 atau -1 (0,9990 dan 0,9980) maka dikatakan linier. Konsentrasi meningkat maka absorbansi meningkat.hasil penelitian ini sesuai dengan ketentuan tersebut, sehingga hasil regresi yang berupa persaman Y = a + b X dapat digunakan untuk menghitung besaran yang dicari (Mursyidi, 2005).
Keseksamaan
Hasil uji keseksamaan (presisi) menunjukkan Levofloksasin dalam medium HCl 0,1 N memiliki nilai RSD 2,09 % dan dalam medium dapar fosfat pH 7,4 memiliki nilai RSD 1,69%. Hasil uji presisi yang dapat diterima dengan baik adalah hasil uji presisi pada medium dapar fosfat pH 7,4, karena
0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 1 0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 1 1.1 1.2 absor bansi konsentrasi zat (mg%) Medium HCl 0,1 N 0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 1 1.1 1.2 absor bansi konsentrasi zat (mg%)
PHARMACY, Vol.07 No. 01 April 2010 ISSN 1693-3591
nilai RSD < 2%. Walaupun nilai RSD Levofloksasin dalam medium HCl 0,1 N lebih dari 2 %, akan tetapi hasil uji presisi tersebut masih dapat diterima karena nilai SD < 2,5%. Uji keseksamaan bersifat fleksibel tergantung pada konsentrasi analit yang diperiksa, jumlah sampel, dan kondisi laboratorium. Pada analit yang mempunyai konsentrasi kecil toleransi RSD yang dapat diterima yaitu hingga 16 % (Harmita, 2004).
Disolusi
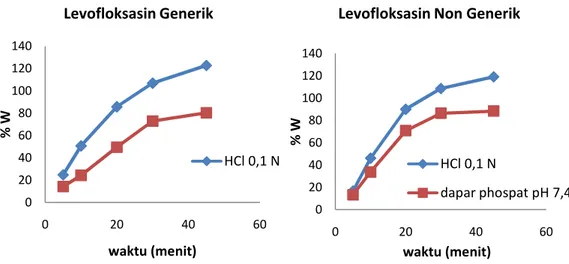
Profil disolusi yang lebih baik ditunjukkan pada profil disolusi Levofloksasin pada medium HCl 0,1 N. Levofloksasin lebih cepat melarut dalam medium HCl 0,1 N, dengan nilai kecepatan melepas dan melarutnya zat aktif dalam medium pembawanya pada waktu tertentu (% W) lebih besar dari pada dalam medium dapar fosfat pH 7,4.
Gambar 4. Perbandingan Profil Pelepasan Levofloksasin (%W) dalam Medium yang Berbeda
Tabel 1. Hasil % W pada menit ke- 45
Tablet Replikasi Medium
HCl 0,1 N (%)
Medium Dapar Fosfat pH 7,4 (%) Levofloksasin Generik I 120,335 80, 097 II 117,041 80, 409 III 130, 893 80, 333 Levofloksasin non Generik I 115, 493 91, 617 II 131, 772 81, 571 III 109, 729 91, 741 0 20 40 60 80 100 120 140 0 20 40 60 % W waktu (menit) Levofloksasin Generik HCl 0,1 N 0 20 40 60 80 100 120 140 0 20 40 60 % W waktu (menit)
Levofloksasin Non Generik
HCl 0,1 N
PHARMACY, Vol.07 No. 01 April 2010 ISSN 1693-3591
Terdapat perbedaan yang bermakna antara profil disolusi tablet Levofloksasin dalam medium HCl 0,1 N dengan medium dapar fosfat pH 7,4. Dilihat dari uji statistik (t test, dengan taraf kepercayaan 95%) dimana t hitung lebih besar dari pada t tabel (t hitung = 2,776). Tidak ada perbedaan yang bermakna antara tablet Levofloksasin generik dengan tablet Levofloksasin non generik (t hitung < t tabel).
Obat-obat yang bersifat sebagai elektrolit lemah misal asam dan basa lemah, besarnya ionisasi mempengaruhi laju pengangkutan obat. Bagian obat yang terionisasi mempunyai muatan dan menjadikannnya lebih larut dalam air dari pada bagian obat yang tak terionkan. Levofloksasin lebih larut dalam media HCl 0,1 N, disebabkan karena siafat Levofloksasin yang berupa basa lemah. Dalam medium yang asam, maka Levofloksasin mengalami ionisasi. Membentuk garam yang lebih larut dalam air. Oleh karena itu, kecepatan pelarutan dalam medium HCl 0,1 N lebih tinggi dibandingkan dengan kecepatan pelarutan Levofloksasin dalam medium dapar fosfat pH 7,4 yang tidak mengalami ionisasi membentuk garam.
Hasil uji disolusi Levofloksasin menggambarkan profil disolusi yang tidak berbeda antara tablet Levofloksasin generik dengan non generik., sehingga kedua merk tersebut secara kualitas mempunyai kesamaan dalam hal keamanan dan keefektifitasannya yang ditunjukkan melalui uji disolusi. Oleh karena itu, perbedaan harga yang terlampau jauh tidak menjamin bahwa obat tersebut memiliki efikasi yang lebih baik dari obat generik.
Jumlah obat yang larut dalam satuan waktu tertentu, dinyatakan sebagai persentasi dari kandungan yang tertera dalam label, umumnya ditentukan dalam monografi. Dua sasaran dalam mengembangkan uji disolusi in vitro yaitu untuk menunjukkan penglepasan obat dari tablet hingga dapat mendekati 100%, dan laju penglepasan obat seragam pada setiap batch dan harus sama dengan dengan laju penglepasan dari
batch yang telah dibuktikan
bioavailbilitas dan efikasinya secara klinis. Batas disolusi tablet dijelaskan pada masing-masing monografi dan alat yang digunakan juga tercantum (Lachman, 1994).
PHARMACY, Vol.07 No. 01 April 2010 ISSN 1693-3591
Uji pelarutan menjadi suatu bagian dari prosedur pengendalian kualitas baku produk obat. Syarat pelarutan obat pada masing-masing monografi berbeda tiap menit yang ditentukan (30%, 35%, 70%, 75% dan 85%), karena pengaruh dari disintegrasi obat tersebut. USP menyatakan bahwa tidak kurang dari 75% melarut dalam 45 menit. Uji disolusi menggunakan 3 replikasi, akan tetapi jika obat tersebut menunjukkan hasil yang tidak sesuai dengan keterangan pada monografi maka menggunakan 6 tablet uji. Hasil dapat diterima jika semua hasil tidak kurang dari batas yang ditentukan pada monografi ditambah 5 % (Lachman, 1994).
Levofloksasin merupakan obat baru yang belum tercantum dalam monografi farmakope, sehingga tidak ada keterangan lebih jelas tentang ketentuan waktu dan persentasi pelarunya. Oleh karena itu, pada penelitian ini mengikuti prosedur yang ditatapkan dalam USP yaitu bahwa tidak kurang dari 75% melarut dalam 45 menit. Dan agar dapat diterima dengan baik ada penambahan persentasi sebanyak 5%, sehingga hasil yang diperoleh untuk patokan profil pelepasan Levofloxacin adalah 80%.
Profil disolusi tablet Levofloxacin baik dalam media asam atau dapar, generik atau non generik menghasilkan profil disolusi lebih dari 80% pada menit ke 45.
Kesimpulan
Profil disolusi tablet Levofloksasin paling baik ditunjukkan dalam medium HCl 0,1 N. Tidak ada perbedaan hasil profil disolusi antara tablet Levofloksasin generik dengan tablet Levofloksasin non generik.
Daftar Pustaka
BPOM, 2005, Pedoman Uji
Bioekuivalensi, Badan
Pengawas Obat dan Makanan, Jakarta
Harianto, Sabarijah W., Fitri T., 2006, Perbandingan Mutu dan Harga Tablet Amoksilin 500 mg Generik dengan Non Generik yang Beredar di Pasaran,
Majalah Ilmu Kefarmasian,
Vol.III, No. 3, 127-142.
Harmita, 2004, Petunjuk Pelaksanaan Validasi Metode dan Cara Perhitungannya, Majalah Ilmu Kefarmasian Vol. I, No.3, 117 – 135.
Lachman, L., Herbert, A.L., Joseph L.K., editor, 1994, Teori dan Praktik
PHARMACY, Vol.07 No. 01 April 2010 ISSN 1693-3591
Farmasi Industri. Siti, S. , penerjemah, Terjemahan dari : The Theory and Practise of Industrial Pharmacy.UI Press Jakarta :.
Mursyidi A, Abdul R, editor., 2005,
Pengantar Kimia Farmasi
Analisis Volometri dan
Gravimetri, Pustaka
Pelajar,Yogyakarta.
Purwati N., 2005, Profil Disolusi Theofilin dari Tablet Lepas
Lambat Dengan Matriks
Methocel K4M Premium Secara Intragranular pada pH Usus [skripsi], Fakultas Farmasi, Universitas Muhammadiyah Purwokerto.
Roth HJ, Gottfried B., 1998, Analisis Farmasi, Sarjono K, Slamet I, penerjemah. Yogyakarta :
Gadjah Mada University Press, Terjemahan dari : Pharmacy Analysis.
Sultana N. et al., 2004, Levofloxacin Interaction With Essential and Trace Element. Pakistan Journal of Pharmaceutical Sciences, Vol. 17, No. 2, July 2004, pp 67-76. Sutriyo, Rosmaladewi, Febrian, H.F..
2005, Pengaruh Polivinil Pirolidon Terhadap Laju Disolusi Furosemid dalam Sistem Dispersi Padat, Majalah Ilmu Kefarmasian, Vol. II, No. 1, 30-42.
Thakkar , V.T., et al., 2009, Goodness of Fit Model Dependent Approach
for Release Kinetic of
Levofloxacin Hemihydrates
Floating Tablet,