PENETAPAN KADAR PHLOROTANNIN DALAM FRAKSI ETIL ASETAT ALGA COKLAT
(Sargassum polycystum C. Agardh) DENGAN METODE FOLIN-CIOCALTEAU
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm)
Program Studi Ilmu Farmasi
Oleh :
Dewi Riana Primawati NIM : 048114057
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
2008
PENETAPAN KADAR PHLOROTANNIN DALAM FRAKSI ETIL ASETAT ALGA COKLAT
(Sargassum polycystum C. Agardh) DENGAN METODE FOLIN-CIOCALTEAU
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm)
Program Studi Ilmu Farmasi
Oleh :
Dewi Riana Primawati NIM : 048114057
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
2008
Penelitian Untuk Skripsi
PENETAPAN KADAR PHLOROTANNIN DALAM FRAKSI ETIL ASETAT ALGA COKLAT
(Sargassum polycystum C. Agardh) DENGAN METODE FOLIN-CIOCALTEAU
Oleh :
Dewi Riana Primawati NIM : 048114057
Telah disetujui oleh :
Pembimbing
Ignatius Yulius Kristio Budiasmoro, M.Si Tanggal : 15 Juli 2008
iii
Pengesahan Skripsi Berjudul
PENETAPAN KADAR PHLOROTANNIN DALAM FRAKSI ETIL ASETAT ALGA COKLAT
(Sargassum polycystum C. Agardh) DENGAN METODE FOLIN-CIOCALTEAU
Oleh :
Dewi Riana Primawati NIM : 048114057
Dipertahankan di hadapan Panitia Penguji Skripsi Fakultas Farmasi
Universitas Sanata Dharma pada tanggal : 26 Juni 2008
Pembimbing
Ign. Yulius Kristio Budiasmoro, M.Si. Panitia Penguji :
1. Ign. Yulius Kristio Budiasmoro, M.Si.
2. Christine Patramurti, M.Si, Apt 3. Erna Tri Wulandari, M.Si, Apt
Jauh di dalam pikiranmu ada keinginan untuk mundur. Tapi itu tak mungkin tak
ada . Jadi simpan pikiranmu dalam-dalam.
(Curahee, catatan pasukan kompi Easy 056)
-Band of Brothers-
Kupersembahkan untuk Mama, Papa, adik-adikku Adit dan Ndaru
yang bisa dijadikan teman bicara Bicara hati dan pikiran Terimakasih untuk selalu menjadi ada
Almamater tercinta
v
LEMBAR PERNYATAAN PERSETUJUAN
PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS
Yang bertanda tangan di bawah ini, saya mahasiswa Universitas Sanata Dharma : Nama : Dewi Riana Primawati
Nomor Mahasiswa : 048114057
Demi pengembangan ilmu pengetahuan, saya memberikan kepada Perpustakaan Universitas Sanata Dharma karya ilmiah saya yang berjudul :
PENETAPAN KADAR PHLOROTANNIN DALAM FRAKSI ETIL ASETAT ALGA COKLAT (Sargassum polycystum C. Agardh) DENGAN METODE FOLIN-CIOCALTEAU
beserta perangkat yang diperlukan (bila ada). Dengan demikian saya memberikan kepada Perpustakaan Universitas Sanata Dharma hak untuk menyimpan, me-ngalihkan dalam bentuk media lain, mengelolanya dalam bentuk pangkalan data, mendistribusikan secara terbatas, dan mempublikasikannya di Internet atau media lain untuk kepentingan akademis tanpa perlu meminta ijin dari saya maupun memberikan royalti kepada saya selama tetap mencantumkan nama saya sebagai penulis.
Demikian pernyataan ini yang saya buat dengan sebenarnya. Dibuat di Yogyakarta
Pada tanggal : 17 Juli 2008
Yang menyatakan
KATA PENGANTAR
Puji syukur penulis panjatkan ke hadirat Tuhan YME sehingga penulis dapat menyelesaikan skripsi dengan judul “PENETAPAN KADAR
PHLOROTANNIN DALAM FRAKSI ETIL ASETAT ALGA COKLAT
(Sargassum Polycystum C. Agardh) DENGAN METODE FOLIN-CIOCALTEAU”. Skripsi ini disusun guna melengkapi salah satu syarat untuk mencapai gelar Sarjana Farmasi pada Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
Tersusunnya skripsi ini tidak luput dari bantuan dan dorongan berbagai pihak. Untuk itu penulis mengucapkan terimakasih kepada :
1. Ignatius Yulius Kristio Budiasmoro, M.Si. selaku dosen pembimbing yang telah menyediakan waktu dan tenaga untuk mengarahkan, memberikan saran dalam penyusunan skripsi ini.
2. Dra. A. Nora Iska Harnita, M.Si, Apt selaku dosen pendamping proyek yang telah menyediakan waktu dan tenaga untuk mengarahkan, memberikan saran dalam penyusunan skripsi ini.
3. Christine Patramurti, M.Si, Apt selaku dosen penguji yang telah meluangkan waktunya, memberikan saran dan kritik yang berguna pada penyusunan skripsi ini.
4. Erna Tri Wulandari, M.Si, Apt selaku dosen penguji yang telah meluangkan waktunya, memberikan saran dan kritik yang berguna pada penyusunan skripsi ini.
vi
5. Prof. Dr. Sudibyo Martono, M. S., Apt., selaku dosen yang telah memberi masukan dan saran selama penelitian dan penyusunan skripsi ini.
6. Dr. Sabikis, Apt., selaku dosen yang telah memberi masukan dan saran, selama penelitian dan penyusunan skripsi ini.
7. Lucia Wiwid Wijayanti, M.Si, selaku dosen yang telah memberi masukan dan saran selama penelitian dan penyusunan skripsi ini.
8. Mama dan Papa, adik-adikku Adit dan Ndaru yang telah memberikan dukungan moral dan materiil selama menyusun skripsi ini.
9. Teman-teman kelompok proyek alga Dipta, Henri, Fani, Andri, Angel dan Elsa yang telah berjuang bersama selama setengah tahun lebih mewujudkan proyek ini, terimakasih untuk kebersamaan yang penuh suka dan duka.
10.Para laboran : Pak Prapto, Pak Parlan, Mas Kunto, Mas Wagiran, Mas Sigit, dan Mas Otok yang telah banyak membantu dalam menjalankan penelitian. Maaf kami sering merepotkan.
11.Sahabat-sahabatku Nana, Tere, Ela dan Ika, buat semangat yang diberikan selama ini di tengah kesibukan masing-masing.
12.Teman-teman satu kelompok praktikum di kelas FST Tere, Ela, Ika, Novi, Rinta, Tika, Yoyo, dan Coco untuk pengalaman tak terlupakan.
13.Teman-teman Fakultas Farmasi angkatan 2004/2005 terutama kelas FST untuk keceriaannya di tengah sibuknya membuat laporan dan makalah. 14.Afrizal Malna untuk imajinasi gilanya, satu meter ke kiri akan membawa
saya kemana saja. Mike Mohede untuk “I Believe I Can Fly” yang sudah
menemani masa-masa mata bengkak. Disordine E Piacevolle
(Ketidakteraturan itu Menyenangkan).
15.Semua pihak yang tidak dapat penulis sebutkan satu persatu yang telah banyak membantu penyelesaian skripsi ini.
Semoga Tuhan YME memberikan perlindungan dan karunianya kepada semua pihak yang telah berjasa dalam penyusunan skripsi ini.
Penulis menyadari bahwa penelitian ini masih banyak kekurangannya. Untuk itu kritik dan saran yang membangun sangat penulis harapkan. Akhir kata semoga skripsi ini dapat memberi manfaat bagi para pembaca.
Penulis
Dewi Riana Primawati
viii
PERNYATAAN KEASLIAN KARYA
Saya menyatakan dengan sesungguhnya bahwa skripsi yang saya tulis ini tidak memuat karya atau bagian karya orang lain, kecuali yang telah disebutkan dalam kutipan dan daftar pustaka, sebagaimana layaknya karya ilmiah.
Yogyakarta, 18 Juli 2008 Penulis
Dewi Riana Primawati NIM : 048114057
DAFTAR ISI
Halaman
HALAMAN JUDUL…………..………... ii
HALAMAN PERSETUJUAN PEMBIMBING………...iii
HALAMAN PENGESAHAN………...….iv
HALAMAN PERSEMBAHAN………...………...v
KATA PENGANTAR...vi
PERNYATAAN KEASLIAN KARYA...ix
DAFTAR ISI...x
DAFTAR GAMBAR...xiv
DAFTAR TABEL...xv
DAFTAR LAMPIRAN...xvi
INTISARI...xvii
ABSTRACT ...xviii
BAB I. PENGANTAR...1
A. Latar Belakang...1
B. Perumusan Masalah...3
C. Keaslian Penelitian...4
D. Manfaat Penelitian...4
1. Manfaat teoritis...4
2. Manfaat praktis...4
E. Tujuan Penelitian...4
1.Tujuan umum...4
x
2. Tujuan khusus...5
BAB II. PENELAAHAN PUSTAKA...6
A. Uraian Alga Coklat Sargassum polycystum C. Agardh...6
1. Morfologi...6
2. Ekologi dan penyebaran...7
3. Kandungan kimia...8
B. Polifenol Alga (phlorotannin)...9
C. Soxhletasi...11
D. Ekstraksi...12
E. Spektrofotometri Visibel...13
F. Kolorimetri...16
G. Metode Folin-Ciocalteau...18
H. Kesalahan Dalam Metode Analisis...18
1.Kesalahan sistematik (determinate error)...19
2.Kesalahan tidak sistematik (intermediate error)...19
I. Keterangan Empiris...20
BAB III. METODOLOGI PENELITIAN...22
A. Jenis Rancangan Penelitian...22
B. Variabel Penelitian...22
C. Definisi Operasional...22
D. Bahan dan Alat...23
1.Bahan...23
2. Alat...24
E. Tata Cara Penelitian...24
1. Preparasi sampel alga coklat Sargassum polycystum C. Agardh...24
2. Uji kualitatif senyawa fenolik...25
a. Preparasi ekstrak...25
b. Uji tanin dan polifenol...25
3. Isolasi crude phlorotannin dari alga coklat Sargassum polycystum C. Agardh...26
4. Optimasi metode kolorimetri dengan Folin-Ciocalteau...27
a. Pembuatan larutan uji dan larutan standar...27
b. Penetapan operating time (OT)...27
c. Penentuan panjang gelombang maksimum (λ maks)...27
d.Pembuatan seri larutan baku...28
5. Estimasi kadar polifenol total pada sampel fraksi etil asetat alga coklat Sargassum polycystum C. Agardh...28
F. Analisis hasil...29
1. Analisis hasil uji kualitatif senyawa fenolik...29
2. Analisis hasil validasi metode...29
3. Analisis hasil penetapan kadar phlorotannin dalam fraksi etil asetat alga coklat Sargassum polycystum C. Agardh...30
BAB IV. PEMBAHASAN...31
A. Preparasi Sampel Alga Coklat Sargassum polycystum C. Agardh...31
B. Uji Kualitatif Senyawa Fenolik Alga Coklat Sargassum polycystum C. Agardh...35
xii
C. Isolasi Crude phlorotannin dari Alga Coklat
Sargassum polycystum C. Agardh ...37
D. Prinsip Reaksi Kolorimetri dengan Metode Folin-Ciocalteau...39
E. Optimasi Kolorimetri dengan Metode Folin-Ciocalteau...41
1. Penentuan operating time (OT)...41
2. Penentuan panjang gelombang maksimum (λ maks)...42
F. Penetapan Kurva Baku Phloroglucinol...45
G. Penetapan Kadar Fraksi Etil Asetat Sargassum polycystum C.Agardh...47
BAB V. KESIMPULAN DAN SARAN...49
A. Kesimpulan...49
B. Saran...49
C. Keterbatasan...49
DAFTAR PUSTAKA...50
LAMPIRAN...55
BIOGRAFI PENULIS...68
DAFTAR GAMBAR
Halaman
Gambar 1. Thallus Sargassum polycystum C. Agardh...8
Gambar 2. Struktur kimia beberapa polifenol alga...10
Gambar 3. Peralatan soxhlet...11
Gambar 4. Gambar tingkat energi elektronik...15
Gambar 5. Oksidasi fenol oleh Polifenol oksidase...32
Gambar 6. Reaksi pada penetapan kadar air dengan metode Karl Fisher...34
Gambar 7. Reaksi fenol dengan pereaksi FeCl3...36
Gambar 8. Kesetimbangan reaksi phloroglucinol dalam suasana basa...40
Gambar 9. Reaksi oksidasi phloroglucinol...40
Gambar 10. Reaksi phloroglucinol dengan Folin Ciocalteau...40
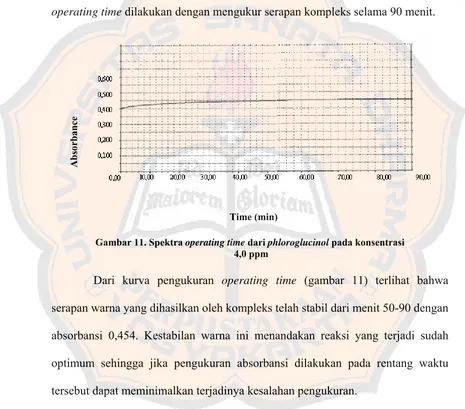
Gambar 11. Spektra operating time dari phloroglucinol pada konsentrasi 4,0 ppm...42
Gambar 12. Spektra panjang gelombang maksimum dari phloroglucinol pada tiga konsentrasi...44
Gambar 13. Kurva hubungan antara konsentrasi baku phloroglucinol dengan absorbansi ...46
xiv
DAFTAR TABEL
Halaman Tabel I. Data hubungan antara konsentrasi phloroglucinol dengan absorbansi....45 Tabel II. Kadar phlorotannin dalam sampel (mg PE/g fraksi)...48
DAFTAR LAMPIRAN
Halaman Lampiran 1. Surat keterangan hasil determinasi alga coklat dari Laboratorium
Taksonomi Tumbuhan, Fakultas Biologi, Universitas Gadjah
Mada...56
Lampiran 2. Penetapan kadar air serbuk alga Sargassum polycystum C. Agardh dengan motede Karl Fischer...58
Lampiran 3. Foto penapisan fitokimia alga Sargassum polycystum C. Agardh....60
Lampiran 4. Hasil penapisan fitokimia serbuk alga Sargassum polycystum C. Agardh...60
Lampiran 5. Foto hasil fraksinasi...61
Lampiran 6. Spektra operating time (OT)...62
Lampiran 7. Spektra scanning panjang gelombang maksimum (λ maks)...62
Lampiran 8. Hasil scanning panjang gelombang maksimum (λ maks) pada konsentrasi 1,0 ppm...63
Lampiran 9. Hasil scanning panjang gelombang maksimum (λ maks) pada konsentrasi 3,0 ppm...63
Lampiran 10. Hasil scanning panjang gelombang maksimum (λ maks) pada konsentrasi 6,0 ppm...64
Lampiran 11. Penimbangan baku phloroglucinol...64
Lampiran 12. Contoh perhitungan baku phloroglucinol...65
Lampiran 13. Hasil pembacaan baku phloroglucinol replikasi pertama pada panjang gelombang hasil scanning...66
Lampiran 14. Kurva baku phloroglucinol...66
Lampiran 15. Data penimbangan sampel...67
Lampiran 16. Absorbansi sampel...67
Lampiran 17. Contoh perhitungan kadar sampel...67
Lampiran 18. Data kadar phlorotannin pada sampel Sargassum polycystum C. Agardh...68
xvi
INTISARI
Sargassum terdistribusi di seluruh perairan Indonesia. Salah satu spesies
Sargassum yang terdapat di Indonesia adalah Sargassum polycystum C. Agardh. Tanaman alga memiliki kandungan kimia phlorotannin. Telah banyak dilakukan penelitian terhadap aktivitas phlorotannin, namun belum ditindaklanjuti dengan pemanfaatan phlorotannin sebagai senyawa aktif pada makanan, obat-obatan dan kosmetik. Pengembangan senyawa aktif pada alga coklat yang dilakukan selama ini lebih kepada kandungan utama alga coklat yaitu alginat.
Tujuan penelitian ini adalah mendapatkan crude phlorotannin dari
Sargassum polycystum C. Agardh dan menetapkan kadarnya. Isolasi dilakukan dengan metode soxhletasi dengan pelarut metanol p.a. Ekstrak yang diperoleh kemudian difraksinasi. Hasil fraksinasi adalah crude phlorotannin berupa fraksi etil asetat Sargassum polycystum C. Agardh.
Konsentrasi polifenol total dalam crude phlorotannin ditetapkan secara spektrofotometri dengan metode Folin-Ciocalteau. Larutan standar yang digunakan adalah phloroglucinol seri konsentrasi 1,0; 2,0; 3,0; 4,0; 5,0; dan 6,0 ppm dengan pelarut aseton 75%. Konsentrasi polifenol total dihitung ekuivalen dengan phloroglucinol (mg PE/g fraksi).
Hasil penetapan kadar phlorotannin pada tiga kali penetapan kadar pada tiga kali replikasi sampel adalah sebesar 6,92 mg PE/g fraksi; 7,15 mg PE/g fraksi; dan 6,81 mg PE/g fraksi diukur dengan panjang gelombang 750,1 nm dengan persamaan kurva baku y = 0,12274x+ 0,0175. Kadar phlorotannin pada alga coklat Sargassum polycystum C. Agardh adalah 6,96 ± 0,17 mg PE/g fraksi. Kata kunci : Sargassum polycystum C. Agardh , phlorotannin, Folin-Ciocalteau
ABSTRACT
Sargassum spread widely in Indonesia marine territorial. Sargassum polycystum C. Agardh is one of the species of Sargassum. Alga have chemical compound called phlorotannin. There are many experimental about phlorotannin activity, but not developed yet, especially as active compound in food, medicine, and cosmetic. Nowadays development of active compound are more for main active compound that is alginate.
This research’s objectives are to get phlorotannin crude of brown alga
Sargassum polycystum C. Agardh and determine the concentration. The isolation method are soxhletation with methanol pro analysis (p.a.). The extract was fractionated. Result from fractionated are ethyl acetate fraction of Sargassum polycystum C. Agardh
Total polyphenol concentration in phlorotannin crude was determined using spectrophotometry with Folin-Ciocalteau method. Standar solution is phloroglucinol with concentration 1.0; 2.0; 3.0; 4.0; 5.0; and 6.0 ppm in 75 % acetone. Phlorotannin concentration was equivalently calculated with phloroglucinol (mg PE/g fraction).
Phlorotannin concentration in tree replication are 6,92 mg PE/g fraction; 7,15 mg PE/g fraction; and 6,81 mg PE/g fraction, measured using 750,1 nm wavelenght and linear regression equation y = 0,12274x + 0,0175. The phlorotannin concentration in Sargassum polycystum C. Agardh is 6,96 ± 0,17 mg PE/g fraction.
Keywords : Sargassum polycystum C. Agardh, phlorotannin, Folin-Ciocalteau
xviii
1
BAB I PENGANTAR
A. Latar Belakang
Selama ini pemanfaatan alga sebagai komoditi perdagangan atau bahan
baku industri masih relatif kecil jika dibandingkan dengan keanekaragaman jenis
alga yang ada di Indonesia. Komponen kimiawi yang terdapat dalam alga sangat
bermanfaat bagi bahan baku industri makanan, kosmetik, farmasi dan lain-lain
(Putra, 2003).
Di Indonesia baru dikenal lima genus alga yang bernilai ekspor tinggi,
yaitu Gelidium, Gelidiella, Hypnea, Eucheuma, dan Gracilaria. Dua genus di
antaranya telah dibudidayakan dan berkembang di masyarakat, yaitu Eucheuma
dan Gracilaria (Yun, 2002). Alga-alga tersebut termasuk dalam genus alga
merah. Genus alga yang lain, termasuk genus alga coklat masih belum
dibudidayakan sehingga memiliki nilai ekonomis yang rendah.
Salah satu genus alga coklat yang terdapat di Indonesia adalah Sargassum.
Diperkirakan terdapat lebih dari 15 jenis Sargassum dan yang telah dikenal
mencapai 12 jenis(Kadi, 2007).
Sargassum memiliki kandungan berupa phlorotannin. Phlorotannin
merupakan polifenol yang ada pada tanaman alga terutama alga coklat, yang tidak
dimiliki oleh tanaman terestrial. Polifenol pada tanaman terestrial terdiri dari asam
elagat dan galat, sedangkan polifenol alga terdiri dari unit phloroglucinol
2
Beberapa aktivitas biologi phlorotannin yang telah diteliti di antaranya
adalah antiproliferasi dan antioksidan (Nakamura et al., 1996; Kang et al., 2005a;
Athukorala et al., 2006; Yuan & Walsh, 2006), efek protektif terhadap ionizing
radiation (Kang et al., 2006), kemampuan untuk mengabsorbsi sinar UV (Roleda
et al., 2006), sitoprotektif terhadap stress oksidatif (Kang et al., 2005b), dan
inhibitor HIV-1 reverse transcriptase dan protease (Ahn et al., 2004).
Dari penelitian yang telah dilakukan, menunjukkan bahwa phlorotannin
dapat dikembangkan menjadi senyawa aktif pada makanan, obat-obatan dan
kosmetik. Hal ini belum ditindaklanjuti. Pengembangan senyawa aktif pada alga
coklat yang dilakukan selama ini lebih kepada kandungan utama yaitu alginat
(Kadi, 2007).
Sargassum polycystum C.Agardh merupakan spesies alga coklat yang
tersebar luas di Indonesia. Telah dilakukan penelitian mengenai aktivitas
antioksidan senyawa golongan triterpenoid dari Sargassum polycystum C. Agardh
di Pulau Seribu (Anggadiredja, 1997). Namun belum dilakukan penelitian
mengenai senyawa phlorotannin dalam Sargassum polycystum C. Agardh.
Dalam upaya peningkatan pemanfaatan phlorotannin dari Sargassum
polycystum C. Agardh sebagai senyawa aktif pada makanan, obat-obatan dan
kosmetik, perlu dilakukan penetapan kadar phlorotannin pada Sargassum
polycystum C. Agardh. Hal ini dapat pula meningkatkan nilai manfaat dan
ekonomis Sargassum polycystum C. Agardh.
Pengukuran kadar phlorotannin pada penelitian ini dilakukan pada fraksi
etil asetat karena fraksi etil asetat alga coklat mengandung phlorotannin yang
meliputi phloroglucinol, phlorofucofuroeckol, dieckol, 8,8’-bieckol dan
phlorotannin golongan tetramer (Nagayama et al., 2002). Senyawa-senyawa
phlorotannin tersebut memiliki kemampuan sebagai antioksidan yang telah diuji
dengan metode freeradical scavenging activity menggunakan DPPH dan Ferric
Reducing Antioxidant Power (FRAP) assay (Kang et al., 2003). Selain itu
senyawa-senyawa tersebut memberikan serapan maksimum pada daerah UV-B
(Shibata et al., 2006).
Penelitian mengenai estimasi kandungan polifenol total pada rumput laut
dan ekstraknya telah dilakukan oleh Zhang, et al. (2006) dengan metode
sederhana berdasarkan reaksi kolorimetri Ciocalteau. Metode
Folin-Ciocalteau memiliki sensitivitas yang tinggi dalam mengukur senyawa-senyawa
yang memiliki gugus fenolik dan sederhana karena hanya membutuhkan satu
reagen yaitu reagen Folin-Ciocalteau (Singleton dan Rossi, 1965).
B. Perumusan Masalah
Rumusan permasalahan adalah sebagai berikut :
1. Apakah phlorotannin dapat diisolasi dari alga coklat Sargassum polycystum C.
Agardh?
2. Berapakah kadar phlorotannin dalam fraksi etil asetat alga coklat Sargassum
4
C. Keaslian Penelitian
Sepengetahuan peneliti, penelitian tentang penetapan kadar phlorotannin
dalam fraksi etil asetat alga coklat Sargassum polycystum C. Agardh dengan
metode Folin-Ciocalteau belum pernah dilakukan.
D. Manfaat Penelitian 1. Manfaat teoritis
Hasil penelitian ini diharapkan dapat memberikan informasi mengenai
kadar phlorotannin pada alga coklat Sargassum polycystum C. Agardh sehingga
dapat dikembangkan sebagai senyawa aktif pada makanan, obat-obatan dan
kosmetik dan meningkatkan nilai manfaat dan ekonomis Sargassum polycystum
C. Agardh.
2. Manfaat praktis
Hasil penelitian ini diharapkan dapat memberikan sumbangan bagi ilmu
pengetahuan mengenai biota laut dan pemanfaatannya, khususnya alga coklat
Sargassum polycystum C. Agardh sebagai senyawa aktif pada bahan makanan,
obat-obatan dan kosmetik.
E. Tujuan Penelitian 1. Tujuan umum
Tujuan umum penelitian ini adalah mengisolasi phlorotannin dan
mengetahui kandungannya dalam alga coklat.
2. Tujuan khusus
Tujuan khusus penelitian ini dapat diuraikan sebagai berikut :
a.Mengisolasi phlorotannin dalam Sargassum polycystum C. Agardh
menggunakan pelarut etil asetat.
b.Mengetahui kadar phlorotannin pada fraksi etil asetat Sargassum polycystum C.
BAB II
PENELAAHAN PUSTAKA
A. Uraian Alga Coklat (Sargassum polycystum C. Agardh) 1. Morfologi
Sargassum polycystum C. Agardh memiliki sinonim Sargassum brevifolium Greville, Sargassum pygmaeum Kützing, Sargassum ambiguum
Sonder,dan Sargassum polycystum var. horridulum Grunow (Guiry, 2006).
Sargassum polycystum C. Agardh memiliki thalli dengan panjang 3-5 cm, berwarna coklat kekuningan dan ditumbuhi holdfast. Poros utama berbentuk silinder dengan permukaan kasar karena adanya beberapa pertumbuhan ke luar. Poros utama mendukung daun-daun cabang dan gelembung udara.
Thalli muda memiliki daun dengan panjang termasuk tangkai adalah 13-42 mm dan lebar 2,5-11,5 mm. Secara umum daun berbentuk lonjong sedikit runcing, dengan tepi bergigi tajam, seperti tampak dalam gambar 1.
Thalli dewasa memiliki daun dengan jumlah lebih sedikit dan ukurannya lebih kecil. Panjang daun termasuk tangkai adalah 7-15 mm dan lebar 1,7-4 mm.
Sargassum polycystum C. Agardh memiliki kantung udara (bladder) berbentuk bola atau seperti telur dengan garis tengah 1,5 -3 mm. Cryptostomata
tersebar merata di permukaan gelembung. Kantung udara dapat tunggal atau dalam jumlah banyak yang dihubungkan dengan cabang primer atau sekunder. Pada thalli dewasa gelembung lebih banyak tetapi lebih kecil (Anonim, 2002).
6
2. Ekologi dan penyebaran
Lingkungan tempat tumbuh Sargassum terutama di daerah perairan laut yang jernih yang memiliki substrat dasar batu karang, karang mati, batuan vulkanik, dan benda-benda yang bersifat massive yang berada di dasar perairan.
Sargassum hidup di perairan dengan kedalaman 0,5 – 10 m. Sargassum tumbuh subur pada daerah tropis dengan suhu perairan 27,25 – 29,300C dan salinitas 32-33,5%. Kebutuhan intensitas cahaya matahari Sargassum berkisar 6500 – 7500 lux. Sargassum tumbuh berumpun dengan untaian cabang-cabang (Kadi, 2007).
Sargassum polycystum C. Agardh banyak ditemukan pada daerah pantai
(beach/tide pool area), paparan terumbu (reef flats), punggung terumbu (ridge), dan Goba (lagoon)(Kadi, 2007).
Sargasum polycystum C. Agardh merupakan alga yang kosmopolitan di daerah tropis hingga subtropis. Alga tersebut bukan merupakan alga endemik perairan Indonesia, tetapi banyak ditemukan di perairan nusantara terutama di Kepulauan Timur Indonesia (Anonim, 2002).
Alga ini dapat ditemukan di daerah Kepulauan Anambas, Kepulauan Bangka-Belitung, Kepulauan Natuna, Selat Sunda, Teluk Lampung, Kepulauan Seribu, Kepulauan Karimunjawa, Pantai Selatan Pulau Jawa, Pantai Bali, Pantai Lombok, Pantai-pantai Sumbawa, Pantai Sumba, Kupang, Kalimantan Timur, Kepulauan Selayar, Kepulauan Spermonde, Sulawesi Utara, Pulau Ternate dan Bacan, dan Ambon (Kadi,2007).
8
fragmentasi yaitu perkembangan dari potongan thallus. Cara ini banyak dilakukan untuk usaha budidaya. Reproduksi seksual dilakukan dengan perkembangan individu melalui organ jantan (antheridia) dan organ betina (oogenia) (Kadi,2007).
3. Kandungan kimia
Kandungan bahan kimia utama Sargassum adalah sebagai sumber alginat dan mengandung protein, vitamin C, tanin, iodin, dan fenol (Trono dan Ganzon, 1988).
Kandungan protein pada Sargassum polycystum C. Agardh (6,26%) lebih tinggi dibandingkan Sargassum cristaefolium (3,45%) (Ungson, 2003).
Telah diteliti kandungan kimia ekstrak Sargassum polycystum C. Agardh, yang menunjukkan aktivitas biologi pada uji hayati pendahuluan menggunakan Artemia salina Leach. Penapisan fitokimia menunjukkan adanya golongan steroid atau triterpenoid (Lestari,1997).
Gambar 1. Thallus Sargassum polycystum C. Agardh, A.)papila, B.) thallus berupa daun, C.) kantung udara (bladder), D.) thallus berupa tangkai
B. Polifenol Alga (Phlorotannin)
Alga coklat (Phaeophyceae) mengandung tanin yang dapat melindungi alga dari herbivora. Tanin ini terdiri dari phloroglucinol yang berikatan bersama untuk membentuk seri polyphloroglucinol yang disebut juga phlorotannin (McInnes, Ragan, dan Walter, 1984). Phlorotannin merupakan tanin tipe ketiga yang berbeda dari tanin terhidrolisis dan tanin terkondensasi (Hernes, 2001).
Phlorotannin berbeda dari polifenol pada tanaman terestrial. Polifenol pada tanaman terestrial terdiri dari asam elagat dan galat, sedangkan polifenol alga terdiri dari unit phloroglucinol (1,3,5-trihydroxybenzene) (gambar 2).
Phlorotannin terdiri dari berbagai macam molekul dengan struktur dan derajat polimerisasi yang berbeda, sehingga memiliki potensi aktivitas biologik yang berbeda pula (Burtin, 2003).
Phlorotannin merupakan hasil polimerisasi dari phloroglucinol dan merupakan produk dari jalur asetat-malonat (Waterman dan Mole, 1994). Senyawa ini memiliki bobot molekul yang rendah (102-103 amu), sedang (103-104 amu) dan tinggi (≥ 104 amu) (McInnes, Ragan, dan Walter, 1984).
Phlorotannin dengan bobot molekul yang rendah terdiri dari
phloroglucinol, dimer dari phloroglucinol yang berikatan karbon-karbon secara langsung (2,2’,4,4’6,6’-hexahydroxybiphenyl) atau dengan ikatan eter
(2,3’,4,5’,6-pentahydroxybiphenyl ether), trimer,dan tetramer (Ragan ,1984).
10
Menurut Ragan dan Craigie (cit., Burtin, 2003) kandungan tertinggi terdapat pada alga coklat, dimana phlorotannin berkisar antara 5-15 % dari berat kering.
Phlorotannin telah diisolasi dari beberapa spesies dalam beberapa genus alga coklat yaitu Eisenia, Fucus, Crystophora, Chordas Cystoseria, Laminaria, Bifurcaria yang terdiri dari unit phloroglucinol C-C dan atau C-O yang berpasangan secara oksidatif (Glombitza dan Gestberger, 1985). Salah satu
phlorotannin adalah fucofuroeckol dari Eisenia arbarea(gambar 3) (Glombitza dan Gestberger, 1985).
HO
Gambar 2. Struktur kimia beberapa polifenol alga : (A) Phloroglucinol, (B)
2,2’,4,4’6,6’-hexahydroxybiphenyl, (C) 2,3’,4,5’,6-pentahydroxybiphenyl ether,(D) Fucofuroeckol (E)Phlorofucofuroeckol-A, (F) 8,8’-bieckol
Aktivitas antioksidan polifenol pada alga coklat dan alga merah telah diperlihatkan pada percobaan in vitro (Nakamura et al., 1996). Namun peran
phlorotannin dalam mencegah penyakit yang berhubungan dengan oxidative stress masih sedikit diketahui (Burtin, 2003).
C. Soxhletasi
Soxhletasi adalah suatu prosedur untuk memperoleh kandungan senyawa organik dari jaringan tumbuhan kering seperti biji kering, akar dan daun. Soxhletasi dilakukan dengan mengekstraksi serbuk bahan secara terus menerus dengan alat soxhlet menggunakan pelarut secara bergantian (Harborne, 1987). Peralatan sohxlet tertera pada gambar 3.
Gambar 3. Peralatan Soxhlet, A.) tempat meletakkan kantong saring, B.) labu alas bulat, C.) pipa naiknya uap, D.) pendingin
Sampel diekstraksi menggunakan larutan yang cocok. Adanya pemanasan menyebabkan pelarut menguap dan akan diembunkan oleh pendingin menjadi tetesan. Tetesan-tetesan akan terkumpul dan apabila sudah melewati batas lubang maka akan terjadi sirkulasi. Sirkulasi terjadi berulang-ulang sehingga menghasilkan penyarian yang lebih baik (Anonim, 1986).
12
banyak dan penyarian dapat diteruskan sesuai kebutuhan tanpa perlu menambah volume cairan penyari. Kerugian cara penyarian dengan alat soxhlet yaitu larutan ekstrak dipanaskan secara terus menerus sehingga zat aktif yang tidak tahan pemanasan kurang cocok (Anonim, 1986).
D. Ekstraksi
Ekstraksi merupakan suatu metode pemisahan komponen dari suatu campuran dengan menggunakan suatu pelarut (Anwar, 1994).
Dasar ekstraksi mengacu pada hukum Nernst yaitu apabila suatu zat terlarut dilarutkan ke dalam pelarut yang tidak saling campur maka zat tersebut akan terdistribusi ke dalam kedua pelarut tersebut (Khopkar, 1990).
KD =
[ ]
[ ]
2 1X X
[X1] adalah konsentrasi zat terlarut dalam fase pertama (fase organik) dan
[X2] adalah konsentrasi pada fase kedua (fase air). KD adalah koefisien partisi
atau distribusi pada saat kesetimbangan tercapai. Semakin besar konsentrasi zat terlarut dalam pelarut organik maka nilai KD akan meningkat.
Metode yang digunakan pada ekstraksi cair-cair adalah : 1. Ekstraksi bertahap (batch)
Metode ini dilakukan dengan mengocok larutan air atau suspensi dengan pelarut organik yang tidak saling campur dengan air kemudian didiamkan sehingga terbentuk dua lapisan dan selanjutnya dipisahkan (Anwar, 1994).
2. Ekstraksi kontinyu
Metode ini digunakan jika perbandingan distribusi relatif kecil sehingga untuk pemisahan yang kuantitatif diperlukan beberapa tahap ekstraksi. Efisiensi pada ekstraksi ini tergantung pada viskositas fase organik (Khopkar, 1990).
3. Ekstraksi kontinyu counter current
Metode ini dilakukan dengan mengalirkan fase cair pengekstraksi pada arah yang berlawanan dengan larutan yang mengandung zat yang diekstraksi. Metode ini biasanya digunakan untuk pemisahan zat, isolasi atau pemurnian (Anwar, 1994).
E. Spektrofrotometri Visibel
Spektofotometri UV-Visibel adalah salah satu teknik analisis fisika-kimia yang mengamati interaksi atom atau molekul dengan radiasi elektromagnetik pada panjang gelombang 190-380 nm (UV) dan 380-780 nm (visibel) dengan menggunakan instrumen spektrofotometer (Mulja dan Suharman, 1995).
Pada umumnya semua molekul dapat menyerap radiasi elektromagnetik di daerah UV dan visibel karena memiliki elektron, baik berkelompok maupun tunggal yang dapat tereksitasi ke tingkat energi yang lebih tinggi. Panjang gelombang yang menunjukkan terjadinya serapan tergantung pada kekuatan ikatan elektron dalam molekul tersebut (Day dan Underwood, 1986).
14
(Mulja dan Suharman, 1995) Bila c dinyatakan dalam mol per liter, dan panjang alur (b) dinyatakan dalam sentimeter, persamaan menjadi :
A = ε .c.b (3)
Istilah ε diketahui sebagai daya serap molar, disebut juga koefisien ekstingsi molar.
(Silverstein, Bassler dan Murril, 1986) Radiasi pada senyawa organik dapat menimbulkan eksitasi dari satu orbital ke orbital yang lain. Biasanya terjadi dari orbital elektron berpasangan atau orbital ikatan menuju orbital elektron tidak berpasangan. Probabilitas transisi dinyatakan sebagai berikut :
ε = 0,87 x 1020 P.a (4)
Probabilitas transisi (P) memiliki nilai dari 0 sampai 1. a merupakan daerah sasaran pada sistem absorbsi. Sistem absorbsi disebut juga kromofor.
Pada panjang kromofor pada umumnya yaitu 10 Å, nilai ε akan menjadi 105. Dengan probabilitas transisi yang tinggi maka nilai ε akan lebih besar daripada 10.000, sedangkan dengan probabilitas transisi yang rendah nilai ε akan
lebih kecil daripada 1.000. Secara umum, semakin panjang kromofor, maka semakin besar absorpsinya (Williams dan Fleming, 1980).
Molekul yang mengabsorbsi dapat melakukan transisi yang meliputi elektron π,σ, n, elektron-elektron d dan f , dan spektrum muatan elektron.
1. Elektron π,σ, n
Jenis transisi ini terjadi pada molekul-molekul organik dan sebagian kecil anion anorganik. Molekul tersebut mengabsorpsi radiasi elektromagnetik karena adanya elektron valensi, yang akan tereksitasi ke tingkat yang lebih tinggi (Khopkar, 1990).
Gambar 4. Gambar tingkat energi elektronik (Mulja dan Suharman, 1995)
2. Elektron-elektron d dan f
Unsur-unsur blok d mengabsorpsi pada daerah UV dan tampak. Terjadinya transisi logam golongan f disebabkan karena elektron-elektron pada orbital f (Khopkar, 1990).
3.Spektrum muatan elektron
16
menghasilkan absorpsi radiasi (Khopkar, 1990). Kompleks charge transfer terdiri dari gugus elektron donor yang berikatan dengan elektron aseptor. Ketika mengabsorpsi radiasi, elektron dari donor berpindah ke orbital aseptor (Skoog et al., 1993).
Absorbsi radiasi visibel oleh kompleks logam disebabkan satu atau lebih transisi yaitu eksitasi logam, eksitasi ligan, atau transisi charge transfer
(Christian, 2004). Pada kompleks ion logam dan ligan terjadi transisi orbital elektron d dari ion logam ke orbital π* dari ligan atau dari orbital elektron π ligan ke orbital d dari ion logam (Ohannesian dan Streeter, 2002).
F. Kolorimetri
Kolorimetri adalah teknik pengukuran cahaya yang diabsorbsi oleh zat berwarna baik warna yang terbentuk dari asalnya maupun akibat reaksi dengan zat lain (Khopkar, 1990).
Metode kolorimetri merupakan salah satu metode analisis yang didasarkan pada gugus yang dapat bereaksi membentuk warna kompleks serta memiliki rantai panjang. Pengukuran intensitas warna dilakukan menggunakan instrumen spektrofotometer visibel. Metode ini melibatkan perbandingan intensitas warna secara visual yaitu warna larutan senyawa yang diteliti dibandingkan dengan warna suatu standar atau seri standar (Butz dan Nobel, 1961).
Menurut definisi yang diperluas, sebagai kolorimetri juga tercakup pengubahan senyawa tidak berwarna menjadi zat yang berwarna dan penentuan
fotometrinya dilakukan dalam daerah sinar tampak (400-800 nm) (Roth dan Baschke, 1994).
Kriteria untuk analisis kolorimetri yang baik adalah : 1. Menghasilkan reaksi warna yang khusus
Reaksi-reaksi yang ada sangat sedikit sekali untuk beberapa substansi tertentu, tetapi justru memberikan warna.–warna yang banyak membentuk kelompok warna tersendiri yang berhubungan dengan substansi khusus.
2. Adanya proporsi yang sesuai antara warna dan konsentrasi
Untuk kolorimeter visual sangat penting bahwa intensitas warna harus meningkat secara liniear dengan konsentrasi dari substansi yang ditentukan.
3. Stabilitas warna
Warna yang dihasilkan pada setiap reaksi harus sama untuk mendapatkan hasil yang akurat. Hal ini menerapkan reaksi-reaksi dari warna yang akan dicapai secara maksimal. Waktu untuk mencapai warna yang maksimal harus cukup lama untuk mendapatkan pengukuran yang akurat.
4. Reprodusibel
Prosedur kolorimetri harus memberikan hasil yang reprodusibel dalam kondisis yang spesifik.
5. Kejernihan larutan
18
G. Metode Folin-Ciocalteau
Metode Folin-Ciocalteau merupakan oksidasi atau reduksi kolorimetrik untuk mengukur semua senyawa fenolik (Folin, 1944).
Menurut Waterman dan Mole (cit., Khadambi, 2007), dasar metode Folin-Ciocalteau adalah oksidasi gugus fenolik-hidroksil. Selama reaksi berjalan, gugus fenolik-hidroksil bereaksi dengan pereaksi Folin-Ciocalteau, membentuk kompleks fosfotungstat-fosfomolibdat berwarna biru dengan suatu struktur yang belum diketahui dan menghasilkan warna biru ungu yang dapat diukur absorbansinya dengan spektrofotometer (Jansoon, 2005). Reaksi Folin Ciocalteau melibatkan reaksi antara ion fenolat dengan kompleks ion polimerik dari asam-asam fosfomolibdat dan fosfotungstat (Anonim, 2006).
Keseluruhan reaksi yang terjadi pada reaksi Folin-Ciocalteau adalah rusaknya pereaksi dalam keadaan basa, ionisasi fenol dalam keadaan basa, proses reduksi pereaksi oleh fenolat untuk menghasilkan kompleks warna biru, dan rusaknya kompleks warna biru tersebut (Singleton dan Rossi, 1965). Fenolat hanya ada pada larutan basa tetapi reagen Folin-Ciocalteau dan produk kompleks warna biru tidak stabil pada kondisi basa (Jansoon, 2005).
H. Kesalahan Dalam Metode Analisis
Kesalahan dalam metode analisis sangat sukar untuk dihilangkan namun sumber kesalahan tetap harus ditekan seminimal mungkin.
1. Kesalahan sistematik (determinate errors)
Kesalahan sistematik adalah hasil analisis yang menyimpang secara tetap dari harga kadar yang sebenarnya karena proses pelaksanaan prosedur analisis, sehingga kesalahan ini disebut juga kesalahan prosedur (Mulja dan Suharman, 1995). Kesalahan sistematik dapat disebabkan oleh beberapa faktor, antara lain: a. Kesalahan personil dan operasi. Kesalahan ini disebabkan oleh cara pelaksanaan analisis, bukan karena metode. Kesalahan operasi umumnya bersifat fisis (bukan khemis), misalnya kesalahan pengamatan visual pada titik akhir titrasi, kekeliruan cara pencucian endapan, dan sebagainya. Jadi kesalahan ini bersifat individual dan sangat dipengaruhi oleh keterampilan analis dalam melakukan pekerjaan analisis.
b. Kesalahan alat dan pereaksi . Kesalahan ini disebabkan oleh pereaksi yang kurang murni, alat yang kurang valid atau pemakaian alat yang kurang tepat walaupun alatnya sendiri baik, contohnya pengambilan volume tepat dengan pipet ukur atau gelas ukur, penggunaan buret 50 mL (buret makro) untuk analisis mikro, dan sebagainya.
c. Kesalahan metode. Kesalahan ini dapat disebabkan oleh kesalahan pengambilan sampel, kesalahan akibat reaksi kimia yang tidak sempurna, atau ikut mengendapnya zat-zat yang tidak diinginkan (Day dan Underwood, 1986).
Kesalahan sistematik dapat dihindari atau diperkecil dengan:
1). Mengkalibrasi instrumen dan melakukan koreksi secara berkala (biasanya tiap 3 bulan atau disesuaikan dengan frekuensi pemakaian alat).
20
3). Memakai bahan kimia dengan derajat untuk analisis. 4). Meningkatkan pengetahuan dan keterampilan para analis. 5). Melakukan penetapan blangko atau kontrol dengan zat baku. 6). Melakukan penetapan paralel (in duplo atau in triplo). 2. Kesalahan tidak sistematik (indeterminate errors)
Kesalahan tidak sistematik adalah penyimpangan yang tidak tetap dari hasil penentuan kadar dengan instrumen yang disebabkan fluktuasi dari instrumen yang dipakai (derau). Penyebab kesalahan ini tidak dapat ditentukan dan tidak dapat dikontrol maka kesalahan ini disebut juga kesalahan acak (random error) (Mulja dan Suharman, 1995).
I. Keterangan Empiris
Kadar phlorotannin di dalam alga coklat berkisar 5-15 % berat kering (Burtin, 2003). Penapisan fitokimia pada alga coklat dilakukan dengan menggunakan pereaksi FeCl3 dan garam gelatin. Apabila reaksi tersebut
menghasilkan endapan maka sampel alga coklat mengandung senyawa fenolik. Penyarian dengan menggunakan cara maserasi kurang sempurna dan membutuhkan waktu yang lama. Penyarian dengan menggunakan cara soxhletasi memiliki keuntungan yaitu tidak membutuhkan waktu yang terlalu lama dan pelarut yang dibutuhkan tidak terlalu banyak karena ekstraksi terjadi secara berulang dan menggunakan panas. Sirkulasi terjadi berulang-ulang sehingga menghasilkan penyarian yang lebih baik (Anonim, 1986).
Simplisia makro alga dalam bentuk serbuk dapat disari menggunakan pelarut tertentu dengan alat soxhlet (Cannel, 1998). Penyarian dalam penelitian ini menggunakan cara sohxletasi.
Telah dilakukan perbandingan antara hasil penyarian dengan pelarut etanol dan metanol. Penyarian menggunakan pelarut metanol menghasilkan jumlah ekstrak yang lebih banyak.
Polifenol yang dianalisis dalam penelitian ini adalah phlorotannin dalam fraksi etil asetat yang meliputi phloroglucinol, phlorofucofuroeckol, dieckol, 8,8’-bieckol, dan phlorotannin golongan tetramer.
Metode yang digunakan untuk menetapkan kadar phlorotannin pada penelitian ini adalah metode Folin-Ciocalteau. Metode ini dipilih karena metode ini spesifik untuk menetapkan kadar polifenol. Gugus fenolik-hidroksil bereaksi dengan pereaksi Folin-Ciocalteau, membentuk kompleks fosfotungstat-fosfomolibdat menghasilkan warna biru ungu yang dapat diukur absorbansinya dengan spektrofotometer (Jansoon, 2005).
Standar yang digunakan dalam penelitian ini adalah phloroglucinol.
BAB III
METODOLOGI PENELITIAN
A. Jenis Rancangan Penelitian
Penelitian ini termasuk dalam penelitian non-eksperimental karena tidak
ada intervensi atau perlakuan terhadap parameter yang diamati.
B. Variabel Penelitian
1. Variabel dalam penelitian ini adalah kadar phlorotannin dalam fraksi etil
asetat alga coklat Sargassum polycystum C. Agardh.
2. Variabel pengacau terkendali dalam penelitian ini adalah waktu pemanenan
alga, tempat pengambilan alga, suhu penyimpanan alga, waktu lamanya proses
ekstraksi, dan pH.
3. Variabel pengacau tidak terkendali dalam penelitian ini adalah umur alga
(bukan tanaman budidaya), bagian alga yang terpanen, suhu air laut, kondisi
substrat karang tempat tumbuh alga, suhu dan kelembaban ruang percobaan.
C. Definisi Operasional
1. Alga coklat adalah simplisia alga coklat Sargassum polycystum C. Agardh
yang diambil dari Pantai Drini, Gunung Kidul, Yogyakarta dengan ciri-ciri
memiliki thalli dengan panjang 3-5 cm, berwarna coklat kekuningan,
ditumbuhi holdfast, poros utama berbentuk silinder dengan permukaan kasar,
dan daun berbentuk lonjong sedikit runcing dengan tepi bergigi tajam.
22
2. Phlorotannin adalah polifenol alga dalam fraksi etil asetat yang terdiri dari
beberapa molekul dengan gugus yang heterogen, meliputi phloroglucinol,
phlorofucofuroeckol, dieckol, 8,8’-bieckol, dan phlorotannin golongan
tetramer.
3. Ekstrak kental adalah ekstrak metanol hasil soxhletasi serbuk alga coklat pada
suhu 120±200, kemudian dipekatkan pelarutnya dengan vacuum rotary
evaporatorsampai kurang lebih 1/10 dari volume mula-mula.
4. Fraksi Etil Asetat Alga Coklat adalah fraksi yang diperoleh dari fraksinasi
ekstrak metanol simplisia alga coklat hasil soxhletasi dan diuapkan pelarutnya
dengan vacuum rotary evaporator sampai pekat kemudian dipanaskan di atas
waterbath hingga kering.
5. Parameter validasi metode analisis yang digunakan dalam penelitian ini adalah
akurasi, presisi, dan linearitas.
6. Kadar phlorotannin adalah kadar polifenol dalam alga coklat yang dihitung
ekivalen terhadap phloroglucinol (mg PE/g fraksi).
D. Bahan dan Alat
1. Bahan
Bahan yang digunakan adalah alga coklat Sargassum polycystum C.
Agardh yang diambil dari pantai Drini, Gunung Kidul, Yogyakarta, Metanol,
kloroform, etil asetat, aseton, natrium bikarbonat, phloroglucinol (p.a., E. Merck,
24
2. Alat
Alat-alat yang digunakan meliputi autoklaf Sanshenyiliaogixie YX-400Z,
oven Memmert ULM 500, UM 400, dan U 50, oven Termaks seri 88725, blender
Retsch bv, alat titrasi Karl Fischer Mettler DL-18, seperangkat spektrofotometer
UV-Vis Perkin Elmer Lambda 20, timbangan elektrik BP 160 dan Scaltec SBC 22
readability 0, 01 mg, corong Buchner, vacum rotary evaporator (Buchi),
waterbath (Abo-Tech), mikropipet 0, 5 – 10 μl dan 100 – 1000 μl (Acura 825,
Socorex), tabung reaksi bertutup (Scott-Germany), soxhlet, labu alas bulat,
heating mantle, corong pisah 500 mL, alat sentrifus, homogenizer, dan alat-alat
gelas.
E. Tata Cara Penelitian
1. Preparasi sampel alga coklat Sargassum polycystum C. Agardh
Alga coklat Sargassum polycystum C. Agardh dikumpulkan, dicuci
dengan air mengalir dan menggunakan tangan untuk menghilangkan sedimen dan
epifit yang menempel, kemudian dipanaskan dengan autoklaf pada suhu 1200 C
selama 30 menit untuk menginaktifkan enzim polifenol oksidase. Selanjutnya
dikeringkan dengan oven pada suhu 90°C dan diserbuk dengan derajat halus
20/30. Penetapan kadar air serbuk alga dilakukan dengan menggunakan metode
Karl Fischer. Serbuk alga coklat Sargassum polycystum C. Agardh ditimbang
sebanyak 2 g, kemudian tambahkan 10 mL metanol, lalu didiamkan selama 1 hari
pada suhu kamar. Dilakukan pre-titrasi pada alat, lalu dilakukan uji kebocoran
alat, hingga didapat angka drift 10-50 pada alat. Standardisasi dilakukan dengan
cara spuit berisi air ditimbang, kemudian 1 tetes air dimasukkan ke dalam alat.
Kemudian ditimbang kembali untuk menentukan berat air yang dimasukkan dan
kesetaraan air dihitung. Dimasukkan 1 mL metanol dan dititrasi dengan alat
(blanko). Kadar air dihitung. Dimasukkan 1 mL sampel, titrasi dengan alat, kadar
air dalam sampel dihitung. Kadar air dalam sampel dihitung dengan menggunakan
rumus:
Kadar air = − (10) ×100%
ditimbang yang
berat
blanko x
x = angka yang muncul pada alat (%) dikali 10.000 mg atau berat yang
dimaksudkan untuk konversi.
2. Uji kualitatif senyawa fenolik
a. Preparasi ekstrak
Tiga puluh mL metanol 80% ditambahkan pada 10 g serbuk alga dengan
derajad halus 20/30. Lalu diletakkan ke dalam wadah dan dipanaskan pada
waterbath selama ± 1 jam. Kemudian didinginkan pada suhu ruang dan disaring
menggunakan corong Buchner yang sesuai dengan dilapisi kertas saring.
Ditambahkan 5 mL metanol 80% dan disaring kembali (Fong, 1992).
b. Uji tanin dan polifenol
Sejumlah volume yang setara dengan 10 g ekstrak metanol 80% yang
telah disiapkan sebelumnya pada langkah preparasi ekstrak, diuapkan
menggunakan waterbath. Ditambahkan 25 mL akuadest panas dan dicampur
secara merata. Dibiarkan hingga dingin pada suhu kamar. Ditambahkan 3-4 tetes
26
Filtrat dibagi ke dalam 4 tabung masing-masing 3 mL. Pada tabung I ditambahkan
4-5 tetes larutan gelatin 1%. Pada tabung II ditambahkan 4-5 tetes pereaksi garam
gelatin (gelatin 1% dan NaCl 10 %). Pada tabung III ditambahkan 3-4 tetes ferri
klorida. Tabung IV dijadikan kontrol dan tidak ditambahkan pereaksi apapun.
Diamati warna yang terbentuk pada setiap tabung (Fong, 1992).
3. Isolasi crude phlorotannin dari alga coklat Sargassum polycystum C.
Agardh
Serbuk alga ditimbang sebanyak 80 g, sesuai dengan kapasitas sohxlet,
kemudian dimasukkan ke dalam kertas filter Schleicher dan Schuell. Setelah itu
dimasukkan ke dalam labu soxhlet. Kemudian pelarut metanol diberikan sebanyak
2 kali sirkulasi. Soxhletasi dilakukan dengan suhu 120±200C kurang lebih selama
30 jam.
Ekstrak metanol yang diperoleh kemudian dipekatkan sampai 1/10 dari
volume mula-mula. Selanjutnya ditambahkan metanol hingga 120 mL, lalu
ditambahkan 120 mL kloroform, dan 45 mL air dalam corong pisah 500 mL.
Kemudian digojog dan didiamkan hingga terbentuk dua lapisan. Pisahkan antara
lapisan atas dan lapisan bawah. Selanjutnya lapisan atas diekstraksi dengan etil
asetat sebanyak dua kali, masing-masing 75 mL pada setiap kali penambahan.
Kumpulkan fraksi etil asetat (bagian atas), selanjutnya diuapkan sehingga
diperoleh ekstrak yang merupakan crude phlorotannin.
4. Optimasi metode kolorimetri dengan Folin-Ciocalteau
a. Pembuatan larutan standar dan larutan sampel
Pembuatan larutan standar phloroglucinol. Standar phloroglucinol
ditimbang seksama lebih kurang 0,05 g, kemudian dilarutkan ke dalam aseton
75% sampai volume 50,0 mL. Seri konsentrasi larutan intermediet dipipet dari
larutan induk sebanyak 0,5; 1,0; 2,0; 3,0; 4,0; 5,0; dan 6,0 mL. Dimasukkan ke
dalam labu ukur 10,0 mL dan dilarutkan ke dalam aseton 75% untuk konsentrasi
0,5; 1,0; 2,0; 3,0; 4,0; 5,0; dan 6,0 ppm.
Pembuatan larutan sampel. Ditimbang 0,05 g fraksi etil asetat alga
coklat, kemudian dilarutkan ke dalam aseton 75% hingga volumenya 50,0 mL.
b. Penetapan operating time (OT)
Larutan intermediet dengan konsentrasi 4,0 ppm dipipet sebanyak 0,5
mL dan dimasukkan ke dalam labu takar 50,0 mL yang berisi 2,5 mL pereaksi
fenol Folin-Ciocalteau yang telah diencerkan dengan akuadest (1:1). Didiamkan
selama 2 menit. Ditambahkan 7,5 mL Na2CO3 1,9 M, dicampurkan sampai
volume 50,0 mL dengan akuadest. Operating time diukur pada spektrofotometer
visibel. Pengukuran dilakukan pada panjang gelombang teoritis (750 nm).
c. Penentuan panjang gelombang maksimum (λ maks)
Larutan intermediet dengan konsentrasi 1,0; 3,0; dan 6,0 ppm
masing-masing dipipet sebanyak 0,5 mL ke dalam labu takar 50,0 mL yang berisi 2,5 mL
pereaksi fenol Folin-Ciocalteau yang telah diencerkan dengan akuadest (1:1).
Didiamkan selama 2 menit. Ditambahkan 7,5 mL Na2CO3 1,9 M, dilarutkan
28
menit, selama 30 detik, sebanyak 2 kali vortex. Kemudian disentrifus dengan
kecepatan 4000 rpm selama 5 menit dan diambil bagian supernatannya. Setelah
itu ketiga larutan tersebut discan menggunakan spektrofotometer visibel untuk
melihat panjang gelombang maksimumnya.
d. Pembuatan seri larutan baku
Masing-masing larutan intermediet dipipet sebanyak 0,5 mL dan
dimasukkan ke dalam labu takar 50,0 mL yang mengandung 2,5 mL pereaksi
fenol Folin-Ciocalteau yang telah diencerkan dengan akuadest (1:1). Didiamkan
selama 2 menit. Selanjutnya ditambahkan 7,5 mL Na2CO3 1,9 M dan dilarutkan
dengan akuadest sampai volume 50,0 mL. Campuran tersebut divortex setiap 15
menit, selama 30 detik, sebanyak 2 kali vortex. Kemudian disentrifus dengan
kecepatan 4000 rpm selama 5 menit dan diambil bagian supernatannya.
Absorbansi diukur pada panjang gelombang hasil scanning dengan menggunakan
spektrofotometer visibel. Dihitung persamaan kurva baku yang diperoleh.
5. Estimasi kadar polifenol total pada sampel fraksi etil asetat alga coklat
Sargassum polycystum C. Agardh
Fraksi etil asetat alga coklat Sargassum polycystum C. Agardh ditimbang
lebih kurang 0,05 g dengan seksama, kemudian dilarutkan dalam aseton 75%S
sampai volumenya 50,0 ml. Sepuluh mL larutan sampel dipipet dan dimasukkan
ke dalam labu ukur 50,0 mL yang mengandung 2,5 mL pereaksi fenol
Folin-Ciocalteau yang telah diencerkan dengan akuadest (1:1). Didiamkan selama 2
menit. Selanjutnya ditambahkan 7,5 mL Na2CO3 1,9 M dan dilarutkan dengan
akuadest sampai volume 50,0 mL. Campuran tersebut divortex setiap 15 menit,
selama 30 detik, sebanyak 2 kali vortex. Kemudian disentrifus dengan kecepatan
4000 rpm selama 5 menit dan diambil bagian supernatannya. Diukur
absorbansinya pada panjang gelombang hasil scanning larutan baku dengan
menggunakan spektrofotometer visibel. Konsentrasi polifenol total dihitung
ekivalen dengan phloroglucinol (mg PE/g fraksi).
F. Analisis hasil
1. Analisis hasil uji kualitatif senyawa fenolik
Apabila terbentuk warna hijau kebiruan atau hitam kehijauan setelah
penambahan larutan FeCl3 (diasumsikan terbentuk endapan setelah penambahan
garam gelatin) maka terdapat senyawa tanin tipe katekol, sedangkan jika
terbentuk warna hitam kebiruan setelah penambahan larutan FeCl3 (diasumsikan
terjadi endapan setelah penambahan garam gelatin) maka terdapat senyawa tanin
tipe pirogalol. Apabila tidak ada endapan tetapi terjadi perubahan warna menjadi
kehijauan atau hitam kebiruan maka tidak terdapat senyawa tanin (Fong, 1992).
Apabila terbentuk endapan pada penambahan gelatin 1% menandakan
adanya kandungan senyawa fenolik. Endapan yang timbul setelah penambahan
garam gelatin (gelatin 1% dan NaCl 10%) menunjukkan adanya kandungan
fenolik berupa tanin (Robinson, 1995).
2. Analisis hasil validasi metode
Validasi metode analisis dilihat dari linearitas. Linearitas dinyatakan
30
linier yang ideal dicapai jika nilai B = 0 dan r = +1 atau -1 bergantung pada arah
garis, sedangkan nilai A menunjukkan kepekaan analisis terutama instrumen yang
digunakan (Harmita, 2004).
3. Analisis hasil penetapan kadar phlorotannin dalam fraksi etil asetat alga
coklat Sargassum polycystum C. Agardh
Kadar phlorotannin diperoleh dengan memasukkan nilai absorbansi
sampel ke dalam persamaan kurva baku phloroglucinol. Konsentrasi polifenol
total dihitung ekivalen dengan phloroglucinol (mg PE/g fraksi).
BAB IV
PEMBAHASAN
A. Preparasi Sampel Alga Coklat Sargassum polycystum C. Agardh
Simplisia alga coklat diambil dari Pantai Drini, Gunungkidul, Yogyakarta pada tanggal 21 Maret 2007. Alga coklat diambil pada daerah pantai (beach area). Kondisi lingkungan pada saat pengambilan sampel adalah air laut dalam keadaan surut pada pukul 16.00-17.00 WIB, musim penghujan dan suhu air laut 270C.
Identifikasi alga coklat dilakukan di Laboratorium Taksonomi Tumbuhan, Fakultas Biologi, Universitas Gadjah Mada. Dari hasil identifikasi diketahui alga coklat yang digunakan dalam penelitian ini termasuk ke dalam genus Sargassum
dan spesies Sargassum polycystum C. Agardh (lampiran 1).
Daerah pantai tempat diambilnya sampel alga coklat bersubstrat karang Secara ekologis, alga coklat berperan dalam pembentukan ekosistem terumbu karang dan tempat hidup biota laut antara lain sebagai tempat untuk meletakkan benih ikan dan udang.
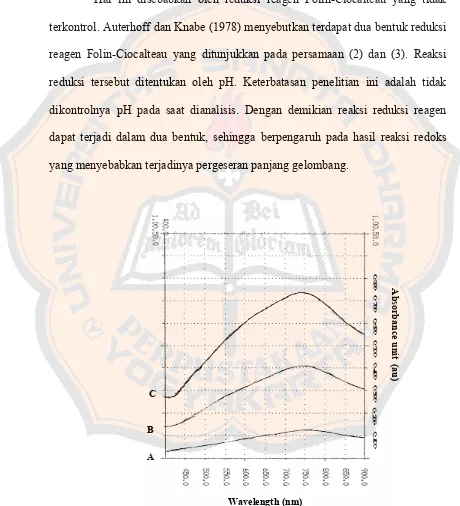
Pengotor yang ada pada alga coklat dapat mempengaruhi reaksi yang terjadi dalam penentuan kadar phlorotannin. Pasir pada habitat alga coklat mengandung silikat dan kalsium. Menurut Auterhoff dan van Joacim Knabe (1978), silikat dapat membentuk kompleks molibdat H6[SiMo12O40].n H2O
dengan pereaksi Folin-Ciocalteu, sehingga bila tidak dihilangkan akan mengganggu analisis sampel. Sedangkan kalsium dalam suasana basa dapat mengakibatkan terbentuknya endapan berupa kalsium fosfat (Ca3(PO4)2) setelah
32
bereaksi dengan reagen Folin (Kahn, 1916). Endapan yang terbentuk dapat mengganggu proses analisis.
Pencucian sampel alga coklat dilakukan dengan air mengalir untuk menghilangkan pasir. Pencucian dilanjutkan dengan pembersihan biota laut lain yang menempel pada alga coklat dengan menggunakan tangan karena tidak dapat hilang hanya dengan pencucian menggunakan air.
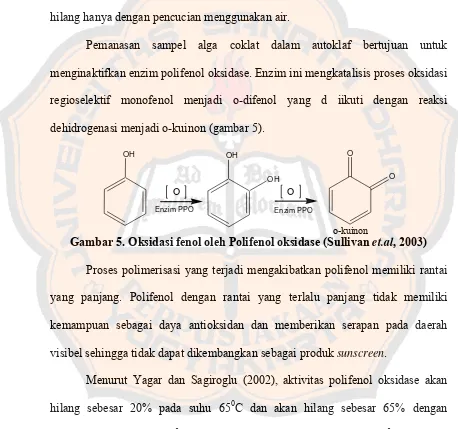
Pemanasan sampel alga coklat dalam autoklaf bertujuan untuk menginaktifkan enzim polifenol oksidase. Enzim ini mengkatalisis proses oksidasi regioselektif monofenol menjadi o-difenol yang d iikuti dengan reaksi dehidrogenasi menjadi o-kuinon (gambar 5).
O Enzim PPO Enzim PPO
Gambar 5. Oksidasi fenol oleh Polifenol oksidase (Sullivan et.al, 2003)
Proses polimerisasi yang terjadi mengakibatkan polifenol memiliki rantai yang panjang. Polifenol dengan rantai yang terlalu panjang tidak memiliki kemampuan sebagai daya antioksidan dan memberikan serapan pada daerah visibel sehingga tidak dapat dikembangkan sebagai produk sunscreen.
Menurut Yagar dan Sagiroglu (2002), aktivitas polifenol oksidase akan hilang sebesar 20% pada suhu 650C dan akan hilang sebesar 65% dengan pemanasan pada suhu 700C selama 30 menit. Pada suhu di atas 600C, semakin tinggi suhu maka enzim ini akan semakin kurang reaktif.
Senyawa-senyawa yang tidak diketahui dalam bahan organik asing dapat turut mereduksi kompleks asam dalam pereaksi Folin-Ciocalteau, sehingga akan berpengaruh terhadap warna larutan sampel yang dihasilkan (membentuk warna biru-hijau).
Alga harus segera dikeringkan dan diekstraksi untuk menghindari proses degradasi karena kandungan kimia yang terdapat di dalam organisme dapat dengan cepat terdegradasi oleh karena proses oksidasi, enzimatik, atau polimerisasi (Cannel, 1998). Alga coklat dikeringkan dengan oven pada suhu 900C untuk mencegah tumbuhnya jamur dan mikrobia.
Proses dilanjutkan dengan pembuatan serbuk dari simplisia alga menggunakan blender agar mempermudah proses isolasi. Isolasi senyawa aktif dari simplisia dalam bentuk serbuk lebih mudah karena memiliki luas permukaan yang lebih besar bila dibandingkan dengan simplisia kering. Proses pengeringan dengan oven membantu proses pembuatan serbuk simplisia karena simplisia sudah dalam keadaan kering. Serbuk simplisia kemudian diayak agar memiliki derajat halus 20/30.
34
ekstraksi. Serbuk yang sangat halus menyebabkan cairan pengekstraksi akan sulit dipisahkan dari sisa yang tertinggal setelah proses ekstraksi selesai.
Kadar air dari serbuk simplisia kemudian diukur menggunakan metode Karl Fischer. Penetapan kadar air dilakukan dengan metode Karl Fischer karena
Sargassum polycystum C. Agardh mengandung senyawa triterpenoid yang merupakan turunan terpenoid dan termasuk dalam golongan minyak atsiri. Golongan minyak atsiri mudah menguap sehingga penetapan kadar air tidak dilakukan menggunakan metode Gravimetri yang memerlukan pemanasan.
Senyawa yang mudah menguap dapat mempengaruhi perhitungan kadar air pada metode Gravimetri.
Metode Karl Fischer menggunakan pereaksi berupa iodin, sulfur dioksida, metanol anhidrat, dan piridin anhidrat. Prinsip reaksi ini adalah I2 dan SO2 akan
bereaksi hanya jika ada air (Vogel, 1978).
I2 + SO2 + 2H2O → H2SO4 + 2HI (1)
Penetapan kadar air dengan metode Karl Fischer berdasar atas reaksi redoks antara SO2 dan I2 menghasilkan garam asam hidroiodat dan garam alkil
sulfat seperti yang tercantum pada gambar 6 (Evans, 2002).
SO2 I2
Gambar 6. Reaksi pada penetapan kadar air dengan metode Karl Fischer
Standar Nasional Indonesia (SNI) 01-2690-1992 tentang rumput laut memberlakukan persyaratan kadar air yang berbeda dengan kisaran antara 15-35% tergantung pada genus alganya. SNI hanya mengatur 4 genus alga yang banyak dibudidayakan seperti Euchema, Gelidium, Gracilaria, dan Hypnea. Persyaratan kadar air genus Sargassum belum dicantumkan secara khusus.
Kadar air yang berlebih di dalam alga dapat mengakibatkan pertumbuhan mikroorganisme yang dapat merusak kandungan kimia alga. Hasil pengukuran kadar air pada Sargassum polycystum C Agardh adalah 5,58 ± 1,3% b/b. Kadar air tersebut sudah memenuhi standar yang ditetapkan oleh SNI.
B. Uji Kualitatif Senyawa Fenolik Alga Sargassum polycystum C. Agardh
Senyawa fenolik merupakan metabolit sekunder yang banyak ditemukan pada tanaman. Senyawa fenolik yang berguna bagi manusia adalah asam fenolik, flavonoid, dan polifenol dengan bobot molekul yang besar (Svobodova, 2003).
Penapisan fitokimia perlu dilakukan untuk mengetahui ada tidaknya kandungan senyawa fenolik pada simplisia. Penapisan fitokimia dilakukan dengan uji tanin karena phlorotannin merupakan tanin yang terdiri dari phloroglucinol
36
phloroglucinol kompleks berwarna biru-ungu
Gambar 7. Reaksi fenol dengan pereaksi FeCl3
Penambahan gelatin 1% akan menimbulkan endapan karena kandungan tanin dalam ekstrak. Namun protein dalam sampel juga dapat memberikan uji positif. Kepekaan reaksi dapat ditingkatkan dengan menambahkan sedikit natrium klorida (Robinson, 1995). Penambahan NaCl 10% dimaksudkan untuk menghilangkan protein sehingga mencegah terjadinya reaksi positif palsu. Kandungan protein dalam sampel juga dapat menyebabkan terbentuknya endapan maka campuran disaring dan filtrat yang diperoleh ditambah gelatin. Hasil uji kualitatif menunjukkan setelah penambahan gelatin 1% terjadi endapan putih di dasar tabung, yang menunjukkan adanya senyawa fenol berupa tanin. Terbentuknya endapan disebabkan karena kemampuan tanin menyamak kulit. Selain itu, endapan menunjukkan adanya tanin yang tidak larut dengan gelatin dalam HCl atau NaCl. Tanin memiliki afinitas yang kuat terhadap gelatin sehingga mengalami presipitasi (Thomas dan Frieden, 1923).
Penambahan FeCl3 menyebabkan perubahan warna menjadi coklat pekat
akibat terbentuknya kompleks berwarna violet-biru yang menandakan adanya senyawa polifenol (Robinson, 1995).
C. Isolasi Crude Phlorotannin dari Sargassum polycystum C. Agardh
Sebelum dilakukan isolasi crude phlorotannin maka dilakukan penyarian dengan cara sohxletasi. Dipilih penyarian dengan cara sohxletasi karena terjadi sirkulasi berulang-ulang sehingga menghasilkan penyarian yang lebih baik (Anonim, 1986). Pelarut pada metode soxhletasi tidak akan mengalami titik jenuh seperti pada metode maserasi, karena pelarut diuapkan dan akan menarik kembali senyawa aktif dari seruk simplisia sehingga penyarian lebih maksimal.
Phlorotannin bersifat relatif polar oleh karena itu dalam penyarian digunakan pelarut metanol yang juga relatif polar. Phloroglucinol yang digunakan sebagai standar merupakan monomer dari phlorotannin. Phloroglucinol memiliki titik lebur 200-2190C (Anonim, 2001). Soxhletasi dilakukan pada suhu yang lebih rendah daripada titik lebur phloroglucinol yaitu 1200C±200C. Ekstrak metanol yang diperoleh dari hasil soxhletasi dipekatkan sampai kurang lebih 1/10 dari volume mula-mula sehingga diperoleh ekstrak kental. Kemudian ekstrak kental tersebut difraksinasi.
38
Tahap awal ekstraksi dilakukan dengan menggunakan pelarut air dan kloroform. Metanol-air akan berada pada lapisan atas karena memiliki berat jenis yang lebih kecil jika dibandingkan dengan pelarut kloroform. Phlorotannin akan tertarik ke dalam pelarut air, sedangkan lipid akan tertarik ke dalam kloroform (Padda, 2006). Senyawa dalam Sargassum polycystum C. Agardh yang tertarik ke dalam kloroform antara lain alginat, iodin, steroid, triterpenoid, dan phlorotannin
yang memiliki berat molekul yang tinggi.
Ekstraksi tahap selanjutnya menggunakan pelarut etil asetat. Etil asetat akan berada di lapisan atas karena memiliki berat jenis yang lebih kecil dibandingkan metanol-air. Phlorotannin yang meliputi phloroglucinol,
phlorofucofuroeckol, dieckol, 8,8’-bieckol, dan phlorotannin golongan tetramer akan tertarik ke dalam fraksi etil asetat. Phlorotannin ini termasuk ke dalam
phlorotannin dengan berat molekul yang rendah. Senyawa yang lebih polar dibandingkan phlorotannin seperti vitamin C akan tertarik ke dalam fraksi metanol-air.
Phlorotannin didapatkan dengan menguapkan fraksi etil asetat di atas
waterbath dengan suhu 500C. Phlorotannin dalam fraksi etil asetat bersifat sangat higroskopis. Oleh karena itu disimpan di dalam oven agar tidak mudah rusak oleh adanya lembab.
Hasil dari ekstraksi tergantung pada banyaknya ekstraksi yang dilakukan. Hasil yang paling baik diperoleh jika jumlah ekstraksi dilakukan berulangkali dengan jumlah pelarut sedikit (Khopkar, 1990). Proses ekstraksi
dengan pelarut etil asetat dilakukan sebanyak dua kali. Hal ini bertujuan agar
phlorotannin dapat diekstraksi dengan sempurna.
Proses pengelompokkan komponen campuran dari bahan alam dalam ekstrak berdasarkan kesamaan karakter fitokimia disebut fraksinasi (Houghton, 2002). Pengelompokkan untuk mendapatkan fraksi etil asetat adalah kelarutan berdasarkan polaritas.
D. Prinsip Reaksi Kolorimetri dengan Metode Folin-Ciocalteau
Penetapan kadar polifenol crude phlorotannin setelah difraksinasi dilakukan secara kolorimetri dengan menggunakan pereaksi reagen Folin-Ciocalteau. Pereaksi Folin-Ciocalteau berupa larutan asam berwarna kuning yang mengandung kompleks ion polimerik yang dibentuk dari asam heteropoli (Singleton dan Rossi, 1965).
Reagen Folin-Ciocalteau yang digunakan adalah dengan pengenceran (1:1) (Anonim, 1994), karena pengenceran reagen Folin-Ciocalteau dengan perbandingan hingga (1:12) tidak memberikan perbedaan yang berarti (Singleton dan Rossi, 1965).
Prinsip reaksi sampel fenolik dengan pereaksi Folin-Ciocalteau melibatkan reaksi ion fenolat dengan kompleks ion polimerik dari asam fosfomolibdat-fosfotungstat. Fenol akan menjadi fenolat dan lebih reaktif dalam suasana basa. Oleh karena itu dalam metode Folin-Ciocalteau ini ditambahkan natrium karbonat (Na2CO3) 1,9 M agar fenol sampel lebih mudah bereaksi dengan pereaksi
40
Gambar 8. Kesetimbangan reaksi phloroglucinol dalam suasana basa
Fenol teroksidasi dengan cepat hanya dalam keadaan yang cukup basa agar dapat memberikan jumlah ion fenolat yang cukup. Sebagian fenol akan terionisasi pada pH 9-10. Ketika fenol yang sudah terionisasi bereaksi dengan reagen Folin-Ciocalteau, maka kesetimbangan akan bergeser dan akan dihasilkan lebih banyak fenolat (Singleton dan Rossi, 1965).
OH
Gambar 9. Reaksi oksidasi fenol menjadi ion fenolat
Ion fenolat dioksidasi oleh asam dalam pereaksi Folin-Ciocalteau dan kompleks molibdenum-tungstat akan direduksi oleh sampel sehingga menghasilkan warna biru (molybdenum-blue). Reaksi ini tertera pada gambar 10.
OH
Pereaksi Folin-Ciocalteau Kompleks oktahedral
molybdenum-blue
2,6-Dihydroxy-(1,4)benzokuinon
Gambar 10. Reaksi senyawa fenolik dengan Folin-Ciocalteau
Folin-Ciocalteau memiliki bilangan oksidasi 2 dan 4, dengan uraian :
H3PO4(MoO3)12 + 2e-+ 2H+ H5(PMo12O40) (2)
H3PO4(MoO3)12 + 4e-+ 4H+ H7(PMo12O40) (3)
Hasil dari reaksi yang terjadi adalah kompleks oktahedral molybdenum-blue dan suatu kuinon. Kompleks oktahedral yang terbentuk merupakan kompleks MoO3-fosfat dengan fosfor (P) sebagai pusatnya.
Menurut Auterhoff dan Knabe (1978), kompleks molybdenum-blue yang terbentuk berupa koloid. Asam fosfat (H3PO4) pada reagen Folin-Ciocalteau akan
menyebabkan terbentuknya kompleks asam fofomolibdat yang berbentuk cairan non-koloidal sehingga dapat dianalisis menggunakan spektrofotometer.
Kondisi optimum agar reaksi dapat berjalan cukup cepat dan memberikan warna yang bertahan cukup lama yaitu adanya reagen Folin-Ciocalteau dalam jumlah banyak dan suasana basa yang sedang (Singleton dan Rossi, 1965).
E. Optimasi Kolorimetri dengan Metode Folin-Ciocalteau
1. Penentuan operating time (OT)
Senyawa baku yang digunakan dalam penelitian ini adalah phloroglucinol.