UJI ANALGETIK EKSTRAK ETANOL 70% DAUN KEPEL (Stelechocarpus burahol (Bl.) Hook. f. & Th.) PADA MENCIT PUTIH BETINA SWISS
DENGAN METODE RANGSANG KIMIA
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm.)
Program Studi Ilmu Farmasi
Oleh: Agustin Angela NIM: 048114068
FAKULTAS FARMASI UNIVERSITAS SANATA DHARMA
Skripsi ini kupersembahkan untuk :
1. Yesus Kristus : You raise me up...to more than I can be 2. Papa, mama, adik-adikku terkasih dan seluruh keluargaku : Engkaulah yang senantiasa membuat hari-hariku lebih berarti dan mempunyai makna 3. Teman-teman angkatanku: “Akhirilah ini semua dengan Indah” 4. Serta almamaterku
Biarkanlah ketakutan itu memperoleh buah
yang matang, supaya kamu menjadi sempurna
PRAKATA
Puji syukur kepada Tuhan Yang Maha Esa atas berkat dan karunia-Nya
sehingga penyusun dapat menyelesaikan skripsi yang berjudul: “Uji Analgetik Ekstrak Etanol 70% Daun Kepel (Stelechocarpus burahol (Bl.) Hook. f. & Th.) pada Mencit Putih Betina Swiss dengan Metode Rangsang Kimia”.
Skripsi ini disusun sebagai salah satu syarat untuk mencapai gelar
kesarjanaan pada Fakultas Farmasi Universitas Sanata Dharma. Penyusunan skripsi
ini tidak akan terwujud tanpa adanya bimbingan, pengarahan, dan bantuan dari
berbagai pihak. Untuk itu penyusun mengucapkan banyak terima kasih kepada :
1. Ibu Rita Suhadi, M.Si., Apt., selaku Dekan Fakultas Farmasi, Universitas Sanata
Dharma, Yogyakarta.
2. Bapak Arief Rahman Hakim, M.Si, Apt., selaku Dosen Pembimbing Utama atas
bimbingan, pengarahan, kesabaran dan dukungannya selama penelitian sampai
penyusunan skripsi ini.
3. Bapak Yohanes Dwiatmaka, M.Si., selaku Dosen Penguji yang telah memberikan
masukan, kritik,dan saran untuk kesempurnaan skripsi ini.
4. Ibu dr. Fenty, selaku Dosen Penguji yang telah memberikan masukan, kritik,dan
saran untuk kesempurnaan skripsi ini.
5. Segenap dosen yang telah memberikan bimbingan yang sangat bermanfaat dalam
penyelesaian skripsi ini.
7. Teman-teman seperjuanganku di Laboratorium, Indra, Mei, Siska dan Filisia,
yang banyak membantu saat penelitian.
8. Teman-teman angkatan 2004 yang telah banyak membantu selama masa
perkuliahan.
9. Keluarga besarku yang selalu mendukung dan memberi semangat untukku.
10.Semua pihak yang tidak dapat disebutkan satu per satu yang telah membantu
penyelesaian skripsi ini.
Penyusun menyadari atas keterbatasan dan kekurangan, maka skripsi ini
masih jauh dari kesempurnaan. Oleh karena itu penyusun mengharapkan kritik dan
saran dari segenap pembaca. Semoga skripsi ini dapat bermanfaat bagi
perkembangan ilmu pengetahuan khususnya dalam bidang penelitian.
Yogyakarta, Juni 2008
INTISARI
Tanaman kepel (Stelechocarpus burahol (Bl.) Hook. f. & Th.) sering digunakan oleh masyarakat Indonesia untuk menurunkan kadar kolesterol, memperlancar air seni (diuretik), pengobatan asam urat, alat pencegah kehamilan tradisional, dan juga sebagai deodoran alami.
Penelitian ini termasuk dalam penelitian eksperimental murni dengan rancangan penelitian acak lengkap pola satu arah. Metode yang digunakan adalah metode induksi kimia. Empat puluh dua ekor mencit betina, galur Swiss, berat badan antara 20-30 gram, umur 2-3 bulan, dibagi secara acak yaitu kelompok kontrol negatif yang diberi CMC-Na 0,5%, kelompok kontrol positif yang diberi parasetamol dosis 91 mg/kgBB, dan kelompok yang diberi perlakuan ekstrak etanol daun kepel per oral dalam 4 peringkat dosis berturut-turut sebesar 35 mg/kgBB; 140 mg/kgBB; 560 mg/kgBB; dan 2240 mg/kgBB. Limabelas menit kemudian mencit diinduksi asam asetat dosis 100 mg/kgBB secara intraperitonial. Geliat yang timbul diamati dan dicatat tiap 5 menit selama 60 menit. Jumlah kumulatif geliat diubah ke dalam bentuk persen penghambatan terhadap geliat. Data yang diperoleh dianalisis secara
statistik dengan One-way ANOVA dilanjutkan dengan uji LSD dengan taraf
kepercayaan 95%.
Hasil penelitian menunjukkan ekstrak etanol daun kepel mempunyai efek analgetik. Persen penghambatan terhadap geliat untuk parasetamol dosis 91 mg/kgBB sebesar 57,76% dan ekstrak etanol daun kepel dosis 35 mg/kgBB; 140 mg/kgBB; 560 mg/kgBB; dan 2240 mg/kgBB berturut-turut sebesar 27,93%; 49,88%; 72,32%; dan 37,00%.
ABSTRACT
Kepel plants(Stelechocarpus burahol (Bl.) Hook. f. & Th.) often used by Indonesian people to decrease cholesterol level, diuretic, nerve acid therapy, prevent pregnancy traditionally, and natural deodorant.
The genre of this research is pure experimental in which the program of this research is random research plan, complete, and one-direction pattern. The method used in this research is chemical induction method. The research uses 42 female mice of Swiss groove, it weights 20-30 grams, and the age is 2-3 months. The 42 mices are divided into 6 groups based on its treatment, are the group of negative control is given CMC-Na 0,5%, the group of positive control is given paracetamol dosage 91 mg/kgBB, and the group of treatment is given extract ethanol of kepel leaves per orally in four different various dosage respectively, i.e.: 35 mg/kgBW; 140 mg/kgBW; 560 mg/kgBW; and 2240 mg/kgBW. Fifteen minutes after the treatment, the mice is induced by acetate acid with dosage 100 mg/kgBB intra peritoneally. The writhes are watched closely and booked every 5 minutes in 60 minutes. The accumulation numbers of the writhes are transferred into the form of resistance percentage toward the writhes. The data which is got from the calculation, later, is analyzed statistically with one-way ANOVA test, then, the step is continued with LSD
with interval 95%.
The result showing that ethanolic extract of kepel’s leaves has analgetic effect. Analgetic effect paracetamol at 91 mg/kgBW respectively, 57.76% and ethanolic extract of kepel’s leaves at 35 mg/kgBW; 140 mg/kgBW; 560 mg/kgBW; and 2240 mg/kgBW, respectively, 27.93%; 49.88%; 72.32%; and 37.00%.
DAFTAR ISI
Halaman
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
HALAMAN PERSEMBAHAN ... iv
PERNYATAAN KEASLIAN KARYA ... v
PERSETUJUAN PUBLIKASI... vi
PRAKATA ... vii
INTISARI ... ix
ABSTRACT ... x
DAFTAR ISI ... xi
DAFTAR TABEL ... xv
DAFTAR GAMBAR ... xviii
DAFTAR LAMPIRAN ... xx
BAB I. PENGANTAR ... 1
A. Latar Belakang ... 1
B. Permasalahan ... 2
C. Keaslian Penelitian ... 3
D. Manfaat Penelitian ... 7
1. Manfaat teoritis ... 7
2. Manfaat praktis ... 7
BAB II. PENELAAHAN PUSTAKA ... 8
A. Tanaman Kepel ... 8
1. Keterangan botani ... 8
2. Deskripsi ... 8
3. Khasiat ... 9
4. Kandungan kimia ... 9
B. Flavonoid ... 10
1. Sifat kelarutan dan isolasi ... 11
2. Karakterisasi ... 12
3. Kegunaan ... 12
C. Perkolasi ... 13
D. Radikal Bebas dan Antioksidan ... 14
1. Radikal bebas ... 14
2. Antioksidan ... 17
E. Nyeri ... 18
1. Definisi dan tipe ... 18
2. Reseptor nyeri ... 18
3. Mekanisme nyeri ... 20
F. Analgetika ... 22
1. Analgetika narkotik ... 23
2. Analgetika nonnarkotik ... 23
H. Metode Pengujian Efek Analgetik ... 25
1. Golongan analgetika narkotika ... 25
2. Golongan analgetika nonnarkotika ... 28
I. Landasan Teori ... 29
J. Hipotesis ... 31
BAB III. METODOLOGI PENELITIAN ... 32
A. Jenis Rancangan Penelitian ... 32
B. Variabel dan Definisi Operasional ... 32
1. Variabel utama ... 32
2. Variabel pengacau ... 32
3. Definisi operasional ... 33
C. Bahan Penelitian ... 34
D. Alat Penelitian ... 35
E. Tata Cara Penelitian ... 36
1. Pembuatan sediaan uji ... 36
2. Pemilihan hewan uji ... 40
3. Penetapan kriteria geliat ... 40
4. Uji pendahuluan ... 40
5. Pengujian efek analgetik kelompok perlakuan ... 44
6. Analisis data ... 46
BAB IV. HASIL DAN PEMBAHASAN ... 48
A. Pengumpulan Bahan dan Pembuatan Serbuk ... 48
C. Uji Pendahuluan ... 50
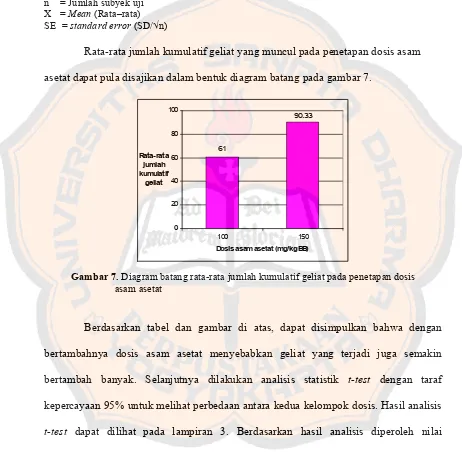
1. Penetapan dosis asam asetat ... 51
2. Penetapan kontrol negatif ... 53
3. Penetapan dosis parasetamol dan ekstrak etanol daun kepel ... 54
4. Penetapan selang waktu pemberian asam asetat terhadap parasetamol ... 58
5. Penetapan selang waktu pemberian asam asetat terhadap ekstrak etanol daun kepel ... 61
D. Pengujian Efek Analgetik Kelompok Perlakuan ... 63
E. Perbandingan Daya Analgetik Ekstrak Etanol Daun Kepel Antara Mencit Jantan dan Mencit Betina ... 71
BAB V. KESIMPULAN DAN SARAN ... 74
A. Kesimpulan ... 74
B. Saran ... 74
DAFTAR PUSTAKA ... 75
LAMPIRAN ... 80
DAFTAR TABEL
Halaman
Tabel 1. Jumlah kumulatif geliat pada penetapan dosis asam asetat ... 52
Tabel 2. Jumlah kumulatif geliat pada penetapan kontrol negatif ... 53
Tabel 3. Jumlah kumulatif geliat dan % penghambatan terhadap geliat
pada penetapan dosis parasetamol dan ekstrak etanol daun
kepel ... 55
Tabel 4. Hasil analisis uji LSD % penghambatan terhadap geliat pada
penetapan dosis parasetamol dan ekstrak etanol daun kepel ... 57
Tabel 5. Jumlah kumulatif geliat dan % penghambatan terhadap geliat
pada penetapan selang waktu pemberian asam asetat terhadap
parasetamol ... 59
Tabel 6. Hasil analisis uji LSD % penghambatan terhadap geliat pada penetapan selang waktu pemberian asam asetat terhadap
parasetamol ... 60
Tabel 7. Jumlah kumulatif geliat dan % penghambatan terhadap geliat
pada penetapan selang waktu pemberian asam asetat terhadap
ekstrak ... 61
Tabel 8. Hasil analisis uji LSD % penghambatan terhadap geliat pada penetapan selang waktu pemberian asam asetat terhadap ekstrak
etanol daun kepel ... 63
pada seluruh kelompok perlakuan ... 64
Tabel 10. Hasil analisis uji LSD % penghambatan terhadap geliat pada
seluruh kelompok perlakuan ... 66
Tabel 11. Persen penghambatan terhadap geliat seluruh kelompok
perlakuan pada mencit jantan dan mencit betina ... 71
Tabel 12. Data jumlah geliat mencit pada penetapan dosis asam asetat ... 85
Tabel 13. Data jumlah geliat mencit pada penetapan kontrol negatif ... 87
Tabel 14. Data jumlah geliat mencit pada penetapan dosis parasetamol
dan ekstrak etanol daun kepel... 89
Tabel 15. Data % penghambatan terhadap geliat pada penetapan dosis
parasetamol dan ekstrak etanol daun kepel ... 92
Tabel 16. Data jumlah geliat mencit pada penetapan selang waktu
pemberian asam asetat terhadap parasetamol ... 94
Tabel 17. Data % penghambatan terhadap geliat pada penetapan selang
waktu pemberian asam asetat terhadap parasetamol ... 97
Tabel 18. Data jumlah geliat mencit pada penetapan selang waktu
pemberian asam asetat ekstrak etanol daun kepel ... 99
Tabel 19. Data % penghambatan terhadap geliat pada penetapan selang
waktu pemberian asam asetat terhadap ekstrak etanol daun
kepel ... 101
Tabel 20. Data jumlah kumulatif geliat mencit pada pengujian efek
analgetik seluruh kelompok perlakuan ... 103
analgetik seluruh kelompok perlakuan ... 109
Tabel 22. Data potensi relatif ekstrak terhadap parasetamol pada pengujian
efek analgetik... 112
Tabel 23. Data % penghambatan terhadap geliat seluruh kelompok
DAFTAR GAMBAR
Halaman
Gambar 1. Struktur kimia isolat ekstrak etanol daun kepel ... 10
Gambar 2. Kerangka dasar tipe-tipe flavonoid ... 11
Gambar 3. Perombakan asam arakhidonat ... 21
Gambar 4. Mekanisme Nyeri ... 22
Gambar 5. Struktur molekul Parasetamol ... 24
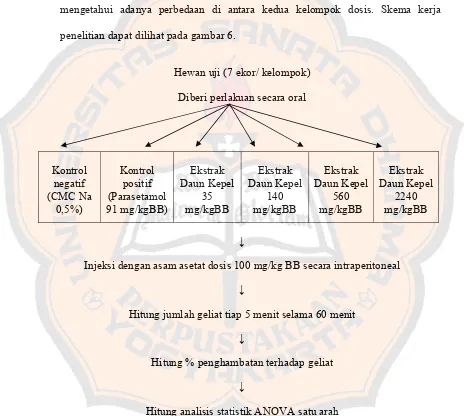
Gambar 6. Skema kerja penelitian ... 47
Gambar 7. Diagram batang rata-rata jumlah kumulatif geliat pada penetapan dosis asam asetat ... 52
Gambar 8. Diagram batang rata-rata jumlah kumulatif geliat pada penetapan kontrol negatif ... 54
Gambar 9. (a) Diagram batang rata-rata jumlah kumulatif geliat, (b) Diagram batang rata-rata % penghambatan terhadap geliat pada penetapan dosis parasetamol dan ekstrak etanol daun kepel ………... 56
Gambar 11. (a) Diagram batang rata-rata jumlah kumulatif geliat,
(b) Diagram batang rata-rata % penghambatan terhadap geliat
pada penetapan selang waktu pemberian asam asetat
terhadap ekstrak ... 62
Gambar 12. (a) Diagram batang rata-rata jumlah kumulatif geliat, (b) Diagram batang rata-rata % penghambatan terhadap geliat pada seluruh kelompok perlakuan ... 65
Gambar 13. Diagram batang perbandingan efek analgetik seluruh kelompok perlakuan antara mencit jantan dan mencit betina ... 72
Gambar 14. Tanaman kepel ... 82
Gambar 15. Buah kepel... 82
Gambar 16. Serbuk daun kepel ... 83
Gambar 17. Ekstrak etanol daun kepel ... 83
Gambar 18. Empat peringkat dosis ekstrak etanol daun kepel ... 84
Gambar 19. Geliat mencit ... 84
Gambar 20. Plot penyebaran vs tingkat geliat terhadap perlakuan ... 106
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Surat determinasi tanaman kepel... 80
Lampiran 2. Foto tanaman, buah, serbuk daun kepel, ekstrak etanol
daun kepel, empat peringkat dosis ekstrak etanol daun
kepel, dan geliat mencit... 82
Lampiran 3. Data jumlah kumulatif geliat mencit dan hasil analisis
statistik pada penetapan dosis asam asetat ... 85
Lampiran 4. Data jumlah kumulatif geliat mencit dan hasil analisis
statistik pada penetapan kontrol negatif ... 87
Lampiran 5. Data jumlah kumulatif geliat mencit dan hasil analisis
statistik pada penetapan dosis parasetamol dan ekstrak etanol
daun kepel ... 89
Lampiran 6. Data % penghambatan terhadap geliat dan hasil analisis
statistik pada penetapan dosis parasetamol dan ekstrak etanol
daun kepel ... 92
Lampiran 7. Data jumlah kumulatif geliat mencit dan hasil analisis statistik
pada penetapan selang waktu pemberian asam asetat terhadap
parasetamol ... 94
Lampiran 8. Data % penghambatan terhadap geliat dan hasil analisis
statistik pada penetapan selang waktu pemberian asam asetat
Lampiran 9. Data jumlah kumulatif geliat mencit dan hasil analisis statistik
pada penetapan selang waktu pemberian asam asetat terhadap
ekstrak etanol daun kepel ... 99
Lampiran 10. Data % penghambatan terhadap geliat dan hasil analisis
statistik pada penetapan selang waktu pemberian asam asetat
terhadap ekstrak etanol daun kepel ... 101
Lampiran 11. Data jumlah kumulatif geliat mencit dan hasil analisis statistik
pada pengujian efek analgetik seluruh kelompok perlakuan .. 103
Lampiran 12. Data % penghambatan terhadap geliat dan hasil analisis
statistik pada pengujian efek analgetik seluruh kelompok
perlakuan ... 109
Lampiran 13. Data potensi relatif ekstrak terhadap parasetamol pada
pengujian efek analgetik ... 112
Lampiran 14. Data % penghambatan terhadap geliat antara mencit jantan
dan betina serta hasil analisis statistik pada pengujian
BAB I PENGANTAR
A. Latar Belakang
Nyeri merupakan respon langsung terhadap kejadian atau peristiwa yang tidak
menyenangkan yang berhubungan dengan kerusakan jaringan seperti, luka, inflamasi,
atau kanker (Rang dkk, 2003). Karena nyeri dirasa sangat mengganggu, maka setiap
individu ingin bebas dari rasa nyeri, salah satunya dengan menggunakan obat-obat
modern maupun tradisional. Tetapi karena, dewasa ini efek samping dari obat-obat
modern yang menggunakan bahan kimia murni mulai menunjukkan hal-hal yang tidak
dikehendaki, sehingga ada keinginan dari masyarakat untuk menggunakan obat
tradisional guna meminimalkan efek samping dari penggunaan obat modern.
Departemen Kesehatan Republik Indonesia melalui Undang-Undang No. 23
tahun 1992 tentang kesehatan mendefinisikan obat tradisional sebagai bahan atau
ramuan bahan yang berupa bahan-bahan tumbuhan, bahan hewan, bahan mineral,
sediaan galenik, atau campuran dari bahan tersebut yang secara turun temurun telah
digunakan untuk pengobatan berdasarkan pengalaman.
Tanaman kepel (Stelechocarpus burahol (Bl.) Hook. f. & Th.) secara empiris telah digunakan sebagai obat bahan alam oleh masyarakat. Secara ilmiah, sudah banyak
penelitian yang berhubungan dengan daun kepel. Pada penelitian terdahulu, Sutomo
(2003) dan Supriyatna (2007) berhasil mengidentifikasi adanya senyawa flavonoid
pada daun kepel. Hal ini terkait dengan kemampuan senyawa flavonoid pada daun
dalam tubuh berlebih maka dapat menyebabkan kerusakan jaringan dan menimbulkan
rasa nyeri. Adanya flavonoid yang berfungsi menangkap radikal bebas dapat
mengurangi terjadinya kerusakan jaringan sehingga rasa nyeri juga dapat dikurangi.
Penelitian lain juga melaporkan bahwa infusa daun kepel memiliki aktivitas
antiinflamasi (Sriwidodo, 2004). Mekanisme terjadinya inflamasi hampir sama dengan
mekanisme terjadinya nyeri, yaitu adanya pelepasan mediator yang memperantarai
inflamasi, sehingga apabila suatu zat memiliki efek antiinflamasi maka kemungkinan
zat tersebut juga memiliki efek analgetik.
Seberapa besar persen efek analgetik tanaman kepel sampai sekarang belum
diketahui. Oleh karena itu dalam penelitian ini akan dilakukan uji efek analgetik dari
ekstrak etanol daun kepel pada mencit putih betina, serta akan dibandingkan pengaruh
jenis kelamin mencit terhadap besarnya daya analgetik ekstrak etanol daun kepel.
Metode pengujian efek analgetik yang digunakan pada penelitian ini adalah metode
rangsang kimia. Hal ini dikarenakan metode rangsang kimia dapat digunakan sebagai
langkah pengujian awal untuk mengetahui adanya efek analgetik pada suatu senyawa,
selain itu metode ini sederhana dan mudah dilakukan. Hewan uji yang digunakan dalam
metode uji rangsang kimia adalah mencit sebagaimana tercantum dalam acuan (Turner,
1965).
B. Permasalahan
Berdasarkan latar belakang tersebut maka permasalahan yang timbul antara
1. Apakah ekstrak etanol daun kepel memiliki efek analgetik terhadap mencit putih
betina melalui metode rangsang kimia?
2. Berapa besar persen daya analgetik yang dimiliki ekstrak etanol daun kepel
terhadap mencit putih betina melalui metode rangsang kimia?
C. Keaslian Penelitian
Penelitian mengenai Uji Analgetik Ekstrak Etanol 70% Daun Kepel
(Stelechocarpus burahol (Bl.) Hook. f. & Th.) pada Mencit Putih Betina Swiss dengan Metode Rangsang Kimia belum pernah dilakukan sebelumnya. Adapun penelitian
tentang tanaman kepel yang pernah dilakukan adalah:
1. Toksisitas Akut Ekstrak Metanol dan Ekstrak Kloroform Daun Kepel
(Stelechocarpus burahol (Bl.) Hook. f. & Th.) Terhadap Larva Artemia salina
Leach (Widiastuti, 2000). Hasil menunjukkan bahwa ekstrak metanol menunjukkan
efek toksik dengan LC50 257 μg/ml, sedangkan ekstrak kloroform tidak toksik
dengan LC50 1053 μg/ml.
2. Pengaruh Infusa Daun Kepel (Stelechocarpus burahol (Bl.) Hook. f. & Th.)
Terhadap Kadar Asam Urat Serum Darah Ayam Terinduksi Hati (Hening, 2002).
Hasil menunjukkan bahwa infusa daun kepel dengan dosis 0,98 g/kgBB; 1,47
g/kgBB; dan 2,205 g/kgBB terbukti mampu menurunkan kadar asam urat dalam
serum darah ayam. Makin tinggi dosis maka kemampuan menurunkan kadar asam
urat semakin besar.
3. Skrining Fitokimia dan Penentuan Identitas Makroskopik dan Mikroskopik Daun
pemisahan KLT menunjukkan bahwa daun kepel mengandung senyawa kimia
golongan antrakinon, flavonoid, dan kumarin.
4. Uji Sitotoksisitas Ekstrak Metanol Daun Kepel (Stelechocarpus burahol (Bl.)
Hook. f. & Th.) Terhadap Penghambatan Pertumbuhan Sel HELA (Aryuni, 2002).
Hasil menunjukkan ekstrak metanol daun kepel bersifat sitotoksik terhadap sel
HELA secara in vitro dengan LC50 setelah inkubasi selama 72 jam sebesar 334,10
μg/ml.
5. Penurunan Asam Urat Darah Ayam Jantan Braille Hiperurisemia Oleh Fraksi
Ekstrak Metanol Daun Kepel (Stelechocarpus burahol (Bl.) Hook. f. & Th.)
(Sutomo, 2003). Hasil menunjukkan bahwa fraksi larut petroleum eter dosis 100
mg/kgBB dan fraksi tidak larut petroleum eter dosis 50; 100; dan 150 mg/kgBB
mampu menurunkan kadar asam urat darah ayam hiperurisemia.
6. Pembuatan Ekstrak Daun Kepel (Stelechocarpus burahol (Bl.) Hook. f. & Th.)
Secara Kempa Langsung Dengan Kombinasi Avicel pH 102® dan Di-Cafos®
Sebagai Bahan Pengisi-Pengikat (Restiyaningsih, 2004). Hasil menunjukkan bahwa
ekstrak daun kepel dapat dibuat jadi sediaan tablet dengan sifat fisik yang
memenuhi persyaratan tablet dengan menggunakan kombinasi Avicel pH 102® dan
Di-Cafos® sebagai bahan pengisi-pengikat.
7. Toksisitas Akut-Oral Ekstrak Etanolik Daun Kepel (Stelechocarpus burahol (Bl.) Hook. f. & Th.) pada Mencit (Ariningsih, 2004). Hasil menunjukkan bahwa potensi
ketoksikan akut-oral ekstrak etanolik daun kepel pada mencit tergolong hampir
tidak toksik dan tidak menyebabkan kematian dengan harga LD-50 semu sebesar >
8. Variasi Kadar Amprotab Sebagai Bahan Penghancur Dalam Pembuatan Tablet
Ekstrak Daun Kepel (Stelechocarpus burahol (Bl.) Hook. f. & Th.) Secara
Granulasi Kering (Ardanie, 2004). Hasil menunjukkan bahwa variasi kadar
Amprotab antara 5-15% sebagai bahan penghancur berpengaruh terhadap daya
serap dan waktu hancur tablet. Semakin besar kadar Amprotab maka semakin besar
daya serap tablet dan semakin cepat waktu hancur tablet.
9. Uji Aktivitas Antiinflamasi Infusa Daun Kepel Pada Tikus Jantan Wistar Dengan
Metode Udema Kaki Belakang (Sriwidodo, 2004). Hasil menunjukkan bahwa
sediaan infusa daun kepel yang diberikan per oral mempunyai daya antiinflamasi
pada tikus yang diinduksi karagenin 1% secara subplanar. Daya antiinflamasi pada
dosis 0,5; 1,0; 2,0; dan 3 g/kgBB masing-masing sebesar 44,33; 67,00; 71,29; dan
50,91%.
10.Toksisitas Akut Infusa Daun Kepel (Stelechocarpus burahol (Bl.) Hook. f. & Th.) pada Mencit Jantan (Maspa, 2005). Hasil menunjukkan bahwa potensi ketoksikan
akut infusa daun kepel pada mencit tergolong dalam kategori toksik ringan dan
dengan harga LD50 semu sebesar > 8190 mg/kgBB.
11.Isolasi dan Identifikasi Senyawa Flavonoid Antioksidan Penangkap Radikal Bebas
Dari Daun Kepel (Stelechocarpus burahol (Bl.) Hook. f. & Th.) (Sunarni, 2006). Hasil menunjukkan bahwa peneliti berhasil mengisolasi dan mengindetifikasi
senyawa flavonoid golongan flavon dalam fraksi etanol infusa daun kepel.
n-heksana daun kepel terdapat senyawa golongan terpenoid, flavonoid dan senyawa
yang belum dapat diidentifikasi dengan menggunakan KLT.
13.Uji Aktivitas Hiperurikemia Ekstrak Etanol Daun Kepel (Stelechocarpus burahol
(Bl.) Hook. f. & Th.) Pada Tikus Putih Jantan Sprague Dawley Serta Penentuan
Kandungan Senyawa Fenolik dan Flavonoid Totalnya (Supriyatna, 2007). Hasil
menunjukkan bahwa ekstrak etanol daun kepel mampu menurunkan kadar asam
urat serum hingga 77,78% pada hari ke-19 setelah pemberian ekstrak etanol daun
kepel dosis 400 mg/kgBB per oral.
14.Uji Ekstrak Etanol Daun Kepel (Stelechocarpus burahol (Bl.) Hook. f. & Th.) Terhadap Aktivitas Enzim Xantin Oksidase Secara In Vitro (Aryadi, 2007). Hasil
menunjukkan bahwa ekstrak etanol daun kepel mempunyai potensi dalam
menghambat aktivitas xantin oksidase sebesar 17,78 ± 2,69% pada konsentrasi 500
μg/ml.
15.Uji Fraksi n-heksana Daun Kepel (Stelechocarpus burahol (Bl.) Hook. f. & Th.) Terhadap Aktivitas Enzim Xantin Oksidase Secara In Vitro (Kurniawati, 2007).
Hasil menunjukkan bahwa fraksi n-heksana daun kepel pada konsentrasi 0,5 dan 5
μg/ml dapat menghambat aktivitas enzim xantin oksidase dengan presentasi
penghambatan yang signifikan dibanding blanko, sedang pada konsentrasi 500
μg/ml menyebabkan pengikatan aktivitas enzim xantin oksidase sebesar 15,00 ±
D. Manfaat Penelitian
Penelitian ini memiliki beberapa manfaat, yaitu sebagai berikut :
1. Manfaat teoritis
Penelitian ini diharapkan dapat memberikan informasi yang berguna tentang
penggunaan tanaman obat tradisional sebagai analgetika.
2. Manfaat praktis
Penelitian ini diharapkan dapat memberikan informasi kepada masyarakat tentang
kegunaan daun kepel sebagai analgetika.
E. Tujuan Penelitian
Penelitian ini memiliki beberapa tujuan, yaitu sebagai berikut :
1. Mengetahui adanya efek analgetik ekstrak etanol daun kepel terhadap mencit putih
betina.
2. Mengetahui besarnya daya analgetik ekstrak etanol daun kepel terhadap mencit
BAB II
PENELAAHAN PUSTAKA
A. Tanaman Kepel 1. Keterangan Botani
Tanaman kepel (Stelechocarpus burahol (Bl.) Hook. f. & Th) termasuk dalam familia Annonaceae (Backer dan Bakhuizen, 1963). Tanaman kepel memiliki nama
daerah :
Sunda : burahol, turalak
Jawa : kepel, kecindul, simpul, cindul (Hutapea, 1994)
2. Deskripsi
Habitat : pohon, tinggi ± 12 m
Batang : tegak, bulat, berkayu, percabangan monodial, coklat.
Daun : tunggal, lonjong, panjang 8-20 cm, lebar 4-6 cm, ujung dan pangkal
meruncing, halus, pertulangan bawah menonjol mengkilat, hijau.
Bunga : majemuk, bentuk tandan, tersebar di batang dan cabang, tangkai
silindris, panjang 4 cm, benang sari dan putik halus kuning, mahkota
lonjong, kuning.
Buah : buni, bulat, kulit kasar, diameter 5 cm, coklat.
Biji : bentuk ginjal, halus, hitam, mengkilat
3. Khasiat
Daging buah kepel berkhasiat sebagai obat radang ginjal dan peluruh air seni
(Hutapea, 1994), selain itu juga bermanfaat sebagai deodoran alami dan alat pencegah
kehamilan tradisional (Siswono, 2002). Penelitian menyatakan bahwa daun kepel dapat
digunakan untuk pengobatan asam urat (Sutomo, 2003), menurunkan kadar kolesterol
(Siswono, 2002) dan sebagai antiinflamasi (Sriwidodo, 2004).
4. Kandungan kimia
Daging buah, biji, dan akar kepel mengandung saponin, flavonoid, dan
polifenol, disamping itu bijinya juga mengandung alkaloida dan daunnya juga
mengandung flavonoid dan polifenol (Hutapea, 1994). Sutomo (2003) dan Supriyatna
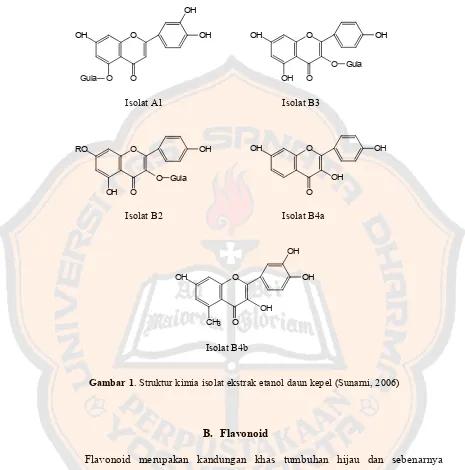
(2007) melaporkan adanya senyawa flavonoid pada daun kepel. Sunarni (2006) berhasil
mengisolasi dan mengidentifikasi senyawa flavonoid golongan flavon pada fraksi
etanol infusa daun kepel yaitu :
- Isolat A1 : 7,3’,4-trihidroksi-5-O-gula-flavon
- Isolat B2 : 5,4’-dihidroksi-7-O-tersubtitusi-3-0-gula flavon
- Isolat B3 : 5,7,4’-trihidroksi-3-O-gula flavon
- Isolat B4a : 3,7,4’-trihidroksi flavon
- Isolat B4b : 3,7,3’,4’-tetrahidroksi-5-metilflavon
Dari kelima isolat tersebut, isolat B4b memiliki aktivitas antioksidan paling
tinggi dibanding isolat lain, hal ini mungkin dikarenakan isolat B4b mempunyai gugus
O
Isolat A1 Isolat B3
O
Gambar 1. Struktur kimia isolat ekstrak etanol daun kepel (Sunarni, 2006)
B. Flavonoid
Flavonoid merupakan kandungan khas tumbuhan hijau dan sebenarnya
terdapat pada semua bagian tumbuhan termasuk daun, akar, kayu, kulit, tepungsari,
nektar, bunga, buah buni, dan biji (Markham, 1988). Kerangka dasar flavonoid dan
C C C
Gambar 2. Kerangka flavonoid (1a) dan sistem penomoran turunan flavonoid (1b) (Robinson, 1995)
1. Sifat kelarutan dan isolasi
Secara individual, kelarutan senyawa flavonoid sangat bermacam-macam
sesuai dengan golongan dan substitusi yang terjadi. Flavonoid terdapat dalam bentuk
bebas sebagai aglikon maupun terikat dengan gula sebagai glikosida. Adanya gula yang
terikat flavonoid cenderung menyebabkan flavonoid lebih mudah larut dalam air.
Dengan demikian glikosida flavonoid juga larut dalam pelarut polar seperti etanol,
metanol, butanol, aseton, dimetilsulfida, dimetilformamida dan air. Sebaliknya, aglikon
yang kurang polar seperti isoflavon, flavanon, flavon, serta flavonol yang
termetoksilasi cenderung lebih mudah larut dalam pelarut nonpolar seperti eter, etil
asetat, dan kloroform (Markham, 1988).
Metode yang banyak dikembangkan untuk pemisahan dan karakterisasi
flavonoid adalah kromatografi kertas. Sejumlah kecil sampel dapat dipisahkan dengan
efisien dengan metode tersebut. Kromatografi lapis tipis (KLT) juga merupakan cara
analisis cepat yang memerlukan bahan yang sangat sedikit. Penjerap dan pengembang
yang digunakan pada umumnya sama dengan penjerap dan pengembang untuk
2. Karakterisasi
Pencirian golongan flavonoid dapat dilakukan berdasarkan reaksi warna dan
sifat kelarutannya. Jika tidak ada pigmen yang mengganggu, flavonoid dapat dideteksi
dengan diberi uap amonia dan akan memberikan warna-warna yang spesifik. Flavon
dan flavonol menunjukkan warna kuning, kalkon dan auron menunjukkan warna
lembayung sampai merah (Robinson, 1995).
Flavonoid dengan alumunium klorida (AlCl3) membentuk senyawa kompleks
berwarna kuning. Reaksi yang terjadi antara AlCl3 dengan gugus hidroksil dan karbonil
yang bertetangga membentuk kompleks yang tahan asam, sedangkan reaksi yang
terbentuk antara AlCl3 dengan gugus o-dihidroksil membentuk kompleks yang tak
stabil dalam suasana asam (Markham, 1988).
Larutan asam borat dan natrium asetat akan membentuk senyawa kompleks
dengan gugus o-dihidroksil pada senyawa flavonoid baik pada cincin A atau B dari inti
flavonoid. Efek dari pereaksi ini akan memberikan pergeseran panjang gelombang dan
berguna pada analisis golongan flavonoid (Mabry dkk,1970).
3. Kegunaan
Flavonoid merupakan produk alamiah dengan beberapa aktivitas farmakologi.
Flavonoid mempunyai aktivitas sebagai penangkap radikal hidroksil dan superoksida
serta dapat melindungi membran lipid dari reaksi-reaksi yang merusak (Robinson,
1995). Flavonoid berkhasiat sebagai antiinflamasi, antialergi, antithrombolik,
vasoprotektif sebagai penghambat promotor tumor dan untuk proteksi pada mukosa
saluran cerna atau gastrik. Efek-efek tersebut berhubungan dengan pengaruh flavonoid
aktivitas flavonoid sebagai penurun kadar asam urat melalui penghambatan enzim
xantin oksidase, flavonoid selain dapat menghambat enzim xantin oksidase juga
bersifat sebagai antioksidan penangkap radikal superoksida.
C. Perkolasi
Ekstrak adalah sediaan pekat yang diperoleh dengan mengekstraksi zat aktif
dari simplisia nabati atau simplisia hewani menggunakan pelarut yang sesuai,
kemudian semua atau hampir semua pelarut diuapkan dan massa atau serbuk yang
tersisa diperlakukan sedemikian hingga memenuhi baku yang telah ditetapkan
(Anonim, 1995).
Penyarian merupakan peristiwa pemindahan massa. Zat aktif yang semula
berada di dalam sel ditarik oleh cairan penyari, sehingga terjadi larutan zat aktif dalam
cairan penyari tersebut. Metode yang digunakan dalam penelitian ini adalah metode
perkolasi. Cairan penyari yang digunakan dalam penelitian ini adalah etanol 70%.
Etanol digunakan sebagai penyari karena lebih selektif, kapang atau kuman sulit
tumbuh dalam etanol di atas 20%, tidak beracun, bersifat netral, absorpsinya baik,
dapat bercampur dengan air, panas yang digunakan untuk pemekatan lebih sedikit, dan
mudah didapat (Anonim, 1986).
Perkolasi adalah cara penyarian yang dilakukan dengan mengalirkan cairan
penyari melalui serbuk simplisia yang telah dibasahi. Prinsip perkolasi adalah sebagai
berikut: serbuk simplisia ditempatkan dalam suatu bejana silinder yang bagian
serbuk tersebut, sehingga cairan penyari akan melarutkan zat aktif sel-sel yang dilalui
sampai mencapai keadaan jenuh (Anonim, 1986).
Cara perkolasi lebih baik daripada dengan cara maserasi karena:
1. Aliran cairan penyari menyebabkan adanya pergantian larutan yang terjadi dengan
larutan yang konsentrasinya lebih rendah, sehingga meningkatkan derajat perbedaan
konsentrasi,
2. Ruangan di antara butir-butir serbuk simplisia membentuk saluran tempat mengalir
cairan penyari. Karena kecilnya saluran kapiler tersebut maka kecepatan pelarut
cukup untuk mengurangi lapisan batas sehingga dapat meningkatkan perbedaan
konsentrasi (Anonim,1986).
D. Radikal Bebas dan Antioksidan 1. Radikal Bebas
Radikal bebas adalah suatu molekul yang mempunyai jumlah elektron ganjil
atau elektron yang tidak berpasangan tunggal pada lingkaran luarnya. Elektron tidak
berpasangan tersebut menyebabkan instabilasi dan bersifat reaktif. Radikal bebas akan
merusak molekul yang elektronnya ditarik oleh radikal bebas tersebut sehingga
menyebabkan kerusakan sel, gangguan fungsi sel, bahkan kematian sel. Molekul utama
di dalam tubuh yang dirusak oleh radikal bebas yaitu DNA, lemak, dan protein. Radikal
bebas yang merusak DNA dapat mengganggu beberapa bagian DNA dan menyebabkan
pertumbuhan sel tidak terkontrol, yang dapat mengakibatkan kanker. Radikal bebas
diproduksi secara eksogen dan secara endogen. Secara endogen, radikal bebas
intisel. Secara eksogen, radikal bebas berasal dari asap rokok, polutan radiasi,
obat-obatan, dan pestisida (Setiati, 2003).
Berikut ini adalah jenis-jenis dari radikal bebas :
a. Radikal superoksida (O2⎯)
Radikal ini merupakan jenis radikal yang paling banyak dan terbentuk bila 1
molekul O2 menerima 1 elektron.
O2 → O2⎯
Superoksidan bersifat reaktif dan dapat bereaksi dengan substansi biologik.
Reaktivitas O2⎯ sangat terbatas karena adanya dismutasi spontan yang dapat terjadi
pada pH fisiologik, membentuk H2O2 dan O2. Tetapi dengan terbatasnya reaktivitas
O2⎯ menyebabkan radikal ini dapat berdifusi dan bereaksi dengan substratnya dalam
jarak yang relatif lebih jauh dari tempat asalnya.
b. Hidrogen peroksida
Penambahan 1 elektron pada radikal O2⎯ menghasilkan ion peroksida O2 2- yang
tidak bersifat radikal, dan pada pH fisiologik akan segera mengalami protonasi
membentuk H2O2. Meskipun bukan radikal bebas, akumulasi H2O2 dapat berbahaya
bila terdapat bersama-sama dengan logam (Fe, Cu) atau zat-zat kelator karena akan
bereaksi membentuk radikal hidroksil yang sangat reaktif.
c. Radikal hidroksil
Radikal fisi homolitik O-O akan menghasilkan 2 molekul radikal hidroksil, OH⎯.
Reaksi homolitik ini dapat terjadi karena pengaruh panas atau radiasi ionisasi.
logam (Fe2+, Cu+), menurut reaksi Fenton, dan dengan adanya kelator melalui
reaksi Haber-Weiss:
Fe2+ + H2O2 → Fe3+ + OH. + OH¯
Cu+ + H2O2 → Cu2+ + OH. + OH¯
Radikal hidroksil adalah oksidan yang sangat reaktif dan tidak stabil. Radikal bebas
dapat bereaksi dengan hampir semua substrat biologik. Karena sangat reaktif efek
radikal ini hanya berlangsung di daerah dengan tempat terbentuknya, dan dalam
kondisi fisiologik normal tidak ditemukan radikal hidroksil dalam kadar besar
(Gitawati, 1995).
Reaksi radikal bebas dapat dibagi menjadi tiga tahap, yaitu:
1. Tahap inisiasi, yaitu tahapan yang menyebabkan terbentuknya radikal bebas.
2. Tahap propagasi, yaitu tahap dimana radikal bebas cenderung bertambah banyak
dengan membuat reaksi rantai dengan molekul lain.
3. Tahap terminasi, apabila terjadi reaksi antara radikal bebas dengan radikal bebas
lain atau antara radikal bebas dengan suatu senyawa pembasmi radikal (scavenger) (Setiati, 2003).
Radikal bebas yang berlebihan akan menyebabkan kerusakan jaringan
sehingga menimbulkan nyeri. Dalam proses peradangan, radikal bebas terbentuk ketika
asam arakhidonat dikonversikan menjadi peroksida baik melalui jalur siklooksigenase
maupun lipoksigenase. Ketika terjadi kerusakan jaringan organ, jumlah radikal bebas
meningkat seiring dengan peningkatan produksi peroksida, padahal tubuh
memproduksi antioksidan endogen yang terbatas contohnya yaitu superoksida
radikal bebas makin banyak, antioksidan endogen tak mampu lagi melumpuhkannya
secara efektif sehingga harus ada tambahan antioksidan dari luar (eksogen) yang
berasal dari bahan makanan (Sibuea, 2004).
2. Antioksidan
Antioksidan adalah senyawa yang dalam kadar lebih rendah dibanding bahan
yang dapat dioksidasi, sangat memperlambat atau menghambat oksidasi dari bahan
tersebut (Setiati, 2003). Secara alamiah tubuh memproduksi antioksidan yang mampu
melindungi sel dari radikal bebas (Sibuea, 2004).
Antioksidan dibedakan menjadi antioksidan eksogen dan antioksidan endogen.
Antioksidan endogen atau sering disebut antioksidan primer terdiri atas enzim-enzim
dan berbagai senyawa yang disintesis dalam tubuh yang bekerja dengan cara mencegah
pembentukan radikal bebas baru. Antioksidan eksogen atau yang dikenal juga sebagai
antioksidan sekunder karena menangkap radikal dan mencegah reaksi berantai. Contoh
antioksidan eksogen adalah vitamin E (tokoferol), vitamin C (askorbat), karoten, asam
urat, bilirubin, dan albumin (Setiati, 2003). Vitamin E dan karoten merupakan
antioksidan yang larut dalam lemak (tidak polar) sedangkan vitamin C merupakan
antioksidan yang larut dalam air (polar) (Muhilal, 1991).
Flavonoid telah dikenal dan merupakan suatu kelompok antioksidan polifenol
yang banyak terdapat pada sayuran, buah-buahan, dan beberapa minuman seperti teh
hijau dan anggur merah. Di dalam keluarga polifenol, flavonoid ternyata mempunyai
sifat antioksidan yang amat kuat yang mencapai 20 kali sifat antioksidan vitamin E
E. Nyeri
1. Definisi dan tipe
Nyeri adalah respon langsung terhadap kejadian atau peristiwa yang tidak
menyenangkan yang berhubungan dengan kerusakan jaringan, seperti, luka, inflamasi,
atau kanker (Rang dkk, 2003). Keadaan psikis sangat mempengaruhi nyeri, misalnya
emosi dapat menimbulkan sakit (kepala) atau memperhebatnya, tetapi dapat pula
menghindarkan sensasi rangsang nyeri. Nyeri merupakan suatu perasaan pribadi dan
memiliki ambang toleransi nyeri berbeda-beda bagi setiap orang (Tjay dan Rahardja,
2002).
Nyeri dapat dibedakan berdasarkan waktu timbulnya nyeri yaitu nyeri akut dan
nyeri kronik (Anonim, 2001). Nyeri akut dengan kecepatan penjalaran antara 6-30
meter per detik biasanya memiliki sebuah penyebab yang dapat ditegaskan. Nyeri
kronik dengan kecepatan penjalaran antara 0,5-2 meter per detik sering kali tidak
menandakan bahaya yang segera menimbulkan pencegahan dan pasien mungkin tidak
mengartikan nyeri tersebut sebagai penyakit serius (Greene dan Harris, 2000).
Nyeri berdasarkan sumbernya dapat dikategorikan menjadi nyeri somatik dan
nyeri viseral. Jika nyeri somatik muncul dari kulit, dinamakan nyeri superfisial. Jika
nyeri itu berasal dari otot, sendi, organ dalam atau jaringan connective, disebut nyeri viseral atau nyeri dalam (Anonim, 2001).
2. Reseptor nyeri
Nosiseptor adalah saraf aferen primer untuk menerima dan menyalurkan
rangsangan nyeri. Ujung-ujung saraf bebas nosiseptor berfungsi sebagai reseptor yang
Distribusi nosiseptor bervariasi di seluruh tubuh, dengan jumlah terbanyak terdapat di
kulit. Nosiseptor terletak di jaringan subkutis, otot rangka dan sendi (Hartwig dan
Wilson, 2006). Terdapat tiga kategori reseptor nyeri :
a. Nosiseptor mekanis yang berespons terhadap kerusakan mekanis, misalnya tusukan,
benturan atau cubitan.
b. Nosiseptor termal yang berespons terhadap suhu yang berlebihan terutama panas.
c. Nosiseptor polimodal yang berespons setara terhadap semua jenis rangsangan yang
merusak, termasuk iritasi zat kimia yang dikeluarkan dari jaringan yang cedera
(Sherwood, 2001).
Sebagian besar reseptor pada kulit memiliki struktur khusus yang merupakan
ujung saraf bebas yang sederhana di perifer. Tiga tipe serabut saraf perifer (aferen)
yang terlibat dalam transmisi nyeri :
1. Serabut A-β : berukuran besar, bermielin, cepat dalam menyalurkan impuls (30-100
meter/detik), memiliki ambang nyeri yang rendah dan merespon terhadap sentuhan
ringan.
2. Serabut A-δ : berukuran kecil, bermielin tipis, dan memiliki kecepatan konduksi
yang lebih rendah (6-30 meter/detik). Serabut ini merespon terhadap tekanan,
panas, zat kimia, dan memberi reaksi terhadap nyeri yang tajam, serta menimbulkan
refleks penarikan diri atau gerakan cepat lainnya.
3. Serabut C : berukuran kecil, tidak bermielin, dan memiliki kecepatan konduksi
yang lambat (1-1,25 meter/detik). Serabut ini merespon terhadap seluruh jenis
rangsang bahaya dan mentransmisikan nyeri yang lambat dan tumpul (Greene dan
3. Mekanisme nyeri
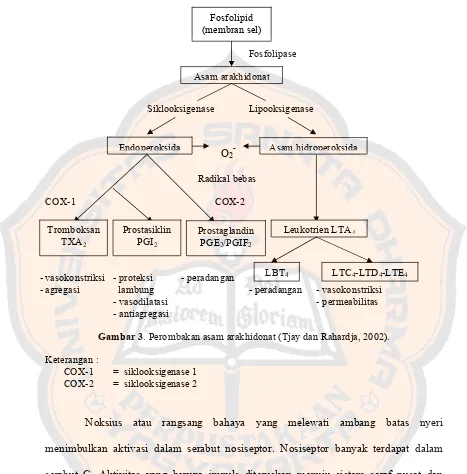
Ketika membran sel mengalami kerusakan, enzim fosfolipase akan mengubah
fosfolipid menjadi asam arakhidonat. Asam arakhidonat ini akan menghasilkan
peroksida. Peroksida yang terbentuk akan menghasilkan prostaglandin dan leukotrien
yang bertanggungjawab atas sebagian besar gejala peradangan yang meliputi calor,
rubor, tumor, dolor, dan fungtio laesa. Rasa nyeri akan timbul bersamaan dengan reaksi peradangan, karena mediator yang memperantarai peradangan (prostaglandin,
bradikinin, leukotrien, dll) akan mengaktivasi reseptor nyeri, sehingga rangsangan
(mekanis, kimia atau fisis) yang diterima reseptor nyeri akan disalurkan ke pusat nyeri
di otak besar, impuls itu kemudian dirasakan sebagai nyeri (Tjay dan Rahardja, 2002).
Nyeri juga dapat terjadi karena jumlah radikal bebas dalam tubuh melampaui
normal. Pada dasarnya radikal bebas dalam jumlah normal tidak berbahaya karena
tubuh memiliki antioksidan alamiah (glutathion-peroxydase, superoxide-dismutase,
katalase) yang mampu menangkap radikal bebas tersebut. Dalam proses peradangan radikal bebas terbentuk ketika asam arakhidonat dikonversikan menjadi peroksida baik
melalui jalur siklooksigenase ataupun lipooksigenase. Ketika terjadi kerusakan sel atau
organ, produksi peroksida meningkat seiring dengan peningkatan jumlah radikal bebas,
padahal di dalam tubuh jumlah antioksidan alamiah terbatas, kondisi ini akan
menimbulkan kerusakan sel atau organ. Apabila sel atau organ sudah rusak, maka
mediator nyeri akan keluar dan mengaktivasi reseptor nyeri sehingga seseorang bisa
Fosfolipid (membran sel)
Fosfolipase
Siklooksigenase Lipooksigenase
O2-
Radikal bebas
COX-1 COX-2
-vasokonstriksi - proteksi - peradangan
-agregasi lambung - peradangan - vasokonstriksi
- vasodilatasi - permeabilitas
- antiagregasi
Gambar 3. Perombakan asam arakhidonat (Tjay dan Rahardja, 2002).
Keterangan :
COX-1 = siklooksigenase 1 COX-2 = siklooksigenase 2
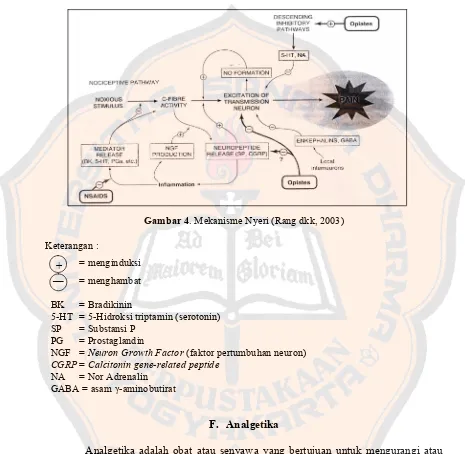
Noksius atau rangsang bahaya yang melewati ambang batas nyeri
menimbulkan aktivasi dalam serabut nosiseptor. Nosiseptor banyak terdapat dalam
serabut C. Aktivitas yang berupa impuls diteruskan menuju sistem saraf pusat dan
menyebabkan eksitasi neuron sehingga menimbulkan nyeri. Aktivasi serabut C memicu
pelepasan Calcitonin gene-related peptide (CGRP). Pada jaringan inflamasi akan
dilepaskan Neuron Growth Factor (NGF) dan mediator lain seperti bradikinin,
serotonin, prostaglandin, dan lain-lain. Analgetika opioid, enkefalin, dan GABA
menghambat eksitasi neuron, sedangkan analgetika perifer dan NSAID bekerja
menghambat pada pelepasan mediator (Rang dkk, 2003).
Gambar 4.Mekanisme Nyeri (Rang dkk, 2003)
Keterangan :
= menginduksi
= menghambat
BK = Bradikinin
5-HT = 5-Hidroksi triptamin (serotonin) SP = Substansi P
PG = Prostaglandin
NGF = Neuron Growth Factor (faktor pertumbuhan neuron) CGRP = Calcitonin gene-related peptide
NA = Nor Adrenalin GABA = asam γ-aminobutirat
F. Analgetika
Analgetika adalah obat atau senyawa yang bertujuan untuk mengurangi atau
melenyapkan rasa nyeri tanpa menghilangkan kesadaran. Secara umum analgetika
dibagi menjadi dua golongan besar yaitu analgetika opioid (narkotik) dan analgetika
non-opioid (nonnarkotik) (Anonim, 2000). +
1. Analgetika narkotik
Golongan ini digunakan untuk menghalangi nyeri yang sangat kuat dengan
titik kerja yang terletak pada sistem saraf pusat. Senyawa-senyawa tersebut pada
umumnya mengurangi kesadaran (bersifat meredakan dan menidurkan), menimbulkan
perasaan nyaman, menyebabkan toleransi, kebiasaan (habituasi), ketergantungan fisik
dan psikis (ketagihan) bila pengobatan dirutinkan (Tjay dan Rahardja, 2002).
Mekanisme kerja golongan ini adalah dengan cara pengikatan obat dengan sisi reseptor
khas pada sel dalam otak dan spinal (Siswandono dan Soekardjo, 1995). Golongan ini
secara kimia dibedakan menjadi dua jenis, yaitu :
a. Alkaloida candu alamiah dan sintesis : morfin dan kodein, heroin dan
hidromorfon, hidrokodon dan dionin
b. Pengganti-pengganti morfin : petidin dan turunannya (fentanil dan sulfotanil),
metadon dan turunannya (dekstromeramida, bezitramida, piritramida, dan
d-propoksifen) (Tjay dan Rahardja, 2002)
2. Analgetika nonnarkotik
Golongan ini juga disebut analgetika perifer, karena efeknya tidak
mempengaruhi sistem saraf pusat, tidak menurunkan kesadaran serta tidak
menyebabkan ketagihan (Tjay dan Rahardja, 2002). Obat golongan ini digunakan untuk
mengurangi rasa sakit yang ringan sampai moderat, untuk menurunkan suhu badan
dalam keadaan panas yang tinggi dan sebagai antiradang. Mekanisme kerja golongan
ini dengan cara menghambat secara langsung dan selektif enzim-enzim pada sistem
saraf pusat yang mengkatalisis biosintesis prostaglandin seperti siklooksigenase,
(Siswandono dan Soekardjo, 1995). Tjay dan Rahardja (2002) membagi golongan
analgetik ini menjadi 4 kelompok :
a. Golongan Salisilat : natrium salisilat, asetosal, salisil amida dan benorilat
b. Turunan p-aminofenol : fanasetin dan parasetamol
c. Turunan Pirozolon : antipirin, aminofenazon, dipiron, fenilbutazon
d. Turunan Antranilat : glafini, asam mefenamat, dan asam diflumiaat
G. Parasetamol
Parasetamol berbentuk hablur putih; tidak berbau; dan rasa agak pahit. Larut
dalam air mendidih dan dalam natrium hidroksida 1N. Selain itu parasetamol mudah
larut dalam etanol (Anonim, 1995). Struktur kimia parasetamol dapat dilihat pada
gambar 5.
OH
NHCOCH3
Gambar 5.Struktur molekul Parasetamol (Anonim, 1995)
Parasetamol berkhasiat sebagai analgetika dan antipiretik, tetapi tidak
antiradang. Parasetamol mempunyai efek sebagai analgetika dengan mengurangi atau
menghilangkan nyeri ringan sampai sedang. Mekanisme kerja parasetamol adalah
menghambat sintesis prostaglandin di sentral (hipotalamus) dengan menghambat
aktivitas dari COX 3 secara reversibel. Penghambatan COX 3 oleh parasetamol melalui
mekanisme sentral mampu mengurangi nyeri dan demam (Chandrasekaran dkk, 2002).
Dewasa ini parasetamol dianggap sebagai zat anti nyeri yang paling aman,
gram, maksimum 4 gram/hari, pada penggunaan kronis maksimal 2,5 gram/hari.
Resorpsinya dari usus cepat dan tuntas. Dalam hati diuraikan menjadi
metabolit-metabolit toksis yang diekskresikan kemih dengan konjugat glukuronida dan sulfat.
Waktu paruh parasetamol adalah 1-4 jam (Tjay dan Rahardja, 2002).
Parasetamol akan bersifat toksik pada orang dewasa pada dosis tunggal yaitu
7000 mg. Kebanyakan kasus keracunan parasetamol terjadi karena orang meminum
dengan dosis kecil dalam jangka waktu yang lama. Pada kasus ini, dosis 4000 mg per
hari sudah dapat bersifat toksik (Anonim, 2006a). Pada over dosis akut, kemungkinan
dapat terjadi nekrosis hepatik. Hepatitis toksik juga dapat terjadi pada pemakaian
jangka panjang 5-8 gram perhari selama beberapa minggu atau selama 1 tahun
(Anonim, 2006b).
H. Metode Pengujian Efek Analgetik
Turner (1965) membagi metode pengujian efek analgetik menjadi 2, yaitu
berdasarkan jenis analgetiknya. Berikut uraian tentang masing-masing metode secara
singkat.
1. Golongan analgetika narkotika
a. Metode jepitan ekor
Sekelompok mencit disuntik dengan senyawa uji dengan dosis tertentu secara
subkutan (s.c.) atau intravena (i.v.). Tiga puluh menit kemudian jepitan
dipasang pada pangkal ekor mencit selama 30 detik. Mencit yang tidak diberi
senyawa uji akan berusaha untuk melepaskan diri dari kekangan tersebut, tetapi
rentang waktu tertentu jepitan dipasang kembali. Respon positif yang
menunjukkan adanya efek analgetik, apabila tidak ada usaha melepaskan jepitan
selama 15 detik pada tiga kali pengamatan.
b. Metode rangsang panas
Hewan percobaan ditempatkan di atas lempeng panas dengan suhu 50° C
sampai 55° C sebagai stimulus nyeri. Mencit yang sudah diberi larutan uji,
diletakkan pada hot plate yang sudah disiapkan. Reaksi mencit adalah menjilat telapak kaki depan, belakang lalu meloncat. Selang waktu antara pemberian
stimulus nyeri dan terjadinya respon, disebut waktu reaksi, dapat diperpanjang
oleh pengaruh obat-obat analgetika. Perpanjangan waktu reaksi selanjutnya
dapat dijadikan sebagai ukuran dalam mengevaluasi aktivitas analgetik.
c. Metode pengukuran tekanan
Metode ini menggunakan suatu alat untuk mengukur tekanan yang diberikan
pada ekor tikus secara seragam. Alat tersebut terdiri dari 2 syringe yang
dihubungkan pada kedua ujungnya, bersifat elastis, fleksibel, serta terdapat pipa
plastik yang diisi dengan cairan. Sisi dari pipa dihubungkan dengan manometer.
Syringe yang pertama diletakkan dengan posisi vertikal dengan ujungnya menghadap ke atas. Ekor tikus diletakkan di bawah penghisap syringe. Ketika
tekanan diberikan pada syringe kedua, maka tekanan akan terhubung pada
sistem hidrolik pada syringe yang pertama kemudian pada ekor tikus. Tekanan
yang sama pada syringe kedua akan meningkatkan tekanan pada ekor tikus,
tikus yang pertama adalah meronta-ronta kemudian akan mengeluarkan suara
(mencicit) sebagai tanda kesakitan.
d. Metode potensi petidin
Metode ini kurang baik, karena dibutuhkan hewan uji dalam jumlah besar, tapi
dapat digunakan untuk uji sedatif. Tiap kelompok tikus terdiri dari 20 ekor,
setengah kelompok dibagi menjadi 3 kelompok kecil dan diberi petidin dengan
dosis berturut-turut 2, 4, dan 8 mg/kg. Setengah kelompok dibagi menjadi dua
yaitu kelompok petidin dan senyawa uji dengan dosis 25% dari LD50. Persen
analgetik dihitung dengan bantuan metode rangsang panas.
e. Metode antagonis nalorfin
Uji analgetik dengan metode ini bertujuan untuk menunjukkan aksi obat-obat
seperti morfin. Nalorfin memiliki kemampuan untuk meniadakan aksi dari
morfin. Hewan uji yang biasa digunakan dalam metode ini adalah tikus, mencit,
dan anjing. Hewan uji diberi obat dengan dosis toksik kemudian segera diikuti
pemberian nalorfin (0,5-10,0 mg/KgBB) secara intravena. Teori menyebutkan
bahwa nalorfin dapat menggantikan ikatan morfin dengan reseptornya.
f. Metode kejang oksitosin
Oksitosin merupakan hormon yang dihasilkan oleh kelenjar pituitori posterior,
yang dapat menyebabkan kontraksi uterin sehingga menimbulkan kejang pada
tikus. Hewan uji yang digunakan yaitu tikus betina dengan berat badan 120-140
mg, diberi estrogen dengan pemberian 15 mg dietilstilbestrol secara subkutan
pada paha hewan uji. Setelah 10 minggu, hewan uji siap untuk tes efek
pemberian secara intraperitonial 2 unit oksitosin (dosis ED50). Persen penurunan
kejang dideterminasi dan ED50 dapat diperkirakan.
g. Metode pencelupan pada air panas
Sepuluh ekor tikus disuntik intraperitonial dengan senyawa uji, kemudian ekor
tikus dicelupkan dalam air panas (suhu 58° C). Respon tikus terlihat dari
hentakan ekornya dari air panas.
2. Golongan analgetika nonnarkotika
a. Metode induksi kimia
Metode ini menggunakan zat kimia yang diinjeksikan pada hewan uji secara
intraperitonial pada mencit yang sudah diberi senyawa uji secara oral pada
selang waktu tertentu, sehingga akan menimbulkan rasa nyeri. Beberapa zat
kimia yang biasa digunakan antara lain asam asetat dan fenil kuinon. Respon
nyeri pada mencit adalah geliat berupa kontraksi perut disertai tarikan kedua
kaki belakang dan perut menempel pada lantai. Geliat diamati setiap 5 menit
selama 1 jam. Pemberian analgetik akan mengurangi rasa nyeri sehingga jumlah
geliat yang terjadi berkurang. Penelitian ini menggunakan metode rangsang
kimia sebagai metode pengujian efek analgetik karena metode ini sederhana,
mudah dilakukan, dan cukup peka untuk pengujian senyawa-senyawa yang
memiliki efek analgetik lemah. Efek analgetik dapat dievaluasi menggunakan
persen penghambatan terhadap geliat, yaitu:
% penghambatan terhadap geliat = 100 – [(P/K) x 100]
Keterangan:
b. Metode pedodolorimetri
Hewan uji diletakkan pada kandang yang bagian alasnya terbuat dari kepingan
metal sehingga bisa dialiri arus listrik. Respon yang timbul yaitu ketika hewan
uji mengeluarkan teriakan dengan pengukuran yang dilakukan setiap 10 menit
selama 1 jam.
c. Metode rektodolometri
Tikus diletakkan dalam kandang yang dibuat khusus dengan alas tembaga yang
kemudian dihubungkan dengan sebuah gulungan yang berfungsi sebagai
penginduksi. Ujung lain dari gulungan tersebut kemudian dihubungkan dengan
silinder elektroda tembaga. Pada gulungan bagian atas terdapat suatu konduktor
yang dihubungkan dengan suatu voltmeter yang sensitif untuk dapat mengubah
0,1 volt. Respon berupa suara teriakan tikus dapat ditimbulkan dengan
pemberian tegangan sebesar 1 sampai 2 volt.
I. Landasan Teori
Sutomo (2003) dan Supriyatna (2007) melaporkan adanya flavonoid pada
daun kepel. Sunarni (2006) berhasil mengisolasi dan mengidentifikasi senyawa
flavonoid golongan flavon dari fraksi etanol infusa daun kepel yaitu :
- Isolat A1 : 7,3’,4-trihidroksi-5-O-gula-flavon
- Isolat B2 : 5,4’-dihidroksi-7-O-tersubtitusi-3-O-gula flavon
- Isolat B3 : 5,7,4’-trihidroksi-3-O-gula flavon
- Isolat B4a : 3,7,4’-trihidroksi flavon
Hasil isolasi dari fraksi etanol infusa daun kepel menghasilkan lima isolat yang
memiliki aktivitas antioksidan. Oleh karena itu, pada penelitian ini digunakan pelarut
etanol untuk proses ekstraksinya, diharapkan pada proses ekstraksi dengan pelarut
etanol juga didapatkan isolat yang memiliki aktivitas antioksidan. Dari kelima isolat
tersebut, isolat B4b memiliki aktivitas antioksidan paling tinggi dibanding isolat lain,
hal ini mungkin dikarenakan isolat B4b mempunyai gugus o-diOH dan 3-OH bebas.
Maka dengan adanya ekstrak etanol daun kepel, diharapkan kandungan antioksidannya
mampu menangkap radikal bebas berlebih sehingga tidak akan terjadi kerusakan
jaringan yang dapat menimbulkan nyeri.
Infusa daun kepel juga terbukti memiliki efek antiinflamasi (Sriwidodo, 2004).
Kandungan flavonoid pada daun kepel diduga dapat menghambat enzim
siklooksigenase dan lipooksigenase sehingga konversi asam arakhidonat menjadi
peroksida terganggu, akibatnya pelepasan mediator yang berperan dalam proses
inflamasi juga akan terganggu dan inflamasi akan terhambat. Mekanisme terjadinya
inflamasi hampir sama dengan mekanisme terjadinya nyeri, yaitu adanya pelepasan
mediator yang memperantai inflamasi, sehingga apabila suatu zat memiliki efek
antiinflamasi maka kemungkinan zat tersebut juga memiliki efek analgetik.
Berdasarkan keterangan tersebut, maka dengan adanya efek antiinflamasi pada infusa
J. Hipotesis
BAB III
METODOLOGI PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini merupakan jenis penelitian eksperimental murni dengan
menggunakan rancangan acak lengkap pola satu arah.
B. Variabel dan Definisi Operasional 1. Variabel utama
a. Variabel bebas
Variabel bebas dari penelitian ini adalah kelompok perlakuan yang meliputi
kelompok kontrol negatif yang diberi CMC Na 0,5%, kelompok kontrol positif
yang diberi suspensi parasetamol, dan kelompok perlakuan suspensi ekstrak
etanol daun kepel dengan menggunakan 4 peringkat dosis.
b. Variabel tergantung
Variabel tergantung dari penelitian ini adalah daya analgetik yang merupakan
besarnya persen penghambatan terhadap geliat yang menunjukkan ketahanan
mencit terhadap rangsang setelah pemberian senyawa uji.
2. Variabel pengacau
a. Variabel pengacau terkendali
1) Galur hewan uji, yaitu mencit dengan galur Swiss
2) Jenis kelamin hewan uji, yaitu mencit betina
4) Berat badan hewan uji, yaitu antara 20-30 gram
5) Cara pemberian bahan uji, yaitu per oral
6) Asal bahan uji, yaitu dari Balai Besar Penelitian dan Pengembangan
Tanaman Obat dan Obat Tradisional, Tawangmangu, Jawa Tengah
b. Variabel pengacau tak terkendali
1) Suhu ekstraksi adalah temperatur lingkungan selama proses ekstraksi
berlangsung.
2) Ketahanan mencit adalah kemampuan mencit dalam menahan rasa sakit.
3) Kemampuan absorpsi mencit adalah kemampuan absorpsi mencit terhadap
ekstrak etanol daun kepel.
3. Definisi operasional
a. Efek analgetik
Efek analgetik merupakan kemampuan suatu zat dalam menghambat rasa
nyeri baik dengan mengurangi atau menghilangkan kesadaran, yang
ditunjukkan dengan berkurangnya respon nyeri.
b. Daya analgetik
Daya analgetik menunjukkan seberapa besar suatu zat tertentu dalam
memberi efek analgetik, yang ditunjukkan dengan besarnya nilai persen
penghambatan terhadap respon (geliat).
c. Uji efek analgetik
Uji efek analgetik menggunakan metode rangsang kimia yaitu suatu metode
uji analgetik yang menggunakan rangsang kimia berupa asam asetat yang
per oral pada selang waktu tertentu. Respon nyeri pada mencit adalah geliat
berupa kontraksi perut disertai tarikan kedua kaki belakang dan perut
menempel pada lantai. Geliat diamati setiap 5 menit selama 1 jam.
d. Ekstrak etanol daun kepel
Ekstrak etanol diperoleh dengan cara mengekstraksi bahan, yaitu daun kepel,
dalam pelarut etanol dengan menggunakan metode perkolasi sehingga
didapat ekstrak etanol daun kepel.
e. Ekstrak kental
Ekstrak kental merupakan sediaan ekstrak yang liat dalam keadaan dingin
dan tidak dapat dituang.
C. Bahan Penelitian 1. Bahan
a. Hewan uji
Hewan uji yang digunakan dalam penelitian ini berupa mencit betina, galur
Swiss, berat 20-30 gram, umur 2-3 bulan, yang diperoleh dari Laboratorium Farmakologi dan Toksikologi, Fakultas Farmasi, Universitas Sanata Dharma
Yogyakarta.
b. Daun Kepel
Bahan uji yang digunakan berupa daun kepel yang diperoleh dari Balai Besar
Penelitian dan Pengembangan Tanaman Obat dan Obat Tradisional,
Tawangmangu, Kabupaten Karanganyar, Jawa Tengah pada bulan Agustus
2. Bahan Kimia
a. Parasetamol diperoleh dari Brataco Chemica dengan kualitas farmasetis.
b. CMC Na diperoleh dari Brataco Chemica dengan kualitas farmasetis.
c. Asam asetat glasial diproduksi oleh Merck dengan kualitas pro analisis,
diperoleh dari Laboratorim Kimia Organik, Fakultas Farmasi, Universitas
Sanata Dharma, Yogyakarta.
d. Etanol diperoleh dari Asia Lab dengan kualitas teknis.
e. Aquadest yang diproduksi oleh Laboratorium Farmakologi dan Toksikologi,
Fakultas Farmasi, Universitas Sanata Dharma, Yogyakarta.
D. Alat Penelitian
Alat yang digunakan untuk ekstraksi meliputi seperangkat alat gelas berupa
beaker glass, Erlenmeyer, gelas ukur, labu ukur, cawan porselen, pipet tetes, batang
pengaduk; perkolator; corong Buchner; rotary vacum evaporator merek Janke and
Kunkel IKA laboratechnik; pompa vacum merek Anleitung Lesen; timbangan analitik
merek Mettler Toledo AE 200.
Alat yang digunakan untuk uji geliat meliputi kotak kaca tempat pengamatan
geliat; stopwatch; jarum yang digunakan untuk pemberian per oral, berupa jarum yang ujungnya berbentuk bulat dan berlubang di bagian tengah; spuit injeksi yang memiliki
ujung runcing dan digunakan untuk pemberian secara intraperotinial dengan merek
E. Tatacara Penelitian
Penelitian ini dilakukan menurut tata cara sebagai berikut:
1. Pembuatan Sediaan Uji a. Pengumpulan bahan
Bahan uji yang digunakan yaitu daun kepel yang diperoleh dari Balai Besar
Penelitian dan Pengembangan Tanaman Obat dan Obat Tradisional, Tawangmangu,
Kabupaten Karanganyar, Jawa Tengah pada bulan Agustus 2007.
b. Pembuatan serbuk
Daun kepel yang telah dikumpulkan dipisahkan dari pengotornya, kemudian
dicuci dengan air mengalir dan dikeringkan di bawah sinar matahari dengan ditutup
kain hitam. Setelah daun mudah dihancurkan, daun diserbuk dan diayak dengan
ayakan nomor 60 mesh sehingga diperoleh serbuk kering.
c. Pembuatan ekstrak etanol daun kepel
Empat ratus gram daun kepel yang sudah diserbuk, dimasukkan ke dalam
perkolator, kemudian direndam dengan etanol 70% sampai mencapai ketinggian 1,5
cm di atas permukaan serbuk selama 24 jam. Kran perkolator dibuka dan kecepatan
aliran diatur sehingga tiap 1 menit didapat perkolat sebanyak 20 tetes. Selama
proses perkolasi berlangsung, tinggi etanol di atas permukaan serbuk harus tetap
1-1,5 cm. Perkolat ditampung dalam Erlenmeyer. Ekstraksi dihentikan jika perkolat
yang keluar berwarna bening. Perkolat yang diperoleh disaring dengan bantuan
pompa vacum dan diuapkan dengan menggunakan rotary vacum evaporator hingga
adalah ekstrak yang liat dalam keadaan dingin dan tidak dapat dituang, kemudian
ekstrak kental disimpan di dalam lemari pendingin (kulkas),
d. Pembuatan larutan CMC Na 0,5%
Larutan CMC Na 0,5% dibuat dengan cara menimbang dengan seksama
500,0 mg serbuk CMC Na kemudian ditaburkan di atas air panas sedikit demi
sedikit hingga mengembang sambil diaduk. Setelah terbentuk larutan kemudian
dimasukkan dalam labu ukur 100,0 ml dan ditambah aquadest hingga 100,0 ml lalu
digojog.
e. Pembuatan larutan asam asetat
Larutan asam asetat yang diujikan dalam penelitian meliputi dosis 100
mg/kgBB dan 150 mg/kgBB. Maka perhitungan kebutuhan asam asetat dengan
volume pemberian 0,5 ml/20 gramBB mencit adalah sebagai berikut:
Larutan asam asetat dosis 100 mg/kgBB
= 2,0 mg/20 gramBB = 2,0 mg/0,5 ml
= 4,0 mg/ml = 400 mg/100 ml
= 0,4 g/100 ml = 0,4%
Larutan asam asetat 0,4% dibuat dengan cara mengambil asam asetat glasial
pro analisis dengan berat jenis (BJ) 1050 mg/ml sebanyak 0,38 ml dengan
mikropipet dan dimasukkan ke dalam labu ukur 100,0 ml dan ditambah aquadest
hingga 100,0 ml.
Larutan asam asetat dosis 150 mg/kgBB
= 3,0 mg/20 gramBB = 3,0 mg/0,5 ml
= 0,6 g/100 ml = 0,6%
Larutan asam asetat 0,6% dibuat dengan cara mengambil asam asetat glasial
pro analisis dengan berat jenis (BJ) 1050 mg/ml sebanyak 0,57 ml dengan
mikropipet dan dimasukkan ke dalam labu ukur 100,0 ml dan ditambah aquadest
hingga 100,0 ml.
f. Pembuatan suspensi parasetamol dalam CMC Na 0,5%
Suspensi parasetamol yang diujikan dalam penelitian ini meliputi dosis 65
mg/kgBB dan 91 mg/kgBB, maka perhitungan kebutuhan parasetamol dengan
volume pemberian 0,5 ml/20 gramBB mencit adalah sebagai berikut:
Suspensi parasetamol dosis 65 mg/kgBB
= 1,30 mg/20 gramBB
= 1,30 mg/0,5 ml
= 2,60 mg/ml
Suspensi parasetamol 2,60 mg/ml dibuat dengan cara menimbang dengan
seksama serbuk parasetamol sebanyak 130,0 mg, setelah itu dimasukkan ke dalam
labu ukur 50,0 ml dan ditambah CMC Na 0,5% hingga 50,0 ml.
Suspensi parasetamol dosis 91 mg/kgBB
= 1,82 mg/20 gramBB
= 1,82 mg/0,5 ml
= 3,64 mg/ml
Suspensi parasetamol 3,64 mg/ml dibuat dengan cara menimbang dengan
seksama serbuk parasetamol sebanyak 182,0 mg, setelah itu dimasukkan ke dalam
g. Pembuatan suspensi ekstrak etanol daun kepel dalam CMC Na 0,5%
Suspensi ekstrak etanol daun kepel yang diujikan dalam penelitian ini
adalah dosis 560 mg/kgBB dan 672 mg/kgBB, maka perhitungan kebutuhan ekstrak
etanol daun kepel dengan volume pemberian 0,5 ml/20 gramBB mencit adalah
sebagai berikut:
Suspensi ekstrak etanol daun kepel dosis 560 mg/kgBB
= 11,2 mg/20 gramBB
= 11,2 mg/0,5 ml
= 22,40 mg/ml
Suspensi ekstrak etanol daun kepel 22,40 mg/ml dibuat dengan cara
menimbang dengan seksama ekstrak kental sebanyak 560,0 mg, setelah itu
dimasukkan ke dalam labu ukur 25,0 ml dan ditambah CMC Na 0,5% hingga 25,0
ml.
Suspensi ekstrak etanol daun kepel dosis 672 mg/kgBB
= 13,4 mg/20 gramBB
= 13,4 mg/0,5 ml
= 26,80 mg/ml
Suspensi ekstrak etanol daun kepel 26,80 mg/ml dibuat dengan cara
menimbang dengan seksama ekstrak kental sebanyak 670,0 mg, setelah itu
dimasukkan ke dalam labu ukur 25,0 ml dan ditambah CMC Na 0,5% hingga 25,0
2. Pemilihan Hewan Uji
Hewan uji yang digunakan yaitu mencit betina, galur Swiss, berat 20-30 gram, umur 2-3 bulan. Semua hewan uji dipelihara dengan kondisi perlakuan yang
sama meliputi: pakan, minum, kandang, dan alasnya. Sebelum digunakan dalam
percobaan, semua hewan uji diadaptasikan terlebih dahulu dengan kondisi yang
sama. Bila akan digunakan dalam perlakuan, hewan uji dipuasakan terlebih dahulu
selama ± 18-22 jam tanpa diberi makan, tetapi tetap diberi minum. Hal ini bertujuan
untuk mengurangi variasi akibat adanya makanan.
3. Penetapan Kriteria Geliat
Respon yang diamati pada uji efek analgetik ini berupa geliat. Kriteria geliat
perlu ditetapkan untuk mendapatkan geliat yang hampir sama. Pedoman gerakan
mencit yang dianggap sebagai geliat adalah apabila mencit menarik kedua kaki ke
belakang dengan mengempiskan perutnya sehingga permukaan perut menempel
pada alas tempat berpijak mencit itu, yaitu alas pada kotak kaca tempat
pengamatan.
4. Uji Pendahuluan
a. Penetapan dosis asam asetat
Pada penetapan asam asetat digunakan asam asetat dengan dua peringkat
dosis yaitu 100 mg/kgBB dan 150 mg/kgBB. Sebanyak enam ekor hewan uji,
mencit betina, galur Swiss, berat 20-30 gram, umur 2-3 bulan yang telah dipuasakan ± 18-22 jam dibagi ke dalam dua kelompok. Masing-masing kelompok terdiri dari
tiga ekor mencit yang diberi asam asetat secara intraperitonial. Geliat mencit