3 ikan pindang. Pengolahan pindang dengan suhu tinggi dapat menghambat bakteri tetapi penanganan setelah pengolahan dapat mengaktivkan kembali bakteri sehingga daya awet ikan menjadi lebih singkat. Penggunaan bahan baku yang hampir busuk, wadah yang tidak higenis dan kondisi penyimpanan yang dapat menurunkan kualitas ikan pindang dan dapat menyebabkan penyakit. Kondisi penanganan dan pengolahan ikan yang demikian mengakibatkan mutu dan kualitas olahan ikan pindang menjadi rendah sehingga menyebabkan ikan lebih cepat busuk dan daya simpan ikan akan lebih singkat. Oleh karena itu perlu dilakukan penelitian untuk mengkaji perubahan mutu ikan pindang selama penyimpanan.
Tujuan Penelitian
Tujuan penelitian yaitu untuk menganalisis pengaruh penyimpanan terhadap kadar histamin dan bakteri penghasil histamin dari pindang badeng tongkol (Auxis rochei).
Hipotesis Penelitian
Penyimpanan akan mempengaruhi kadar histamin pada ikan pindang Penyimpanan akan mempengaruhi kadar TVB pada ikan pindang Penyimpanan akan mempengaruhi total bakteri pada ikan pindang
2
METODE
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Desember 2013 hingga April 2014. Ikan tongkol segar (Auxis rochei) diperoleh dari hasil penangkapan kapal satu hari melaut dengan alat mini purse seine di TPI Cisolok Palabuhanratu, Jawa Barat. Pengolahan ikan pindang bertempat di Pengolahan ikan Cisolok Palabuhanratu. Pengujian parameter mutu dilakukan di Balai Pengujian Mutu dan Pengolahan Hasil Perikanan dan Kelautan DKI Jakarta (BPMPHPK DKI Jakarta), Laboratorium Pengawasan Perikanan Nusantara Palabuhanratu (PPN Palabuahanratu), Laboratorium Terpadu dan Laboratorium Kesehatan Masyarakat Veteriner Fakultas Kedokteran Hewan dan Bioteknologi II Fakultas Perikanan dan Ilmu Kelautan IPB.
Bahan dan Alat
Bahan baku penelitian adalah ikan tongkol (Auxis rochei) segar dengan panjang 25–30cm, berat 120–170 gram per ekor dan sampel ikan sebanyak ±205 ekor atau ±35 kg. Bahan-bahan lainnya adalah metanol, resin penukar ion (dowex1-x800-100-mesh), aquades, HCl, NaOH, H3PO4, ortoptalatdikarboksilaldehide (OPT), larutan TCA, asam borat, K2CO3, indikator conway, larutan Butterfield’s Phospate Buffered, Plate Count Agar (PCA), Media
4
niven (0,5% trypton, 0,5% yeast ekstrak, 1% L-histidin, 0,1% CaCO3, 0,5% NaCl, 2% agar, 0,0018% phenol red).
Alat yang digunakan adalah spektrofluorometer tipe Varian Cary Eclipse FL0811M007, cawan conway, kertas saring, botol bening 100 mL laminar, inkubator Dumedpower tipe DIC-104-S, shaker, autoklaf GEA/SMIC Type LSB 35 L.
Tahapan Penelitian
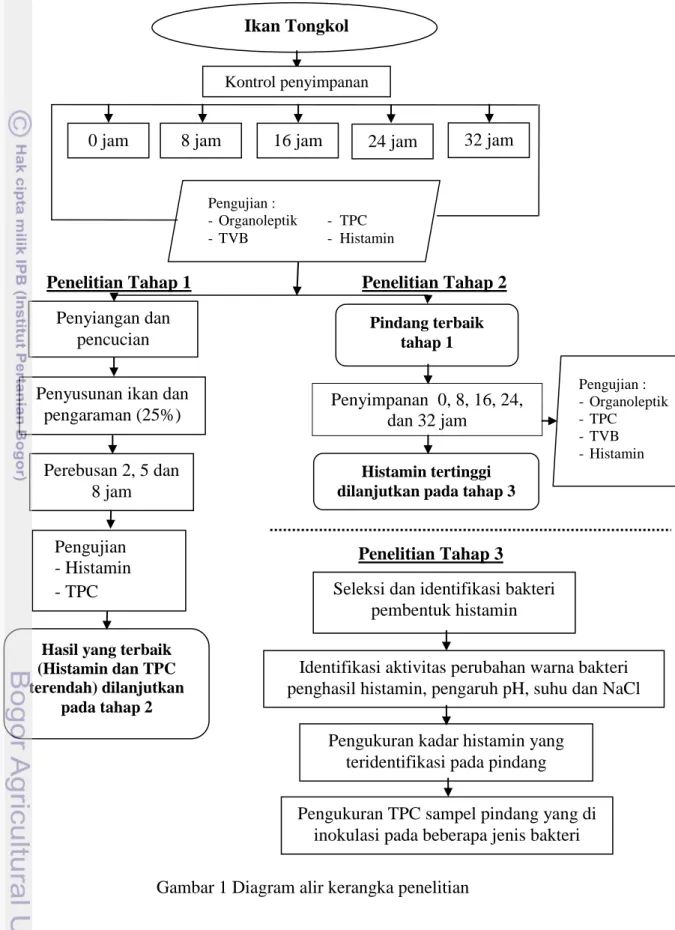
Penelitian ini terdiri dari dua tahap, yaitu tahap pendahuluan ikan tongkol segar disimpan pada waktu penyimpanan 0 jam, 8 jam, 16 jam, 24 jam dan 32 jam (sebagai kontrol) dan dilakukan pengujian organoleptik, TPC, TVB dan histamin.
Penelitian lanjutan terdiri dari tiga tahap. Tahap pertama yaitu pemindangan, ikan tongkol yang tanpa diberi perlakuan waktu penyimpanan dilakukan pemindangan dengan penambahan garam 25% dan waktu pemindangan yang berbeda (2 jam, 5 jam dan 8 jam) dan dilakukan pengujian histamin dan TPC. Hasil yang terbaik (histamin dan TPC terendah) dilanjutkan pada tahap ke-2. Tahap kedua yaitu penyimpanan, ikan hasil pemindangan terbaik (tahap pertama) disimpan pada suhu ruang yakni 0 jam, 8 jam, 16 jam, 24 jam dan 32 jam serta dilakukan pengujian organoleptik, histamin, TPC dan TVB. Sampel dengan histamin tertinggi selanjutnya dianalisis pada tahap ke-3. Tahap tiga terdiri dari seleksi dan identifikasi bakteri pembentuk histamin, aktivitas bakteri pembentuk histamin, pengaruh pH, suhu dan NaCl, serta mengukur kadar histamin yang diproduksi oleh bakteri serta mengukur TPC sampel pindang yang diinokulasi dengan beberapa jenis bakteri. Tahapan penelitian disajikan pada Gambar 1.
Prosedur Analisis Uji organoleptik
Uji organoleptik yang dilakukan dalam penelitian antara lain organoleptik ikan tongkol segar (SNI 01-2729.1-2006) dan uji hedonik untuk produk olahan pindang (SNI 01-2717.1-2009). Uji ini berfungsi untuk menilai suatu sifat organoleptik yang spesifik. Pada uji skoring diberikan penilaian terhadap mutu sensorik dalam suatu jenjang mutu. Tujuan uji skoring adalah pemberian suatu nilai atau skor tertentu terhadap karakteristik mutu. Pemberian skor dapat dilakukan dengan skala yang jumlah skalanya tergantung pada tingkat kelas yang dikehendaki. Pengujian organoleptik meliputi kenampakan mata, insang, lendir permukaan badan, daging, bau, rasa dan tekstur dengan nilai berkisar 1–9.
Penetapan total volatile base (TVB) Metode Conway (AOAC, 1995)
Penetapan ini bertujuan untuk menentukan jumlah kandungan senyawa-senyawa basa volatil yang terbentuk akibat degradasi protein. Prinsip analisis TVB adalah menguapkan senyawa-senyawa basa volatil (amin, mono-, di-, dan trimetilamin) pada suhu kamar selama 32 jam. Senyawa tersebut kemudian diikat oleh asam borat, kemudian dititrasi dengan larutan 0,1 N HCl. Sampel sebanyak 25 gram ditambah 75 mL larutan TCA 7% (w/v) kemudian diblender selama 1 menit, kemudian disaring dengan kertas saring sehingga filtrat yang diperoleh
5
Penelitian Tahap 2 Penelitian Tahap 1
Penelitian Tahap 3
berwarna jernih. Larutan asam borat 1 mL dimasukkan ke dalam inner chamber cawan conway lalu diletakkan tutup cawan dengan posisi hampir menutupi cawan.
Gambar 1 Diagram alir kerangka penelitian Ikan Tongkol
Pengujian :
-Organoleptik - TPC
-TVB - Histamin
Kontrol penyimpanan
0 jam 8 jam 16 jam 24 jam 32 jam
Penyusunan ikan dan pengaraman (25%) Perebusan 2, 5 dan
8 jam
Penyimpanan 0, 8, 16, 24, dan 32 jam
Hasil yang terbaik (Histamin dan TPC terendah) dilanjutkan pada tahap 2 Penyiangan dan pencucian Pindang terbaik tahap 1 Histamin tertinggi dilanjutkan pada tahap 3
Seleksi dan identifikasi bakteri pembentuk histamin Pengujian
-Histamin -TPC
Pengukuran kadar histamin yang teridentifikasi pada pindang Pengukuran TPC sampel pindang yang di
inokulasi pada beberapa jenis bakteri Identifikasi aktivitas perubahan warna bakteri penghasil histamin, pengaruh pH, suhu dan NaCl
Pengujian : - Organoleptik - TPC
- TVB - Histamin
6
Filtrat dimasukkan ke dalam outer chamber disebelah kiri dengan memakai pipet ukuran 1 mL yang lain, kemudian ditambahkan 1 mL larutan K2CO3 jenuh ke dalam outer chamber sebelah kanan sehingga filtrat dan K2CO3 tidak tercampur. Cawan segera ditutup dan digerakkan memutar sehingga kedua cairan di outer chamber tercampur. Pengerjaan blanko dilakukan dengan prosedur yang sama tetapi filtrat diganti dengan larutan TCA 7% (w/v).
Kedua cawan conway tersebut disimpan dalam inkubator pada suhu 37oC selama 2 jam. Larutan asam borat dalam inner chamber cawan conway dititrasi dengan larutan HCl 0,2 N (Vo blanko) menggunakan pipet volume sampai berubah warna menjadi merah muda (V1 sampel). Contoh perhitungan disajikan pada Lampiran 1.
Kadar TVB-N (mg/100g) =
Vol ,titrasi sampel −Vol ,titrasi blanko x N HCl x Ar N x faktor pengenceran x 100 bobot Bobot sampel
Keterangan :
Ar N : 14
Faktor pengenceran : 60
N HCl : 0,0191
Analisis Kadar Histamin (SNI 2354.10: 2009)
Analisis kadar histamin dilakukan dengan menggunakan spektroflorometri, yang didasarkan pada pengukuran fluorosensi. Prinsip metode tersebut adalah histamin diekstrak dari jaringan daging sampel (BSN 2009a).
Prosedur analisis kadar histamin, yakni sampel diblender hingga homogen, kemudian ditimbang sebanyak 10±0,1 gram dalam beaker glass 250 mL dan ditambahkan 50 mL metanol. Sampel dalam keadaan tertutup dipanaskan di dalam waterbath selama 15 menit pada suhu 60 ºC dan didinginkan dalam suhu kamar. Sampel tersebut dituang ke dalam labu takar 100 mL dan ditepatkan hingga tanda tera dengan metanol. Setelah itu dilakukan penyaringan menggunakan kertas saring dan filtrat ditampung dalam botol contoh. Filtrat dapat disimpan dalam refrigerator.
Glass wool yang telah diberi aquades dimasukkan ke dalam kolom resin setinggi 1,5 cm. Resin netral dalam medium air dimasukkan ke kolom resin setinggi 8 cm dengan volume air di atas resin setinggi 1 cm. Labu takar 50 mL yang berisi 5 mL HCl 1 N diletakkan di bawah kolom resin untuk menampung elusi contoh yang dilewatkan pada kolom resin.
Filtrat contoh sebanyak 1 mL dipipet ke dalam kolom resin, kran kolom resin dalam posisi terbuka dan hasil elusi dibiarkan menetes lalu ditampung dalam labu takar 50 mL. Aquades ditambahkan pada saat tinggi cairan 1 cm di atas resin dan cairan dibiarkan terelusi. Prosedur tersebut diulangi hingga hasil elusi dalam labu takar tepat 50 mL. Hasil elusi dapat disimpan dalam refrigerator.
Tiga tabung reaksi 50 mL disiapkan untuk sampel, standar, dan blanko. Filtrat sampel, larutan standar kerja, dan blanko (HCl 0,1 N) dipipet masing-masing sebanyak 5 mL. Ke dalam tabung reaksi tersebut berturut-turut ditambahkan 10 mL HCl 0,1 N dan diaduk; 3 mL NaOH 1 N dan diaduk, kemudian didiamkan selama 5 menit; 1 mL OPT 0,1% lalu diaduk dan didiamkan selama 4 menit; 3 mL H3PO4 3,57 N dan diaduk. Pengukuran flourescene
7 dilakukan terhadap sampel, standar, dan blanko sesegera mungkin dengan alat spektroflorometri pada panjang gelombang eksitasi 350 nm dan emisi 444 nm dalam waktu 90 menit. Contoh perhitungan disajikan pada Lampiran 2.
y = a + bx Keterangan: y : fluoresensi contoh a : intersep b : kemiringan x : konsentrasi contoh
Konsentrasi histamin (mg/kg) = x . (volume akhir (mL). faktor pengenceran) gram sampel
Analisis Total Mikroba (Total Plate Count) (SNI 01-2332.3-2006)
Prinsip kerja analisis TPC adalah pertumbuhan mikroorganisme setelah contoh diinkubasi dalam media agar pada suhu 35°C selama 48 jam, maka mikroorganisme tersebut akan tumbuh berkembang biak dengan membentuk koloni yang dapat langsung dihitung. Prosedur kerja analisis TPC adalah sebagai berikut: sampel ditimbang secara aseptik sebanyak 25 gram dan ditambah 225 mL larutan Butterfield’s Phospate Buffered, kemudian dihomogenkan selama 2 menit. Homogenat ini merupakan larutan hasil pengenceran 10-1. Sebanyak 1 mL homogenat diambil menggunakan pipet steril dan dimasukkan ke dalam botol berisi 9 mL larutan Butterfield’s Phospate Buffered sehingga diperoleh contoh dengan pengenceran 10-2. Pada setiap pengenceran dilakukan pengocokan minimal 25 kali. Hal yang sama dilakukan untuk pengenceran 10-3, 10-4, 10-5, dan seterusnya sesuai kondisi sampel. Selanjutnya untuk metode cawan agar tuang (Pour Plate Method), dipipet sebanyak 1 mL dari setiap pengenceran dan dimasukkan ke dalam cawan petri steril secara duplo menggunakan pipet steril. Masing-masing cawan yang sudah berisi sampel, ditambahkan 12-15mL media Plate Count Agar (PCA) yang sudah didinginkan hingga mencapai suhu 45 °C. Setelah agar menjadi padat, cawan petri yang telah berisi agar dan larutan sampel tersebut dimasukkan ke dalam inkubator dengan posisi terbalik selama 48 jam pada suhu 35 °C. Selanjutnya dilakukan pengamatan dengan menghitung jumlah koloni bakteri yang ada di dalam cawan petri menggunakan alat penghitung koloni. Jumlah koloni yang dihitung adalah cawan petri yang mempunyai koloni bakteri antara 25-250 koloni.
Isolasi dan Karakterisasi Bakteri Pembentuk Histamin (Niven et al. 1981) Prinsip analisis bakteri pembentuk histamin adalah enterobactericeae akan mengubah histidin menjadi histamin melalui proses dekarboksilasi yang akan menaikkan pH dan mengubah warna pada media.
Media modifikasi niven agar dipersiapkan dengan cara mencampurkan semua bahan, yaitu 0,5% trypton, 0,5% yeast extract, 1% L-histidin monohydrochlorid monohydrat, 0,1% CaCO3, 0,5% NaCl, 2,5% agar, dan 0,0018% phenol red, kemudian dimasukkan ke dalam erlenmeyer lalu diencerkan menggunakan aquades hingga 1000 mL. Selanjutnya dipanaskan hingga mendidih
8
dan diatur pada pH 5,3 kemudian disterilisasi menggunakan otoklaf pada suhu 121 °C selama 10 menit.
Sampel sebanyak 25 gram dimasukkan ke dalam botol yang berisi 225 mL larutan Butterfield’s Phospate Buffered, kemudian dilumatkan dengan blender hingga larutan homogen. Homogenat ini merupakan larutan pengenceran 10-1. Campuran tersebut diambil 1 mL dan dimasukkan ke dalam botol berisi 9 mL larutan Butterfield’s Phospate Buffered sehingga diperoleh contoh dengan pengenceran 10-2, kemudian dikocok sampai homogen. Pengenceran dilakukan hingga 10-4. Satu mL larutan sampel hasil setiap pengenceran dimasukkan ke dalam cawan petri, lalu 12-15 mL media niven agar cair yang sudah didinginkan hingga mencapai suhu 45°C dituangkan ke dalam masing-masing cawan yang sudah berisi sampel. Setelah agar menjadi padat, cawan petri yang telah berisi agar dan larutan sampel tersebut dimasukkan ke dalam inkubator dengan posisi terbalik selama 48 jam pada suhu 37°C. Selanjutnya dilakukan penghitungan jumlah koloni berwarna merah muda dengan halo pink pada latar belakang awal tanpa bakteri berwarna kuning atau orange setelah ditumbuhkan bakteri latar belakang berubah menjadi warna pink sampai ungu kemerahan. Koloni tersebut merupakan koloni bakteri pembentuk histamin.
Isolasi Bakteri Pembentuk Histamin (modifikasi Niven et al. 1981)
Isolasi bakteri pembentuk histamin dilakukan dengan mengambil 0,1 mL dari larutan pengenceran 10-1 dan dimasukkan ke dalam cawan petri, kemudian niven agar cair dituangkan ke dalam cawan dan dihomogenkan dengan cara cawan digerakkan membentuk angka 8. Setelah agar menjadi padat, cawan petri diinkubasi pada suhu 35oC selama 4 hari (Chen et al. 2009). Koloni yang telah diinkubasi selama 4 hari berwarna putih, pink atau ungu digoreskan pada agar miring (Niven’s Agar) dan digoreskan pada media trypticase soy agar (TSA) untuk memperoleh kultur murni. Penggoresan yang sempurna akan menghasilkan koloni yang terpisah. Isolat bakteri digolongkan murni jika diperoleh bentuk sel dan morfologi koloni yang seragam dan dijadikan sebagai stok kultur untuk diidentifikasi lebih lanjut.
Identifikasi Bakteri Pembentuk Histamin (Cowan and Steel 1982; Holt et al.
1994)
Pewarnaan Gram
Pewarnaan Gram merupakan uji awal untuk identifikasi bakteri. Tahapan ini diawali dengan fiksasi inokulum isolat bakteri yang berasal dari Niven Agar. Preparat yang sudah kering kemudian ditambah pewarna crystal violet-ammonium oxalat dan dicuci pada air mengalir serta dikeringkan. Preparat ditambah iodin selama 1 menit dan dicuci. Kemudian tahap dekolorisasi dengan penambahan etanol 95% pada preparat untuk menghilangkan warna biru (±30 detik). Tahap akhir preparat diberikan safranin, pencucian dan dilakukan pengamatan di bawah mikroskop. Bakteri pembentuk histamin merupakan Gram negatif yang ditandai dengan warna merah muda, berbentuk batang (curve atau straight), dan membentuk koloni sel tunggal.
9 Uji motilitas
Uji motilitas dilakukan dengan cara inokulum dari Niven Agar diinokulasikan ke dalam media motility test medium (MTM) dengan kedalaman 2/3 dari ketinggian media MTM dan diinkubasikan pada suhu 37±2°C selama 18-24 jam. Reaksi positif ditunjukkan dengan adanya pertumbuhan bakteri yang berdifusi secara sirkular dari garis tusukan.
Uji Indol
Uji Indol: sebanyak 5,0 mL dari media Trypton (atau Tryptophan) Broth dipindahkan ke tabung uji sucihama. Selanjutnya ditambah 0,2-0,3 mL reagen Kovacs’, jika bakteri histamin tidak menyebabkan munculnya warna merah bata di permukaan media ini reaksi dianggap negatif.
Uji Katalase
Uji katalase dilakukan dengan cara diambil 1 ose bakteri dan dipindahkan pada kaca objek. Kemudian ditetesi larutan H2O2 3%. Adanya enzim katalase ditandai dengan terbentuknya gelembung-gelembung oksigen yang terlihat seperti busa (Cowan 1982)
Uji oksidase
Uji oksidase dilakukan dengan cara sebanyak 1ose inokulum dari Niven Agar dan dipindahkan pada kertas oksidasi. Kemudian diberikan 2-3 tetes pereaksi oksidase dan dilakukan pengamatan. Reaksi positif ditunjukkan dengan terbentuknya warna biru tua pada kertas oksidasi.
Pertumbuhan pada media agar triple sugar iron (TSI)
Koloni dari media Niven Agar diinokulasikan pada media agar triple sugar iron (TSI) dengan cara digoreskan pada agar miring dan ditusukkan pada agar tegak kemudian diinkubasikan pada suhu 37±2°C selama 18-24 jam. Pertumbuhan bakteri akan menghasilkan warna merah (alkalin) pada agar miring dan asam (warna kuning) pada agar tegak serta tidak menghasilkan gas dan H2S. Simmons Citrate Agar
Simmons Citrate Agar: dengan menggunakan jarum, koloni tersebut dipindahkan dari TSI Agar kemudian digoreskan pada bagian miring dan ditusukkan pada bagian tegak, kemudian diinkubasi pada suhu 37±2 oC selama 24-48 jam. Bakteri histamin akan tumbuh baik pada media ini dan mengubah warna media menjadi biru (hasil positif).
Fermentasi karbohidrat
Tujuan untuk mengetahui jenis bakteri yang memfermentasikan jenis karbohidrat tertentu. Perbenihan gula-gula yang digunakan adalah cair yang mengandung satu jenis karbohidrat (kadar 1%) dengan indikator phenol red. Jika, terjadi fermentasi, medium terlihat berwarna kuning karena perubahan pH menjadi asam.
Koloni bakteri dari media TSA diambil sedikit dengan ose steril dan diinokulasi pada perbenihan karbohidrat. Inkubasi pada suhu 370C selama 24-48 jam. Terjadinya warna kuning pada medium berarti tes positif dari warna dasar media yaitu merah (Suyati 2010).
10
Pembacaan hasil identifikasi
Hasil dapat dinyatakan positif bakteri histamin, apabila dalam uji tersebut lebih dari 90 % atau dapat dinyatakan negatif apabila hasil uji-uji kurang dari 90%. Sifat-sifat bakteri pembentuk histamin
Masing-masing genus bakteri pembentuk histamin hasil identifikasi, diamati kemampuannya dalam menghasilkan histamin dan pengaruh lingkungan dalam pertumbuhannya yaitu pengaruh pH, suhu dan konsentrasi NaCl.
Uji aktivitas bakteri pembentukan histamin (Tanudjaja 1998)
Isolat bakteri murni dari masing-masing genus yang diperoleh diinokulasikan ke dalam larutan pengencer, kemudian dilakukan penghitungan jumlah bakteri dengan menggunakan Mc Farlan dan Neubauer hingga dicapai jumlah bakteri yang seragam dari masing-masing genus.
Larutan isolat 0,02 mL ditumbuhkan ke dalam medium Niven’s Agar yang telah dilubangi dengan diameter 0,45. Kemudian inkubasi selama 48 jam pada suhu 37oC. Pengamatan dilakukan dengan mengukur diameter lingkaran kuning yang terbentuk.
Pengaruh pH dan suhu
Isolat bakteri murni yang diperoleh diinokulasikan ke dalam medium Nutrien Broth yang mempunyai pH yang berbeda yaitu 5, 6, 7, 8, dan 9. Kemudian diinkubasi pada suhu yang berbeda yaitu 10, 30, 37 dan 50oC selama 48 jam. Penghitungan pengaruh pH dan suhu dilakukan dengan menggunakan spektrofotometri dengan panjang gelombang 660 nm berdasarkan metode Hardy dan Smith (1976).
Pengaruh konsentrasi NaCl
Isolat bakteri murni yang diperoleh diinokulasikan ke dalam medium Nutrien Broth yang telah ditambah NaCl dengan konsentrasi yang berbeda yaitu 0, 15%, 20%, 25%. pH dan suhu medium pada konsentrasi NaCl diatur sesuai hasil penelitian pengaruh suhu dan pH sebelumnya. Inkubasi dilakukan selama 48 jam. Penghitungan pengaruh konsentrasi NaCl dilakukan dengan menggunakan spektrofotometri dengan panjang gelombang 660 nm berdasarkan metode Hardy dan Smith (1976).
Pengukuran kadar histamin dari bakteri yang teridentifikasi
Isolat bakteri uji ditumbuhkan pada 5 mL medium (Trypticase soy broth-histidine medium) TSBH (Taylor et al. 1979) dalam tabung, diinkubasikan selama 18 jam pada suhu 37oC, dengan pengocokan menggunakan shaker 125g (Mangunwardoyo et al. 2007). Analisis kadar histamin menggunakan modifikasi metode spektrofotometri menurut (Hardy dan Smith 1976). Pengukuran kadar histamin dilakukan dalam 2 tahap. Tahap 1 (persiapan): sebanyak 5 mL suspensi isolat bakteri dalam medium TSBH kemudian ditambahkan 70 mL asam trikloroasetat (TCA) 2,5 % lalu dinetralkan dengan larutan KOH 1 N. Tahap ke-2: sebanyak 1 g amberlite resin dimasukkan ke dalam kolom sepanjang 30 cm, kemudian dicuci dengan 150 mL larutan bufer asetat 0,2 N pH 4,6 dijaga agar tidak kering. Setelah itu TCA yang telah ditambah hasil fermentasi seperti diuraikan pada tahap 1 (mengatur jumlah tetesan 9 -10 tetes/menit). Kemudian
11 kolom dielusi dengan 25 mL HCl 0,2 N. Setelah itu tambahkan 1 mL eluen dengan 15 mL larutan Na2CO3 5% dan 2 mL larutan diazonium dan dinginkan larutan pada suhu 0oC selama 10 menit. Absorbansi diukur pada panjang gelombang 495 nm dengan menggunakan spektrofotometri UV-VIS. Blanko dibuat dengan prosedur yang sama menggunakan TCA 2,5% netral yang tidak ditambah bakteri.
Pengukuran TPC sampel pindang yang diinokulasi pada beberapa jenis bakteri (SNI 01-2332.3-2006)
Suspensi dibuat pada masing-masing bakteri yang berumur 24 jam (kode H, K.o, M, K.p, E dan P) dengan standar Mc.Farland I atau setara dengan 3,0 x 108. Pindang ikan tongkol disiapkan dan ditimbang sebanyak 20 gram dan dimasukan ke dalam cawan streril dan diberi kode susai dengan kode bakteri. (Catatan konsentrasi bakteri sudah berkurang 10x menjadi 107). Kemudian sebanyak 2 mL suspensi dimasukkan ke dalam pindang ikan tongkol secara merata dan dimasukkan ke dalam pengencer 180 mL untuk pindang ikan tongkol yang sudah diberi suspensi bakteri (Catatan konsentrasi bakteri sudah berkurang 10x menjadi 106). Kemudian dilakukan pengenceran sampai 10-9. Setelah itu, dimasukan masing-masing 1 mL pengencer dari pengencer 10-3 sampai 10-9, secara berulang ke dalam cawan yang steril. Masukan medium PCA ke dalam cawan secara aseptic dan goyang-goyang membentuk angka 8, diamkan sampai membeku dan dimasukan ke dalam inkubator suhu 370C selama 2 x 24 jam, dilakukan perhitung.
Analisis Data (Steel and Torrie 1993)
Data hasil analsis kadar histamin, TVB, TPC, dan jumlah bakteri pembentuk histamin dianalisis menggunakan program Microsoft Excel 2007 dan SPSS.Rancangan percobaan yang digunakan adalah Rancangan Acak Lengkap (RAL) yaitu waktu penyimpanan yang terdiri dari 5 taraf pengamatan yakni 0 jam, 8 jam, 16 jam, 24 jam dan 32 jam. Rumus umum RAL yaitu :
Yij = µ + αi + εij Keterangan :
Yij = Nilai pengamatan pada perbedaan waktu penyimpanan perlakuan ke-i dan ulangan ke-j
µ = Rataan umum
αi = Pengaruh perlakuan ke-i εij = Galat
Hipotesis :
H0: μt = 0, artinya tidak ada perbedaan di antara semua nilai tengah perlakuan; H1: μt ≠ 0, artinya minimal ada sepasang nilai tengah perlakuan yang berbeda.
Pengujian data organoleptik dianalisis menggunakan Kruskall-Walis dengan uji chi square. Apabila nilai x2 hitung > x2 tabel maka tolak Ho. Prosedur pengujian kruskall wallis menggunakan rumus.
12 1 H = 12 𝑛(𝑛 + 1) 𝑅𝑖2 𝑛𝑖 − 3(𝑛 + 1) 2 FK = 𝑛 − 1 𝑛(𝑛 + 1) 𝑇 3 H = H FK Keterangan:
ni = banyaknya pengamatan tiap perlakuan atau jumlah panelis n = banyaknya data
Ri = jumlah rata-rata tiap perlakuan ke-i
T = banyaknya pengamatan yang seri dalam tiap ulangan H’ = H terkoreksi (ki-kuadrat)
FK = faktor koreksi
Apabila hasil uji chi-square menunjukkan di antara perlakuan tersebut memberikan pengaruh yang berbeda terhadap parameter yang diamati maka pengujian dilanjutkan dengan uji lanjut multiple comparison dengan menggunakan Uji Dunn.
3
HASIL DAN PEMBAHASAN
Karakteristik Ikan Segar Nilai organoleptik ikan segar
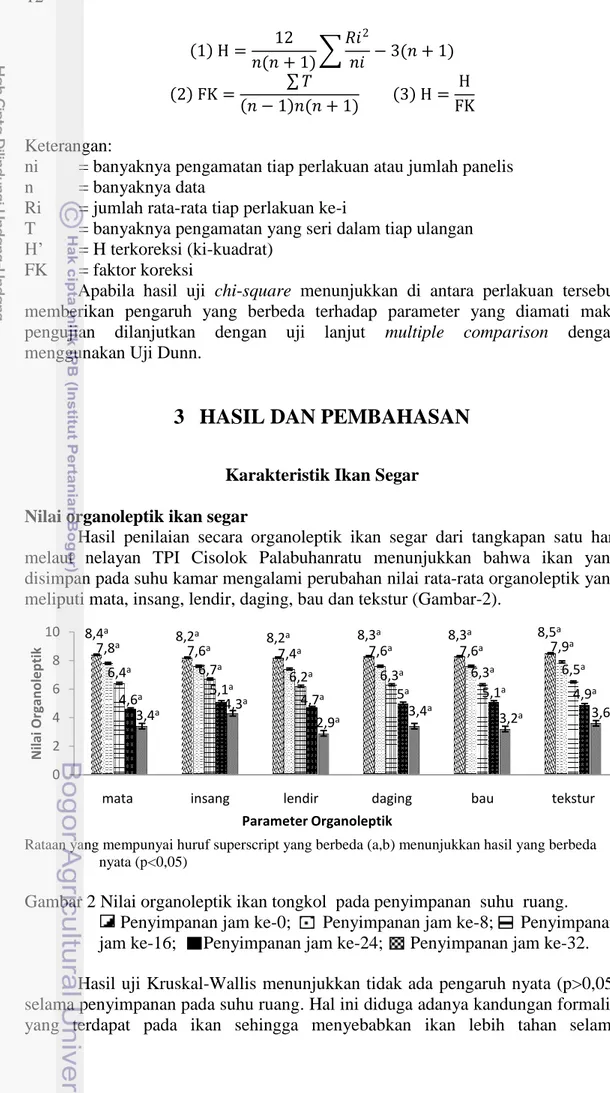
Hasil penilaian secara organoleptik ikan segar dari tangkapan satu hari melaut nelayan TPI Cisolok Palabuhanratu menunjukkan bahwa ikan yang disimpan pada suhu kamar mengalami perubahan nilai rata-rata organoleptik yang meliputi mata, insang, lendir, daging, bau dan tekstur (Gambar-2).
Rataan yang mempunyai huruf superscript yang berbeda (a,b) menunjukkan hasil yang berbeda nyata (p<0,05)
Gambar 2 Nilai organoleptik ikan tongkol pada penyimpanan suhu ruang. Penyimpanan jam ke-0; Penyimpanan jam ke-8; Penyimpanan jam ke-16; Penyimpanan jam ke-24; Penyimpanan jam ke-32. Hasil uji Kruskal-Wallis menunjukkan tidak ada pengaruh nyata (p>0,05) selama penyimpanan pada suhu ruang. Hal ini diduga adanya kandungan formalin yang terdapat pada ikan sehingga menyebabkan ikan lebih tahan selama
8,4a 8,2a 8,2a 8,3a 8,3a 8,5a 7,8a 7,6a 7,4a 7,6a 7,6a 7,9a 6,4a 6,7a 6,2a 6,3a 6,3a 6,5a 4,6a 5,1a 4,7a 5a 5,1a 4,9a 3,4a 4,3 a 2,9a 3,4 a 3,2a 3,6a 0 2 4 6 8 10
mata insang lendir daging bau tekstur
N ilai Or gan o le p tik Parameter Organoleptik