Laporan Praktikum Nama : Diana Agustini Raharja
Mikrobiologi NIM : J3L112168
Kelas/kelompok : C P1/1
PJP : M. Arif Mulya, S. Pi.
Asisten : 1. Yuriska Sekar Rani 2. Lia Suliani
3. Ramdhani
KUANTITASI MIKROBA: METODE PENGHITUNGAN
TIDAK LANGSUNG
PROGRAM KEAHLIAN ANALISIS KIMIA PROGAM DIPLOMA
INSTITUT PERTANIAN BOGOR BOGOR
Pendahuluan
Hal mendasar yang juga perlu diperhatikan dalam Mikrobiologi, yaitu analisis kuantitatif terhadap suatu bahan. Analisis ini sangat penting untuk mengetahui jumlah mikroorganisme yang ada pada suatu sampel tertentu mengandung banyak mikroorganisme atau sebaliknya (Ferdiaz 1993). Pengamatan bakteri dapat dilakukan secara individual maupun secara kelompok dalam bentuk koloni. Bila bakteri yang ditumbuhkan di dalam medium yang tidak cair, maka akan terjadi suatu kelompok yang dinamakan koloni. Bentuk koloni berbeda-beda untuk setiap spesies dan bentuk tersebut merupakan ciri khas bagi suatu spesies tertentu (Waluyo 2007).
Beberapa cara yang dapat digunakan untuk menghitung atau mengukur jumlah jasad renik di dalam suatu suspensi atau bahan. Cara tersebut dibedakan atas beberapa kelompok yaitu, perhitungan jumlah sel, terdiri dari hitungan mikroskopik, hitungan cawan, dan MPN (most probable number); perhitungan massa sel secara langsung, terdiri dari volumetrik, gravimetrik, dan kekeruhan (turbidimetri); perhitungan massa sel secara tidak langsung, terdiri dari analisis komponen sel, analisis produk katabolisme, dan analisis konsumsi nutrien (Ferdiaz 1993). Sedangkan menurut Irianto (2007), ada beberapa cara penghitungan jumlah mikroba, yaitu cara penghitungan pada lempeng pembiakan, cara menghitung langsung (metode kaca objek), metode ukur kekeruhan, metode turbidimetri, nefelometri, serta dengan jumlah perkiraan terdekat (JPT). Cara penghitungan pada lempeng pembiakan disebut juga metode penghitungan bakteri hidup atau metode penghitungan koloni. Pada penghitungan koloni, dilakukan penyimpanan pada suhu yang sesuai. Oleh karena itu, suatu bakteri dapat tumbuh menjadi satu koloni yang terhitung mewakili jumlah bakteri hidup yang terdapat dalam tiap volume pengenceran yang digunakan.
Prinsip dari metode hitungan cawan adalah menumbuhkan sel mikroba yang masih hidup pada metode agar, sehingga sel mikroba tersebut akan berkembang biak dan membentuk koloni yang dapat dilihat langsung dengan mata tanpa menggunakan mikroskop. Metode hitungan cawan dapat dibedakan atas dua cara, yaitu metode tuang (pour plate) dan metode permukaan atau sebar (surface atau spread plate) (Fardiaz 1993). Untuk memenuhi persyaratan statistik, cawan yang dipilih untuk dihitung harus memiliki 30-300 koloni. Oleh karena itu, dilakukan sederatan pengenceran dan pencawan. Jumlah mikroba dalam sampel ditentukan dengan mengalikan jumlah koloni dengan faktor pengenceran pada cawan yang bersangkutan. Satuan yang digunakan untuk menyatakan jumlah koloni bakteri adalah CFU/mL (CFU = colony forming units)(Waluyo 2008).
Tujuan
Praktikum dilakukan bertujuan mempelajari cara melakukan pengenceran serial dan menentukan kepadatan sel bakteri dalam suatu sampel dari jumlah koloni bakteri yang terbentuk dengan metode hitungan cawan baik cawan sebar maupun cawan tuang.
Alat dan Bahan
Broth, media Plate Count Agar dalam cawan petri, tabung-tabung berisi 9 mL larutan fisiologis (0,85% NaCl), alkohol 70%, dan Erlenmeyer yang berisi media Plate Count Agar cair bersuhu sekitar 50°C (hangat).
Prosedur Kerja
Suasana steril harus diciptakan dari awal praktikum hingga akhir praktikum. Oleh karena itu, tangan dan area meja yang digunakan dibasahi dengan alkohol 70%. Selain itu, pengerjaan dilakukan di dekat api untuk mengurangi atau mencegah bakteri kontaminan menempel pada alat maupun media. Larutan pengencer dilakukan dengan cara sebanyak 1 mL suspensi bakteri dalam media Lactose Broth diambil dengan mikropipet dan dimasukkan ke dalam tabung pertama (10-1) yang berisi larutan fisiologis, kemudian tabung dikocok homogen. Tabung kedua (10-2) diisi dengan 1 mL larutan pada tabung pertama dan dikocok homogen. Percobaan diulangi sampai pengenceran 10-7.
Metode hitungan cawan sebar dilakukan dengan cara sebanyak 0,1 mL larutan fisiologis hasil pengenceran 10-7 diambil dengan mikropipet dan diteteskan pada cawan petri yang berisi media Plate Count Agar, kemudian disebar atau diratakan dengan menggunakan spreader sebanyak tiga kali ulangan. Spreader yang digunakan harus dalam keadaan sudah steril, yaitu dengan cara direndam dalam alkohol 70% dan dipanaskan dengan api. Begitu juga tip yang digunakan untuk mikropipet harus dalam keadaan steril. Percobaan diulangi untuk larutan fisiologis hasil pengenceran 10-6.
Metode hitungan cawan tuang dilakukan dengan cara sebanyak 0,1 mL larutan fisiologis hasil pengenceran 10-7 diambil dengan mikropipet dan diteteskan pada cawan petri kosong yang steril. Setelah itu, cawan petri tersebut dituangkan media Plate Count Agar sebanyak kira-kira 12 mL yang masih dalam keadaan hangat. Media Plate Count Agar diratakan dengan cara cawan petri diletakkan pada meja datar dan digerakkan dengan cara membentuk angka delapan. Hal ini dilakukan agar ketebalan media Plate Count Agar seragam. Percobaan diulangi untuk larutan fisiologis hasil pengenceran 10-6 dan 10-5. Setelah selesai, semua cawan petri diberi pelabelan dan diisolasi pada bagian mulut cawan. Kemudian cawan-cawan petri tersebut dimasukkan ke dalam plastik steril. Plastik dapat disterilkan dengan cara disemprotkan alkohol 70% bagian dalamnya. Semua cawan petri diinkubasi dalam inkubator selama 24 jam.
Data dan Hasil Pengamatan
Berikut ini data dan hasil pengamatan yang dilakukan pada metode hitungan cawan baik cawan sebar maupun cawan tuang.
Tabel 1 Hasil pengamatan koloni bakteri pada cawan tuang sebar dan cawan tuang Jenis cawan Jumlah koloni Jumlah bakteri(CFU/mL)
10-5 10-6 10-7
Cawan sebar - 11 5 Tidak dapat dihitung
Cawan tuang TBUD 0 0 Tidak dapat dihitung
Gambar 1 Koloni bakteri pada larutan fisiologis 10-6 (a) dan 10-7 (b) dengan metode cawan sebar
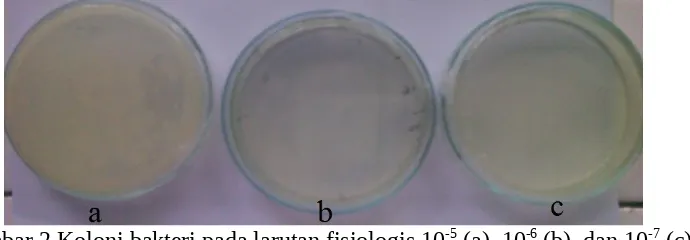
Gambar 2 Koloni bakteri pada larutan fisiologis 10-5 (a), 10-6 (b), dan 10-7 (c) dengan metode cawan tuang
Pembahasan
Proses sterilisasi dibutuhkan sebelum memulai maupun mengakhiri sebuah pekerjaan di laboratorium dengan menggunakan teknik aseptik. Teknik aseptik dilakukan dengan cara tangan dan area meja yang digunakan disemprotkan dengan alkohol 70%. Spreader, cawan petri, dan tip yang digunakan juga harus steril. Spreader dibuat steril dengan cara direndam dalam alkohol 70% yang kemudian dipanaskan dalam api ketika hendak digunakan. Cawan petri baik yang masih kosong maupun yang sudah berisi media Plate Count Agar harus distrelisasikan terlebih dahulu dalam autoclave. Tip yang digunakan juga harus steril. Kotak tip baru dibuka ketika tip akan dipasangkan dengan mikropipet dan segera ditutup agar kontaminan dari udara tidak sempat menempel pada tip. Setiap pengerjaan dilakukan di dekat api spirtus. Hal tersebut dilakukan untuk membunuh mikroorganisme yang tidak diinginkan (kontaminan) agar diperoleh pengukuran yang akurat.
tip dapat terbawa oleh cairan. Tip yang digunakan untuk memindahkan cairan selalu diganti setiap pemindahan cairan agar sterilisasi dapat terjaga.
Pada percobaan larutan yang digunakan untuk pengenceran, yaitu larutan fisiologis 0,85% yang mengandung 0,85 gram NaCl dalam 100 mL air. Selain larutan fisiologis, dapat pula menggunakan phospat buffer salin (PBS) dan akuades steril. Larutan phospat buffer salin ini merupakan larutan yang paling baik jika digunakan karena selain mengandung ion-ion yang baik untuk bakteri juga mengandung NaCl seperti larutan fisiologis. Akuades steril merupakan pilihan terakhir yang dapat digunakan, karena akuades tidak baik untuk bakteri akibat adanya pengaruh osmotik dalam air akuades. Jika akuades steril ini digunakan maka pengerjaan pengenceran bertingkat sebaiknya dilakukan cepat agar tidak memengaruhi pertumbuhan bakteri ketika berada dalam media agar.
Media agar yang digunakan baik pada cawan tuang dan cawan sebar adalah Plate Count Agar. Plate Count Agar merupakan media bentuk padat yang komposisinya sintetik dan memiliki fungsi umum. Plate Count Agar sebagai media mikroorganisme aerob dengan inokulasi di atas permukaannya. Komposisi yang terkandung dalam Plate Count Agar di antaranya ekstrak ragi 2,5 g/L, kasein 5,0 g/L, glukosa 1,0 g/L, dan agar 15.0 g/L. Media ini dapat dibuat dengan cara dicampurkan 23,5 g media Plate Count Agar dalam 1 L air distilasi yang kemudian dididihkan sampai larut sempurna. Setelah larut sempurna, media Plate Count Agar disterilkan terlebih dahulu dengan autoclave pada suhu 121°C selama 15 menit.
Pada cawan sebar, media Plate Count Agar sudah berada di cawan yang telah disterilkan dengan autoclave. Sedangkan pada cawan tuang, media tersebut berada pada Erlenmeyer dan media masih dalam keadaan hangat. Jika media pada cawan tuang terlalu panas, maka bakteri yang hidup di suhu ruang yang diteteskan dapat mati dan apabila sudah dalam keadaan dingin, media Plate Count Agar akan membeku sehingga sulit untuk dituangkan ke dalam cawan. Oleh karena itu, media Plate Count Agar yang sudah dingin sebaiknya dipanaskan kembali. Media Plate Count Agar yang berada dalam Erlenmeyer harus ditutup dengan menggunakan aluminium foil agar bakteri yang berasal dari udara (kontaminan) tidak masuk ke dalam media.
Bakteri yang ditanam pada media diambil dengan mikropipet pada larutan pengenceran terkecil terlebih dahulu, yaitu 10-7, sehingga tip yang telah digunakan tidak perlu diganti lagi dengan tip baru untuk mengambil bakteri pada larutan pengenceran yang lebih besar. Jika dilakukan sebaliknya maka jumlah bakteri pada larutan yang pengencerannya lebih besar akan memengaruhi jumlah bakteri pada larutan yang pengencerannya lebih kecil. Sebelum dan sesudah bakteri ditanam pada media, baik cawan sebar maupun cawan tuang dipanaskan pada bagian mulutnya agar tidak ada kontaminan yang menempel. Pada cawan tuang, media yang telah dituangkan diletakkan pada meja yang datar dan ketebalan lapisan diatur rata dengan cara digerakkan dengan gerakan membentuk angka delapan.
koloni bakteri sama sekali dan pada pengenceran 10-5 koloni bakteri yang terbentuk menumpuk dan bergelombol sehingga sulit untuk dihitung sebagai suatu koloni yang dapat pula disebut dengan terlalu banyak untuk dihitung (TBUD). Tidak terbentuknya koloni atau sedikitnya koloni bakteri yang terbentuk dapat disebabkan oleh beberapa hal di antaranya cawan yang berisi bakteri tersebut terlalu dekat dengan api sehingga bakteri tersebut menjadi mati atau hanya sedikit saja yang hidup. Selain itu dapat pula dikarenakan spreader yang digunakan untuk meratakan larutan pengencer bakteri masih panas sehingga bakteri tersebut mati semua atau sebagian. Jumlah koloni yang diperoleh dalam jumlah sedikit dapat pula dikarenakan pengenceran bertingkat yang dilakukan tidak homogen sehingga larutan tersebut terlalu encer (jumlah bakteri terlalu sedikit). Jika koloni bakteri yang diperoleh pada suatu percobaan memiliki warna lebih dari satu, hal ini menunjukkan bahwa adanya kontaminan yang ikut tumbuh. Jika suatu cawan membentuk banyak koloni maka perhitungan dapat dipermudah dengan cara menggunakan kuadran dan pada salah satu kuadran dihitung yang dapat mewakili kuadran lainnya seperti berikut.
Gambar 3 Pembuatan kuadran untuk mempermudah perhitungan koloni bakteri Semakin tinggi tingkat pengenceran yang dilakukan maka jumlah koloni bakteri yang akan terbentuk semakin sedikit. Hal ini dapat dilihat pada pengenceran 10-5 yang memiliki jumlah koloni yang terlalu banyak pada cawan tuang dan pada pengenceran 10-7 memiliki jumlah koloni paling sedikit atau bahan tidak ada sehingga tidak memenuhi persyaratan statistik. Jumlah koloni yang berkurang seiring dengan peningkatan pengenceran disebabkan karena jumlah bakteri yang terkandung dalam tiap volume inokulan yang dipindahkan semakin berkurang akibat pengenceran yang dilakukan.
Jumlah sel bakteri yang terdapat dalam sampel dapat ditentukan dengan rumus sebagai berikut.
∑sel = ∑koloni x x
Satuan untuk ∑sel adalah CFU/mL yang mana CFU merupakan colony forming units per mL. Semakin besar pengenceran, maka jumlah koloni semakin kecil sehingga jumlah mikroorganisme dapat dihitung. Fp merupakan faktor pengenceran sedangkan ∑inokulan merupakan larutan pengencer yang diambil untuk diinokulasikan. Pada percobaan volume inokulan yang digunakan sebesar 0,1 mL. Jumlah bakteri pada percobaan baik cawan sebar maupun cawan tuang tidak dapat dihitung, karena tidak memenuhi persyaratan statistik.
baik yang mati maupun hidup dihitung seluruhnya ketika tidak menggunakan suatu zat pewarna untuk dapat membedakannya (Lay 1994). Kelemahan utama metode hitungan cawan adalah keselektifannya. Kondisi pertumbuhan bakteri, termasuk komposisi media yang digunakan, waktu inkubasi, suhu, dan pH sangat menentukan jenis bakteri yang dapat tumbuh dari seluruh populasi yang ada. Tidak ada satu kondisi yang universal untuk membuat seluruh mikroorganisme dapat tumbuh dengan baik. Kekurangan tersebut dapat menjadi suatu keunggulan jika ingin menghitung populasi mikroorganisme spesifik. Sebagai contoh yaitu mendesain prosedur yang selektif untuk menghitung bakteri koliform atau kelompok mikroorganisme fisiologis lainnya (Harmita 2006).
Simpulan
Berdasarkan percobaan yang dilakukan dapat disimpulkan bahwa pada cawan sebar baik pada pengenceran 10-7 maupun 10-6 jumlah koloni bakteri yang terbentuk terlalu sedikit untuk dihitung. Pada cawan tuang baik pada pengenceran 10-7 maupun 10-6 tidak terbentuk koloni bakteri sedangkan pada pengenceran 10-5 jumlah koloni yang terbentuk terlalu banyak untuk dihitung. Sehingga kepadatan sel bakteri dalam sampel tidak dapat ditentukan.
Daftar Pustaka
Fardiaz S. 1993. Analisis Mikrobiologi Pangan. Jakarta: PT. Raja Grafindo Persada.
Harmita. 2006. Buku Ajar Analisis Hayati. Jakarta: Kedokteran EGC. Ed. ke-3. Irianto K. 2007. Mikrobiologi. Bandung: Yrama Widya.
Lay B. 1994. Analisis Mikroba di Laboratorium. Jakarta: Raja Grafindo Persada. Waluyo Lud. 2008. Teknik dan Metode Dasar dalam Mikrobiologi. Malang: UMM Press.