PERBEDAAN KADAR SERUM 8-HIDROKSI-2-DEOKSIGUANOSIN
PADA BLIGHTED OVUM DAN
KEHAMILAN NORMAL
dr. A A N Anantasika, Sp.OG(K)
BAGIAN/SMF OBSTETRI DAN GINEKOLOGI FAKULTAS KEDOKTERAN UNIVERSITAS UDAYANA/RS SANGLAH DENPASAR
RINGKASAN
Abortus merupakan komplikasi yang sering terjadi pada trimester pertama kehamilan,
dimana salah satunya adalah kehamilan anembrionik (blighted ovum). Penyebab pasti
blighted ovum hingga saat ini belum diketahui dengan pasti. Diduga salah satu penyebab terjadinya blighted ovum adalah kelainan kromosom. Beberapa ahli telah
berpendapat bahwa radikal bebas berperan dalam terjadinya komplikasi pada kehamilan
muda, yaitu gangguan keseimbangan antara oksidan dan antioksidan yang disebabkan
oleh reactive oxygen species (ROS). Salah satunya adalah radikal hidroksil, yang dapat
merusak DNA, tetapi tidak dapat dinilai secara langsung karena sangat reaktif. Senyawa
8-hidroksi-2-deoksiguanosin (8-OHdG) merupakan salah satu pertanda kerusakan DNA
yang dapat diperiksa di dalam serum dengan metode ELISA. Sejauh ini dari
penelitian-penelitian yang ada, belum ada yang menunjukkan kadar 8-OHdG pada blighted ovum,
sehingga peneliti mencoba melakukan penelitian dalam upaya menemukan perbedaan
kadar serum 8-OHdG pada blighted ovum dan kehamilan normal.
Kerangka konsep penelitian ini adalah terjadinya ketidakseimbangan ROS dan
antioksidan sehingga menyebabkan terjadinya stres oksidatif yang berlebihan, yang
merusak DNA embrio (oksidasi DNA) yang berakhir pada blighted ovum. Dari
penelitian ini muncul hipotesis penelitian bahwa terdapat perbedaan kadar serum
8-OHdG pada blighted ovum dan kehamilan normal.
Telah dilakukan penelitian cross sectional analitik, dilaksanakan di poliklinik dan
ruang bersalin IRD Kebidanan dan Kandungan RS Sanglah Denpasar dari bulan Juni
dengan blighted ovum dan 51 pasien dengan kehamilan normal pada umur kehamilan
7-12 minggu.
Dari hasil penelitian didapatkan hasil rerata kadar serum 8-OHdG pada blighted
ovum 0,177 (SD 0,06) ng/mL lebih tinggi dari rerata kadar serum 8-OHdG pada kehamilan normal 0,111 (SD 0,01) ng/mL, dengan perbedaan rerata kadar serum
8-OHdG pada blighted ovum dan kehamilan normal sebesar 0,066 ng/mL (p<0,05). Pada
penelitian ini disimpulkan didapatkan perbedaan bermakna kadar rerata serum 8-OHdG
pada blighted ovum dan kehamilan normal. Nilai cut off point kadar serum 8-OHdG
berdasarkan kurva ROC adalah 0,138 ng/ml dengan nilai sensitivitas 96,1 % dan nilai
ABSTRAK
Tujuan Penelitian : Untuk mengetahui perbedaan kadar serum
8-hidroksi-2-deoksiguanosin (8-OHdG) pada blighted ovum dan kehamilan normal.
Metode penelitian : Penelitian ini merupakan desain cross sectional analitik. Jumlah
sampel adalah sebesar 82 sampel, dimana 31 kasus dengan blighted ovum dan 51 kasus kehamilan normal, dengan umur kehamilan 7-12 minggu. Pengambilan darah pada vena cubiti sebanyak 3 cc kemudian dimasukkan ke dalam tabung pemeriksaan, lalu diperiksa kadar serum 8-OHdG pada Laboratorium Patologi Klinik RS Sanglah Denpasar. Dari data yang terkumpul dilakukan pengujian normalitas data dengan Shapiro-Wilk Test, kemudian dilakukan analisa data dengan t-independent sample test dengan tingkat kemaknaan ά = 0,05.
Hasil : Rerata kadar serum 8-OHdG pada blighted ovum 0,177 (SD 0,06) ng/mL,
sedangkan pada kehamilan normal sebesar 0,111 (SD 0,01) ng/mL dengan perbedaan rerata kadar serum 8-OHdG pada blighted ovum dan kehamilan normal 0,066 ng/mL, dimana hasil pada dua kelompok ini berbeda bermakna (p<0,05). Nilai cut off point kadar serum 8-OHdG berdasarkan kurva ROC adalah 0,138 ng/ml dengan nilai sensitivitas 96,1 % dan nilai spesifisitas sebesar 80,6 %.
Simpulan : Rerata kadar serum 8-OHdG pada blighted ovum lebih tinggi dari
kehamilan normal.
ABSTRACT
Objective : To determine the difference of 8-hydroxy-2-deoxyguanosine (8-OHdG)
serum in blighted ovum and normal pregnancy.
Method : This is an analytic cross sectional with 82 samples divided into two groups.
31 cases of blighted ovum and 51 cases of normal pregnancies, with 7-12 weeks gestational age. We took 3 cc of blood samples from the cubiti veins, and its 8-OHdG serum quantities were than examined at the Pathology Lab at Sanglah General Hospital. Data was analyzed with the Shapiro-Wilk Test and the t independent test with alpha 0.05.
Result : The average 8-OHdG serum for blighted ovum and normal pregnancies were
0,177 (SD 0,06) ng/mL and 0,111 (SD 0,01) ng/mL, respectively with the difference between the both group 0,066 ng/mL (p<0,05). The cut off value of 8-OHdG serum level is 0,138 ng/ml with sensitivity 96,1% and specificity 80,6%.
Conclusion : The level of 8-OHdG serum in blighted ovum is higher than normal
pregnancies.
BAB 1 PENDAHULUAN
1.1. Latar Belakang Masalah
Abortus merupakan komplikasi yang paling sering terjadi pada trimester pertama
kehamilan(Cunningham et al., 2010). Diperkirakan 10-15% hasil konsepsi secara klinis
akan mengalami abortus dan 3% diantaranya adalah kehamilan anembryonic (blighted
ovum) (Nyobo Andersen, 2000). Blighted ovum terdiagnosa berdasarkan tidak adanya embrio di dalam kantung gestasi melalui pemeriksaan ultrasonografi (Asim Kurjak,
2003). Penyebab blighted ovum hingga saat ini belum diketahui secara pasti. Diduga
penyebabnya adalah kelainan hormonal, kelainan genetik, kelainan imunologis,
penyakit sistemik pada ibu dan faktor lain seperti radiasi, obat-obatan antineoplastik,
obat-obatan anestesi, alkohol dan nikotin (Jauniaux et al., 2010).
Penyebab terjadinya abortus tidak selalu jelas. Salah satu penyebabnya adalah
adanya kelainan kromosom. Faktor kromosom menyumbang sekitar 75% dari penyebab
abortus. (Griebel et al., 2005; Cunningham et al., 2010). Salah satu faktor yang berperan
terhadap kelainan kromosom adalah reactive oxidative species (ROS) yang mampu
menyebabkan kerusakan seluler. Radikal hidroksil adalah salah satu ROS yang dapat
merusak DNA, tetapi tidak bisa dinilai secara langsung karena sangat reaktif (Seino
et al., 2002). Senyawa 8-hidroksi-2-deoksiguanosin (8-OHdG) yang merupakan
salah satu ekspresi utama kerusakan DNA dapat diperiksa di dalam serum dengan
metode ELISA. Kadar 8-hidroksi-2-deoksiguanosin yang tinggi berhubungan dengan
tingginya agresi radikal hidroksil dan atau rendahnya kecukupan antioksidan (Ledo et
Sampai saat ini belum ditemukan adanya penelitian tentang perbedaan rerata kadar
8-hidroksi-2-deoksiguanosin pada blighted ovum dan kehamilan normal. Dengan
mengetahui perbedaan rerata kadar 8-hidroksi-2-deoksiguanosin ini dapat dipikirkan
agresi dari radikal bebas khususnya radikal hidroksil, pada pasien dengan blighted
ovum, sehingga nantinya dapat dilakukan pencegahan secara lebih dini.
1.2. Rumusan Masalah
Apakah terdapat perbedaan rerata kadar 8-hidroksi-2-deoksiguanosin pada blighted
ovum dan kehamilan normal ?
1.3. Tujuan Penelitian 1.3.1. Tujuan Umum
Mengetahui perbedaan rerata kadar 8-hidroksi-2-deoksiguanosin pada blighted
ovum dan kehamilan normal.
1.3..2. Tujuan Khusus
1. Untuk mengetahui rerata kadar 8-hidroksi-2-deoksiguanosin pada blighted ovum.
2. Untuk mengetahui rerata kadar 8-hidroksi-2-deoksiguanosin pada kehamilan
normal.
3. Untuk mengetahui cut off point kadar 8-hidroksi-2-deoksiguanosin pada blighted
ovum dan kehamilan normal.
1.4. Manfaat Penelitian 1.4.1. Manfaat Keilmuan
ovum.
2. Sebagai data awal untuk penelitian selanjutnya.
1.4.2. Manfaat Praktis
Bila rerata kadar 8-hidroksi-2-deoksiguanosin lebih tinggi pada pasien dengan
blighted ovum dibandingkan dengan kehamilan normal maka sangat besar
kemungkinannya menjadi salah satu faktor risiko terjadinya blighted ovum sehingga
dapat dilakukan upaya pencegahan dan pengobatan dengan antioksidan guna mencegah
kejadian abortus.
BAB 2
TINJAUAN PUSTAKA
2.1. Definisi Blighted Ovum
Blighted ovum atau kehamilan anembrionik adalah suatu kehamilan yang di dalam
kantungnya tidak ditemukan adanya embrio. Secara ultrasonografi diameter kantung
kehamilan lebih dari 17 mm, dan embrio seharusnya sudah terlihat saat usia kehamilan
43 hari (Vern et al., 2007). Kelainan ini dapat pula ditemukan pada pemeriksaan
sonografi transvaginal dengan diameter kantung kehamilan 1,5 cm, dan jika volume
kantung kehamilan kurang dari 2,5 ml serta tidak didapatkan pertumbuhan dalam waktu
1 minggu sebanyak 75% dari volume awal, maka kondisi ini disebut blighted
ovum(Asim Kurjak, 2003; Gracia et al., 2005). Dari ultrasonografi transabdominal,
apabila didapatkan kantung kehamilan dengan diameter lebih dari 20 mm tanpa yolk sac
atau 25 mm tanpa embrio, dapat merupakan blighted ovum.(Morin et al, 2005)
2.2. Insiden Blighted Ovum
Sepertiga kejadian abortus yang terjadi pada usia kehamilan kurang dari 9 minggu
adalah blighted ovum (Peter Uzelac, 2008). Kejadian kegagalan kehamilan trimester
awal sebanyak 2,8% pada studi yang melibatkan 17.810 wanita pada usia kehamilan
10-13 minggu, dan blighted ovum didapatkan sebesar 37,5% (Huang et al., 2010).
2.3. Etiologi dan Faktor Risiko Blighted Ovum
Sebuah studi meta-analisis menemukan bahwa kelainan kromosom terjadi 49% dari abortus spontan. Kelainan trisomi autosom adalah yang tersering sekitar
52%, diikuti oleh kelainan poliploid 21% dan monosomi X 13% (Gracia et al., 2005;
Griebel et al., 2005). Gracia dkk (2005) menemukan bahwa risiko aneuploid pada fetus
meningkat sesuai dengan jumlah kejadian abortus. Selain itu, kelainan poliploid akan
berkembang menjadi kehamilan dengan kantung gestasi yang kosong, atau blighted
ovum.
Beberapa faktor risiko untuk terjadinya blighted ovum (Griebel et al., 2005) :
1. Umur ibu
Peningkatan usia maternal dan paternal tidak menaikkan insiden triploid.
Kejadian abortus euploid meningkat dengan tajam setelah umur ibu lebih dari 35
tahun,
2. Pemakaian obat dan lingkungan, seperti : konsumsi alkohol, kokain, perokok,
gas anestesi (NO),
3. Penyakit kronis ibu antara lain : diabetes yang kurang terkontrol, dan penyakit
autoimun (terutama sindrom antibodi antifosfolipid),
4. Konsepsi yang terjadi setelah tiga sampai enam bulan pasca melahirkan,
5. Kelainan hormon atau endokrin : hipotiroidisme, diabetes melitus, dan
defisiensi progesteron,
6. Penggunaan IUD,
7. Infeksi ibu : vaginosis bakterial, mikoplasmosis, virus herpes simpleks,
toksoplasmosis, listeriosis, klamidia, HIV, sifilis, parvovirus, malaria,
gonorrhea, rubella, cytomegalovirus,
8. Obat-obatan : misoprostol, retinoid, methotrexat, dan obat-obat anti-inflamasi
nonsteroid,
10. Toksin : arsenik, poliurethane, karbon disulfida, timbal, etilen glikol,
logam berat, dan pelarut organik,
11. Kelainan uterus : kelainan kongenital, adhesi, dan leiomioma,
12. Kelainan kromosom fetal, dan perkembangan zigot abnormal.
Radikal bebas ditemukan pada proses respirasi aerobik dan metabolik lainnya.
Oksigen yang digunakan dalam proses oksidasi molekul organik yang dikonversikan
dalam air, namun secara signifikan dikonversikan dalam reactive oxygen species (ROS).
Menurut Jauniaux dkk (2010), tekanan oksigen pada sirkulasi intervilus yang awalnya
20 mmHg pada usia kehamilan 7-10 minggu, meningkat menjadi lebih dari 50 mmHg
saat usia kehamilan 11-14 minggu saat sirkulasi plasenta terbentuk. Hal ini
menyebabkan terjadinya stres oksidatif dan peningkatan produksi ROS.
2.4. Stres Oksidatif
Spesies oksigen reaktif merupakan produk normal yang dihasilkan pada
metabolisme seluler. Organisme aerobik memerlukan energi sebagai bahan bakar
biologis. ROS mampu menyebabkan kerusakan seluler, seperti merusak DNA/RNA,
protein dan lipid. Dalam sel aerobik, ROS seperti superoksid (O2- ), hidrogen peroksida
(H2O2), oksigen tunggal, radikal hidroksil(OH), nitrit oksid (NO). Sumber ROS dapat
dibagi dua yaitu sumber endogen misalnya dari sel (netrofil), enzim yang langsung
menghasilkan ROS (NO synthase), enzim yang secara tidak langsung menghasilkan
ROS (xanthin oksidase), metabolisme sel (mitokondria), serta penyakit (kelainan
metal,proses iskemia). Sumber eksogen misalnya radiasi sinar gamma, radiasi sinar
2002). Beberapa persen (1-5%) dari oksigen yang diperlukan sel, dapat membentuk
ROS.
Tabel 2.1 Metabolit Radikal dan Non Radikal Oksigen (Kohen dan Nyska, 2002)
Berlanjutnya paparan ROS baik dari dalam maupun dari luar mengakibatkan
berlanjutnya kerusakan oksidatif terhadap komponen sel dan mengubah beberapa fungsi
sel. Di antara target biologi yang paling peka adalah protein-protein enzim,membran
lipid dan DNA (Kohen dan Nyska, 2002).
Spesies oksigen reaktif merupakan promoter penting dalam proses ovulasi.
Perkembangan proses meiosis I diinduksi oleh peningkatan ROS dan dihambat oleh
antioksidan (Takami et al., 2000; Behrman et al., 2001). Sel granulosa dan sel teka
berperan negatif terhadap ROS dan adanya ROS akan menghambat perkembangan
meiosis II, yang dapat menyebabkan berkurangnya aktivitas gonadotropin dan
steroidogenik, kerusakan DNA dan hambatan produksi ATP (Behrman et al., 2001).
Disebutkan bahwa paparan stres oksidatif sebelum fertilisasi dapat mengganggu proses
Nama Simbol Radikal oksigen Oksigen (bi-radical) Ion Superoksid Hidroksil Peroksil Alkoksil Nitrit oksida
Turunan nonradikal oksigen Hidrogen peroksida (Peroksida Organik) Asam Hipoklorus Ozone Aldehid Oksigen tunggal Peroksinitrit O2-. O2. OH. ROO. RO. NO. H2O2 ROOH HOCL O3 HCOR 1 O2 ONOOH
meiosis dan meningkatkan terbentuknya zigot yang abnormal (Zuelke et al., 1997).
Aktivitas ROS yang dihasilkan selama fusi gamet dihambat oleh peningkatan produksi
antioksidan.
Radikal hidroksil merupakan salah satu ROS yang sangat agresif, diproduksi di
mitokondria dan bertanggung jawab terhadap kerusakan yang terjadi pada mitokondria.
DNA Mitokondria merupakan target utama radikal oksigen oleh karena lokasinya yang
dekat dengan DNA membran inti tempat oksidan terbentuk dan aktivitas perbaikan
DNA berkurang (Tamura et al., 2008). Radikal hidroksil sangatlah reaktif dan
mempunyai jangka waktu hidup sangat pendek sehingga tidak bisa dinilai secara
langsung, tetapi oksidasi produk DNA atau turunannya dapat dideteksi dalam urin,
serum, dan saliva.
Walaupun DNA stabil, ROS dapat berinteraksi dan menyebabkan beberapa macam
kerusakan seperti : modifikasi basa DNA, merusak rantai tunggal dan ganda DNA,
hilangnya purin, kerusakan pada gula deoksiribosa, protein hasil reaksi silang DNA, dan
kerusakan pada sistem perbaikan (usaha memperbaiki diri) DNA. Tidak semua ROS
menyebabkan kerusakan ini. Radikal hidroksil adalah salah satu ROS yang berperan
menyebabkan kerusakan ini.
Radikal hidroksil dapat dihasilkan dari reaksi superoksid yang dikatalisis oleh Fe2+
atau oleh transisi metal sebaik efek yang ditimbulkan oleh radiasi ion dioksigen. Sketsa
di bawah ini mengilustrasikan hubungan antara masing-masing metabolit ROS serta
Bagan 2.1 Hubungan Metabolit ROS (Kohen dan Nyska, 2002)
2.5. 8-Hidroksi-2-Deoksiguanosin
Seperti yang telah disebutkan sebelumnya bahwa peningkatan stres oksidatif dapat
menyebabkan radikal bebas menyerang molekul-molekul yang secara fisiologis sangat
penting seperti lipid, protein termasuk enzim dan DNA.
Sebagai akibat kerusakan terhadap purin dan pirimidin akan terjadi modifikasi DNA
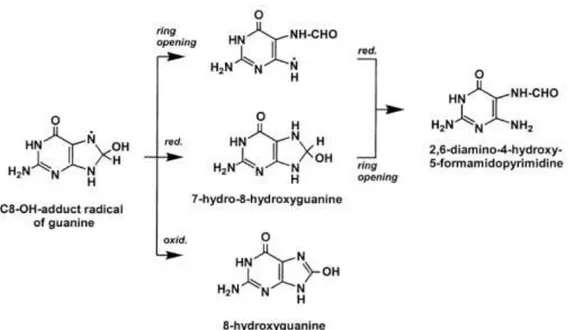
yang teroksidasi. Guanin dapat diserang oleh OH. pada posisi C8 menghasilkan
8-hidroksi-2-deoksiguanosin (8-OHdG) sebagai produk oksidasinya.
Posisi lain juga dapat diserang dan produk-produk lainnya mungkin saja terbentuk.
Di antara basa-basa yang teroksidasi itu, 8-hidroksi-2-deoksiguanosin yang terbanyak
Gambar 2.1. Mekanisme pembentukan produk oksidasi guanin oleh radikal hidroksil pada rantai C8 (Dizdaroglu et al., 2002)
Produk oksidasi oleh radikal hidroksil adalah 8-hidroksiguanin, bersama dengan
ekivalennya 8-hidroksi-2-deoksiguanosin (8-OHdG) yang sangat mutagenik. Komponen
ini menyebabkan transversi A:T menjadi C:C atau G:C menjadi T:A oleh karena
pasangan basanya dengan adenin sebaik sitosin (Kohen dan Nyska, 2002). Radikal
hidroksil juga dapat menyerang basa yang lain seperti adenin untuk membentuk 8 (atau
4-,5-) hidroksiadenin. Produk-produk lain hasil interaksi antara pirimidin dengan radikal
hidroksil yaitu tiamin peroksida, tiamin glikol, 5 (hidroksimetil) urasil dan
produk-produk lainnya. Interaksi langsung lain antara ROS yang kurang reaktif seperti O.2- dan
H2O2 tidak menimbulkan kerusakan fisiologis, namun produk ini adalah sumber-sumber
intermediat reaktif yang mudah diserang dan menyebabkan kerusakan. Seperti contoh
H2O2 dan superoksid dapat menurunkan OH. melalui reaksi Haber-Weiss, NO dan O.2-
dapat menurunkan formasi ONOO- dan mudah menyebabkan kerusakan DNA yang
serupa dengan kerusakan yang melibatkan radikal hidroksil. Transisi logam seperti besi,
memastikan serangan berulang atas DNA selain oleh karena radikal hidroksil sendiri.
Delapan-hidroksi-2-deoksiguanosin yang dibentuk oleh ROS pertama kali dilaporkan
Kasai dan Nishimura pada tahun 1984. Senyawa ini dapat terbentuk dari beberapa agen
yang menghasilkan ROS.
Delapan-hidroksi-2-deoksiguanosin (8-OHdG) adalah indikator kerusakan DNA
yang sensitif sebagai akibat stres oksidatif. Disebutkan bahwa komponen yang
dihasilkan melalui DNA yang rusak diakibatkan oleh radiasi, radikal hidroksil,
superoksid atau peroksinitrit. Delapan-hidroksi-2-deoksiguanosin itu sendiri
mempunyai peran biologi yang mampu menginduksi konversi G:C ke T:A selama
replikasi DNA. Juga digunakan sebagai biomarker pada karsinogenesis ginjal, diabetes
melitus, kanker dan proses penuaan (Seino et al., 2002 ). Kadar 8-OHdG normal pada
urin berada dalam kisaran 2,7-13 ng/mg kreatinin, sedangkan kadar 8-OHdG normal
pada serum dilaporkan berada dalam kisaran 0,004-0,021 ng/ml (DNA damage ELISA
kit). Adanya pemeriksaan yang sensitif untuk 8-hidroksi-2-deoksiguanosin
menyebabkan 8-hidroksi-2-deoksiguanosin ini dipakai di banyak laboratorium sebagai
biomarker kerusakan oksidasi DNA. Faktor-faktor lain yang mendukung adalah
(Halliwell, 2000) :
1. Formasinya di DNA oleh beberapa spesies oksigen reaktif seperti singlet
oksigen dan radikal hidroksil,
2. Kemampuan mutagenisitasnya dalam menginduksi transversi G:CT:A,
3. Mekanisme yang terlibat dalam transfer 8-OHdG dari DNA atau mencegah
penyatuan 8-OHdG ke dalam sel DNA, dengan asumsi bahwa sel menganggap
4. Karena prevalensi dan kemudahan dalam mendeteksi senyawa ini pada
sampel-sampel biologik (Zhang et al., 2000).
Pada sistem reproduksi wanita, ROS dan antioksidan mempunyai peran fisiologi
selama proses folikulogenesis, maturasi oosit, regresi luteal dan fertilisasi (Agarwal et
al., 2005). Contohnya adalah peningkatan marker kerusakan oksidatif DNA,
8-hidroksi-2-deoksiguanosin pada sel granulosa dan sel kumulus ooforus (COCs) (Seino et al.,
2002.), berhubungan dengan rendahnya kemampuan fertilisasi oosit, kualitas embrio
yang rendah dan mengurangi kesuksesan implantasi.
Disebutkan juga bahwa 8-hidroksi-2-deoksiguanosin ini tidak hanya sebagai marker
stres oksidatif pada sel granulosa selama proses ovulasi sehingga mempengaruhi
fertilisasi tetapi juga mempengaruhi pertumbuhan embrio (Seino et al., 2002).
Beberapa penelitian telah menguji pengaruh stres oksidatif terhadap kualitas oosit
in vitro. Persentase oosit matur (tahap meiosis II oosit dengan polar body pertama)
secara signifikans menurun dengan pemberian radikal H2O2 dosis tertentu tetapi dengan
menginkubasi oosit dengan antioksidan (melatonin) dosis tertentu maka pengaruh
radikal terhadap pematangan oosit dapat dihambat. Paparan radikal hidroksil yang lama
dapat memicu terjadinya ovum yang patologis (oosit yang berkualitas rendah). (Tamura
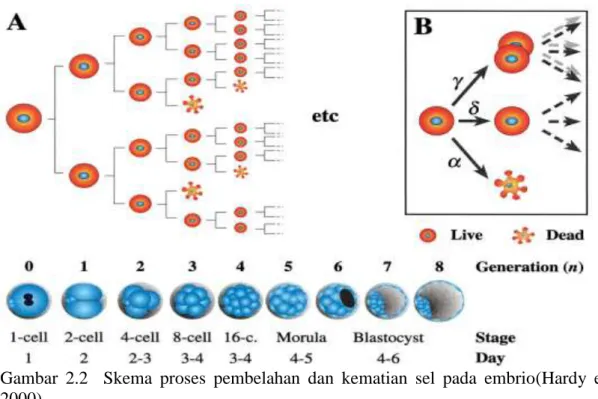
Gambar 2.2 Skema proses pembelahan dan kematian sel pada embrio(Hardy et al., 2000)
Kelainan kromosom sangat menonjol dalam penilaian dampak penyakit genetik
yaitu sekitar 50% kematian mudigah, 5-7% kematian janin, 6-11% lahir mati dan
kematian neonatus sebanyak 0,9% dari bayi lahir hidup. Gamet-gamet abnormal kecil
kemungkinannya menghasilkan konsepsi yang baik dibandingkan dengan gamet
normal. Apabila tetap terjadi pembuahan maka seleksi menyebabkan sebagian besar
hasil konsepsi aneuploid (kelainan kromosom) akan lenyap sebelum implantasi
(Cunningham, 2010).
Dari penelitian terbaru tentang stres oksidatif dan kualitas oosit yang rendah, pada
wanita yang menjalani IVF dan embrio transfer (ET), didapatkan konsentrasi
8-hidroksi-2’-deoksiguanosin yang meningkat secara bermakna pada cairan intrafolikel
dengan tingkat degenerasi oosit yang tinggi (>30%) (Tamura et al., 2008).
Pada sekelompok wanita yang gagal hamil saat siklus IVF-ET sebelumnya, dengan
pemberian salah satu dari tiga pengobatan antioksidan (melatonin 3 mg/hari, α-tokoferol
sebelumnya sampai dengan hari pemilihan oosit, dibandingkan dengan siklus IVF-ET
sebelumnya, berhubungan dengan berkurangnya konsentrasi 8-OHdG pada cairan
intrafolikel secara bermakna (p<0,05) (Ruder et al., 2009).
Oksigenasi intrafolikel yang rendah berhubungan dengan potensi gangguan
perkembangan oosit melalui peningkatan frekuensi kerusakan sitoplasma oosit, yang
menyebabkan lemahnya pembelahan dan kelainan segregasi kromosom oosit yang
berasal dari folikel yang miskin vaskularisasi. Spesies oksigen reaktif (ROS)
bertanggung jawab terhadap terjadinya fragmentasi embrio sebagai akibat dari
peningkatan proses apoptosis. Dengan meningkatnya level ROS tidak memungkinkan
terjadinya pertumbuhan dan perkembangan embrio.
Penelitian terkini lebih memfokuskan diri kepada kemampuan growth factors untuk
melindungi keadaan embrio in vitro dari pengaruh ROS yang merugikan seperti
apoptosis. Plasentasi yang abnormal mengarah kepada stres oksidatif plasenta yang
merugikan sinsitiotrofoblast dan diduga terlibat dalam mekanisme terjadinya abortus.
Puncak ekspresi dari marker stres oksidatif pada trofoblast terdeteksi pada kehamilan
normal dan jika berlebihan akan menyebabkan abortus dini (Agarwal et al., 2005).
Perkembangan embrio awal pada mamalia terjadi melalui diferensiasi sistem
organ dasar dalam lingkungan rendah oksigen. Konsentrasi oksigen yang rendah pada
lingkungan in vitro akan menurunkan level H2O2 yang selanjutnya dapat mengurangi
fragmentasi DNA sehingga akan memperbaiki kemampuan berkembangnya embrio.
Konsentrasi oksigen yang tinggi (sampai 20%) berhubungan dengan turunnya
kemampuan berkembang dan sebaliknya perkembangan yang cepat terjadi saat
Spesies oksigen reaktif (ROS) bisa didapatkan endogen atau eksogen dimana
keduanya dapat mempengaruhi oosit dan embrio. Kultur media IVF bisa merupakan
sumber ROS eksogenous yang mempengaruhi oosit dan embrio preimplantasi. Pada hari
pertama, level ROS yang tinggi pada media kultur berhubungan dengan perkembangan
embrio yang terlambat, fragmentasi yang tinggi, dan berkembangnya morfologi
blastokis yang abnormal. Terdapat hubungan yang bermakna antara peningkatan level
ROS pada hari pertama media kultur dengan tingkat fertilisasi yang rendah pada pasien
yang menjalani intracytoplasmic sperm injection(ICSI).
Fertilisasi dan perkembangan embrio in vivo terjadi dalam lingkungan rendah tekanan
oksigen. Selama kultur, tekanan oksigen yang rendah lebih efektif memperbaiki proses
implantasi dan tingkat kehamilan dibandingkan dengan tekanan oksigen yang tinggi.
Vaskularisasi folikel menentukan kandungan oksigen intrafolikuler serta kemampuan
berkembangnya oosit. Hipoksia intrafolikuler menyebabkan kelainan segregasi
kromosom dan gangguan struktur embrio. Hal tersebut menjelaskan kembali bagaimana
ROS dapat merusak oosit (Agarwal et al., 2005).
2.6. Peranan ROS dan Antioksidan pada Kehamilan Normal
Pada kehamilan sendiri metabolisme akan meningkat sehingga memerlukan energi
dan oksigen yang lebih banyak, sehingga semakin meningkat pula radikal bebas yang
dihasilkan. Stres oksidatif yang terjadi dapat mengganggu kehamilan jika antioksidan
tidak dapat mengimbanginya. Secara umum, kelainan kromosom pada fetus merupakan
penyebab pada paling sedikit separuh dari abortus dini (Hasegawa et al., 1996; Griebel
et al., 2005; Cunningham et al., 2010).
Mekanisme terjadinya abortus tidak selalu jelas, tetapi pada bulan-bulan awal
dan kelainan kromosom pada mudigah dan janin ini menyebabkan sebagian besar
kejadian abortus pada awal kehamilan.
Dengan mengetahui kadar 8-hidroksi-2-deoksiguanosin, secara tidak langsung
dapat diketahui agresi dari radikal bebas atau antioksidan yang bekerja melawan radikal
bebas itu dalam hal ini pasien yang mengalami abortus spontan. Sehingga jika
memang kadarnya signifikan berbeda dengan kehamilan normal kita dapat melakukan
pencegahan abortus dan bahkan abortus berulang salah satunya dengan pemberian
antioksidan secara dini.
MALE + ..+ FEMALE
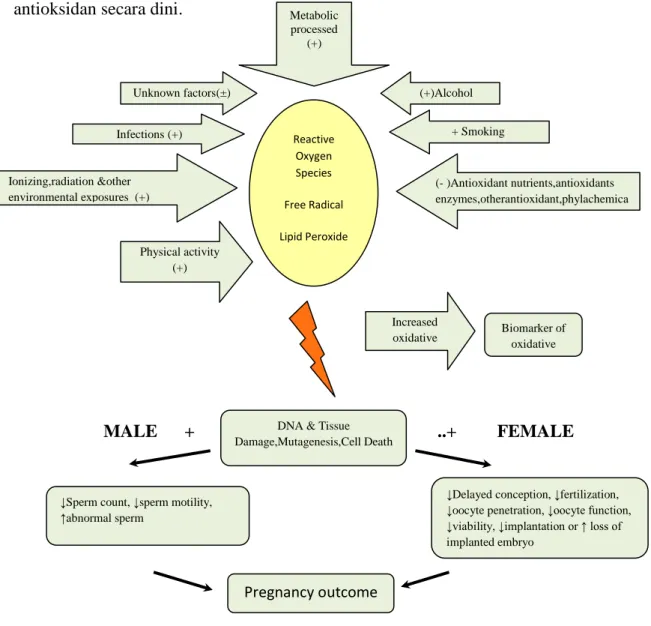
Gambar 2.3 Peran stres oksidatif pada fertilisasi (Ruder et al., 2008) Reactive Oxygen Species Free Radical Lipid Peroxide Ionizing,radiation &other environmental exposures (+) (- )Antioxidant nutrients,antioxidants enzymes,otherantioxidant,phylachemica ls Infections (+) + Smoking (+)Alcohol Unknown factors(±) Metabolic processed (+) Physical activity (+) Increased oxidative stress Biomarker of oxidative stress
DNA & Tissue Damage,Mutagenesis,Cell Death
↓Sperm count, ↓sperm motility, ↑abnormal sperm
↓Delayed conception, ↓fertilization, ↓oocyte penetration, ↓oocyte function, ↓viability, ↓implantation or ↑ loss of implanted embryo
BAB 3
KERANGKA PIKIR, KONSEP DAN HIPOTESIS PENELITIAN
3.1. Kerangka Pikir
Terjadinya blighted ovum diakibatkan oleh multifaktorial. Salah satunya adalah
ROS. Salah satu ROS adalah radikal hidroksil yang dapat dinilai secara tidak langsung
dengan pemeriksaan kadar 8-hidroksi-2-deoksiguanosin.
Kadar 8-hidroksi-2-deoksiguanosin yang tinggi sangat mungkin memberikan peran
besar akan terjadinya blighted ovum, demikian juga faktor-faktor lainnya seperti umur
ibu yang meningkat, anomali uterus, anomali plasenta, penyakit maternal,
ketidakseimbangan hormon, pengaruh lingkungan, dan ovum patologik dapat
meningkatkan kejadian abortus, sehingga 8-hidroksi-2-deoksiguanosin ini memberikan
kedudukan yang sejajar terhadap kejadian blighted ovum.
Seseorang yang terpapar radikal hidroksil, jika antioksidan tidak adekuat
menetralisirnya akan menyebabkan stres oksidatif yang mampu merusak DNA sehingga
apabila kemudian hamil akan berpengaruh terhadap janinnya.
Namun demikian, faktor-faktor yang mempengaruhi kejadian blighted ovum
seperti yang telah disebutkan sebelumnya pada bab 2, dapat memperberat terjadinya
blighted ovum apabila terjadi atau ditemukan bersama-sama termasuk jumlah
3.2. Kerangka Konsep Penelitian
Bagan 3.2 Kerangka Konsep Penelitian
3.3. Hipotesis Penelitian
Terdapat perbedaan rerata kadar serum 8-hidroksi-2-deoksiguanosin pada blighted
ovum dan kehamilan normal.
ANTI OKSIDAN AGRESI RADIKAL HIDROKSIL
KERUSAKAN DNA
MUTASI GEN
KERUSAKAN SEL
TIDAK STRES OKSIDATIF STRES OKSIDATIF
APOPTOSIS NEKROSIS 8-HIDROKSI-2-DEOKSIGUANOSIN SEL NORMAL KEHAMILAN NORMAL
KEHAMILAN
BLIGHTED OVUMBAB 4
METODE PENELITIAN
4.1. Rancangan Penelitian
Rancangan penelitian yang digunakan pada penelitian ini adalah cross-sectional
analytic.
4.2. Tempat dan Waktu Penelitian 4.2.1. Tempat Penelitian
Penelitian ini dilaksanakan di Poliklinik dan IRD Kebidanan dan Penyakit
Kandungan RS Sanglah Denpasar.
4.2.2. Waktu Penelitian
Penelitian ini dilaksanakan sejak bulan Juni 2012 sampai dengan bulan Desember
2012.
4.3. Populasi, Pemilihan dan Besar Sampel 4.3.1. Populasi Penelitian
Pada penelitian ini yang menjadi populasi adalah semua ibu hamil yang datang ke
Ruang Bersalin IRD dan Poliklinik Kebidanan dan Penyakit Kandungan RS Sanglah
Denpasar.
4.3.2. Sampel Penelitian
Sampel penelitian adalah semua ibu hamil yang datang ke Ruang Bersalin IRD dan
Poliklinik Kebidanan dan Penyakit Kandungan RS Sanglah Denpasar dengan diagnosis
blighted ovum dan hamil muda normal dengan usia kehamilan 7 sampai dengan 12
4.3.2.1. Kriteria Inklusi
1. Ibu hamil dengan usia kehamilan 7 sampai dengan 12 minggu yang didiagnosis
blighted ovum dan hamil normal dari USG, yang datang ke Ruang IRD dan
Poliklinik Kebidanan dan Penyakit Kandungan RS Sanglah Denpasar.
2. Bersedia ikut penelitian.
4.3.2.2. Kriteria Eksklusi
1. Ibu hamil muda dengan kelainan uterus.
2. Ibu hamil muda dengan mioma uterus.
3. Kehamilan mola hidatidosa.
4.3.3. Pemilihan Sampel
Sampel ditentukan dengan cara concecutive sampling dari ibu hamil yang datang ke
Ruang Bersalin IRD dan Poliklinik Kebidanan dan Penyakit Kandungan RS Sanglah
Denpasar dengan diagnosis blighted ovum dan hamil muda normal dari USG dengan
usia kehamilan 7 sampai dengan 12 minggu, sampai jumlah sampel terpenuhi.
4.3.4 Penghitungan Besar Sampel
Jumlah sampel (Sastroasmoro, 2010) ditentukan berdasarkan asumsi :
1. Tingkat kesalahan tipe I (α) dipergunakan 0,05 Zα = 1,960 2. Power penelitian sebesar 90%
3. Tingkat kesalahan tipe II (β) adalah 20% Zβ = 1,282 4. S = simpang baku = 80,58 (Wiktor et al., 2004)
Rumus yang digunakan adalah (dikutip dari Sastroasmoro, 2010) : 2 n1=n2= 2 2 n1=n2= 2 n1=n2= 37,87
Untuk menghindari drop out, maka jumlah sampel yang didapatkan dari rumus ini
ditambahkan 10%, sehingga jumlah sampel per kelompok adalah 40,56 ~ 41 sampel.
Berdasarkan perhitungan dengan rumus di atas didapatkan total jumlah sampel yang
diperlukan adalah 82.
4.4. Variabel Penelitian
4.4.1. Variabel bebas
Variabel bebas adalah kadar 8-hidroksi-2-deoksiguanosin
4.4.2. Variabel tergantung
Variabel tergantung adalah blighted ovum
4.4.3. Variabel terkontrol
Variabel terkontrol adalah umur ibu, umur kehamilan, paritas 68246,5 3603,6 (1,960+1,282).80,58 (179,97-240) 2 n1=n2=2 (Zα + Zβ).S (X1-X2)
4.5. Definisi Operasional Variabel
1. Kadar serum deoksiguanosin adalah nilai satuan
8-hidroksi-2-deoksiguanosin serum yang diperiksa dengan metoda ELISA dan dikerjakan di
Laboratorium Patologi Klinik RS Sanglah.
2. Blighted Ovum adalah kehamilan antara 7 sampai dengan 12 minggu, dengan
diameter kantung gestasi lebih dari 20 mm tanpa yolk sac atau lebih dari 25
mm tanpa embryo di dalam kantung gestasi, pada pemeriksaan USG
Transabdominal 2 dimensi oleh Supervisor.
3. Umur ibu merupakan umur ibu hamil yang dihitung dari tanggal lahir atau
yang tercantum dalam Kartu Tanda Penduduk (KTP).
4. Umur kehamilan merupakan umur kehamilan yang dihitung dari hari pertama
haid terakhir (HPHT) atau berdasarkan hasil pemeriksaan USG yang dilakukan
sebelum umur kehamilan 12 minggu.
5. Paritas adalah jumlah anak lahir hidup yang dialami oleh ibu hamil sebelum
kehamilan yang sekarang.
6. Kehamilan normal adalah kehamilan dengan umur kehamilan 7-12 minggu,
dimana telah dijumpai adanya kantung gestasi pada umur kehamilan 5 minggu,
dengan fetal pole setelah 6 minggu, fetal movement dan fetal heart beat setelah
umur kehamilan 7 minggu dengan USG Transabdominal oleh Supervisor.
7. Ibu hamil muda dengan kelainan uterus adalah kehamilan mulai umur
kehamilan 7 sampai dengan 12 minggu, dengan kelainan bawaan pada uterus
berupa uterus didelphys yaitu dua buah uterus terpisah sama sekali disertai dua
ditemukan pada pemeriksaan inspekulo dan dibuktikan dengan USG
Transabdominal oleh Supervisor dimana tampak 2 buah uterus yang terpisah.
8. Ibu hamil muda dengan mioma uteri adalah ibu hamil muda mulai umur
kehamilan 7 sampai dengan 12 minggu ditandai dengan tinggi fundus uteri
lebih besar dari umur kehamilan dan dijumpai kantong kehamilan dengan fetal
pole, dan fetal heart beat dengan gambaran whorled like appearrance pada pemeriksaan USG Transabdominal oleh Supervisor.
9. Kehamilan mola hidatidosa adalah tumor jinak trofoblas oleh karena
kegagalan plasentasi yang mengakibatkan vili menggelembung menyerupai
buah anggur yang ditandai dengan adanya gejala klinis umur kehamilan 7
sampai dengan 12 minggu berupa riwayat amenore, perdarahan pervaginam
atau tidak, disertai keluarnya gelembung mola atau tidak, dengan besar uterus
lebih besar dari umur kehamilan, tidak ditemukan adanya ballotement dan
detak jantung, dan dengan pemeriksaan USG Transabdominal oleh Supervisor,
ditemukan adanya vesikel di dalam rongga uterus.
4.6. Alat Pengumpul Data
Alat-alat pengumpul data meliputi :
1) Lembar status pasien
2) Timbangan berat badan
3) Alat pengukur tinggi badan
4) Tensimeter
5) Spuit disposibel 3 cc
4.7. Alur Penelitian
Ibu-ibu hamil yang memenuhi kriteria inklusi dan eksklusi seperti yang disebutkan
di atas dimasukkan dalam sampel blighted ovum dan sampel kehamilan normal
kemudian diminta untuk membaca dan menandatangani formulir yang telah disediakan.
Selanjutnya semua sampel penelitian dikelola sesuai dengan Pedoman Terapi
Bagian/SMF Obstetri dan Ginekologi Fakultas Kedokteran Universitas Udayana/RS
Sanglah Denpasar.
Langkah-langkah yang akan dilakukan pada penelitian ini adalah :
1. Anamnesis meliputi nama, umur, paritas, hari pertama haid terakhir, berat badan
sebelum hamil, pertambahan berat badan selama kehamilan, riwayat kehamilan
sebelumnya, dan riwayat penyakit sebelumnya.
2. Pemeriksaan fisik meliputi kesadaran, tinggi badan dan berat badan, tekanan darah
dan pemeriksaan tes kehamilan, dan USG sesuai Prosedur Tetap.
3. Ibu hamil yang memenuhi kriteria sebagai blighted ovum dan hamil normal diambil
darah vena sebanyak 3 cc untuk pemeriksaan serum 8-hidroksi-2-deoksiguanosin.
Sampel darah kemudian diberi label identitas sesuai nomor urut kelompok sampel
tanpa menulis diagnosis pasien. Selanjutnya sampel akan dikirim ke Laboratorium
Patologi Klinik RS Sanglah Denpasar untuk dilakukan pemeriksaan kadar
8-hidroksi-2-deoksiguanosin serum. Hasil pemeriksaan akan dikumpulkan oleh
Bagan 4.1. Alur Penelitian
4.8. Teknik Analisis Data
Hipotesis statistik :
Ho : µκ = µp Ha : µκ ≠ µp Keterangan :
µκ : rerata kadar serum 8-hidroksi-2-deoksiguanosin pada kehamilan
normal dengan umur kehamilan 7-12 minggu.
µp : rerata kadar serum 8-hidroksi-2-deoksiguanosin pada blighted ovum
dengan umur kehamilan 7-12 minggu.
Ibu Hamil yang Datang ke Poliklinik dan VK IRD RS Sanglah Denpasar Informed Consent Blighted Ovum UK 7-12 minggu ANALISIS DATA Kriteria Inklusi Hamil normal UK 7-12 minggu Serum 8 OHDG Kriteria Eksklusi Ultrasonografi(USG)
Data dalam penelitian ini diolah dengan menggunakan program Statistical Package
for The Social Sciences (SPSS) for Windows 16.0. Analisa dalam penelitian ini meliputi :
Analisa Deskriptif
Uji Normalitas Data dengan Shapiro-Wilk Test
Komparabilitas karakteristik blighted ovum dan kehamilan normal diuji dengan t-independent untuk variabel umur ibu, umur kehamilan, dan paritas.
Perbedaan rerata kadar 8-hidroksi-2-deoksiguanosin dan kehamilan normal diuji dengan uji t-independent.
BAB 5
HASIL PENELITIAN
Selama periode penelitian, telah dikumpulkan 85 sampel, dengan 4 sampel rusak,
dan kerusakan kit sebesar 14 tabung, dari total 1 kit sebanyak 96 tabung. Total sampel
yang diperoleh 82 sampel darah terdiri atas 31 orang sampel blighted ovum dan 51
orang sampel kehamilan normal.
5.1 Karakteristik Sampel
Pada studi cross sectional ini dilakukan uji beda rerata dengan menggunakan uji
t-independent untuk variabel umur ibu, umur kehamilan, paritas, dan kadar serum 8- hidroksi-2-deoksiguanosin (8-OHdG). Hasil analisis disajikan pada tabel 5.1 berikut.
Tabel 5.1
Rerata umur ibu, umur kehamilan, dan paritas pada kelompok blighted ovum dan
kelompok kehamilan normal
Karakteristik Blighted ovum
n=31
Kehamilan normal n=51
p
Umur ibu (tahun) 30,42 (SD 5,36)
30,06(SD 6,36) 0,793 Paritas 1, 58 (SD 0,80) 1,31 (SD 1,09) 0,240 Umur Kehamilan (minggu) 8,45 (SD 1,06) 8,63 (SD 1,99) 0,651
Pada tabel 5.1 menunjukkan bahwa meskipun terdapat perbedaan jumlah sampel
antara kelompok blighted ovum(n=31) dan kelompok kehamilan normal(n=51), umur
ibu pada kelompok blighted ovum dan kelompok kehamilan normal tidak berbeda
bermakna(p>0,05). Demikian juga untuk kelompok paritas dan umur kehamilan tidak
berbeda bermakna (p>0,05).
5.2. Perbedaan Kadar Serum 8-Hidroksi-2’- Deoksiguanosin Pada Kelompok Blighted Ovum Dan Kelompok Kehamilan Normal
Untuk mengetahui perbedaan rerata kadar serum 8-OHdG pada penelitian ini
dilakukan uji t-independent. Hasil analisis disajikan pada tabel 5.2.
Tabel 5.2
Perbedaan rerata kadar serum 8-OHdG pada kelompok blighted ovum dan kelompok
kehamilan normal
Kelompok
Kadar Serum 8-OHdG (ng/ml)
p Rerata SD Blighted ovum Kehamilan normal 0,177 0,111 0,06 0,02 0,001
Pada tabel 5.2 ditunjukkan bahwa rerata kadar serum 8-OHdG kelompok blighted
ovum sebesar 0,177 ng/ml (SD 0,06). Sedangkan rerata kadar serum 8- OHdG kelompok kehamilan normal sebesar 0,111 ng/ml (SD 0,02). Di mana hasil kedua
kelompok ini berbeda secara bermakna (p<0,05). Nilai cut off point kadar 8-OHdG
berdasarkan kurva ROC adalah 0,138 ng/ml dengan nilai sensitivitas 96,1 % dan nilai
BAB 6 PEMBAHASAN
Pada tubuh yang sehat, golongan oksigen reaktif (ROS) dan antioksidan berada
dalam posisi berimbang. Saat keseimbangan tersebut terganggu, terjadilah stres
oksidatif. Golongan oksigen reaktif adalah pisau bermata dua, di satu sisi mereka
berperan sebagai molekul pemberi sinyal pada proses fisiologis dan juga berperan
dalam proses patologis pada saluran reproduksi wanita. Golongan oksigen reaktif
mempengaruhi berbagai proses fisiologis mulai dari proses maturasi oosit sampai
dengan proses fertilisasi,perkembangan embrio dan kehamilan.(Agarwal et al., 2005)
Setelah proses implantasi, embrio manusia dikelilingi oleh sel-sel trofoblas
proliferatif. Kemudian trofoblas ekstravili masuk ke dalam desidua dan lapisan
miometrium yang mana akan mengelilingi dan menginvasi arteri spiralis ibu. Beberapa
bukti ilmiah melaporkan bahwa aliran darah maternal yang signifikan belum terjadi
sampai dengan akhir trimester satu. Dengan demikian, embrio berkembang di
lingkungan oksigen yang relatif rendah dibandingkan dengan kehamilan lebih lanjut.
Disebutkan dengan konsentrasi oksigen sebesar 20% berhubungan dengan kemampuan
perkembangan embrio yang lebih rendah. Perkembangan yang cepat terlihat pada
konsentrasi oksigen yang rendah (5%) (Agarwal et al., 2005).
Radikal bebas adalah molekul-molekul reaktif dengan membawa elektron yang
tidak berpasangan, yang dihasilkan di dalam sel atau karena akibat hasil dari suatu
metabolisme.Reaksi-reaksi reduktasi oksidasi pada metabolisme protein, karbohidrat,
dengan hasil akhir oksigen dan turunannya seperti superoksida dan radikal hidroksil.
Apabila stres oksidatif terjadi secara berlebihan akan mengganggu keseimbangan
seluler dan dapat menyebabkan gangguan pertumbuhan sel pada embrio atau terjadi
apoptosis yang menyebabkan fragmentasi embrio. 8-hidroksi-2-deoksiguanosin (8-
OHdG) merupakan bentuk nukleosida DNA inti dan mitokondria yang teroksidasi, dan
merupakan marker kerusakan DNA yang sering dipergunakan.(Hung et al., 2010).
Blighted ovum sebagian besar disebabkan oleh kelainan kromosom, yaitu triploidi,
dan dapat berkembang menjadi mola hidatidosa parsial (Peter Uzelac, 2008). Pada
blighted ovum, hasil konsepsi berkembang menjadi blastokis, tetapi inner mass cell dan
pole embrionik tidak pernah terbentuk (Asim Kurjak, 2003). Radikal bebas menjadi salah satu pemicu terjadinya kelainan kromosom ini. Radikal bebas merupakan senyawa
tidak stabil dan sangat reaktif, sehingga mengakibatkan kerusakan sel. Plasentasi
abnormal menyebabkan terjadinya stres oksidatif yang menghasilkan efek yang
merugikan pada sinsitiotrofoblas dan telah disebutkan sebagai salah satu mekanisme
terjadinya abortus.(Agarwal et al., 2005)
6.1 Karakteristik Sampel
Rerata umur pada blighted ovum adalah 30,42 tahun dan 30,06 tahun pada
kehamilan normal (p>0,05), secara statistik tidak berbeda bermakna. Pada penelitian
Harma, dkk. (2003) di Turki, didapatkan rerata umur ibu dengan mola hidatidosa
komplit sebesar 31,0 (SD 8,1) tahun dan rerata umur ibu dengan kehamilan normal
sebesar 29,5 (SD 5,7) tahun . Rerata paritas pada penelitian ini adalah 1,58 untuk
kelompok blighted ovum dan 1,31 untuk kelompok kehamilan normal. Di mana secara
dilakukan Okan, dkk. (2008) di Turki sebesar 2,0 (SD 1,2) dan menurut Harma dkk
(2003) rerata paritas sebesar 4,5 (SD 3,3).
Apabila dikaitkan antara umur dengan jumlah paritas, maka semakin
meningkatnya jumlah paritas akan diikuti dengan meningkatnya umur ibu. Dengan
demikian, pengaruh stres oksidatif akan meningkat pada paritas yang lebih tinggi
dikaitkan dengan peningkatan umur ibu.
Rerata usia kehamilan pada penelitian ini adalah 8,45 (SD 1,06) minggu untuk
kelompok blighted ovum, dan 8,63 (SD 1,99) untuk kelompok kehamilan normal.
Secara statistik tidak berbeda bermakna (p>0,05). Pada penelitian oleh Harma dkk
(2003) melaporkan rerata usia kehamilan pada kelompok mola hidatidosa komplit 12,9
(SD 4,8) minggu, dan kehamilan normal pada usia 13,2 (SD 4,4) minggu. Zachara dkk
(2001) menemukan bahwa rerata usia kehamilan pada kelompok abortus 12,5 (SD 2,6)
minggu, dan 11,8 (SD 3,5) minggu pada kelompok kehamilan normal.
Pada penelitian ini rerata usia kehamilan pada kelompok blighted ovum lebih rendah
dibandingkan dengan kehamilan normal. Namun, dari beberapa penelitian yang telah
dilakukan, rerata umur kehamilan yang mengalami abortus lebih rendah. Setelah
implantasi, embrio manusia dikelilingi oleh sel-sel trofoblas proliferatif. Kemudian
trofoblas ekstravili berimplantasi ke dalam desidua dan lapisan miometrium dimana
akan mengelilingi dan menginvasi arteri spiralis ibu. Hal ini mengakibatkan terjadinya
transformasi arteri, dengan mengubah struktur dinding muskulo elastik, dan
meningkatkan diameter pembuluh dengan resistansi yang rendah serta kapasitansi
pembuluh darah yang tinggi. Sirkulasi uteroplasenta dimulai dalam dua minggu pertama
setelah konsepsi, dengan vili korionik mulai berfungsi pada minggu ketiga. Bukti dari
dan studi USG Doppler dari awal terbentuknya plasenta menunjukkan, bahwa aliran
darah maternal yang signifikan tidak terjadi sampai akhir trimester pertama, sebelum 10
minggu usia kehamilan (Jacobson et al., 2006).
Dalam kasus kegagalan awal kehamilan, terjadinya sirkulasi intraplasental maternal
lebih awal dan tidak teratur dibandingkan dengan kehamilan normal. Dimulai pada
tahap awal, dan terjadi secara acak di seluruh plasenta. Ini mungkin dikarenakan 70%
invasi ekstravili trofoblas yang dangkal, dan akibatnya penyumbatan arteri spiral tidak
sempurna (Jauniaux et al., 2010). Bila terjadi stres oksidatif, maka kegagalan awal
kehamilan baik blighted ovum atau abortus terjadi pada usia kehamilan lebih dini. Dari
penelitian didapatkan hasil yang berbeda, sehingga masih diperlukan penelitian lanjutan
untuk dapat menjawab masalah ini.
6.2 Kadar Rerata Serum 8-Hidroksi-2-Deoksiguanosin (8-OHdG) Pada Blighted Ovum dan Kehamilan Normal
Pada penelitian ini diperoleh rerata kadar serum 8-OHdG pada kelompok blighted
ovum sebesar 0,177 (SD 0,06) ng/ml, lebih tinggi dari kelompok kehamilan normal sebesar 0,111 (SD 0,01) ng/ml. Pada kedua kelompok didapatkan perbedaan bermakna
secara statistik (p<0,05). Nilai cut off point kadar serum 8-OHdG berdasarkan kurva
ROC adalah 0,138 ng/ml dengan nilai sensitivitas 96,1 % dan nilai spesifisitas 80,6 %.
Dari beberapa temuan di atas, rerata kadar 8-OHdG pada awal kehamilan lebih
tinggi dibandingkan dengan kehamilan normal. Ini terjadi oleh karena ketidak
seimbangan antara golongan reaktif oksigen (ROS) dengan antioksidan yang ada. Dan
antioksidan yang tersedia tidak mampu menetralisir stres oksidatif, sehingga terjadi
blighted ovum sebagian besar disebabkan oleh kelainan kromosom. Apabila mekanisme pertahanan tubuh masih baik, maka terjadi perlindungan embrio terhadap ROS dengan
tujuan memberi keseimbangan dan mencegah terjadinya stres oksidatif. Stres oksidatif
berperan dalam terjadinya gangguan perkembangan embrio dan retardasi pertumbuhan
embrio yang dikaitkan dengan kerusakan membran sel DNA dan apoptosis. Apoptosis
menghasilkan embrio terfragmentasi, yang telah membatasi kemampuan untuk
implantasi dan mengakibatkan rendahnya keberhasilan fertilisasi (Agarwal et al., 2005).
Stres oksidatif timbul sebagai akibat dari produksi ROS yang berlebihan dan, atau
mekanisme pertahanan antioksidan yang terganggu. Tinjauan literatur menunjukkan
bahwa stres oksidatif memicu berbagai patologi fungsi reproduksi. Pada sistem
reproduksi laki-laki, bukti jelas menunjukkan bahwa sperma manusia dapat
menghasilkan ROS. Sayangnya, spermatozoa tidak dapat memperbaiki kerusakan yang
disebabkan oleh ROS yang berlebihan, karena mereka tidak memiliki sistem enzim
sitoplasma, yang diperlukan untuk mencapai perbaikan ini. Stres oksidatif menyerang
fluiditas membran plasma sperma dan integritas DNA di dalam inti sperma. Oksigen
spesies reaktif yang menyebabkan kerusakan DNA dapat mempercepat proses apoptosis
sel, yang mengarah ke penurunan jumlah sperma yang berhubungan dengan infertilitas
laki-laki. Oleh karena itu, ROS mungkin memainkan peran dalam pasien dengan
infertilitas idiopatik. Dari beberapa penelitian menunjukkan bahwa ROS yang terdapat
pada cairan folikel dengan konsentrasi yang rendah, dapat menjadi penanda potensial
untuk memprediksi keberhasilan pada pasien in vitro fertilization (IVF). Ada
kecenderungan yang lebih tinggi perkembangan blastokista dengan tingkat rendah ROS
dalam cairan hidrosalping. Dengan demikian, rendahnya ROS dapat menjadi penanda
memainkan peran penting dalam fungsi reproduksi normal, sedangkan tingkat tinggi
akan menyebabkan berbagai kondisi patologis yang mempengaruhi fertilisasi manusia.
Strategi pengobatan harus diarahkan untuk menurunkan tingkat ROS dalam menjaga
jumlahnya sedikit, sehingga dapat diperlukan untuk mempertahankan fungsi sel normal
(Agarwal et al., 2005)
Delapan-hidroksi-2-deoksiguanosin (8-OHdG) adalah indikator kerusakan DNA
yang sensitif sebagai akibat stres oksidatif. 8-OHdG itu sendiri mempunyai peran
biologi yang mampu menginduksi konversi G:C ke T:A selama replikasi DNA. Juga
digunakan sebagai biomarker pada karsinogenesis ginjal, diabetes melitus, kanker dan
proses penuaan (Seino et al., 2002 dikutip dari Kasai dan Nishimura, 1984). Adanya
pemeriksaan yang sensitif untuk 8-OHdG menyebabkan 8-OHdG ini dipakai di banyak
laboratorium sebagai biomarker kerusakan oksidasi DNA. Pada sistem reproduksi
wanita, ROS dan antioksidan mempunyai peran fisiologi selama proses folikulogenesis,
maturasi oosit, regresi luteal dan fertilisasi (Agarwal et al., 2005). Disebutkan juga
bahwa 8-OHdG tidak hanya sebagai marker stres oksidatif pada sel granulosa selama
proses ovulasi sehingga mempengaruhi fertilisasi tetapi juga mempengaruhi
pertumbuhan embrio (Seino et al., 2002).
Embrio dapat tumbuh dan berkembang baik dalam keadaan rendah oksigen
terutama masa implantasi. Apabila terjadi peningkatan konsentrasi oksigen dapat
memicu terbentuknya radikal bebas yang bersifat toksik terhadap embrio terutama
sinsitiotropoblas. Pada dua pertiga kasus abortus, terdapat bukti anatomis adanya defek
pada plasentasi yang memiliki karakteristik lapisan pelindung trofoblas yang lebih tipis
maupun berfragmentasi, invasi endometrium oleh trofoblas yang menurun dan
adanya perubahan fisiologis pada sebagian besar arteri spiralis dan menyebabkan onset
prematus dari sirkulasi maternal pada seluruh plasenta.
Karena ROS memiliki fungsi fisiologis dan patologis, maka tubuh manusia
mengembangkan sistem pertahanan untuk memelihara konsentrasinya dalam kadar
tertentu. Sistem reproduksi wanita kaya akan antioksidan enzimatik dan non-enzimatik.
Katalase, SOD dan GPx adalah antioksidan enzimatik yang mencegah dan menjaga
keseimbangan agar ROS tidak sampai merusak molekul selular. Antioksidan
non-enzimatik terdapat di folikel dan cairan tuba, yang memberikan perlindungan eksterna
pada gamet dan embrio. Antioksidan ini adalah vitamin C, vitamin E, glutathione, taurin
hipotaurin. Bilamana terjadi peningkatan konsentrasi ROS patologis dan stres oksidatif
(OS) timbul, antioksidan bekerja dengan cara mencegah formasi ROS yang dapat
menyebabkan kerusakan sel dan memperbaikinya (Agarwal et al., 2005).
6.3. Kelemahan Penelitian
Kelemahan penelitian ini adalah jumlah sampel yang terbatas dan waktu yang relatif
singkat. Kadar 8-OHdG yang diperiksa berasal dari serum, dimana faktor-faktor
perancu seperti merokok, dan diabetes melitus sangat mungkin berpengaruh dan tidak
BAB 7
SIMPULAN DAN SARAN
7.1 Simpulan
Berdasarkan penelitian tersebut diatas dapat disimpulkan bahwa terdapat perbedaan
rerata kadar serum 8-hidroksi-2-deoksiguanosin (8-OHdG) pada blighted ovum dan
kehamilan normal, dimana kadar serum 8-OHdG secara bermakna pada blighted ovum
lebih tinggi daripada kehamilan normal, dengan nilai cut off point kadar serum 8-OHdG
sebesar 0,138 ng/ml dengan sensitivitas 96,1% dan spesifisitas 80,6%.
7.2 Saran
Hasil penelitian menunjukkan bahwa oksidasi DNA yang dinilai melalui kadar
serum 8-OHdG mungkin terlibat dalam terjadinya blighted ovum. Namun diperlukan
penelitian lebih lanjut dari populasi yang berbeda sehingga kadar serum 8-OHdG dapat
digunakan sebagai skrining terhadap kemungkinan terjadinya blighted ovum dan
DAFTAR PUSTAKA
Agarwal, A.; Gupta,S. and Sharma R.K. 2005. Role of oxidative stress in female reproduction. Reproductive Biology and Endocrinology 3 : 28.
Behrman, H.R.; Kodaman, P.H.; Preston, S.L. and Gao, S. 2001. Oxidative stress and the ovary. J.Soc Gynecol Investig 8 (suppl.1):S40-S42.
Brand, M.D.; Buckingham, A.J.; Esteves, T.C. et al. 2004. Mithochondrial superoxide and ageing: uncoupling protein activity and superoxide production. Biochem Soc Symp 71:203-213.
Cunningham, F.G.; Gant, N.F.; Leveno, K.J.; Bloom,S.L.; Hauth, J.C.;Rouse, D.J. and Spong, C.Y. 2010. Williams Obstetric. Twenty third edition. The Mcgraw-Hill Companies.
DNA damage ELISA kit : For the detection and quantification of 8-hydroxy-2’-deoxiguanosine in urine,serum, and saliva samples. www.assaydesigns.com Toll free 1-800-833-8651 Fax 734-668-2793.
Dizdaroglu, M.; Jaruga, P.; Birincioglu, M. and Rodriguez, H. 2002. Free radical-induced damage to DNA : mechanisms and measurement. Free Radical Biology & Medicine 32(11): 1102-1115.
Gracia, C.R.; Sammel, M.D.; Chittams, J.; Hummel, A.C.; Shaunik, A. and Barnhart, K.T. 2005. Risk factors for spontaneous abortion in early symptomatic first-trimester pregnancies. Americans College of Obstretrician and Gynecologists 106(5): 993-999. Griebel, C.P.; Halvorsen, J.; Golemon, T.B. and Day, A.A. 2005. Management of spontaneous abortion. Am Fam Physician 72 : 1243-1250.
Hardy, K.; Spanos, S.; Becker, D.; Iannelli ,P.; Winston, R.M.L. and Stark, J. 2000. From cell death to embryo arrest : mathematical models of human preimplantation embryo development. PNAS 98 : 1655-1660.
Harma, M.; Erel, O. 2003. Increased oxidative stress in patients with hydatidiform mole. Swiss Med Wkly 133: 563-566.
Halliwell, B. 2000. Why and how should we measured oxidative DNA damage in nutritional studies? how far have we come?. Am J Clin Nutr 72 : 1082-1087.
Hasegawa, I.; Takakuwa, K. and Tanaka, K. 1996. The role of oligomenorrhoea and fetal chromosomal abnormalities in spontaneous abortions. Human Reproduction 11:2304-2305.
Helbock, H.J.; Beckman K.B. and Ames, B.N.1999. hydroxydoxyguanosine and
8-hydroxyguanine as biomarkers of oxidative DNA damage. Methods in Enzymology 300 (18):
156.
Huang Y.T., Horng S.G., Lee F.K., Tseng Y.T. 2010. Management of Anembryonic Pregnancy Loss : An Observational Study. J Chin Med Assoc 73 : 150-155.
Hung, T.H.; Lo, L.M.; Chiu, T.H.; Li , M.J.; Yeh, Y.L.; Chen, S.F. and Hsieh, T.T. 2010. A longitudinal study of oxidative stress and antioxidant status in women with uncomplicated pregnancies throughout gestation. Reproductive Sciences 17: 401-409. Jacobson, G.A., Narkowicz, C., Tong, Y.C., Peterson, G.M. 2006. Plasma Glutathione Peroxidase by ELISA and Relationship to Selenium Level. Clinica Chimica Acta, 369:100-103.
Jauniaux, E., Poston, L., Burton, G.J. 2006. Placental-Related Diseases of Pregnancy : Involvement of Oxidative Stress and Implications in Human Evolution. Hum Reprod Update 12(6):747-55.
Kohen, R. and Nyska, A. 2002. Oxidation of biological systems: oxidative stress phenomena, antioxidants, redox reactions,and methods for their quantification. The Society of Toxicologic Pathology 30:620-650.
Kurjak, Asim. 2003. Donald School Textbook of Ultrasound in Obstetrics and Gynecology. Parthenon Publishing 13: 147-8.
Ledo, A.; Arduini, A.; Asensi, M.A.; Sastre, J.; Escrig, R.; Brugada, M.; Aguar, M.; Saenz, P. and Vento, M. 2009. Human milk enhances antioxidant defences against hydroxyl radical aggression in preterm infants. The American Journal of Clinical Nutrition 89:210-215.
Morin L., Van den Hof M. 2005. Ultrasound Evaluation of First Trimester Pregnancy Complications. SOGC Clinical Practice Guidelines 161:581-585.
Nyobo Andersen A.M., Wohlfahrt J., Christens P., Olsen J., Melbye M. 2000. Maternal age and fetal loss: population based register linked study. Br Med J 320:1708-12
Okan, O., Mekin, S., Hakan, K. 2008. Serum Malondialdehyde, Erythrocyte Glutation Peroxidase, and Erythrocyte Superoxide Dismutase Levels in Woman With Early Spontaneous Abortion Accompanied by Vaginal Bleeding. Med Sci Monit, Vol.14, No.1, pp.47-51.
Ruder, E.H.; Hartman, T.J. and Goldman, M.B. 2009. Impact of oxidative stress on female fertility. Curr Opin Obstet Gynecol 21(3):219-222.
Ruder, E.H.; Hartman, T.J.; Blumberg, J. and Goldman, M.B. 2008. Oxidative stress and antioxidants : Impact on female fertility. Human Reproduction Update 14(4) : 345-357.
Sastroasmoro,S. dan Ismael, S. 2010. Dasar-dasar metodologi penelitian klinis. Sagung Seto 16:302-330.
Seino, T.; Saito, H.; Kaneko, T.; Takahashi, T.; Kawachiya, S. and Kurachi, H. 2002. Eight-hydroxy-2;-deoxyguanosine in granulose cells is correlated with the quality of oocyte and embryo in an in vitro fertilization-embryo transfer program. American Society for Reproductive Medicine 77(6): 1184-1190.
Takami,M.;Preston,S.L. and Behrman,H.R. 2000. Eicosatetraynoic and eicosatriynoic acids, lipoxygenase inhibitors block meiosis via antioxidant action. Am J Physiol Cell Physiol 278:C646-C650.
Tamura, H.; Takasaki, A.; Miwa, I.; Taniguchi, K.; Maekawa, R.; Asada, H.; Taketani, T.; Matsuoka, A.; Yamagata, Y.; Shimamura, K.; Morioka, H.; Ishikawa, H.; Reiter, R.J. and Sugino, N. 2008. Oxidative stress impairs oocyte quality and melatonin protects oocytes from free radical damage and improve fertilization rate. Journal of Pineal Research 44: 280-287.
Uzelac, Peter S., Garmel, Sara H. 2008 Early Pregnancy Risks. 14:259-60.
Vern, KL. 2007. Comprehensive Gynecology. Mosby Elsevier. 5th Edition. 16 : 309-11.
Wiktor, H.; Kankofer, M.; Schmerold, I.; Dadak, A.; Lopucki, M. and Niedermuller, H. 2004. Oxidative DNA damage in placentas from normal and pre-eclamptic pregnancies.Virchows Arch 445: 74-78.
Zachara, B.A., Dobrzynsksi, W., Trafikowska, U., Szymanski, W. 2001. Blood Selenium and Glutathione Peroxidase In Miscarriage. British Journal of Obstetrics and Gynaecology, 108:244-247.
Zhang, H.; Xu, Y.; Kamendulis, L.M. and Klaunig, J.E. 2000. Morphological transformation by 8-hydroxy-2’-deoxyguanosine in syrian hamster embryo (SHE) cells. Toxicological Sciences 56:303-312.
Zuelke.K.A;Jones, D.P. and Perreault, S.D.1997. Glutathion oxidation is associated with altered microtube function and disrupted fertilization in mature hamster oocytes. Mol Reprod 57: 1413-1419.
DATA PENELITIAN Blighted Ovum No Nama Umur (tahun) Paritas Diagnosis Hamil Muda Kadar 8 OHdG (ng/mL) 1 SS 30 2 10-11 mg 0.364 2 YS 20 1 8-9 mg 0.203 3 KS 27 2 9-10 mg 0.136 4 JS 27 2 8-9 mg 0.151 5 LA 28 2 8-9 mg 0.167 6 NS 37 3 7-8 mg 0.171 7 ST 30 2 10-11 mg 0.138 8 DS 37 2 9-10 mg 0.136 9 KM 32 2 7-8 mg 0.171 10 SP 40 2 11-12 mg 0.156 11 MJ 27 2 9-10 mg 0.149 12 KN 20 1 8-9 mg 0.139 13 HM 30 0 8-9 mg 0.143 14 LS 31 0 9-10 mg 0.132 15 NH 29 1 7-8 mg 0.389 16 PS 33 1 9-10 mg 0.165 17 SW 38 2 8-9 mg 0.269 18 DA 23 1 10-11 mg 0.183 19 NL 29 2 9-10 mg 0.278 20 BI 27 2 8-9 mg 0.144 21 AS 27 2 9-10 mg 0.159 22 MM 34 0 8-9 mg 0.152 23 YA 30 1 7-8 mg 0.194 24 SE 22 1 8-9 mg 0.154 25 LI 37 3 10-11 mg 0.144 26 LL 29 1 7-8 mg 0.176 27 IS 37 3 8-9 mg 0.138 28 WS 26 1 9-10 mg 0.148 29 SP 35 2 7-8 mg 0.162 30 RA 33 2 8-9 mg 0.133 31 WD 38 1 9-10 mg 0.147
Kehamilan Normal No Nama Umur (tahun) Paritas Diagnosis Hamil Muda Kadar 8 OHdG (ng/mL) 1 NW 25 0 8-9 mg 0.103 2 WS 22 0 7-8 mg 0.096 3 NR 25 0 7-8 mg 0.132 4 MS 35 1 9-10 mg 0.125 5 SK 35 1 9-10 mg 0.129 6 AD 22 0 11-12 mg 0.125 7 IK 24 0 10-11 mg 0.082 8 AS 28 1 9-10 mg 0.13 9 SJ 35 1 10 mg 0.129 10 PP 34 1 11-12 mg 0.129 11 LT 31 1 11-12 mg 0.121 12 WY 27 2 8-9 mg 0.128 13 SU 27 2 8-9 mg 0.089 14 LW 29 1 9 mg 0.076 15 PE 20 1 10-11 mg 0.132 16 DA 22 0 9-10 mg 0.112 17 WE 30 0 8-9 mg 0.11 18 BU 21 1 9-10 mg 0.117 19 EN 36 1 8-9 mg 0.1 20 JU 40 3 11-12 mg 0.101 21 JA 23 2 10-11 mg 0.122 22 SN 25 0 8-9 mg 0.097 23 IL 24 0 8-9 mg 0.124 24 KA 36 1 9 mg 0.118 25 EK 26 1 10-11 mg 0.086 26 SC 22 0 11-12 mg 0.12 27 WA 38 3 10-11 mg 0.072 28 SS 38 2 11-12 mg 0.073 29 AN 29 1 11-12 mg 0.089 30 ST 28 1 9-10 mg 0.128 31 VA 29 1 9-10 mg 0.091 32 LM 31 2 7-8 mg 0.103 33 EH 42 3 7-8 mg 0.129 34 AY 41 3 8 mg 0.121 35 EA 23 3 7-8 mg 0.099 36 SN 36 2 10-11 mg 0.1 37 MU 39 2 10-11 mg 0.101 38 RT 37 2 8 mg 0.13 39 MA 23 0 8-9 mg 0.131
40 AN 32 2 11-12 mg 0.119 41 RU 24 0 7-8 mg 0.128 42 PA 38 2 8-9 mg 0.116 43 KR 42 4 7-8 mg 0.118 44 SW 31 4 8 mg 0.119 45 AA 32 0 10-11 mg 0.129 46 KS 40 2 11-12 mg 0.11 47 SN 25 1 7-8 mg 0.125 48 SI 30 2 8-9 mg 0.12 49 SD 30 2 9-10 mg 0.11 50 MR 24 1 11-12 mg 0.098 51 RD 27 1 7-8 mg 0.089
HASIL PENELITIAN Uji Normalitas Data
Group Statistics
Kelompok N Mean Std. Deviation Std. Error Mean
Umur (Tahun) HAMIL NORMAL 51 30.0588 6.36054 .89065
BLIGHTED OVUM 31 30.4194 5.36516 .96361
Paritas HAMIL NORMAL 51 1.3137 1.08610 .15208
BLIGHTED OVUM 31 1.5806 .80723 .14498
Umur Kehamilan(Minggu) HAMIL NORMAL 51 8.6275 1.98958 .27860
BLIGHTED OVUM 31 8.4516 1.05952 .19030
Kadar 8 OHDG(ng/ml) HAMIL NORMAL 51 .11139 .017220 .002411
BLIGHTED OVUM 31 .17713 .063347 .011377
Uji t-independent
Independent Samples Test
Levene's Test for Equality of
Variances t-test for Equality of Means
F Sig. T Df Sig. (2-tailed) Mean Difference Std. Error Differen ce 95% Confidence Interval of the Difference Lower Upper Umur Equal variances assumed 2.283 .135 -.264 80 .793 -.36053 1.36796 -3.08285 2.36179 Equal variances not assumed -.275 71.739 .784 -.36053 1.31218 -2.97647 2.25541 Paritas Equal variances assumed 2.892 .093 -1.183 80 .240 -.26692 .22564 -.71595 .18211 Equal variances not assumed -1.270 76.657 .208 -.26692 .21012 -.68535 .15151
Umur Kehamilan Equal variances assumed 12.554 .001 .454 80 .651 .17584 .38749 -.59530 .94697 Equal variances not assumed .521 78.911 .604 .17584 .33738 -.49572 .84740 Kadar 8 OHDG Equal variances assumed 15.273 .000 -7.021 80 .000 -.065737 .009363 -.084369 -.047105 Equal variances not assumed -5.652 32.716 .000 -.065737 .011630 -.089406 -.042067
Area Under the Curve
Test Result Variable(s):Kadar 8 OHDG(ng/ml)
Area Std. Errora Asymptotic Sig.b
Asymptotic 95% Confidence Interval
.999 .001 .000 .997 1.001 a. Under the nonparametric assumption
b. Null hypothesis: true area = 0.5
Coordinates of the Curve
Test Result Variable(s):Kadar 8 OHDG(ng/ml) Positive if Less Than
or Equal Toa Sensitivity 1 – Specificity
.00000 .000 .000 .07250 .020 .000 .07450 .039 .000 .07900 .059 .000 .08400 .078 .000 .08750 .098 .000 .09000 .157 .000 .09350 .176 .000 .09650 .196 .000 .09750 .216 .000 .09850 .235 .000 .09950 .255 .000 .10050 .294 .000 .10200 .333 .000 .10650 .373 .000 .11100 .431 .000 .11400 .451 .000 .11650 .471 .000 .11750 .490 .000 .11850 .529 .000 .11950 .569 .000 .12050 .608 .000 .12150 .647 .000 .12300 .667 .000 .12450 .686 .000 .12650 .745 .000 .12850 .804 .000
.12950 .902 .000 .13050 .941 .000 .13150 .941 .000 .13250 .941 .032 .13450 .961 .065 .13700 .961 .129 .13850 .961 .194 .14100 .961 .226 .14350 1.000 .258 .14550 1.000 .323 .14750 1.000 .355 .14850 1.000 .387 .15000 1.000 .419 .15150 1.000 .452 .15300 1.000 .484 .15500 1.000 .516 .15750 1.000 .548 .16050 1.000 .581 .16350 1.000 .613 .16600 1.000 .645 .16900 1.000 .677 .17350 1.000 .742 .17950 1.000 .774 .18850 1.000 .806 .19850 1.000 .839 .23600 1.000 .871 .27350 1.000 .903 .32100 1.000 .935 .37650 1.000 .968 1.00000 1.000 1.000
a. The smallest cutoff value is the minimum observed test value minus 1, and the largest cutoff value is the maximum observed test value plus 1. All the other cutoff values are the averages of two consecutive ordered observed test values.