1 BAB I PENDAHULUAN
A. Latar Belakang
Indonesia merupakan negara beriklim tropis dengan keberagaman flora dan fauna. Masyarakat Indonesia memanfaatkan kekayaan flora yang ada disekitarnya menjadi obat yaitu dengan mengolahnya menjadi Jamu. Hingga saat ini banyak masyarakat yang masih mengkonsumsi Jamu sebagai suplemen tubuh maupun untuk mengobati penyakit-penyakit tertentu. Salah satu contoh jamu yang terkenal adalah kunyit asam. Khasiat utama dari kunyit berasal dari kandungan zat aktif kurkuminoid di dalamnya yaitu kurkumin. Kurkumin merupakan bagian pigmen kuning yang terdapat dalam rimpang. Sebuah studi mengenai senyawa kurkumin menunjukkan bahwa senyawa ini memiliki sejumlah aktivitas biologis seperti antibakteri, antiprotozoa, antivirus, antiinflamasi (Chattopadhyay dkk., 2004), antioksidan (Rao, 1997), antitumor dan antikarsinogenik (Huang dkk., 1997).
Kurkumin terdapat pada berbagai genus Curcuma dalam jumlah yang relatif kecil dan variasi struktur yang terbatas. Hal ini merupakan kendala bagi penggunaan kurkumin dalam bidang pengobatan mengingat aktivitas biologis kurkumin yang poten dan beragam. Selain jumlah yang cukup juga dibutuhkan variasi struktur yang beragam. Kondisi ini sulit diperoleh melalui isolasi bahan alam sehingga dilakukan penelitian untuk mengembangkan metode sintesis kurkumin (Pedersen dkk., 1985).
Penelitian untuk mensintesis senyawa-senyawa analog kurkumin telah berhasil dilakukan dan dihasilkan 47 molekul berbeda. Berdasarkan struktur cincin tengahnya, senyawa-senyawa ini dibagi menjadi tiga seri (Heksagamavunon, Pentagamavunon, dan Gamavuton). Salah satu dari 47 senyawa analog kurkumin hasil sintesis Sardjiman (2000) adalah 1,5-bis -(4'-triflorometilfenil)-penta-1,4-dien-3-on atau senyawa dengan kode C7 (seri Gamavuton, struktur tengah tanpa cincin yang terikat pada karbonil). Senyawa ini memiliki aktivitas sebagai antibakteri. Aktivitas antibakteri dari senyawa ini masih kurang baik sehingga perlu dilakukan penelitian lebih lanjut untuk mendapatkan senyawa turunan C7 dengan aktivitas yang lebih baik (Sardjiman, 2000).
PGV-0 (Pentagamavunon-0) merupakan satu dari 47 senyawa analog kurkumin hasil sintesis Sardjiman (2000) yang telah dipatenkan (Sardjiman dkk., 2004). PGV-0 memiliki aktivitas antioksidan (Sardjiman, 1997), antiinflamasi, dan antikanker yang lebih baik dibandingkan dengan kurkumin (Da’i, 1998). PGV-0 memiliki kesamaan stuktur dengan kurkumin, keduanya memiliki profil farmakokinetika yang kurang baik. Kadar PGV-0 dan kurkumin dalam darah cepat hilang sehingga profil kadar dalam darahnya mengalami fluktuasi terutama dengan pemberian oral (Hakim dkk., 2004). Mengacu pada senyawa metabolit dari kurkumin yaitu tetrahidrokurkumin (THC), maka Ritmaleni dan Simbara (2010) melakukan sintesis terhadap senyawa Tetrahidropentagamavunon-0 (THPGV-0). Senyawa ini merupakan senyawa metabolit dari PGV-0. Sintesis dilakukan dengan starting material PGV-0 melalui reaksi hidrogenasi (reduksi dengan gas hidrogen) menggunakan pelarut metanol. Katalis yang digunakan
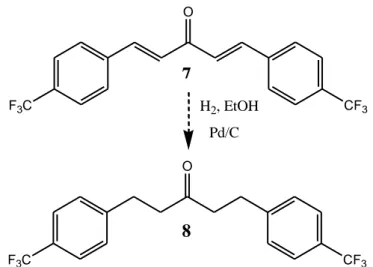
adalah paladium karbon 10% (Pd/C). Senyawa THPGV-0 hasil hidrogenasi memiliki aktivitas antioksidan yang lebih baik dibandingkan PGV-0 maupun kurkumin (Ritmaleni dan Simbara, 2010). Widyastani (2012) menjelaskan bahwa bentuk tereduksi (terhidrogenasi) memiliki aktivitas biologis yang relatif lebih baik. Senyawa 1,5-bis-(4'-triflorometilfenil)-pentan-3-on (THC7, Tetrahidro-C7) merupakan bentuk modifikasi (terhidrogenasi) dari 1,5-bis -(4'-triflorometilfenil)-penta-1,4-dien-3-on (C7). Senyawa tersebut (THC7) diprediksi memiliki aktivitas biologis yang lebih baik dibandingkan bentuk tidak terhidrogenasinya (C7).
Metode hidrogenasi yang digunakan oleh Ritmaleni dan Simbara (2010) telah berhasil diaplikasikan pada beberapa penelitian terhadap sintesis senyawa analog tetrahidrokurkumin yang lain seperti Tetrahidro-pentagamavunon-1 (THPGV-1) dari starting material Pentagamavunon-1 (PGV-1) (Andhini, 2012), Tetrahidro-heksagamavunon-5 (THHGV-5) dari starting material
Heksagamavunon-5 (HGV-5) (Wibowo, 2013) dan Tetrahidro-heksagamavunon-7 (THHGV-7) dari starting material Heksagamavunon-7 (HGV-7) (Praditya, 2014). Metode hidrogenasi tersebut diharapkan dapat diterapkan pada senyawa 1,5-bis -(4'-triflorometilfenil)-penta-1,4-dien-3-on (C7) sebagai starting material untuk mensintesis bentuk terhidrogenasinya yaitu 1,5-bis -(4'-triflorometilfenil)-pentan-3-on (THC7).
Sintesis 1,5-bis-(4'-triflorometilfenil)-pentan-3-on (THC7) dengan
starting material 1,5-bis-(4'-triflorometilfenil)-penta-1,4-dien-3-on (C7) melalui reaksi hidrogenasi (reduksi dengan gas hidrogen) belum pernah dilakukan sebelumnya. Hasil dari sintesis tersebut diharapkan dapat bermanfaat untuk pengembangan senyawa analog kurkumin yang aman, stabil, memiliki aktivitas
biologis yang lebih baik dan spesifik dibandingkan kurkumin itu sendiri sehingga dapat membantu dalam penemuan obat baru.
B. Rumusan Masalah
Apakah senyawa 1,5-bis-(4'-triflorometilfenil)-pentan-3-on (THC7) dapat disintesis dari starting material 1,5-bis -(4'-triflorometilfenil)-penta-1,4-dien-3-on (C7) melalui reaksi hidrogenasi (reduksi) dengan menggunakan katalis paladium karbon (Pd/C) dalam pelarut etanol?
C. Pentingnya Penelitian Diusulkan
Penelitian ini bermanfaat untuk pengembangan senyawa analog kurkumin yang aman, stabil, memiliki aktivitas biologis yang lebih baik dan spesifik dibandingkan kurkumin itu sendiri sehingga dapat membantu dalam penemuan obat baru.
D. Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui apakah senyawa 1,5-bis -(4'-triflorometilfenil)-pentan-3-on (THC7) dapat disintesis dari starting material
1,5-bis-(4'-triflorometilfenil)-penta-1,4-dien-3-on (C7) melalui reaksi hidrogenasi (reduksi) dengan menggunakan katalis paladium karbon (Pd/C) dalam pelarut etanol.
E. Studi Pustaka 1. Kurkumin
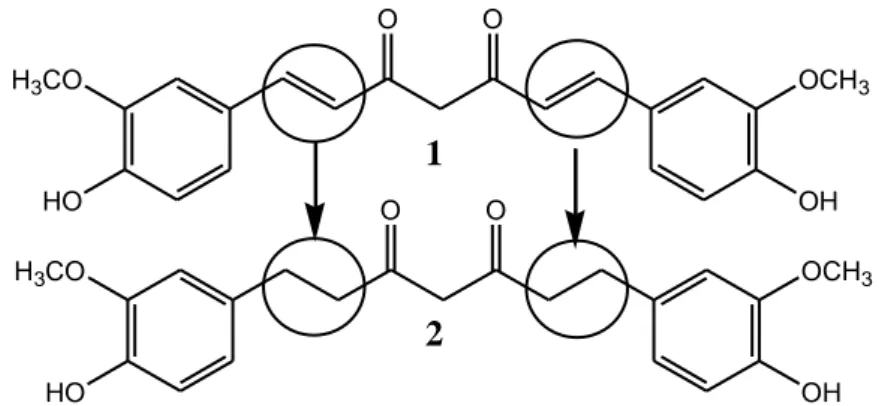
Kurkumin 1 atau 1,7-bis -(4'-hidroksi-3'-metoksifenil)-1,6-heptadiena-3,5-dion adalah senyawa yang didapat dari tanaman kunyit (Curcuma Longa L.) dan telah berhasil dikembangkan sintesisnya (Pabon, 1964). Kurkumin telah diketahui memiliki aktivitas biologis sebagai antiinflamasi, antitrombosis, antioksidan, antimutagen, antiviral, antiparasitik, dan antimikrobial (Majeed dkk., 1995). HO O O OCH3 H3CO OH HO O O OCH3 H3CO OH
Gambar 1. Struktur Kurkumin (1) dan Tetrahidrokurkumin (2) (Huang dkk, 1995)
Aktivitas antioksidan kurkumin dipengaruhi oleh gugus hidroksi aromatik terminal dan gugus β-diketon. Kurkumin telah terbukti memiliki aktivitas antimutagenik dan antikanker pada senyawa kurkumin (Kuttan dkk., 1985). Berbagai penelitian lain juga mendukung efek antikanker dan antiinflamasi pada senyawa kurkumin (Nagabushan dan Bhide, 1992; Huang dkk., 1994). Kurkumin memiliki aktivitas penghambat siklooksigenase (COX) sebesar 79% (van der Goot, 1997) dan diduga bersifat COX-2 selektif. Kurkumin tidak toksik pada gastrointestinal meskipun pada dosis tinggi (Kawamori dkk., 1999).
Kurkumin tidak larut dalam air namun larut dalam pelarut organik seperti kloroform. Secara umum, pada pH di bawah 6,5 kurkumin stabil dan
1
terdekomposisi dalam pH netral hingga pH basa. Terjadi perbedaan kinetika degradasi yang signifikan pada kurkumin antara rentang suasana pH 6,5 hingga pH 6,8. Kurkumin terdekomposisi 90% dalam waktu 30 menit dalam sistem inkubasi dengan buffer fosfat 0,1 M dan suhu 37 °C. Senyawa trans -6-(4'-hidroksi-3'-metoksifenil)-2,4-diokso-5-heksenal diketahui sebagai produk utama degradasi kurkumin dan produk samping berupa vanilin dan asam ferulat. Jumlah vanilin akan meningkat seiring dengan bertambahnya waktu inkubasi (Wang dkk., 1997).
2. Tetrahidrokurkumin (THC)
Senyawa tetrahidrokurkumin 2 atau 1,7-bis -(4'-hidroksi-3'-metoksifenil)-heptana-3,5-dion adalah metabolit utama kurkumin. Senyawa ini memiliki aktivitas biologi sebagai antioksidan dan antikanker (Pan dkk., 1999). Struktur senyawa ini analog dengan kurkumin. Perbedaan struktur kedua senyawa ini terletak pada ikatan karbon-α,β. Gambar 1 memperlihatkan bahwa pada kurkumin ikatan tersebut merupakan ikatan rangkap (tak jenuh) sedangkan pada tetrahidrokurkumin ikatannya adalah ikatan tunggal (jenuh). Perbedaan tersebut menyebabkan terjadinya perbedaan warna pada kedua senyawa, kurkumin memiliki warna kuning sedangkan tetrahidrokurkumin berwarna putih. Tetrahidrokurkumin yang merupakan bentuk tereduksi dari kurkumin bersifat lebih hidrofil dibanding kurkumin sehingga tetrahidrokurkumin memiliki kestabilan yang lebih baik dalam media berair (Sneharani dkk., 2001).
Tetrahidrokurkumin dapat disintesis melalui proses hidrogenasi dari kurkumin menggunakan katalis PtO2. Senyawa ini memiliki aktivitas antioksidan
yang lebih baik dibanding kurkumin. Sugiyama dkk, melaporkan bahwa mekanisme antioksidan tersebut dipengaruhi oleh bagian gugus β-diketon dari tetrahidrokurkumin (Sugiyama, 1996). Tetrahidrokurkumin terbukti memiliki potensi besar sebagai agen kemopreventif baru yang lebih poten dari kurkumin dan telah diuji secara in-vivo (Lai dkk., 2011).
3. Senyawa-senyawa analog kurkumin hasil sintesis
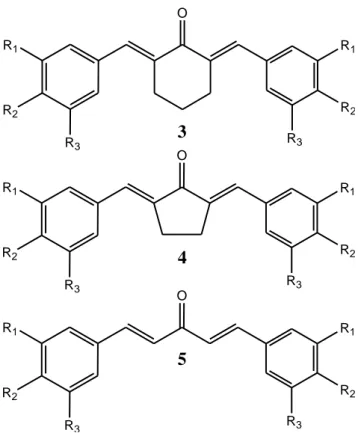
Sejak beberapa dekade terakhir, kurkumin telah banyak diteliti dan dikembangkan dengan harapan dapat ditemukan senyawa analog kurkumin dengan aktivitas yang lebih baik dibandingkan kurkumin itu sendiri. Berbagai peneliti dari seluruh dunia telah mencoba melakukan sintesis terhadap senyawa analog kurkumin dan meneliti berbagai aspek farmakologi dan farmakokinetik dari masing-masing senyawa mereka. Sardjiman (2000), telah berhasil mensintesis 47 senyawa analog kurkumin dengan harapan dapat menemukan senyawa yang memiliki aktivitas lebih baik dibanding kurkumin. Beberapa dari senyawa-senyawa tersebut memiliki aktivitas biologis yang cukup poten dibandingkan kurkumin itu sendiri dan telah dipatenkan (Sardjiman dkk., 2004). Senyawa-senyawa ini dibagi menjadi tiga kelompok berdasarkan struktur cincin tengahnya yaitu Heksagamavunon 3 (kode A), Pentagamavunon 4 (kode B), dan Gamavuton 5 (kode C).
O R1 R2 R3 R1 R2 R3 O R1 R2 R3 R1 R2 R3 O R1 R2 R3 R1 R2 R3
Gambar 2. Struktur Heksagamavunon (3), Pentagamavunon (4), dan Gamavuton (5)
(Sardjiman, 2000)
4. Pentagamavunon-0 dan Tetrahidropentagamavunon-0
Senyawa 2,5-bis-(4'-hidroksi-3-metoksibenzilidin)-siklopentanon adalah salah satu senyawa analog kurkumin hasil sintesis oleh Sardjiman (2000). Senyawa ini bersama aktivitas biologisnya telah dipatenkan dengan nama PGV-0 (Pentagamavunon-0) (Sardjiman dkk., 2004). Sardjiman melaporkan bahwa aktivitas antioksidan PGV-0 lebih baik daripada kurkumin (Sardjiman, 1997). Senyawa PGV-0 diketahui memiliki aktivitas antiinflamasi yang lebih baik dibandingkan dengan kurkumin. Aksi farmakologis PGV-0 sebagai antiinflamasi yaitu dengan menghambat biosintesis prostaglandin melalui jalur siklooksigenase (Nurrochmad, 1997). Meiyanto (2007) meneliti bahwa PGV-0 juga dapat menginduksi apoptosis pada sel kanker payudara T47D melalui uji immunositokimia dan western blot. Hasil penelitian tentang farmakokinetika yang
5 4 3
telah dilakukan menunjukkan bahwa profil kadar PGV-0 dalam darah mengalami fluktuasi terutama dengan pemberian oral (Hakim dkk., 2004).
Ritmaleni dan Simbara (2010) telah berhasil mereduksi Pentagamavunon-0 (PGV-0) 6a menjadi Tetrahidropentagamavunon-0 6b (THPGV-0). Tetrahidropentagamavunon-0 dipercaya merupakan senyawa hasil metabolit PGV-0 didalam tubuh. Reaksi dilakukan melalui reaksi hidrogenasi menggunakan gas hidrogen (H2) dengan katalis paladium karbon (Pd/C). Hasil sintesis berupa padatan serbuk putih dengan jumlah rendemen sebesar 24% dan jarak lebur senyawa 122,2-123,4 °C. Mintariyanti (2010) mengemukakan bahwa pelarut protik terbaik yang dapat digunakan untuk hasil optimum dari reaksi hidrogenasi tersebut adalah etanol dengan hasil rendemen hingga 44%.
O OCH3 OH H3CO HO O OCH3 OH H3CO HO Pd/C Metanol 24% H2 ,r.t
Gambar 3. Reaksi Hidrogenasi PGV-0 (5) Menjadi THPGV-0 (6)
(Ritmaleni dan Simbara, 2000)
6a
5. Senyawa 1,5-bis-(4'-triflorometilfenil)-penta-1,4-dien-3-on (C7)
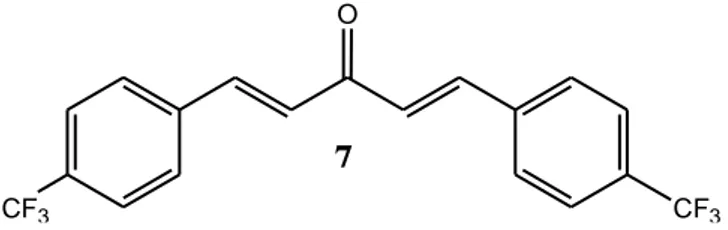
Salah satu senyawa analog kurkumin hasil sintesis Sardjiman (2000) adalah 1,5-bis-(4'-triflorometilfenil)-penta-1,4-dien-3-on 7. Senyawa ini berada dalam kelompok Gamavuton 5 dengan seri kode C7. Senyawa C7 memiliki bobot molekul 370,0 gram/mol dengan titik lebur 153,7-155,3 °C. Tidak seperti senyawa yang lain (kode A 3 dan B 4), senyawa ini memiliki gugus karbonil yang tidak terikat pada suatu cincin sikloheksana ataupun siklopentana. Senyawa C7 memiliki gugus karbonil yang terikat pada rantai pentana. Senyawa ini sukar larut dalam air tetapi larut dalam beberapa pelarut organik seperti kloroform dan metanol. Senyawa ini menunjukkan aktivitas yang kurang poten sebagai antibakteri (Sardjiman, 2000).
O
CF3 CF3
Gambar 4. Struktur 1,5-Bis-(4'-triflorometilfenil)-penta-1,4-dien-3-on (7) (Sardjiman, 2000)
6. Pelarut organik
Keberadaan suatu pelarut tidak termasuk dalam stokiometri reaksi yang terjadi dalam reaksi kimia, akan tetapi pelarut merupakan komponen penting. Interaksi antara pelarut dan molekul terlarut dapat memodifikasi aktivitas dan energi bebas dari molekul atau secara langsung dapat mempengaruhi reaktivitas dari suatu molekul (Isaacs, 1987).
Molekul dari pelarut dengan momen dipol yang besar dan konsanta dielektrik yang tinggi termasuk bersifat polar. Sedangkan molekul dari pelarut
yang memiliki momen dipol yang kecil dan konstanta dielektrik rendah diklasifikasikan sebagai nonpolar. Sedangkan secara operasional, pelarut yang larut dengan air termasuk polar, sedangkan pelarut yang tidak larut dalam air termasuk nonpolar. Berdasarkan kepolaran pelarut, maka pelarut diklasifikasikan ke dalam tiga kategori sebagai berikut:
a. Pelarut protik polar
Pelarut protik polar merupakan jenis pelarut yang memiliki banyak muatan proton yang dapat bereaksi dengan atom elektronegatif. Dengan kata lain pelarut protik polar adalah senyawa yang memiliki momen dipol yang besar dan mampu untuk mengadakan ikatan hidrogen. Contoh dari pelarut protik polar ini adalah alkohol, amina, asam karboksilat, dan air
b. Pelarut aprotik polar
Pelarut aprotik polar merupakan jenis pelarut yang memiliki proton namun tidak memiliki gugus hidroksida atau tidak memiliki proton asam. Proton biasanya terikat pada karbon sehingga memiliki ikatan dengan momen dipol besar. Biasanya ikatannya merupakan ikatan ganda antara karbon dengan oksigen atau nitrogen. Contoh dari pelarut yang termasuk kategori ini adalah dimetilsulfoksida, alkil sianida, amina sekunder dan keton.
c. Pelarut aprotik non-polar
Pelarut aprotik non-polar merupakan pelarut yang memilki konstanta dielektrik yang rendah dan tidak larut dalam air. Pelarut dengan kategori ini memiliki momen dipol yang rendah dan tidak memiliki kemampuan untuk mendonorkan proton asam. Contoh pelarut dari kategori ini adalah hidrokarbon, halokarbon, dan eter (Reichardt dan Welton, 2011).
7. Titik lebur
Titik lebur adalah suhu dimana terjadi perubahan bentuk dari padatan menjadi cairan pada tekanan 1 atm. Kenaikan suhu suatu zat dapat menyebabkan meningkatnya kinetika partikel suatu zat. Ketika suhu suatu zat dinaikkan, maka partikel-partikel zat tersebut akan menyerap energi panas dari suhu yang dinaikkan tersebut. Energi panas ini akan menyebabkan partikel-partikel zat padat bergerak dengan cepat dan saling menjauh sehingga wujud suatu zat akan mengalami perubahan (Martin, 1990).
Titik lebur adalah suatu karakteristik penting pada senyawa organik yang berwujud padat karena dapat digunakan sebagai parameter kemurnian dan juga sebagai parameter identifikasi suatu senyawa. Senyawa murni akan memiliki jarak lebur yang sempit yaitu 1-2 °C (Sharp dkk., 1989). Senyawa yang tidak murni atau mengandung pengotor didalamnya memiliki titik lebur lebih rendah atau lebih tinggi dari senyawa dalam bentuk murninya, dan memiliki jarak lebur yang lebih besar.
8. Kromatografi
Kromatografi merupakan teknik yang digunakan untuk tujuan isolasi, identifikasi, dan kualifikasi komponen di dalam campuran. Prinsip kromatografi secara umum adalah memisahkan substansi campuran menjadi komponen-komponennya. Komponen-komponen tersebut akan dipisahkan pada dua fase yaitu fase diam dan fase gerak. Fase diam berfungsi untuk menahan komponen campuran sedangkan fase gerak berfungsi untuk melarutkan zat komponen campuran. Komponen yang mudah tertahan pada fase diam akan tertinggal,
sedangkan komponen yang mudah larut dalam fase gerak akan bergerak lebih cepat. Kinerja (efisiensi dan resolusi) suatu sistem kromatografi akan semakin baik seiring dengan semakin kecil ukuran rata-rata fase diam dan semakin sempit ukuran kisaran fase diam (Gandjar dan Rohman, 2007).
a. Kromatografi lapis tipis (KLT)
Jenis kromatografi yang paling sederhana adalah kromatografi lapis tipis (KLT). Kromatografi tipe ini memiliki bentuk planar. Fase diamnya berupa lapisan homogen yang melekat pada permukaan suatu bidang datar. Lapisan tersebut didukung oleh suatu lempeng, dimana lempeng tersebut dapat terbuat dari kaca, alumunium atau plastik. Fase diam ini berperan sebagai penjerap dengan ukuran partikel kecil. Beberapa contoh fase diam yang biasa digunakan adalah silika gel, selulosa, alumina, poliamida, penukar ion, dan silika gel yang berikatan kimia. Fase gerak adalah medium pembawa dari senyawa yang akan diteliti. Fase gerak dapat berupa larutan tunggal atau campuran dari pelarut organik. Metode pemisahan komponen pada kromatografi lapis tipis didasarkan pada perbedaan adsorpsi atau partisi oleh fase diam di bawah gerakan pelarut fase gerak. Perbedaan tersebut menyebabkan tiap komponen yang terdapat dalam totolan sampel memiliki kecepatan dan jarak migrasi yang berbeda sesuai dengan sifat kimianya (Fried dan Sherman, 1994).
Kromatografi lapis tipis sering digunakan untuk tujuan kualitatif, kuantitatif, maupun tujuan preparatif. Parameter yang digunakan dapat berupa perhitungan harga Rf (Retardation factor). Nilai Rf merupakan perbandingan
migrasi komponen dibanding jarak migrasi fase gerak. Visualisasi bercak pada KLT dapat menggunakan sinar ultraviolet (UV) baik pada panjang gelombang
254 nm maupun 366 nm. Cara lain yang juga sering digunakan adalah penyemprotan dengan pereaksi penampak bercak, yang juga berfungsi kualitatif karena penampak bercak bersifat spesifik terhadap gugus-gugus tertentu. Untuk keperluan kuantitatif digunakan densitometer yang dapat mengukur kerapatan suatu bercak, baik kerapatan absorpsi cahaya oleh molekul, ataupun fluoresensi dari molekul itu (Gandjar dan Rohman, 2007).
b. Kromatografi kolom
Kromatografi kolom merupakan salah satu metode kromatografi dengan fase gerak cair dan fase diam padat. Prinsip pemisahan dalam kromatografi kolom sama dengan prinsip pada KLT. Pemisahan dalam sistem kromatografi kolom dibantu dengan adanya dorongan gravitasi sehingga eluen akan mengalir keluar kolom melewati fase diam. Penggunaan fase gerak (eluen) disesuaikan dengan kepolaran senyawa yang akan dipisahkan. Fase diam ditempatkan dalam tabung kaca berbentuk silinder, pada bagian bawah tertutup dengan katup atau kran dan fase gerak dibiarkan mengalir ke bawah karena gaya gravitasi. Fase gerak atau eluen yang merupakan komponen campuran biasanya dipisahkan dengan cara membiarkannya mengalir keluar dari kolom dan mengumpulkannya sebagai fraksi. Jenis adsorben yang paling banyak digunakan dan mudah didapat adalah alumina dan silika gel (Gritter dkk.,1991).
9. Spektroskopi
Spektroskopi adalah ilmu yang mempelajari atribut suatu materi dan yang didasarkan pada suara, cahaya, atau partikel yang diserap, dipancarkan atau dipantulkan oleh materi tersebut. Spektroskopi juga dapat didefinisikan sebagai
ilmu yang mendalami tentang fenomena antaraksi energi dan materi. Saat ini definisi spektroskopi berkembang seiring teknik-teknik baru yang dikembangkan untuk memanfaatkan tidak hanya cahaya tampak, tetapi juga bentuk lain dari radiasi elektromagnetik dan non-elektromagnetik seperti gelombang mikro, gelombang radio, elektron, gelombang suara, sinar dan lain sebagainya (Gandjar dan Rohman, 2007).
Spektroskopi umumnya digunakan dalam kimia fisik dan kimia analisis untuk mengidentifikasi suatu substansi melalui spektra yang dipancarkan, diteruskan ataupun yang diserap. Alat untuk merekam spektra disebut spektrometer. Panjang gelombang pada suatu senyawa organik mampu menyerap energi cahaya, intensitas penyerapan tersebut bergantung pada struktur senyawa tersebut. Oleh karena itu teknik-teknik spektroskopi dapat digunakan untuk menentukan struktur senyawa yang tak diketahui dan untuk mempelajari karakteristik ikatan dari senyawa yang telah diketahui sebelumnya (Hollas, 2004).
a. Spektroskopi infra merah
Suatu molekul yang menyerap energi (dalam hal ini, energi berasal dari radiasi infra merah) akan mengalami eksitasi. Spektroskopi infra merah merupakan metode spektroskopi yang memanfaatkan vibrasi dari suatu molekul yang tereksitasi tersebut dan menghasilkan suatu spektra infra merah. Spektra infra merah dapat menyediakan informasi spesifik dari gugus fungsional yang mengalami vibrasi. Instrumen yang digunakan untuk mengukur resapan adalah spektrometer infra merah. Radiasi infra merah yang digunakan untuk analisis instrumental adalah radiasi pada rentang bilangan gelombang 4000-650 cm-1. Sinyal yang terukur dapat diukur pada berbagai panjang gelombang. Absorpsi
energi radiasi infra merah merupakan proses terkuantifikasi seperti proses absorpsi energi lainnya, hanya frekuensi tertentu yang akan diserap suatu molekul (Pavia dkk., 2001).
Radiasi infra merah tidak dapat diserap secara sempurna oleh semua senyawa. Hanya senyawa dengan ikatan kimia tertentu yang mampu menyerap radiasi infra merah, yaitu ikatan yang cukup memiliki momen dipol. Masing-masing ikatan kimia memiliki frekuensi vibrasi alamiah yang spesifik sesuai dengan ikatan tersebut. Jika suatu ikatan kimia dipaparkan terhadap radiasi infra merah yang frekuensinya sesuai dengan frekuensi alaminya maka akan terjadi interaksi medan listrik. Hal tersebut menyebabkan perubahan vibrasi yang menandakan absorpsi radiasi infra merah oleh molekul bersangkutan. Energi yang diserap akan digunakan untuk meningkatkan amplitudo vibrasi ikatan-ikatan dalam molekul (Pavia dkk., 2001).
Ada atau tidaknya absorpsi pada frekuensi tertentu dalam suatu spektra infra merah dapat dijadikan indikator ada tidaknya gugus fungsional tertentu. Hal ini sangat penting dalam mengidentifikasi senyawa yang diteliti. Senyawa organik akan memberikan spektra infra merah yang khas, baik pada daerah gugus fungsi maupun daerah sidik jari. Sedikit perbedaan pada atom-atom yang mengelilingi gugus fungsional akan mempengaruhi pola spektra infra merah yang ada. Atas dasar tersebut spektra infra merah dapat digunakan untuk identifikasi kualitatif senyawa organik (Pavia dkk., 2001).
b. Spektroskopi massa
Spektrometer massa bekerja dengan cara menembaki suatu molekul dengan elektron berenergi tinggi. Tabrakan antara sebuah molekul organik dan salah satu elektron berenergi tinggi menyebabkan lepasnya sebuah elektron dari molekul tersebut dan berubah menjadi ion radikal positif. Ion yang dihasilkan oleh pembombardiran elektron berenergi tinggi ini tidak stabil dan pecah menjadi fragmen yang kecil, baik berbentuk radikal bebas maupun ion-ion lain. Ion-ion tersebut kemudian dipercepat dalam medan listrik dan dipisahkan sesuai rasio muatan dalam medan magnet atau medan listrik. Ion dengan rasio massa-muatan (m/z) tertentu dideteksi dengan alat yang dapat menghitung jumlah ion yang menumbuknya (Pavia dkk., 2001).
Ada beberapa cara ionisasi untuk menjadikan suatu molekul ion agar dapat dideteksi oleh spektrometer massa, yaitu: Electron Impact (EI), Chemical Ionization (CI), Field-Desorption Ionization (FDI), Fast Atom Bombardement
(FAB), Matrix Assisted Laser Desorption Ionization (MALDI), Electrospray-Ionization (ESI). Masing-masing metode tersebut digunakan sesuai dengan sifat dari sampel dan informasi yang ingin kita dapat dari spektroskopi massa. Metode
Electron Impact adalah cara yang paling sering digunakan dalam analisis spektroskopi massa (Williams dan Fleming, 1995).
Data yang diperoleh dari spektra massa dapat memberikan informasi antara lain puncak ion molekul dan m/z fragmen yang terjadi beserta kelimpahannya. Puncak ion molekul menunjukkan berat molekul senyawa yang dianalisis, sedangkan fragmen (m/z) beserta kelimpahannya dapat digunakan untuk menyusun kemungkinan reaksi fragmentasi yang terjadi. Analisis
mekanisme reaksi fragmentasi digunakan untuk mendukung struktur molekul asal serta bagaimana fragmen-fragmen terbentuk (Silverstein dan Webster, 1998).
c. Spektroskopi NMR (Nuclear Magnetic Resonance)
Spektroskopi NMR merupakan metode spektroskopi yang digunakan untuk mengidentifikasi struktur kimia dari suatu senyawa organik terutama senyawa organik yang mengandung atom karbon dan hidrogen. Secara esensial, spektroskopi NMR merupakan spektroskopi absorpsi seperti spektroskopi infra merah dan ultraviolet. Suatu sampel dapat menyerap radiasi elektromagnetik pada rentang frekuensi tertentu yang tergantung dari sifat-sifat sampel. Berbeda dari spektroskopi infra merah yang berfungsi untuk mengidentifikasi gugus fungsional dari suatu senyawa organik, spektroskopi NMR dapat memberikan informasi dari suatu senyawa organik mengenai jumlah atom magnetis yang berbeda maupun memperoleh informasi mengenai sifat lingkungan langsung dari masing-masing inti atom tersebut. Informasi tersebut dapat membantu dalam identifikasi struktur suatu senyawa organik yang dipelajari (Pavia dkk., 2001).
Setiap inti atom memiliki muatan yang berputar pada sumbu inti tersebut. Perputaran muatan inti ini kemudian menimbulkan suatu dipol magnetik selaras dengan sumbu inti, dipol atau momen magnetik ini dinyatakan dengan μ. Tidak semua inti bersifat sebagai magnet, hanya inti atom yang memiliki nomor atom gasal, nomor massa gasal, dan atom yang memiliki nomor atom juga nomor massa gasal yang dapat berlaku sebagai magnet. Semua orientasi dari suatu inti memiliki tingkat energi terdegenerasi dalam keadaan normal, inti tersebut tidak dikenai medan magnet eksternal. Bila suatu inti dikenai medan magnet maka orientasi/tingkat spin inti tidak lagi berenergi sama. Hal ini disebabkan karena inti
mempunyai momen magnetik (μ) yang ditimbulkan oleh berpusingnya muatan. Fenomena NMR terjadi apabila inti yang searah dengan medan magnet eksternal dibuat mengabsorpsi energi atau suatu radiasi elektromagnetik sehingga orientasi
spin dari inti tersebut berubah, yaitu dari searah menjadi berlawanan arah dengan medan magnet eksternal. Peristiwa ini disebut resonansi dan resonansi yang terjadi akan dibaca oleh instrumen sebagai suatu sinyal (Pavia dkk., 2001).
Spektroskopi 1H-NMR dan 13C-NMR paling penting dan sering digunakan dalam penggunaan spektroskopi NMR. Atom 1H dan 13C memiliki
spin dengan nilai setengah sehingga inti-inti tersebut hanya dapat mengambil salah satu dari dua orientasi, yaitu orientasi energi yang rendah sejalan dengan bidang yang diterapkan dan orientasi energi tinggi yang bertentangan dengan medan listrik (Williams dan Fleming, 1995).
Isotop 13C magnetik memiliki momen magnetik serta resonansinya lebih rendah dibandingkan isotop 12C. Parameter yang digunakan pada spektra 13C adalah geseran kimia atau chemical shift. Interaksi spin-spin yang sangat jarang antara karbon-karbon yang berdekatan dikarenakan kelimpahan isotop 13C yang sangat rendah, kemungkinan untuk mendapatkan dua atom 13C yang bersebelahan sangat kecil. Isotop atom 13C akan mengalami interaksi spin-spin dengan atom 1H yang saling berikatan (Pavia dkk., 2001).
10. Hidrogenasi dengan katalis paladium karbon a. Hidrogenasi
Reduksi merupakan reaksi kimia yang menyebabkan substansi target menerima elektron (Anonim, 2011). Reaksi hidrogenasi merupakan reaksi
hidrogen dengan senyawa organik dan tergolong dalam reaksi reduksi. Reaksi ini terjadi melalui penambahan (adisi) hidrogen secara langsung pada ikatan rangkap dari molekul yang tidak jenuh sehingga dihasilkan suatu produk yang jenuh. Proses hidrogenasi merupakan salah satu proses yang penting dan banyak digunakan dalam pembuatan bermacam-macam senyawa organik. Proses ini umumnya terdiri dari adisi sepasang atom hidrogen ke sebuah molekul. Reaksi membutuhkan suhu dan tekanan yang berbeda tergantung pada substrat dan aktivitas katalis (Hudlicky, 1996).
b. Katalis paladium karbon
Paladium adalah logam berwarna putih baja yang termasuk dalam golongan logam Platinum Group Metals (PGMs), yang terdiri dari enam logam yang saling berhubungan, yaitu platina (Pt), paladium (Pd), rhodium (Rh), ruthenium (Ru), iridium (Ir) dan osmium (Os). Paladium tidak mengkilap di udara dan memiliki bobot jenis yang paling ringan dan titik lebur paling rendah diantara golongan PGMs yang lain (Aldrich, 1996).
Paladium dalam karbon (Pd/C) merupakan suatu katalis heterogen (organopaladium). Senyawa ini sering digunakan sebagai katalisator dalam berbagai reaksi hidrogenasi gugus keton, imina, alkena, alkuna, golongan nitro, benzenoid dan heterosiklik aromatik. Katalis ini juga dapat digunakan untuk dehidrogenasi aromatik dan deformilasi aldehid (Wipf, 2005). Paladium karbon memiliki chemoselectivity untuk mereduksi ikatan rangkap karbon-α,β tanpa mereduksi gugus karbonilnya dibandingkan dengan katalis organologam lain (Solomons, 1990).
c. Hidrogenasi dengan katalis paladium karbon
Penggunaan katalis diperlukan agar reaksi dapat berjalan secara efisien dengan cara meningkatkan laju reaksi (Martin, 1993). Proses hidrogenasi biasanya menggunakan gas hidrogen dengan menambahkan suatu katalis tertentu untuk mempercepat kecepatan laju reaksi agar reaksi tersebut dapat berjalan dengan lebih sempurna. Hidrogenasi non-katalitik hanya dapat berjalan dengan kondisi suhu dan tekanan yang tinggi. Jarang ditemukan reaksi di bawah 480° C (750 K atau 900° F) terjadi antara hidrogen (H2) dan suatu senyawa tanpa menggunakan katalis. Katalis paladium karbon (Pd/C) dinilai sesuai untuk digunakan pada proses yang melibatkan hidrogenasi dan hidrogenolisis benzil keton dan aldehid. Hidrogenasi benzil keton menjadi alkohol adalah proses yang sangat cepat dengan menggunakan katalis paladium karbon (Wipf, 2005).
Terdapat tiga tahap reaksi pada mekanisme hidrogenasi heterogen reaksi. Pertama, paladium akan beraksi dengan gas hidrogen dan mengalami oksidasi. Kemudian ikatan antara paladium dengan gas hidrogen mengalami hidrometalasi dengan substrat sehingga terbentuk intermediet organometalik (proses non-redoks). Selanjutnya reduksi eliminasi dari produk intermediet organometalik yang terbentuk sehingga dihasilkan produk hasil reduksi, pada saat yang bersamaan juga terjadi regenerasi katalis (Negishi, 2002b).
F. Landasan Teori
Metode hidrogenasi dengan paladium karbon (Pd/C) 10% dalam pelarut etanol telah berhasil dilakukan pada hidrogenasi beberapa senyawa turunan kurkumin seperti: THPGV-0 dari PGV-0 (Ritmaleni dan Simbara, 2010),
THPGV-1 dari PGV-1 (Andhini, 2012), THHGV-5 dari HGV-5 (Wibowo, 2013), dan THHGV-7 dari HGV-7 (Praditya, 2014). Adanya katalis paladium karbon akan meningkatkan kemungkinan bahwa reduksi hanya akan terjadi pada ikatan rangkap karbon-α,β dan tidak mereduksi karbonil menjadi alkohol sekunder (Solomons, 1990; Negishi, 2002b; Nishimura, 2001; Anonim, 2001; Hudlicky, 1996). Pelarut etanol dapat mempercepat jalannya reaksi hidrogenasi ikatan rangkap (tak jenuh) karbon-α,β menjadi ikatan tunggal karbon-α,β (ikatan jenuh) (Isaacs, 1987).
Pada keempat sintesis yang telah disebutkan, dihasilkan lebih dari satu senyawa produk samping (byproduct) yang memiliki kepolaran yang berbeda dari senyawa target. Hasil elusi KLT dapat digunakan untuk menganalisis senyawa target yang dicari dalam campuran hasil sintesis. Analisis ini didasarkan oleh perbedaan kepolaran senyawa. Pada ketiga sintesis senyawa yang telah disebutkan sebelumnya, dapat diamati perubahan struktur (struktur ikatan rangkap menjadi ikatan tunggal) secara langsung berdasarkan perubahan warna dari senyawa awal (serbuk berwarna kuning) menjadi senyawa tidak berwarna. Jika reaksi berjalan sesuai prediksi maka senyawa THC7 hasil sintesis juga diprediksi akan berubah warna dari starting material. Isolasi pada senyawa hasil sintesis dilakukan untuk memisahkan senyawa target dari produk samping. Hasil elusidasi struktur (IR, GC-MS, 1H-NMR, dan 13C-NMR) yang dibandingkan dengan literatur dapat digunakan untuk menganalisis kesesuaian struktur senyawa hasil sintesis dengan senyawa target (THC7).
G. Hipotesis
Berdasarkan penelitian yang telah dilakukan dan prediksi mekanisme reaksi, senyawa 1,5-bis-(4'-triflorometilfenil)-pentan-3-on (THC7) 8 dapat disintesis dari starting material 1,5-bis-(4'-triflorometilfenil)-penta-1,4-dien-3-on melalui reaksi hidrogenasi dengan menggunakan katalis paladium karbon (Pd/C) dalam pelarut etanol. Persamaan reaksi hidrogenasi pada penelitian ini adalah sebagai berikut: F3C O CF3 F3C O CF3 H2, EtOH Pd/C
Gambar 5. Prediksi Reaksi Hidrogenasi C7 Menjadi THC7 (8)
8 7