KONDlSl POHON PASCA INDUKSI PEMBUNGAAN MASA OFF-YEAR
Pendahuluan Latar Belakang
Induksi pembungaan pada pohon buah-buahan dapat dilakukan dengan cara menghambat pertumbuhan vegetatif tanaman, meningkatkan akumulasi karbohidrat tersimpan di tajuk pohon, atau mengganggu keseimbangan hormonal di dalamnya. Perlakuan fisik dengan cara menghambat 1 memutuskan aliran karbohidrat dari tajuk ke akar telah digunakan dalam skala komersial untuk mengatur produksi jeruk di Israel, Amerika, Spanyol, dan Afiika Selatan (Cohen et al. 1988 dalam Rabe dan Krajewski 1995) diketahui mampu membungakan rambutan di luar musim (Poenvanto et al. 2000).
Perlakuan kerat batang utama dapat memutuskan pasokan fotosintat dari tajuk ke daerah perakaran. Pada kondisi tertentu, perlakuan tersebut mampu meningkatkan akumulasi pati tajuk, menurunkan akumulasi pati di akar dan dapat menyebabkan pohon mengalami stres akar. Stres akar yang berlebihan dapat mengganggu hngsi akar dalam menyerap air dan hara untuk memenuhi kebutuhan tanaman. Hasil percobaan Schecter et al. (1994) menunjukkan, perlakuan kerat pada cabang-cabang apel dengan cara membuang kulit cabang secara melingkar selebar 1.5 cm dapat menurunkan kadar hara makro (N, P, K, Ca, Mg) dan mikro (Mn, Cu, Zn, B, Fe) daun dari cabang-cabang apel yang tidak berbuah. Perlakuan kerat batang utama secara melingkar dengan membuang kulit batang sekitar 4 - 5 cm di bawah percabangan sebanyak dua keratan dengan lebar efektif 1 mm pada pohon satsuma Mihowase dapat menurunkan kadar klorofil
107
daun secara nyata. Pada kondisi tanaman tercukupi kebutuhan airnya, kadar nitrogen tidak nyata dipengaruhi oleh perlakuan kerat batang, namun dalam keadaan defisit air, perlakuan kerat batang dapat menurunkan kadar nitrogen daun (Peng dan Rabe 1996).
Dalam kondisi lingkungan yang mendukung dan pohon dalam kondisi sehat, jaringan floem yang terputus di batang utama akibat perlakuan kerat batang dapat terbentuk dan tersarnbung kembali. Menurut Rabe dan Krajewski (1995) floem yang terbentuk di bekas luka keratan tidak pernah teregenerasi secara sempurna, sehingga mengakibatkan translokasi floem menjadi lambat secara permanen. Dengan tidak lancarnya aliran metabolit dari tajuk ke akar, dapat mengakibatkan kebutuhan akar akan hasil fotosintat tidak terpenuhi secara optimal. Kondisi tersebut diduga mampu mempengaruhi pertumbuhan akar dan kemampuan akar dalam penyerapan hara serta sintesis hormon-hormon tertentu.
Dalam pembentukan dan pembesaran buah, buah akan membutuhkan banyak hasil fotosintat. Menurut Akao et al. (1981) dalam Goldschmidt (1999) untuk perkembangan reproduktif, tanaman banyak mendapat suplai dari karbohidrat tersimpan. Dengan semakin lebatnya buah yang terbentuk, maka akan semakin banyak membutuhkan hasil fotosintat untuk pertumbuhannya. Dengan demikian semakin banyak karbohidrat tersimpan yang diremobilisasi untuk dialirkan ke daerah pembentukan buah.
Lebar luka keratan harus sesuai, tidak terlalu lebar dan tidak terlalu sempit, agar kulit atas dan bawah luka keratan dapat menyatu tepat pada waktunya. Sebelum luka tersambung kembali, diharapkan pohon telah cukup menerima stres fisik untuk inisiasi pembungaan.dan diharapkan luka telah pulih kembali setelah
108 tanaman berhasil berbuah. Hal ini diperlukan agar pertumbuhan akar tanaman tidak terganggu dan mampu berfbngsi secara normal.
Berdasarkan ha1 tersebut di atas maka dilakukan pengamatan waktu yang diperlukan jaringan kulit batang terluka untuk dapat menyatu kembali serta melihat anatomi jaringan yang terbentuk di bekas luka keratan. Hal lain yang perlu diamati adalah kondisi pohon pasca perlakuan kerat batang - KNO3 pada pohon yang pernah dan belum pernah dikerat, dengan arah untuk melihat sampai sejauh mana perlakuan kerat batang dapat mempengaruhi kelangsungan hidup pohon rambutan.
Tujuan Percobaan
Tujuan dilakukannya percobaan ini adalah untuk mengetahui:
1. Pemulihan luka dan kesempurnaan sambungan setelah perlakuan kerat batang.
2. Penampilan tajuk pohon setelah perlakuan kerat batang dan .setelah masa berbuah selesai.
Hipotesis Percobaan
1. Jaringan floem yang terputus akibat perlakuan kerat batang akan dapat tersambung kembali.
2. Perlakuan kerat batang mempengaruhi penampilan tajuk pohon. Bahan dan Metode
Tempat dan Waktu Percobaan
Percobaan lapang dilaksanakan pada bulan April 2000 hingga Maret 2002, berlokasi di Kebun Buah Blok B Taman Buah Mekarsari, Cileungsi - Bogor pada ketinggian tempat 80 m dpl.
109
Analisis anatomi jaringan dilaksanakan mulai bulan Oktober 2001 hingga April 2002 di Laboratorium Sitologi
-
Herbarium Bogoriense, Bogor; Laboratorium Bioteknologi Kehutanan - Biotrop, Tajur-Bogor; dan Laboratorium Mikrobiologi-
Puslitbang Kehutanan, Gunung Batu - Bogor.Bahan dan AIat Percobaan
Bahan tanaman yang digunakan dalam percobaan ini adalah rambutan Binjai berumur 4 tahun berlokasi di areal Kebun Buah Blok B Taman Buah Mekarsari.
Bahan kimia dan peralatan yang digunakan adalah bahan dan alat untuk analisis anatomi jaringan serta mikroskop binokuler berkamera.
Metode Percobaan
Pengamatan dilakukan dengan menggunakan pohon percobaan yang digunakan pada Percobaan "Pembungaan dan Produksi Rambutan Binjai 08-Year
setelah Induksi Pembungaan pada Fase Tumbuh Berbeda" (Percobaan I, 11, dan 111) serta Percobaan "Fluktuasi Perubahan Pati Tajuk-Akar dan Hubungannya dengan Pembungaan dan Produktivitas Rambutan Binjai" (Percobaan IV).
Pada Percobaan I, 11,111, dan IV dilakukan pengamatan:
1. Perubahan yang te rjadi pada daun setelah perlakuan kerat batang-KN03 pada pohon yang pernah dan belum pernah dikerat batang tahun sebelumnya. 2. Pembentukan kalus dan penyambungan kalus atas dan bawah luka keratan. 3. Perubahan fisik pohon setelah buah dipanen.
Analisis anatomi jaringan hanya dilakukan pada Percobaan IV. Pengambilan jaringan baru di daerah luka keratan dilakukan setelah ada kalusl jaringan yang menghubungkan bagian atas dan bawah luka keratan. Sarnpel diambil dengan cara melakukan sedikit penyayatan setebal 0.5 cm dan sepanjang
110
lcm pada tempat dimana diperkirakan terjadi penyambungan floem dari bagian atas dengan bagian bawahnya. Selain itu, sebagai perbandingan juga dilakukan pengamatan pada pohon kontrol yang belum pernah dikerat dan dibekas luka kerat tahun sebelumnya.
Jaringan sampel dimasukan ke dalam botol bekas film yang berisi FAA dan kemudian dibekukan dalam parafin. Untuk melihat apakah jaringan floem yang terbentuk tersebut sempurna, dilakukan pemotongan jaringan sampel tersebut setipis mungkin dengan bantuan mikrotom dan diamati dibawah mikroskop. Untuk memudahkan pengamatan dan pembahasan, preparat tersebut difoto secara mikroskopik pada perbesaran 40x dan 100x.
Hasil Percobaan Penampakan Daun
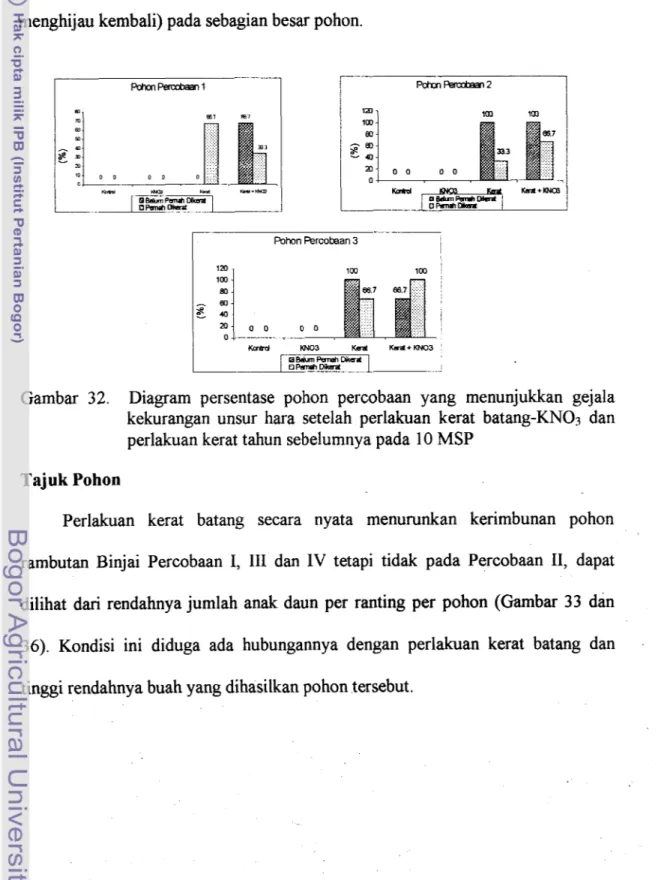
Sebagian besar pohon percobaan yang mendapat perlakuan kerat batang dengan dan tanpa KN03 menguning daunnya pada 4 MSP, seperti t.mpak pada Gambar 30 dan 31. Daun yang menguning tersebut, sebagian besar adalah daun yang berada di ujung ranting yang sudah berkembang penuh. Gejala tersebut muncul baik pada Percobaan I, 11, III maupun IV. Ada sekitar 60% pohon Percobaan IV menunjukkan gejala seperti tersebut di atas, sedangkan pada Percobaan 1,II, dan 111 bervariasi seperti yang terlihat pada Gambar 32.
Selama penelitian berlangsung, terdapat dua pohon yang mendapat perlakuan kerat batang dari pohon yang pernah dikerat, mati mendadak setelah sebelumnya menunjukkan gejala dessiensi hara yang cukup berat, dimana lebih dari 90% daunnya klorosis dan mulai ada gejala nekrosis pada pinggir-yinggir daunnya. Setelah dilakukan analisis di daerah perakarannya tidak ditemukan
11 1 adanya penyakit ataupun hama yang menyerang. Kedua pohon tersebut mati pada
9 dan 10 MSP. Sedangkan setelah periode panen buah, terdapat dua buah pohon
yang pertumbuhannya sangat merana seperti tampak pada Gambar 33, daunnya banyak yang rontok dan rendah sekali laju pertumbuhannya. Kalus belum terbentuk dibekas luka keratan hingga 15 BSP pada kedua pohon tersebut (Gambar 33). Sedangkan pada pohon lainnya, luka sudah tertutup kalus dan
secara visual kalus yang tumbuh
dari
luka atasdan
luka bawah keratan sudahtersambung serta tarnpak normal pertumbuhannya (Gambar 34 dan 35).
Gambar 30. Gejala defisiensi unsur
hara
pada daun rambutan Binjai setelahperlakuan kerat batang
-
KN03Gambar 31. Penampilan fisik pohon pada 10 minggu setelah perlakuan kerat
Mengingat terdapat 2 pohon mati dan sebagian besar tanaman menunjukkan gejala yang sama, maka pada 10 MSP tajuk disemprot dengan pupuk daun yang mengandung ektrak ikan bercampur humid acid
+
hlvic acid dan tanah di bawah tajuk disiram dengan larutan humid acid. Satu minggu setelah penyemprotan, gejala defisiensi unsur hara mulai berkurang (daun menguning berangsur-angsur menghijau kembali) pada sebagian besar pohon.1
Pohn Percotean 3i
Gambar 32. Diagram persentase pohon percobaan yang menunjukkan gejala kekurangan unsur hara setelah perlakuan kerat batang-KNOs dan perlakuan kerat tahun sebelumnya pada 10 MSP
Tajuk Pohon
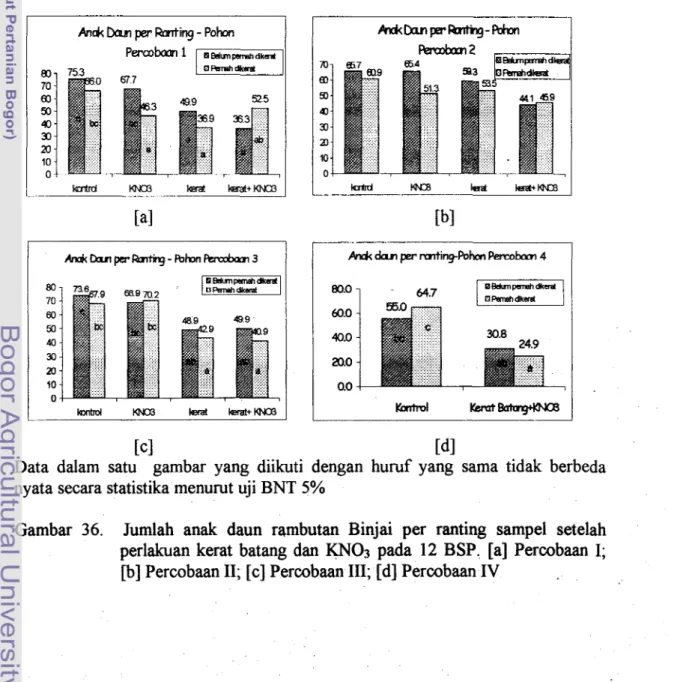
Perlakuan kerat batang secara nyata menurunkan kerimbunan pohon rambutan Binjai Percobaan I, I11 dan IV tetapi tidak pada Percobaan 11, dapat dilihat dari rendahnya jumlah anak daun per ranting per pohon (Gambar 33 dan 36). Kondisi ini diduga ada hubungannya dengan perlakuan kerat batang dan tinggi rendahnya buah yang dihasilkan pohon tersebut.
"hmbm
33.
P e m m p k
behs
luka
keraEan
pada 15BSP
dari
poQon
yaug
w pernahdikerat
h g mluka
b m
belurn
menyatu @ri) dan-wi-wm
&bar
34.Pmmpilan
Mas luka
keratan
(IS
BSP)
h h bPutelah
menyatu
l
a
dari pohonyang
belm
pemah
dikesrd
@hi)dm
-*&yaw=)
Oambar35.
Penampilanbekas
lulrakaatan
(15 BSP) d m p n l u h b a r u t e l a h menyatu 100 %dsti
p o h yang
pemah
dikerrd
(kki)
dan
penampilan*h~(Irarran)Pada Percobaan I, kerimbunan pohon perlakuan kerat batang menurun dibandingkan pohon kontrol dari pohon yang belum pernah dikerat batang, baik perlakuan tersebut dikombinasikan ataupun tidak dengan KN03 dari pohon yang belum pernah dikerat maupun pernah dikerat sebelumnya. Perlakuan KN03 tidak menyebabkan daun rontok. Tingginya kerontokan daun pada pohon dikerat dikombinasikan dengan KN03 bukan disebabkan oleh perlakuan KN03 yang diberikan, tetapi lebih disebabkan oleh perlakuan kerat batangnya, mengingat jumlah anak daun per ranting dari pohon yang dikerat dikombinasikan dengan perlakuan KN03 dengan yang hanya mendapat perlakuan kerat batang saja tidak berbeda nyata.
An& Daun per Ranting
-
PohonI
[cl [dl
Data dalam satu gambar yang diikuti dengan huruf yang sama tidak berbeda nyata secara statistika menurut uji BNT 5%
Gambar 36. Jumlah anak daun rambutan Binjai per ranting sampel setelah perlakuan kerat batang dan KNO3 pada 12 BSP. [a] Percobaan I; [b] Percobaan 11; [c] Percobaan 111; [dl Percobaan IV
115 Kondisi pohon Percobaan 111 setelah berbuah tidak jauh berbeda dengan kondisi pohon Percobaan I. Dimana pohon yang diberi perlakuan kerat batang saat kondisi pohon dorman, tingkat kerontokan daumya tinggi. Jumlah rata-rata anak daun pohon tersebut 30% lebih sedikit dibandingkan pohon yang tidak dikerat batangnya (Gambar 36).
Pada Percobaan 11, perlakuan kerat batang tidak meningkatkan kerontokan daun rambutan Binjai, meskipun ada kecenderungan pohon yang dikerat mempunyai daun lebih sedikit dibandingkan pohon yang tidak dikerat (Garnbar 36).
Kondisi pohon Percobaan IV setelah berbuah tidak jauh berbeda dengan pohon Percobaan I dan 111. Pohon yang diberi perlakuan kerat batang saat kondisi pohon dorman, tingkat kerontokan daunnya tinggi. Jumlah rata-rata anak daun pohon tersebut 40-55 persen lebih sedikit dibandingkan pohon yang tidak dikerat batangnya (Gambar 36). Bahkan pada beberapa pohon, kondisi tajuknya cukup parah, yaitu pohon yang pernah dikerat kemudian mendapat kerat batang kembali mempunyai tingkat kerontokan > 75% seperti tampak pada Gambar 33.
Penyembuhan Luka Kerat Pasca Perlakuan Kerat Batang
Penutupan luka kerat pohon Percobaan I lebih lambat dibandingkan pohon Percobaan I1 dan 111. Pada Percobaan I, saat 23-27 MSP baru ada sekitar 66.7% bekas luka keratan yang tertutup kalus dan tersambung. Sedangkan pada Percobaan 11, saat 19 MSP sudah terdapat 66.7% pohon percobaan yang luka bekas keratannya tertutup kalus dan tersambung. Penutupan luka bekas keratan pohon Percobaan I11 juga lebih cepat dibandingkan Percobaan I, sekitar 66,7%
luka keratan sudah tertutup kalus dan tersambung kembali pada 16-20 MSP (Tabel 14 dan 15).
Tabel 14. Penutupan luka oleh jaringan kalus pada rambutan Binjai yang diperlakukan pada bulan April, Mei, dan Juni 2000.
Hingga pengamatan bulan Januari 2001, baik pada Percobaan I (35 MSP), Waktu Pengeratan 15 April '00 Percob. 1 15 Mei '00 Percob. 2 12 Juni '00 Percob. 3
Percobaan I1 (3 1 MSP) maupun Percobaan I11 (28 MSP), masih ada luka keratan yang belum tertutup kalus 100% (baru sekitar 50-75 persen luka keratan tertutup Keterangan :
Pada saat pengamatan terakhir (3 1 Januari 2001), kondisi luka keratan sbb. : [O] = belum ada kalus tumbuh di jaringan yang terluka
[ l ] = < 25% jaringan terluka muncul kalus
[2] = 25% < x < 50% jaringan terluka muncul kalus [3] = 50% < x < 75% jaringan terluka muncul kalus [4] = 75% < x < 100% jaringan terluka muncul kalus [5] = 100 % jaringan terluka muncul kalus
U1. 1
-
-
2 3 1-
-
2 3 1-
-
2 3kalus), yaitu pada perlakuan kerat batang tanpa KN03 dari pohon yang pernah dikerat dan belum pernah dikerat serta dari pohon yang mendapat perlakuan kerat batang+KNOs dari pohon yang belum pernah dikerat. Bahkan pada Percobaan 111,
Pernah Dikerat
yaitu pohon yang diberi perlakuan kerat batang tanpa KN03 dari pohon yang belum pernah dikerat, ada yang persentase penyambungan lukanya masih rendah,
Belum Pernah Dikerat kerat
+
KN03 23 MSP (Okt.) mat i 27 MSP(Nov) 27 MSP (Des) 19 MSP (Okt.) 19 MSP (Okt.) mati 16 MSP (Okt.) 16 MSP (Okt.)yaitu kurang dari 50% lebar luka keratan.
kerat + K N 0 3 27 MSP (Nov) 27 MSP (Nov) [31 19 MSP(0kt.) 19 MSP (Okt.) [dl 20 MSP (Nov) 16 MSP (Okt.) [41 kerat 23 MSP (Okt.) 27 MSP (Nov) [31 19 MSP (Okt.) 141 19 MSP(0kt.) 20 MSP (Nov) [31 20 MSP (Nov) kerat 27 MSP (Nov) [31 23 MSP (Okt.) 19 MSP (Okt.) 19 MSP (Okt.) 23 MSP(Nov) 20 MSP (Nov) 20 MSP (Nov) [31
Tabel 15. Penyambungan luka oleh jaringan kalus pada rambutan Binjai yang diperlakukan pada bulan April, Mei, dan Juni 2000, pengamatan dilakukan hingga 3 1 Januari 200 1.
Keterangan:
Saat pengamatan terakhir (3 1 Januari 2001), kriteria penampilan luka keratan sbb: [O] = belum ada jaringan kalus atas dan bawah tersambung
[ l ] =
<
25% jaringan kalus atas dan bawah tersambung[2] = 25% < x < 50% jaringan kalus atas dan bawah tersambung [3] = 50% <
x
< 75% jaringan kalus atas dan bawah tersambung [4] = 75% < x < 100% jaringan kalus atas bawah tersambung [5] = 100 % jaringan kalus atas dan bawah tersambungI
Waktu Kalus Atas dan Kalus Bawah TersambungJ
Pada perlakuan kerat batang+KNOs dari pohon yang pernah .dikerat tahun sebelumnya, luka keratan telah 100% tertutup kalus pada 16 MSP untuk Percobaan 111, dan 19-27 MSP untuk Percobaan 11, serta 23-27 MSP untuk
, Pernah Dikerat
kerat + KNO3 kerat 23 MSP (Okt.) 23 MSP (Okt.) mati 27 MSP (Nov) 27 MSP (Nov) [3] Waktu ... ... % ... Pengeratan 15 April '00 Percob. 1
Belum Pernah Dikerat
Percobaan I. Ul. ... 1
-
-
2 3 kerat+
KN03 27 MSP (Nov) 27 MSP (Nov) [2]-
-Kecepatan penyambungan luka kerat pohon Percobaan IV lebih lambat kerat 27 MSP (Nov) 131 23 MSP (Okt.) 19 MSP (Okt.) 19 MSP (Okt.) 23 MSP (Nov) 20 MSP (Nov) 20 MSP (Nov) [21
dibandingkan pohon Percobaan I, 11, dan III. Pada saat akhir pengamatan bulan 15 Mei '00
Percob. 2 12 Juni '00
Percob. 3
Januari 2001 atau saat 3 1 MSP, baru ada 33.3% pohon yang luka keratannya telah 19 MSP (Okt.) [41 19 MSP (Okt.) 20 MSP (Nov) 131 20 MSP (Nov)
tertutup kalus dan tersambung loo%, yaitu untuk pohon yang diberi perlakuan 19 MSP (Okt.) 19 MSP (Okt.) 131 20 MSP (Nov) 16 MSP (Okt.)
P I
1-
-
2 3 1 --
2 3kerat batang
+
KN03 dari pohon yang pernah dikerat tahun sebelumnya. 27 MSP @es) 19 MSP (Okt.) 19 MSP (Okt.) mati 16 MSP (Okt.) 16 MSP (Okt.)Sedangkan untuk pohon yang diberi perlakuan kerat batang
+
KN03 dari pohon yang belum pernah dikerat batangnya baru ada 33,3% pohon yang jaringanlukanya telah 100% tertutup oleh kalus, namun belum ada satupun yang telah tersarnbung 100% (Tabel 16 dan 17). Hal ini terjadi diduga akibat stress Yang diterima pohon Percobaan IV lebih berat dibandingkan pohon Percobaan I, 11, dan 111, yaitu akibat adanya pengambilan sampel jaringan berupa ranting dan akar sebanyak 8 kali selama percobaan berlangsung pada seluruh pohon Percobaan IV. Tabel 16. Penutupan luka oleh jaringan kalus pada rambutan Binjai yang
diperlakukan pada bulan Mei 2000 dari Percobaan IV.
Keterangan :
Saat pengamatan terakhir (3 1 Januari 2001), kriteria penampilan luka keratan sbb: [O] = belum ada kalus tumbuh di jaringan yang terluka
[ l ] = < 25% jaringan terluka muncul kalus
[2] = 25% < x < 50% jaringan terluka muncul kalus [3] = 50% < x < 75% jaringan terluka muncul kalus [4] = 75% < x < 100% jaringan terluka muncul kalus [5] = 100 % jaringan terluka muncul kalus
Tabel 17. Penyambungan luka oleh jaringan kalus pada rambutan Binjai yang diperlakukan pada bulan Mei 2000 dari Percobaan IV.
Belum Pernah Dikerat [41 [41 3 1 MSP (Januari) Pernah Dikerat [ll 23 MSP (November) [I] Perlakuan Kerat
+
KN03 Keterangan :[O] = belum ada jaringan kalus atas dan bawah tersambung [I] = < 25% jaringan kalus atas dan bawah tersambung
[2] = 25% =
x
< 50% jaringan kalus atas dan bawah tersarnbung [3] = 50% = x < 75% jaringan kalus atas dan bawah tersambung [4] = 75% = x < 100% jaringan kalus atas bawah tersambung [5] = 100 % jaringan kalus atas dan bawah tersarnbungUlangan 1 2 3
Belum Pernah Dikerat [ 4 1 [ 4 1 [ 4 1 Perlakuan Kerat
+
K N 0 3 Ulangan 1 2 3 Pernah Dikerat [ O l 23 MSP(November) 1 0 1119 Pembentukan Jaringan Floem di Bekas Luka Keratan
Pada percobdn ini dilakukan pemutusan jaringan floem dengan cara membuang sebagian kulit batang utama secara melingkar selebar 1 cm. Kambium yang menempel pada batang dilindungi dari kekeringan dengan cara ditutup lakban hitam agar tetap lembab. Fahn (1991) mengatakan, salah satu hngsi penting dari kambium adalah membentuk kalus di atas luka. Kalus terdiri atas massa jaringan parenkima lunak yang dengan cepat terbentuk di atas atau di bawah permukaan terluka pada batang dan akar. Sel-sel luar pada massa yang bersifat parenkima itu dapat bergabus (periderm). Dibawah lapisan protektif ini, kambium yang tersusun kembali akan membentuk jaringan pembuluh baru. Selain itu kambium dapat dibentuk kembali dari xilem yang belum matang dibawahnya, jika segera terlindungi dari kekeringan setelah luka terbentuk. Sel- sel xilem yang belum dewasa mampu membentuk jaringan halus yang di dalamnya bisa tumbuh kambium baru.
Pada percobaan ini, jaringan luka kerat bisa tertutup kalus 100% dan tersambung antara atas dan bawah luka keratan paling cepat 23 MSP pada Percobaan I, sedangkan Percobaan I1 pada 19 MSP, dan Percobaan I11 pada 16 MSP, yaitu pada bulan Oktober 2001 dimana pada saat tersebut sebagian besar pohon sedang membentuk buah.
Hasil analisis jaringan menunjukkan, kulit batang yang dikerat mampu membentuk kembali jaringan pembuluh (floem), namun tidak sempurna. Hasilnya beragam tergantung pada stres yang pernah dialami pohon tersebut.
Pohon Pernah Dikerad
Pada tahun pertama setelah kerat batang, unsur tapis yang terbentuk pada pohon pernah dikerat, kemudian dikerat lagi tahun berikutnya, sulit ditemukan. Komponen yang banyak terbentuk pada jaringan baru tersebut adalah sel parenkima, parenkima jari-jari empulur, sklereid, kolenkima, dan sejumlah kecil protofloem (Gambar 37 a). Eames dan MacDaniels (1953) mengatakan, jaringan floem merupakan jaringan yang klompleks. Pada angiospermae, jaringan floem terdiri dari sel tapis (sieve tube), sel tetangga (companion cells), satu atau beberapa bentuk parenkima floem, serat floem, sklereid, dan beragam sel-sel sekresi.
a
Jaringan parenkima merupakan jaringan dasar (ground tissue) tersusun dari sel-sel hidup dengan struktur morfologi serta fisiologi yang bervariasi dan masih melakukan segala kegiatan proses fisiologis (Sutrian 1992). Parenkima berkembang dari prokambium dan menjadi bagian dari jaringan pembuluh, mempunyai peranan penting dalam penyembuhan luka serta regenerasi (Hidayat 1995). Sel-sel ini berfbngsi sebagai penyimpan cadangan makanan berupa zat dapat larut yang disimpan pada vakuola dan bahan-bahan padat yang disimpan dalam vakuola dan sitoplasma sel-sel tersebut (Eammes dan MacDaniels 1953). Pada tahun pertarna, sel-sel parenkima banyak ditemukan, selnya berbentuk bulat panjang, dengan zat pewarna safianine+aniline memberikan warna keunguan pada bagian dalam sel yang dibelah melintang (Gambar 37 a). Selain parenkima, sel yang paling banyak ditemukan adalah parenkima jari-jari empulur, sel berbentuk persegi panjang dan memberikan warna merah tua (Gambar 37 a). Sutrian (1992) mengatakan, parenkima jari-jari empulur disebut juga sebagai parenkima
121 pengangkut, karena berguna sebagai alat angkut yang menghubungkan jaringan sebelah luar dan sebelah dalam. Di dalam perenkima pengangkut ini banyak ditemukan butir-butir amilum. Parenkima jari-jari empulur, merupakan parenkima sistim radial, dinding-dinding selnya tidak mengayu dan tetap tipis. Setelah jaringan floem berhenti bekerja, keadaannya dapat tetap tidak mengalami
perubahan atau akan mengalami sklerefikasi menjadi sklereid (Sutrian 1992). Pada tahun pertama, di dekat karnbium jaringan bekas dikerat dari pohon yang telah mengalami dua kali kerat batang, banyak ditemukan kolenkima (Gambar 37 a). Kolenkima yang ditemukan adalah kolenkima lakuna, yaitu 0
jaringan kolenkima yang penebalannya hanya berlangsung pada permukaan ruang antar sel. Apabila dilihat dibawah mikroskop, akan tampak sebagai kumpulan sel dengan penebalan tidak teratur, selnya jernih tampak putih mengkilat (Sutrian 1992). Dengan pewarnaan aniline+safianine, kolenkima lakuna tersebut tampak sebagai kumpulan sel berdinding tebal berwarna pink, dengan bagian dalam sel putih jernih (Gambar 37 a). Jaringan kolenkima berfungsi sebagai jaringan mekanik yang bertugas menyokong tumbuhan, berdinding primer, lunak, lentur, dan tidak berlignin. Kolenkima merupakan sel hidup, bersifat plastis dan dapat meregang secara permanen bersama dengan pertumbuhan organ tempatnya berada (Hidayat 1995). Fahn (1 99 1) mengatakan, kolenkima adalah jaringan penunjang tanaman muda, dalam jangka waktu yang lama dapat menjadi sel bersklereid.
[a]. h m h karat 12 BSP
Gambar37.
h m ~ j ~ f l o e m d i W l u k a b ( a , b , c , d , e )
dikerat
saatumm
4tahun
dan
j-
lcontrol
(f).
Kb
=J. Kambium;
J F = J . m o e m ; K t = J * ~ k b = k a m ~ ~ ~ a = ~ a w a l , p r =
p t d o e m ;
pj
= p e n k h ajari-jari
emplur",pf
= p & h a fhmqk l = k o I ~ s l d = ~ s k n = & l ~ F P = J . F l ~ e ~
~ F S = J . F I o e m ~
Jaringan penguat laimya yang bisa ditemukan di tahun pertama setelah kerat batang adalah sel-sel sklereid atau yang biasa disebut dengan sel batu. Sel sklereid biasa ditemukan di jaringan floem, berfbngsi sebagai penyokong, pelindung, dan kadang-kadang juga penyimpan cadangan makanan (Hidayat
1995). Sel-sel ini mudah dibedakan dari sel-sel jaringan sekitarnya
karena
ukuran,bentuk dan ketebalan dindingnya (Sutrian 1992). Sklereid berkembang dari sel- sel parenkima melalui penebalan sekunder dinding selnya. Dinding sekunder ini sangat tebal dengan lapisan-lapisan konsentris sangat banyak. Sklereid seringkali muncul dekat jaringan-jaringan luka, diduga berkembang sebagai reaksi terhadap beberapa gangguan fisiologik (Fahn 1991). Pada penampang melintang jaringan
floem Gambar 37 a, sklereid tampak berbeda dengan sel-sel laimya, ukurannya
lebih besar dan tampak tebal dengan warna merah muda, berada didekat sel-sel parenlcima dan jari-jari empulur.
Tahun pertama setelah batang dikerat, tidak ditemukan unsur tapis awal (sieve tube) sebagaimana jaringan floem kontrol pada pohon yang sudah pernah
dikerat (Gambar 37 f). Sel yang ditemukan mampu berfbngsi sebagai sel
pengangkut adalah protofloem (Gambar 37 a), yaitu jaringan pembuluh dari
bagian tumbuhan muda yang sedang mengalami pemanjangan (Sutrian 1992). Komponen pembuluh tapis ini sempit dan daerah tapisnya hanya dapat dikenali
dengan susah payah. Pembuluh tapis protofloem hanya aktif dalam jangka waktu
yang singkat dan hancur (Fahn 1991). Pada tahun kedua setelah kerat batang,
unsur tapis mulai bisa ditemukan pada pohon yang pernah dikerat, tetapi jumlahnya sangat sedikit dan pendek serta terputus-putus (Gambar 37 b).
124 Jaringan floem di bekas luka keratan pohon pernah dikerat pada tahun kedua
berbeda dengan tahun pertama (Gambar 37 a dan 35 b). Pada tahun kedua,
parenkima jari-jari empulur mulai berkurang dan letaknya tidak serapat tahun pertama,. demikian juga dengan parenkima floem menjadi sangat berkurang digantikan dengan protofloem. Jaringan kolenkima menjadi sangat sulit
ditemukan, sebaliknya sklereid jumlahnya meningkat (Gambar 37 b).
Unsur
tapisawal mulai bisa ditemukan, meskipun jumlahnya sangat sedikit serta pendek dan
terputus. Unsur tapis awal merupakan bagian jaringan floem yang bertugas dalam
penyaluran hasil fotosintesis, merupakan sel penting pada floem (Fahn 1995). Dinding unsur tapis berupa dinding primer dan jarang berlignin. Protoplas unsur tapis mengalami banyak perubahan selama pertumbuhannya. Mula-mula, sel penuh dengan sitoplasma. Pada waktu sel menjadi dewasa, suatu lapisan dinding
baru terbentuk
di
atas dinding primer. Lapisan ini disebut lapisan kulit dalamkerang karena dalam keadaan segar berkilauan seperti bagian dalam kulit kerang.
Pada waktu sel sudah tua, lapisan tersebut mengerut dan menjadi jauh lebih tipis
(Hidayat 1995). Pada irisan melintang kulit batang rambutan, unsur tapis awal mempunyai ukuran sel lebih besar dibandingkan sel-sel sekitarnya. Dengan
menggunakan zat pewarna aniline
+
safianine, unsur tapis tampak bening dengandinding sel berwarna biru muda (Garnbar 37 b). Di dalam unsur tapis terdapat
daerah tapis (sieve area) dan pada daerah tapis ini terdapat alas tapis atau papan
tapis (sieve plate). Unsur tapis (sieve tubes) tersusun dari sel-sel yang protoplasnya melekat pada dinding selnya, adapun nukleusnya telah lenyap. Sel-
sel ini memiliki turgor
yang
tetap, sehingga unsur tapis tetap dalamkeadaan
125
Pohon
Belum Pernah DiReratPembentukan jaringan floem tahun pertama di bekas luka keratan pohon belum pernah dikerat jauh lebih baik dibandingkan pohon yang sudah pernah dikerat tahun sebelumnya. Unsur tapis awal yang masih segar sudah mulai bisa
ditemukan pada tahun pertama di dekat sel-sel kambium pembuluh (Gambar 37
c), jurnlah lebih banyak dan untaiannya lebih panjang dibandingkan unsur tapis
awal pada pohon yang pernah dikerat (Gambar 37 b) meskipun tidak sebanyak
jaringan floem kontrol (Gambar 37 f). Selain unsur tapis awal, juga ditemukan sel
sklerenkima, sklereid, dan parenkima jari-jari empulur.
Pada jaringan bekas luka kerat dari pohon belum pernah dikerat, selain ditemukan jaringan penguat berupa sklereid juga ditemukan jaringan penguat
lainnya seperti sel sklerenkima. Pada Gambar 37 c, tampak bahwa sel-sel
sklerenkima bentuknya tidak setajam sel sklereid. Menurut Fahn (1991) sel sklerenkima (serat) berkembang dari sel meristem, sedangkan skelerid (&I batu) berkembang dari sel parenkima yang dindingnya mengalami penebalan. Pada tahun pertama setelah kerat, sel sklerenkima lebih banyak ditemukan dibandingkan sklereid pada pohon yang belum pernah dikerat tahun sebelumnya. Warna kedua sel tersebut sama, hanya terlihat penebalan selnya berbeda, penebalan sel sklereid jauh terlihat lebih tajamltebal dibandingkan sel sklerenkima. Sel sklerenkima tidak ditemukan lagi pada tahun kedua, sedangkan jaringan penguat lainnya seperti sklereid dapat ditemukan (Gambar 37 d).
Pada tahun kedua, unsur tapis awal sudah lebih banyak terbentuk
dibandingkan tahun
pertama.
Unsur tapis awal pada tahun kedua, jaraknya lebihdengan sel-sel kambium. Pada tahun pertarna, dari setelah jaringan kambium langsung terbent.uk unsur tapis awal, sedangkan pada tahun pertarna unsur tapis awal berada setelah protofloem.
Pada tahun ketiga, selain jaringan floem primer juga terdapat jaringan floem sekunder. Pada jaringan floem primer, protofloem dan unsur tapis sudah mulai
menipis (unsur tapis lanjut), seperti tampak pada Gambar 37 e. Menurut Hidayat
(1995)
ha1
itu disebabkan oleh tekanan keluar akibat silinder xilem semakinmembesar. Floem primer terdorong keluar, hngsi pengangkutan terhenti,
protofloem membentuk serat. Sel yang berdinding tipis
akan
rebah dan remuk.Pada floem sekunder, selain terdapat unsur tapis awal yang terlihat adalah
sklereid, protofloem yang sudah menipis (memanjang),
dan
parenkima jari-jariempulur.
Antara jaringan floem dengan korteks tidak terlihat batas yang jelas pada
Gambar 37 c. Hidayat (1995) mengatakan, pada batang tanaman tahunan
berkayu, batas antara korteks dan daerah jaringan pembuluh sering tidak jelas karena tidak ada endodermis, namun lapisan korteks terdalam memiliki sifat kimiawi dan fisiologi yang serupa dengan endodermis.
Pohon Kontrol
Pada kulit batang pohon kontrol, terdapat jaringan floem sekunder dan jaringan floem primer. Pada jaringan floem sekunder terdapat unsur tapis awal
yang berangkai membentuk deretan yang tidak terputus (Garnbar 37 f ) . Ukuran
sel unsur tapis besar, dapat dibedakan dengan sel-sel sekitarnya. Ukuran unsur
tapis awal kulit batang rambutan yang
besar
jernih berbeda dengan sel sekitarnya127
vinifera oleh Esau (1965) dalam Hidayat (1995)
dan
irisan melintang jaringan floem oleh Zimmerman dan Brown (1971) dalam Teiz dan Zeiger (1991).Jaringan floem merupakan jaringan majemuk. Unsur tapis, yang melaksanakan
penyaluran hasil fotosaintesis, merupakan sel penting dalam floem. Lewatnya hasil fotosintesis dalam unsur tapis lebih cepat dari pada dalam sel parenkima biasa. Kecepatan transportasi floem bervariasi dari 10-100 cm per jam atau bahkan lebih (Zimmermann 196 1, 1963 dalam Fahn 1991). Zimmermann (1964)
dalam Fahn (1991) memperkirakan, unsur tapis
akan
kosong 3-10 kali setiapSelain terdapat unsur tapis awal, pada jaringan floem sekunder juga terdapat protofloem, sklereid, parenkima floem, dan parenkima jari-jari empulur serta ada sejumlah kecil sel kolenkima. Pada jaringan floem sekunder, parenkima jari jari empulurnya cukup rapat pada daerah dekat dengan kambium. Sel-sel parenkima floem jumlahnya juga relatif sedikit, berada dekat dengan sel-sel kambium. Sel penguat lebih didominasi oleh skleried, sel penguat lainnya seperti kolenkima jumlahnya sangat sedikit dan letaknya pun berdekatan dan harnpir menyatu d a g a n sklereid. Sel protofloem segar (bulat jernih) berada pada daerah dekat kambium, sedangkan pada daerah dekat dengan unsur tapis awal sudah menipis, meskipun masih ditemukan beberapa yang masih berbentuk bulat jernih (Gambar 36 f ) .
Pada kulit batang rambutan umur 5 tahun, jaringan floem primernya
mempunyai dua lapis unsur tapis lanjut yang sudah menipis dan terputus-putus
serta telah
kehilangan
hngsinya (Gambar Lampiran 7;Gambar
37 f). Hal ini terjadi karena dengan semakin bertambah besarnya empulur batang ,karenapertumbuhan sekunder yang membesar, rnaka floem primer akan terdorong keluar. Sel-sel floem (unsur tapis) yang berdinding tipis akan rebah dan remuk, tidak dapat mengikuti pertambahan diameter empulur karena tidak mampu membelah diri akibat telah hilangnya inti pada unsur tapis. Sutrian (1992) mengatakan, pada saat mulai tidak aktifhya pembuluh tapis, muncul callose di daerah plasmodesmata dan seringkali melakukan penekanan terhadap benang- benang plasmodesmata sehingga berbentuk lebih kecil. Selain itu callose juga muncul menyumbat pori-pori daerah tapis sehingga tidak berfbngsi lagi.
Jaringan penguat lainnya yang bisa ditemukan di tahun pertama setelah
kerat batang adalah sel-sel sklereid atau yang biasa disebut dengan sel batu. Dalam kulit pohon, perubahan jaringan parenkima menjadi sklereid diduga penyebabnya adalah usia jaringannya (Fahn 199 1). Pada penampang melintang
jaringan floem (Gambar 37 f ) , sklereid tampak berbeda dengan sel-sel lainnya,
ukurannya lebih b e a r dan tampak tebal dengan warna merah muda, berada didekat sel-sel parenkima dan jari-jari empulur.
Pem bahasan Tajuk Pohon
Pada tanaman yang diberi perlakuan kerat batang muncul gejala seperti
kekurangan unsur
hara
dalam ha1 ini magnesium. Daun tua menguning dimulaidari bagian tengah ke pinggir daun. Gejala tersebut mulai muncul sekitar empat minggu dari saat pohon diberi perlakuan kerat batang. Menurut Marschner (1995), gejala awal tanaman kekurangan magnesium adalah lembar daun dewasa
menguning atau terjadi klorosis pada tulang-tulang daun tua. Jones et al. (1991)
gejala nekrosis. Hasil percobaan Schecter et al. (1994) rnenunjukkan, kadar magnesium dalam daun ape1 menwun setelah perlakuan kerat pada cabang-cabang tidak berbuah. Lavo, Goldschmidt, dan Frank (1995) mengatakan, adanya kekurangan magnesium dan kalsium di daun dapat menyebabkan peningkatan
kadar pati daun dan peningkatan nisbah pati-gula terlarutnya. Salisbury
dan
Ross(1992) mengatakan, magnesium merupakan kofaktor pengaktif enzim pengkatalisis tiap reaksi yang terlibat dalam lintasan utama pembentukan sukrosa dan ini merupakan salah satu alasan penting mengapa magnesium penting bagi tumbuhan. Dengan adanya deffisiensi magnesium, maka sintesis sukrosa menurun yang mengakibatkan terjadinya penimbunan pati di daun. Hasil percobaan menunjukkan, kadar pati daun dan lculit ranting pohon meningkat setelah diberi perlakuan kerat batang (Gambar 20 dan 22). Kadar pati daun meningkat diduga disebabkan oleh dua faktor, yaitu pertama, menurunnya aliran karbohidrat tajuk
,
ke pangkal batang; kedua, akar kekurangan energi untuk melalrukan aktifitasnya dalam menyerap unsur hara, karena terhentinya pasokan karbohidrat ke daerah
perakaran. Berdasarkan uraian di atas, menurunnya kemampuan akar dalam
menyerap hara tertentu seperti magnesium dapat menyebabkan peningkatan kadar
pati di daun.
Munculnya gejala defisiensi unsur magnesium, diduga rnampu mempengaruhi proses fisiologi dalam pohon rambutan Binjai, seperti laju fotosintesis. Adanya gangguan pada proses fotosintesa diduga mempengaruhi laju pertumbuhan vegetatif tanaman. Hasil percobaan menunjukkan, perlakuan kerat
batang-KNa secara nyata menurunkan produksi tunas pucuk
daun
rambutan130
(1991), magnesium merupakan elemen penting dari molekul klorofil dan sebagai kofaktor penting dari enzim-enzim yang mengaktiflcan proses fosforilasi. Perlakuan kerat batang pada musim panas setelah periode gugur buah fisiologi dapat menurunkan kadar klorofil daun, sedangkan kadar N daun tidak dipengaruhi oleh perlakuankerat batang pada kondisi tanaman tercukupi kebutuhan airnya (Peng dan Rabe 1966). Berdasarkan urain di atas, perlakuan kerat batang di duga mampu menurunkan laju fotosintesis rambutan Binjai yang disebabkan oleh menurunnya kadar klorofil dalam daun dan tingginya kadar pati daun. Tingginya kadar pati dalam daun diduga menyebabkan daun jenuh berfotosintesis. Pendapat ini didukung oleh hasil percobaan yang dilakukan Schechter et al. (1994); Roper dan Williams (1989) dimana laju fotosintesis daun pohon yang dikerat rendah, resistensi stomata dan kadar COz internalnya tinggi. Selanjutnya Schechter et al.
(1994) mengatakan, hasil tersebut tidak mendukung pengaruh balik penghambatan fotosintesis dan memperlihatkan keadaan spesifik dimana kapasitas .sink untuk menggunakan hasil fotosintesis telah jenuh. Kekuatan sink secara nyata berkurang akibat akumulasi karbohidrat yang berlebihan dalam daun.
Selain terjadi gejala deffisiensi, pohon yang diberi perlakuan kerat batang pada percobaan ini ada yang mati (dua pohon dari 72 pohon yang digunakan dalam percobaan). Munculnya defisiensi unsur hara yang cukup berat dan adanya pohon yang pernah dikerat batangnya mati diduga dikarenakan akar mengalami stres berat akibat kemarau panjang dan tingginya kedalaman air tanah di tempat tumbuh tanaman tersebut. Kedalaman air tanah di lokasi percobaan tinggi, ditandai dengan cepat mengeringnya rumput di lokasi percobaan tersebut dan retaknya tanah disekitar pohon. Hasil pengamatan Liferdi et al. (2000)
13 1 menunjukkan sebaran akar rambutan Binjai berada pada kedalaman 10-80 cm dari permukaan tanah dengan jumlah akar serabut sedang. Hal ini didukung oleh Tindall et al. (1994) yang mengatakan, perakaran rambutan tidak dalam menembus tanah, meskipun ujung akar utamanya bisa memanjang hingga beberapa meter dari permukaan tanah, namun akar-akar lateralnya kebanyakan didapati tumbuh pada area relatif dekat pemukaan tanah. Selanjutnya hasil pengamatan Lim dan Diezbalis (1995) menunjukkan, sekitar 80% akar rambutan berada pada 15 cm dari permukaan tanah, sehingga bersifat sensitif terhadap kekeringan. Menurut Erner (1988) dalam Rabe dan Krajweski (1995), perlakuan kerat batang termasuk teknik yang efektif dalam pembungaan pohon jeruk jika diaplikasikan pada saat yang tepat, tetapi teknik ini merupakan prosedur yang rentan. Kerat batang tiap tahun dapat merusak pohon, dimana pertumbuhan akar terganggu dan meningkatkan akumulasi zat perusak yang belum teridentifikasi dalam daun serta terjadinya diferensiasi tunas bunga yang. berlebihan. Subhadrabandhu dan Yapwattanaphun (2000) mengatakan, kerat batang dan kerat cabang dapat menginduksi dormansi dan meningkatkan pembungaan, pembuahan, dan produksi lengkeng, namun hasil tersebut tidak konsisten sehingga tidak bisa direkomendasikan untuk diaplikasikan skala komersial. Selanjutnya Cohen et al. (1988) dalam Rabe dan Krajewski (1995) mengatakan, kerat batang sudah beberapa tahun diaplikasikan pada pohon jeruk di Israel, Arnerika, Spanyol, dan Afi-ika Selatan, namun tetap merupakan ha1 yang kontroversial dan seyogyanya hanya diaplikasikan pada pohon yang kondisinya sehat.
Perlakuan kerat batang secara nyata menurunkan kerimbunan pohon rambutan Binjai pada Percobaan I, 111 dan IV, tetapi tidak pada Percobaan 11. Hal
132 ini terlihat dari rendahnya jumlah anak daun per ranting per pohon (Gambar 35). Pengaruh tersebut nyata pada pohon yang diberi perlakuan kerat batang saat tanaman sedang donnan (akhir flush kedua, ketiga, dan keempat), tetapi tidak pada pohon yang dikerat batangnya saat aktif memunculkan daun baru (pertengahan flush ketiga). Hasil ini didukung oleh percobaan Adulsak-Koo- Duang (1984), dimana perlakuan kerat batang pada pohon leci menyebabkan kerontokan daun pada 4-5 BSP, kerontokan pada varietas 0-Hea lebih tinggi dibandingkan kerontokan pada varietas Hong-Huay. Goldschmidt dan Golomb (1982) mengatakan, kadar klorofil daun pohon Wilking yang berbuah lebat menurun hingga 213 kadar klorofil daun normal. Hal ini mengindkasikan adanya gangguan pada sistem fotosintesanya. Apabila dilihat secara keseluruhan pada Tabel 1, Gambar 12, Gambar 13, dan Gambar 35, terlihat bahwa pohon yang mengalami kerontokan daun tinggi adalah pohon yang dikerat saat tanaman dalam kondisi donnan dan produksi buah per pohonnya nyata meningkat lebih tinggi dibandingkan pohon kontrol. Berdasarkan ha1 tersebut, diduga menurunnya kerimbunan tajuk pohon setelah berbuah ada hubungannya dengan kondisi pohon saat perlakuan kerat batang dan tinggi rendahnya buah yang dihasilkan pohon tersebut.
Kerontokan daun yang cukup tinggi setelah berbuah lebat diduga berhubungan dengan menurunnya kemampuan akar dalam menyediakan hara yang dibutuhkan selama pembentukan dan pembesaran buah akibat perlakuan kerat batang. Hasil percobaan Schecter et al. (1994) menunjukkan perlakuan kerat cabang-cabang ape1 yang tidak berbuah menurunkan kadar unsur N, P, K, Ca, Mg, Mn, Cu, Zn, B, dan Fe daun secara nyata. Pada percobaan ini diduga akar
133
rambutan tidak mampu menyerap hara secara optimal akibat adanya gangguan pada jaringan floem di batang utarna.
Selama pembentukan dan pertumbuhan buah, cadangan makanan yang tertimbun di bagian atas tajuk pohon diduga banyak digunakan untuk pertumbuhan dan perkembangan buah. Pohon yang berbuah lebat akan lebih banyak menghabiskan cadangan makanan dibandingkan pohon yang tidak lebat buahnya. Hasil percobaan menunjukkan, pohon yang mendapat perlakuan kerat batang menghasilkan buah jauh lebih lebat (400
- 1000 persen lebih tinggi)
dibandingkan pohon yang tidak mendapat perlakuan kerat (Gambar 13 dan 14); sedangkan pembentukan floem di bekas luka keratan tidak sempurna (Gambar 37 a dan 37 c). Beberapa pohon ada yang luka keratannya belum tertutup kalus dan menyambung (Tabel 1 5, 16, 17, dan 18; Gambar 33). Hasil percobaan pada pohon leci oleh Adulsak-Koo-Duang (1984) menunjukkan, pembentukan kalus pada bekas keratan lambat, pada 1-8 BSP belum ada kalus yang terbentuk pada bekas luka keratan. Kecepatan penyembuhan luka kerat berbeda antar varietas. Pembelahan kalus di luka bekas keratan pohon leci varietas 0-Hea lebih lambat dibandingkan pada varietas Hong-Huay. Diduga pembentukan jaringan floem yang tidak sempurna menyebabkan kemampuan akar dalam mensuplai hara menurun. Hal ini terjadi karena akar tidak memperoleh karbohidrat secara memadai untuk menyerap hara secara aktif Sedangkan sink buah untuk memperoleh karbohidrat dari pohon yang berbuah lebat dari pohon yang mendapat perlakuan kerat batang sangat h a t yang mengakibatkan remobilisasi karbohidrat dari cadangan karbohidrat organ non fotosintetik (batang, cabang, ranting) tidak mencukupi, untuk itu perlu juga mengambil cadangan karbqhidrat134 dari organ fotosintetik (daun). Diduga ha1 ini yang menyebabkan pohon yang berbuah lebat mengalami kerontokan daun cukup tinggi (Gambar 33 dan 36).
Pada Percobaan 11, perlakuan kerat batang tidak meningkatkan kerontokan daun rambutan Binjai, meskipun ada kecenderungan pohon yang dikerat mempunyai daun lebih sedikit dibandingkan pohon yang tidak dikerat. Diduga ada hubungannya dengan produksi buah yang dihasilkan pohon tersebut, dimana perlakuan kerat batang tidak secara nyata meningkatkan produksi buah pohon Percobaan I1 (Gambar 13). Dengan demikian remobilisasi cadangan makanan yang tersimpan dalam tajuk pohon Percobaan I1 untuk pertumbuhan buahnya tidak sebesar pada pohon berbuah lebat di Percobaan I dan Percobaan 111. Sehingga kerontokan daun pasca berbuah pohon Percobaan I1 tidak sebanyak pohon Percobaan I dan Percobaan 111.
Berdasarkan uraian tersebut di atas dapat disimpulkan bahwa pembentukan jaringan floem di bekas luka keratan yang tidak sempurna dan adanya jaringan luka kerat belum tertutup oleh kalus pada beberapa pohon, secara tidak langsung menyebabkan pohon yang berbuah lebat menurun kerimbunannya setelah buah dipanen. Pohon berbuah lebat lebih banyak menghabiskan cadangan makanan yang tersimpan dalam tajuk tanaman untuk pertumbuhan buahnya. Sedangkan pasokan karbohidrat dari hasil fotosintesis saat pertumbuhan buah berlangsung tidak banyak membantu. Hasil fotosintesis saat pertumbuhan buah berlangsung tidak mampu menutupi kebutuhan karbohidrat untuk pertumbuhan buah. Diduga laju fotosintesis menurun akibat tidak mendapat suplai hara secara memadai dari akar. Kemampuan akar menyerap hara menurun karena akar kekurangan energi untuk menyerap hara yang diperlukan daun berfotosintesis. Hal ini menyebabkan
135 cadangan makanan (pati) yang tersimpan di daun ikut terkuras untuk memenuhi kebutuhan buah untuk pertumbuhannya, sehingga terjadi kerontokan daun yang cukup tinggi pasca berbuah.
Luka Kerat
Dalam melakukan kerat batang, jaringan yang dibuang adalah kulit kayu (floem, korteks, dan epidermis), sedangkan sel kambium yang menempel pada batang (xilem) tidak dibuang. Sel kambium tersebut dilindungi dari kekeringan
dengan cara ditutup lakban hitam. Hidayat (1995) mengatakan, kambium
merupakan meristem lateral, pada batang, sel ini akan membelah secara periklinal, dimana sel yang ada di sebelah luar berkembang menjadi jaringan floem. Dengan masih tertinggalnya kambium di bekas luka keratan dan dilindunginya kambium tersebut dari kekeringan, maka kambium tersebut akan mampu berploriferasi membentuk kalus dan selanjutnya akan berdifferensiasi membentuk jaringan floem.
Pada percobaan ini luka di bekas keratan mampu membentuk kalus. Kalus yang terbentuk tersebut diduga berasal dari sel kambium dan sel parenkima yang berploriferasi. Sel mati di permukaan sayatan akan terurai dan membentuk lapisan nekrotik, seperti bekas luka pada penyembuhan luka. Sel utuh di bawah lapisan nekrotik akan membesar, membelah, dan membentuk jaringan kalus yang mengisi ruang antara jaringan terluka. Akhirnya, akan terjadi pertemuan kalus yang tumbuh dari atas bekas luka dengan kalus yang tumbuh dari bawah bekas luka. Kalus yang tumbuh dibekas luka mampu berdifferensiasi menjadi sel kambium. Penyesuaian letak kambium dari tiap-tiap pihak memudahkan terjadinya kesinambungan kambium dan keberhasilan dalam penyatuan jaringan sekunder
136 yang terjadi kemudian (Hidayat 1995). Hasil percobaan menunjukkan, pada awalnya jaringan luka kerat mengandung banyak sel-sel parekima, baik parenkima floem maupun parenkima jari-jari empulur. Hal ini dapat dilihat pada Gambar 37 a, yaitu pada tahun pertama setelah kerat batang pada pohon yang pernah dikerat tahun sebelumnya, lebih banyak membentuk sel parenkima pada tahun pertama setelah kerat batang. Tingginya sel parenkima yang terbentuk pada tahun pertama adalah reaksi kambium akibat luka kerat. Sebagaimana yang dikatakan Fahn (1991), yaitu salah satu hngsi dari kambium adalah membentuk kalus atau jaringan luka di atas luka. Jaringan ini terdiri atas massa jaringan parenkima lunak yang cepat terbentuk di atas atau di bawah permukaan terluka.
Kalus dapat terbentuk oleh pembelahan sel-sel parenkima pada floem, korteks atau jejari pembuluh, tetapi terutama oleh kambium. Selain itu kambium bisa juga terbentuk dari sel-sel xilem yang belum matang. Sel-sel xilem hidup yang belum dewasa tersebut dapat membentuk jaringan kalus yang didalamnya tumbuh kambium baru. Sel-sel luar kalus akan membentuk lapisan periderm. Dibawah lapisan protektif (periderm), kambium yang tersusun kembali membentuk jaringan pembuluh baru (Fahn 199 1). Hasil percobaan menunjukkan kalus yang menutup luka bekas keratan mampu membentuk jaringan pembuluh (floem) namun tidak sempurna. Hasilnya bervariasi tergantung stres yang dialami pohon tersebut.
Pembentukan jaringan floem pada pohon yang dikerat dua kali selama dua tahun berturut-turut lebih lambat dibandingkan yang hanya mengalami satu kali kerat. Pada tahun pertarna, pohon yang dikerat dua kali baru mampu membentuk parenkima floem, parenkima jari-jari empulur, kolenkima, sklereid dan pedikit
137
protofloem (Gambar 37 a). Unsur tapis awal belum dapat ditemukan. Unsur tapis awal baru bisa ditemukan pada tahun kedua setelah kerat, dengan jumlah sangat sedikit, pendek dan terputus-putus (Gambar 37 b). Berbeda dengan pohon yang baru mendapat perlakuan kerat batang satu kali, unsur tapis awal sudah mulai bisa ditemukan pada tahun pertama setelah kerat batang, rangkaian sel unsur tapis cukup panjang (Gambar 37 c) meskipun masih terputus-putus tidak seperti unsur tapis jaringan floem kontrol (Gambar 37 f).
Pohon yang mengalami kerat batang dua kali riskan terhadap stres lingkungan, karena jaringan floem yang terbentuk di bekas luka keratan tidak sempurna dan sangat sulit ditemukan adanya unsur tapis awal. Gambar 33 menunjukkan pohon yang mengalami kerat batang dua kali mengalami kerontokan daun sangat tinggi setelah berbuah. Meskipun produksi buahnya meningkat, perlakuan kerat dua kali dalam dua tahun berefek kurang baik bagi kelanjutan pertumbuhannya. Diduga erat kaitannya dengan terkurasnya cadangan makanan dalam pohon tersebut dan tidak sempurnanya pembentukan floem pada bekas luka keratan. Pada tahun pertama, pohon yang dikerat dua kali, tidak ditemukan adanya unsur tapis awal (Gambar 37 a), unsur tapis awal baru ditemukan pada tahun kedua dengan jumlah sangat sedikit dan pendek (Gambar 37 b). Sutrian (1992) mengatakan, untuk dapat befingsi, floem harus dalam keadaan hidup. Floem befingsi mengangkut dan menyebarkan zat-zat makanan yang merupakan hasil fotosintesis dari sumber ke bagian lain yang memerlukan. Gardner et al. (1991) mengatakan, zat-zat yang diangkut oleh jaringan floem adalah karbohidrat (90%) dalam ha1 ini adalah gula yang bersifat pereduksi (gula tanpa kelompok aldehida atau keton yang terbuka: sukrosa atau rafinosa), ,selain
138
itu juga ditemukan substansi yang mengandung nitrogen (asam amino, amida, dan urida) dan zat pengatur tumbuhan, nukleotida, dan beberapa hara anorganik. Dengan demikian apabila unsur tapis tidak terbentuk atau sedikit jumlahnya, maka pengangkutan karbohidrat, protein, zat pengatur tumbuh dan juga hara anorganik akan terhambat yang dapat berakibat pada menurunnya pertumbuhan dan perkembangan tanaman.
Pada tahun pertama setelah kerat batang, pohon yang dikerat dua kali belum membentuk unsur tapis awal, tetapi sudah membentuk protofloem (Gambar 37 a). Protofloem mampu mengangkut zat-zat makanan ke bagian yang memerlukan karena dalam protofloem dapat ditemukan daerah tapis meskipun hanya dapat dikenali dengan susah payah. Namun demikian pembuluh tapis protofloem ini hanya aktif dalam jangka waktu relatif pendek (Fahn 1991). Selain sel-sel protofloem, dalam jaringan floemnya juga ditemukan parenkima floem. Menurut Zimmermann (1 96 1, 1963) dalam Fahn (1 99 1 ), pengangkutan hasil fotosintesis dapat melewati sel parenkima biasa meskipun kecepatannya jauh lebih rendah dibandingkan lewat unsur tapis.
Pada tahun ketiga setelah kerat batang, jaringan floem dari pohon yang hanya mengalami satu kali kerat batang, semakin lebar (Gambar 37 e) dibandingkan tahun pertama dan tahun kedua (Gambar 37 c dan 37 d). Dimana dengan pembesaran yang sama (40x), jaringan korteks tidak tampak pada luka kerat umur 3 tahun, tetapi pada umur 1 dan 2 tahun jaringan korteksnya terlihat. Meskipun jaringan floemnya semakin lebar, namun yang masih aktif mengangkut bahan makanan (jaringan floem sekunder) hanya sebagian saja yaitu yang dekat dengan jaringan kambium (Gambar 37 e). Sebagian besar jaringannya ,sudah
139
tidak aktif lagi (jaringan floem primer). Hidayat (1995) mengatakan jumlah floem sekunder tidak banyak dan tetap terbatas karena sumbu di sebelah dalam floem senantiasa membesar dan floem tidak cukup sering membelah untuk mengimbangi penebalan sumbu tersebut, maka floem yang barn dibentuk oleh kambium akan mendesak keluar sehingga floem tua (floem primer) terhimpit menjadi tak berfbngsi dan terdorong keluar. Fungsi pengangkutan terhenti dan pada banyak
I
turnbuhan dikotil, protofloem membentuk serat. Sel yang berdinding tipis akan rebah atau remuk. Bila pertumbuhan sekunder berlangsung terus menerus, maka floem sekunder pun akan terkena tekanan dari bagian dalam karena silinder xilem terus membesar garis tengahnya.
Kesimpulan
1. Penyambungan jaringan terbentuk pada luka kerat bagian atas dan bawah keratan dari pohon yang dikerat pada akhir flush kedua lebih lambat dibandingkan pohon yang dikerat saat flush ketiga atau setelab akhir flush keempat karena lebih lambat membentuk kalus.
2. Jaringan floem batang utama yang dikelupas mampu terbentuk kembali, namun tidak normal seperti jaringan floem kontrol.
3. Pembentukan jaringan floem pohon yang dikerat batang dua kali dengan interval waktu satu tahun lebih lambat dibandingkan pohon baru dikerat satu kali.
4. Pohon dikerat dan berbuah lebat menurun kerimbunan daunnya setelah panen buah. Daun pohon dikerat namun tidak berbuah lebat, masih serimbun daun pohon kontrol.