PENGAMATAN LAJU REAKSI TERHADAP FAKTOR-FAKTOR YANG
MEMPENGARUHINYA
Muhammad Basir Nasution1, Murni Arifah2, Rayhanah Nur Tsabitah3 Program Studi Pendidikian Kimia, Fakultas Ilmu Tarbiyah dan Keguruan
UIN Syarif Hidayatullah Jakarta
ABSTRAK
Laju reaksi dapat dipergunakan untuk memprediksi kebutuhan bahan pereaksi dan produk reaksi tiap satuan waktu, dan dapat juga dipergunakan untuk menghitung kebutuhan energi untuk produksi hidrogen. Persamaan laju reaksi diperoleh melalui eksperimen, dan tidak bisa hanya dilihat dari persamaan reaksinya saja. Dengan pengukuran jumlah konsentasi tiap zat terhadap waktu persamaan laju reaksi dapat ditentukan. Laju suatu reaksi dapat terjadi karena adanya beberapa faktor, seperti penambahan konsentrasi zat, menurunkan atau meningkatkan suhu pada sistem, luas permukaan atau bentuk fisik zat, dan katalis yang dapat mempercepat laju reaksi. Percobaan ini dilakukan untuk mengamati keempat faktor yang mempengaruhi cepat lambatnya suatu reaksi dapat berlangsung.
Kata Kunci : Laju reaksi, reaktan, produk, suhu, konsentrasi, luas permukaan, katalis.
ABSTRACT
The reaction rate can be used to predict the needs of reagents and reaction products per unit time, and can also be used to calculate the energy requirement for the production of hydrogen. Reaction rate equation was obtained through experiments, and can not only be seen from the equation alone. By measuring the amount of concentrations of each agent to the time the reaction rate equation can be determined. The rate of a reaction can occur due to several factors, such as the addition of concentration, decrease or increase the temperature of the system, the surface area or the physical form of the substance, and catalyst to accelerate the reaction rate. This experiment was conducted to observe the four factors that affect how quickly a reaction can
take place. Keywords: rate of reaction, reactant, product, temperature, concentration, surface area, catalysts
I. INTRODUCTION
Bidang kimia yang mengkaji kecepatan atau laju terjadinya reaksi kimia dinamakan kinetika kimia (Chemical kinetic). Kata kinetik menyiratkan gerakan atau perubahan, energi kinetik didefinisikan sebagai energi yang tersedia karena gerakan suatu benda. Disini kinetika merujuk pada laju reaksi (Reaction rate), yaitu perubahan konsentrasi reaktan atau produk terhadap waktu (M/s). Secara umum, setiap reaksi dapat digambarkan dengan persamaan : Reaktan Produk
Persamaan ini memberitahukan bahwa, selama berlangsungnya suatu reaksi, molekul reaktan bereaksi sedangkan molekul produk terbentuk. Sebagai hasilnya, untuk mengamati jalannya laju reaksi dengan cara memantau menurunnya konsentrasi rektan atau meningkatya konsentrasi produk. Menurunnya jumlah molekul reaktan dan meningkat jumlah molekul produk seiring berjalannya wakru, secara umum akan lebih mudah diamati apabila laju dinyatakan dalam perubahan konsentrasi terhadap waktu. Secara umum untuk reaksi
aA + bB cC + dD
persamaan laju reaksinya adalah r = = (Chang,2005:30) Kecepatan reaksi bergantung pada banyak faktor, konsentrasi reaktan memerankan peran penting dalam mempercepat atau memperlambat reaksi tertentu. Banyak reaksi yang sangat peka terhadap suhu, sehingga pengendalian suhu sangat penting untuk pengukuran kuantitatif dalam kinetika kimia, bentuk fisik reaktan juga berperan penting dalam laju yang diamati.(Oxtoby,2001:415) Bukan hanya konsentrasi, suhu dan bentuk fisik reaktan saja yang dapat mempengaruhi kecepatan reaksi. Penambahan zat lain yang disebut katalis juga ikut mempengaruhi kecepatan reaksi. Katalis ialah zat yang mengambil bagian dalam reaksi kimia dan mempercepatnya, tetapi ia sendiri tidak mengalami perubahan kimia yang permanen. Jadi, katalis tidak muncul dalam persamaan kimia balans. Secara keseluruhan, tapi kehadirannya sangat mempengaruhi hukum laju. Katalis menimbulkan efek yang nyata pada laju reaksi, meskipun dengan jumlah yang sangat sedikit. Dalam kimia industri,
banyak upaya untuk menemukan katalis yang akan mempercepat reaksi tertentu tanpa meningkatkan timbulnya produk yang tidak diinginkan. (Oxtoby,2005:439)
Laju reaksi menggambarkan seberapa cepat reaktan terpakai dan produk terbentuk. Seberapa cepat reaktan terpakai pada umumnya dipengaruhi oleh beberapa macam perlakuan pada sistem atau lingkungan. Seperti halnya ketika suhu dinaikan maka suhu energi kinetik partikel zat meningkat sehingga memungkinkan semakin banyaknya tumbukan efektif yang menghasilkan perubahan akibatnya reaksi berlangsung lebih cepat dari suhu semula. Semakin banyak partikel zat, maka tumbukan efektif yang menghasilkan perubahan akan semakin cepat terjadi, hal ini terjadi pada penambahan konsentrasi zat yang dapat mempercepat reaksi. Selain suhu dan konsentrasi luas permukaan zat atau bentuk fisik dari zat juga ikut mempengaruhi kecepatan reaksi zat. Semakin luas permukaan suatu zat atau semakin halus bentuk fisik dari suatu zat, semakin kecil ukuran zat, reaksi berlangsung semakin cepat karena hal tersbut.(Purwanti,2013)
Laju reaksi terukur, seringkali sebanding dengan konsentrasi reaktan satu pangkat. Contohnya mungkin saja laju itu sebanding
dengan konsentrasi dua reaktan A dan B, sehingga :
r = k [A][B]
koefisien k disebut konstanta laju, yang tidak bergantung pada konsentrasi (tetapi bergantung pada temperatur). Persamaan sejenis ini yang ditentukan secara eksperimen disebut hukum laju reaksi.(P.W.Atkins,1999:335)
II.MATERIAL AND METODE Materials :
1. Pita magnesium 4 buah
2. Larutan HCl dengan konsentrasi 0,1M, 0,5M, 1M, 2M dan 3M 5 ml.
3. Larutan Na2S2O3 0,01 M
4. Larutan H2O2 0,1M sebanyak 5 ml 5. Larutan NaCl 0,1M 4 tetes
6. Larutan FeCl3 0,1M 4 tetes
7. CaCO3 sebanyak 1 gram, baik yang berbentuk bongkahan ataupun serbuk. Apparatus :
1. Tabung reaksi 2. Rak Tabung reaksi 3. Penjepit tabung reaksi 4. Spatula
5. Neraca O’Hauss 6. Kaca arloji
7. Gelas ukur 25 ml 8. Gelas beaker 50 ml 9. Mortal dan alu 10. Pipet tetes 11. Stopwatch 12. Termometer
Experiment Prosedural
Pengamatan Pengaruh Konsentrasi
Pita magnesium yang telah disiapkan di masukan kedalam 4 tabung reaksi yang berbeda, berikan label 1, 2, 3, dan 4 untuk memudahkan pengamatan. Masing-masing tabung ditetesi dengan HCl yang memiliki konsentrasi berbeda-beda tiap tabung. HCl 0,5M untuk tabung label 1, HCl 1M untuk tabung label 2, HCl 2M untuk tabung label 3, HCl 3M untuk tabung label 3. Amati saat HCl mulai diteteskan kedalam tabung, dengan menggunakan stop watch lakukan pengambilan data dengan mencatat waktu yang dibutuhkan pita magnesium sampai habis bereaksi dengan HCl.
Pengaruh Suhu
Buat potongan kertas berbentuk segi empat dan buat diagonal garis pada bagian tengah kertas dengan spidol, letakan gelas beaker diatas kertas yang telah diberi tanda menyilang dengan spidol. Larutan Na2S2O3 yang telah disediakan dituangkan kedalam
gelas beaker, kemudian tuangkan HCl kedalam gelas beaker yang telah terisi larutan natrium tio sulfat. Saat larutan natriumm tio sulfat ditetesi HCl, lakukan pengamatan saat garis menyilang dibawah gelas beaker tidak terlihat dari bagian atas gelas beaker, gunakan stop watc untuk mengamati seberapa cepat garis menyilang tersebut mulai tidak terlihat. Lakukan percobaan diatas sekali lagi, namun kedua larutan dipanaskan terlebih dahulu, setelah suhunya sama barulah kedua larutan dicampurkan secara bersamaan. Lakukan pengamatan dan prosedur yang sama dengan percobaan sebelumnya.
Pengaruh Luas Permukaan
Sediakan 2 buah gelas beaker, satu gelas beaker diisi dengan batu pualam berbentuk bongkahan dan satu gelas diisi dengan batu pualam berbentuk serbuk. Batu pualam telah ditimbang massanya seberat 1 gram. Kedalam gelas beaker yang masing-masing telah diisi batu pualam teteskan HCl 0,1M. Lakukan pengamatan dengan mencatat waktunya menggunakan stop watch sampai batu pualam habis bereaksi.
Pengaruh Katalis
Kedalam 3 buah tabung reaksi, teteskan larutan Peroksida sebanyak 5 ml beri label pada masing-masing tabung. Tabung 1
dibiarkan tanpa perlakuan apapun, tabung 2 diteteskan larutan NaCl 0,1M sebanyak 4 tetes, dan tabung 3 diteteskan larutan FeCl3 sebanyak 4 tetes. Lakukan pengamatan terhadap ada tidaknya gelembung yang terbentuk dan seberapa banyak gelembung yang dihasilkan dalam masing-masing tabung reaksi.
III. RESULT AND DISCUSSION
Dari hasil percobaan berbagai pengaruh luar terhadap proses berjalannya suatu reaksi, didapatkan data-data sebagai berikut :
Pengaruh Konsentrasi
Pengamatan terhadap pengaruh penambahan konsentrasi zat dalam suatu reaksi kimia dari percobaan diatas dihasilkan persamaan reaksi sebagai berikut :
Mg(s) + 2HCl(aq) MgCl2(aq) + H2(g)
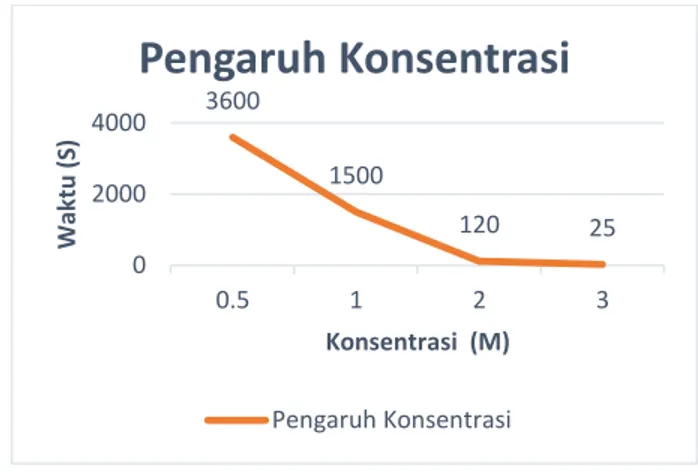
Semakin besar konsentrasi yang ditambahkan, menunjukan bahwa waktu yang dibutuhkan untuk bereaksi akan semakin cepat. Seperti di tunjukan pada gambar berikut :
Gambar 1.1 Hasil Pengamatan Pengaruh Konsentrasi Terhadap Laju
Reaksi
Dari gambar 1.1 dapat dijelaskan bahwa dengan penambahan HCl dengan konsentrasi yang berbeda-beda pada pita magnesium menunjukan bahwa pada konsentrasi HCl tertinggi yaitu 3 M, waktu yang dibutuhkan pita magnesium untuk bereaksi dengan HCl berlangsung sangat cepat, dibandingkan dengan HCl 0,5 M yang membutuhkan waktu sangat lama yaitu 3600 detik atau berkisar 1 jam waktu yang dibutuhkan pita magnesium untuk bereaksi dengan HCl. Dengan menambahkan konsentrasi zat suatu reaksi, jumlah partikel zat bertambah banyak, semakin banyaknya jumlah partikel zat maka tumbykan efektif yang menghasilkan perubahan akan semakin cepat terjadi dan reaksi akan berlangsung lebih cepat. (Purwanti,2013). 3600 1500 120 25 0 2000 4000 0.5 1 2 3 Waktu ( S) Konsentrasi (M)
Pengaruh Konsentrasi
Pengaruh KonsentrasiDari data ini dapat dinyatakan bahwa penambahan konsentrasi suatu zat dapat mempercepat terjadinya reaksi.
Pengaruh Suhu
Pengamatan pengaruh suhu terhadap laju reaksi menghasilkan persamaan reaksi sebagai berikut :
Na2S2O3(aq) + HCl(aq) NaCl(aq) + H2O(aq) + SO2(g) + S(s)
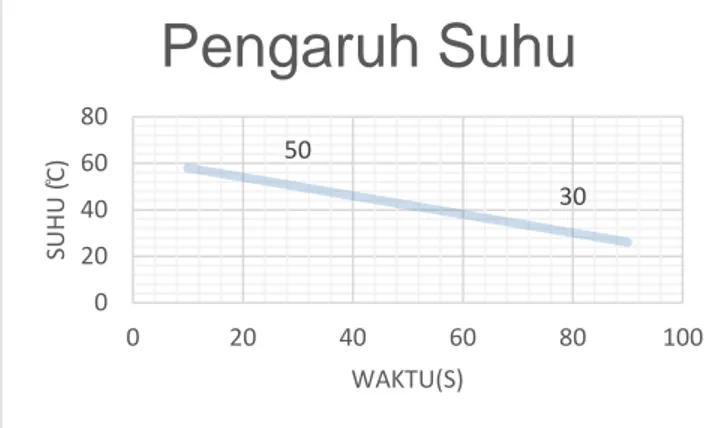
Meningkatnya suhu pada sistem atau lingkungan dapat mempercepat terjadinya reaksi kimia, hal ini ditunjukan pada grafik berikut :
Gambar 1.2 Hasil Pengamatn Pengaruh Suhu Terhadap Laju Reaksi
Sebagian besar reaksi kimia akan berlangsung cepat pada suhu yang tinggi. Hal ini terjadi karena molekul yang berenergi lebih tinggi terdapat pada suhu yang lebih tinggi, maka laju pembentukan
produk juga lebih besar pada suhu yang tinggi.(Chang,2005:45)
Dari data percobaan yang ditunjukan pada grafik 1.2 dapat dilihat pengaruh suhu terhadap berlangsungnya suatu reaksi. Pada dua suhu yang berbeda distribusi kecepatan reaksinya lebih cepat terjadi pada suhu yang tinggi. Hasil percobaan meunjukan bahwa kenaikan suhu dapat mempercepat laju reaksi.
Pengaruh Luas Permukaan
Dari pengamatan batu pualam berbentuk bongkahan dan serbuk yang dieteskan HCl kedalamnya, didapatkan hasil pengamatan yang menunjukan pada pengaruh luas permukaan pada proses berlangsungnya reaksi kimia, persamaan reaksinya sebagai berikut :
2HCl(aq) + CaCO3(s) CaCl2(aq) + CO2(g) + H2O(l)
Dari percobaan, dihasilkan data sebagai berikut :
CaCO3(s) HCl(aq) Waktu (s) Serbuk Bongkahan 0,1 M, 5 ml 0,1 M, 5 ml 36 786 50 30 0 20 40 60 80 0 20 40 60 80 100 SUHU ( ̊ C) WAKTU(S)
Pengaruh Suhu
Tabel 1.1 Hasil Pengamatan Pengaruh Luas Permukaan Terhadap
Laju Reaksi
Teori tumbukan kinetik menjelaskan bahwa laju reaksi akan berbanding lurus dengan banyaknya tumbukan molekul perdetik, atau berbanding lurus dengan frekuensi tumbukan molekul.(Chang,2005:43)
Semakin batu pualam dihaluskan, semakin luas bidang sentuhnya. Sehingga mengakibatkan tumbukan molekul akan lebih sering terjadi. Hal inilah yang menyebabkan batu pualam dalam bentuk serbuk dapat lebih cepat bereaksi dengan HCl.
Pengaruh Katalis
Penambahan zat lain yang disebut katalis dalam percobaan menyebabkan reaksi berlangsung lebih cepat, persamaan reaksi pada percobaan adalah sebagai berikut : H2O2(l) 2H2O(l) + O2(g)
H2O2(l) 2H2O(l) + O2(g)
H2O2(l) 2H2O(l) + O2(g)
Hasil Pengamatan ada tidaknya gelembung yang dihasilkan di dalam tabung reaksi sebagai berikut :
No Reaksi Hasil Pengamatan 1 2 3 H2O2 H2O2 + NaCl H2O2 + FeCl3
Tidak ada gelembung
Terdapat sedikit gelembung
Terdapat banyak gelembung
Tabel 1.2 Hasil Pengamatan Pengaruh katalis Terhadap Laju Reaksi
Pada pengamatan pengaruh penambahan katalis pada reaksi, didapatkan data seperti pada tabel 1.2. Dimana data menunjukan bahwa, reaksi terurainya lebih cepat menghasilkan gas oksigen ketika ditambahkan FeCl3. Cepatnya reaksi berlangsung ditunjukan dengan adanya gelembung udara didalam tabung reaksi. Tabung 1, dimana peroksida dibiarkan terurai tanpa ditambahi zat apapun berlangsung dalam jangka waktu yang cukup lama dan tidak menghasilkan gelembung. Pada tabung ke-2 ada sedikit gelembung namun waktunya lebih lama dari tabung 3 yang ditambahi FeCl3 dan menghasilkan banyak gelembung.
Katalis merupakan zat yang mengambil peran dalam reaksi kimia dan NaCl(aq)
mempercepatnya, tetapi ia sendiri tidak ikut bereaksi. (Oxtoby,2001:439)
Dari hasil percobaan, FeCl3 merupakan katalis yang mempercepat terurainya H2O2 menjadi H2O dan O2.
IV. CONCLUSSION
Dari uraian teori dan hasil percobaan berbagai pengaruh atau faktor yang mempengaruhi berlangsungnya suatu reaksi kimia, dapat disimpulkan bahwa :
1. Perbedaan laju reaksi disebabkan oleh beberapa faktor, seperti Konsentrasi, suhu, luas permukaan bidang sentuh, dan katalis.
2. Semakin besar konsentrasi, semakin besar kemungkinan terjadinya tumbukan antar partikel sehingga reaksi berlangsung lebih cepat.
3. Luas permukaan bidang sentuh dapat mempercepat laju reaksi. Dengan semakin luasnya bidang sentuh kemungkinan terjadinya tumbukan efektif akan semakin besar sehingga laju reaksi semakin meningkat.
4. Apabila suhu reaksi dinaikan, maka energi kinetik partikel akan bertambah. Hal ini menyebabkan jumlah tumbukan bertambah dan reaksi berlangsung semakin cepat.
5. Katalis dapat mempercepat terjadinya suatu reaksi tanpa menimbulkan produk baru, katalis ditambahkan untuk mempercepat reaksi tanpa ikut mengalami perubahan secara kimiawi diakhir reaksi.
V. REFERENCES LIST
Atjins,P.W.Kimia Fisika edisi keempat.Jakarta:Erlangga.1999
Chang,R.Kimia Dasar jilid 2 edisi ketiga.Jakarta:Erlangga.2004
Oxtoby, David .w. Prinsip-prinsip Kimia
modern jilid 2 edisi
keempat.Jakarta:Erlangga.2001
PurwantiWidhyHastuti.LajuReaksi.http://staf f.uny.ac.id/sites/default/files/pendidika n/purwantiwdhyhastuti,S.Pd,M.Pd/Laj uReaksi(2).pdf. Diakses Pada tanggal 22 Maret 2014 pukul 15.30 WIB.