KESETIMBANGAN LARUTAN IODIN
A. Tujuan
1. Menentukan konstanta kesetimbangan distribusi iodin diantara dua pelarut.
2. Menentukan konstanta kesetimbangan konsentrasi iodin, ion iodida, dan ion triodida
B. Dasar Teori
1.Konstanta Kesetimbangan Distribusi (Kd)
Kesetimbangan kimia merupakan proses dinamik. Kesetimbangan kimia melibatkan zat-zat yang berbeda untuk reaktan dan produknya. Kesetimbangan antara dua fasa dari zat yang sama dinamakan kesetimbangan fisis (physical equilibrium) karena perubahan yang terjadi hanyalah proses fisis (Chang, 2004:66).
Bila suatu zat terlarut membagi diri antara dua cairan yang tak dapat campur, ada suatu hubungan yang pasti antara konsentrasi zat pelarut dalam kedua fase pada kesetimbangan. Nerts pertama kalinya memberikan pernyataan yang jelas mengenai hukum distribusi pada tahun 1981ia menunjukkan bahwa suatu zat terlarut akan membagi dirinya antara dua cairan yang tak dapat campur sehingga angka banding konsentrasi pada kesetimbangan adalah pada suatu temperatur tertentu (Day & Underwood, 1999: 461).
Menurut Hukum Distribusi Nernst
Jika [X1] adalah konsentrasi zat terlarut dalam fase l dan [X2] adalah konsentrasi zat terlarut
dalam fase 2,maka pada kesetimbangan, X1,X2 didapat: Kd= [X1]/ [X2]
Dimana Kd (koefisien distribusi/partisi). Partisi atau distribusi ini tidak tergantung pada konsentrasi total zat terlarut pada kedua fasa tersebut.Pada persamaan tersebut kita tidak menuliskan koefisien aktivasi zat pada fase organik maupun fase air (Khopkar,2010: 90-91).
2. Konstanta Kesetimbangan Konsetrasi (Kc)
Konstanta kesetimbangan yang dinyatakan dengan term konsentrasi Kc dapat mempunyai harga yang sangat besar atau juga sangat kecil. Bila konstanta kesetimbangan (Kc ) kecil (Kc<1), berarti bahwa dalam keadaan kesetimbangan konsentrasi dalam produk adalah kecil ,sehingga konstanta kesetimbangan yang kecil menunujukkan reaksi bolak-balik tidak berlangsung dengan baik.
Misalnya jika reaksi :
A(g) + B(g) ↔ C(g) + D(g)
Dengan Kc = 10-5 berarti bahwa campuran A dan B tidak banyak menghasilkan C dan D pada kesetimbangan. Bila konstanta kesetimbangan besar (Kc > 1) berarti bahwa konsentrasi reaktan yang tinggal pada kesetimbangan adalah kecil, sehingga harga konstanta kesetimbangan yang besar menunjukkan bahwa reaksi berlangsung ke kanan dengan baik. Misalnya untuk reaksi :
E(g) + F(g) ↔ G(g) + H(g)
Dengan harga Kc = 105 berarti campuran E dan F akan berubah hampir sempurna menjadi G dan H. Harga konstanta kesetimbangan dapat ditentukan berdasarkan data eksperimen (www.chem-is-try.org).
3. Ekstraksi
Ekstraksi pelarut atau disebut juga ekstraksi air merupakan metode pemisahan yang paling baik dan populer. Hal tersebut karena pemisahan ini dapat dilakukan baik dalam tingkat makro ataupun mikro. Prinsip metode ini didasarkan pada disrtibusi zat terlarut dengan perbandingan tertentu antara dua pelarut yang tidak saling bercampur, seperti benzen, karbon tetraklorida atau kloroform. Batasannya adalah zat terlarut dapat ditransfer pada jumlah yang berbeda dalam kedua fase pelarut (Khopkar,2010: 90).
4. Iodin
Iodin hanya larut sedikit dalam air ( 0,00134 mol / liter pada suhu 25 C ). Namun larut cukup banyak dalam larutan – larutan yang mengandung ion iodida. Iodin membentuk kompleks triodida, dengan konstanta kesetimbangan sekitar 710 pada 25 C. Suatu kelebihan kalium iodida ditambahkan untuk meningkatkan kelarutan dan untuk menurunkan kestabilan iodin. Biasanya sekitar 3 sampai 4 % berat KI ditambahkan kedalam larutan 0,1 N, dan botol yang mengandung larutan ini adalah larutan ini di sumbat dengan baik ( Day & Underwood, 1999 :298 ).
Ion triodida adalah salah satu spesies yang tergolong dalam ion polihalida, dihasilkan melalui reaksi ion halide dengan halogen atau molekul antar halogen. Dalam reaksi ini, ion halide bertindak sebagai basa lewis ( pemberi pasangan electron ) dan molekul sebai asam lewis ( penerima pasangan electron ). Larutan ion dalam KI, yaitu ion triodida, banyak
digunakan dalam kimia analitik. Dapat diambil sebuah contoh adalah struktur dari Ion triodida dimana pasangan electron ikatan digambarkan sebagai garis hitam. Pasangan electron bebas dari atom I pusat digambarkan dengan titik- titik ( Petrucci,1985 : 60 ).
Larutan – larutan iodin standar dapat dibuat melalui penimbangan langsung iodin murni dan mengencerkan dalam sebuah labu volumetryk. Iodiun yang akan dimurnikan oleh sublimasi dan ditambahkan kedalam sebuah larutan KI yang konsentrasinya ditimbang secara akurat sebelum dan sesudah penambahan iod. Namun demikian, biasanya larutan tersebut distandarisasi terhadap sebuah standar primer yang paling sedikit digunakan.Dan kekuatan reduksinya tergantung pada PH yang digunakan ( Day & Underwood, 1999: 296 – 297 ).
Salah satu fakta yang penting tetntang reaksi kimia reversibel (dapat-balik). Bilamana suatu reaksi kimia dimulai, hasil-hasil reaksi mulai menimbun, dan seterusnya akan bereaksi satu sama lain memualai suatu reaksi yang kebalikannya. Setelah beberapa lama, terjadilah kesetimbangan dinamis, yaitu jumlah molekul (atau ion) dan setiap zat terurai, sama banyaknya dengan jumlah molekul yang terbentuk dalam suatu satuan waktu. Dalam beberapa hal, kesetimbangan ini terletak sama sekali berada di pihak pembentukan suatu atau beberapa zat, maka reaksi itu tampak seakan-akan berlangsung sampai selesai (Svehla, 1990 : 21).
Iod jauh lebih dapat larut dalam larutan kalium iodida dalam air daripada dalam air; ini disebabkan oleh terbentuknya ion triiodida, I3-. Kesetimbangan berikut berlangsung dalam
suatu larutan seperti ini :
I2+I-—>I3-
Jika larutan itu dititrasidengan larutan natrium tiosulfat, konsentrasi iod total, sebagai I2 bebas
dan I3- tak bebas, diperoleh, karena segera sesudah iod dihilangkan akibat interaksi dengan
triosulfat, sejumlah iod baru dibebaskan dari tri-iodida agar kesetimbangan tidak terganggu. Namun jika larutan dikocok dengan karbon tetra klorida, dalam mana iod saja yang dapat larut cukup banyak, maka iod bebas dalam larutan air. Dengan menentukan konsentrasi iod dalam larutan karbon tetraklorida, konsentrasi ion iod bebas dalam larutan air dapat dihitung dengan menggunakan koefisien distribusi yang diketahui, dan dari situ konsentrasi total iod bebas yang ada dalam kesetimbangan. Dengan memperkurangkan harga ini dari konsentrasi
awal kalium iodida, dapatlah disimpulkan konsentrasi KI bebas. Tetapan Kesetimbangan :
K= ([I-] x [I2])/([I3-]) (Svehla, 1986 : 142).
Jika larutan iodium di dalam KI pada suasana netral maupun asam dititrasi maka: I3- + 2S2O32- --->3I- + S4O6
2-Selama zat antara S2O3I- yang tidak berwarna adalah terbentuk sebagai:
S2O32- + I3- ---> S2O3I- + 2I
Yang mana berjalan terus menjadi:
2S2O3I- + I- ---> S4O62- + I3
Warna indikator muncul kembali pada
S2O3I- + S2O32- ---> S4O62- + I
-Reaksi berlangsung baik di bawah PH = 5,0, sedangkan pada larutan alkali, larutan asam hypoiodos (HOI) terbentuk (Khopkar,2010:54).
5. Indikator Amilum
Kanji atau pati disebut juga amilum yang terbagi menjadi dua yaitu: Amilosa (1,4) atau disebut b-Amilosa dan amilopektin (1,4) ; (1,6) disebut a-Amilosa. Indikator kanji yang dipakai adalan amilosa, karena jika dipaki amilopektin, maka akan membentuk kompleks kemerah-merahan (violet) dengan iodium, yang sulit dihilangkan warnanya. Hal ini dikarenakan rangkaiannya yang panjang dan bercabang dengan Mr = 50.000-1.000.000 (www.chem-is-try.com).
Warna larutan iod 0,1 N cukup tua sehingga iod dapat bertindak sebagai indikatornya sendiri. Iod juga memberikan suatu warna ungu atau lembayung kepada pelarut seperti karbon tetraklorida atau kloroform, dan kadang-kadang ini digunakan dalam mendeteksi itik akhir titrasi. Tetapi, lebih lazim digunakan suatu larutan (dispersi koloid) kanji atau amilum, karena warna biru tua kompleks pati-iod berperan sebagai uji kepekaan terhadap iod. Kepekaan tu lebih besar dalam larutan sedikit sekali asam daripada dalam larutan netral dan lebih besar dengan adanya ion iodida ( Day & Underwood, 1999: 302)
C.Alat dan Bahan
Alat-alat yang digunakan dalam percobaan ini adalah erlenmeyer 250 mL,erlenmeyer 125mL, gelas arloji besar, pipet volume 25 mL, bola hisap, spatula, magnetic stirrer, corong
pisah kecil, buret 50 mL, buret 10 mL, statif, klem, o-ring, corong pisah 25 mL, labu ukur 30 mL, gelas piala 100 mL, botol akuades, alumunium foil, pipet volume 10 mL, dan pipet ukur 25 mL.
Bahan yang digunakan dalam percoban ini yaitu kloroform, I2 ,amilum, Na2S2O3,dan
akuades.
D.Cara Kerja
Dalam percobaan ini terdapat dua langkah kerja. Pertama yaitu penentuan konstanta kesetimbangan distribusi (Kd). Kedua yaitu penentuan konstanta kesetimbangan konsentrasi (Kc) larutan iodin.
1.Penentuan konstanta kesetimbangan distribusi (Kd)
Langka pertama dalam penentuan konstanta kesetimbnagn distribusi yaitu 25 mL kloroform dimasukkan dalam Erlenmeyer 250 mL. Kemudian ke dalam erlenmeyer tersebut dimasukkan masing-masing 0,5; 0,75; dan1 gram Kristal I2. Larutan kemudian diaduk
menggunakan magnetic stirrer hingga larutan homogen, lalu dipindahkan kedalam corong pisah 250 mL. Selanjutkan ditambahkan 25 mL akuades dalam corong pisah,dikocok, lalu didiamkan beberapa menit hingga terbentuk dua lapisan yang terpisah. Kemudian kedua lapisan tersebut dipisahkan. Setelah kedua larutan tersebut dipisahkan, kemudian larutan masing-masing diambil 10 mL dan dimasukkan ke dalam erlenmeyer. Kemudian ditambahkan indikator amilum 5 tetes ke dalam masing-masing larutan, lalu dititrasi dengan Na2S2O3 0,1M.
2.Penentuan konstanta kesetimbangan konsentrasi (Kc) larutan iodin.
Langkah dalam penentuan konstanta kesetimbnagan konsentrasi larutan iodin yaitu dilarutkan sebanyak 1 gram kristal I2 ke dalam 25 mL kloroform didalam gelas beker,
kemudian dipindahkan ke dalam labu ukur 50 mL untuk selanjutnya ditambahkan larutan KI 0,1M sampai batas tanda. Kemudian larutan tersebut dipindahkan kedalam corong pisah 250 mL, dikocok, lalu didiamkan beberapa menit hingga tampak dua lapisan yang terpisah. Setelah kedua larutan tersebut dipisahkan, kemudian larutan masing-masing diambil 10 mL pada lapisan bawah dan dimasukkan ke dalam erlenmeyer dan ditambahkan indikator amilum 5 tetes selanjutnya dititrasi dengan Na2 S2 O3 0,1 M.
E. Data Pengamatan
1. Konstanta kesetimbangan distribusi (Kd) Iodin
No Massa I2 (gram)
Lapisan Kloroform Lapisan Air
Volume Na2S2O3 0,1 M (mL) [I2]kloroform (Mol) Volume Na2S2O3 0,1 M (mL) [I2]kloroform (Mol) 1 0.5 19.21 9.605 x 10-4 0.20 1.0 x 10-5 2 0.75 25.50 1.275 x 10-3 0.20 1.0 x 10-5 3 1.0 37.50 1.875 x 10-3 0.30 1.5 x 10-5
2. Penentuan konstanta kesetimbangan konsentrasi (Kc)larutan iodin
No Massa Kristal I2 (gram) Lapisan Kloroform [I2]air (mol) [I2]total (mol) Volume (mL) Na2S2O3 [I2] CHCl3 (mol) 1 27 3,375 × 10-3 1,965 x 10-5 3,94 × 10-3 3. Grafik
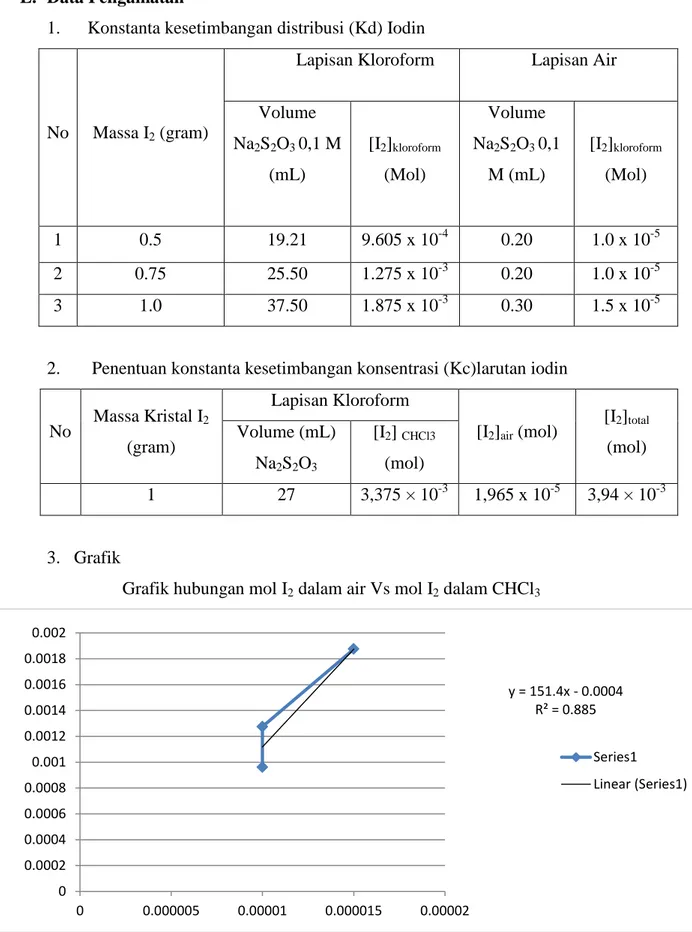
Grafik hubungan mol I2 dalam air Vs mol I2 dalam CHCl3
y = 151.4x - 0.0004 R² = 0.885 0 0.0002 0.0004 0.0006 0.0008 0.001 0.0012 0.0014 0.0016 0.0018 0.002 0 0.000005 0.00001 0.000015 0.00002 Series1 Linear (Series1)
E. Pembahasan
Percobaan ini berjudul kesetimbangan larutan iodin. Adapun tujuan dari percobaan ini yaitu untuk menentukan konstanta kesetimbangan distribusi iodin diantara dua pelarut dan menentukan konstanta iodin, ion iodida dan ion triodida. Prinsip kerja dari percobaan ini yaitu penentuan konstanta kesetimbangan distribusi iodin diantara dua pelarut dan penentuan konstanta kesetimbangan konsentrasi ion iodin ,ion idida dan ion triodida dengan variasi massa iodin yang dititrasi dengan natrium tiosulfat. Sehingga dari hasil titrasi diperoleh volume Na2S2O3 yang berbeda, dimana volume tersebut digunakan untuk mencari mol iodin
dalam air dan kloroform. Selanjutnya dibuat grafik antara I2 kloroform Vs I2 air. Dari grafik
tersebut maka dapat diperoleh konstanta kesetimbangan distribusi (Kd) dan konstanta kesetimbangan konsentrasi (Kc) dari iodin.
Langkah awal dari percobaabn ini yaitu kristal iodin dengan berbagai variasi massanya 0,5gr ,0,75gr ,1gr direaksikan dengan kloroform.Larutan tersebut diaduk dengan magnetik stirer supaya semua kristal iodin larut semua sehingga larutan homogen.Selanjutnya larutan dipindahkan kedalam corong pisah lalu ditambahkan dengan akuades ,kemudian diekstraksi. Pada saat larutan diekstraksi, sekali-kali mulut corong dibuka yang bertujuan untuk mengurangi tekanan dalam corong, selain itu juga untuk mengeluarkan gas yang dihasilkan oleh larutan. Gas tersebut adalah gas Cl2.Penambahan akuades ini bertujuan agar I2
terdistribusi diantara dua pelarut yaitu air dan kloroform.Sedangkan pengocokan bertujuan untuk mempercepat terjadinya proses distribusi dalam lapisan air dan kloroform.Setelah itu didiamkan sampai terbentuknya dua lapisan,yaitu lapisan atas adalah lapisan iod dalam air dan lapisan bawah adalah lapisan iod dalam kloroform.Terbentuknya dua lapisan ini dikarenakan adanya perbedaan sifat kepolaran antara kedua pelarut yang digunakan.Air bersifat polar dan kloroform bersifat nonpolar.Air berada pada lapisan atas,hal ini dikarenakan massa jenis air lebih kecil dibandingkan massa jenis kloroform. Massa jenis air adalah 1 g/ml sedangkan kloroform massa jenisnya adalah 1,49 g/ml.Lapisan atas yaitu iod dan kloroform pun dipisahkan. Reaksi jika iodin dilarutkan dalam air adalah :
I2 + I- —> I3-
Lapisan atas berwarna kuning tua menunjukkan iod telah terdistribusi kedalam
pelarut air. Hal tersebut disebebkan iod tersebut akan membentuk reaksi
kesetimbangan.Lapisan tersebut diambil 10 mL lalu ditambah indikator amilum sebanyak 5 tetes,warna biru dari kompleks iodin-amilum, bertindak sebagai suatu tes yang sangat sensitive untuk iodin.Selain itu juga supaya waktu titrasi saat mencapai titik ekuivalen dapat
diketahui perubahannya. Lapisan iodin dalam kloroform berwarna ungu dan lapisan iodin dalam air berwarna kuning tua. Hal ini menandakan bahwa iodin telah terdistribusi dalam pelarut kloroform maupun dalam air, ini disebabkan karena iodin telah membentuk suatu kesetimbangan. Setelah itu dilakukan titrasi dengan larutan natrium tiosulfat (Na2S2O3).
Penitrasian dihentikan apabila larutan kloroform maupun air sudah mencapai titik ekuivalen atau warna larutan berubah menjadi bening. Berikut reaksi antara iodin dengan natrium tiosulfat:
I2 + 2S2O32- 2I- + S4O62-
Dari tabel hasil pengamatan terlihat bahwa jumlah larutan iodin dalam kloroform lebih banyak daripada jumlah larutan iodin dalam air. Hal ini disebabkan iodin sukar larut dalam air dan mudah larut dalam pelarut non polar seperti kloroform.
Volume Na2S2O3 0,1 pada lapisan kloroform yang didapat setelah titrasi pada 0,5;
0,75;dan 1gram Kristal I2 berturut-turutyaitu 19,20 mL; 25,50 mL; dan 37,50 mL. Sedangkan
pada lapisan air yaitu 0,20 mL, 0,20 mL,dan 0,30 mL. Dari hasil titrasi larutan iodin dengan variasi massa, volumenya digunakan untuk mencari mol iodin dalam air dan mol iodin dalam kloroform. Sehingga dapat dibuat grafik mol iodin (I2) dalam kloroform Vs mol iodin (I2)
dalam air. Dari grafik diperoleh persamaan garis y = 151,4x + 0,0004 . Jadi dapat diperoleh harga konstanta kesetimbangan distribusi (Kd) iodin sebesar 151,4.
. Tahap kedua yaitu penentuan konstanta keseimbangan konsentrasi (Kc) iodin, ion iodida dan ion triodida dengan cara mengekstraksi larutan kloroform yang telah ditambah kristal iodin dengan penambahan larutan KI sampai tanda batas. Penambahan larutan KI berfungsi sebagai penyedia ion iodida I- yang kemudian akan bereaksi dengan I2 membentuk
ion triiodida, karean I2 akan larut dan terdistribusi dengan baik dalam larutan yang
mengandung I- dan membentuk I3-. Pencampuran kedua larutan tersebut dilakukan pada
corong pisah, selanjutnya kedua larutan dikocok untuk membantu proses pendistribusian iodin dalam kedua pelarut. Kemudian corong pisah didiamkan sampai terbentuk dua lapisan , lapisan atas berupa lautan iodin dalam air yang berwarna kuning tua dan lapisan bawah berupa larutan iodin dalam kloroform yang berwarna ungu. Reaksi yang terjadi adalah sebagai berikut:
I2(CHCl3) + I2(H2O) + I- ---> I3-
Selanjutnya kedua lapisan tersebut dipisahkan dan diambil masing-masing 10 mL untuk dititrasi dengan larutan natrium tiosulfat (Na2S2O3) dan sebelum dititrasi ditambahkan
bereaksi dan reaksinya adalah reaksi balik dan juga indikator ni berfungsi untuk mengikat I2
yang lepas dari ikatannya denga air ataupun CHCL3. Adapun reaksi yang terjadi adalah
I2 + 2S2O32- 2I- + S4O62-
Berdasarkan percobaan volume kloroform dari hasil ekstraksi yaitu 25 mL dan volume KI yaitu sebesar 25 mL juga. Volume titrasi yang dihasilkan yaitu 27 mL .
Dari hasil titrasi larutan iodin diberbagai massa, volumenya digunakan untuk mencari mol iodin dalam air dan mol iodin dalam kloroform. Sehingga dapat dibuat grafik mol iodin (I2)
dalam kloroform Vs mol iodin (I2) dalam air. Dari grafik diperoleh persamaan garis y =
151,4x + 0,0004 . Jadi dapat diperoleh harga konstanta kesetimbangan distribusi (Kd) iodin sebesar 151,4..Sedangkan dari perhitungan konsentrasi mol I2 total, mol I2(CHCl3) dan mol
I2(H2O) didapatkan nilai Kc iodin, ion iodida dan ion triodida sebesar 176,89. Hal ini berarti
bahwa konsentrasi reaktan yang tinggal pada kesetimbangan adalah kecil, sehingga harga konstanta kesetimbangan yang besar menunjukkan bahwa reaksi berlangsung ke kanan dengan baik.
F. Kesimpulan
Berdasarkan percobaan yang telah dilakukan, maka dapat disimpulkan bahwa: 1) Nilai konstanta kesetimbangan distribusi (Kd) iodin adalah sebesar 151,4
2) Nilai konstanta kesetimbangan konsentrasi (Kc) iodin, ion iodida dan ion triodida adalah sebesar 176,89.
Day, R.A dan
G. Daftar Pustaka
Chang, Raymond. 2004. Kimia Dasar Konsep-Konsep Inti. Eidsi Ketiga. Jilid 2. Jakarta: Erlangga.
Khopkar, S.M.2010 Konsep Dasar Kimia Analitik. Jakarta : Universitas Indonesia (UI-Press).
Svehla,Vogel . 1986. Buku Teks Analisis Anorganik Kualitatif Mikro dan Semimikro Edisi ke-5. Jakarta : PT Kalam Media Pustaka.
Underwood dan Day, R.A .1990. Analisis Kimia Kuantitatif Edisi Kelima. Jakarta:Erlangga. http://www.chem-is-try.org/materi_kimia/instrumen_analisis/iodometri/indikator/diakses pada tanggal 8 desember 2013 pukul 12.35 WIB.
http://www.chem-is-try.org/materi_kimia/kimia-smk/kelas_x/karakteristik-macam-macam-sistem-dan-konstanta-kesetimbangan/diakses pada tanggl 8 Desember 2013 pukul 13.00 WIB. LAMPIRAN Perhitungan Diketahui. 1. I2 + 2Na2S2O3 Na2S2O3 + 2 NaI Mol I2 kloroform (CHCl3)1 = ½ VS2O32- x M S2O3 2-= ½ 19.21 mL x 0.1 M = 0.9605 mmol
= 9.605 x 10-4 mol Mol I2 kloroform (CHCl3)2 = ½ VS2O32- x M S2O3 = ½ 25.50 mL x 0.1 M = 1.275 mmol = 1.275 x 10-3 mol Mol I2 kloroform (CHCl3)3 = ½ VS2O32- x M S2O3 = ½ 37.50 mL x 0.1 M = 1.875 mmol = 1.875 x 10-3 mol Mol I2 air (H2O) = ½ VS2O32- x M S2O3 = ½ 0.2 mL x 0.1 M = 0.1 mL x 0.1 M = 0.01 mmol = 1.0 x 10-5 mol
Mol I2 air (H2O) = ½ VS2O32- x M S2O3
= ½ 0.2 mL x 0.1 M = 0.1 mL x 0.1 M = 0.01 mmol = 1.0 x 10-5 mol Mol I2 air (H2O) = ½ VS2O32- x M S2O3 = ½ 0.3 mL x 0.1 M = 0.15 mL x 0.1 M = 0.015 mmol = 1.5 x 10-5 mol 2. I2CH3Cl3 I2H2O+I- I3
-Mol I2 CHCl3 = ½ × V S2O3 (kloroform awal/kloroform titrasi) x M S2O3
= ½ × 27 ( 25 mL/10 mL) × 0.1 M = 13.5 × 2.5 × 0.1 M = 3,375 mmol = 3,375 × 10-3 mol Mol I2H2O =
= 1,965 x 10-5 mol
Mol I3- = mol I2 total-(mol I2CHCl3+mol I2H2O)
= 0,00394-(3,375 × 10-3+ 1,965 x 10-5) = 0,00394 – 3.395x 10-3
= 5,45 x 10-4 mol Mol I2 total KI = 25mL × 0,1 M
= 2,5 ×10-3 mol
Mol I- = mol I- total KI-mol I
3-= 2,5 ×10-3 – 5,45 × 10-4 = 0,001955mol Kc = [ ] = = 176, 89