3.1 Waktu dan Lokasi Penelitian
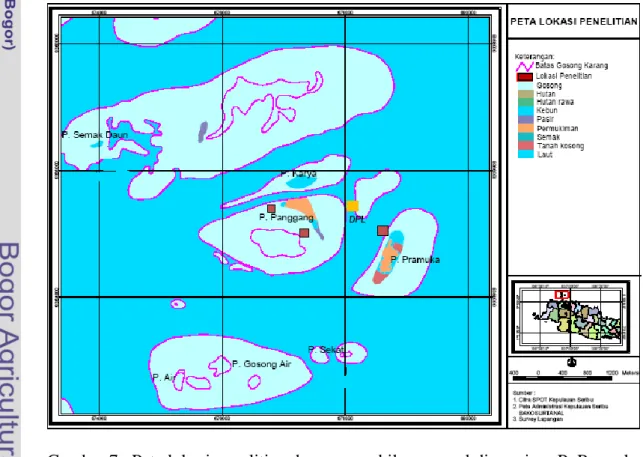
Penelitian ini dilaksanakan selama lima bulan, yaitu pada awal Bulan Mei sampai dengan awal Bulan Oktober 2009. Sampel karang Goniopora spp. diambil di perairan P. Pramuka bagian utara, P. Panggang bagian barat dan selatan Kabupaten Kepulauan Seribu, DKI Jakarta (Gambar 7) yang termasuk dalam zona pemukiman, masing-masing pada tubir di kedalaman tiga sampai enam meter. Dasar Pemilihan lokasi ini adalah di sekitar perairan tersebut sudah banyak dilakukan kegiatan transplantasi karang dan juga ada perkebunan karang serta masih banyak dijumpai karang masif genus Goniopora (Lampiran 8 dan 9). Analisa karakteristik genetika karang dilakukan di Laboratorium Biologi Molekuler, Pusat Penelitian Sumberdaya Hayati dan Bioteknologi (PPSHB), LPPM, Institut Pertanian Bogor (IPB). Sedangkan sampel karang hidup dipelihara di Laboratorium Biologi Laut Fakultas Perikanan dan Kelautan IPB.
Gambar 7 Peta lokasi penelitian dan pengambilan sampel di perairan P. Pramuka bagian utara dan P. Panggang bagian barat dan selatan.
3.2 Tahapan Penelitian
Tahapan penelitian yang dilakukan yaitu :
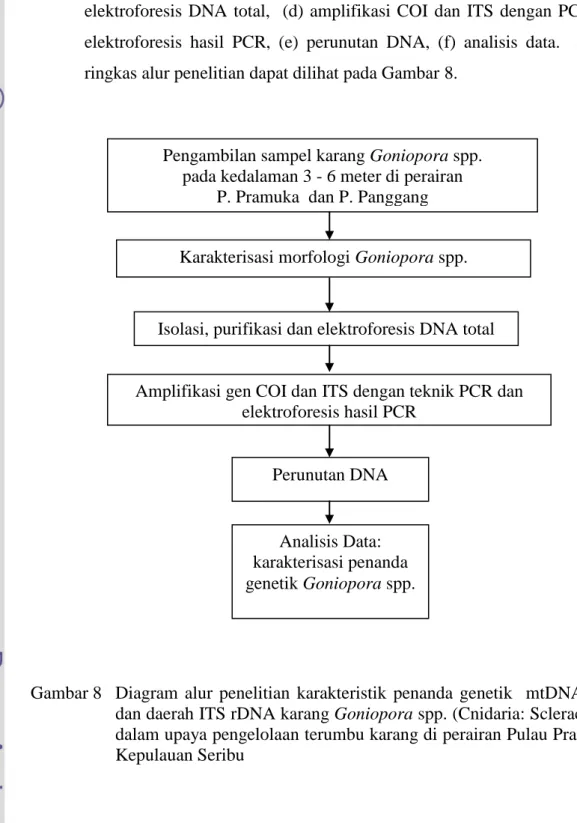
(a) Pengambilan sampel, (b) karakterisasi morfologi, (c) isolasi, purifikasi dan elektroforesis DNA total, (d) amplifikasi COI dan ITS dengan PCR dan elektroforesis hasil PCR, (e) perunutan DNA, (f) analisis data. Secara ringkas alur penelitian dapat dilihat pada Gambar 8.
Gambar 8 Diagram alur penelitian karakteristik penanda genetik mtDNA COI dan daerah ITS rDNA karang Goniopora spp. (Cnidaria: Scleractinia) dalam upaya pengelolaan terumbu karang di perairan Pulau Pramuka, Kepulauan Seribu
Pengambilan sampel karang Goniopora spp. pada kedalaman 3 - 6 meter di perairan
P. Pramuka dan P. Panggang
Karakterisasi morfologi Goniopora spp.
Isolasi, purifikasi dan elektroforesis DNA total
Amplifikasi gen COI dan ITS dengan teknik PCR dan elektroforesis hasil PCR
Perunutan DNA
Analisis Data: karakterisasi penanda genetik Goniopora spp.
3.3 Alat dan Bahan Penelitian a. Alat Penelitian
b. Bahan Penelitian
No Bahan Uraian
1. Analisa morfologi Bayclin (bahan pemutih), akuades steril, etanol 70%
A. Isolasi dan Purifikasi DNA
1. Digestion Buffer CTAB (hexadesiltrimetil ammonium bromida) 2%, NaCl 1.4 M, EDTA 20 mM, 100mM Tris-HCl pH 8,0, 2-mercaptoetanol 0,2%, proteinase K, RNAse A
2. Fenol Disimpan pada suhu 4 oC dalam botol gelap 3. Kloroform : Isoamil alcohol
(CIAA 24:1)
Disimpan pada suhu kamar dalam botol gelap
4. Etanol absolute atau isopropanol Disimpan pada -20 oC 5. Alkohol 70% Disimpan pada -20 oC
No Uraian Alat
A. Pengambilan Sampel
1. Pengambilan sampel karang untuk analisis morfologi dan DNA
Gunting yang tajam dan bersih, pahat, kantong plastik klip yang telah diberi yang telah diberi kode tahan air, kontainer, kotak
styrofoam. 2. Penyimpanan sampel untuk
analisis morfologi dan DNA
Analisis morfologi
Botol sampel berisi larutan air laut
mengandung formalin 10%, akuades, etanol 70%.
Analisis DNA
Kontainer berisi air laut, Termos berisi N2
cair ( -20 oC ) atau botol sampel berisi larutan alkohol absolute : gliserol (4:1) 3. Analisa morfologi Scalpel steril, penggaris, jangka sorong,
kamera digital, kaca pembesar B. Isolasi, Purifikasi dan Amplikasi DNA
1. Isolasi dan Purifikasi DNA Ependorf 1.5 ml, mortar, rak ependorf, sentrifuse, vortex, pipetor berbagai ukuran volume, tip pipet, waterbath, rak ependorf, spektrofotometer
2. Amplifikasi DNA Mesin Thermal Cycler, microtube 0.2 ml, rak ependorf, pipetor berbagai ukuran volume, tip pipet, sentrifuse.
C. Elektroforesis dan Perunutan DNA
1. Elektroforesis Mesin elektroforesis horizontal, sisir dan cetakan agarosa, gelas ukur, timbangan analitis, hot plate, strirer, UV
transluminator, pipetor, tip pipet 2. Perunutan DNA Kolom GFX, mesin perunutan DNA
6. TE buffer 1 mM EDTA ph 8, 10 mM Tris HCl pH 8 7. Akuabides steril Disimpan pada suhu ruang
B. Amplifikasi DNA dengan PCR
1. PCR kit Disimpan pada -20 oC
2. Primer Disimpan pada -20 oC
3. ddH2O steril atau free nuclease
water
Disimpan pada suhu ruang C. Pembuatan Gel Agarosa dan Buffer
1. 1x TAE bufer Tris base, asam asetat glasial, 0.5M EDTA pH 8
2. Etidium bromide (EtBr) 10 mg EtBr dilarutkan dalam volume 10 ml
3. Agarosa Disimpan pada suhu kamar
4. Loading dye Disimpan pada -20 oC
5. DNA ladder Disimpan pada -20 oC
6. Akuades steril Disimpan pada suhu ruang D. Perunutan DNA
1. Kit Purifikasi Disimpan pada -20 oC 2. Kit perunutan DNA Disimpan pada -20 oC
3.4. Pelaksanaan Penelitian a) Pengambilan Sampel
Spesimen Goniopora spp. dikumpulkan dari berbagai habitat di perairan P. Pramuka dan P. Panggang di daerah Kepulauan Seribu. Masing-masing pada kedalaman 3 - 6 meter. Dari setiap koloni diambil sampel berukuran ± 10 cm secara acak. Sampel yang akan digunakan untuk analisa morfologi disimpan dalam air laut mengandung formalin 4% yang kemudian dalam waktu 24 jam dibilas dengan akuades steril dan dipindahkan ke dalam larutan alkohol 70%. Sementara sampel yang akan digunakan untuk analisis DNA berupa karang hidup yang disimpan kontainer bertutup berisi air laut, dan untuk jaringan polip karang disimpan dalam kontainer berisi etanol absolute atau di dalam termos berisi Nitrogen cair.
b) Karakterisasi Morfologi
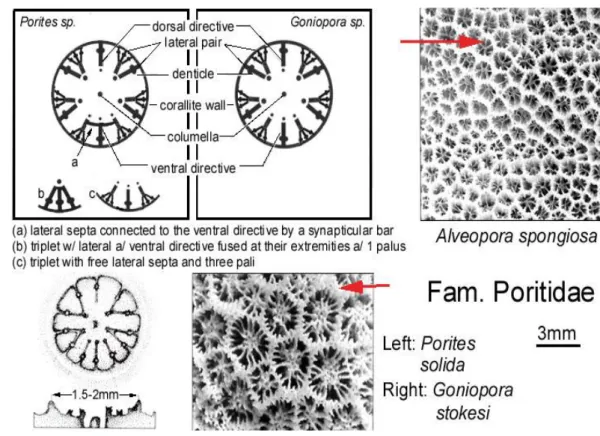
Karakter morfologi yang akan diamati adalah jumlah tentakel pada setiap polip karang (24 buah) saat karang masih hidup, bentuk dan kerangka kapur, diameter koralit (coralite) dan calyx (calice), bentuk koralit, paliform lobe, columella dan dinding koralit, serta jumlah septa tiap koralit. Metode pengamatan yang dilakukan mengacu pada Klemm et al. (1995), Veron (2000) dan Kleemann (2002).
Gambar 9 Ilustrasi karakteristik morfologik yang diamati pada karang Goniopora.
c) Isolasi DNA Total, Purifikasi dan Elektroforesis DNA Total Isolasi dan Purifikasi DNA Total
Isolasi DNA Total dilakukan menggunakan modifikasi metode Duryadi (1993). Sampel polip karang segar dicacah dan dihaluskan dalam mortar sambil ditetesi larutan CTAB sebanyak 600 μl sedikit demi sedikit. Setelah itu dimasukkan ke dalam ependorf 1.5 ml, sambil dikocok sebentar. Kemudian dinkubasi selama 3 jam dengan suhu 65 ºC. Tambahkan proteinase-K sebanyak 2 μl, dan diinkubasi selama semalaman dengan suhu 55 ºC. ditambah larutan fenol sebanyak 400 μl dan dikocok manual selama 40 menit, disentrifugasi selama 3 menit dengan kecepatan 13 000 rpm, sedangkan supernatannya dipindahkan ke ependorf lain, lalu fenolnya dibuang. Kemudian ditambah larutan CIAA sebanyak 600 μl (minimum 500 μl), dikocok lagi secara manual selama 20 menit hingga berbusa dan terlihat bening, kemudian disentrifugasi selama 3 menit dengan kecepatan 13 000 rpm, supernatannya dipindahkan ke ependorf lain. Selanjutnya
ditambah etanol absolut sebanyak 1000 μl, dikocok lagi secara manual selama 10 menit. Kemuidan dimasukkan ke dalam freezer ± 15 menit, lalu disentrifugasi selama 2 menit dengan kecepatan 13 000 rpm. Etanolnya dibuang (usahakan agar endapan DNA yang terbentuk tidak terbuang), kemudian ditambahkan etanol 70% sebanyak 600 μl. Dikocok lagi secara manual hingga terbentuk endapan selama 5 menit, kemudian disentrifugasi selama 3 menit dengan kecepatan 13 000 rpm. Etanol tersebut dibuang sampai menyisakan endapannya saja, lalu dikering-udarakan dan divakum selama ± 10 menit. Kemudian dimasukkan TE+RNAase 50 μl dan diinkubasi ± 10 menit dengan suhu 37 ºC. Selanjutnya disentrifugasi selama beberapa detik dengan kecepatan 6 500 rpm, dan dimasukkan ke dalam freezer dengan suhu -20 ºC.
Elektroforesis Gel
Gel elektroforesis merupakan metode analisis kualitatif untuk memisahkan dan menganalisis DNA. Untuk membuat satu agar penuh, campurkan TBE 1 x sebanyak 50 l dicampur dengan 0.6 g bubuk agarosa (1.2% gel agarosa) dan dipanaskan hingga mendidih. Agarosa merupakan polisakarida yang berasal dari rumput laut dan akan membentuk gel padat jika diarutkan dengan pemanasan pada konsentrasi antara 0.5 dan 2% (w/v). Agarosa ini kemudian akan membentuk pori yang besarnya sesuai dengan konsentrasi agarosa. Molekul DNA yang lebih kecil akan bergerak lebih cepat di dalam gel agarosa sebaliknya molekul yang lebih besar akan bergerak lebih lambat. TBE digunakan karena larutan ini memungkinkan DNA bergerak dengan perlahan di dalam gel. Larutan ini akan mengoptimalisasi pH dan mengkonsentrasikan ion di dalam gel sekaligus merendam gel sehingga arus listrik dapat mengalir dalam gel. TBE mengandung Tris yang merupakan senyawa kimia yang membantu mempertahankan konsistensi pH dalam larutan. Selain itu juga mengandung asam borat yang berfungsi untuk menyediakan konsentrasi ion yang tepat untuk buffer dan EDTA yang berfungsi mengkelat kation divalen Magnesium (Saunders dan Parkes 1999).
Kemudian larutan didinginkan lalu ditambah dengan 2.5 l EtBr (Ethidium bromide) merupakan pewarna yang digunakan untuk alat identifikasi dan mengukur semi-kualitatif fragmen DNA yang terseparasi dalam gel. EtBr
yang mengandung zat fluorosence akan terikat diantara dua untai ganda DNA sehingga pita DNA dalam gel agarosa akan berpendar jika diihat menggunakan UV transluminator (Saunders dan Parkes 1999). Larutan gel ini kemudian dituang kedalam cetakan gel yang telah diatur posisinya dalam keadaan sejajar (datar) dan telah dipasangi sisir. Cetakan harus benar-benar datar agar proses migrasi DNA dapat berjalan baik dan hasil migrasi tidak dipengaruhi oleh kemiringan gel akibat cetakan yang tidak datar. Gel kemudian didiamkan selama 30 menit hingga mengeras dan dimasukkan ke dalam bak gel lalu dituang dengan TBE buffer sampai gel terendam. TBE ini berfungsi sebagai konduktor listrik. Sampel DNA kemudian diambil 5 l dan dicampur dengan loading dye 0.5 l diatas plastik bersih sampai merata lalu dipipet kembali dan dimasukkan ke dalam sumuran (well). Loading dye berfungsi sebagai pemberat untuk meningkatkan densitas DNA sehingga DNA akan tenggelam dalam sumuran sehingga tidak melayang dalam larutan TBE. Selain itu, loading dye juga digunakan sebagai penanda visual untuk mengetahui seberapa jauh pergerakan DNA di dalam gel.
Proses migrasi DNA dengan menggunakan piranti Submarine Electrophoresis (Hoefer, USA) yang dihubungkan dengan elektroda pada voltase 85 V, 45 Amp selama 30 menit. Pada saat proses migrasi, akan terjadi aliran listrik. DNA yag bermuatan negatif akan bergerak menuju elektroda positif. Kecepatan pergerakan DNA dalam gel akan sangat bergantung pada ukuran dan bentuk DNA, konsentrasi gel dan voltase yang digunakan. Setelah proses migrasi DNA selesai, power supply dimatikan dan gel diambil kemudian diamati di bawah UV- transluminator lalu difoto.
d) Amplifikasi COI dan ITS dengan PCR dan Elektroforesis Hasil PCR Dalam penelitian ini, amplifikasi DNA dengan PCR menggunakan primer CO1 yang didisain menggunakan soft ware Primer 3 version 0.4.0 (http://frodo.wi.mit.edu/primer3/) berdasarkan modifikasi runutan gen COX1 Porites porites, (kode akses NC_008166) dan gen COX1 Goniopora sp. ZHF-2009 isolate Wa3 cytochrome oxidase subunit 1 (COX1) (kode akses FJ423995) yang sudah di-alignment dengan program MEGA versi 4.0 (Tamura et al. 2007). Amplifikasi primer gen mitokondrial sitokrom c oksidase sub unit 1 (COI) adalah:
GJWCO1 F 5’-CTC GGC ACA GCC TTC AGT ATG TTA-3’ (24 bp) dan GJWCO1 R 5’-AAT ATA AAC TTC AGG ATG CCC AAA-3’ (24 bp) sedangkan primer gen daerah nuclear intra transcribed spacer ribosomal (ITS) adalah primer yang dikembangkan oleh Forsman et al. (2009) dengan atau tanpa modifikasi yaitu : ITSZF 5'-TAA AAG TCG TAA CAA GGT TTC CGT A-3' (25 bp), dan ITSZR 5'-CCT CCG CTT ATT GAT ATG CTT AAA T-3' (25 bp).
Proses amplifikasi COI dan daerah ITS menggunakan mesin GeneAmpR PCR system 2004 (Perkin Elmer). Strategi dan komposisi larutan menggunakan modifikasi metode Duryadi (1993). Kondisi PCR yang digunakan untuk amplifikasi COI adalah : tahap predenaturasi pada suhu 94 ºC selama 5 menit, dilanjutkan dengan siklus utama yaitu tahap denaturasi pada suhu 94 ºC selama 45 detik, tahap penempelan (annealing) pada suhu 48 ºC selama 1 menit, tahap polimerasi (extension) pada suhu 72 ºC selama 1 menit, yang diulang sebanyak 35 siklus, dan diakhiri dengan tahap polimerasi (post extension) pada suhu 72 ºC selama 5 menit dan tahap perpanjangan (elongation) pada suhu 20 ºC. Sedangkan proses amplifikasi ITS adalah sama dengan amplifikasi COI hanya berbeda pada tahap penempelan (annealing) yaitu pada suhu 48 ºC selama 1 menit.
e) Perunutan Fragmen CO1 dan ITS
Perunutan (sequencing) DNA hasil PCR dilakukan di PT. CHAROEN POKPHAN INDONESIA. Dengan menggunakan Mesin ABI Prism 3100-Avant Genetic Analyzer (Applied Biosystems, USA), yang menggunakan metode Dye-dideoxy-terminator menggunakan BigDye Terminator Cycle Sequencing Kit v.3.1 (Applied Biosystems, USA).
f) Analisis Data
Sisi homolog dari runutan basa nukleotida gen COI dan ITS kemudian disejajarkan (multiple alignment) dan dibandingkan dengan runutan-runutan COI dan ITS dari GenBank kemudian dianalisis menggunakan program MEGA versi 4.0 (Tamura et al. 2007) dengan metode bootstrapped neighbor joining dengan 1000 kali pengulangan.