ANALISIS HUBUNGAN KUANTITATIF STRUKTUR DAN AKTIVITAS ANTIOKSIDAN SENYAWA TURUNAN APIGENIN
Teks penuh
Gambar
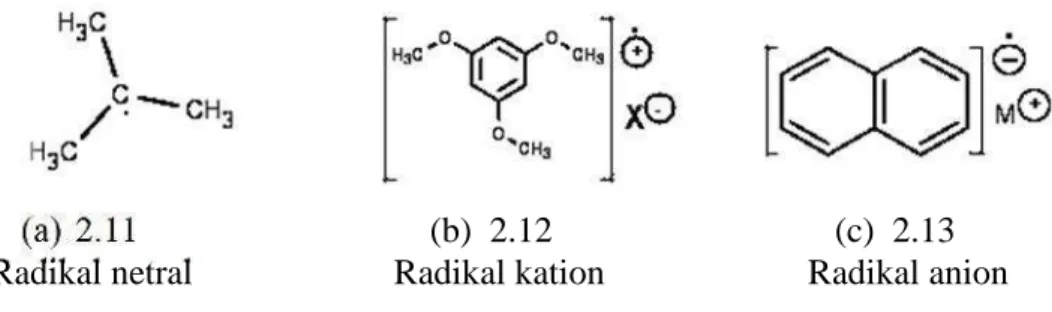
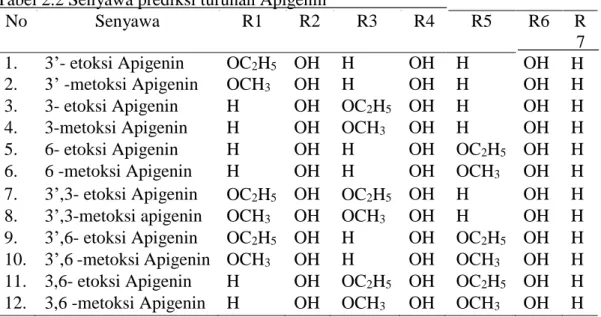
Dokumen terkait
Dalam penelitian menggunakan metode kimia komputasi, perhitungan dilakukan dengan menyertakan basis set, basis set dalam ilmu kimia adalah kumpulan fungsi
Digunakan bila tidak ada data tetapan kimia fisika dari senyawa dan uji aktivitas lebih lambat dibanding dengan sintesis turunan senyawa.. Parameter teori
Digunakan bila tidak ada data tetapan kimia fisika dari senyawa dan uji aktivitas lebih lambat dibanding dengan sintesis turunan senyawa.. Parameter teori
Optimasi model senyawa turunan quinoxalin menggunakan metode DFT dengan basis set 6311G menggunakan program Gaussian09W, dan nilai deskriptor diperoleh
Dalam penelitian menggunakan metode kimia komputasi, perhitungan dilakukan dengan menyertakan basis set, basis set dalam ilmu kimia adalah kumpulan fungsi matematika
Untuk menguji apakah deskriptor- deskriptor tersebut memiliki pengaruh yang signifikan terhadap aktivitas analgesik dari senyawa turunan meperidin maka dilakukan
Dengan metoda analisis HKSA, senyawa yang akan disintesis dapat didesain terlebih dahulu berdasarkan hubungan antara sifat-sifat kimia serta fisik molekul dengan aktivitas
Analisis hubungan antara struktur, sifat fisika kimia lipofilik, elektronik, dan sterik dari senyawa N- fenilkarbamotioil-benzamida dan turunanannya terhadap aktivitas,