SINTESIS DAN KARAKTERISASI KOMPLEKS
BESI(III) DAN NIKEL(II) DENGAN PIRAZINAMIDA
Disusun Oleh RUS MAYSYAROH
M 0304061
SKRIPSI
Ditulis dan diajukan untuk memenuhi sebagian persyaratan mendapatkan gelar Sarjana Sains Kimia
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SEBELAS MARET
SURAKARTA 2009
ii
HALAMAN PENGESAHAN
Skripsi ini dibimbing oleh : Pembimbing I
Prof. Drs. Sentot Budi Rahardjo, Ph.D. NIP. 19560507 198601 1001
Pembimbing II
Dra. Tri Martini, M.Si. NIP. 19581029 198503 2002
Dipertahankan di depan Tim Penguji Skripsi pada : Hari : Selasa
Tanggal : 25 Agustus 2009
Anggota Tim Penguji :
1. Dr.rer.nat. Atmanto Heru W., M.Si. NIP. 19740813 200003 1001 2. Nestri Handayani, M.Si., Apt. NIP. 19701211 200501 2001
1. ………
2. ………
Disahkan oleh
Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sebelas Maret Surakarta
Ketua Jurusan Kimia,
Prof. Drs. Sentot Budi Rahardjo, Ph.D. NIP. 19560507 198601 1001
iii
PERNYATAAN
Dengan ini saya menyatakan bahwa dalam skripsi saya yang berjudul “SINTESIS DAN KARAKTERISASI KOMPLEKS BESI(III) DAN NIKEL(II) DENGAN PIRAZINAMIDA” adalah benar – benar hasil penelitian sendiri dan tidak terdapat karya yang pernah diajukan untuk memperoleh gelar kesarjanaan di suatu perguruan tinggi, dan sepanjang pengetahuan saya juga tidak terdapat kerja atau pendapat yang pernah ditulis atau diterbitkan oleh orang lain, kecuali yang secara tertulis diacu dalam naskah ini dan disebutkan dalam daftar pustaka.
Surakarta, Agustus 2009
iv ABSTRAK
Rus Maysyaroh. 2009. SINTESIS DAN KARAKTERISASI KOMPLEKS BESI(III) DAN NIKEL(II) DENGAN PIRAZINAMIDA. Skripsi. Jurusan Kimia. Fakultas Matematika dan Ilmu Pengetahuan Alam. Universitas Sebelas Maret .
Penelitian ini bertujuan untuk mengetahui sintesis kompleks, formula, dan karakteristik dari masing – masing senyawa kompleks yang terbentuk. Kompleks Fe(III) dan Ni(II) dengan pirazinamida telah disintesis dengan perbandingan mol logam dan mol ligan 1 : 1 dalam air. Formula kompleks yang diperkirakan dari analisis kadar Fe dan Ni dalam kompleks dengan spektroskopi serapan atom (SSA) adalah Fe(pirazinamida)mCl3.nH2O (m = 1 atau 2 dan n = 12,13,5 atau 6) dan Ni(pirazinamida)m(NO3)2.nH2O (m = 2 atau 3 dan n = 10,11,3 atau 4). Perbandingan muatan kation dan anion yang diperkirakan dari pengukuran daya hantar listrik dengan konduktivitimeter menunjukkan perbandingan muatan kation : anion = 3 : 1 untuk kompleks Fe(III)-pirazinamida dan 2 : 1 untuk kompleks Ni(II)-pirazinamida. Analisis termal dengan Thermogravimetric/Differential Thermal Analyzer (TG/DTA) mengindikasikan adanya enam molekul H2O dalam kompleks Fe(III)-pirazinamida dan sembilan molekul H2O dalam kompleks Ni(II)-pirazinamida. Data spektrum infra merah menunjukkan pergeseran serapan gugus fungsi karbonil pada kompleks Fe(III) yang mengindikasikan gugus fungsi tersebut terkoordinasi pada atom pusat Fe(III) secara monodentat. Pergeseran serapan gugus fungsi karbonil dan cincin pirazin pada kompleks Ni(II), mengindikasikan gugus fungsi tersebut terkoordinasi pada atom pusat Ni(II) secara bidentat. Pengukuran momen magnet dengan Magnetic
Susceptibility Balance (MSB) menunjukkan bahwa kedua kompleks bersifat
paramagnetik dengan µeff = 5,97 – 6,15 BMuntuk kompleks Fe(III)-pirazinamida dan 3,49 – 3,57 BM untuk kompleks Ni(II)-pirazinamida. Harga absorptivitas molar kompleks Fe(III)-pirazinamida adalah 1610,32 L.mol-1cm-1 sedangkan untuk kompleks Ni(II)-pirazinamida adalah 7,49 dan 41,15 L.mol-1cm-1. Hal ini mengindikasikan kedua kompleks berstruktur oktahedral dengan rumus
[Fe(pza)2(H2O)4]Cl3.2H2O dan [Ni(pza)2(H2O)m](NO3)2.nH2O (m = 2,3 dan n = 8,7).
Kata kunci : Sintesis, Karakterisasi, Kompleks Fe(III), Kompleks Ni(II), Pirazinamida.
v ABSTRACT
Rus Maysyaroh. 2009. SYNTHESIS AND CHARACTERIZATION COMPLEXES OF IRON(III) AND NICKEL(II) WITH PYRAZINAMIDE. Thesis. Department of Chemistry. Mathematic and Science Faculty. Sebelas Maret University.
The purpose of this research is to find out the synthesis complexes , formula, and characteristic of each complexes which was formed. Complexes of iron(III) and nickel(II) with pyrazinamide had been synthesized in 1 : 1 mole ratio of metal to ligan in aquadest. The formula of complexes which were predicted from analysis of % Fe and Ni in complexes by Atomic Absorption Spectroscopy areFe(pyrazinamide)mCl3. nH2O (m = 1 or 2 dan n = 12,13,5, or 6) dan Ni(pyrazinamide)m(NO3)2.nH2O (m = 2,3 dan n = 10,11,3,4). Charge ratios of cation and anion of complexes were measured by conductivitymeter correspond to 3 : 1 for Fe(III)-pyrazinamide and 2 : 1 for Ni(II)-pyrazinamide. The thermal analysis was determined by Thermogravimetric/ Differential Thermal Analyzer (TG/DTA) indicate that both of complexes contain six molecules hydrates for Fe(III)-pyrazinamide and nine molecules hydrates for Ni(II)-pyrazinamide. Data of infra red spectras show a negatif shift of C=O group absorption and indicate this functional group is coordinated to the center ion by monodentat order in Fe(III) complexes. A negatif shift of C=O group absorption and positif shift of pyrazine ring absorption indicate this functional groups are coordinated to the center ion by bidentat order in Ni(II) complexes. Magnetic susceptibility measurements show that complexes are paramagnetic with µeff = 5,97 – 6,15 BM for Fe(III)-pyrazinamide and 3,50 – 3,58 BM for Ni(II)-pyrazinamide.The molar absorptivity for Fe(III)-pyrazinamide is 1610,32 L.mol-1cm-1 while for Ni(II)-pyrazinamide is 7,49 dan 41,15 L.mol-1cm-1 indicates that the structure of both complexes are octahedral with formulas [Fe(pza)2(H2O)4]Cl3.2H2O and [Ni(pza)2(H2O)m](NO3)2.nH2O (m = 2,3 and n = 8,7).
Keywords : Synthesis, Characterization, Complexes Fe(III), Complexes Ni(II), Pyrazinamide.
vi MOTTO
Barangsiapa yang bertakwa kepada Allah, Niscaya Dia akan mengadakan jalan keluar baginya, dan memberinya rizqi dari arah yang tidak disangka - sangkanya
(Q.S.Ath-Thalaq : 2 - 3)
Jagalah Alloh niscaya engkau akan mendapatiNya dihadapanmu, Kenalilah Alloh di waktu lapang niscaya Dia mengenalmu di waktu sempit,
Ketahuilah, bahwa apa yang luput darimu tidak akan mengenaimu Dan apa yang mengenaimu tidak akan luput darimu.
Ketahuilah, bersama kesabaran ada pertolongan, Bersama kesusahan ada jalan keluar dan
Bersama kesulitan ada kemudahan. (H.R. Tirmidzi)
vii
PERSEMBAHAN
Dengan segenap rasa syukur penulis persembahkan karya ini untuk : Kedua orang tuaku, Bapak Zainu dan Ibu Siti Djuwariyah Allohummaghfirlii wali waalidayya war hamhumaa kama robbayaanii shoghiiro, Semoga kalian senantiasa mendapat perlindungan Alloh, Mas Shidiq, Mas Ipul, Mbak Nur dan Mbak Irna Baarokallohu fiikum atas doa dan dukungannya selama ini Jazakumulloh Khoirul Jazaa Semoga Alloh membalas kebaikan kalian semua
viii
KATA PENGANTAR
Alhamdulillaah, puji syukur penulis panjatkan kehadirat Allah ‘Azza wa Jalla atas segala limpahan rahmat dan hidayah-Nya, sehingga penulis dapat menyelesaikan skripsi dengan judul “SINTESIS DAN KARAKTERISASI KOMPLEKS BESI(III) DAN NIKEL(II) DENGAN PIRAZINAMIDA” guna memenuhi sebagian persyaratan untuk mendapatkan gelar Sarjana Sains di Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sebelas Maret Surakarta.
Skripsi ini tidak akan selesai tanpa adanya bantuan dari banyak pihak. Oleh karena itu penulis ingin mengucapkan terima kasih kepada :
1. Bapak Prof. Drs. Sutarno, M.Sc., Ph.D. selaku dekan FMIPA UNS.
2. Bapak Prof. Drs. Sentot Budi Rahardjo, Ph.D. selaku ketua jurusan kimia dan pembimbing I.
3. Ibu Dra. Tri Martini, M.Si. selaku pembimbing II.
4. Bapak I.F. Nurcahyo, M.Si. selaku pembimbing akademis dan ketua laboratorium kimia dasar FMIPA UNS Surakarta beserta para stafnya.
5. Bapak dan ibu dosen jurusan kimia FMIPA UNS, atas semua ilmu yang telah diberikan.
6. Bapak Dr.rer.nat. Fajar Rakhman Wibowo, M.Si. selaku ketua sub laboratorium kimia pusat FMIPA UNS dan para stafnya.
7. Dosen dan karyawan FMIPA UNS Surakarta.
8. Staf dan operator sub laboratorium kimia Universitas Sebelas Maret Surakarta.
9. Bapak dan ibuku tercinta, mas Shidiq, mbak Yani, mas Ipul, mbak Nur, dan mbak Irna barokallahu fiikum.
10. Teman – temanku mbak Laily, NH, Anggun, Ade, Camel, Mar’atus, Astri Y, Maya, Eva, Inti, Nana, jazaakumullohu khoiron.
11. Teman-teman kimia angkatan 2004, 2005, 2006, 2007 terima kasih untuk semuanya.
ix
12. Semua pihak yang telah membantu namun yang tidak dapat penulis sebutkan satu persatu, terima kasih.
Penulis menyadari bahwa banyak kekurangan dalam penulisan skripsi ini. Oleh sebab itu, kritik dan saran yang membangun dari pembaca sangat diharapkan penulis. Semoga karya kecil ini dapat memberikan manfaat bagi perkembangan ilmu pengetahuan dan kita semua.
Surakarta, Agustus 2009
x
DAFTAR ISI
Halaman
HALAMAN JUDUL ... i
HALAMAN PENGESAHAN ... ii
HALAMAN PERNYATAAN... iii
ABSTRAK... iv
ABSTRAC... v
MOTTO... vi
PERSEMBAHAN... vii
KATA PENGANTAR... viii
DAFTAR ISI ... x
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
BAB I PENDAHULUAN ... 1
A. Latar Belakang Masalah ... 1
B. Perumusan Masalah ... ... 3 1. Identifikasi Masalah ... ... 3 2. Batasan Masalah ... 4 3. Rumusan Masalah ... 4 C. Tujuan Penelitian ... 4 D. Manfaat Penelitian ... 4
BAB II LANDASAN TEORI ... 5
A. Tinjauan Pustaka ... 5
1. Sintesis Kompleks ... 5
2. Senyawa Kompleks Besi(III) dan Nikel(II)... 6
3. Teori Pembentukan Kompleks... 8
a. Teori Ikatan Valensi... 8
b. Teori Medan Kristal... 11
xi
4. Sifat Magnetik ... 18
5. Daya Hantar Listrik ... 20
6. Spektroskopi Infra Merah ... 22
7. Thermogravimetric/Differential Thermal Analysis (TG/DTA)….. 23
8. Pirazinamida... 25
B. Kerangka Pemikiran ... 25
C. Hipotesis ... 27
BAB III METODOLOGI PENELITIAN ... 29
A. Metode Penelitian ... 29
B. Tempat dan Waktu Penelitian ... 29
C. Alat dan Bahan ... 29
1. Alat ... 29
2. Bahan ... 30
D. Prosedur Penelitian ... 30
1. Sintesis Kompleks ... 30
a. Sintesis Kompleks Fe(III) dengan Pirazinamida... 30
b. Sintesis Kompleks Ni(II) dengan Pirazinamida... 31
2. Penentuan Kadar Besi dan Nikel... 31
3. Pengukuran Daya Hantar Listrik ... 32
4. Analisis TG/DTA ... 32
5. Pengukuran Momen Magnet ... 32
6. Pengukuran Spektrum Infra Merah ... 32
7. Pengukuran Spektrum Elektronik... 33
E. Teknik Pengumpulan dan Analisis Data ... 33
BAB IV HASIL DAN PEMBAHASAN... 34
A. Sintesis Kompleks... 34
1. Sintesis Kompleks Besi(III) dengan Pirazinamida... 34
2. Sintesis Kompleks Nikel(II) dengan Pirazinamida... 35
xii
1. Pengukuran Kadar Besi dan Nikel…... 36
a. Pengukuran Kadar Besi dalam Kompleks... 36
b. Pengukuran Kadar Nikel dalam Kompleks... 36
2. Pengukuran Daya Hantar Listrik... 37
3. Analisis Termal dengan TG/DTA... 38
C. Karakteristik Kompleks... 41
1. Sifat Kemagnetan... 41
2. Spektrum Infra Merah... 42
3. Spektrum Elektronik... 45
D. Perkiraan Struktur Kompleks... 47
1. Perkiraan Struktur Kompleks Fe(III)-pirazinamida... 47
2. Perkiraan Struktur Kompleks Ni(II)-pirazinamida... 48
BAB V PENUTUP... 50
A. Kesimpulan... 50
B. Saran... 51
DAFTAR PUSTAKA ... 52
xiii
DAFTAR TABEL
Halaman Tabel 1. Orbital Hibridisasi beberapa Konfigurasi Geometri... 10 Tabel 2. Energi Transisi dan Panjang Gelombang Maksimum Konfigurasi
Elektron d5 dalam Medan Ligan Oktahedral... 15 Tabel 3. Faktor Koreksi Diamagnetik untuk Beberapa Kation, Anion, Atom
Netral dan Molekul (10-6 cgs)…... 19 Tabel 4. Konduktansi Molar Ion dalam Air pada 25 ºC... 21 Tabel 5. Kadar Besi dalam Kompleks Besi(III) dengan Pirazinamida
dengan Berbagai Komposisi secara Teoritis... 36 Tabel 6. Kadar Nikel dalam Kompleks Nikel(II) dengan Pirazinamida
dengan Berbagai Komposisi secara Teoritis... 37 Tabel 7. Daya Hantar Listrik Larutan Standar dan Kompleks dalam Air... 37 Tabel 8. Perkiraan Pelepasan Molekul Kompleks Fe(pza)2Cl3.6H2O... 39 Tabel 9. Perkiraan Pelepasan Molekul Kompleks Ni(pza)2(NO3)2.10H2O... 40 Tabel 10. Serapan Gugus Fungsi Ligan Pirazinamida dan Kompleks
Fe(III)-pirazinamida maupun Ni(II)-pirazinamida... 42 Tabel 11. Panjang Gelombang Maksimum (λmaks), Absorbansi (A) dan
xiv
DAFTAR GAMBAR
Halaman
Gambar 1. Struktur Pirazinamida ... 1
Gambar 2. Struktur Molekul [Cu(IDA)(pza)(H2O)].H2O... 2
Gambar 3. Struktur Kompleks {[Cu(pzca)(CH3CN)3](ClO4)2.H2O}n... 2
Gambar 4. Struktur Kompleks[Fe(Hbida)Cl(H2O)]... 7
Gambar 5. Kompleks [Ni(2A-4Mpy)(dipicolinate)(H2O)2].2H2O... 7
Gambar 6. Struktur Kompleks Ni(II)[5-(2'hydroxyphenyl)-3-phenylpyrazoline] 8
Gambar 7. Ikatan Koordinasi pada Kompleks [Ni(2A-4Mpy)(dipicolinate)(H2O)2].H2O... ... 9
Gambar 8. Ikatan pada Ion Kompleks [FeCl6]3-... 10
Gambar 9. Orbital d dan Susunannya dalam Ruang... 11
Gambar 10. Diagram Pemisahan Orbital d dalam Medan Oktahedral... 12
Gambar 11. Diagram Pemisahan Orbital d dan Bidang Kubik Medan Tetrahedral 13 Gambar 12. Diagram Orgel dan Spektrum Transisi Elektronik untuk Ion d8... 14
Gambar 13. Spektrum Elektronik (a) [Ni(H2O)6]2+ dan (b) [Ni(NH3)6]2+... 15
Gambar 14. Diagram Tingkat Energi Orgel untuk Konfigurasi Elektron d5 dalam Medan Ligan Oktahedral... 15
Gambar 15. Diagram Tingkat Energi Orbital Molekul Kompleks Oktahedral... 17
Gambar 16. Diagram Tingkat Energi Orbital Molekul Kompleks Tetrahedral... 18
Gambar 17. Kurva TG/DTA Kompleks [Cu2(pcp)2(4,4’-bipy)].5H2O... 24
Gambar 18. Beberapa Kemungkinan Koordinasi Pirazinamida pada Atom Pusat Fe(III) dan Ni(II)... 26
Gambar 19. Spektrum Elektronik Fe3+ pada Larutan FeCl3.6H2O (a) dan Fe3+ pada Larutan Kompleks Fe(III)-pirazinamida (b) dalam Metanol... 34
Gambar 20. Spektrum Elektronik Ni2+ pada Larutan Ni(NO3)2.6H2O (a) dan Ni2+ pada Larutan Kompleks Ni(II)-pirazinamida (b) dalam Metanol 35 Gambar 21. Termogram TG/DTA Kompleks Fe(III)-pirazinamida... 38
xv
Gambar 22. Termogram TG/DTA Kompleks Ni(II)-pirazinamida... 40
Gambar 23. Spektrum Infra Merah Kompleks Fe(III)-pirazinamida... 43
Gambar 24. Spektrum Infra Merah Kompleks Ni(II)-pirazinamida... 44
Gambar 25. Perkiraan Struktur [Fe(pirazinamida)2(H2O)4]Cl3.2H2O... 48
Gambar 26. Perkiraan Struktur [Ni(pirazinamida)2(H2O)2]Cl3.8H2O... 49
xvi
DAFTAR LAMPIRAN
Halaman Lampiran 1. Tahapan Sintesis Kompleks Fe(III) dan Ni(II) dengan
Pirazinamida... 56
Lampiran 2. Perhitungan Rendemen Hasil Sintesis Kompleks... 57
Lampiran 3. Pengukuran Kadar Besi dan Nikel dalam Kompleks dengan Spektrofotometer Serapan Atom (SSA)... 58
Lampiran 4. Pengukuran Daya Hantar Listrik dengan Konduktivitimeter... 61
Lampiran 5. Pengukuran Sampel Kompleks dengan Thermogravimetric/Differential Thermal Analyzer (TG/DTA)... 63
Lampiran 6. Penentuan Momen Magnet Efektif... 66
Lampiran 7. Perhitungan Nilai Absorptivitas Molar dan Energi Pembelahan Kompleks... 70
Lampiran 8. Spektrum Infra Merah Ligan dan Kompleks... 72
Gambar 1. Diagram Tahapan Sintesis Senyawa Kompleks... 56
Gambar 2. Kurva Larutan Standar Fe(III)... 58
Gambar 3. Kurva Larutan Standar Ni(II)... 60
Gambar 4. Spektrum Infra Merah Ligan Pirazinamida... 72
Gambar 5. Spektrum Infra Merah Kompleks Fe(III)-pirazinamida... 73
Gambar 6. Spektrum Infra Merah Kompleks Ni(II)-pirazinamida... 74
Tabel 1. Konsentrasi Besi dalam Larutan Sampel... 59
Tabel 2. Konsentrasi Nikel dalam Larutan Sampel... 60
Tabel 3. Daya Hantar Listrik Larutan Standar dan Sampel Kompleks dalam Akuades... 61
Tabel 4. Kondisi Pengukuran Sampel Kompleks dengan TG/DTA... 63
Tabel 5. Hasil Uji TG/DTA... 63
Tabel 6. Perhitungan Pelepasan Molekul dalam Kompleks Fe(III)-pirazinamida... 64
xvii
Tabel 7. Perhitungan Pelepasan Molekul dalam Kompleks Ni(II)-pirazinamida 65 Tabel 8. Hasil Pengukuran Kerentanan Magnetik... 66 Tabel 9. Harga µeff pada Beberapa Harga χg dari Sampel Kompleks
Fe(III)-pirazinamida... 68 Tabel 10. Harga µeff pada Beberapa Harga χg dari Sampel Kompleks
Ni(II)-pirazinamida... 69 Tabel 11. Harga Absorptivitas Molar Formula Kompleks Fe(III)-pirazinamida 70 Tabel 12. Harga 10 Dq FeCl3.6H2O, Ni(NO3)2.6H2O, Fe(III)-pirazinamida dan
xviii BAB I PENDAHULUAN
A. Latar Belakang Masalah
Sejumlah senyawa kompleks terjadi dan terdapat secara alamiah dalam sistem biologi. Proses pengikatan oksigen oleh Fe menjadi senyawa kompleks dalam tubuh merupakan salah satu contoh aplikasi senyawa kompleks. Studi pembentukan kompleks menjadi hal yang menarik untuk dipelajari karena kompleks yang terbentuk dimungkinkan memberi banyak manfaat, misalnya untuk ekstraksi, sebagai katalis, dan penanganan keracunan logam berat.
Suatu senyawa heterosiklis memainkan peranan penting dalam banyak sistem biologi, khususnya sistem ligan donor N yang merupakan komponen beberapa vitamin dan obat-obatan. Oleh sebab itu, banyak dilakukan penelitian mengenai senyawa heterosiklis dan kompleksnya, baik mengenai struktur maupun spektroskopinya (Cakir, Bicer, Aoki dan Coskun, 2006), salah satunya adalah pirazinamida. Pirazinamida merupakan turunan amida heterosiklik dan beberapa kompleks yang terbentuk darinya digunakan secara luas dengan aktivitas antituberkulosis (gambar 1). Pirazinamida (pza atau pyrazine-2-carboxamide) mempunyai efek bakterisid yang membunuh atau menghentikan pertumbuhan bakteri penyebab tuberkulosis, pada umumnya digunakan bersama-sama obat tuberkulosis lainnya (Siswandono, 2000).
N
N C
NH2
O
Gambar 1. Struktur Pirazinamida
Blanco, Perez, Maria, Lazarte, Carbalo, Castineiras dan Gutierrez (2003) mensintesis kompleks [Cu(IDA)(pza)(H2O)].H2O (IDA = iminodiacetato, pza =
xix
pyrazine-2-carboxamide), dalam kompleks tersebut nitrogen cincin pirazin
terkoordinasi pada Cu(II) seperti ditunjukkan oleh gambar 2.
Gambar 2. Struktur Molekul [Cu(IDA)(pza)(H2O)].H2O (Blanco et al., 2003)
Selain itu juga telah disintesis kompleks {[Cu(pzca)(CH3CN)3](ClO4)2.H2O}n (pzca = 2-pyrazine carboxamide), dalam kompleks tersebut atom O gugus karbonil dan atom nitrogen cincin pirazin terkoordinasi pada ion pusat Cu(II) sebagaimana ditunjukkan oleh gambar 3 (Tanase, Gallego, Bouwman, Rene de Gelder dan Reedijk, 2005).
Gambar 3. Struktur Kompleks {[Cu(pzca)(CH3CN)3](ClO4)2.H2O}n (Tanase et al., 2005)
Akyuz, Andreeva, Sukarova dan Basar (2007) melaporkan bahwa dalam kompleks yang disintesisnya, yaitu M(pza)2Ni(CN)4 (dengan M = Mn, Ni, Zn, Cd dan pza = pirazinamida), bahwa ikatan koordinasi pirazinamida pada ion pusat terjadi
xx
melalui nitrogen cincin pirazin. Menurutnya, pirazinamida ini mempunyai empat donor elektron (dua nitrogen pada cincin pirazin, nitrogen pada gugus amino dan oksigen pada gugus karboksil) dan dua akseptor (hidrogen pada gugus aminonya), sehingga ikatannya dengan ion logam dimungkinkan dapat terjadi dengan model yang berbeda-beda.
Dari uraian di atas, maka menarik dikaji lebih lanjut interaksi pirazinamida dengan ion logam lainnya, yaitu besi(III) dan nikel(II) meskipun hanya sebatas sintesis dan karakterisasinya. Besi (III) cukup reaktif sehingga dapat membentuk banyak senyawa koordinasi dengan berbagai macam ligan (Cotton dan Wilkinson, 1989), sedangkan nikel mampu berkoordinasi dengan berbagai macam ligan karena didukung energi penstabilan medan kristal (Crystal Field Stabilization Energy-CFSE) yang cenderung sedang dibandingkan ion logam transisi deret pertama lainnya, sehingga mudah membentuk senyawa kompleks (Cotton dan Wilkinson, 1989).
B. Perumusan Masalah 1. Identifikasi Masalah
a. Sintesis kompleks dapat dilakukan dengan berbagai cara dan kondisi antara lain mereaksikan ligan dan logam pada pH tertentu, merefluks, mencampur tanpa pemanasan, atau dengan pemanasan dan pengadukan.
b. Formula kompleks dapat ditentukan berdasarkan analisis unsur C, H, N,O dan logam atau diperkirakan dari analisis logamnya saja.
c. Kedudukan anion dalam kompleks dapat bertindak sebagai ligan atau sisa asam. d. Keberadaan air dalam suatu kompleks dapat sebagai ligan atau bukan ligan. e. Gugus yang terkoordinasi pada logam dapat ditentukan melalui kristalografi sinar
X atau diperkirakan dari data spektrum Infra Merah.
f. Karakterisasi kompleks diperkirakan melalui spektrum infra merah, spektrum
xxi
2. Batasan Masalah
a. Formula kompleks diperkirakan dari pengukuran kadar logamnya, daya hantar listriknya, dan pengukuran dengan Thermogravimetric/Differential Thermal
Analysis (TG/DTA).
b. Gugus fungsi ligan yang terkoordinasi pada atom pusat diperkirakan dari spektrum infra merahnya.
c. Karakterisasi kompleks diperkirakan melalui spektrum infra merah, spektrum
ultraviolet-visible (Uv-Vis), dan sifat kemagnetannya.
3. Rumusan Masalah
a. Bagaimana sintesis kompleks besi(III) dan nikel(II) dengan pirazinamida ? b. Bagaimana formula kompleks besi(III) dan nikel(II) dengan pirazinamida ? c. Bagaimana karakteristik kompleks besi(III) dan nikel(II) dengan pirazinamida ?
C. Tujuan Penelitian
1. Mensintesis senyawa kompleks besi(III) dan nikel(II) dengan pirazinamida. 2. Mengetahui formula kompleks besi(III) dan nikel(II) dengan pirazinamida . 3. Mengetahui karakteristik kompleks besi(III) dan nikel(II) dengan pirazinamida
yang meliputi sifat kemagnetannya, sifat elektroniknya, koordinasi ligan dengan ion pusat dan perkiraan struktur kompleksnya.
D. Manfaat Penelitian
Dengan mengetahui karakteristik kompleks yang dihasilkan, maka akan memudahkan dalam pembelajaran peningkatan aktivitas dan efektivitasnya sebagai obat antibakteri atau antidotum untuk keracunan logam berat.
xxii BAB II
LANDASAN TEORI
A. Tinjauan Pustaka 1. Sintesis Kompleks
Sintesis kompleks dapat dilakukan dengan berbagai cara, antara lain merefluks larutan logam dan ligan selama beberapa jam, pencampuran dan pengadukan larutan dengan pemanasan atau tanpa pemanasan. Pemanasan kadang dibutuhkan guna mempercepat reaksi yang terjadi. Cara sintesis kompleks dengan refluks sebagaimana dalam pembentukan kompleks MX2.n(INH-DCB) (M = Co(II), Ni(II); X = Cl¯, Br¯, NO3¯ dan INH-DCB =
N-Isonicotinamido-2’,4’-Dichlorobenzalaldimine) (Agarwal, Sharma, Singh dan Agarwal, 2005). Garam
Co(II) atau Ni(II) dalam larutan etanol panas dicampurkan dengan larutan ligan dalam etanol panas (1 : 2 atau 1 : 3), kemudian direfluks pada water bath sekitar 2 – 3 jam. Setelah didinginkan pada suhu kamar, kompleks berwarnapun terbentuk, kemudian disaring, dicuci dengan etanol, dan dikristalisasi, serta dikeringkan dengan P2O5 dalam vakum.
Cara sintesis lainnya sebagaimana pada kompleks [Cu(IDA)(pza)(H2O)].H2O (IDA = iminodiacetato; pza = pyrazine-2-carboxamide) (Blanco et al., 2003), yaitu Cu2CO3(OH)2 dan H2IDA direaksikan dengan pirazinamida dalam 150 ml air dengan perbandingan mol 1 : 2 : 2, akan dihasilkan larutan biru. Penguapan pertama menghasilkan kristal biru muda (senyawa 1), diikuti kristal biru tua (senyawa 2) dan kristal pirazinamida. Senyawa 2 inilah yang merupakan kompleks [Cu(IDA)(pza)(H2O)]H2O. Cara sintesis hanya dengan pengadukan sebagaimana dalam sintesis kompleks [Fe(Hbida)Cl(H2O)] (Moon, Kim, Lah, 2006), sebanyak 0,17 g FeCl3.6H2O (0,63 mmol) ditambahkan kedalam larutan 0,16 g (0,62 mmol) H3bida (N-(benzimidazol-2-ylmethyl)iminodiacetic acid) dalam 30 ml metanol. Larutan diaduk konstan sampai jernih, dibiarkan selama ± 7 hari hingga terbentuk kristal berwarna oranye.
xxiii
2. Senyawa Kompleks Besi dan Nikel
Suatu senyawa kompleks akan terbentuk bila terjadi ikatan kovalen koordinasi antara suatu atom atau ion logam dengan beberapa molekul netral atau ion donor elektron. Atom atau ion logam berfungsi sebagai ion pusat sedangkan molekul netral atau ion donor elektron berfungsi sebagai gugus pengeliling atau yang lebih dikenal dengan ligan (Day et al., 1985). Atom pusat biasanya ion – ion logam transisi yang berfungsi sebagai penerima pasangan elektron bebas dari ligan (Cotton, Wilkinson and Gauss, 1995). Kemampuan suatu ion logam untuk berikatan dengan sejumlah ligan dinyatakan oleh bilangan koordinasinya. Ligan yang dapat menyumbangkan lebih dari satu pasang elektron (mempunyai lebih dari satu atom donor) disebut ligan polidentat (Cotton et al., 1988).
Besi termasuk golongan logam transisi yang mempunyai konfigurasi elektronik [Ar] 3d6 4s2 yang mempunyai tingkat oksidasi utama (+II) dan (+III), kompleks besi(III) pada umumnya lebih stabil daripada kompleks besi(II) (Lee, 1991). Besi (III) ditinjau dari muatan kompleksnya dapat membentuk kompleks yang bervariasi yaitu kationik, netral dan anionik. Keistimewaan yang menarik dari koordinasi kimia besi(III) adalah kecenderungannya membentuk kompleks dengan ligan donor atom O dibandingkan dengan ligan donor atom N (Greenwood and Earnshow, 1984).
Kompleks besi(III) umumnya membentuk struktur oktahedral dengan bilangan koordinasi enam, sebagaimana pada kompleks [Fe(Hbida)Cl(H2O)] (Moon
et al., 2006). Kompleks [Fe(Hbida)Cl(H2O)] yang berstruktur oktahedral dengan harga momen magnet 5,83 BM, ikatan koordinasi ligan pada ion pusat Fe3+ melalui kedua atom O gugus karbonil dan dua nitrogen amin (N1 dan N2) dari ligan
N-(benzimidazol-2-ylmethyl)iminodiacetic acid, satu atom Cl dan sebuah molekul air,
xxiv
Gambar 4. Struktur Kompleks [Fe (Hbida)Cl(H2O)] (Moon et al., 2006)
Nikel merupakan salah satu logam transisi deret pertama yang terletak pada periode empat dan golongan VIIIB, memiliki nomor atom 28 dan massa atom 58,71 g/mol (Huheey and Keiter, 1993). Nikel dalam keadaan nikel(II) lebih stabil daripada nikel(0), nikel(I), nikel(III) dan nikel(IV). Nikel(I) dan nikel(0) tidak stabil karena mudah teroksidasi, nikel(III) mudah tereduksi menjadi nikel(II) dan nikel(IV) jarang ditemukan (Cotton et al., 1988). Bentuk kompleks nikel(II) yang paling umum adalah oktahedral dan bujur sangkar (square planar) (Lee, 1991).
Bulut, Ucar, dan Kazak (2009) mensintesis Ni(II)-dipicolinat dengan
2-Amino-4-methylpyrimidine (2A-4Mpy), menghasilkan kompleks [Ni(2A-4Mpy)
(dipicolinate)(H2O)2].2H2O sebagaimana ditunjukkan oleh gambar 5. Dalam kompleks tersebut, dua atom O dan satu atom N dari dipicolinat, satu atom N dari 2A-4Mpy dan dua molekul air terkoordinasi pada ion pusat Ni2+ membentuk geometri oktahedral terdistorsi.
xxv
Struktur kompleks Ni(II) bujur sangkar terjadi pada kompleks
(Ni[5(2’-Hydroxyphenyl)-3-phenylpyrazoline]) seperti ditunjukkan oleh gambar 6. Bentuk
bujur sangkar ini terjadi karena masing-masing ligan pirazolin mendonorkan satu atom O dan satu atom N pada ion pusat Ni2+, koordinasi ini diketahui dari tidak nampaknya puncak proton hidroksil pada spektrum 1H NMR. Spektrum UV-Vis kompleks (Ni[5-(2'-hydroxyphenyl)-3-phenylpyrazoline]) menunjukkan dua puncak pada 25.147 dan 20.225 cm-1 yang merupakan transisi Ag B2g
1 1 1 dan Ag B1g 1 1 1 . C H2C N O CH NH Ni N HN C CH CH2 O
Gambar 6. Struktur Kompleks (Ni[5-(2'hydroxyphenyl)-3-phenylpyrazoline]) (Tripathi, Sharma, Chaturvedi, 2003)
3. Teori Pembentukan Kompleks
a. Teori Ikatan Valensi
Berdasarkan teori ini, pembentukan senyawa kompleks melibatkan reaksi antara asam Lewis (atom pusat) dengan basa-basa Lewis (ligan-ligan) melalui ikatan kovalen koordinasi (Effendy, 2007). Menurut Pauling, ikatan kovalen terjadi karena adanya tumpang tindih antara orbital kosong logam dengan orbital ligan yang berupa molekul atau ion yang mempunyai pasangan elektron bebas (Day et al., 1985). Dalam ikatannya dengan ligan-ligan, atom pusat menggunakan orbital-orbital hibrida yang diperoleh dari proses hibridisasi, yaitu proses pembentukan orbital-orbital hibrida
xxvi
dengan tingkat energi yang sama melalui kombinasi linear orbital-orbital atom dengan tingkat energi yang berbeda (Effendy, 2007).
Kompleks [Ni(2A-4Mpy)(dipicolinate)(H2O)2].2H2O (gambar 5) (Bulut et al., 2009) yang bergeometri oktahedral, disebabkan 6 orbital kosong dari ion Ni2+ didonasi oleh sepasang elektron N piridin dan dua pasang elektron atom O gugus karboksilat dari ligan dipicolinat, dua pasang elektron dari air, dan sepasang elektron atom N dari 2-Amino-4-methylpyrimidine yang menempati dua orbital 3d, satu orbital 4s dan tiga orbital 4p, yang kemudian mengalami hibridisasi d2sp3 seperti ditunjukkan oleh gambar 7. Ni2+ [Ar] Ni2+ [Ar] tereksitasi 3d8 4s0 4p0 4d0 3d8 [Ni(2A-4Mpy)(dpc)(H2O)2] [Ar] 3d8 4s2 4p6 4d4
Didonasi oleh 1 atom N, 2 atom O dari dpc, 2 atom O dari air, 1 atom N dari 2A-4Mpy, hibrida sp3d2 = oktahedral
N N O O O O..
.. ..
.. ..
..
Gambar 7. Ikatan Koordinasi pada Kompleks ([Ni(2A-4Mpy)(dipicolinate)(H2O)2]. 2H2O) (Bulut et al., 2009)
Berdasarkan fakta eksperimen, kompleks [FeCl6]3- bergeometri oktahedral dan bersifat paramagnetik yang kemagnetikannya setara dengan adanya 5 elektron tidak berpasangan (high spin) pada orbital 3d atom pusatnya. Oleh karena itu, pembentukan kompleks ini melibatkan hibridisasi sp3d2 (Effendy, 2007), sebagaimana ditunjukkan oleh gambar 8.
xxvii Fe3+ [Ar] Fe3+ [Ar] hibridisasi 3d5 4s0 4p0 4d0 3d5 [FeCl6]3- [Ar] 3d5 4s2 4p6 4d4
Didonasi oleh 6 atom Cl membentuk hibrida sp3d2 (oktahedral)
Cl Cl Cl Cl Cl Cl..
.. ..
.. ..
..
Gambar 8. Ikatan pada Ion Kompleks [FeCl6]3- (Effendy, 2007)
Hibridisasi dapat diperkirakan dari bentuk geometri molekul atau senyawa hasil eksperimen. Geometri hasil hibridisasi beberapa orbital lain ditunjukkan oleh tabel 1 (Sharpe , 1992). Teori ikatan valensi ini dapat menjelaskan struktur dan kemagnetan banyak senyawa kompleks, namun memiliki kelemahan yaitu tidak dapat menerangkan warna kompleks yang dihasilkan dan momen magnet yang berbeda pada temperatur yang bervariasi (Lee, 1994).
Tabel 1. Orbital Hibridisasi Beberapa Konfigurasi Geometri (Sharpe, 1992) Bilangan
koordinasi
Konfigurasi orbital
Bentuk geometri Ion kompleks
2 sp linier [Ag(NH3)2] +
3 sp2 trigonal [HgI3]
-4 sp3 tetrahedral Ni(CO)4
dsp2 square planar [Ni(CN)4]
2-5 dsp3 trigonal bipyramida [CuCl5]
3-d2sp2 square pyramid [Ni(CN)5]
xxviii b. Teori Medan Kristal
Menurut teori ini, interaksi antara logam atau atom pusat dan ligan dalam kompleks adalah murni elektrostatik. Logam transisi sebagai atom pusat diasumsikan sebagai ion positif yang dikelilingi oleh ligan yang bermuatan negatif atau molekul netral yang mempunyai pasangan elektron bebas (Lee, 1994). Interaksi ini menimbulkan medan kristal dan menyebabkan naiknya tingkat energi semua orbital yang dimiliki oleh atom pusat, serta menyebabkan pemisahan orbital-orbital d dari atom pusat, tetapi tidak menyebabkan pemisahan orbital-orbital p (Effendy, 2007). Orbital-orbital d ada lima macam yaitu dxy , dxz ,dyz , dx2-y2 dan dz2 dengan susunannya dalam ruang ditunjukkan pada gambar 9. Orbital dz2 merupakan hasil kombinasi linear dari orbital dz2-x2 dan dz2-y2.
y x z x y x z z y x y 3 dz 2 dx2-y2 dxy dyz dxz
Gambar 9. Orbital d dan Susunannya dalam Ruang (Huheey et al., 1993)
1. Pembelahan Orbital d Kompleks Oktahedral
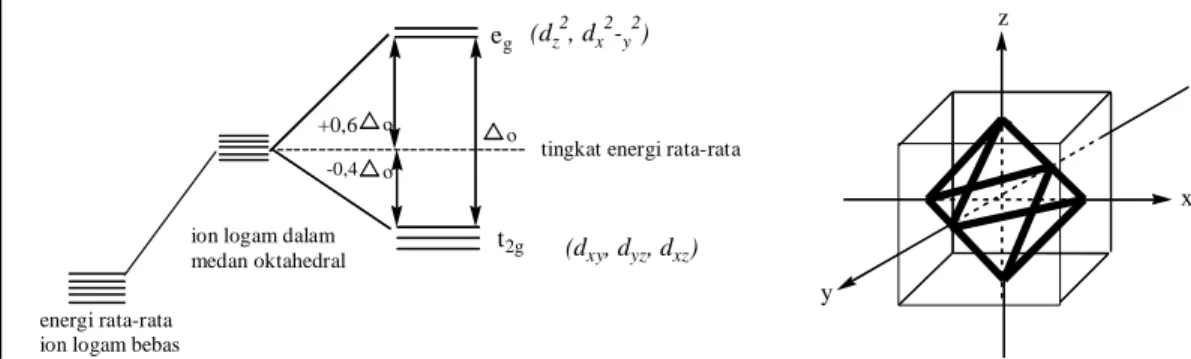
Satu ion sebagai pusat oktahedral dikelilingi oleh enam ligan yang terletak pada sumbu oktahedral (gambar 10). Orbital d akan mengalami kenaikan energi karena tolakan dari ligan. Orbital dz2 , dx2-y2 , yang berada pada sumbu oktahedral mengalami tolakan lebih besar daripada orbital dxy , dxz , dyz yang berada diantara sumbu oktahedral. Hal ini mengakibatkan pemisahan (splitting) orbital d, dimana orbital dz2 dan dx2-y2 (orbital eg) mengalami kenaikan energi sedangkan orbital dxy ,dxz,
dyz (orbital t2g) mengalami penurunan energi (Huheey et al., 1993). Perbedaan tingkat
energi antara dua kelompok orbital tersebut dinyatakan 10 Dq atau o yang juga menunjukan kekuatan medan kristal.
xxix
Pada kompleks oktahedral, pengisian orbital t2g menurunkan energi kompleks yang akan membuatnya lebih stabil sebesar -0,4∆0 per elektron. Sementara pengisian orbital eg menaikkan energi sebesar 0,6∆0 per elektron. Total Crystal Field
Stabilization Energi (CFSE) atau energi yang terstabilkan oleh medan kristal adalah CFSEoctahedral = -0,4n(t2g) + 0,6n(eg)
n(t2g) dan n(eg) berturut – turut adalah jumlah elektron yang mengisi orbital t2g dan eg. Nilai CFSE konfigurasi d0 dan d10 adalah nol baik di medan ligan kuat maupun lemah. Nilai konfigurasi d5 juga nol pada medan ligan lemah (Lee, 1994). Pembelahan orbital pada kompleks oktahedral ditunjukkan oleh gambar 10.
---eg
t2g
tingkat energi rata-rata
ion logam dalam medan oktahedral +0,6 -0,4 o o o (dz2, dx2-y2) (dxy, dyz, dxz) energi rata-rata
ion logam bebas
z
x
y
Gambar 10. Diagram Pemisahan Orbital d dalam Medan Oktahedral (Lee, 1994).
2. Pembelahan Orbital d Kompleks Tetrahedral
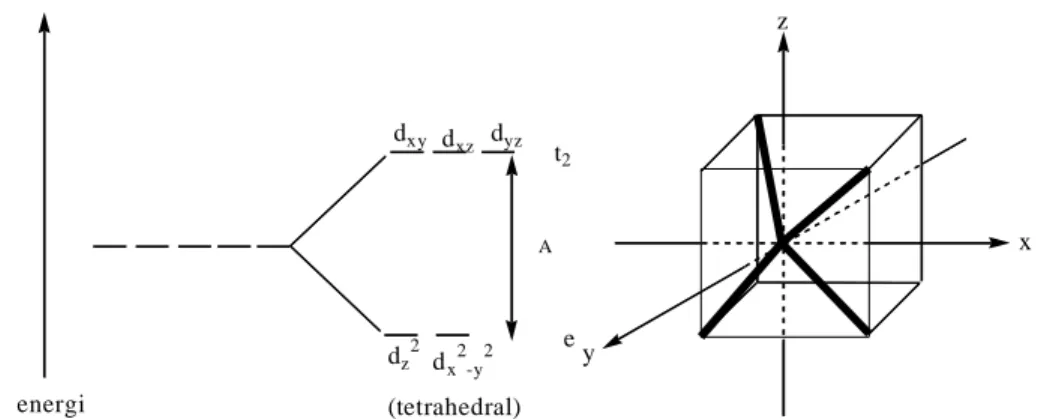
Bila keempat ligan mendekati ion pusat secara tetrahedral, maka arah pendekatan ligan-ligan tersebut tidak searah, baik dengan kelompok orbital t2g maupun dengan orbital eg. Arah pendekatan ligan menuju ion pusat lebih dekat kepada orbital t2g (dxy , dxz , dyz) dibanding dengan orbital eg (dz2 dan dx2-y2). Medan listrik yang terjadi pada pembentukan kompleks tetrahedral menyebabkan pemisahan orbital pada ion pusat menjadi kelompok orbital t2g yang triplet dengan energi yang lebih tinggi dan kelompok orbital eg dengan tingkat energi yang lebih rendah (Huheey
et al., 1993). Diagram pemisahan orbital d dan bidang kubik medan tetrahedral
xxx dxy d xz dyz dz 2 dx2-y2 t2 e A energi (tetrahedral) z x y
Gambar 11. Diagram Pemisahan Orbital d dan Bidang Kubik Medan Tetrahedral (Huheey et al., 1993)
Kompleks tetrahedral mempunyai energi pemisahan atau medan ligan sebesar 4/9 Δokathedral (Δo) (Yamamoto, 1986). Karena itu pada kompleks tetrahedral, energi setiap orbital pada eg = -3/5 x 4/9 Δo = -0,27 Δo dan energi setiap orbital pada t2g = +2/5 x 4/9 Δo = +0,18 Δo (Syarifuddin, 1994).
3. Spektrum Elektronik Kompleks Fe(III) dan Ni(II)
Pada senyawa kompleks terdapat tiga jenis transisi elektronik dari ion logam yang memberikan spektrum, yaitu transisi perpindahan muatan (charge transfer), transisi antara orbital pada ligan, dan transisi d-d. Transisi elektronik yang terjadi pada kompleks nikel(II) adalah akibat dari pembelahan tingkat energi pada orbital-orbital d oleh suatu medan ligan. Dalam keadaan ion bebas atau tanpa adanya medan ligan, tolakan elektrostatis antara elektron-elektron yang tidak berpasangan menghasilkan tingkat-tingkat energi yang dinyatakan dengan term symbol 1S, 1D, 1G, 3
xxxi
Gambar 12. Diagram Orgel dan Spektrum Transisi Elektronik untuk Ion d8 (Lee, 1994)
Keadaan dasar 3F mempunyai dua elektron dengan spin sejajar, tetapi keadaan 1
G, 1D dan 1S mempunyai elektron dengan spin berlawanan. Sehingga transisi dari keadaan dasar ke keadaan tereksitasi 1G, 1D dan 1S terlarang dan dapat diabaikan. Keadaan 3F dan 3P merupakan transisi yang diperbolehkan.
Dalam medan oktahedral, keadaan 3P tidak terpecah (splitting) dan ditulis sebagai 3T1g, sedangkan keadaan 3F terpecah menjadi tiga tingkat, yaitu 3T1g, 3T2g, dan 3A2g. Tiga transisi yang mungkin adalah dari 3A2g → 3T2g (F), 3A2g → 3T2g (F), 3
A2g → 3T1g (P), transisi ini tampak sebagai tiga puncak pada spektrum UV-Vis (Lee, 1994). Sebagai contohnya kompleks hijau [Ni(H2O)6]2+ yang mempunyai spektrum elektronik sekitar 1111 nm (9.000 cm-1), 714 nm (14.000 cm-1) dan 400 nm (25.000 cm-1). Apabila pada kompleks [Ni(H2O)6]2+ ditambahkan ligan NH3 sehingga menjadi kompleks violet [Ni(NH3)6]2+, maka spektrum elektroniknya menjadi berada di sekitar 1000 nm (10.000 cm-1), 571 nm (17.500 cm-1) dan 364 nm (27.500 cm-1) (Sharpe, 1992) sebagaimana ditunjukkan oleh gambar 13.
3 A2g 3 T2g 3 T1g (F) 3 T1g (P)
Medan Ligan Bertambah 3
F 3
P Energi
xxxii 3A 2g 3T1g (P ) 3A 2 g 3T1g (F) 3 A2g 3T2g (F) υ/cm-1
Gambar 13. Spektrum Elektronik (a) [Ni(H2O)6]2+ dan (b) [Ni(NH3)6]2+ (Sharpe, 1992)
Transisi elektronik besi(III) dengan konfigurasi elektron d5 pada medan ligan oktahedral ditunjukkan dalam diagram tingkat energi orgel seperti pada tabel 2 dan gambar 14.
Tabel 2. Energi Transisi dan Panjang Gelombang Maksimum Konfigurasi Elektron d5 dalam Medan Ligan Oktahedral (Day and Selbin, 1985)
Transisi Frekuensi (cm-1) λmaks(nm)
6 A1g → 4T1g (G) 18.000 556 6 A1g → 4T2g (G) 23.000 435 6 A1g → 4Eg, 4A1g (G) 24.000-25.000 400-417 6 A1g → 4T2g (D) 28.000 357 6 A1g → 4Eg (D) 29.500 339 4 F 4 D 4 P 4 G 6 S 4 T2 g 4 T1 g 4 A2 g 4 T1 g 4 Eg 4 T2 g 4 Eg, 4A1 g 4 T2 g 4T 1 g 6 A1 g D a er a h M ed a n L ig a n
Gambar 14. Diagram Tingkat Energi Orgel untuk Konfigurasi Elektron d5 dalam
Medan Ligan Oktahedral (Day and Selbin, 1985) log ε
xxxiii
Serapan transisi elektron pada 4F dan 4P tidak terlihat disebabkan energinya jauh lebih besar dibandingkan 4G dan 4D (Miessler et al., 1991). Serapan elektronik yang terjadi pada kompleks [FeCl3(H2O)3]3H2O berupa transisi d-d dan transisi perpindahan muatan. Transisi d-d murni adalah eksitasi pada orbital d. Transisi ini terlarang menurut Laporte karena menghasilkan intensitas yang rendah (absorptivitas molar (ε) mencapai 50 L.mol-1.cm-1) yang terjadi pada daerah panjang gelombang 500-600 nm dengan transisi elektroniknya 6A1g → 4T1g (G). Meskipun terlarang, transisi ini penting untuk menentukan besarnya pembelahan (Δo) orbital d pada medan oktahedral (Lee, 1991). Besarnya energi transisi (10 Dq) dapat dihitung dengan persamaan (1) :
1
. 10 . o hc NA Dq J mol ...(1)keterangan : h = tetapan Planck (6,626.10-34 Js) c = kecepatan cahaya (3.108 ms-1) λ = panjang gelombang maksimum (m) NA = bilangan avogadro (6,023.1023 mol-1)
(Szafran, Pie and Singh, 1991)
Transisi yang menghasilkan pita intensitas rendah namun bukan nol tidak selamanya terlarang. Hal ini disebabkan orbital-orbital yang terlibat sebenarnya tidak mempunyai sifat 3d murni, artinya ada beberapa vibrasi ligan yang menyebabkan sedikit bersifat p tercampur dengan orbital-orbital d, sehingga transisi jenis p d
diperbolehkan dengan ε = 500 L.mol-1.cm-1 (Lee, 1994).
c. Teori Orbital Molekul
Teori orbital molekul didasarkan asumsi bahwa pada pembentukan senyawa kompleks terjadi interaksi kombinasi linear antara orbital-orbital dari atom pusat dengan orbital-orbital dari ligan membentuk orbital molekul. Interaksi antara atom
xxxiv
pusat dengan ligan-ligan merupakan gabungan dari interaksi elektrostatis (ionik) dan interaksi kovalen (Effendy, 2007). Sifat ikatan kovalen pada senyawa kompleks dapat dijelaskan dengan teori orbital molekul.
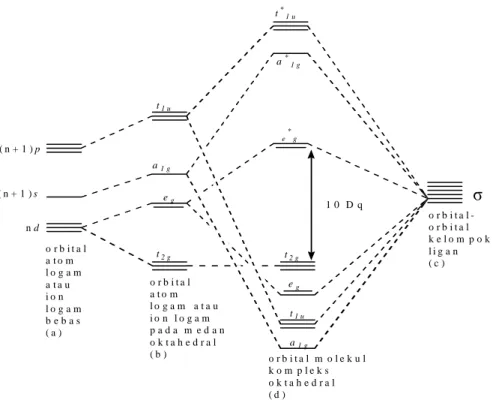
Pada kompleks oktahedral yang digunakan untuk membentuk orbital molekul adalah enam orbital logam (sebagai s, px, py, pz, dz2 dan dx2-y2) dan enam orbital ligan (Sharpe, 1992). Orbital-orbital yang mempunyai energi sama atau hampir sama dapat mengadakan tumpang tindih membentuk orbital molekul bonding dan orbital molekul
antibonding. Tiga orbital d logam t2g (dxy, dxz, dyz) merupakan orbital nonbonding, yang tidak terlibat dalam pembentukan ikatan. Ketiga orbital p membentuk orbital molekul bonding t1u dan orbital molekul antibonding t1u*. Orbital dx2-y2 dan dz2 membentuk orbital molekul bonding e1g dan orbital molekul antibonding e1g*. Orbital
s membentuk orbital molekul bonding a1g dan orbital molekul antibonding a1g* (Huheey et al., 1993). Diagram tingkat energi orbital molekul pada kompleks oktahedral ditunjukkan oleh gambar 15.
t*1 u a*1 g e * g t2 g eg t1 u a1 g ( n + 1 ) p ( n + 1 ) s n d t2 g eg a1 g t1 u o r b i t a l a t o m l o g a m a t a u i o n l o g a m b e b a s ( a ) o r b i t a l a t o m l o g a m a t a u i o n l o g a m p a d a m e d a n o k t a h e d r a l ( b ) o r b i t a l m o l e k u l k o m p l e k s o k t a h e d r a l ( d ) o r b i t a l -o r b i t a l k e l o m p o k l i g a n ( c ) 1 0 D q
Gambar 15. Diagram Tingkat Energi Orbital Molekul Kompleks Oktahedral (Effendy, 2007)
xxxv
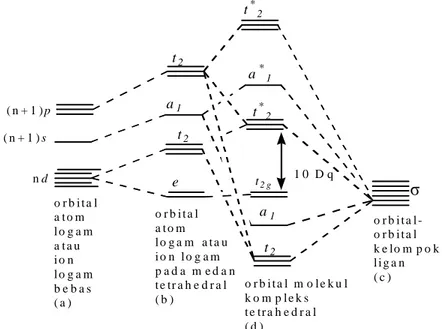
Pada kompleks tetrahedral orbital dz2 dan dx2-y2 merupakan orbital nonbonding yang tidak terlibat pada pembentukan ikatan. Empat orbital ligan yang simetrinya sama dengan orbital logam akan bertumpang tindih. Setiap tumpang tindih orbital dapat membentuk orbital molekul bonding dan orbital molekul nonbonding. Diagram tingkat energi orbital molekul pada kompleks tetrahedral dapat dilihat pada gambar 16. t*2 a*1 t*2 t2 g a1 t2 ( n + 1 ) p ( n + 1 ) s n d e t2 a1 t2 o r b i t a l a t o m l o g a m a t a u i o n l o g a m b e b a s ( a ) o r b i t a l a t o m l o g a m a t a u i o n l o g a m p a d a m e d a n t e tr a h e d r a l ( b ) o r b i t a l m o l e k u l k o m p l e k s t e tr a h e d r a l ( d ) o r b i t a l -o r b i t a l k e lo m p o k l i g a n ( c ) 1 0 D q
Gambar 16. Diagram Tingkat Energi Orbital Molekul Kompleks Tetrahedral (Effendy, 2007)
4. Sifat Magnetik
Sifat magnetik kompleks dibedakan menjadi dua yaitu sifat paramagnetik dan diamagnetik. Kompleks dengan medan ligan lemah menghasilkan pemisahan orbital
d (Δ) yang tidak terlalu besar, sehingga setelah elektron memenuhi orbital d energi
rendah elektron berikutnya akan mengisi orbital d energi tinggi, sehingga elektron cenderung tidak berpasangan. Keadaan ini dinamakan spin tinggi. Kompleks dengan medan ligan kuat menghasilkan pemisahan orbital d yang cukup besar, sehingga elektron cenderung berpasangan. Keadaan ini dinamakan spin rendah yang menimbulkan sifat diamagnetik (Lee, 1994).
xxxvi
Adanya elektron yang tidak berpasangan akan menyebabkan sifat paramagnetik pada senyawa kompleks. Gerakan spin elektron dari orbital d tersebut menimbulkan momen magnet permanen yang bergerak searah dengan medan magnet luar dan menghasilkan nilai kerentanan magnet (Jolly, 1991).
Pada pengukuran dengan neraca kerentanan magnetik, diperoleh harga kerentanan magnetik per gram (Xg), hubungannya dengan kerentanan magnetik molar (XM) ditunjukkan oleh persamaan (2) (Szafran et al., 1991). Harga XM dikoreksi terhadap faktor diamagnetik (XL) dari ion logam dan ligan, sehingga diperoleh harga kerentanan magnetik terkoreksi (XA), yang ditunjukkan oleh persamaan (3).
XM = Xg x Berat Molekul (dalam g mol-1)...(2) XA = XM - ∑XL ...(3)
Tabel 3. Faktor Koreksi Diamagnetik untuk Beberapa Kation, Anion, Atom Netral dan Molekul (10-6 cgs) (Huheey et al., 1993)
No Kation/anion/atom netral/molekul Faktor koreksi (10-6 cgs)
1. Ni2+ -13,00 2. Fe3+ -13,00 3. Cl¯ -23,40 4. NO3¯ -18,90 5. C -6,00 6. H -2,93
7. N (dalam lingkar lima atau enam) -4,61
8. N (amida) -2,11
9. O (aldehid atau keton) -1,73
10. H2O -13,00
Hubungan antara µeff dengan kerentanan magnetik terkoreksi (XA) ditunjukkan oleh persamaan (4) (Szafran et al., 1991).
µeff = 2,828 (XA x T)1/2 BM (Bohr Magneton) ...(4) keterangan : µeff = momen magnet(BM)
xxxvii
Momen magnet logam transisi merupakan paduan dari momen spin dan orbital, akan tetapi pada kebanyakan senyawa kompleks kontribusi orbital hampir dapat diabaikan sehingga momen magnet dapat dihitung berdasarkan momen magnet spin saja, rumus momen magnet yang ditimbulkan oleh spin (spin-only) ditunjukkan pada persamaan (5).
µs = 2[s(s+1)]1/2 BM (Bohr Magneton) ...(5) keterangan : µs = momen magnet yang ditimbulkan oleh spin elektron
s = total spin elektron = ½ x jumlah elektron tidak berpasangan
Hubungan nilai momen magnet suatu senyawa dengan banyaknya elektron yang tidak berpasangan dinyatakan dalam persamaan (6) (Jolly, 1991).
µs = [n(n+2)]1/2 BM (Bohr Magneton) ………..……….(6) keterangan : µs = momen magnetik yang ditimbulkan oleh spin elektron
n = jumlah elektron yang tidak berpasangan
Ion Fe3+ mempunyai konfigurasi elektron d5 sehingga bersifat paramagnetik. Harga momen magnet efektif kompleks besi(III) spin tinggi dengan lima elektron yang tidak berpasangan adalah 5,92 BM sedang pada eksperimen berkisar pada 5,7 – 6,0 BM. Kompleks besi(III) spin rendah mempunyai momen magnetik sebesar 2,0 – 2,5 BM, angka ini lebih besar dibanding dengan hanya melibatkan spin elektron saja yaitu 1,73 BM. Pada Ni2+ mempunyai konfigurasi elektron d8 dengan dua elektron tidak berpasangan sehingga bersifat paramagnetik. Harga momen magnet efektif kompleks nikel(II) adalah 2,80 – 3,50 BM, angka ini lebih besar dibanding dengan hanya melibatkan spin elektron saja yaitu 2,83 BM (Huheey et al., 1993).
5. Daya Hantar Listrik
Daya hantar listrik adalah ukuran seberapa kuat suatu larutan dapat menghantarkan arus listrik. Daya hantar listrik larutan elektrolit dapat dinyatakan sebagai daya hantar listrik molar (molar conductivity) yang didefinisikan sebagai
xxxviii
daya hantar yang ditimbulkan oleh satu mol zat, sesuai persamaan (7) (Kartohadiprodjo, 1990).
C K m
...(7)
keterangan : Λm = hantaran molar (S mol-1 cm2)
K = daya hantar listrik spesifik larutan elektrolit (S cm-1) C = konsentrasi elektrolit (mol cm-3)
Apabila daya hantar spesifik larutan merupakan daya hantar yang sudah terkoreksi (K*) dalam satuan µ S cm-1 maka daya hantar molar larutan elektrolit dapat ditulis seperti pada persamaan (8).
C K m 1000 * ...(8)
keterangan : Λm = hantaran molar (S.mol-1.cm2)
K* = konduktansi = daya hantar listrik spesifik terkoreksi (µ.S.cm-1) = K-K pelarut
C = konsentrasi elektrolit (mol.L-1)
Pada kompleks logam transisi, anion dari sisa asam dapat terkoordinasi pada ion pusat atau tidak terkoordinasi. Dengan membandingkan konduktivitas molar suatu senyawa dengan senyawa ionik yang diketahui molarnya, dapatlah diperkirakan jumlah ion (kation atau anion) yang dihasilkan dalam larutan (Szafran et
al., 1991). Besarnya konduktansi molar beberapa ion dalam air pada suhu kamar
ditunjukkan oleh tabel 4.
Tabel 4. Konduktansi Molar Ion dalam Air pada 25 ºC (Szafran et al., 1991) Jumlah ion Konduktansi molar
(cm-1mol-1Ω-1) 2 3 4 5 118 – 131 235 – 273 408 – 435 ~ 560
xxxix
6. Spektroskopi Infra Merah
Inti-inti atom yang terikat oleh ikatan kovalen mengalami getaran (vibrasi) atau osilasi, dengan cara serupa dengan dua bola yang terikat oleh suatu pegas. Apabila getaran atom - atom tersebut menghasilkan perubahan momen dwikutub, akan terjadi penyerapan radiasi infra merah pada frekuensi yang sama dengan frekuensi vibrasi alamiah molekul tersebut (Pudjaatmaka, 1989).
Gerakan vibrasi suatu molekul ada dua macam yaitu vibrasi ulur (stretching) dan vibrasi tekuk (bending). Vibrasi ulur terdiri atas vibrasi simetri dan antisimetri, sedangkan vibrasi tekuk terdiri atas vibrasi gunting (scissoring), goyang (rocking), kibas (wagging) dan putar (twisting) (Williams and Fleming, 1981).
Frekuensi vibrasi ulur antara dua atom yang berikatan dapat dihitung berdasarkan hukum Hooke seperti dirumuskan dalam persamaan (9) (Kemp, 1987).
2 1 2 1 2 1. )/( ) ( 2 1 m m m m k c
...(9)keterangan : υ = frekuensi (detik-1)
k = tetapan gaya ikatan (Nm-1) m1 dan m2 = massa dua atom (gram)
Dari persamaan (9) terlihat bahwa bilangan gelombang υ berbanding lurus dengan kekuatan ikatan dua atom (k). Sebaliknya bilangan gelombang υ berbanding terbalik dengan massa tereduksi µ, dimana :
2 1 2 1
m
m
m
m
...(10)Keterangan : µ = massa tereduksi (g) m1 dan m2 = massa dua atom (g)
xl
Pirazinamida memiliki gugus koordinasi yang berbeda-beda, sehingga model ikatannya juga berbeda-beda. Dalam berikatan dapat melalui gugus N cincin pyrazine, >C=O, dan atau gugus –NH2nya. Apabila ikatan koordinasinya melalui atom N gugus amino, diharapkan pengurangan yang besar (Δ = 150-220 cm-1) pada bilangan gelombang NH2 stretching, ikatan NH2, dan C-NH2 stretching, dan bila koordinasi terjadi melalui oksigen gugus karbonil maka terjadi pergeseran negatif υ(C=O) dibandingkan ligan bebasnya. Selain itu, bila nitrogen cincin aromatik terlibat ikatan koordinasi, maka akan mempengaruhi model cincinnya (Akyuz et al., 2007). Serapan kuat pada 871 cm-1 dan 685 cm-1 menunjukkan vibrasi kerangka aromatik cincin pirazin yang teramati pada pirazinamida (Tanase et al., 2005).
Serapan N-H pada amida primer memperlihatkan dua pita serapan yang sedang-kuat secara simetris dan asimetris pada 3400 cm-1 dan 3520 cm-1 dalam larutan. Namun dalam cuplikan padat teramati di dekat 3180 cm-1 dan 3350 cm-1 yang disebabkan ikatan hidrogen. Amida sekunder menunjukkan serapan di daerah 3330-3060 cm-1. Uluran C=O pada amida primer memiliki serapan kuat di daerah 1650 cm-1 (dalam padatan) atau di dekat 1690 cm-1 (dalam larutan encer). Pada amida sekunder, serapan karbonil di daerah 1640 cm-1 (dalam padatan) atau di dekat 1690 cm-1 (dalam larutan encer). Sedangkan pada gugus C–N mempunyai serapan di dekat 1400 cm-1 dan gugus C=N di daerah 1689-1471 cm-1. Vibrasi ikatan rangkap C=C aromatik terkonjugasi menunjukkan serapan pada 1650–1600 cm-1 (Hartono dan Purba, 1986).
7. Thermogravimetric/Differential Thermal Analysis (TG/DTA)
Analisis termal didefinisikan sebagai pengukuran sifat fisika dan kimia dari material sebagai fungsi temperatur. Thermogravimetri analysis (TGA) secara otomatis mencatat perubahan berat sampel sebagai fungsi temperatur atau waktu (Susilowati, 2002). Differential Thermal Analysis merupakan teknik yang mengukur perbedaan temperatur antara sampel dan materi pembanding inert sebagai fungsi temperatur jika temperatur keduanya dinaikkan dengan kecepatan sama dan konstan.
xli
Proses yang terjadi pada sampel yaitu eksoterm dan endoterm yang ditampilkan dalam bentuk termogram diferensial (Skoog, Holler and Nieman, 1985).
Dalam termogram diferensial, puncak maksimum menunjukan peristiwa eksoterm dimana panas akan dilepaskan oleh sampel dan puncak minimum menunjukan peristiwa endoterm dimana terjadi penyerapan panas oleh sampel. Salah satu contoh bentuk termogram diferensial adalah termogram ([Cu2(pcp)2 (4,4’-bipy)].5H2O) (pcp = P,P’-diphenylmethylenediphosphinate) (Bataille, Costantino, Luis, Midollini, Orlandini, 2008) seperti yang ditunjukkan pada gambar 17.
Gambar 17. Kurva TG/DTA Kompleks ([Cu2(pcp)2(4,4’-bipy)].5H2O) (Bataille et al., 2008)
Pada gambar 17 menggambarkan bahwa pada suhu 25-80 ºC kompleks ([Cu2(pcp)2(4,4’-bipy)].5H2O) kehilangan massa 7,8 % yang sebanding dengan lepasnya 4 molekul H2O (teori 8,2 %). Pada suhu 80-260 ºC menunjukkan pembentukan ([Cu2(pcp)2(4,4’-bipy)].H2O). Kemudian kehilangan massa 19 % terjadi pada suhu 260-340 ºC yang sebanding dengan hilangnya sebuah molekul air dan ligan 4,4’-bipy (teori 19,8 %). Kehilangan massa ketiga dan keempat sebesar 30 % terjadi pada suhu 340-800 ºC yang merupakan pembakaran karbon dan hidrogen dari gugus phosphinate dengan pembentukan campuran tembaga oksida dan tembaga pirofosfat, hal ini didukung dengan puncak eksotermis yang kuat pada kurva DTA dan data difraksi sinar-X (Bataille et al., 2008).
xlii 8. Pirazinamida
Pirazinamida merupakan turunan dari pirazin yang analog dengan nicotinamida, berupa serbuk kristal berwarna putih, stabil pada suhu ruangan dan larut dalam kloroform, metil klorida, sedikit larut dalam benzena dan sangat larut dalam air. Nama kimia pirazinamida adalah pyrazinecarboxamide, sedangkan nama lainnya antara lain pyrazinoic acid amide, pyrazine carboxylamide, Pezetamida (Hefa-Frenon), Pirafat (Fatol), Pirilena (Cassenne), Piraldina (Bracco), Tebrazida (Searle), Unipiranamida (Unichem), Zinamida(Merck & Co.), 2-Carbamyl pyrazine,
2-Pyrazinecarboxamide, Pyrazine-2-carboxamide. Formula kimia pirazinamida
adalah C5H5N3O dengan berat molekulnya 123,11 g.mol-1, memiliki titik leleh 192 ºC (Handbook of Anti-Tuberculosis Agents, 2008).
Pirazinamida merupakan turunan dari pirazin yang mampu bergabung dengan senyawa lain membentuk senyawa polisiklis dengan struktur yang berguna dalam bidang farmasi dan parfum. Pirazin sendiri merupakan komponen folat (pada vitamin B) dan cincin isoalloxazin pada inti flavin. Pirazin dan turunan senyawa polisiklisnya digunakan dalam industri parfum dan flavouring, obat, dan biologi. Pirazinamida biasa digunakan sebagai obat antituberkulosis.
B. Kerangka Pemikiran
Senyawa kompleks akan terbentuk jika terjadi ikatan kovalen koordinasi antara ion logam yang mempunyai orbital kosong dengan ligan yang merupakan pendonor elektron. Besi(III) dan nikel(II) dapat menyediakan orbital kosong untuk membentuk senyawa kompleks. Pirazinamida mempunyai atom donor lebih dari satu yaitu atom O pada gugus karbonil, atom N amida dan dua atom N pada cincin pirazinnya, sehingga ikatan koordinasi dengan Fe(III) dan Ni(II) dalam berbagai kemungkinan. Sebagaimana pada kompleks ([Cu(iminodiacetato)(pyrazine-2-carboxamide)(H2O)].H2O) (Blanco et al., 2003) atom N cincin pirazin dari
pyrazine-2-carboxamide terkoordinasi pada Cu(II). Pada kompleks {[Cu(2-pyrazine
xliii
dan atom N cincin pirazin dari ligan 2-pyrazine carboxamide terkoordinasi pada Cu(II). Kemungkinan ikatan koordinasi antara pirazinamida dengan Fe3+ dan Ni2+ ditunjukkan oleh gambar 18.
N N C O NH2 N N C O NH2 N N C O NH2 N N C O NH2 N N C O NH2 N N C O NH2 N N C O NH2 N N C O NH2 N N C O NH2 N N C O NH2 Fe3+ Ni2+ Ni2+ Fe3+ Fe3+ Ni2+ N N C O NH2 N N C O NH2 Fe3+ Ni2+
Gambar 18. Beberapa Kemungkinan Koordinasi Pirazinamida pada Atom Pusat Fe(III) dan Ni(II)
Gugus amida pada pirazinamida mampu melakukan resonansi sehingga ikatan pada ikatan karbon-nitrogen menjadi terbatas. Penumbang dipolar sangat penting sehingga ikatan C-N berperilaku seperti ikatan rangkap. Akibatnya, atom N dan C pada C=O dan dua atom yang melekat pada masing-masing atom tersebut terletak pada bidang yang sama dan rotasi pada C-N terbatas.
O C N R H H O C N+ R H H
..
Sebagai penyumbang resonansi dipolar, gugus amida ini sangat polar dan membentuk ikatan hidrogen yang kuat. Elektronegatifan atom O yang cukup besar (3,5) daripada atom N (3,0) serta adanya awan elektron pada cincin pirazinnya, memungkinkan koordinasi dengan ion pusat melalui salah satu atau kedua atom ini.
xliv
Secara umum kompleks Fe(III) mempunyai struktur oktahedral dan kompleks Ni(II) dapat berstruktur oktahedral, bujur sangkar atau tetrahedral. Dalam kompleks Ni(II), ligan kuat yang terkoordinasi pada ion pusat dan mampu melakukan pendonoran elektron lebih baik, cenderung memilih struktur bujur sangkar daripada oktahedral.
Serapan spektrum elektronik dapat menandai terbentuknya kompleks dan geometri yang terbentuk melalui besarnya transisi elektronik dari keadaan dasar ke keadaan eksitasi. Kompleks Fe(III) dengan konfigurasi elektron d5 berstruktur oktahedral menunjukkan beberapa puncak transisi pada daerah 300–600 nm atau 18.000–30.000 cm-1. Struktur oktahedral Ni(II) dengan dua elektron tidak berpasangan ditandai dengan tiga puncak di sekitar 400-1000 nm dengan intensitas tinggi, namun yang teramati dengan spektrofotometer UV-Vis biasanya hanya dua puncak saja.
Besi(III) dengan konfigurasi elektron d5 dapat membentuk kompleks berspin tinggi dengan lima elektronnya tidak berpasangan, mempunyai harga momen magnet
spin-only (µs) sebesar 5,92 BM atau berspin rendah dengan sebuah elektron yang tidak berpasangan memiliki harga momen magnet spin-only (µs) sebesar 1,73 BM dan keduanya bersifat paramagnetik. Sedangkan kompleks nikel(II) paramagnetik cenderung menjadikan dua elektronnya (d8) tidak berpasangan dengan harga momen magnet spin-only (µs) sebesar 2,83 BM.
C. Hipotesis
1. Besi(III) dan nikel(II) dapat membentuk kompleks dengan pirazinamida.
2. Formula kompleks yang mungkin terbentuk adalah Ni(pirazinamida)m(NO3)2.nH2O dan Fe(pirazinamida)mCl3.nH2O dengan m = 1, 2, 3, 4, 5, atau 6 dan n = 0, 1, 2, 3, 4 atau 5.
3. Kompleks yang terbentuk diperkirakan memiliki karakteristik antara lain: a. Mengalami pergeseran spektrum elektronik.
xlv
b. Kompleks Fe(III)-pirazinamida bersifat paramagnetik dengan harga µeff berkisar 1,73 atau 5,92 BM dan kompleks Ni(II)-pirazinamida bersifat paramagnetik juga dengan harga µeff berkisar 2,83 BM.
c. Atom O pada gugus karbonil (C=O) dan atom N cincin pirazin mempunyai kecenderungan besar terkoordinasi pada ion pusat.
xlvi BAB III
METODOLOGI PENELITIAN
A. Metode Penelitian
Metode yang dilakukan dalam sintesis kompleks ini adalah metode eksperimen. Cara sintesis kompleks mengacu pada Cakir et al.,2006. Terbentuknya kompleks ditandai dengan adanya pergeseran spektrum UV-Vis dan pergeseran spektrum infra merah. Formula kompleks diperkirakan dari pengukuran kadar besi(III) dan nikel(II) dalam kompleks dengan spektrofotometer serapan atom (SSA), pengukuran daya hantar listrik (DHL) dengan konduktivitimeter dan analisis termal dengan TG/DTA. Sifat kompleks ditentukan dari pengukuran spektrum UV-Vis, spektrum infra merah, dan sifat kemagnetannya.
B Tempat dan Waktu Penelitian
Penelitian dilakukan selama enam bulan yaitu bulan Oktober 2008 sampai dengan Maret 2009 :
1. Sintesis kompleks dilakukan di Laboratorium Kimia Fakultas MIPA Universitas Sebelas Maret Surakarta.
2. Pengukuran kadar logam, daya hantar listrik, spektrum elektronik, dan momen magnet dilakukan di Laboratorium Pusat MIPA Sub-Lab Kimia Universitas Sebelas Maret Surakarta.
3. Pengukuran spektrum infra merah dilakukan di Laboratorium Kimia Organik Fakultas Kimia Universitas Gajah Mada Yogyakarta.
4. Analisis TG/DTA dilakukan di Laboratorium Uji Polimer Pusat Penelitian Fisika (P2F) LIPI Bandung.
C. Alat dan Bahan 1. Alat
a. Spektrofotometer serapan atom (SSA) Shimadzu AA-6650 b. Spektrofotometer UV-Vis Double Beam Shimadzu 1601
xlvii c. Spektrofotometer FTIR Prestige 21
d. Thermogravimetric/Differential Thermal Analyzer 200 Seiko SSC 5200H e. Magnetic Susceptibility Balance (MSB) Auto Sherwood Scientific 10169 f. Konduktivitimeter Jenway CE 4071
g. Neraca analitik Shimadzu AEL-200 h. Pemanas listrik Cimarec Thermolyne
i. Pengaduk magnetik Heidholp M1000 Germany j. Peralatan gelas
k. Termometer 100 ºC
2. Bahan-bahan
Semua bahan kimia yang digunakan dalam penelitian ini mempunyai derajat kemurnian pro analisis (pa) :
a. Ni(NO3)2.6H2O (Merck) b. FeCl3.6H2O (Merck)
c. Pirazinamida (PT. Kimia Farma-Linaria) d. Asam nitrat (HNO3) 65% (Merck) e. Asam klorida (HCl) 37% (Merck) f. KBr kering (Merck) g. Metanol (Merck) h. Etanol (Merck) i. Akuades j. Kertas saring D. Prosedur Penelitian 1. Sintesis Kompleks
a. Sintesis Kompleks Fe(III) dengan Pirazinamida
Larutan FeCl3.6H2O (1,081 g; 4 mmol) dalam akuades (10 ml) ditambahkan ke dalam larutan pirazinamida (0,492 g; 4 mmol) dalam akuades (15 ml) pada suhu 55 ºC lalu diaduk konstan selama ± 3 jam. Larutan kemudian dipekatkan sampai
xlviii
volume ± 10 ml kemudian dibiarkan selama ± 48 jam dan diperoleh endapan berwarna jingga kemerahan. Endapan ini kemudian direkristalisasi, dicuci dengan etanol dan didiamkan pada suhu kamar. Endapan berwarna jingga kemerahan (0,9308 g; 90,12%) ini diperkirakan kompleks Fe(III)-pirazinamida.
b. Sintesis Kompleks Ni(II) dengan Pirazinamida
Larutan Ni(NO3)2.6H2O (1,163 g; 4 mmol) dalam aquades (10 ml) ditambahkan ke dalam larutan pirazinamida (0,492 g, 4 mmol) dalam aquades (15 ml) pada suhu 55 ºC lalu diaduk konstan selama ± 3 jam. Larutan kemudian dipekatkan sampai volume ± 10 ml dan dibiarkan selama ± 48 jam hingga terbentuk endapan hijau muda. Endapan ini kemudian direkristalisasi, dicuci dengan etanol dan didiamkan pada suhu kamar. Endapan berwarna hijau muda (0,8420 g; 69,21 %) ini diperkirakan kompleks Ni(II)-pirazinamida.
2. Penentuan Kadar Besi dan Nikel
Kadar besi diukur dengan spektrofotometer serapan atom (SSA) pada panjang gelombang maksimum λmax 248,28 nm. Larutan standar induk dibuat dengan melarutkan FeCl3.6H2O dalam HCl 0,1 N sehingga diperoleh standar Fe3+ 1000 ppm, kemudian dibuat larutan standar Fe3+ 50 ppm. Konsentrasi larutan standar untuk pengukuran dibuat pada konsentrasi 0,1, 2, 3, 4 dan 5 ppm yang diambil dari larutan standar 50 ppm, kemudian diukur absorbansinya dan dibuat kurva standar. Larutan sampel dalam HCl 0,1 N dibuat dengan konsentrasi tidak lebih dari 5 ppm, diukur absorbansinya kemudian diplotkan pada kurva standar.
Pengukuran kadar nikel diukur dengan spektrofotometer serapan atom (SSA) pada panjang gelombang maksimum λmax 232 nm. Larutan standar induk dibuat dengan melarutkan Ni(NO3)2.6H2O dalam HNO3 0,5 N sehingga diperoleh standar Ni2+ 1000 ppm, kemudian dibuat larutan standar Ni2+ 50 ppm dalam 0,1 N HNO3. Konsentrasi larutan standar untuk pengukuran dibuat pada konsentrasi 0,1, 2, 3, 4 dan 5 ppm yang diambil dari larutan standar 50 ppm, kemudian diukur absorbansinya dan
xlix
dibuat kurva standar. Larutan sampel dalam HNO3 0,1 N dibuat dengan konsentrasi tidak lebih dari 5 ppm, diukur absorbansinya kemudian diplotkan pada kurva standar.
3. Pengukuran Daya Hantar Listrik (DHL)
Sampel dan standar dilarutkan dalam akuades dan dibuat pada konsentrasi kurang lebih sama (10-3 M), kemudian masing-masing larutan diukur daya hantar listriknya dengan konduktivitimeter (setiap pengukuran dikoreksi terhadap nilai daya hantar spesifik pelarut, kpelarut).
4.Analisis TG/DTA
Analisis termal dilakukan dengan Thermografimetric Analyzer (TGA) yang mencatat perubahan berat sampel sebagai fungsi temperatur dan Differential Thermal
Analyzer (DTA) untuk identifikasi adanya molekul H2O dalam senyawa kompleks dengan mendeteksi perubahan pada kandungan panasnya. Analisis ini dilakukan pada suhu 30-575 °C. Sampel kompleks yang diukur sekitar 5-10 mg dan ditempatkan pada perangkat sampel TG/DTA.
5. Pengukuran Momen Magnet
Sampel senyawa kompleks padat yang akan ditentukan harga momen magnetnya dimasukkan ke dalam tabung kosong pada neraca kerentanan magnetik, lalu diukur tinggi sampel dalam tabung minimal 1,5 cm dan beratnya antara 0,001 – 0,999 gram. Hasil pengukuran akan diperoleh harga kerentanan magnetik per gram atom (χg) yang kemudian diubah menjadi kerentanan magnetik molar (χM) dan dikoreksi terhadap faktor diamagnetik (χL), sehingga didapatkan nilai kerentanan magnetik terkoreksi (χA). Dari harga χA dapat dihitung momen magnet efektifnya.
6. Pengukuran Spektrum Infra Merah
Masing-masing sampel senyawa kompleks dan ligan pirazinamida (1 mg) dibuat pelet menggunakan KBr kering (300 mg). Masing-masing pelet dibuat
l
spektrumnya dengan menggunakan Spektrofotometer FTIR pada daerah 4000-400 cm-1.
7. Pengukuran Spektrum Elektronik
Sampel dan standar dilarutkan dalam metanol dengan konsentrasi 10-2 M sampai 10-4 M, kemudian diukur spektrum elektroniknya dengan spektrofotometer
UV-Vis. Pengukuran spektrum elektronik dilakukan pada daerah 300 nm – 800 nm.
Serapan diamati pada absorbansi yang sesuai dengan panjang gelombang maksimum dengan spektrofotometer UV-Vis.
E. Teknik Pengumpulan dan Analisis Data
Data hasil pengamatan diolah secara deskriptif non statistik. Indikasi terbentuknya kompleks besi(III) dan nikel(II) dengan pirazinamida ditandai dengan pergeseran panjang gelombang spektrum elektronik UV-Vis dari FeCl3.6H2O dan Ni(NO3)2.6H2O. Formula kompleks diperkirakan dari hasil analisis SSA yaitu kadar logam Ni dan Fe hasil eksperiemen ini dibandingkan dengan yang persentasenya mendekati perhitungan secara teoritis, hasil pengukuran daya hantar listrik yang menunjukkan jumlah muatan ion dalam kompleks dan analisis TG/DTA. Sifat magnetik kompleks ditentukan dengan pengukuran nilai momen magnet menggunakan MSB. Besarnya energi transisi pada kompleks diketahui dari spektrum elektronik UV-Vis. Gugus fungsi ligan yang terkoordinasi pada ion pusat diperkirakan dari pergeseran spektrum infra merah.
![Gambar 2. Struktur Molekul [Cu(IDA)(pza)(H 2 O)].H 2 O (Blanco et al., 2003) Selain itu juga telah disintesis kompleks {[Cu(pzca)(CH 3 CN) 3 ](ClO 4 ) 2 .H 2 O}n (pzca = 2-pyrazine carboxamide), dalam kompleks tersebut atom O gugus karbonil da](https://thumb-ap.123doks.com/thumbv2/123dok/4275839.2890120/19.918.299.686.271.458/struktur-molekul-disintesis-kompleks-pyrazine-carboxamide-kompleks-tersebut.webp)
![Gambar 5. Kompleks [Ni(2A-4Mpy)(dipicolinate)(H 2 O) 2 ].2H 2 O (Bulut et al., 2009)](https://thumb-ap.123doks.com/thumbv2/123dok/4275839.2890120/24.918.289.677.859.1020/gambar-kompleks-ni-a-mpy-dipicolinate-h-bulut.webp)
![Gambar 7. Ikatan Koordinasi pada Kompleks ([Ni(2A-4Mpy)(dipicolinate)(H 2 O) 2 ].](https://thumb-ap.123doks.com/thumbv2/123dok/4275839.2890120/26.918.231.733.476.662/gambar-ikatan-koordinasi-pada-kompleks-ni-mpy-dipicolinate.webp)
![Gambar 8. Ikatan pada Ion Kompleks [FeCl 6 ] 3- (Effendy, 2007)](https://thumb-ap.123doks.com/thumbv2/123dok/4275839.2890120/27.918.233.729.166.386/gambar-ikatan-pada-ion-kompleks-fecl-effendy.webp)