SINTESIS DAN KARAKTERISASI KOMPLEKS BINUKLIR
HOFMANN-LIKE NETWORK BESI(II) - NIKEL(II) DENGAN
SIANIDA DAN ETILENDIAMIN
Yusi Deawati
1, Firman Syamsul Bahtiar
2dan Juliandri
31,2,3Jurusan Kimia, FMIPA, Universitas Padjadjaran, Jl. Raya Bandung-Sumedang Km. 21 Jatinangor,
Sumedang, 45363, yusi_dea@unpad.ac.id
ABSTRAK
SINTESIS DAN KARAKTERISASI KOMPLEKS BINUKLIR HOFMANN-LIKE NETWORK BESI(II) - NIKEL(II) DENGAN SIANIDA DAN ETILENDIAMIN. Senyawa kompleks binuklir Hofmann like-network merupakan suatu senyawa yang memiliki dua sifat magnet, yaitu: high spin dan low spin dalam kondisi yang berbeda pada satu senyawa sekaligus. Keadaan transisi spin dari high spin ke low spin atau sebaliknya memiliki jalur hyteresis loop yang berbeda. Semakin lebar hysteresis loop pada senyawa kompleks binuklir maka akan semakin baik kemampuannya dalam menyimpan memori seperti dalam random access memory (RAM) pada PC. Tujuan dari penelitian ini adalah mensintesis senyawa besi(II) - nikel(II) dengan ligan sianida dan etilendiamin serta menentukan sifat-sifat senyawa kompleks yang terbentuk. Sintesis kompleks besi(II) - nikel(II) dengan ligan sianida dan etilendiamin ini dilakukan dengan cara mereaksikan tris-etilendiaminbesi(II) sulfat dengan kalium tetrasianonikelat(II) dalam pelarut air menggunakan nitrogen Schlenk manifold dalam suasana bebas oksigen. Penelitian ini menghasilkan kompleks binuklir Hofmann-like network besi(II)-nikel(II)-sianida-etilendiamin yang berwarna hitam-kehijauan sebanyak 0,64685 g. Setelah dilakukan uji kelarutan dengan beberapa pelarut, penentuan kemagnetan dengan MSB, dan penentuan komposisi molekul padatan kompleks dengan SEM-EDX, diketahui bahwa kedua kompleks hanya larut sempurna dalam akuaregia 12 M, bersifat paramagnetik pada suhu ruang, dan telah terbentuk ikatan binuklir antara besi(II) dan nikel(II) dengan sianida sebagai ligan yang menjembatani kedua inti tersebut. Hasil karakterisasi menggunakan spektrofotometer UV-tampak dan FTIR menunjukkan bahwa kompleks
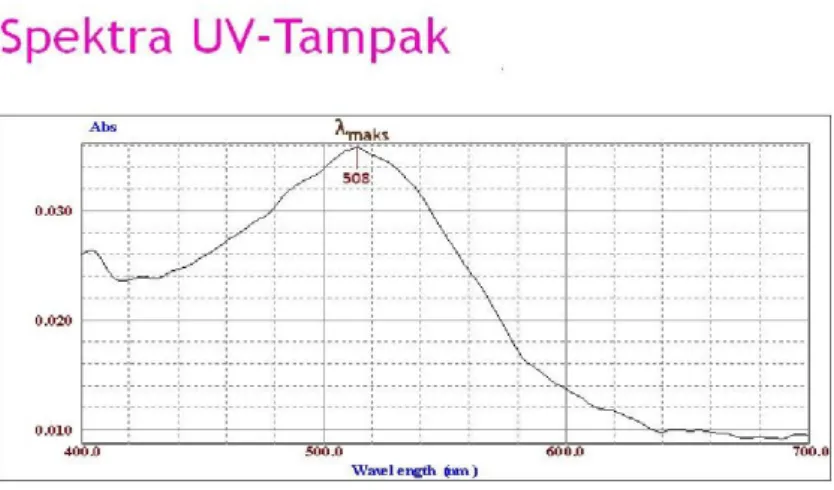
memiliki serapan maksimum pada maks sebesar 508 nm dan mengandung serapan N-H dari
etilendiamin, O-H dari molekul H2O, C-H sp3 dari etilendiamin, dan CN dari serapan Ni-CN.
Kata kunci: hysteresis loop, kompleks binuklir, transisi spin, nitrogen Schlenk manifold
ABSTRAK
SYNTHESIS AND CHARACTERIZATION OF HOFMANN-LIKE NETWORK BINUCLEAR COMPLEX OF IRON(II) - NICKEL(II) WITH CYANIDE AND ETHYLENEDIAMINE. Binuclear complexes of Hofmann-like network are compound that have two magnetic characteristics high and low spin in different conditions on one compound at once. The state of transition spin of the high to low spin or otherwise have path hyteresis loop different. Even wider of the hysteresis loop in binuclear complexes then will be better his ability to keep memories such as in random access memory (RAM) on PC. The purposes of this research are synthesis compounds of iron(II)-nickel(II) with cyanide and ethylenediamine ligands and determining the properties complex compounds formed. Synthesis of complexes of iron(II)-nickel(II) with cyanide and ethylenediamine ligands were done by way of reacting tris-ethylenediamineiron(II) sulphate with potassium tetrasianonickelat(II) in aquades solvent uses Nitrogen Schlenk Manifold in an atmosphere free of oxygen. This research resulted in Hofmann-like network binuclear complex of iron(II)-nickel(II)-cyanide-ethylenediamine are black-greenish colored. After test solubility was done with some solvent solubility, determination of magnetization with MSB, and determination of molecular composition of complex solids with SEM-EDAX, note that the complex is only soluble in aquaregia 12 M, paramagnetic at room temperature, and have formed a binuclear bond between iron(II) and nickel(II) with a cyanide ligand as a bridging two core samples.
Characterization of the results using UV-visible spectrophotometer and FTIR indicated that the complex has a maximum absorption at max of 508 nm and containing N-H absorption of
ethylenediamine, O-H from H2O molecules, C-H sp3 from ethylenediamine, and CN absorption of
Ni-CN.
Key words: hysteresis loop, binuclear complexes, transition spin, Nitrogen Schlenk Manifold
1. PENDAHULUAN
Senyawa kompleks binuklir telah banyak diteliti dan dikembangkan pada tahun 1930-an. Keunikan senyawa ini dapat membentuk transisi spin (TS) dari keadaan high spin ke low spin ataupun sebaliknya akan memiliki sifat kemagnetan yang lebih tajam, serta penggunaanya lebih luas, terutama untuk komponen dalam memori komputer. Semakin lebar hysteresis loop pada senyawa kompleks binuklir maka akan semakin baik kemampuanya dalam menyimpan memori.
Kitazawa et al melaporkan gabungan
senyawa kompleks besi(II) dan piridin, suatu ligan monodentat, dengan senyawa kompleks Ni(II) membentuk polimer kompleks bimetal
Hofmann-like network yang dibuktikan dari
difraksi sinar x kristal tunggal kompleks tersebut [1].
Penelitian ini dilakukan dengan mereaksikan kalium tetrasianonikelat(II), K2[Ni(CN)4] dan kompleks
tris-etilendiaminbesi(II) sulfat [Fe(en)3]SO4.
Penelitian mengenai sintesis kompleks binuklir besi(II)-nikel(II) dengan ligan sianida dilakukan untuk pengembangan senyawa kompleks binuklir hofmann like-network yang berpotensi memiliki sifat transisi spin.
2. FENOMENA TRANSISI SPIN
Fenomena transisi spin (TS) pada ion besi(II) pertama kali ditemukan pada kompleks [Fe(phen)2(NCS)2] (phen=1,10-fenantrolin)
tahun 1964 oleh Baker dan Bobonich [2]. Selanjutnya penelitian transisi spin terus berkembang hingga saat ini untuk menemukan aplikasi sifat magnet yang lebih tajam sehingga akan lebih efektif dan efisien penggunaanya pada bidang elektronika.
Pengembangan saklar molekular yang mampu menyimpan dan memindahkan informasi saat ini menjadi kajian yang menarik dalam sains molekul. Kompleks besi(II) sangat potensial dijadikan saklar molekular karena mengalami transisi spin (TS) atau perubahan
secara dapat-balik dari suatu keadaan spin rendah (low spin, LS) diamagnetik ke keadaan spin tinggi (high spin, HS) paramagnetik melalui induksi suhu, tekanan, penyinaran dan medan magnet [3].
Sebagai konsekuensi splitting energi orbital d pada t2g dan eg dengan adanya pengaruh ligan,
kompleks oktahedral ion logam transisi tertentu, terutama pada deret transisi pertama dengan konfigurasi d4 sampai d7, dapat berada dalam
dua keadaan, yaitu spin tinggi (HS) atau spin rendah (LS), tergantung dari kecenderungan pengaruh kuat ligan terhadap ion logam. Dalam pengaruh ligan lemah, keadaan dasar adalah HS, paramagnetik, dimana multiplisitas spin adalah maksimum, elektron d terdistribusi pada t2g dan
eg, sedangkan pengaruh ligan kuat menstabilkan
keadaan LS, diamagnetik, dengan multiplisitas minimum, elektron-elektron pada t2g menjadi
sempurna dipasangkan sebelum sempat ditambahkan ke eg [4].
Untuk ion d6 besi(II), dua keadaan spin ini
terlihat sangat tajam. Sebagai contoh adalah ilustrasi [Fe(H2O)6]2+, dimana dengan pengaruh
ligan yang lemah, konfigurasi elektron menjadi t2g4eg2, sehingga kompleks tersebut memiliki
empat elektron tak berpasangan dan bersifat paramagnetik (keadaan 5T
2g dalam simetri
oktahedral). Pengaruh ligan yang kuat seperti pada [Fe(CN)6]4- menyebabkan konfigurasi
elektron adalah t2g6eg0 dimana seluruh elektron
berpasangan pada t2g sehingga tidak ada elektron
bebas dan bersifat diamagnetik (keadaan 1A 1g).
Ini dapat dilihat pada Gambar 1.
Gambar 1. Konfigurasi elektron ion besi(II) d6
oktahedral, dalam keadaan HS dan LS. Δ adalah parameter pengaruh ligan dan P diartikan sebagai energi pasangan-spin [4].
Perilaku konversi spin telah mendorong banyak penelitian karena transisi orde pertama dan thermal hysteresis dapat memberikan efek
potential memory. Terjadi perubahan ukuran dan
bentuk molekul seiring perubahan kedua tingkat spin. Perubahan struktur ini sesuai dengan transfer elektron dari dua elektron antara orbital eg dan t2g yang menyertai konversi spin.
Kemudian perubahan perilaku dapat dianggap sebanding dengan pengukuran transmisi selama perubahan terjadi, melalui interaksi intermolekul, dalam keseluruhan molekul kristal. Kemudian, sintesis polimer koordinasi 1D (satu dimensi), 2D (dua dimensi), dan 3D (tiga dimensi) telah menjadi jalan alternatif untuk menyelidiki perilaku magnet sebagai gaya intermolekul sulit dikontrol [5].
2.1 Senyawa Kompleks Besi(II) Berinti Tunggal
Kompleks besi(II) berinti tunggal lainnya dengan struktur yang lebih rumit telah sangat
banyak dilaporkan, seperti
{Fe[H2B(pz)2]2L}([H2B(pz)2]–,
dihidrobis(pira-zolil)borat, dengan L= bipy dan phen;15
[Fe{(pz)3CH}2][ClO4]2; dengan pz= pirazin;2
[FeL2]X2 (L= 2,6-dipirazol-1-ilpirazin [L2H], 2,6-bis{3-metilpirazol-1-il}pirazin [L2Me], 2,6-bis{3,5-dimetilpirazol-1-il}pirazin [L2Me 2] atau 2,6-bis{3-[2,4,6-trimetilfenil]pirazol-1-il}pirazin [L2Mes]; X–= BF 4– atau ClO4–) [6].
2.2 Senyawa Kompleks Besi(II) Berinti Ganda
Kompleks dengan satu ion logam pusat dikenal sebagai kompleks inti tunggal (mononuklir). Penelitian kompleks terus berkembang dari kompleks inti tunggal mengarah pada kompleks yang dikenal sebagai kompleks berinti ganda (binuklir). Pembentukan kompleks berinti ganda memerlukan ligan jembatan yang dapat menghubungkan ion logam pusat yang satu dengan yang lainnya [7].
Desain dan sintesis senyawa berinti banyak merupakan strategi alternatif untuk menemukan kooperativitas. Lebih jauh lagi, korelasi antara karakter spin crossover dengan banyaknya inti telah diteliti. Sehubungan dengan itu, maka banyak dilakukan strategi dengan ide menggabungkan dua sifat elektron yang berbeda seperti pertukaran magnet dan spin crossover dalam molekul yang sama, dimana telah direalisasikan oleh Kahn dan dilanjutkan oleh Real et al. pada pertengahan tahun 1980-an.
Pekerjaan ini berdasarkan pada senyawa besi(II) berjembatan 2,2’-bipirimidin.
3. BAHAN, ALAT, DAN METODE
Penelitian meggunakan bahan-bahan dan metode-metode yang dijelaskan berikut ini. 3.1 Bahan
Penelitian ini menggunakan bahan-bahan, yaitu: akuades, H2O(l); akuaregia(aq); asam
klorida, HCl(aq); asam nitrat, HNO3 (aq); aseton;
barium(II) klorida dihidrat, BaCl2.2H2O(s);
besi(II) sulfat heptahidrat, FeSO4.7H2O(s);
tris-etilendiaminbesi(II) sulfat, [Fe(en)3]SO4(s);
difosforpentoksida, P4O10. xH2O; etanol,
C2H5OH(aq); etilendiamin, C2H8N2(aq); kalium
bromida, KBr(s); kalium sianida, KCN;
n-heksana, C6H14(aq), nikel(II) sulfat heksahidrat,
NiSO4.6H2O(s); nitrogen, N2(g); propanol,
C3H7OH(aq); dan kalium tetrasianonikelat(II),
K2[Ni(CN)4](s).
3.2 Alat
Alat-alat yang digunakan dalam penelitian ini terdiri atas alat-alat gelas yang umum dipakai di laboratorium seperti botol coklat, botol bening, corong saring, gelas kimia, gelas ukur, kaca masir. Digunakan pula alat khusus untuk suasana bebas oksigen, yaitu: nitrogen manifold
Schlenk, dan rubber septum.
Untuk mengkarakterisasi kompleks besi(II)-nikel(II) yang terbentuk dilakukan menggunakan spektrofotometer UV-tampak, spektrofotometer inframerah, SEM-EDX, uji kelarutan dan penentuan sifat magnet menggunakan MSB.
3.3 Metode
Metode penelitian ini terdiri atas pembuatan reagen, pembuatan pelarut bebas oksigen, pembuatan senyawa kompleks binuklir dan karakterisasinya.
3.3.1 Pembuatan Reagen Kalium Tetrasiano-nikelat(II), K2[Ni(CN)4]
Sebanyak 15 gram nikel(II)sulfat heksahidrat dilarutkan dalam 20 mL akuades dalam gelas kimia sambil diaduk menggunakan
magnetic stirrer sampai terbentuk larutan
sianida sebanyak 7,5 g yang telah dilarutkan dalam 15 mL akuades dalam gelas kimia yang lain hingga larutan berubah warna menjadi biru muda, yaitu larutan nikel(II) disianida. Endapan yang didapat disaring dengan corong Buchner lalu dicuci dengan etanol : akuades (1:1) sebanyak 10 mL dan aseton 5 mL. Kemudian endapan dikeringkan dalam eksikator. Endapan yang sudah kering ditambahkan 7,5 g kalium sianida dalam 10 mL akuades panas (larutan induk). Setelah larut ditambahkan akuades 5 mL. Larutan dipanaskan sampai 80oC selama 30
menit. Penambahan larutan kalium sianida diulangi untuk mendapatkan kristal yang lebih banyak dari larutan induk. Setelah kristal terbentuk disaring dengan corong Buchner menggunakan kaca masir dan dicuci dengan aseton. Kristal dikeringkan di dalam eksikator. 3.3.2 Pembuatan Reagen tris-Etilendiamin
besi(II) Sulfat, [Fe(en)3]SO4
Sebanyak 5 g besi(II)sulfat heptahidrat dimasukkan ke dalam botol coklat lalu dideoksigenasi selama lima belas menit dalam
nitrogen manifold Schlenk. Kemudian dilarutkan
dengan 10 mL akuades dengan suntikan. Larutan diaduk dengan magnetic stirrer sampai larut sempurna dan ditambahkan 15 mL etilendiamin sambil diaduk dengan konstan. Larutan dibiarkan selama satu hari hingga endapan berwarna cokelat terbentuk. Endapan ini disaring menggunakan kaca masir, dicuci dengan akuades dan dikeringkan dalam desikator. Filtrat yang berwarna coklat kembali disaring dengan menggunakan kertas saring, dicuci dengan akuades dan dikeringkan dalam desikator.
3.3.3 Pembuatan Kompleks Binuklir Besi(II) - Nikel(II)
Padatan tris-etilendiaminbesi(II) sulfat ditimbang sebanyak 0,9983 g lalu dimasukkan ke dalam botol vial berbeda yang sebelumnya telah ditimbang. Kemudian padatan ini dideoksigenasi dalam nitrogen manifold Schlenk selama 15 menit dan dilarutkan dalam 1,5 mL akuades bebas oksigen. Lalu ke dalam botol vial yang lain ditimbang padatan kalium tetrasianonikelat(II) sebanyak 0,3627 g yang kemudian dideoksigenasi pula selama 15 menit dan dilarutkan dalam 1,5 mL akuades bebas oksigen. Selanjutnya kedua larutan dicampurkan dan diaduk dengan magnetic stirrer sampai terbentuk endapan kompleks berwarna hitam-kehijauan. Endapan dicuci dengan air sebanyak 5 mL kemudian disaring dan dikeringkan. Didapatkan endapan kering sebanyak 0,6469 g 3.3.4 Karakterisasi Kompleks
Kompleks binuklir besi(II)-nikel(II) yang terbentuk dikarakterisasi menggunakan spektrofotometer UV-tampak, spektrofotometer FT-IR, SEM-EDX, dan MSB.
4. HASIL DAN PEMBAHASAN
Kompleks hanya larut sempurna dalam akuaregia 12 M dan larut perlahan dengan akuaregia encer atau 2 M, dan sulit larut dalam akuades.
Panjang gelombang maksimum yang diserap oleh kompleks dengan spektrofotometer UV-tampak adalah 508 nm. Spektra UV-tampak ditunjukkan pada Gambar 2.
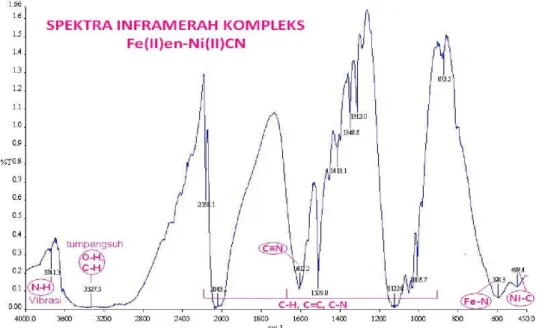
Gambar 3 Spektra inframerah kompleks.
Pada spektra inframerah kompleks yang ditunjukkan pada Gambar 2, terlihat serapan 3741 cm-1 dengan sedikit bahu yang merupakan
ciri dari vibrasi N-H pada etilendiamin yang mengikat besi(II), serapan pada daerah 2800-3600 cm-1 merupakan tumpang suh antara
serapan O-H dari molekul H2O dan C-H sp3
pada etilendiamin, serta serapan 2168 cm-1 –
1006,7 cm-1 dari C-H, C-C, dan C-N. Jembatan
ligan sianida teramati pada = 1602,2 cm-1 dari
serapan –CN– yang menghubungkan logam pusat Fe dan Ni.
Dari pemeriksaan SEM-EDX didapatkan data bahwa kompleks mengandung 10,17% besi dan 5,46% nikel seperti terlihat pada Tabel 1.
Hasil karakterisasi dengan MSB menunjukkan kompleks bersifat paramagnetik dengan harga momen magnet sebesar 4,2 BM pada 26 C. Data pengukuran dengan MSB ditampilkan pada Tabel 2.
Tabel 1 Komposisi Unsur Kompleks hasil SEM-EDAX.
Tabel 2 Data pengukuran kompleks dengan MSB.
5. KESIMPULAN DAN SARAN
Kompleks binuklir Hofmann-like network besi(II)-nikel(II) dengan sianida dan etilendiamin berhasil terbentuk, namun belum menghasilkan kristal. Belum terlihat adanya sifat transisi spin atau SCO pada kompleks.
Penelitian ini perlu dilanjutkan dengan metode pembentukan kristal dalam tabung-H untuk mengusahakan terbentuknya kristal tunggal. Selain itu, Perlu dilakukan analisis dengan metode spektroskopi Mössbauer untuk melihat transisi spin yang mungkin terjadi.
6. UCAPAN TERIMAKASIH
Ucapan terimakasih disampaikan kepada Jurusan Kimia FMIPA Unpad yang telah membantu baik dalam bentuk fasilitas, dana ataupun peralatan bagi keberhasilan dan kelancaran kegiatan penelitian ini.
7. DAFTAR PUSTAKA
1. KITAZAWA, T., Y.GOMI, M. TAKA-HASHI, M. TAKEDA, M. ENOMOTO, A. MIYAZAKI, AND T. ENOKI, Spin Crossover Behaviour of The Coordination Polymer FeII(C
5H5N)2NiI33I(CN)4, J. Mater.
Chem., 6, (1996) 119-120.
2. GÜTLICH, P. AND H.A. GOODWIN, Spin Crossover—An Overall Perspective. Top Curr Chem., (2004) 233-235, Springer, Heildelberg.
3. KAHN, O. AND MARTINEZ, C. J.,. Spin-Transition Polymers: From Molecular Materials Toward Memory Devices, Science, 279, (1998) 44–48.
4. GÜTLICH, P., Y. GARCIA, AND GOODWIN, H. A., Spin Crossover Phenomena in Fe(II) Complexes. Chem. Soc. Rev., 29, (2000) 419-427.
5. GUIONNEAU,P., L._ETARD J-F., YUFIT D. S., CHASSEAU D., BRAVIC G., GOETA A.E., HOWARD J.A.K., KAHN O., Structural Approach of the Features of the Spin Crossover Transition in Iron (II) Compounds, J Mater.Chem 9: (1999) 985.
6. ELHAÏK, J., MONEY V. A., BARRETT S. A., KILNER C. A., R. EVANS, I. HALCROW, M. A., The Spin-states and Spin-crossover Behaviour of Iron(II) Complexes of 2,6-dipyrazol-1-ylpyrazine Derivatives, Dalton Transactions, (2003) 2053-2060.
7. JAHRO, I. S., ONGGO D., RAHAYU S. I. DAN ISMUNANDAR, Sintesis dan Karakterisasi Senyawa Kompleks Polimer {[MnIICrIII(C
2O4)3][Fe(NH2-trz)3]Cl}.6H2O.
Seminar Nasional MIPA 2005. Depok. (2005).
DISKUSI Rudi
Apakah dilakukan SEM dari sinle kristalnya? Haisl sintesis berupa apa?
Apakah sudah dilihat dengan XRD? Yusi D
SEM tidak dilakukankarena hasil SEM berupa anatomi yang tidak mendukung penelitian tapi yang mendukung adalah komposisi. Produknya berupa semi amorf.