perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
SINTESIS DAN KARAKTERISASI
KOMPLEKS NIKEL(II) DENGAN DIFENILAMIN
Disusun oleh :
FITA NURDIYAH
M 0306033
SKRIPSI
Diajukan untuk memenuhi sebagian
persyaratan mendapatkan gelar Sarjana Sains Kimia
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SEBELAS MARET
SURAKARTA
Juli, 2011
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
HALAMAN PENGESAHAN
Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas
Sebelas Maret telah mengesahkan skripsi mahasiswa:
Fita Nurdiyah NIM M0306033, dengan judul ”Sintesis dan Karakterisasi
Kompleks Nikel(II) dengan Difenilamin”
Skripsi ini dibimbing oleh :
Pembimbing
Prof. Drs. Sentot Budi Rahardjo, Ph.D.
NIP. 19560507 198601 1001
Dipertahankan di depan Tim Penguji Skripsi pada:
Hari : Senin
Tanggal : 4 Juli 2011
Anggota tim Penguji :
1. Dr. Sayekti Wahyuningsih, M.Si 1. ... NIP. 19711211 199702 2001
2. Dr. Eddy Heraldy, M.Si 2. ... NIP. 19640305 200003 1002
Ketua Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sebelas Maret Surakarta
Dr. Eddy Heraldy, M.Si NIP. 19640305 200003 1002
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
PERNYATAAN
Dengan ini saya menyatakan bahwa skripsi saya yang berjudul
“SINTESIS DAN KARAKTERISASI KOMPLEKS NIKEL(II) DENGAN
DIFENILAMIN” adalah benar-benar hasil penelitian sendiri dan tidak terdapat
karya yang pernah diajukan untuk memperoleh gelar kesarjanaan di suatu
perguruan tinggi, dan sepanjang pengetahuan saya juga tidak terdapat kerja atau
pendapat yang pernah ditulis atau diterbitkan oleh orang lain, kecuali yang secara
tertulis diacu dalam naskah ini dan disebutkan dalam daftar pustaka.
Surakarta, Juli 2011
FITA NURDIYAH
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
SINTESIS DAN KARAKTERISASI KOMPLEKS NIKEL(II) DENGAN
DIFENILAMIN
FITA NURDIYAH
Jurusan Kimia. Fakultas MIPA. Universitas Sebelas Maret
ABSTRAK
Penelitian tentang kompleks nikel(II) dengan difenilamin bertujuan untuk mengetahui cara sintesis, formula dan karakteristik kompleks yang terbentuk. Kompleks nikel(II) dengan difenilamin telah disintesis dengan perbandingan mol logam dan mol ligan 1 : 6 dalam metanol. Terbentuknya kompleks dapat ditandai dengan adanya pergeseran panjang gelombang maksimum kompleks ke arah yang lebih kecil dari panjang gelombang ion logamnya. Formula kompleks yang diperkirakan dari analisis kadar Ni dalam kompleks dengan Spektroskopi Serapan Atom (SSA) adalah [Ni(difenilamin)4(NO3)2.6H2O]. Pengukuran daya hantar
listrik (DHL) dengan konduktivitimeter menunjukkan perbandingan muatan kation : anion adalah 1:1, hal ini menunjukkan bahwa NO3- ada yang terkoordinasi
pada ion pusat Ni2+ dan juga berkedudukan sebagai anion, sehingga formula kompleks yang mungkin yaitu [Ni(difenilamin)4(NO3)(H2O)](NO3).5H2O.
Data spektra Infra Merah (IR) menunjukkan adanya pergeseran serapan gugus NH sekunder yang mengindikasikan gugus fungsi tersebut terkoordinasi pada ion pusat Ni2+ secara monodentat. Pengukuran momen magnet dengan Magnetic Susceptibility Balance (MSB) menunjukkan bahwa kompleks bersifat paramagnetik dengan µeff = 2,99 ± 0,05 BM. Spektra Ultra Violet-Visibel
(UV-Kata kunci : Sintesis, Karakterisasi, Kompleks Ni(II), Difenilamin.
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
SYNTHESIS AND CHARACTERIZATION OF NICKEL(II) COMPLEX
WITH DIPHENYLAMINE
FITA NURDIYAH
Departement of Mathematic and Natural Science Faculty. Sebelas Maret University
ABSTRACT
The purposes of this research are to know the synthesis, formula and characteristic of complex of nickel(II) with diphenylamine. Complex of nickel(II) with diphenylamine (dpa) has been synthesized in 1 : 6 mole ratio of metal to ligan in methanol. The forming of complex was indicated by the shifting of maximum wavelength to the shorter wavelength than metal ion. The formula of complex which was predicted from analysis of % Ni in the complex by Atomic Absorption Spectroscopy (AAS) was [Ni(diphenylamine)4(NO3)2.6H2O]. Charge monodentately. Magnetic susceptibility measurement showed that this complex was paramagnetic with µeff = 2,99 ± 0,05 BM. The UV-Vis spectra showed two
absorptions band at 396,00 nm (25.252,53 cm-1) and 724,50 nm (13.802,62 cm-1). This peak indicated that the complex was octahedral structure with transitions
( )
PKeywords : Synthesis, Characterization, Nickel(II) Complex, Diphenylamine.
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
MOTTO
Tetapi boleh jadi kamu tidak menyenangi sesuatu padahal itu baik bagimu,
dan boleh jadi kamu menyukai sesuatu padahal itu tidak baik bagimu. Allah
mengetahui, sedang kamu tidak mengetahui.
(Al-Baqarah : 216)
Dan Dia memberinya rezeki dari arah yang tidak disangka-sangkanya. Dan
barang siapa bertawakal kepada Allah, niscaya Allah akan mencukupkan
(keperluan)nya. Sesungguhnya Allah melaksanakan urusan-Nya. Sungguh,
Allah telah mengadakan ketentuan bagi setiap sesuatu.
(At-Talaq : 3)
Nun jauh disana di dekat sinar sang surya terletak impian-impianku yang
tertinggi. Barangkali aku tak kan meraihnya tetapi aku bisa mendongak dan
melihat keindahan mereka, mempercayai mereka dan mencoba mengikuti
mereka.
(Louisa May Alcott)
Tekanan akan membuat anda selalu terjaga, tekanan akan membuat anda
selalu merasa harus belajar dan tekanan akan selalu membuat anda
berusaha menggali kemampuan anda sampai ke batas maksimal.
(B20P)
Tidakkah kau renungkan bahwa segala intrik yang terjadi dalam hidup
hingga memaksa meneteskan air mata adalah tanda
ketika Tuhan jatuh cinta?
(Wahyu Sujani)
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
PERSEMBAHAN
Karya sederhana ini penulis persembahkan untuk :
v Allah S.W.T Rabb penguasa alam semesta yang telah memberikan limpahan nikmat yang luar biasa..
v Ibu dan Bapak yang senantiasa mencurahkan doa, semangat dan kepercayaan, ibu dan bapak juara 1
seluruh dunia..
v Iput, adik tersayang, terimakasih untuk pengertiannya..
v Sahabat-sahabat tercinta FC club, terimakasih untuk persahabatan yang indah ini..
v Semua orang yang telah memberikan inspirasi dan semangat yang luar biasa..
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
KATA PENGANTAR
Puji syukur kepada Allah SWT atas segala limpahan nikmat dan
karuniaNya sehingga penulis dapat menyelesaikan penulisan skripsi yang berjudul
“SINTESIS DAN KARAKTERISASI KOMPLEKS NIKEL(II) DENGAN
DIFENILAMIN” guna memenuhi sebagian persyaratan untuk mendapatkan gelar
Sarjana Sains di Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas
Sebelas Maret Surakarta.
Skripsi ini tidak akan selesai tanpa adanya bantuan dari banyak pihak.
Oleh karena itu penulis ingin mengucapkan terima kasih kepada :
1. Bapak Ir. Ari Handono Ramelan, MSc., Ph.D. selaku Dekan FMIPA
UNS.
2. Bapak Dr. Eddy Heraldy, M.Si. selaku Ketua Jurusan Kimia.
3. Bapak Prof. Drs. Sentot Budi Rahardjo, Ph.D. selaku Pembimbing
Skripsi.
4. Bapak Drs. Mudjijono, Ph.D. selaku Pembimbing akademik.
5. Bapak I.F. Nurcahyo, M.Si. selaku Ketua Laboratorium Kimia Dasar
FMIPA UNS.
6. Bapak Dr. rer. nat. Atmanto Heru Wibowo, M.Si. selaku Ketua Sub
Laboratorium Kimia Laboratorioum Pusat FMIPA UNS.
7. Bapak dan Ibu Dosen Jurusan Kimia, Fakultas Matematika dan Ilmu
Pengetahuan Alam, Universitas Sebelas Maret atas semua ilmu yang
berguna dalam penyusunan skripsi ini serta karyawan Jurusan Kimia
FMIPA UNS.
8. Staf Laboratorium Kimia Dasar FMIPA UNS : Mbak Nanik dan Mas
Anang.
9. Staf dan operator Sub Laboratorium Kimia Universitas Sebelas Maret
Surakarta.
10. Teman sepenelitian, Endah dan Syafi’i, terima kasih untuk
kesabarannya.
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
11. Teman-teman 2006 serta adik-adik angkatan 2007-2009 yang selalu
membantu.
Semoga Allah SWT berkenan memberikan balasan yang lebih baik atas
pengorbanan yang diberikan. Amin.
Penulis menyadari bahwa banyak kekurangan dalam penulisan skripsi ini.
Oleh karena itu, kritik dan saran yang membangun akan sangat membantu penulis
dalam memperbaikinya. Semoga karya kecil ini dapat memberikan manfaat bagi
perkembangan ilmu pengetahuan.
Surakarta, Juli 2011
Fita Nurdiyah
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
DAFTAR ISI
Halaman
HALAMAN JUDUL ... i
HALAMAN PENGESAHAN ... ii
HALAMAN PERNYATAAN... iii
ABSTRAK... iv
ABSTRACT... v
MOTTO... vi
PERSEMBAHAN... vii
KATA PENGANTAR... viii
DAFTAR ISI ... x
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN ... xvi
BAB I PENDAHULUAN ... 1
A. Latar Belakang Masalah ... 1
B. Perumusan Masalah ... 6
1. Identifikasi Masalah ... 6
2. Batasan Masalah ... 6
3. Rumusan Masalah ... 7
C. Tujuan Penelitian ... 7
D. Manfaat Penelitian ... 7
BAB II LANDASAN TEORI ... 8
A. Tinjauan Pustaka ... 8
1. Sintesis Kompleks ... 8
2. Senyawa Kompleks Nikel(II)... 9
3. Teori Pembentukan Kompleks Ni(II)... 11
a. Teori Ikatan Valensi... 11
b. Teori Medan Kristal... 14
c. Teori Orbital Molekul... 19
4. Sifat Magnetik ... 21
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
5. Daya Hantar Listrik ... 23
6. Spektroskopi Serapan Atom (SSA) ... 24
7. Spektroskopi Infra Merah ... 26
8. Difenilamin ... 28
B. Kerangka Pemikiran ... 29
C. Hipotesis ... 31
BAB III METODOLOGI PENELITIAN ... 32
A. Metode Penelitian ... 32
B. Tempat dan Waktu Penelitian ... 32
C. Alat dan Bahan ... 32
1. Alat ... 32
2. Bahan ... 33
D. Prosedur Penelitian ... 33
1. Sintesis Kompleks Ni(II) dengan Difenilamin... 33
2. Penentuan Kadar Nikel... 33
3. Pengukuran Daya Hantar Listrik ... 34
4. Pengukuran Momen Magnet ... 34
5. Pengukuran Spektrum Infra Merah ... 34
6. Pengukuran Spektrum Elektronik... 34
E. Teknik Pengumpulan dan Analisis Data ... 35
BAB IV HASIL DAN PEMBAHASAN... 36
A. Sintesis Kompleks Nikel(II) dengan Difenilamin ... 36
B. Penentuan Formula Kompleks... 37
1. Pengukuran Kadar Nikel dalam Kompleks ... 37
2. Pengukuran Daya Hantar Listrik... 37
C. Karakteristik Kompleks... 38
1. Sifat Kemagnetan... 38
2. Spektrum Infra Merah... 39
3. Spektrum Elektronik... 42
D. Perkiraan Struktur Kompleks Ni(II)-difenilamin ... 43
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
BAB V PENUTUP... 45
A. Kesimpulan... 45
B. Saran... 45
DAFTAR PUSTAKA ... 46
LAMPIRAN... 50
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
DAFTAR TABEL
Halaman
Tabel 1. Orbital Hibridisasi beberapa Konfigurasi Geometri... 13
Tabel 2. Faktor Koreksi Diamagnetik untuk Beberapa Kation,
Anion, Atom Netral dan Molekul (10-6cgs)…... 22
Tabel 3. Kadar Nikel dalam Kompleks Nikel(II) dengan
Difenilamin dengan Berbagai Komposisi secara
Teoritis... 37
Tabel 4. Daya Hantar Listrik Larutan Standar dan Kompleks
dalam Metanol... 38
Tabel 5. Serapan Gugus Fungsi Ligan Difenilamin dan Kompleks
Ni(II)-difenilamin... 39
Tabel 6. Serapan Gugus (>N-H) sekunder dari beberapa senyawa
kompleks... 41
Tabel 7. Panjang Gelombang Maksimum (λmaks), Absorbansi (A)
dan Absorptivitas Molar (ε) Ni(NO3)2.6H2O... 42
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
DAFTAR GAMBAR
Halaman
Gambar 1. Struktur kompleks [Ni(L1)] ... 2
Gambar 2. Struktur kompleks [Ni(L2)(H2O)2Cl2] ... 3
Gambar 3. Struktur kompleks [Ni(L3)2] ... 3
Gambar 4. Struktur kompleks [Ru(L4)(CO)2Cl]PF6 ... 4
Gambar 5. Struktur difenilamin ... 5
Gambar 6. Struktur kompleks [Ni(L5)NO3]NO3 ... 5
Gambar 7. Struktur senyawa kompleks Ni(II) dengan ligan 2-aminopyrimidin dan potassium thiocyanate ... 10
Gambar 8. Struktur senyawa kompleks Ni(L6)2 ... 10
Gambar 9. Struktur senyawa kompleks Ni(L7)2 ... 11
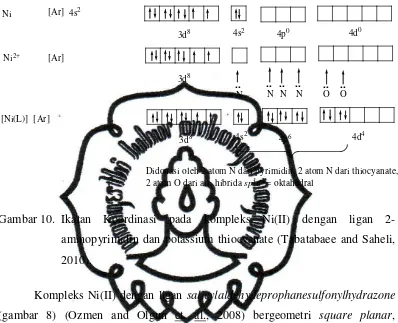
Gambar 10. Ikatan Koordinasi pada kompleks Ni(II) dengan ligan 2-aminopyrimidin dan potassium thiocyanate... 12
Gambar 11. Ikatan Koordinasi pada kompleks Ni(II) dengan ligan salicylaldehydeprophanesulfonylhydrazone... 13
Gambar 12. Orbital d dan Susunannya dalam Ruang ……….. 14
Gambar 13. Diagram Pemisahan Orbital d dalam Medan Oktahedral ... 15
Gambar 14. Diagram Pemisahan Orbital d dan Bidang Kubik Medan Tetrahedral ... 16
Gambar 15. Diagram Orgel dan Spektrum Transisi Elektronik untuk Ion d8... 17
Gambar 16. Spektrum Elektronik (a) [Ni(H2O)6]2+ dan (b) [Ni(NH3)6]2+... 18
Gambar 17. Diagram Tingkat Energi Orbital Molekul Kompleks Oktahedral ... 20
Gambar 18. Diagram Tingkat Energi Orbital Molekul Kompleks Tetrahedral ... 21
Gambar 19. Vibrasi Ulur : (a) Simetri, (b) Asimetri.
Vibrasi Tekuk : (c) Guntingan, (d) Goyangan, (e) Kibasan
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
dan (f) Pelintiran ... 26
Gambar 20. Kemungkinan Ikatan koordinasi antara Ni2+ dengan
Difenilamin ………... 29
Gambar 21. Struktur Ligan Tetrazole ... 30
Gambar 22. Spektrum Elektronik kompleks Ni(H2O)62+ dalam metanol (a)
dan spektrum elektronik kompleks Ni(II)-difenilamin dalam
metanol (b) ...……... 33
Gambar 23. Spektrum Infra Merah ligan Difenilamin ... 39
Gambar 24. Spektrum Infra Merah Kompleks Ni(II)-difenilamin ... 40
Gambar 25. Perkiraan Struktur
[Ni(difenilamin)4(NO3)(H2O)](NO3).5H2O ... 44
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Tahapan Sintesis Kompleks Ni(II) dengan
Difenilamin ... 50
Lampiran 2. Perhitungan Rendemen Hasil Sintesis Kompleks... 51
Lampiran 3. Pengukuran Kadar Nikel dalam Kompleks dengan Spektrofotometer Serapan Atom (SSA)... 52
Lampiran 4. Pengukuran Daya Hantar Listrik dengan Konduktivitimeter... 54
Lampiran 5. Penentuan Momen Magnet Efektif... 55
Lampiran 6. Perhitungan Nilai Absorptivitas Molar dan Energi Pembelahan Kompleks... 57
Gambar 1. Diagram Tahapan Sintesis Senyawa Kompleks... 50
Gambar 2. Kurva Larutan Standar Ni(II)... 52
Tabel 1. Konsentrasi Nikel dalam Larutan Sampel... 53
Tabel 2. Daya Hantar Listrik Larutan Standar dan Sampel Kompleks dalam Metanol ... 54
Tabel 3. Hasil Pengukuran Kerentanan Magnetik... 55
Tabel 4. Harga µeff pada Beberapa Harga χg dari Sampel Kompleks Ni(II)-difenilamin... 56
Tabel 5. Harga Absorptivitas Molar Formula Kompleks Ni(II)-difenilamin ... 57
Tabel 6. Harga 10 Dq Ni(NO3)2.6H2O dan Ni(II)-difenilamin …. 58
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
BAB I
PENDAHULUAN
A. Latar Belakang Masalah
Senyawa kompleks didefinisikan sebagai senyawa yang terdiri dari ion
logam yang dikelilingi oleh molekul-molekul atau ion-ion yang disebut ligan. Ion
pusat pada umumnya merupakan ion-ion logam transisi yang memiliki orbital d
atau f yang terisi sebagian atau belum terisi penuh. Sedangkan ligan merupakan
molekul-molekul atau ion-ion yang memiliki pasangan elektron bebas atau donor
elektron (Cotton and Wilkinson, 1995). Sejumlah senyawa kompleks terjadi dan
terdapat secara alamiah dalam sistem biologi. Proses pengikatan oksigen oleh Fe
menjadi senyawa kompleks dalam tubuh merupakan salah satu contoh aplikasi
senyawa kompleks. Studi pembentukan kompleks menjadi hal yang menarik
untuk dipelajari karena kompleks yang terbentuk dimungkinkan memberi banyak
manfaat, misalnya untuk ekstraksi, sebagai katalis, dan penanganan keracunan
logam berat.
Peningkatan penggunaan logam berat dan hasil buangan yang
mengandung logam berat dalam berbagai macam kegiatan industri telah
menyebabkan keberadaan cemaran logam berat meningkat. Salah satu cemaran
logam berat yang banyak ditemukan yaitu nikel (Oboh et. al., 2009). Untuk itu
perlu dilakukan berbagai macam upaya penanganan maupun pengelolaan agar
cemaran logam berat dapat berkurang. Upaya yang dilakukan antara lain dengan
pengompleksan logam nikel dengan menggunakan senyawa tertentu. Asam sitrat,
asam nitril asetat (NTA), dan EDTA merupakan beberapa senyawa yang dapat
digunakan untuk pengompleksan logam berat (Zeng et. al., 2005). Seperti pada
pengompleksan nikel dengan Bis-(pentan-2,4-dione)propan-1,2-di-imine (Lecourt
et. al., 1999).
Nikel merupakan salah satu logam transisi deret pertama yang terletak
pada periode empat dan golongan VIIIB, memiliki nomor atom 28 dan massa
atom 58,71 g/mol. Ni merupakan unsur transisi dengan konfigurasi elektron 3d8
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
dan banyak berada sebagai Ni(II) dalam senyawa kompleks. Kompleks Ni(II)
dapat berstruktur oktahedral, bujur sangkar atau tetrahedral. Namun bentuk
kompleks nikel(II) yang paling umum adalah oktahedral dan bujur sangkar
(square planar) (Lee, 1994).
Kompleks [Ni(L1)] (L1 = tetrazole), ligan L1 terkoordinasi pada ion Ni2+
melalui gugus (›NH), atom N pada siklik lima dan juga atom N di luar lingkar
(Kang et. al., 2009). Kompleks yang terbentuk bergeometri oktahedral seperti
ditunjukkan oleh Gambar 1.
N
NH N
HN
N N
N N
N
N N
N
Ni2+
Gambar 1. Struktur kompleks [Ni(L1)] (L1 = tetrazole) (Kang et. al., 2009)
Kompleks [Ni(L2)(H2O)2Cl2]; (L2 = desipramine). L2 terkoordinasi pada
Ni(II) melalui atom N dari gugus (›NH) dan atom N dari piridin membentuk
geometri oktahedral, seperti yang ditunjukkan oleh Gambar 2 (Revanasiddappa et.
al., 2010).
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
N
H N
Ni
2+Cl OH2
H2O Cl
Gambar 2. Struktur kompleks [Ni(L2)(H2O)2Cl2] (Revanasiddappa et. al., 2010)
Kompleks [Ni(L3)2] (L3 = 4-chlorobenzaldehyde phenylhydrazone) yang
bergeometri square planar seperti ditunjukkan oleh Gambar 3 (Hania, 2009). L3
terkoordinasi pada ion Ni2+ melalui atom N dari gugus (›NH) dan gugus C=N
yang ditunjukkan dengan adanya pergeseran spektra IR gugus (›NH) dari 3430,
3450 dan 3420 cm-1(pada ligan L3) menjadi 3160 cm-1(pada kompleks [Ni(L3)2])
serta gugus C=N dari 1600, 1610 cm-1 (pada ligan L3) menjadi 1580 cm-1 (pada
kompleks [Ni(L3)2]).
N N H
H Cl
N H N
H
Cl
Ni2+
Gambar 3. Struktur kompleks [Ni(L3)2] (L3 = 4-chlorobenzaldehydephenyl
hydrazone) (Hania, 2009)
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
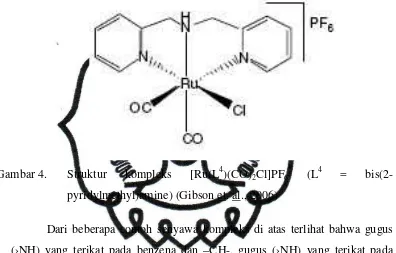
Kompleks [Ru(L4)(CO)2Cl]PF6 (L4 = bis(2-pyridylmethyl)amine), dimana
L4 memiliki struktur yang mirip dengan difenilamin (Gibson et. al., 2006). L4
terkoordinasi pada Ru2+ melalui gugus (›NH) dan dua atom N piridin secara
tridentat. Dalam kompleks ini, ion Cl- dan ligan CO juga terkoordinasi pada ion
Ru2+ seperti ditunjukkan oleh gambar 4.
Gambar 4. Struktur kompleks [Ru(L4)(CO)2Cl]PF6 (L4 =
bis(2-pyridylmethyl)amine) (Gibson et. al., 2006)
Dari beberapa contoh senyawa kompleks di atas terlihat bahwa gugus
(›NH) yang terikat pada benzena dan –CH-, gugus (›NH) yang terikat pada
atom C di luar lingkar, gugus (›NH) yang terikat antara gugus Cl-Ph-CH=N-
dan -Ph, terkoordinasi pada ion pusat membentuk kompleks dengan geometri
oktahedral dan square planar. Gugus pengeliling (›NH) dapat memberikan
pengaruh terhadap geometri kompleks, karena itu pengaruh gugus lain yang
mengelilingi gugus (›NH) perlu dipelajari misalnya difenilamin yang
strukturnya ditunjukkan oleh Gambar 5.
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
H
N
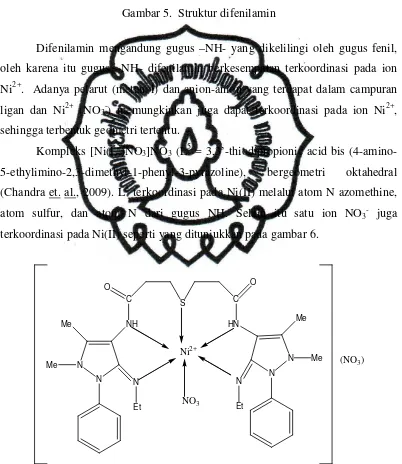
Gambar 5. Struktur difenilamin
Difenilamin mengandung gugus –NH- yang dikelilingi oleh gugus fenil,
oleh karena itu gugus –NH- difenilamin berkesempatan terkoordinasi pada ion
Ni2+. Adanya pelarut (metanol) dan anion-anion yang terdapat dalam campuran
ligan dan Ni2+ (NO3-) memungkinkan juga dapat terkoordinasi pada ion Ni2+,
sehingga terbentuk geometri tertentu.
Kompleks [Ni(L5)NO3]NO3 (L5 = 3,3’-thiodipropionic acid bis
(4-amino-5-ethylimino-2,3-dimethyl-1-phenyl-3-pyrazoline), bergeometri oktahedral
(Chandra et. al., 2009). L5 terkoordinasi pada Ni(II) melalui atom N azomethine,
atom sulfur, dan atom N dari gugus NH. Selain itu satu ion NO3- juga
terkoordinasi pada Ni(II) seperti yang ditunjukkan pada gambar 6.
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
Dari gambar 6 terlihat bahwa ion NO3- dapat berkedudukan sebagai anion
maupun terkoordinasi pada Ni(II). Adanya ion NO3- yang berkedudukan sebagai
anion maupun yang terkoordinasi pada Ni(II) dapat diamati dari spektrum infra
merah yang menunjukkan serapan pada daerah 1407, 1313, 1075 cm-1 yang
menunjukkan vibrasi stretching dari ion NO3- (Chandra et. al., 2009). Karena itu
pembentukan kompleks antara Ni2+ dengan difenilamin menarik untuk dipelajari.
B. Perumusan Masalah
1. Identifikasi Masalah
a. Sintesis kompleks dapat dilakukan dengan berbagai cara dan kondisi antara
lain mereaksikan ligan dan logam pada pH tertentu, merefluks, mencampur
tanpa pemanasan, atau dengan pemanasan dan pengadukan.
b. Formula kompleks dapat ditentukan berdasarkan analisis unsur C, H, N, O dan
logam.
c. Kedudukan anion dalam kompleks dapat bertindak sebagai ligan atau sisa
asam.
d. Gugus yang terkoordinasi pada logam dapat ditentukan melalui kristalografi
sinar X atau diperkirakan dari data spektrum Infra Merah.
e. Karakterisasi kompleks diperkirakan melalui spektrum infra merah, spektrum
ultraviolet-visible (Uv-Vis) , sifat kemagnetan, atau potensial redoksnya.
2. Batasan Masalah
a. Formula kompleks ditentukan dari pengukuran kadar logam.
b. Kedudukan anion sebagai ligan atau sebagai sisa asam ditentukan dari daya
hantar listrik senyawa kompleksnya.
c. Gugus fungsi ligan yang terkoordinasi pada atom pusat diperkirakan dari
spektra infra merahnya.
d. Karakterisasi kompleks diperkirakan melalui spektrum infra merah, spektrum
ultraviolet-visible (Uv-Vis) , sifat kemagnetan.
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
3. Rumusan Masalah
a. Bagaimana sintesis kompleks nikel(II) dengan difenilamin ?
b. Bagaimana formula kompleks nikel(II) dengan difenilamin ?
c. Bagaimana karakteristik kompleks nikel(II) dengan difenilamin ?
d. Bagaimana perkiraan struktur kompleks nikel(II) dengan difenilamin?
C. Tujuan Penelitian
1. Mensintesis senyawa kompleks nikel(II) dengan difenilamin.
2. Mengetahui formula kompleks nikel(II) dengan difenilamin.
3. Mengetahui karakteristik kompleks nikel(II) dengan difenilamin yang meliputi
sifat kemagnetannya, sifat elektroniknya, koordinasi ligan dengan ion pusat.
4. Memperkiraan struktur kompleks nikel(II) dengan difenilamin.
D. Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan informasi tentang
sintesis dan karakteristik kompleks Ni(II) dengan Difenilamin, untuk kemudian
dapat diaplikasikan dalam bidang ilmu yang lain.
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
BAB II
LANDASAN TEORI
A. Tinjauan Pustaka
1. Sintesis Kompleks
Sintesis kompleks dapat dilakukan dengan berbagai cara, antara lain
merefluks larutan logam dan ligan selama beberapa jam, pencampuran dan
pengadukan larutan dengan pemanasan atau tanpa pemanasan. Pemanasan kadang
dibutuhkan untuk mempercepat reaksi yang terjadi. Cara sintesis kompleks
dengan refluks sebagaimana dalam pembentukan kompleks [NiL2] (L =
N-(Pyridin-2-yl) picolinamide ) (Wang et. al., 2010). Campuran ligan (0.5 mmol)
dan NiBr2 (0.5 mmol) dalam methanol direfluks selama 6 jam kemudian 30 ml
dietil eter ditambahkan untuk mengendapkan kompleks. Kompleks yang
dihasilkan disaring dan dicuci dengan dietil eter kemudian dikeringkan dengan
vakum sehingga dihasilkan serbuk berwarna hijau.
Sintesis kompleks [Ni(Thz)(Qz)] (Qz = quinalizarin, Thz = thiacetazone)
(Shaker et. al., 2010). Larutan logam NiCl2.6H2O ditambahkan secara
bertetes-tetes ke dalam campuran larutan ligan yaitu quinalizarin dalam 12 ml etanol dan
thiacetazone dalam 15 ml etanol. Campuran tersebut kemudian dipanaskan dan
distirer selama 30 menit sehingga dihasilkan kristal. Kristal tersebut kemudian
dicuci dan direkristalisasi dengan campuran air : etanol (1:3), kemudian
dikeringkan pada suhu 60 oC.
Cara sintesis lainnya sebagaimana pada kompleks [Ni3(ppko)6].2H2O
(ppko = anion dari phenyl(2-pyridyl)ketone oxime) (Efthymiou et. al., 2010),
yaitu NaOMe (0.130 g, 2.40 mmol) ditambahkan ke dalam larutan ppkoH (0.238
g, 1.20 mmol) dalam methanol (25 ml). Kemudian NiSO4.6H2O (0.158 g, 0.60
mmol) ditambahkan ke dalam larutan ligan sehingga dihasilkan larutan berwarna
merah dan distirer selama 1 jam pada temperatur kamar. Larutan tersebut
kemudian dipekatkan dengan vakum. Hasil pemekatan dilarutkan kembali dalam
MeCO2Et (15 ml) untuk menghasilkan larutan merah tua, kemudian disaring dan
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
ditempatkan dalam labu tertutup hingga diperoleh kristal berwarna merah
kemudian dicuci dengan Et2O (2 x 3 ml) dan dikeringkan.
2. Senyawa Kompleks Nikel
Suatu senyawa kompleks akan terbentuk bila terjadi ikatan kovalen
koordinasi antara suatu atom atau ion logam dengan beberapa molekul netral atau
ion donor elektron. Atom atau ion logam berfungsi sebagai ion pusat sedangkan
molekul netral atau ion donor elektron berfungsi sebagai gugus pengeliling atau
yang lebih dikenal dengan ligan (Day et. al., 1985). Atom pusat biasanya ion – ion
logam transisi yang berfungsi sebagai penerima pasangan elektron bebas dari
ligan. Kemampuan suatu ion logam untuk berikatan dengan sejumlah ligan
dinyatakan oleh bilangan koordinasinya. Ligan yang dapat menyumbangkan lebih
dari satu pasang elektron (mempunyai lebih dari satu atom donor) disebut ligan
polidentat (Cotton et. al., 1988).
Nikel merupakan salah satu logam transisi deret pertama yang terletak
pada periode empat dan golongan VIIIB, memiliki nomor atom 28 dan massa
atom 58,71 g/mol (Huheey and Keiter, 1993). Nikel dalam keadaan nikel(II) lebih
stabil daripada nikel(0), nikel(I), nikel(III) dan nikel(IV). Nikel(I) dan nikel(0)
tidak stabil karena mudah teroksidasi, nikel(III) mudah tereduksi menjadi nikel(II)
dan nikel(IV) jarang ditemukan (Cotton et. al., 1988). Bentuk kompleks nikel(II)
yang paling umum adalah oktahedral dan bujur sangkar (square planar) (Lee,
1994).
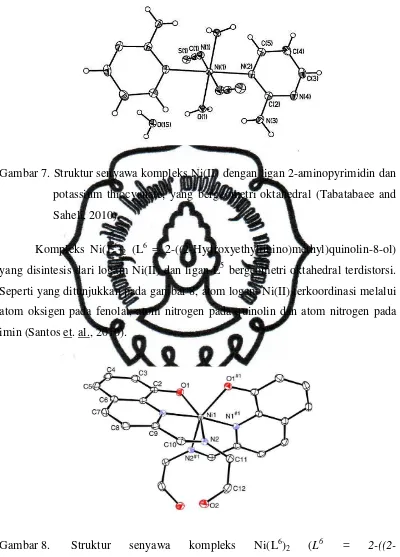
Seperti pada sintesis kompleks Ni(II) dengan ligan 2-aminopyrimidin dan
potassium thiocyanate, kompleks yang dihasilkan bergeometri oktahedral dengan
atom N pada cincin pyrimidin, atom N pada thiocyanate, dan atom O dari air
terkoordinasi pada Ni (II) (Tabatabaee and Saheli, 2010) seperti ditunjukkan pada
Gambar 7.
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
Gambar 7. Struktur senyawa kompleks Ni(II) dengan ligan 2-aminopyrimidin dan
potassium thiocyanate, yang bergeometri oktahedral (Tabatabaee and
Saheli, 2010).
Kompleks Ni(L6)2 (L6 = 2-((2-Hydroxyethylimino)methyl)quinolin-8-ol)
yang disintesis dari logam Ni(II) dan ligan L5 bergeometri oktahedral terdistorsi.
Seperti yang ditunjukkan pada gambar 8, atom logam Ni(II) terkoordinasi melalui
atom oksigen pada fenolat, atom nitrogen pada quinolin dan atom nitrogen pada
imin (Santos et. al., 2010).
Gambar 8. Struktur senyawa kompleks Ni(L6)2 (L6 =
2-((2-Hydroxyethylimino)methyl)quinolin-8-ol) (Santos et. al., 2010).
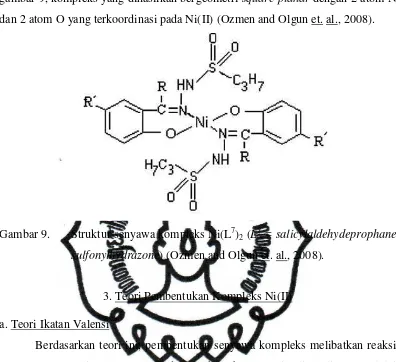
Selain itu juga telah disintesis kompleks Ni(II) dengan ligan L7 (L7 =
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
gambar 9, kompleks yang dihasilkan bergeometri square planar dengan 2 atom N
dan 2 atom O yang terkoordinasi pada Ni(II) (Ozmen and Olgun et. al., 2008).
Gambar 9. Struktur senyawa kompleks Ni(L7)2 (L7 = salicylaldehydeprophane
sulfonylhydrazone) (Ozmen and Olgun et. al., 2008).
3. Teori Pembentukan Kompleks Ni(II)
a. Teori Ikatan Valensi
Berdasarkan teori ini, pembentukan senyawa kompleks melibatkan reaksi
antara asam Lewis (atom pusat) dengan basa-basa Lewis (ligan-ligan) melalui
ikatan kovalen koordinasi (Effendy, 2007). Menurut Pauling, ikatan kovalen
terjadi karena adanya tumpang tindih antara orbital kosong logam dengan orbital
ligan yang berupa molekul atau ion yang mempunyai pasangan elektron bebas
(Day et. al., 1985). Dalam ikatannya dengan ligan-ligan, atom pusat menggunakan
orbital-orbital hibrida yang diperoleh dari proses hibridisasi, yaitu proses
pembentukan orbital-orbital hibrida dengan tingkat energi yang sama melalui
kombinasi linear orbital-orbital atom dengan tingkat energi yang berbeda
(Effendy, 2007).
Kompleks Ni(II) dengan ligan 2-aminopyrimidin dan potassium
thiocyanate (gambar 6) (Tabatabaee and Saheli, 2010), bergeometri oktahedral,
disebabkan 6 orbital kosong dari ion Ni2+ didonasi oleh dua pasang elektron N
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
O dari air yang menempati dua orbital 3d, satu orbital 4s dan tiga orbital 4p, yang
kemudian mengalami hibridisasi d2sp3 seperti ditunjukkan oleh gambar 10.
Ni [Ar]
Ni2+
3d8 4p0 4d0
3d8
[Ni(L)] [Ar]
3d8 4s2 4p6 4d4
Didonasi oleh 2 atom N dari pyrimidin, 2 atom N dari thiocyanate, 2 atom O dari air, hibrida sp3d2= oktahedral
N ..N N.. N.. ..O O..
..
4s2 4s2
[Ar]
Gambar 10. Ikatan Koordinasi pada kompleks Ni(II) dengan ligan
2-aminopyrimidin dan potassium thiocyanate (Tabatabaee and Saheli,
2010).
Kompleks Ni(II) dengan ligan salicylaldehydeprophanesulfonylhydrazone
(gambar 8) (Ozmen and Olgun et. al., 2008) bergeometri square planar,
disebabkan 4 orbital kosong dari ion Ni2+ didonasi oleh dua pasang elektron N dan
dua pasang elektron O yang menempati satu orbital 3d, satu orbital 4s dan dua
orbital 4p, yang kemudian mengalami hibridisasi dsp2 seperti ditunjukkan oleh
gambar 11.
perpustakaan.uns.ac.id digilib.uns.ac.id
Gambar 11. Ikatan Koordinasi pada kompleks Ni(II) dengan ligan
salicylaldehydeprophanesulfonylhydrazone (Ozmen and Olgun et.
al., 2008).
Hibridisasi dapat diperkirakan dari bentuk geometri molekul atau senyawa
hasil eksperimen. Geometri hasil hibridisasi beberapa orbital lain ditunjukkan oleh
tabel 1 (Sharpe , 1992). Teori ikatan valensi ini dapat menjelaskan struktur dan
kemagnetan banyak senyawa kompleks, namun memiliki kelemahan yaitu tidak
dapat menerangkan warna kompleks yang dihasilkan dan momen magnet yang
berbeda pada temperatur yang bervariasi (Lee, 1994).
Tabel 1. Orbital Hibridisasi Beberapa Konfigurasi Geometri (Sharpe, 1992)
Bilangan koordinasi
Konfigurasi orbital
Bentuk geometri Ion kompleks
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
b. Teori Medan Kristal
Menurut teori ini, interaksi antara logam atau atom pusat dan ligan dalam
kompleks adalah murni elektrostatik. Logam transisi sebagai atom pusat
diasumsikan sebagai ion positif yang dikelilingi oleh ligan yang bermuatan negatif
atau molekul netral yang mempunyai pasangan elektron bebas (Lee, 1994).
Interaksi ini menimbulkan medan kristal dan menyebabkan naiknya tingkat energi
semua orbital yang dimiliki oleh atom pusat, serta menyebabkan pemisahan
orbital-orbital d dari atom pusat, tetapi tidak menyebabkan pemisahan
orbital-orbital p (Effendy, 2007). Orbital-orbital-orbital d ada lima macam yaitu dxy , dxz ,dyz , dx2
-y2 dan dz2 dengan susunannya dalam ruang ditunjukkan pada gambar 12. Orbital
Gambar 12. Orbital d dan Susunannya dalam Ruang (Huheey et. al., 1993)
1. Pembelahan Orbital d Kompleks Oktahedral
Satu ion sebagai pusat oktahedral dikelilingi oleh enam ligan yang terletak
pada sumbu oktahedral (gambar 10). Orbital d akan mengalami kenaikan energi
karena tolakan dari ligan. Orbital dz2 , dx2-y2, yang berada pada sumbu oktahedral
mengalami tolakan lebih besar daripada orbital dxy , dxz , dyz yang berada diantara
sumbu oktahedral. Hal ini mengakibatkan pemisahan (splitting) orbital d, dimana
orbital dz2 dan dx2-y2 (orbital eg) mengalami kenaikan energi sedangkan orbital dxy
,dxz, dyz (orbital t2g) mengalami penurunan energi (Huheey et. al., 1993).
Perbedaan tingkat energi antara dua kelompok orbital tersebut dinyatakan 10
Dq atau Do yang juga menunjukan kekuatan medan kristal.
Pada kompleks oktahedral, pengisian orbital t2g menurunkan energi
kompleks yang akan membuatnya lebih stabil sebesar -0,4∆0 per elektron.
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
Sementara pengisian orbital eg menaikkan energi sebesar 0,6∆0 per elektron. Total
Crystal Field Stabilization Energi (CFSE) atau energi yang terstabilkan oleh
medan kristal adalah
CFSEoctahedral = -0,4n(t2g) + 0,6n(eg)
n(t2g) dan n(eg) berturut – turut adalah jumlah elektron yang mengisi orbital t2g dan
eg. Nilai CFSE konfigurasi d0 dan d10 adalah nol baik di medan ligan kuat maupun
lemah. Nilai konfigurasi d5 juga nol pada medan ligan lemah (Lee, 1994).
Pembelahan orbital pada kompleks oktahedral ditunjukkan oleh gambar 13.
---Gambar 13. Diagram Pemisahan Orbital d dalam Medan Oktahedral (Lee, 1994).
2. Pembelahan Orbital d Kompleks Tetrahedral
Bila keempat ligan mendekati ion pusat secara tetrahedral, maka arah
pendekatan ligan-ligan tersebut tidak searah, baik dengan kelompok orbital t2g
maupun dengan orbital eg. Arah pendekatan ligan menuju ion pusat lebih dekat
kepada orbital t2g (dxy , dxz , dyz) dibanding dengan orbital eg (dz2 dan dx2-y2). Medan
listrik yang terjadi pada pembentukan kompleks tetrahedral menyebabkan
pemisahan orbital pada ion pusat menjadi kelompok orbital t2g yang triplet dengan
energi yang lebih tinggi dan kelompok orbital eg dengan tingkat energi yang lebih
rendah (Huheey et. al., 1993). Diagram pemisahan orbital d dan bidang kubik
medan tetrahedral ditunjukkan pada gambar 14.
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
dx y dx z dy z
dz 2
dx 2
- y 2
t2
e
A
e n e r g i ( te t r a h e d r a l)
z
x
y
Gambar 14. Diagram Pemisahan Orbital d dan Bidang Kubik Medan Tetrahedral (Huheey et. al., 1993)
Kompleks tetrahedral mempunyai energi pemisahan atau medan ligan sebesar 4/9 Δokathedral (Δo) (Yamamoto, 1986). Karena itu pada kompleks
tetrahedral, energi setiap orbital pada eg = -3/5 x 4/9 Δo = -0,27 Δo dan energi
setiap orbital pada t2g = +2/5 x 4/9 Δo = +0,18 Δo (Syarifuddin, 1994).
3. Spektrum Elektronik Kompleks Ni(II)
Pada senyawa kompleks terdapat tiga jenis transisi elektronik dari ion
logam yang memberikan spektrum, yaitu transisi perpindahan muatan (charge
transfer), transisi antara orbital pada ligan, dan transisi d-d. Transisi elektronik
yang terjadi pada kompleks nikel(II) adalah akibat dari pembelahan tingkat energi
pada orbital-orbital d oleh suatu medan ligan. Dalam keadaan ion bebas atau tanpa
adanya medan ligan, tolakan elektrostatis antara elektron-elektron yang tidak
berpasangan menghasilkan tingkat-tingkat energi yang dinyatakan dengan term
symbol 1S, 1D, 1G, 3P dan 3F (Miessler and Tarr, 1991) sebagaimana ditunjukkan
oleh gambar 15.
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
Gambar 15. Diagram Orgel dan Spektrum Transisi Elektronik untuk Ion d8 (Lee, 1994)
Keadaan dasar 3F mempunyai dua elektron dengan spin sejajar, tetapi
keadaan 1G, 1D dan 1S mempunyai elektron dengan spin berlawanan. Sehingga
transisi dari keadaan dasar ke keadaan tereksitasi 1G, 1D dan 1S terlarang dan
dapat diabaikan. Keadaan 3F dan 3P merupakan transisi yang diperbolehkan.
Dalam medan oktahedral, keadaan 3P tidak terpecah (splitting) dan ditulis
sebagai 3T1g, sedangkan keadaan 3F terpecah menjadi tiga tingkat, yaitu 3T1g, 3T2g,
dan 3A2g. Tiga transisi yang mungkin adalah dari 3A2g → 3T2g (F), 3A2g → 3T1g
(F), 3A2g → 3T1g (P), transisi ini tampak sebagai tiga puncak pada spektrum
UV-Vis (Lee, 1994). Sebagai contohnya kompleks hijau [Ni(H2O)6]2+ yang
mempunyai spektrum elektronik sekitar 1111 nm (9.000 cm-1), 714 nm (14.000
cm-1) dan 400 nm (25.000 cm-1). Apabila pada kompleks [Ni(H2O)6]2+
ditambahkan ligan NH3 sehingga menjadi kompleks violet [Ni(NH3)6]2+, maka
spektrum elektroniknya menjadi berada di sekitar 1000 nm (10.000 cm-1), 571 nm
(17.500 cm-1) dan 364 nm (27.500 cm-1) (Sharpe, 1992) sebagaimana ditunjukkan
oleh gambar 16.
3
A2g 3
T2g 3
T1g (F) 3
T1g (P)
Medan Ligan Bertambah
3
F
3
P Energi
perpustakaan.uns.ac.id digilib.uns.ac.id
menurut Laporte karena menghasilkan intensitas yang rendah (absorptivitas molar (ε) mencapai 50 L.mol-1.cm-1) yang terjadi pada daerah panjang gelombang 500-600 nm dengan transisi elektroniknya 6A1g → 4T1g (G). Meskipun terlarang, λ = panjang gelombang maksimum (m) NA = bilangan avogadro (6,023.1023 mol-1)
(Szafran, Pie and Singh, 1991)
Transisi yang menghasilkan pita intensitas rendah namun bukan nol tidak
selamanya terlarang. Hal ini disebabkan orbital-orbital yang terlibat sebenarnya
tidak mempunyai sifat 3d murni, artinya ada beberapa vibrasi ligan yang
menyebabkan sedikit bersifat p tercampur dengan orbital-orbital d, sehingga
transisi jenis p«d diperbolehkan dengan ε = 500 L.mol-1.cm-1 (Lee, 1994). log ε
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
c. Teori Orbital Molekul
Teori orbital molekul didasarkan asumsi bahwa pada pembentukan
senyawa kompleks terjadi interaksi kombinasi linear antara orbital-orbital dari
atom pusat dengan orbital-orbital dari ligan membentuk orbital molekul. Interaksi
antara atom pusat dengan ligan-ligan merupakan gabungan dari interaksi
elektrostatis (ionik) dan interaksi kovalen (Effendy, 2007). Sifat ikatan kovalen
pada senyawa kompleks dapat dijelaskan dengan teori orbital molekul.
Pada kompleks oktahedral yang digunakan untuk membentuk orbital
molekul adalah enam orbital logam (sebagai s, px, py, pz, dz2 dan dx2-y2) dan enam
orbital ligan (Sharpe, 1992). Orbital-orbital yang mempunyai energi sama atau
hampir sama dapat mengadakan tumpang tindih membentuk orbital molekul
bonding dan orbital molekul antibonding. Tiga orbital d logam t2g (dxy, dxz, dyz)
merupakan orbital nonbonding, yang tidak terlibat dalam pembentukan ikatan.
Ketiga orbital p membentuk orbital molekul bonding t1u dan orbital molekul
antibonding t1u*. Orbital dx2-y2 dan dz2 membentuk orbital molekul bonding e1g dan
orbital molekul antibonding e1g*. Orbital s membentuk orbital molekul bonding
a1g dan orbital molekul antibonding a1g* (Huheey et. al., 1993). Diagram tingkat
perpustakaan.uns.ac.id digilib.uns.ac.id
Gambar 17. Diagram Tingkat Energi Orbital Molekul Kompleks Oktahedral (Effendy, 2007)
Pada kompleks tetrahedral orbital dz2 dan dx2-y2 merupakan orbital
nonbonding yang tidak terlibat pada pembentukan ikatan. Empat orbital ligan
yang simetrinya sama dengan orbital logam akan bertumpang tindih. Setiap
tumpang tindih orbital dapat membentuk orbital molekul bonding dan orbital
molekul nonbonding. Diagram tingkat energi orbital molekul pada kompleks
tetrahedral dapat dilihat pada gambar 18.
perpustakaan.uns.ac.id digilib.uns.ac.id
Gambar 18. Diagram Tingkat Energi Orbital Molekul Kompleks Tetrahedral (Effendy, 2007)
4. Sifat Magnetik
Sifat magnetik kompleks dibedakan menjadi dua yaitu sifat paramagnetik
dan diamagnetik. Kompleks dengan medan ligan lemah menghasilkan pemisahan
orbital d (Δ) yang tidak terlalu besar, sehingga setelah elektron memenuhi orbital d energi rendah elektron berikutnya akan mengisi orbital d energi tinggi, sehingga
elektron cenderung tidak berpasangan. Keadaan ini dinamakan spin tinggi.
Kompleks dengan medan ligan kuat menghasilkan pemisahan orbital d yang
cukup besar, sehingga elektron cenderung berpasangan. Keadaan ini dinamakan
spin rendah yang menimbulkan sifat diamagnetik (Lee, 1994).
Adanya elektron yang tidak berpasangan akan menyebabkan sifat
paramagnetik pada senyawa kompleks. Gerakan spin elektron dari orbital d
tersebut menimbulkan momen magnet permanen yang bergerak searah dengan
medan magnet luar dan menghasilkan nilai kerentanan magnet (Jolly, 1991).
Pada pengukuran dengan neraca kerentanan magnetik, diperoleh harga
kerentanan magnetik per gram (Xg), hubungannya dengan kerentanan magnetik
σ
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
molar (XM) ditunjukkan oleh persamaan (2) (Szafran et. al., 1991). Harga XM
dikoreksi terhadap faktor diamagnetik (XL) dari ion logam dan ligan, sehingga
diperoleh harga kerentanan magnetik terkoreksi (XA), yang ditunjukkan oleh
persamaan (3).
XM = Xg x Berat Molekul (dalam g mol-1)...(2)
XA = XM - ∑XL ...(3)
Tabel 2. Faktor Koreksi Diamagnetik untuk Beberapa Kation, Anion, Atom Netral dan Molekul (10-6 cgs) (Huheey et. al., 1993)
No Kation/anion/atom netral/molekul Faktor koreksi (10-6 cgs)
1. Ni2+ -13,00
2. Fe3+ -13,00
3. Cl¯ -23,40
4. NO3¯ -18,90
5. C -6,00
6. H -2,93
7. N (dalam lingkar lima atau enam) -4,61
8. N (amida) -2,11
9. O (aldehid atau keton) -1,73
10. H2O -13,00
Hubungan antara µeff dengan kerentanan magnetik terkoreksi (XA) ditunjukkan
oleh persamaan (4) (Szafran et. al., 1991).
µeff = 2,828 (XA x T)1/2 BM (Bohr Magneton) ...(4)
keterangan : µeff = momen magnet(BM)
T = suhu (K)
Momen magnet logam transisi merupakan paduan dari momen spin dan
orbital, akan tetapi pada kebanyakan senyawa kompleks kontribusi orbital hampir
dapat diabaikan sehingga momen magnet dapat dihitung berdasarkan momen
magnet spin saja, rumus momen magnet yang ditimbulkan oleh spin (spin-only)
ditunjukkan pada persamaan (5).
µs = 2[s(s+1)]1/2 BM (Bohr Magneton) ...(5)
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
keterangan : µs = momen magnet yang ditimbulkan oleh spin elektron
s = total spin elektron = ½ x jumlah elektron tidak berpasangan
Hubungan nilai momen magnet suatu senyawa dengan banyaknya elektron
yang tidak berpasangan dinyatakan dalam persamaan (6) (Jolly, 1991).
µs = [n(n+2)]1/2 BM (Bohr Magneton) ………..……….(6)
keterangan : µs = momen magnetik yang ditimbulkan oleh spin elektron
n = jumlah elektron yang tidak berpasangan
Pada kompleks nikel(II) dengan konfigurasi elektron d8, momen magnet
yang diharapkan untuk dua elektron yang tidak berpasangan pada kompleks
oktahedral 2,8 – 3,2 BM dan tetrahedral 3,4 – 4,2 BM, sedangkan kompleks
square planar bersifat diamagnetik (Agarwal et. al., 2006).
Kompleks [Ni(L5)NO3]NO3 (L5 = 3,3’-thiodipropionic acid
bis(4-amino-5-ethylimino-2,3-dimethyl-1-phenyl-3pyrazoline) yang bergeometri oktahedral
memiliki momen efektif sebesar 2,84 BM (Chandra et. al., 2009). Selain itu,
kompleks oktahedral [Ni(CPHPZ)2(H2O)2], CPHPZ = 4-Carboxaldehyde
phenylhydrazone-1-phenyl-3-methyl-2-pyrazolin-5-one memiliki harga momen
magnet efektif 2.97 BM(Pandya et. al., 2010).
5. Daya Hantar Listrik
Daya hantar listrik adalah ukuran seberapa kuat suatu larutan dapat
menghantarkan arus listrik. Daya hantar listrik larutan elektrolit dapat dinyatakan
sebagai daya hantar listrik molar (molar conductivity) yang didefinisikan sebagai
daya hantar yang ditimbulkan oleh satu mol zat, sesuai persamaan (7)
(Kartohadiprodjo, 1990).
C K
m =
L ...(7)
keterangan : Λm = hantaran molar (S mol-1 cm2)
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
K = daya hantar listrik spesifik larutan elektrolit (S cm-1)
C = konsentrasi elektrolit (mol cm-3)
Apabila daya hantar spesifik larutan merupakan daya hantar yang sudah terkoreksi
(K*) dalam satuan µ S cm-1 maka daya hantar molar larutan elektrolit dapat ditulis
seperti pada persamaan (8).
K* = konduktansi = daya hantar listrik spesifik terkoreksi(µ.S.cm-1)
= K-K pelarut
C = konsentrasi elektrolit (mol.L-1)
Pada kompleks logam transisi, anion dari sisa asam dapat terkoordinasi
pada ion pusat atau tidak terkoordinasi. Dengan membandingkan konduktivitas
molar suatu senyawa dengan senyawa ionik yang diketahui molarnya, dapatlah
diperkirakan jumlah ion (kation atau anion) yang dihasilkan dalam larutan
(Szafran et. al., 1991).
Kompleks [Ni(L)NO3]NO3 (L = 3,3’-thiodipropionic acid bis
(4-amino-5-ethylimino-2,3-dimethyl-1-phenyl-3-pyrazoline), dalam pelarut DMSO memiliki
harga konduktivitas molar sebesar 88 S.mol-1.cm2 (Chandra et. al., 2009). Hal
tersebut mengindikasikan bahwa kompleks bersifat elektrolit dengan satu ion
NO3- terkoordinasi pada Ni(II) dan satu ion No3- yang lain berkedudukan sebagai
anion.
Sedangkan pada kompleks [Ni(Thz)(Qz)] (Qz = quinalizarin, Thz =
thiacetazone), bersifat non elektrolit karena dalam DMSO memiliki daya hantar
listrik yang sangat rendah yaitu sebesar 4,6 S.mol-1.cm2 (Shaker et. al., 2010).
6.Spektroskopi Serapan Atom (SSA)
Spektroskopi Serapan Atom (SSA) merupakan suatu metode analisis kimia
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
Hasil perhitungan akan memberikan kadar total unsur logam atau semi logam
dalam sampel dan tidak tergantung pada bentuk molekul logam tersebut dalam
sampel. Hasil ini didasarkan pada pengukuran jumlah radiasi yang diserap oleh
atom-atom saat sejumlah radiasi dilewatkan melalui suatu sistem yang
mengandung atom tersebut.
Prinsip kerja SSA adalah adanya interaksi antara energi (sinar) dan materi
(atom). Ini dapat dilaksanakan dengan menghisap cuplikan melalui selang kapiler
dan menyemprotkan ke dalam nyala api yang memenuhi syarat tertentu sebagai
kabut yang halus (aerosol). Jumlah radiasi yang diserap tergantung pada jumlah
atom-atom bebas yang terlibat dan kemampuan atom itu untuk menyerap radiasi.
Dasar perhitungan pada SSA adalah menggunakan hukum Lambert-Beer yaitu:
A= ε.b.C
Keterangan : A = absorbansi
ε = koefisien absorpsi molar b = tebal kuvet
C = konsentrasi.
Cuplikan harus disiapkan dalam bentuk larutan untuk analisis kuantitatif
dengan menggunakan nyala. Cuplikan ini perlu perlakuan pendahuluan untuk
memperoleh bentuk larutan yang prosedurnya tergantung pada sifat dan jenis
cuplikan yang akan dianalisis. Ada beberapa cara untuk melarutkan cuplikan,
yaitu: (1) cuplikan langsung dilarutkan dalam pelarut yang sesuai, (2) cuplikan
direaksikan dengan asam, atau (3) cuplikan dilebur dulu dengan basa kemudian
hasil leburan dilarutkan dalam asam. Prosedur yang banyak digunakan adalah
dengan melarutkan sampel dengan asam murni seperti HNO3, H2SO4, dan HCl
karena tidak menambah kadar zat padat dalam larutan. Penentuan kadar logam
dari suatu sampel dengan metode SSA, dapat dilakukan dengan cara kurva
kalibrasi maupun penambahan standar (Skoog, et. al., 1998).
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
7.Spektroskopi Infra Merah
Atom-atom dalam molekul tidak hanya diam di tempat, melainkan
mengalami getaran (vibrasi) relatif satu sama lain. Apabila getaran atom-atom
tersebut menghasilkan perubahan momen dwikutub, akan terjadi penyerapan
radiasi infra merah pada frekuensi yang sama dengan frekuensi vibrasi alamiah
molekul tersebut (Pudjaatmaka, 1997).
Energi yang diemisikan pada daerah infra merah cukup untuk mengubah
tingkat vibrasi ikatan dalam suatu molekul. Daerah yang paling banyak digunakan
untuk keperluan praktis dalam penentuan struktur senyawa organik adalah 4000–
690 cm-1 (Szafran, et. al., 1991).
Molekul-molekul diatomik memperlihatkan dua jenis vibrasi yaitu ulur
(stretching) dan vibrasi tekuk (bending). Vibrasi ulur ada dua yaitu simetri dan
asimetri. Vibrasi tekuk terdiri dari guntingan (scissoring), kibasan (waging),
pelintiran (twisting) dan goyangan (rocking). Gambar vibrasi tekuk dan ulur
ditunjukkan oleh Gambar 19.
Makin rumit struktur suatu molekul semakin banyak bentuk-bentuk vibrasi
yang mungkin terjadi, akibatnya akan terlihat banyak pita-pita absorbsi yang
diperoleh pada spektrum infra merah. Spektrum infra merah suatu molekul
poliatom sangat rumit untuk dianalisis, setiap absorbsi gugus fungsional suatu
molekul tampak pada daerah yang agak spesifik (Hendayana, dkk., 1994).
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
dihitung berdasarkan hukum Hooke yang ditunjukkan oleh persamaan (9) (Kemp,
1987) :
Dari persamaan (10) terlihat bahwa bilangan gelombang υ berbanding lurus dengan kekuatan ikatan dua atom k. Sebaliknya bilangan gelombang υ berbanding
terbalik dengan massa tereduksi µ, dimana :
2 atom semakin kuat dan panjang ikatan semakin pendek. Pergeseran bilangan
gelombang ke arah yang lebih besar akan menambah kuat ikatan dua atom dalam
satu molekul yang bervibrasi. Pergeseran bilangan gelombang ke arah yang lebih
kecil akan memperlemah ikatan dua atom dalam satu molekul yang bervibrasi.
Gugus fungsi tertentu yang dapat menyerap sinar infra merah antara lain :
1. Nitrogen-hidrogen pada amina
a) Getaran ulur N-H
Amina primer memperlihatkan dua pita serapan lemah, satu di dekat 3500
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
H simetri dan asimetri. Amina sekunder menunjukkan serapan lemah di daerah
3350 - 3310 cm-1.
b) Getaran tekuk N-H
Getaran tekuk N-H amina primer teramati di daerah spektrum 1650 – 1580
cm-1 ( Hartono dan Purba, 1986).
2. Karbon-nitrogen pada rantai siklik
Gugus C=N pada cincin aromatik mempunyai serapan pada daerah
1689-1471 cm-1 ( Hartono dan Purba, 1986).
3. Karbon - karbon pada cincin aromatik
Vibrasi ikatan rangkap C=C aromatik terkonjugasi menunjukkan serapan
pada daerah 1650-1600 cm-1 (Hartono dan Purba, 1986).
Ligan L (L=3,3’-thiodipropionic acid bis
(4-amino-5-ethylimino-2,3-dimethyl-1-phenyl-3-pyrazoline)), terkoordinasi pada Ni(II) membentuk
kompleks [Ni(L)Cl]Cl melalui atom N azomethine, atom sulfur, dan atom N dari
gugus NH, selain itu satu ion NO3- juga terkoordinasi pada Ni(II). Adanya ikatan
koordinasi ini diperlihatkan oleh pergeseran serapan spektrum infra merah dari
kompleksnya dibandingkan dengan ligannya. Spektrum infra merah dari ligan
memperlihatkan serapan pada daerah 1621 cm-1 (n C=N), 1647 cm-1 (n C=O), 1532 cm-1 (d NH), dan 768 cm-1 (n C-S). Sedangkan untuk spektrum infra merah dari kompleks yaitu 1570 cm-1 (n C=N), 1640 cm-1 (n C=O), 1405 cm-1 (d NH), dan 673 cm-1 (n C-S), kemudian juga muncul serapan baru pada 384 cm-1 (n M-N), 1640 cm-1 (n M-S), dan juga serapan ion NO3- pada 1407, 1313, 1075 cm-1.
8. Difenilamin
Difenilamin merupakan senyawa organik, berupa serbuk kristal berwarna
putih, larut dalam pelarut-pelarut organik seperti metanol, etanol. Nama lain dari
difenilamin diantaranya N-Phenyl benzenamine, N-Phenyl Aniline,
Anilinobenzene, (phenylamino)benzene, N,N-diphenylamine, Phenyl
benzenamine. Formula kimia difenilamin adalah C12H11N dengan berat
molekulnya 169,23 g/mol, memiliki titik leleh 53ºC, titik didih 302ºC.
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
Difenilamin merupakan turunan dari anilin yang memiliki peranan penting
dalam bidang farmasi. Reaksi antara difenilamin dengan sulfur menghasilkan
phenothiazine yang merupakan suatu prekursor dalam industri obat. Sedangkan
reaksinya dengan iodin menghasilkan carbazole. Diphenylamin juga sering
digunakan sebagai reagen tes nitrat.
B. KERANGKA PEMIKIRAN
Senyawa kompleks akan terbentuk jika terjadi ikatan kovalen koordinasi
antara ion logam yang mempunyai orbital kosong dengan ligan yang merupakan
pendonor elektron. Ni(II) menyediakan orbital kosong sedangkan difenilamin
memiliki atom donor elektron lebih dari satu, sehingga kemungkinan dapat
membentuk ikatan kooordinasi dengan Ni(II) dalam berbagai kemungkinan.
Donor elektron tersebut adalah NH sekunder dan cincin benzena. Kemampuan
atom donor berikatan dengan atom pusat dalam membentuk kompleks
dipengaruhi oleh kekuatan ligan dan keruahan (efek sterik). Efek sterik yang
ditimbulkan oleh N sekunder lebih kecil daripada efek sterik cincin benzena.
Ligan dapat terkoordinasi pada Ni(II) sebagai monodentat dengan N atau dengan
cincin benzena pada ion pusat. Kemungkinan ikatan antara difenilamin dengan
Ni(II) ditunjukkan oleh Gambar 20.
Gambar 20. Kemungkinan Ikatan koordinasi antara Ni2+ dengan difenilamin.
Difenilamin memiliki kekuatan ligan yang relatif lebih kuat bila
dibandingkan dengan air (H2O). Hal tersebut menyebabkan difenilamin akan
dapat menggantikan H2O pada Ni(NO3)2.6H2O sehingga pada spektrum elektronik N
H
Ni2+
N H
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
akan terjadi pergeseran panjang gelombang maksimum (lmax) ke arah yang lebih
kecil. Serapan spektrum elektronik dapat menandai terbentuknya kompleks dan
geometri yang terbentuk melalui besarnya transisi elektronik dari keadaan dasar
ke keadaan eksitasi. Struktur oktahedral Ni(II) dengan dua elektron tidak
berpasangan ditandai dengan tiga puncak di sekitar 400-1000 nm dengan
intensitas tinggi, namun yang teramati dengan spektrofotometer UV-Vis biasanya
hanya dua puncak saja.
Banyaknya difenilamin yang dapat menggantikan molekul H2O tergantung
dari kemampuan difenilamin dalam berikatan dengan ion pusat Ni2+. Difenilamin
merupakan ligan lemah sehingga tidak dapat menggantikan semua molekul H2O.
Selain itu adanya pelarut yang digunakan (metanol) ataupun anion (NO3-) dapat
juga untuk terkoordinasi pada ion pusat Ni2+.
Kompleks [Ni(tetrazole)] memiliki harga momen magnet efektif sebesar
2,86 BM (Kang et. al., 2009). Hal tersebut menunjukkan bahwa kompleks bersifat
paramagnetik, dengan geometri oktahedral membentuk spin tinggi sehingga ligan
tetrazole merupakan ligan lemah. Difenilamin memiliki struktur yang mirip
dengan ligan tetrazole, seperti yang ditunjukkan pada gambar 21.
N
NH N
HN
N N
N N
N
N N
N
Gambar 21. Struktur ligan Tetrazole
Dikarenakan kemiripan struktur antara difenilamin dengan tetrazole maka
diperkirakan difenilamin juga merupakan ligan lemah, bersifat paramagnetik dan
bergeometri oktahedral.
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
Pada kompleks nikel(II) dengan konfigurasi elektron d8, momen magnet
yang diharapkan untuk dua elektron yang tidak berpasangan pada kompleks
oktahedral 2,8 – 3,2 BM dan tetrahedral 3,4 – 4,2 BM, sedangkan kompleks
square planar bersifat diamagnetik (Agarwal et. al., 2006).
C. Hipotesis
1. Kompleks Ni(II) - difenilamin dapat disintesis dari Ni(NO3)2.6H2O dengan
difenilamin.
2. Formula kompleks yang mungkin terbentuk adalah
Ni(difenilamin)m(NO3)2.nH2O dengan m = 1,2,3,4,5 atau 6 dan n =
0,1,2,3,4,5 atau 6.
3. Karakterisasi kompleks Ni(II) -difenilamin antara lain:
a. Pergeseran spektra elektronik ke arah panjang gelombang yang kecil.
b. Kompleks bersifat paramagnetik dengan harga momen magnet efektif
berkisar antara 2,83-3,2 BM.
c. Ikatan koordinasi antara Ni(II) dengan Difenilamin diperkirakan melalui
atom N pada gugus NH sekunder.
4. Struktur kompleks diperkirakan oktahedral.
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
BAB III
METODOLOGI PENELITIAN
A. Metode Penelitian
Metode yang dilakukan dalam sintesis kompleks ini adalah metode
eksperimen. Terbentuknya kompleks ditandai dengan adanya pergeseran spektrum
UV-Vis dan pergeseran spektrum infra merah. Formula kompleks diperkirakan
dari pengukuran kadar nikel(II) dalam kompleks dengan spektrofotometer serapan
atom (SSA), pengukuran daya hantar listrik (DHL) dengan konduktivitimeter.
Sifat kompleks ditentukan dari pengukuran spektrum UV-Vis, spektrum infra
merah, dan sifat kemagnetannya.
B. Tempat dan Waktu Penelitian
Penelitian dilakukan selama sepuluh bulan mulai bulan Juli 2010 sampai
dengan April2011 :
1. Sintesis kompleks, pengukuran kadar logam, daya hantar listrik, spektrum
elektronik, dan momen magnet dilakukan di Laboratorium Pusat MIPA Sub
Laboratorium Kimia Universitas Sebelas Maret Surakarta.
2. Pengukuran spektrum infra merah dilakukan di Laboratorium Kimia Fakultas
MIPA Universitas Sebelas Maret Surakarta.
C. Alat dan Bahan
1. Alat
a. Spektrofotometer serapan atom (SSA) Shimadzu AA-6650
b. Spektrofotometer UV-Vis Double Beam Shimadzu 1601
c. Spektrofotometer FTIR Prestige 21
d. Magnetic Susceptibility Balance (MSB) Auto Sherwood Scientific 10169
e. Konduktivitimeter Jenway CE 4071
f. Neraca analitik Shimadzu AEL-200
g. Pemanas listrik Cimarec Thermolyne
h. Pengaduk magnetik Heidholp M1000 Germany
i. Peralatan gelas
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
j. Termometer 100 ºC
2. Bahan-bahan
Semua bahan kimia yang digunakan dalam penelitian ini mempunyai
derajat kemurnian pro analisis (pa) :
a. Ni(NO3)2.6H2O (Merck)
b. Difenilamin (Merck)
c. Asam nitrat (HNO3) 16 M (Merck)
d. KBr kering (Merck)
e. Metanol (Merck)
f. NiSO4.6H2O (Merck)
g. CuSO4.5H2O (Merck)
h. CuCl2.6H2O (Merck)
i. NiCl2.6H2O (Merck)
j. AlCl3.6H2O (Merck)
k. Akuades
l. Kertas saring
D. Prosedur Penelitian
1. Sintesis Kompleks Ni(II) dengan Difenilamin
Ni(NO3)2.6H2O (0,582 g, 2 mmol) dalam metanol (10 ml) ditambahkan ke
dalam larutan difenilamin (2,031 g; 12 mmol) dalam metanol (20 ml) lalu diaduk
konstan selama ± 3 jam. Larutan kemudian dipekatkan sampai volume ± 10 ml
dan dibiarkan selama ± 48 jam hingga terbentuk endapan hijau muda. Endapan
ini kemudian direkristalisasi, dicuci dengan metanol dan didiamkan pada suhu
kamar (1,6320 g; 84,328%).
2. Penentuan Kadar Nikel
Pengukuran kadar nikel diukur dengan spektrofotometer serapan atom
(SSA). Larutan standar induk dibuat dengan melarutkan Ni(NO3)2.6H2O dalam
HNO3 0,1 M sehingga diperoleh standar Ni2+ 1000 ppm, kemudian dibuat larutan
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
standar Ni2+ 25 ppm dalam 0,1 M HNO3. Konsentrasi larutan standar untuk
pengukuran dibuat pada konsentrasi 0; 1; 2; 3; 4 dan 5 ppm yang diambil dari
larutan standar 25 ppm, kemudian diukur absorbansinya dan dibuat kurva standar.
Larutan sampel dibuat dengan mendistruksi sampel dengan HNO3 pekat sehingga
diperoleh konsentrasi tidak lebih dari 5 ppm, diukur absorbansinya kemudian
diplotkan pada kurva standar.
3. Pengukuran Daya Hantar Listrik (DHL)
Sampel dan standar dilarutkan dalam metanol dan dibuat pada konsentrasi
kurang lebih sama (10-3 M), kemudian masing-masing larutan diukur daya hantar
listriknya dengan konduktivitimeter (setiap pengukuran dikoreksi terhadap nilai
daya hantar spesifik pelarut, kpelarut).
4. Pengukuran Momen Magnet
Sampel senyawa kompleks padat yang akan ditentukan harga momen
magnetnya dimasukkan ke dalam tabung kosong pada neraca kerentanan
magnetik, lalu diukur tinggi sampel dalam tabung minimal 1,5 cm dan beratnya
antara 0,001 – 0,999 gram. Hasil pengukuran akan diperoleh harga kerentanan
magnetik per gram atom (χg) yang kemudian diubah menjadi kerentanan magnetik
molar (χM) dan dikoreksi terhadap faktor diamagnetik (χL), sehingga didapatkan
nilai kerentanan magnetik terkoreksi (χA). Dari harga χA dapat dihitung momen
magnet efektifnya.
5. Pengukuran Spektrum Infra Merah
Masing-masing sampel senyawa kompleks dan ligan difenilamin (1 mg)
dibuat pelet menggunakan KBr kering (300 mg). Masing-masing pelet dibuat
spektrumnya dengan menggunakan Spektrofotometer FTIR pada daerah 4000-400
cm-1.
6. Pengukuran Spektrum Elektronik
Sampel dan standar dilarutkan dalam metanol dengan konsentrasi 10-2 M
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
UV-Vis. Pengukuran spektrum elektronik dilakukan pada daerah 350 nm – 800
nm. Serapan diamati pada absorbansi yang sesuai dengan panjang gelombang
maksimum dengan spektrofotometer UV-Vis.
E. Teknik Pengumpulan dan Analisis Data
Data hasil pengamatan diolah secara deskriptif non statistik. Indikasi
terbentuknya kompleks nikel(II) dengan difenilamin ditandai dengan pergeseran
panjang gelombang spektrum elektronik UV-Vis dari Ni(NO3)2.6H2O. Formula
kompleks diperkirakan dari hasil analisis SSA yaitu kadar logam Ni dan hasil
eksperimen ini dibandingkan dengan yang persentasenya mendekati perhitungan
secara teoritis, hasil pengukuran daya hantar listrik yang menunjukkan jumlah
muatan ion dalam kompleks. Sifat magnetik kompleks ditentukan dengan
pengukuran nilai momen magnet menggunakan MSB. Besarnya energi transisi
pada kompleks diketahui dari spektrum elektronik UV-Vis. Gugus fungsi ligan
yang terkoordinasi pada ion pusat diperkirakan dari pergeseran spektrum infra
merah.
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
BAB IV
HASIL PENELITIAN DAN PEMBAHASAN
A. Sintesis Kompleks
Sintesis Kompleks Nikel(II) dengan Difenilamin
Sintesis kompleks Ni(II)-difenilamin dilakukan dengan menambahkan
larutan Ni(NO3)2.6H2O (0,582 g, 2 mmol) dalam 10 ml metanol secara
bertetes-tetes ke dalam larutan difenilamin (2,031 g, 12 mmol) dalam metanol 20 ml pada
suhu kamar sehingga merubah warna larutan yang semula bening menjadi hijau
muda. Pengadukan larutan dilakukan selama ± 3 jam, kemudian dipekatkan
hingga 10 ml dan didiamkan ± 48 jam untuk menghasilkan padatan berwarna
hijau muda (1,6320 g) yang diperkirakan kompleks Ni(II)-difenilamin.
Pembentukan kompleks ini diindikasikan oleh adanya pergeseran serapan
panjang gelombang maksimum (λmax) spektrum elektronik Ni(NO3)2.6H2O ke
arah yang lebih kecil, seperti yang ditunjukkan gambar 22.
Gambar 22. Spektrum Elektronik kompleks Ni(H2O)62+ dalam metanol (a) dan
Spektrum Elektronik kompleks Ni(II)-difenilamin dalam metanol (b).
(a) 397,50 nm
(b) 396,00 nm
(b) 724,50 nm
(a) 728,00 nm


![Gambar 1. Struktur kompleks [Ni(L1)] (L1 = tetrazole) (Kang et. al., 2009)](https://thumb-ap.123doks.com/thumbv2/123dok/323853.212942/18.595.113.494.215.514/gambar-struktur-kompleks-ni-l-l-tetrazole-kang.webp)
![Gambar 2. Struktur kompleks [Ni(L2)(H2O)2Cl2] (Revanasiddappa et. al., 2010)](https://thumb-ap.123doks.com/thumbv2/123dok/323853.212942/19.595.114.510.103.690/gambar-struktur-kompleks-l-h-o-cl-revanasiddappa.webp)