commit to user
SINTESIS DAN KARAKTERISASI KOMPLEKS
TEMBAGA(II) DENGAN DIFENILAMIN
Disusun oleh :
ENDAH SUCININGRUM
M0306026
SKRIPSI
Ditulis dan diajukan untuk memenuhi sebagian persyaratan mendapatkan gelar Sarjana Sains Kimia
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SEBELAS MARET
SURAKARTA
commit to user
HALAMAN PENGESAHAN
Skripsi ini dibimbing oleh :
Pembimbing I
Prof. Drs. Sentot Budi Rahardjo, Ph.D. NIP. 19560507 198601 1001
Dipertahankan di depan TIM Penguji Skripsi pada : Hari : Jum‟at
Tanggal : 10 Juni 2011
Anggota TIM Penguji :
1. Edi Pramono, M.Si ……….
NIP. 19830918 200812 1003
2. Soerya Dewi Marliyana, M.Si ……….
NIP. 19690313 199702 2001
Disahkan oleh Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sebelas Maret
Surakarta
Ketua Jurusan Kimia,
Prof. Drs. Sentot Budi Rahardjo, Ph.D. NIP. 19560507 198601 1001
commit to user
PERNYATAAN
Dengan ini saya menyatakan bahwa dalam skripsi saya yang berjudul “SINTESIS DAN KARAKTERISASI KOMPLEKS TEMBAGA(II) DENGAN DIFENILAMIN” adalah benar-benar hasil penelitian sendiri dan tidak terdapat karya yang pernah diajukan untuk memperoleh gelar kesarjanaan di suatu perguruan tinggi, dan sepanjang pengetahuan saya juga tidak terdapat kerja atau pendapat yang pernah ditulis atau diterbitkan oleh orang lain, kecuali yang secara tertulis diacu dalam naskah ini dan disebutkan dalam daftar pustaka.
Surakarta, Juni 2011
ENDAH SUCININGRUM
commit to user
SINTESIS DAN KARAKTERISASI
KOMPLEKS TEMBAGA(II) DENGAN DIFENILAMIN
ENDAH SUCININGRUM
Jurusan Kimia. Fakultas MIPA. Universitas Sebelas Maret
ABSTRAK
Penelitian tentang kompleks difenilamin dengan CuCl2.2H2O dan
CuSO4.5H2O bertujuan untuk mengetahui cara sintesis, struktur dan karakteristik
kompleks yang terbentuk. Kompleks difenilamin dengan CuCl2.2H2O dan
CuSO4.5H2O telah disintesis pada perbandingan mol logam dan mol ligan 1 : 4
dalam metanol. Terbentuknya kompleks ditandai oleh adanya pergeseran spektra UV-Vis. Kadar Cu ditentukan dengan Spektrofotometer Serapan Atom (SSA), perbandingan muatan kation : anion diketahui dari daya hantar listriknya, gugus fungsi difenilamin yang terkoordinasi pada atom pusat Cu2+ diperkirakan dari adanya pergeseran spektra IR.
Hasil analisis kadar Cu dalam kompleks menunjukkan rumus empiris dari kompleks adalah Cu(difenilamin)4.Cl2.6H2O dan Cu(difenilamin)4.SO4.6H2O.
Daya hantar listrik kompleks Cu(difenilamin)4.Cl2.6H2O dan
Cu(difenilamin)4.SO4.6H2O menunjukkan perbandingan muatan kation : anion
berturut-turut = 2 : 1 dan 1 : 1. Data spektra IR menunjukkan gugus fungsi (›N-H) difenilamin terkoordinasi pada atom pusat Cu2+. Momen magnet (μeff) kompleks
Cu(difenilamin)4.Cl2.6H2O dan Cu(difenilamin)4.SO4.6H2O = 1,71 ± 0,02 dan
1,72 ± 0,01 BM yang bersifat paramagnetik. Spektra UV-Vis kompleks Cu(difenilamin)4.Cl2.6H2O menunjukkan tiga puncak serapan pada panjang
gelombang 861; 592,5 dan 419 nm (11614,40; 16877,64 dan 23866,35 cm-1) yang merupakan transisi 2B1g → 2A1g, 2B1g → 2B2g dan 2B1g → 2Eg, sedangkan untuk
kompleks Cu(difenilamin)4.SO4.6H2O menunjukkan dua puncak serapan pada
panjang gelombang 593 dan 421,5 nm (υ = 16863,41 dan 23724,79 cm-1) yang merupakan transisi 2B1g → 2B2g dan 2B1g → 2Eg. Hal ini mengindikasikan kedua
kompleks berstruktur square planar. Dengan demikian struktur kompleks yang terbentuk adalah [Cu(difenilamin)4]Cl2.6H2O dan [Cu(difenilamin)4]SO4.6H2O.
Kata kunci : Sintesis, Karakterisasi, Kompleks Cu(II), Difenilamin
commit to user
SYNTHESIS AND CHARACTERIZATION OF COPPER(II) COMPLEX WITH DIPHENYLAMINE
ENDAH SUCININGRUM
Department of Chemistry. Mathematic and Natural Science Faculty. Sebelas Maret University
ABSTRACT
The objective of this research is to find out the complex synthesis of diphenylamine with CuCl2.2H2O and CuSO4.5H2O, structure and characteristic of
each the complex. Complexes of diphenylamine with CuCl2.2H2O and
CuSO4.5H2O have been synthesized in 1 : 4 mole ratio of metal to ligan in
methanol. The forming of complex was indicated by shifting of UV-Vis spectra. The percentage of Cu was determined by Atomic Absorption Spectroscopy (AAS), the charge ratio of cation and anion was known by it‟s electrical conductivity, the functional group of diphenylamine which coordinated to center ion Cu2+ was predicted by shifting of infra red spectra.
The result of analysis Cu(II) in the complex shows empirical formula of the complexes were Cu(difenilamin)4.Cl2.6H2O and Cu(difenilamin)4.SO4.6H2O.
The electrical conductivit y of complexes Cu(difenilamin)4.Cl2.6H2O and
Cu(difenilamin)4.SO4.6H2O show the charge ratio of cation and anion = 2 : 1
and 1 : 1, respectively. Infra red spectra indicated that the functional group of (›N-H) of diphenylamine was coordinated to the center ion Cu2+
. Magnetic moment (μeff) of Cu(difenilamin)4.Cl2.6H2O and Cu(difenilamin)4.SO4.6H2O were
1,71 ± 0,02 and 1,72 ± 0,01 BM, respectively, it means the complexes were paramagnetic. The UV-Vis spectra of Cu(difenilamin)4.Cl2.6H2O shows three
transition peaks on = 861; 592,5 and 419 nm (11614,40; 16877,64 and 23866,35 cm-1) corresponding to the transition 2B1g → 2A1g, 2B1g → 2B2g and 2B1g → 2Eg,
while the Cu(difenilamin)4.SO4.6H2O complex shows two transition peaks on =
593 and 421,5 nm (υ = 16863,41 and 23724,79 cm-1) corresponding to the transition 2B1g → 2B2g and 2B1g → 2Eg. It indicated that the structure of both
complexes were square planar. Finally, the structure of complexes were [Cu(difenilamin)4]Cl2.6H2O and [Cu(difenilamin)4]SO4.6H2O.
Keyword : Synthesis, Characterization, Copper(II) Complexes, Diphenylamine
commit to user
MOTTO
Barangsiapa yang bertakwa kepada Allah, Niscaya Dia akan mengadakan jalan keluar baginya, dan memberinya rizqi dari arah yang tidak disangka - sangkanya
(Q.S.Ath-Thalaq : 2 - 3)
Sesungguhnya sesudah kesulitan ada kemudahan.
Maka apabila engkau telah selesai (dari suatu urusan), maka kerjakanlah (urusan yang lain) dengan sungguh-sungguh
(Q.S. Al-Insyirah : 6-7)
Hai orang-orang yang beriman,
mintalah pertolongan (kepada Allah) dengan sabar dan sholat sesungguhnya Allah beserta orang-orang yang sabar
(Q.S. Al-Baqarah : 153)
commit to user
PERSEMBAHAN
Dengan segenap rasa syukur penulis persembahkan karya ini untuk :
Ibunda dan Ayahanda tercinta yang senantiasa memberikan kasih sayang, doa, bimbingan, cinta dan kepercayaan …
Mas Arief, mas Basuki, & mas Santosa yang selalu memberikan kasih sayang, doa dan motivasi …
Teman kecilku yang telah mengajariku akan arti hidup di dunia yang singkat ini …
Fita dan Syafii yang setia menemani hari-hariku di Laboratorium ...
Sahabat-sahabatku di FC Club ...
Sahabat-sahabat seperjuangan 2006 ...
commit to user
KATA PENGANTAR
Alhamdulillaah, puji syukur penulis panjatkan ke hadirat Alloh „Azza wa Jalla yang telah melimpahkan rahmat, karunia dan hidayah-Nya sehingga penulis dapat menyelesaikan penulisan skripsi dengan judul “SINTESIS DAN KARAKTERISASI KOMPLEKS TEMBAGA(II) DENGAN DIFENILAMIN” untuk memenuhi sebagian persyaratan guna mencapai gelar Sarjana Sains dari Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sebelas Maret. Sholawat dan salam senantiasa penulis haturkan kepada Rosulullah Sholallahu „Alaihi Wassalaam sebagai suri tauladan bagi seluruh umat manusia.
Skripsi ini tidak akan selesai tanpa adanya bantuan dari banyak pihak, karena itu dengan kerendahan hati penulis menyampaikan terima kasih kepada : 1. Bapak Prof. Drs. Sutarno, M.Sc., Ph.D., selaku Dekan FMIPA UNS.
2. Bapak Prof. Drs. Sentot Budi Rahardjo, Ph.D., selaku Ketua Jurusan Kimia, Pembimbing Akademik dan Pembimbing TA.
3. Bapak I.F. Nurcahyo, M.Si., selaku Ketua Laboratorium Kimia Dasar FMIPA UNS.
4. Bapak Dr. rer. nat. Atmanto Heru Wibowo, M.Si., selaku Ketua Sub Laboratorium Kimia Laboratorium Pusat FMIPA UNS.
5. Mas Anang dan Mbak Nanik selaku staf Laboratorium Kimia FMIPA UNS. 6. Bapak Kentriyus, Bapak Sugito, Bapak Basuki, Mas Wanto, Mbak Retno,
Mbak Watik dan Mbak Tutik selaku staf Sub Laboratorium Kimia Laboratorium Pusat FMIPA UNS.
7. Mbak Imah dan Mbak Asri selaku karyawan Jurusan Kimia FMIPA UNS. 8. Sahabat-sahabatku Erna, Ovy, Rina, Nurul, Tya, Eva Ro dan Santi di FC
Club, terima kasih atas semua nasihat, semangat dan dukungan yang telah
kalian berikan.
9. Spesial untuk Fita dan Syafii, yang senantiasa setia menemani hari-hariku selama penelitian di Laboratorium, terima kasih atas semua nasihat, semangat dan dukungan serta kesabarannya.
commit to user
10. Saudara-saudara seperjuangan 2006, terima kasih atas semua dukungan, semangat dan doanya.
Semoga Allah „Azza wa Jalla membalas jerih payah dan pengorbanan yang telah diberikan dengan balasan yang lebih baik. Amin.
Penulis menyadari banyak kekurangan dalam penulisan skripsi ini. Oleh karena itu, penulis mengharapkan kritik dan saran untuk menyempurnakannya. Namun demikian, penulis berharap semoga karya kecil ini bermanfaat bagi perkembangan ilmu pengetahuan dan semuanya. Amin.
Surakarta, Juni 2011
Endah Suciningrum
commit to user DAFTAR ISI Halaman HALAMAN JUDUL ... i HALAMAN PENGESAHAN ... ii PERNYATAAN ... iii ABSTRAK ... iv ABSTRACT ... v HALAMAN MOTTO ... vi
HALAMAN PERSEMBAHAN ... vii
KATA PENGANTAR ... viii
DAFTAR ISI ... x
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN ... xvi
TABEL LAMPIRAN ... xvii
GAMBAR LAMPIRAN ... xviii
BAB I PENDAHULUAN ... 1
A. Latar Belakang Masalah ... 1
B. Perumusan Masalah ... 5 1. Identifikasi Masalah ... 5 2. Batasan Masalah ... 5 3. Rumusan Masalah ... 6 C. Tujuan Penelitian ... 6 D. Manfaat Penelitian ... 6
BAB II LANDASAN TEORI ... 7
A. Tinjauan Pustaka ... 7
1. Sintesis Senyawa Kompleks ... 7
2. Kompleks Cu(II) ... 8
3. Teori Pembentukan Kompleks ... 10
a. Teori Ikatan Valensi ... 10
b. Teori Medan Kristal ... 13
commit to user
1) Kompleks Oktahedral ... 13
2) Kompleks Tetrahedral ... 14
3) Kompleks Square Planar ... 16
c. Teori Orbital Molekul ... 17
4. Spektroskopi Elektronik Kompleks Tembaga(II) ... 21
5. Sifat magnetik ... 22
6. Spektroskopi Infra Merah ... 24
7. Daya Hantar Listrik ... 25
8. Spektroskopi Serapan Atom (SSA) ... 26
9. Ligan Difenilamin ... 27
B. Kerangka Pemikiran ... 28
C. Hipotesis ... 28
BAB III METODOLOGI PENELITIAN ... 29
A. Metode Penelitian ... 29
B. Tempat dan Waktu ... 30
C. Alat dan Bahan ... 30
1. Alat ... 30
2. Bahan-bahan ... 31
D. Prosedur Penelitian ... 31
1. Penentuan Bilangan Koordinasi Ion Cu2+ ... 31
2. Sintesis Senyawa Kompleks Cu(II)-Difenilamin... 32
a. Sintesis Kompleks CuCl2.2H2O dengan Difenilamin. 32 b. Sintesis Kompleks CuSO4.5H2O dengan Difenilamin 32 3. Pengukuran Kadar Cu(II) dengan SSA ... 33
4. Pengukuran Daya Hantar Listrik ... 33
5. Pengukuran Momen Magnet... 33
6. Pengukuran Spektra UV-Vis ... 33
7. Pengukuran Spektra Infra Merah ... 34
E. Teknik Pengumpulan dan Analisis Data ... 34
commit to user
BAB IV HASIL DAN PEMBAHASAN ... 35
A. Sintesis Kompleks Cu(II)-Difenilamin ... 35
1. Sintesis Kompleks CuCl2.2H2O dengan Difenilamin .... 35
a. Penentuan Bilangan Koordinasi Ion Cu2+ dengan Metode Perbandingan Mmol ... 35
b. Sintesis Kompleks CuCl2.2H2O dengan Difenilamin. 37 2. Sintesis Kompleks CuSO4.5H2O dengan Difenilamin ... 38
B. Penentuan Formula Kompleks ... 39
1. Penentuan Kadar Cu dalam Kompleks ... 39
a. Pengukuran Kadar Cu dalam Kompleks CuCl2.2H2O dengan Difenilamin ... 39
b. Pengukuran Kadar Cu dalam Kompleks CuSO4.5H2O dengan Difenilamin ... 39
2. Pengukuran Daya Hantar Listrik ... 40
3. Spektra Infra Merah ... 41
C. Sifat-Sifat Kompleks... 46
1. Sifat Spektroskopi ... 46
2. Sifat Kemagnetan ... 48
D. Perkiraan Struktur Senyawa Kompleks ... 48
1. Kompleks [Cu(difenilamin)4]Cl2.nH2O... 48
2. Kompleks [Cu(difenilamin)4]SO4.nH2O ... 49
BAB V PENUTUP ... 51 A. Kesimpulan ... 51 B. Saran ... 51 DAFTAR PUSTAKA ... 52 LAMPIRAN ... 55 xii
commit to user
DAFTAR TABEL
Halaman Tabel 1. Bentuk Hibridisasi Dan Konfigurasi Geometri ... 12 Tabel 2. Faktor Koreksi Diamagnetik untuk Beberapa Ion dan
Molekul ... 23 Tabel 3. Pembuatan Seri Larutan CuCl2.2H2O dengan Difenilamin
dalam Metanol ... 32 Tabel 4. Kadar Tembaga dalam Kompleks CuCl2.2H2O dengan
Difenilamin Secara Teoritis ... 39 Tabel 5. Kadar Tembaga dalam Kompleks CuSO4.5H2O dengan
Difenilamin Secara Teoritis ... 40 Tabel 6. Daya Hantar Listrik Larutan Standar 103M dan Larutan
Sampel Kompleks Cu(difenilamin)4.Cl2.6H2O dan
Cu(difenilamin)4.SO4.6H2O 103M dalam Metanol ... 40
Tabel 7. Serapan Gugus Fungsi Ligan Difenilamin, Kompleks Cu(difenilamin)4.Cl2.6H2O dan Cu(difenilamin)4.SO4.6H2O . 41
Tabel 8. Tabel Pergeseran Serapan Gugus (›NH) pada Beberapa Kompleks ... 45 Tabel 9. Panjang Gelombang Maksimum (λmaks), Absorbansi (A)
dan Besarnya Harga Absorptivitas Molar (ε) : CuCl2.2H2O,
CuSO4.5H2O, Kompleks Cu(difenilamin)4.Cl2.6H2O dan
Cu(difenilamin)4.SO4.6H2O ... 46
Tabel 10. Moment Magnet Efektif (µeff) Kompleks
Cu(difenilamin)4.Cl2.6H2O dan Cu(difenilamin)4.SO4.6H2O . 48
commit to user
DAFTAR GAMBAR
Halaman Gambar 1. Struktur senyawa kompleks [CuL1](H2O) (L1 = N,N’-
O-phenylenebis(salicylideneimine)) yang bergeometri
square planar ... 2
Gambar 2. Struktur senyawa kompleks [Cu(L2)2] (L2 = 4-chloro benzaldehydephenylhydrazone) yang bergeometri square planar ... 2
Gambar 3. Struktur senyawa kompleks [{Cu(CH3COO)}2(μ-L3)2] (L3 = 2-((2-(dimethylamino)ethylamino)methyl)phenol) yang bergeometri square pyramidal ... 3
Gambar 4. Struktur senyawa kompleks [Cu(L4)(H2O)2(Cl)2] (L4 = desipramine) yang bergeometri oktahedral ... 3
Gambar 5. Struktur difenilamin ... 4
Gambar 6. Konfigurasi elektron Cu dan Cu2+ ... 8
Gambar 7. Struktur kompleks [Cu(L6)(OH)2] (L6 =3,5-diamine-4-(4-bromo-phenylazo)-1H-pyrazole) yang bergeometri square planar ... 9
Gambar 8. Struktur kompleks [Cu(L5)2(H2O)(SO42-)] (L5 = aminoguanizone of pyruvic acid) yang bergeometri square pyramidal ... 9
Gambar 9. Struktur kompleks [Cu(L8)2(Cl)2] (L8 = 2-[(4-phenyl-1H-1,2,3-triazol-1-yl)methyl]pyridine) yang bergeometri oktahedral terdistorsi Jahn-Teller... 10
Gambar 10. Penggambaran teori ikatan valensi [CoF6]3- dan [Co(NH3)6]3+ ... 11
Gambar 11. Ilustrasi pembentukan hibridisasi dsp2 pada ion ... 12
Gambar 12. Arah sumbu x, y dan z dalam medan oktahedral ... 13
Gambar 13. (a) Kelompok eg (b) Kelompok t2g ... 13
Gambar 14. Diagram tingkat energi orbital d pada medan oktahedral 14 Gambar 15. Hubungan tetrahedron dengan kubus ... 15
commit to user
Gambar 16. Pembelahan dan tingkat energi orbital d pada medan
tetrahedral ... 15
Gambar 17. Distorsi kompleks oktahedral yang kemudian menjadi kompleks oktahedral yang terdistorsi secara tetragonal dan kompleks square planar ... 16
Gambar 18. Pembelahan orbital d pada kompleks square planar ... 17
Gambar 19. Diagram tingkat energi kompleks oktahedral ... 18
Gambar 20. Diagram tingkat energi kompleks tetrahedral ... 19
Gambar 21. Diagram tingkat energi kompleks square-planar ... 20
Gambar 22. Pembelahan tingkat energi konfigurasi d9 pada medan oktahedral ... 21
Gambar 23. Pembelahan tingkat energi konfigurasi d9 pada medan square planar ... 21
Gambar 24. Struktur difenilamin.. ... 27
Gambar 25. Spektra UV-Vis penentuan bilangan koordinasi ion Cu2+ dengan metode perbandingan mmol (mmol CuCl2.2H2O : mmol difenilamin) ... 35
Gambar 26. Grafik λmaks versus perbandingan mmol CuCl2.2H2O dengan mmol difenilamin pada penentuan bilangan koordinasi ion Cu2+ dengan metode perbandingan mmol 36 Gambar 27. Spektra UV-Vis (a) CuCl2.2H2O dan (b) kompleks CuCl2.2H2O dengan difenilamin ... 37
Gambar 28. Spektra UV-Vis (a) CuSO4.5H2O dan (b) kompleks CuSO4.5H2O dengan difenilamin ... 38
Gambar 29. Spektra IR ligan difenilamin ... 42
Gambar 30. Spektra IR kompleks Cu(difenilamin)4.Cl2.6H2O ... 42
Gambar 31. Spektra IR kompleks Cu(difenilamin)4.SO4.6H2O ... 43
Gambar 32. Spektra UV-Vis (a) Cu(difenilamin)4.Cl2.6H2O (b) Cu(difenilamin)4.SO4.6H2O ... 47
Gambar 33. Perkiraan struktur [Cu(difenilamin)4]Cl2. nH2O ... 49
Gambar 34. Perkiraan struktur [Cu(difenilamin)4]SO4. nH2O ... 50
commit to user
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Diagram Alir Percobaan ... 55
Lampiran 2. Penentuan Bilangan Koordinasi Ion Cu2+ ... 57
Lampiran 3. Perhitungan Rendemen Kompleks Hasil Sintesis ... 58
Lampiran 4. Pengukuran Kadar Tembaga dalam Kompleks Menggunakan SSA ... 59
Lampiran 5. Pengukuran Daya Hantar Listrik Kompleks ... 61
Lampiran 6. Penentuan Momen Magnet Effektif ... 62
Lampiran 7. Perhitungan Nilai Absorptivitas Molar ... 65
commit to user
TABEL LAMPIRAN
Halaman Tabel 1. Penentuan Bilangan Koordinasi Ion Cu2+ pada Kompleks
CuCl2.2H2O dengan Difenilamin Menggunakan Metode
Perbandingan Mmol...……….. ... 57 Tabel 2. Data dan Hasil Perhitungan Kadar Tembaga dengan SSA
dalam Kompleks CuCl2.2H2O dengan Difenilamin ... 60
Tabel 3. Data dan Hasil Perhitungan Kadar Tembaga dengan SSA dalam Kompleks CuSO4.5H2O dengan Difenilamin ... 60
Tabel 4. Daya Hantar Listrik Larutan Standar 103M dan Kompleks Cu(difenilamin)4.Cl2.6H2O dan Cu(difenilamin)4.SO4.6H2O
103M dalam Metanol ... 61 Tabel 5. Hasil Pengukuran Kerentanan Magnetik Kompleks
Cu(difenilamin)4.Cl2.6H2O dan Cu(difenilamin)4.SO4.6H2O . 62
Tabel 6. Harga μeff pada Beberapa Harga χg dari Kompleks
Cu(difenilamin)4.Cl2.6H2O dan Cu(difenilamin)4.SO4.6H2O . 64
commit to user
GAMBAR LAMPIRAN
Halaman Gambar 1. Diagram sintesis dan karakterisasi senyawa kompleks
CuCl2.2H2O dengan difenilamin ... 55
Gambar 2. Diagram sintesis dan karakterisasi senyawa kompleks CuSO4.5H2O dengan difenilamin ... 56
Gambar 3. Kurva larutan standar Cu(II) pada konsentrasi 0-3 ppm . 59
commit to user
BAB I PENDAHULUAN
A. Latar Belakang Masalah
Sejumlah senyawa kompleks terjadi dan terdapat secara alamiah dalam sistem biologi. Proses pengikatan oksigen oleh Fe menjadi senyawa kompleks dalam tubuh merupakan salah satu contoh aplikasi senyawa kompleks. Studi pembentukan kompleks menjadi hal yang menarik untuk dipelajari karena kompleks yang terbentuk dimungkinkan memberi banyak manfaat misalnya untuk ekstraksi, sebagai katalis dan penanganan keracunan logam berat. Senyawa kompleks terdiri dari ion logam yang dikelilingi oleh molekul-molekul atau ion-ion yang disebut ligan.
Tembaga(II) merupakan salah satu ion logam transisi deret pertama yang mempunyai orbital d yang terisi sebagian atau belum terisi penuh. Tembaga(II) mempunyai konfigurasi elektron 3d9 dengan satu elektron tidak berpasangan. Tembaga(II) memiliki stabilitas kompleks yang paling besar jika dibandingkan dengan logam transisi deret pertama yang lain dan paling stabil jika dibandingkan dengan bilangan oksidasi tembaga lain. Kebanyakan senyawa tembaga(I) cukup mudah teroksidasi menjadi tembaga(II). Pada umumnya tembaga(II) membentuk kompleks dengan bilangan koordinasi 4, 5 atau 6 dengan geometri square planar,
square pyramidal atau oktahedral.
Belaid et al. (2008) mensintesis kompleks [CuL1](H2O) (L1 =
N,N’-O-phenylenebis(salicylideneimine)), ligan L1 terkoordinasi pada ion Cu2+ secara tetradentat melalui gugus (›NH) dan atom O gugus hidroksil fenol yang terdeprotonasi membentuk geometri square planar seperti yang ditunjukkan oleh Gambar 1.
commit to user
Gambar 1. Struktur senyawa kompleks [CuL1](H2O) (L1 = N,N’-O-phenylene
bis(salicylideneimine)) yang bergeometri square planar (Belaid et al., 2008: 63-69)
Hania, M. (2009) mensintesis kompleks [Cu(L2)2] (L2 = 4-chloro
benzaldehydephenylhydrazone) yang strukturnya ditunjukkan oleh Gambar 2.
Ligan L2 terkoordinasi pada ion Cu2+ melalui atom N dari gugus (›NH) dan gugus C=N secara bidentat membentuk kompleks dengan geometri square planar.
N N H H Cl N H N H Cl Cu2+
Gambar 2. Struktur senyawa kompleks [Cu(L2)2] (L2 = 4-chlorobenzaldehyde
phenylhydrazone) yang bergeometri square planar (Hania M.,
2009: 508-514)
commit to user
Bhardwaj et al. (2010) mensintesis kompleks [{Cu(CH3COO)}2(μ-L3)2]
(L3 = 2-((2-(dimethylamino)ethylamino)methyl)phenol), ligan L3 terkoordinasi pada ion Cu2+ melalui gugus (›NH), atom N tersier dan atom O gugus fenol yang terdeprotonasi. Dalam kompleks ini, anion CH3COO- juga terkoordinasi pada ion
Cu2+ sehingga menghasilkan kompleks yang bergeometri square pyramidal seperti ditunjukkan oleh Gambar 3.
O -HN N H3C H3C O -NH N CH3 CH3 Cu2+ Cu2+ O -C O CH3 O -C O CH3
Gambar 3. Struktur senyawa kompleks [{Cu(CH3COO)}2(μ-L3)2] (L3 =
2-((2-(dimethylamino)ethylamino)methyl)phenol) yang bergeometri
square pyramidal (Bhardwaj et al., 2010: 97–106)
Revanasiddappa et al. (2010) mensintesis kompleks [Cu(L4)(H2O)2(Cl)2]
(L4 = desipramine), ligan L4 terkoordinasi pada ion Cu2+ melalui gugus (›NH) dan atom N heterosiklik secara bidentat. Dalam kompleks ini, ion Cl- dan H2O juga
terkoordinasi pada ion Cu2+ membentuk geometri oktahedral seperti yang ditunjukkan oleh Gambar 4.
Gambar 4. Struktur senyawa kompleks [Cu(L4)(H2O)2(Cl)2] (L4 =
desipramine) yang bergeometri oktahedral (Revanasiddappa et al.,
2010: 18-25)
commit to user
Dari beberapa contoh senyawa kompleks di atas terlihat bahwa gugus (›NH) yang terikat antara gugus phenol-CH2- dan -phenil, gugus (›NH) yang
terikat antara gugus Cl-phenil-CH=N- dan –phenil, gugus (›NH) yang terikat antara gugus phenol-CH2- dan –C2H5N(CH3)2, gugus (›NH) yang terikat antara
gugus -CH3 dan suatu heterosiklik terkoordinasi pada ion pusat Cu2+ membentuk
kompleks dengan geometri square planar, square pyramidal dan oktahedral. Gugus pengeliling (›NH) dapat memberikan pengaruh terhadap geometri kompleks, karena itu pengaruh gugus lain yang mengelilingi gugus (›NH) perlu dipelajari misalnya pada difenilamin yang strukturnya ditunjukkan oleh Gambar 5.
H
N
Gambar 5. Struktur difenilamin
Difenilamin mengandung gugus (›NH) yang dikelilingi oleh gugus phenil, karenanya gugus (›NH) difenilamin berkesempatan terkoordinasi pada ion Cu2+. Adanya pelarut (metanol) dan anion-anion yang terdapat dalam campuran ligan dan ion Cu2+ (SO42- dan Cl-) memungkinkan juga terkoordinasi pada ion Cu2+
sebagaimana terjadi pada ion asetat dan ion klorida yang terkoordinasi pada ion Cu2+ pada kompleks [{Cu(CH3COO)}2(μ-L3)2] dan [Cu(L4)(H2O)2(Cl)2], oleh
karena itu ada beberapa kemungkinan kompleks yang terbentuk dengan geometri tertentu. Dengan demikian pembentukan kompleks antara ion Cu2+ dengan difenilamin menarik untuk dipelajari.
commit to user
B. Perumusan Masalah
1. Identifikasi Masalah
Pelarut yang digunakan dalam sintesis kompleks memiliki peranan yang penting dalam pembentukan kompleks. Penggunaan pelarut basa memungkinkan terjadinya persaingan antara ligan dengan pelarut. Penggunaan pelarut asam memungkinkan ligan akan terprotonasi oleh H+ dari pelarut sehingga menyebabkan kompleks tidak terbentuk. Sifat kelarutan ion logam dan ligan juga perlu diperhatikan. Oleh karena itu, pemilihan suatu pelarut menjadi masalah dalam sintesis kompleks. Perbandingan mmol logam dan ligan dalam pembentukan kompleks tidak selalu stoikiometri sehingga perlu dicari perbandingan yang sesuai.
Penentuan struktur kompleks dapat dilakukan berdasarkan analisis unsur-unsurnya dan kristallografi sinar-X. Karakterisasi kompleks yang terbentuk meliputi :
a. Sifat kemagnetan b. Sifat spektroskopi c. Kestabilan kompleks d. Sifat redoks kompleks
2. Batasan masalah
a. Sintesis kompleks dapat dilakukan dengan berbagai cara, antara lain dengan mencampur logam dan ligan tanpa pemanasan, dengan pemanasan, atau dengan cara refluks. Difenilamin merupakan ligan yang sedikit larut dalam air dan mudah larut dalam pelarut organik, oleh karena itu dipilih pelarut organik. Perbandingan mol logam dan ligan yang digunakan dalam sintesis kompleks dilakukan dengan menentukan bilangan koordinasi ion logam dalam kompleks dengan metode perbandingan mmol.
b. Penentuan struktur kompleks dilakukan berdasarkan analisis unsur tembaga dalam kompleks dengan Spektrofotometer Serapan Atom (SSA), daya hantar listrik larutan kompleks, dan analisis spektra FT-IR untuk memperkirakan gugus atau atom dari difenilamin yang terkoordinasi pada ion Cu2+.
commit to user
c. Karakterisasi kompleks tembaga(II) dengan difenilamin yang dilakukan meliputi sifat kemagnetan dan sifat spektroskopi kompleks.
3. Rumusan Masalah
a. Bagaimana sintesis kompleks tembaga(II) dengan difenilamin?
b. Bagaimana perkiraan struktur kompleks tembaga(II) dengan difenilamin? c. Bagaimana sifat kemagnetan dan sifat spektroskopi kompleks tembaga(II)
dengan difenilamin?
C. Tujuan Penelitian
a. Mensintesis kompleks tembaga(II) dengan difenilamin.
b. Memperkirakan struktur kompleks tembaga(II) dengan difenilamin.
c. Mengetahui sifat kemagnetan dan sifat spektroskopi kompleks tembaga(II) dengan difenilamin.
D. Manfaat Penelitian
Memberikan informasi mengenai sintesis, cara penentuan struktur dan sifat kompleks tembaga(II) dengan difenilamin.
commit to user
BAB II
LANDASAN TEORI
A. TinjauanPustaka
1. Sintesis Senyawa Kompleks
Senyawa kompleks didefinisikan sebagai senyawa yang terdiri dari ion logam yang dikelilingi oleh molekul-molekul atau ion-ion yang disebut ligan. Ion pusat pada umumnya merupakan ion-ion logam transisi karena ion logam ini memiliki orbital d yang terisi sebagian atau belum terisi penuh. Ligan adalah molekul-molekul atau ion-ion yang mempunyai atom donor elektron. Banyaknya atom donor ligan yang terkoordinasi pada atom atau ion pusat disebut bilangan koordinasi (Cotton and Wilkinson, 1998: 226).
Sintesis kompleks dapat dilakukan dengan berbagai cara antara lain dengan pencampuran larutan pada berbagai perbandingan mol logam : mol ligan dalam berbagai pelarut tanpa pemanasan, maupun dengan pemanasan pada berbagai suhu. Sintesis kompleks [Cu(L5)2(H2O)(SO42-)] (L5 = aminoguanizone of
pyruvic acid), dilakukan dengan merefluks CuSO4.5H2O dan L5 dalam campuran
DMSO-metanol (1/4V) selama 0,5 jam (Turta et al., 2008: 309-316). Kompleks [CuL1](H2O) (L1 = N,N’-O-phenylenebis(salicylideneimine)) disintesis dengan
cara merefluks CuCl2.6H2O dan L1 dalam etanol selama 4-5 jam (Belaid et al.,
2008: 63–69). Cara sintesis lain adalah dengan pancampuran disertai pemanasan seperti pada sintesis kompleks [Cu(L6)(OH)2] (L6 =
3,5-diamine-4-(4-bromo-phenylazo)-1H-pyrazole) yang diperoleh dengan mencampur larutan CuCl2.2H2O
dalam metanol dan L6 dalam DMF kemudian diaduk selama 4 jam pada suhu 110 ºC (Turan et al., 2008: 27-32). Kompleks lain dapat dihasilkan dengan pencampuran tanpa pemanasan seperti pada kompleks [Cu(L7)(Cl)2] (L7 =
2,3,5,6-tetra(2-pyridyl)pyrazine). Kompleks disintesis dengan mencampur larutan
CuCl2.2H2O dengan L7 dalam asetonitril dan diaduk selama 2 jam pada suhu
ruang (Trivedi et al., 2009: 284–290).
commit to user 2. Kompleks Cu(II)
Tembaga(II) merupakan salah satu ion logam transisi deret pertama yang terletak pada periode empat dan golongan IB, memiliki nomor atom 29 dan massa atom 63,54 g/mol. Konfigurasi elektron tembaga adalah [Ar] 3d10 4s1, sedang pada ion tembaga(II) adalah [Ar] 3d9 4s0. Konfigurasi elektron tembaga dan tembaga(II) diilustrasikan pada Gambar 6. Tembaga(II) memiliki stabilitas kompleks yang paling besar jika dibandingkan dengan logam transisi deret pertama yang lain dan paling stabil jika dibandingkan dengan bilangan oksidasi tembaga lain. Kebanyakan senyawa tembaga(I) cukup mudah teroksidasi menjadi tembaga(II) (Lee, 1994: 827).
Gambar 6. Konfigurasi elektron Cu dan Cu2+ (Basolo and Johson, 1964: 32)
Tembaga(II) dapat membentuk kompleks dengan bilangan koordinasi 4, 5 atau 6 dengan geometri square planar, square pyramidal atau oktahedral. Sebagai contoh yaitu pada kompleks [Cu(L6)(OH)2] (L6 =
3,5-diamine-4-(4-bromo-phenylazo)-1H-pyrazole) (Turan et al., 2008: 27-32) yang memiliki bilangan
koordinasi 4 dan bergeometri square planar. Pada kompleks tersebut, ligan L6 terkoordinasi pada ion Cu2+ melalui atom N di luar siklis secara bidentat dan dua ion OH- juga terkoordinasi pada ion Cu2+. Struktur kompleks [Cu(L6)(OH)2]
ditunjukkan oleh Gambar 7.
3d10 4s1 4p 4d
3d9 4s0 4p 4d
Cu [Ar]
Cu2+ [Ar]
commit to user N Br N N NH NH2 NH2 Cu2+ HO HO DMF
Gambar 7. Struktur kompleks [Cu(L6)(OH)2] (L6
=3,5-diamine-4-(4-bromo-phenylazo)-1H-pyrazole) yang bergeometri square planar (Turan et al., 2008: 27-32)
Kompleks [Cu(L5)2(H2O)(SO42-)] (L5 = aminoguanizone of pyruvic acid)
(Turta et al., 2008: 309-316) memiliki bilangan koordinasi 5 dengan geometri
square pyramidal. Atom O hidroksil yang terdeprotonasi, atom N tersier dan
(=NH) dari ligan L5 serta atom O dari H2O dan anion SO42- terkoordinasi pada ion
pusat Cu2+, seperti ditunjukkan oleh Gambar 8.
C O O C CH3 N N H C NH2 NH Cu O O S O O O H H C O O C CH3 N H N C H2N NH O H H Cu
Gambar 8. Struktur kompleks [Cu(L5)2(H2O)(SO42-)] (L5 = aminoguanizone of
pyruvic acid) yang bergeometri square pyramidal (Turta et al.,
2008: 309-316)
Kompleks [Cu(L8)2(Cl)2] (L8 =
2-[(4-phenyl-1H-1,2,3-triazol-1-yl)methyl]pyridine) (Crowley et al., 2010: 70-83) memiliki bilangan koordinasi 6
dan bergeometri oktahedral terdistorsi Jahn-Teller. Atom N siklis dari L8 secara bidentat terkoordinasi pada ion pusat Cu2+, serta dua anion Cl- terkoordinasi pada ion pusat Cu2+. Struktur kompleks [Cu(L8)2(Cl)2] dapat dilihat pada Gambar 9.
commit to user N N N N N N N N Cu2+ Cl -Cl
-Gambar 9. Struktur kompleks [Cu(L8)2(Cl)2] (L8 =
2-[(4-phenyl-1H-1,2,3-triazol-1-yl)methyl]pyridine) yang bergeometri oktahedral
terdistorsi Jahn-Teller (Crowley et al., 2010: 70-83)
3. Teori Pembentukan Kompleks
Pembentukan kompleks Cu(II) dapat dijelaskan dengan teori ikatan valensi, teori medan kristal dan teori orbital molekul.
a. Teori Ikatan Valensi
Teori ikatan valensi dikembangkan oleh Prof. Linus Pauling. Menurut teori ini, senyawa kompleks mengandung ion kompleks dengan ligan sebagai basa lewis harus mempunyai pasangan elektron bebas yang terkoordinasi pada atom pusat yang mempunyai orbital kosong. Ikatan yang terbentuk merupakan ikatan kovalen koordinasi (Lee, 1994: 202). Sebagai contoh, yaitu pada pembentukan kompleks [CoF6]3- dan [Co(NH3)6]3+.
Ion ion Co3+ mempunyai struktur elektron terluar 3d6. Pada kompleks [CoF6]3-, ion Co3+ mengandung empat elektron yang tidak berpasangan,
sedangkan semua elektron orbital d ion Co3+ pada kompleks [Co(NH3)6]3+ sudah
berpasangan. Setiap ligan, sebagai basa lewis, menyumbangkan satu pasang elektron untuk membentuk suatu ikatan kovalen koordinasi. Penggambaran teori ikatan valensi dari struktur elektronik ditunjukkan oleh Gambar 10. Kombinasi orbital-orbital atom logam bercampur menghasilkan orbital-orbital hibrida, yang membentuk ikatan kovalen paling stabil antara logam dan ligan-ligan (Basolo and Johnson, 1964: 33).
commit to user [CoF6] 3-3d 4s 4p 4d F- F- F- F- F- F -[Co(NH3)]3+ 3d 4s 4p NH3 NH3 NH3 NH3 NH3 NH3 3d
Gambar 10. Penggambaran teori ikatan valensi [CoF6]3- dan [Co(NH3)6]3+ (Lee,
1994: 203)
Orbital-orbital hibrida dalam sistem koordinasi enam melibatkan orbital-orbital atom s, px, py, pz, dx2-y2, dan dz2. Enam hasil orbital hibrida sp3d2 mengarah
pada sudut-sudut oktahedron. Untuk kompleks [CoF6]3-, orbital-orbital d yang
digunakan mempunyai tingkat energi yang sama dengan orbital s dan p. Kompleks dengan tipe nsnp3nd2 dinamakan kompleks outer-orbital karena
menggunakan orbital d luar. Pada kompleks [Co(NH3)6]3+ menggunakan orbital d
yang tingkat energinya lebih rendah dibanding orbital s dan p. Kompleks dengan tipe (n-1)d2 ns np3 dinamakan kompleks inner-orbital karena menggunakan orbital d dalam (Basolo and Johnson, 1964: 34).
Kompleks [Cu(NH3)4]2+ dapat terbentuk jika ion logam Cu2+ menyediakan
4 orbital kosong untuk ditempati pasang elektron bebas dari empat ligan NH3.
Orbital yang digunakan adalah satu orbital 3d, satu orbital 4s dan dua orbital 4p yang mengalami hibridisasi dsp 2 (Day and Selbin, 1993: 579). Ilustrasi pembentukan hibridisasi dsp2 pada ion [Cu(NH3)4]2+ ditunjukkan oleh Gambar 11.
sp3d2
d2sp3
commit to user 3d 4s 4p 4d Cu2+ Cu2+ tereksitasi 3d 4s 4p 4d [Cu(NH3)4]2+ 3d 3d 4s 4p NH3 NH3 NH3NH3
Gambar 11. Ilustrasi pembentukan hibridisasi dsp2 pada ion [Cu(NH3)4]2+ (Day
and Selbin, 1993: 579)
Orbital hibridisasi dapat digunakan untuk meramalkan geometri suatu senyawa, sebagaimana yang ditunjukkan oleh Tabel 1 (Lee, 1994: 85).
Tabel 1. Bentuk Hibridisasi dan Konfigurasi Geometri (Lee, 1994: 85)
Bilangan Koordinasi Bentuk Hibridiasi Geometri 2 Sp Lurus 3 sp2 Segitiga Datar 4 sp3 Tetrahedral 4 dsp2 Segiempat Datar 5 sp3d Segitiga Bipiramida 6 sp3d2 Oktahedral
Teori ikatan valensi ini dapat menjelaskan struktur dan kemagnetan banyak senyawa kompleks, namun memiliki kelemahan yaitu tidak dapat menerangkan warna dan spektra kompleks yang dihasilkan serta tidak dapat menjelaskan momen magnet yang berbeda pada temperatur yang bervariasi (Lee, 1994: 204).
dsp2
commit to user b. Teori Medan Kristal
Teori medan kristal mengasumsikan ikatan antara ion logam/atom pusat dan ligan dalam kompleks adalah murni elektrostatik (ikatan ion murni). Ion logam transisi sebagai atom pusat dianggap sebagai ion positif yang dikelilingi oleh ligan yang bermuatan negatif atau molekul netral yang mempunyai pasangan elektron bebas (Lee, 1994: 202).
1) Kompleks Oktahedral
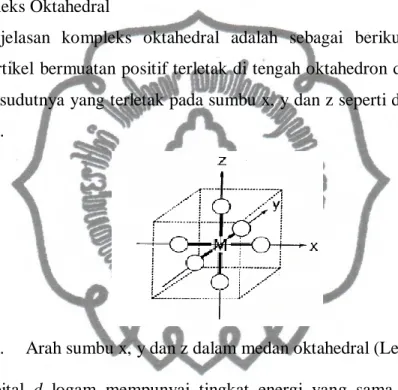
Penjelasan kompleks oktahedral adalah sebagai berikut : ion logam sebagai partikel bermuatan positif terletak di tengah oktahedron dan ligan berada di keenam sudutnya yang terletak pada sumbu x, y dan z seperti ditunjukkan oleh Gambar 12.
Gambar 12. Arah sumbu x, y dan z dalam medan oktahedral (Lee, 1994: 205) Orbital d logam mempunyai tingkat energi yang sama (terdegenerasi), akan tetapi ketika terbentuk kompleks mengalami pemisahan karena adanya pengaruh medan ligan (Lee, 1994: 204). Orbital d logam terpisah menjadi dua kelompok yaitu dxy, dxz, dyz yang disebut t2g dan dx2-y2, dz2 yang disebut eg seperti
ditunjukkan oleh Gambar 13.
y x z x y x z z y x y 3 dz2 d x 2 -y 2 dxy dyz dxz (a) (b)
Gambar 13. (a) Kelompok eg (b) Kelompok t2g (Huheey, 1993: 396)
commit to user
Medan ligan akan menyebabkan kenaikan tingkat energi orbital eg lebih
besar jika dibandingkan t2g. Diagram tingkat energi orbital d dalam medan ligan
oktahedral ditunjukkan pada Gambar 14. Perbedaan energi antara orbital t2g dan eg
adalah 10 Dq atau ∆o. Orbital eg mempunyai energi +0,6∆o di atas tingkat energi
rata-rata, sedangkan orbital t2g mempunyai energi -0,4∆o di bawah tingkat energi
rata-rata (Lee, 1994: 208).
Pengisian orbital t2g pada kompleks octahedral akan menurunkan energi
kompleks dan membuatnya menjadi lebih stabil, sebesar -0,4∆0 per elektron.
Sementara pengisian orbital eg menaikkan energi sebesar 0,6∆0 per elektron. Total
Crystal Field Stabilization Energy (CFSE) atau energi yang terstabilkan oleh
medan kristal adalah
CFSEoctahedral = -0,4n(t2g) + 0,6n(eg)
Dimana n(t2g) dan n(eg) berturut-turut adalah jumlah elektron yang mengisi orbital t2g
dan eg. Nilai CFSE konfigurasi d0 dan d10 adalah nol baik di medan ligan kuat
maupun lemah. Nilai konfigurasi d5 juga nol pada medan ligan lemah (Lee, 1994: 210-211).
Gambar 14. Diagram tingkat energi orbital d pada medan oktahedral (Lee, 1994: 206)
2) Kompleks Tetrahedral
Tetrahedral sering dihubungkan dengan sebuah kubus. Pada kompleks tetrahedral, atom pusat terletak di tengah kubus dan empat dari delapan sudutnya terisi oleh ligan, seperti ditunjukkan oleh Gambar 15.
eg
t 2g
Energi rata-rata ion logam pada medan spherical
Orbital 3d
E
Ion logam dalam medan oktahedral
Tingkat energi rata-rata +0,6Δo
-0,4Δo
Δo
commit to user
Gambar 15. Hubungan tetrahedron dengan kubus (Lee, 1994: 219)
Empat ligan pada kompleks tetrahedral tidak secara langsung mendekati orbital-orbital d dari logam, akan tetapi ligan-ligan ini lebih mendekat pada orbital-orbital yang berada searah dengan sisi kubus (dxy, dxz dan dyz (orbital t2))
daripada orbital yang searah dengan pusat kubus (dz2 dan dx2-y2 (orbital e)). Orbital t2 akan berada pada tingkat energi yang lebih tinggi sementara orbital e akan stabil
pada tingkat energi di bawahnya, sehingga akan membentuk diagram energi yang berkebalikan dengan medan oktahedral (Huheey, 1993: 402).
Diagram tingkat energi orbital d pada medan tetrahedral ditunjukkan oleh Gambar 16. Medan ligan kuat dapat menyebabkan perbedaan energi pemisahan t2
dan e yang lebih besar. Akan tetapi, energi pemisahan tetrahedral selalu lebih kecil jika dibandingkan energi pemisahan oktahedral. Kompleks tetrahedral mempunyai energi pemisahan sebesar 4/9∆o jika dibandingkan dengan kompleks oktahedral (Lee, 1994: 220).
Gambar 16. Pembelahan dan tingkat energi orbital d pada medan tetrahedral (Lee, 1994: 221)
e t 2
Energi rata-rata ion logam pada medan spherical
Orbital 3d
E
Ion logam dalam medan tetrahedral
Tingkat energi rata-rata +0,4Δt
-0,6Δt
Δt
commit to user 3) Kompleks Square Planar
Kedua ligan yang berada pada posisi trans kompleks oktahedral, apabila bergerak menjauh dari ion pusat, maka kompleks yang dihasilkan adalah kompleks oktahedral yang terdistorsi secara tetragonal. Distorsi seperti ini dinamakan distorsi Jahn-Teller. Distorsi Jahn-Teller terdapat pada bentuk oktahedral dimana orbital ion pusatnya terisi secara tidak simetris, yaitu seperti pada ion Cu2+ dengan konfigurasi d9. Kedua ligan sepanjang sumbu z yang menjauhi ion pusat menyebabkan orbital dxy, dxz dan dyz-nya terstabilkan dan
energinya berkurang karena elektron-elektron yang terdapat pada orbital tersebut memperoleh tolakan yang lebih kecil dibandingkan tolakan yang diperoleh dalam bentuk oktahedral. Berkurangnya energi-energi orbital di atas, disertai dengan bertambahnya energi orbital-orbital dx2-y2 dan dz2 ( Huheey, 1993: 443-444).
Pelepasan kedua ligan di sepanjang sumbu z kompleks oktahedral yang terdistorsi secara tetragonal akan menghasilkan kompleks dengan struktur square
planar (Gambar 17), seperti yang umumnya terbentuk pada kompleks
tembaga(II). Pembelahan orbital d pada kompleks square planar dapat dilihat pada Gambar 18.
Gambar 17. Distorsi kompleks oktahedral yang kemudian menjadi kompleks oktahedral yang terdistorsi secara tetragonal dan kompleks square
planar (Madan, 1987: 1361) Cu2+ L L L L Sumbu Z Sumbu Y Sumbu X Cu2+ L L L L L L Cu2+ L L L L L L
Kompleks oktahedral Kompleks oktahedral yang terdistorsi secara tetragonal
Kompleks square planar Kedua ligan pada sb. Z
menjauhi ion pusat Cu2+
Kedua ligan pada sb. Z lepas
commit to user
Gambar 18. Pembelahan orbital d pada kompleks square planar (Miessler and Tarr, 2011: 429)
c. Teori Orbital Molekul
Teori orbital molekul dapat digunakan untuk menjelaskan adanya ikatan kovalen dalam senyawa kompleks. Orbital atom logam dan ligan digunakan untuk membentuk orbital molekul. Pada kompleks oktahedral, orbital dxy, dxz, dyz yang
arahnya berada di antara arah ligan menuju ion pusat tidak terlibat dalam pembentukan ikatan (nonbonding). Sedangkan orbital dx2-y2 dan dz2 yang
mengarah langsung pada ligan dapat membentuk orbital molekul ikatan (bonding) dan anti ikatan (antibonding), selain itu orbital 4s dan 4p juga terlibat dalam pembentukan orbital molekul (Lee, 1994: 228). Diagram tingkat energi untuk kompleks oktahedral ditunjukkan oleh Gambar 19.
17
E
Orbital 3d
Oktahedral Square Planar
J-T Distortion a1g x2-y2 xz yz eg xy xz yz xy t 2g b2g eg z2 b1g x2-y2 z2
commit to user p s d dx2-y2 dz2 dxy dxz d yz t2g dxy dxz dyz t2g dx2-y2 dz2 px py pz a1g t1u eg nonbonding dx2-y2 dz2 eg* a1g* px* py* pz* t1u* 10 Dq antibonding bonding
orbital logam orbital molekul orbital ligan
t1u
a1g
eg
Gambar 19. Diagram tingkat energi kompleks oktahedral (Huheey, 1993: 417)
Teori orbital molekul juga dapat digunakan untuk menjelaskan pembentukan kompleks tetrahedral. Pada kompleks tetrahedral, lima orbital d logam terpisah menjadi dua kelompok yaitu orbital e (dx2-y2 dan dz2) dan t2 (dxy, dxz, dyz). Orbital (dx2-y2 dan dz2) merupakan orbital nonbonding e, yang tidak terlibat
dalam pembentukan ikatan. Ketiga orbital p membentuk orbital molekul bonding
t2 dan orbital molekul antibonding t2*. Orbital dxy, dxz, dyz membentuk orbital
molekul bonding t2 dan orbital antibonding t2*. Orbital s membentuk orbital
molekul bonding a1 dan orbital antibonding a1*. Empat orbital ligan juga
mempunyai orbital molekul bonding dan antibonding (Huheey, 1993: 418-420). Diagram tingkat energi untuk kompleks tetrahedral ditunjukkan oleh Gambar 20.
commit to user
Gambar 20. Diagram tingkat energi kompleks tetrahedral (Huheey, 1993: 419) Diagram tingkat energi orbital molekul pada kompleks square-planar ditunjukkan oleh gambar 21. Kompleks dengan bilangan koordinasi empat yang mempunyai bentuk square planar mengikat empat ligan yang identik. Orbital d terpecah menjadi orbital a1g (dz2), b1g (dx2-y2), b2g (dx-y) dan eg (dx-z, dy-z). Orbital p
juga terpecah menjadi orbital a2u (pz) dan eu (px, py). Keempat ligan yang
terorientasi pada sumbu x dan sumbu y terpecah menjadi orbital a1g, eu dan b1g
yang akan berinteraksi dengan orbital yang memiliki simetri yang sama. Sebagian orbital logam (a2u, eg dan b2g) memiliki orbital nonbonding karena orbital tersebut
tidak mengalami tumpang tindih dengan orbital ligan (Miessler and Tarr, 2011: 384-386). (n+1) p (n+1) s n d t2 t2 t2 a1 a1 a1 t2 e e t2* t2* a1* ∆t Orbital antibonding Orbital bonding Orbital Non-bonding
Orbital logam Orbital molekul Orbital ligan
commit to user
Gambar 21. Diagram tingkat energi kompleks square-planar (Miessler and Tarr, 2011: 385) Orbital antibonding Orbital ligan Δ 2b1g 2a1g 1a1g 1eu 1b1g Orbital bonding a1g eu b1g dz2 dx2-y2 eg dxy b2g eg b2g b1g a1g dxz , dyz Orbital 3d Orbital d logam Orbital Nonbonding 2eu 3a1g eu a2u a2u px , py pz a1g Orbital 4p Orbital 4s 20
commit to user
4. Spektra Elektronik Kompleks Tembaga(II)
Spektra kompleks meliputi transisi elektronik tingkat-tingkat energi yang berbeda. Ion Cu2+ dengan konfigurasi d9 tanpa adanya medan magnet/listrik dari luar mempunyai satu tingkat energi yaitu 2D. Ion bebas 2D akan terpisah menjadi tingkat energi 2Eg dan 2T2g karena adanya pengaruh dari medan oktahedral.
Pembelahan tingkat energi konfigurasi d9 pada medan oktahedral ditunjukkan oleh Gambar 22 (Lee, 1994: 956).
Gambar 22. Pembelahan tingkat energi konfigurasi d9 pada medan oktahedral (Lee, 1994: 956)
Ion bebas 2D pada medan oktahedral akan terpisah menjadi 2Eg dan2T2g,
dan selanjutnya masing-masing tingkatan energi ini terpisah pada medan square
planar karena distorsi Jahn-Taller. Gambar pembelahan tingkat energi konfigurasi d9 pada medan square planar ditunjukkan oleh Gambar 23 (Miessler and Tarr, 2011: 430).
Gambar 23. Pembelahan tingkat energi konfigurasi d9 pada medan square
planar (Miessler and Tarr, 2011: 430)
2 D Energi
Kekuatan Medan Ligan
2 T2g 0.4 0.6 2 Eg B2g A1g B1g Eg E
Oktahedral Square Planar
2 D 2 Eg 2 T2g 21
commit to user
Studi eksperimen mengenai spektra sejumlah besar kompleks yang mengandung berbagai ion logam dan ligan telah dipelajari, dan dapat dijelaskan bahwa ligan-ligan dapat ditata dalam deret menurut kapasitasnya untuk menyebabkan pemisahan atau pembelahan orbital d dari ion pusat. Deret tersebut bagi ligan-ligan yang umum adalah :
I- < Br-< Cl-< OH-<RCO2-<F- <H2O <NCS-< NH3< en < NO2-<phen <CN
-(Cotton and Wilkinson, 1998: 537)
5. Sifat Magnetik
Senyawa kompleks dengan orbital d dan f yang belum terisi penuh, dapat diketahui rentang sifat kemagnetannya, yang tergantung pada tingkat oksidasi, konfigurasi elektron dan bilangan koordinasi atom logamnya. Perkalian kerentanan spesifik (Xg) dari suatu senyawa dengan berat molekulnya akan diperoleh harga kerentanan molar (Xm) yang dapat dihubungkan dengan momen
paramagnetik permanen (μ) suatu molekul dengan Persamaan 1 (Huheey, 1993: 459). X m = RT N 3 2 2
... (1)N adalah bilangan Avogadro, R adalah tetapan gas ideal, T adalah suhu (dalam K)
dan μ dalam satuan BM (1 BM = eh/4mπ). Dari Persamaan 1 dapat diketahui besarnya harga μ, yaitu dengan :
μ = 2 2 1 3 N RTXm ... (2) μ = 2,84 (X m T) 1/2... (3) - Spin tinggi - Medan lemah - Pemisahan medan ligan (Δ) kecil - Spin rendah - Medan kuat - Pemisahan medan ligan (Δ) besar 22
commit to user
Harga μ dapat diubah ke dalam jumlah spin elektron tak berpasangan, dengan menyertakan kontribusi paramagnet dan diamagnet. Kontrisbusi diamagnet dari suatu senyawa dapat diperoleh dari jumlah kerentanan diamagnetik setiap komponennya. Harga faktor koreksi diamagnetik dari beberapa ion dan molekul ditunjukkan oleh Tabel 2.
Tabel 2. Faktor Koreksi Diamagnetik untuk Beberapa Ion dan Molekul (Szafran, 1991: 52) dan (Huheey, 1993: 463) No Kation/ Anion/Atom Netral/Molekul Faktor Koreksi (x 10-6 cgs) 1 Cu2+ -13,00 2 3 SO4 2-Cl- -38,00 -23,00 4 H2O -13,00 5 C -6,00 6 7 H N -2,93 -4,61
Dengan demikian diperoleh kerentanan molar terkoreksi, seperti ditunjukkan oleh persamaan 4.
X A = X m - X l... (4)
Sehingga persamaan 3 dapat ditulis menjadi :
μ = 2,84 (X A T) 1/2... (5)
Senyawa kompleks dengan tingkat energi dasar A seperti d3 oktahedral, dan d5 spin tinggi mempunyai rumus momen paramagnet permanen (μs) secara teoritis :
μs = 2 [S (S+1)]1/2
... (6) Persamaan 6 dikenal dengan formula spin-only, dimana S adalah bilangan kuantum momentum anggular spin, S berhubungan dengan jumlah elektron tak berpasangan (n) = S/2, sehingga didapatkan Persamaan 7 (Lee, 1994: 225).
μs = [n(n+2)] 1/2
... (7) Dimana:
μs = momen magnetik yang ditimbulkan oleh spin elektron (BM)
n = jumlah elektron yang tidak berpasangan
commit to user
6. Spektroskopi Infra Merah
Pembentukan kompleks dapat ditandai oleh beberapa hal yaitu antara lain : terjadinya pergeseran serapan panjang gelombang maksimum (λmaks) spektra
UV-Vis dan terjadinya pergeseran serapan gugus fungsi spektra IR yang disebabkan karena adanya ikatan koordinasi (Sonmez M., 2003: 397-402). Frekuensi vibrasi antara dua atom dan ikatan yang menghubungkannya dapat dihitung berdasarkan hukum Hooke yang ditunjukkan oleh Persamaan 8.
2 1 2 1 2 1 ) ( 2 1 . m m m m k c ...(8)
keterangan : υ = bilangan gelombang (cm-1) c = kecepatan cahaya (cm.det-1)
k = tetapan gaya ikatan (N.m-1) m1 dan m2 = massa dua atom (g)
Harga bilangan gelombang υ yang semakin besar, maka akan menyebabkan kekuatan ikatan dua atom menjadi semakin kuat dan panjang ikatan semakin pendek. Pergeseran bilangan gelombang ke arah yang lebih besar akan menambah kuat ikat dua atom dalam satu molekul yang bervibrasi. Pergeseran bilangan gelombang ke arah yang lebih kecil akan memperlemah ikatan dua atom dalam satu molekul yang bervibrasi (Kemp, 1987: 19).
Pergeseran spektra IR suatu kompleks dapat digunakan untuk memperkirakan gugus fungsi mana yang terkoordinasi pada atom pusat. Spektra infra merah dari kompleks [CuL1](H2O) (L1 = N,N’-O-phenylenebis
(salicylideneimine)) (Belaid et al., 2008: 63-69), menunjukkan pada ligan bebas
muncul serapan melebar υ(OH) gugus hidroksil fenolik pada daerah 3030-3065 cm-1. Namun pita ini tidak terlihat pada kompleks, yang mengindikasikan bahwa ligan terkoordinasi pada ion Cu2+ melalui bentuk deprotonasi. Pada kompleks terjadi pergeseran bilangan gelombang dari tipe vibrasi cincin dan C–O stretching (1465 dan 1106 cm-1 pada ligan menjadi 1513 dan 1180 cm-1 pada kompleksnya secara berturut-turut). Serapan gugus N-H (3298 cm-1 pada ligan bebas menjadi 3198 cm-1 pada kompleks) mengalami pergeseran ke arah yang lebih kecil. 24
commit to user
Adanya pergeseran tersebut mengindikasikan bahwa kedua gugus terkoordinasi pada ion Cu2+. Data ini juga diperkuat dengan munculnya pita baru pada spektra kompleks yaitu pada 453 cm-1 yang menunjukkan pita vibrasi υ(Cu-O) dan pita vibrasi υ(Cu-N) pada 500 dan 546 cm-1
.
7. Daya Hantar Listrik
Daya hantar listrik adalah ukuran seberapa kuat suatu larutan dapat menghantarkan arus listrik. Daya hantar listrik larutan elektrolit dapat dinyatakan sebagai daya hantar listrik molar (molar conductivity) yang didefinisikan sebagai daya hantar yang ditimbulkan oleh satu mol zat, sesuai Persamaan 10.
C K
m
...(9) Keterangan : Λm = hantaran molar (S.mol-1.cm2)
κ = daya hantar listrik spesifik larutan elektrolit (S.cm-1) C = konsentrasi elektrolit (mol.cm-3)
Apabila daya hantar spesifik larutan merupakan daya hantar yang sudah terkoreksi (K*) dalam satuan μ.S.cm-1 maka daya hantar molar larutan elektrolit dapat ditulis seperti pada Persamaan 11.
C K m 1000 * ...(10) Keterangan : Λm = hantaran molar (S.mol-1.cm2)
κ*
= daya hantar listrik spesifik terkoreksi (μ.S.cm-1) = K-K pelarut
C = konsentrasi elektrolit (mol.L-1)
Daya hantar molar suatu larutan bergantung pada konsentrasi dan jumlah ion dari senyawa elektrolit. Jumlah muatan atau jumlah ion dari spesies yang terbentuk ketika larutan kompleks dilarutkan dapat diketahui dengan cara membandingkan daya hantar molar kompleks tersebut dengan senyawa ionik sederhana dalam berbagai pelarut yang sesuai dan telah diketahui daya hantar molarnya (Lee, 1994: 197-198).
commit to user
Sisa asam atau anion dalam suatu kompleks dapat diperkirakan apakah terkoordinasi pada atom pusat sebagai ligan atau hanya sebagai sisa asam. Dengan membandingkan konduktivitas molar suatu senyawa ionik yang diketahui molarnya, dapatlah diperkirakan jumlah ion (kation atau anion) yang dihasilkan dalam larutan (Szafran, 1991: 102-105).
8. Spektroskopi Serapan Atom (SSA)
Spektroskopi Serapan Atom (SSA) merupakan suatu metode analisis kimia untuk menentukan unsur-unsur logam dan semi logam dalam jumlah renik (trace). Hasil perhitungan akan memberikan kadar total unsur logam atau semi logam dalam sampel dan tidak tergantung pada bentuk molekul logam tersebut dalam sampel. Prinsip kerja SSA adalah adanya interaksi antara energi (sinar) dan materi (atom). Jumlah radiasi yang diserap tergantung pada jumlah atom-atom bebas yang terlibat dan kemampuan atom itu untuk menyerap radiasi. Dasar perhitungan pada SSA adalah menggunakan hukum Lambert-Beer yaitu :
A = ε.b.C Keterangan : A = absorbansi
ε = koefisien absorpsi molar b = tebal kuvet
C = konsentrasi
Cuplikan harus disiapkan dalam bentuk larutan yang prosedurnya tergantung pada sifat dan jenis cuplikan yang akan dianalisis. Ada beberapa cara untuk melarutkan cuplikan, yaitu: (1) cuplikan langsung dilarutkan dalam pelarut yang sesuai, (2) cuplikan direaksikan dengan asam atau (3) cuplikan dilebur dahulu dengan basa kemudian hasil leburan dilarutkan dalam asam. Prosedur yang banyak digunakan adalah dengan melarutkan sampel dengan asam murni seperti HNO3, H2SO4 dan HCl karena tidak menambah kadar zat padat dalam larutan.
Penentuan kadar logam dari suatu sampel dengan metode SSA, dapat dilakukan dengan cara kurva kalibrasi maupun penambahan standar (Skoog et al., 1998: 223-224).
commit to user 9. Ligan Difenilamin
Difenilamin merupakan senyawa organik yang berupa serbuk kristal berwarna putih, sedikit larut dalam air dan larut dalam pelarut-pelarut organik seperti metanol dan etanol. Nama lain dari difenilamin di antaranya
N-phenylbenzenamine, N-phenylaniline, Anilinobenzene, (phenylamino)benzene, N,N-diphenylamine, phenylbenzenamine. Formula kimia difenilamin adalah
C12H11N dengan berat molekulnya 169,23 g/mol, memiliki titik leleh 53ºC, titik
didih 302 ºC. Difenilamin merupakan basa lemah dengan kb = 10-14. Struktur dari
difenilamin ditunjukkan oleh Gambar 24.
H N
Gambar 24. Struktur difenilamin (Day and Underwood, 1980: 274)
Difenilamin merupakan turunan dari anilin yang memiliki peranan penting dalam bidang farmasi. Reaksi antara difenilamin dengan sulfur menghasilkan
phenothiazine yang merupakan suatu prekursor dalam industri obat. Difenilamin
juga bereaksi dengan deoxyribose DNA menghasilkan warna biru, sehingga dapat digunakan untuk mendeteksi kehadiran DNA dalam suatu sampel. Difenilamin juga sering digunakan sebagai indikator redoks pada titrasi Fe2+ dengan kalium dikromat (Day and Underwood, 1980: 273-274).
commit to user
B. Kerangka Pemikiran
Kemungkinan struktur kompleks yang dapat terbentuk tergantung dari jenis dan jumlah ligan yang terkoordinasi pada atom pusat, anion dan adanya pelarut dalam kompleks. Anion dapat bertindak sebagai ligan atau sisa asam. Seperti pada kompleks Cu(II) dengan NH3 yang membentuk kompleks
[Cu(NH3)4]2+ dan bergeometri square planar. NH3 dapat terkoordinasi pada
Cu(II) karena memiliki atom donor elektron N dan ligan tersebut memiliki keruahan yang kecil. Apabila dua atom H dari NH3 digantikan dengan dua gugus
phenil, seperti pada difenilamin, maka diharapkan gugus (›NH) difenilamin juga
dapat membentuk kompleks dengan ion Cu(II). Geometri kompleks Cu(II) pada umumnya square planar, namun tidak menutup kemungkinan ditemukan struktur kompleks yang lain seperti tetrahedral, oktahedral dan square pyramidal.
Indikasi terbentuknya kompleks Cu(II) dengan difenilamin ditunjukkan oleh adanya pergeseran panjang gelombang maksimum di daerah ultraviolet dan sinar tampak. Atom donor elektron bagian ligan yang terkoordinasi pada ion pusat diperkirakan dari pergeseran serapan gugus fungsi infra merah.
C. Hipotesis
1. Senyawa kompleks tembaga(II) dengan difenilamin dapat disintesis dari CuCl2.2H2O dan CuSO4.5H2O dengan difenilamin.
2. Struktur kompleks tembaga(II) dengan difenilamin :
a. Kemungkinan struktur kompleks CuCl2.2H2O dengan difenilamin yang
terbentuk adalah Cu(difenilamin)m(Cl)b(H2O)n
(m = 1,2,3,4), (b = 0,1,2) dan (n = 0,1,2,3,4,5,6).
b. Kemungkinan struktur kompleks CuSO4.5H2O dengan difenilamin yang
terbentuk adalah Cu(difenilamin)m(SO4)b(H2O)n
(m = 1,2,3,4), (b = 0,1) dan (n = 0,1,2,3,4,5,6).
Kompleks tembaga(II) dengan difenilamin bergeometri square planar dengan gugus (›NH) terkoordinasi pada ion Cu2+.
3. Kompleks bersifat paramagnetik dengan sifat spektroskopi terjadinya transisi elektronik Eg ke T2g .
commit to user
BAB III
METODOLOGI PENELITIAN
A. Metode Penelitian
Metode yang dilakukan dalam penelitian ini adalah metode eksperimen. Sintesis kompleks yang dilakukan mengacu pada Trivedi et al. (2009). Kompleks Cu(II) dengan 2-[(4-phenyl-1H-1,2,3-triazol-1-yl)methyl]pyridine disintesis dengan cara mencampur larutan CuCl2 anhidrat dalam metanol dan larutan
2-[(4-phenyl-1H-1,2,3-triazol-1-yl)methyl]pyridine dalam kloroform pada perbandingan
mol logam dan mol ligan tertentu. Campuran larutan diaduk pada suhu ruang selama 1 jam. Dan mengacu pada Turta et al. (2008), dimana kompleks Cu(II) dengan aminoguanizone of pyruvic acid, disintesis dengan merefluks CuSO4.5H2O dan aminoguanizone of pyruvic acid dalam campuran
DMSO-metanol (1/4V) selama 0,5 jam. Terbentuknya kompleks diketahui dari pergeseran λmaks pada spektra UV-Vis.
Formula senyawa kompleks diperkirakan dengan mengukur kadar logam tembaga dari senyawa kompleks dengan menggunakan Spektrofotometer Serapan Atom (SSA), kedudukan anion dalam kompleks ditentukan dengan menggunakan konduktivitimeter. Sifat kemagnetan dari kompleks Cu(II) diketahui dengan
Magnetic Susceptibility Balance (MSB). Atom donor elektron dari ligan yang
terkoordinasi pada ion pusat Cu(II) diperkirakan dari pergeseran serapan gugus fungsi infra merah.
commit to user
B. Tempat dan Waktu Penelitian
Penelitian dilakukan selama sepuluh bulan mulai dari bulan Juli 2010 sampai dengan bulan April 2011.
1. Sintesis kompleks dilakukan di Sub Laboratorium Kimia Fakultas MIPA Universitas Sebelas Maret Surakarta.
2. Penentuan kadar tembaga, pengukuran daya hantar listrik (DHL), analisis spektra elektronik dan pengukuran momen magnet kompleks dilakukan di Sub Laboratorium Kimia Fakultas MIPA Universitas Sebelas Maret Surakarta.
3. Analisis gugus fungsi dilakukan di Laboratorium Kimia Fakultas MIPA Universitas Sebelas Maret Surakarta.
C. Alat dan Bahan
1. Alat Alat yang digunakan dalam penelitian ini : a. Peralatan gelas Pyrex dan Duran b. Konduktivitimeter 4071 CE Jenway
c. Magnetik Susceptibility Balance (MSB) AUTO Sherwood Scientific 10169 d. Spektrofotometer UV-Vis Double Beam Shimadzu 1601
e. Spektrofotometer Serapan Atom (SSA) Shimadzu AA-6650 f. Pemanas Listrik AEL-200 Shimadzu dan Cole Palmer 4658 g. Neraca Analitik Shimadzu AEL-200
h. Spektrofotometer FTIR Perkin Elmer 2000 i. Pengaduk magnetic Haeidholp M1000 Germany j. Desikator
commit to user 2. Bahan-Bahan a. CuSO4.5H2O (Merck) b. CuCl2.2H2O (Merck) c. Difenilamin (Merck) d. NiCl2.6H2O (Merck) e. NiSO4.6H2O (Merck) f. AlCl3.6H2O (Merck)
g. Metanol p.a. (Merck) h. Aquadest
i. Asam Klorida (HCl) pekat 37% (Merck) j. KBr kering (Merck)
k. Kertas Saring Whatman 42
D. Prosedur Penelitian
1. Penentuan Bilangan Koordinasi Ion Cu2+
Bilangan koordinasi dari kompleks Cu(II) dengan difenilamin ditentukan dengan metode perbandingan mmol yaitu membuat seri larutan CuCl2.2H2O
dengan difenilamin dengan perbandingan mmol CuCl2.2H2O : mmol difenilamin
= 1 : 2, 1 : 1, 1 : 2, 1 : 3, 1 : 4, 1 : 5, 1 : 6 dan 1 : 7. Masing-masing seri larutan diukur panjang gelombang maksimum (λmaks)-nya dengan spektrofotometer
UV-Vis, kemudian dibuat grafik antara panjang gelombang maksimum (λmaks) sebagai
ordinat dan perbandingan mmol logam dan mmol ligan sebagai absisnya. Dari grafik ditentukan perbandingan banyaknya mmol antara ion logam dan ligan dalam kompleks pada titik setaranya. Pembuatan seri larutan CuCl2.2H2O dengan
difenilamin dalam metanol dapat dilihat pada Tabel 3.
commit to user
Tabel 3. Pembuatan Seri Larutan CuCl2.2H2O dengan Difenilamin dalam
Metanol No Perbandingan (mmol) CuCl2.2H2O : Difenilamin CuCl2.2H2O (mmol) Difenilamin (mmol) 1 1 : 0 0,2 0 2 1 : 1 0,2 0,2 3 1 : 2 0,2 0,4 4 1 : 3 0,2 0,6 5 1 : 4 0,2 0,8 6 1 : 5 0,2 1,0 7 1 : 6 0,2 1,2 8 1 : 7 0,2 1,4
2. Sintesis Senyawa Kompleks Cu(II)-Difenilamin a. Sintesis Kompleks CuCl2.2H2O dengan Difenilamin
CuCl2.2H2O (0,341 g; 2 mmol) dalam metanol (10 mL) ditambahkan pada
difenilamin (1,354 g; 8 mmol) dalam metanol (20 mL) secara bertetes-tetes. Campuran diaduk selama ± 6 jam. Larutan dipekatkan hingga volume ± 15 ml dan didiamkan selama ± 72 jam sampai terbentuk endapan. Endapan yang terbentuk disaring dan dicuci dengan metanol kemudian dikeringkan dalam desikator selama 24 jam.
b. Sintesis Kompleks CuSO4.5H2O dengan Difenilamin
CuSO4.5H2O (0,748 g; 3 mmol) dalam metanol (10 mL) ditambahkan
pada difenilamin (2,031 g; 12 mmol) dalam metanol (20 mL) secara bertetes-tetes. Campuran direfluks selama ± 2 jam. Larutan dipekatkan hingga volume ± 15 ml dan didiamkan selama ± 48 jam sampai terbentuk endapan. Endapan yang terbentuk disaring dan dicuci dengan metanol kemudian dikeringkan dalam desikator selama 24 jam.
 (L 1 = N,N’-O-phenylene bis(salicylideneimine)) yang bergeometri square planar (Belaid et al., 2008: 63-69)](https://thumb-ap.123doks.com/thumbv2/123dok/4371588.3190564/20.893.255.666.187.1028/gambar-struktur-senyawa-kompleks-phenylene-salicylideneimine-bergeometri-belaid.webp)
![Gambar 7. Struktur kompleks [Cu(L 6 )(OH) 2 ] (L 6 =3,5-diamine-4-(4-bromo- =3,5-diamine-4-(4-bromo-phenylazo)-1H-pyrazole) yang bergeometri square planar (Turan et al., 2008: 27-32)](https://thumb-ap.123doks.com/thumbv2/123dok/4371588.3190564/27.893.253.649.158.895/gambar-struktur-kompleks-diamine-diamine-phenylazo-pyrazole-bergeometri.webp)
![Gambar 9. Struktur kompleks [Cu(L 8 ) 2 (Cl) 2 ] (L 8 = 2-[(4-phenyl-1H-1,2,3- 2-[(4-phenyl-1H-1,2,3-triazol-1-yl)methyl]pyridine) yang bergeometri oktahedral terdistorsi Jahn-Teller (Crowley et al., 2010: 70-83)](https://thumb-ap.123doks.com/thumbv2/123dok/4371588.3190564/28.893.210.699.161.746/gambar-struktur-kompleks-pyridine-bergeometri-oktahedral-terdistorsi-crowley.webp)
![Gambar 10. Penggambaran teori ikatan valensi [CoF 6 ] 3- dan [Co(NH 3 ) 6 ] 3+ (Lee, 1994: 203)](https://thumb-ap.123doks.com/thumbv2/123dok/4371588.3190564/29.893.249.747.196.753/gambar-penggambaran-teori-ikatan-valensi-cof-co-lee.webp)
![Gambar 11. Ilustrasi pembentukan hibridisasi dsp 2 pada ion [Cu(NH 3 ) 4 ] 2+ (Day and Selbin, 1993: 579)](https://thumb-ap.123doks.com/thumbv2/123dok/4371588.3190564/30.893.225.746.182.949/gambar-ilustrasi-pembentukan-hibridisasi-dsp-ion-day-selbin.webp)