SINTESIS DAN KARAKTERISASI SENYAWA KOMPLEKS
NIKEL(II) DENGAN LIGAN ETILENDIAMINTETRAASETAT
(EDTA)
Nur Chamimmah Lailis I dan Irmina Kris Murwani*
Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan AlamInstitut Teknologi Sepuluh Nopember, Surabaya *Email: irmina@chem.its.ac.id
Abstrak :
Pada penelitian ini dilakukan sintesis senyawa kompleks Ni-EDTA melalui reaksi larutan Ni2+ dan H4EDTA. pH optimum sintesis Ni-EDTA diperoleh pada pH 10. Penentuan rumus senyawa
kompleks dilakukan dengan metode variasi kontinu sehingga diperoleh perbandingan logam Ni dan EDTA adalah 1 : 1. Padatan kompleks Ni-EDTA berwarna biru, mempunyai serapan panjang gelombang maksimum sebesar 584 nm dan serapan khas vibrasi logam-ligan dengan spektroskopi infra merah pada bilangan gelombang 347 cm-1.
Kata kunci : Senyawa kompleks, Nikel (II) EDTA, sintesis, karakterisasi
1. Pendahuluan
Senyawa koordinasi adalah salah satu senyawa yang memegang peranan penting dalam kehidupan manusia. Senyawa ini terbentuk karena adanya ikatan antara ligan yang berperan sebagai donor pasangan elektron (basa lewis) dengan ion pusat (logam) yang berperan sebagai akseptor pasangan elektron (asam lewis).
Kajian dan penelitian tentang sintesis senyawa koordinasi juga semakin beragam. Salah satunya adalah penelitian tentang senyawa kompleks sebagai katalis. Dari beberapa penelitian telah dilaporkan bahwa senyawa kompleks nikel telah terbukti dapat digunakan pada proses katalitik dalam beberapa reaksi organik seperti reaksi karbonilasi etanol menjadi asam propionat yang menggunakan katalis senyawa kompleks [Ni(isoquinoline)4]Cl2 (Ubale, 1997) dan reaksi hidrogenasi yang mengkonversi glukosa menjadi sorbitol dengan katalis senyawa kompleks [Ni(EDTA)3(NO3)2] berpendukung silika (SiO2) (Schimpf, 2007). Senyawa kompleks yang bisa dijadikan sebagai katalis harus memiliki sifat yang stabil. Salah satu senyawa kompleks yang sangat stabil adalah senyawa kompleks yang membentuk khelat. Salah satu senyawa kompleks yang memiliki tingkat kestabilan cukup tinggi adalah senyawa kompleks Nikel(II)-EDTA yang memiliki Kstab = 18.62 (Underwood, 2002). Pada penelitian ini disintesis dan dikarakterisasi senyawa kompleks nikel(II)-EDTA yang nantinya dapat dimanfaatkan sebagai katalis.
2. Metodologi
Bahan-bahan yang dibutuhkan dalam penelitian ini adalah bahan-bahan kimia yang memiliki kemurnian pro analisis (p.a) meliputi nikel(II) triklorida heksahidrat NiCl2.6H2O, H4EDTA (Titriplex II), NH4OH dan akuades. Selanjutnya akan dilakukan karakterisasi dengan UV-VIS, FTIR, dan XRD.
Tahapan dalam sintesis senyawa kompleks Ni-EDTA adalah penentuan panjang gelombang maksimum, pengaruh pH pada pembentukan senyawa kompleks dan penentuan rumus senyawa kompleks dengan metode variasi kontinu. Sintesis senyawa kompleks dilakukan dengan
mereaksikan larutan H4EDTA (titriplex II) dan NiCl. Larutan campuran tersebut dipanaskan sampai tepat jenuh kemudian didiamkan selama beberapa hari hingga terbentuk padatan kristal. Kristal yang terbentuk disaring dan diletakkan pada cawan porselen lalu di oven 90° hingga cukup kering. 3. Hasil dan Pembahasan
Penentuan Panjang Gelombang Senyawa Kompleks [Ni(EDTA)]2-
Hasil reaksi NiCl2 dan EDTA diukur dengan spektrofotometer UV-VIS pada panjang gelombang 400-780 nm. Dari hasil analisis diperoleh bahwa panjang gelombang maksimum senyawa kompleks [Ni(EDTA)]2- adalah 584 nm. Jika dibandingkan dengan panjang gelombang maksimum NiCl2 yaitu sebesar 658 nm, maka terjadi pergeseran ke arah panjang gelombang yang lebih pendek seperti yang terlihat pada Gambar 1. Pergeseran ini dipengaruhi oleh ligan EDTA yang merupakan ligan dengan medan kuat (Sukardjo, 1992). Senyawa kompleks [Ni(EDTA)] 2-memiliki warna biru, sehingga senyawa kompleks tersebut menyerap panjang gelombang pada daerah kuning (580-595) nm (Underwood, 2002).
Gambar 1. Panjang Gelombang Maksimum Senyawa NiCl2 ( ) dan Senyawa Kompleks [Ni(EDTA)]2- ( )
Pengaruh pH Pada Pembentukan Senyawa Kompleks [Ni(EDTA)]2-
Pembentukan senyawa kompleks sangat dipengaruhi oleh pH. Pengamatan pengaruh pH pada pembentukan kompleks terlihat pada Gambar 2. Dari gambar tersebut dapat dilihat bahwa senyawa kompleks [Ni(EDTA)]2- mulai terbentuk pada pH 5 sedangkan pH optimum terdapat pada pH 10, karena pada pH tersebut absorbansi senyawa kompleks menunjukkan nilai paling besar. Hal ini menunjukkan bahwa akibat perubahan pH larutan, konsentrasi senyawa kompleks yang terbentuk juga mengalami perubahan.
Gambar 2. Pengaruh pH Pada Pembentukan Senyawa Kompleks [Ni(EDTA)]2-
Penentuan Rumus Senyawa Kompleks dengan Metode Variasi Kontinu
Rumus senyawa kompleks nikel-EDTA ditentukan melalui metode variasi kontinu. Hasil menunjukkan bahwa perbandingan mol antara Ni2+ dan ligan EDTA adalah 1 : 1. Hasil penentuan rumus senyawa kompleks dapat diamati pada Gambar 3. Pada gambar tersebut titik potong terdapat pada perbandingan fraksi mol EDTA 0,5. Hasil perbandingan ini menunjukkan bahwa satu mol ligan EDTA dapat berikatan dengan satu mol nikel(II) sehingga dihasilkan perbandingan mol nikel(II) : EDTA adalah 1 : 1 dan membentuk senyawa koordinasi [Ni(EDTA)]2- (Bhat, dkk. 1965).
Berdasarkan hasil penentuan rumus stoikiometri tersebut maka dapat diperkirakan bahwa senyawa kompleks [Ni(EDTA)]2- mempunyai struktur oktahedral seperti yang dapat dilihat pada Gambar 4.
Gambar 4. Struktur Senyawa Kompleks [Ni(EDTA)]2- Karakterisasi Senyawa Kompleks dengan Spektrofotometer Inframerah
Karakterisasi senyawa kompleks [Ni(EDTA)]2- dilakukan pada bilangan gelombang 300-4000 cm-1. Pada karakterisasi ini dibandingkan spektra antara senyawa kompleks yang terbentuk [Ni(EDTA)]2- dan ligan EDTA seperti yang terlihat pada Gambar 5.
Spektra EDTA (Gambar 5) diperoleh dengan menganalisis padatan H4EDTA (titriplex II). Pada gambar diatas terlihat bahwa terdapat serapan O-H pada daerah 3400 cm-1 tidak terlalu tajam karena EDTA yang dianalisis bukan garam EDTA yang memiliki air hidrat. Sedangkan serapan N-H terlihat sangat tajam pada daerah 3100 cm-1. Gugus fungsi C=O terlihat pada 1697 cm-1 sedangkan vibrasi COO- yang berasal dari ester pada 1396 cm-1 sedangkan frekuensi vibrasi C-C untuk alkana muncul pada serapan 1200-800 cm-1.
Pada spektra [Ni(EDTA)]2- diatas, dapat dilihat bahwa terdapat serapan melebar O-H muncul pada daerah 3410 cm-1 yang mengindikasikan bahwa senyawa koordinasi [Ni(EDTA)] 2-mengandung air kristal. Sedangkan serapan N-H muncul pada daerah 3200 cm-1. Serapan C=O muncul pada 1600 cm-1 sedangkan vibrasi C-O yang berasal dari ester pada 1396 cm-1. Vibrasi C-O yang berasal dari ester menunjukkan serapan yang sangat tajam dibandingkan dengan serapan pada ligan bebasnya, hal ini karena vibrasi dari C-O pada senyawa ini terikat pada logam Ni sehingga intensitasnya meningkat. Frekuensi vibrasi C-C untuk alkana muncul pada serapan 1200-800 cm-1. Serapan vibrasi ikatan antara logam Ni dengan ligan terlihat pada bilangan gelombang 300-600 cm-1, vibrasi ikatan Ni-N terlihat pada bilangan gelombang 347 nm. Hal ini sesuai dengan literatur yang menyebutkan bahwa vibrasi ikatan logam dengan gugus N dari ligan akan muncul pada bilangan gelombang 300-390 cm-1. Sedangkan vibrasi Ni-O dari ligan EDTA muncul pada bilangan gelombang 470 cm-1. Hal ini sesuai dengan literatur yang menyebutkan bahwa vibrasi logam dengan gugus O dari ligan akan muncul pada bilangan gelombang 600-400 cm-1 (Nakamoto, 1978).
Identifikasi Senyawa Kompleks dengan Difraktometer Sinar-X
Padatan senyawa kompleks [Ni(EDTA)]2- hasil sintesis dianalisis XRD untuk mengetahui komponen penyusunnya. Difraktogram hasil analisis disajikan pada Gambar 6.
2-4. Kesimpulan
Senyawa kompleks nikel(II)-EDTA telah berhasil disintesis dengan perbandingan mol ligan dan atom pusat = 1:1. pH maksimum pembentukan senyawa kompleks adalah pH 10. Berdasarkan hasil penentuan rumus molekul senyawa kompleks dan analisis FTIR yang membuktikan adanya vibrasi logam nikel ke ligan EDTA, maka [Ni(EDTA)]2- diperkirakan mempunyai struktur oktahedral.
Daftar Pustaka
Bhat, R.T., Radhamma, D. & Shankar, J., (1965), “ Studies on EDTA Complexes : Mixed Complexes of Copper (II), Nickel (II) and Cobalt (II) Versenates with Pyridine, Hydrazine, Hydroxylamine, Ethylenediamine and Propylenediamine “, Journal Inorganic Nuclear Chemistry, Vol. 27, hal. 2641-2651.
Nakamoto K., 1978, Infrared and Raman Spectra of Inorganic and Coordination Compound, Third Edition., John Wiley and Sons Inc, New York.
Schimpf, S., Louis, C & Claus, P., (2007), “ Ni/SiO2 catalysts prepared with ethylenediamine nickel precursors : Influence of the pretreatment on the catalytic properties in glucose hydrogenation “, Applied Catalysis A: General , Vol. 318, hal. 45–53.
Sukardjo., 1992, Kimia Koordinasi, Edisi Ketiga, PT. Rineka Cipta, Jakarta.
Ubale, R.S., Kelkar, A.A. & Chaudari, R.V. (1997), “Carbonylation of ethanol using Ni-isoquinoline complex catalyst: Activity and selectivity studies”, Journal of Molecular Catalysis A : Chemical, Vol.118, hal. 9-19.
Underwood, A. L. & Day, R.A, (2002), Analisis Kimia Kuantitatif, Edisi Keenam, Penerbit Erlangga, Jakarta.
ESTERIFIKASI ASAM LEMAK BEBAS DARI
LIMBAH MINYAK SAWIT MENTAH DENGAN METANOL DAN
KATALIS KAOLINIT TERIMPREGNASI AlCl
3Harlia, Thamrin Usman, Nelly Wahyuni, Winda Rahmalia
Jurusan Kimia FMIPA Universitas TanjungpuraJl. A Yani Pontianak, 78124 Email: rahmalia_mipa@yahoo.com
Abstrak
Telah dilakukan sintesis metil ester dengan metode esterifikasi terhadap asam lemak bebas limbah minyak sawit mentah menggunakan katalis kaolinit terimpregnasi AlCl3. Variabel yang dikaji
pada proses esterifikasi adalah waktu reaksi dan konsentrasi katalis AlCl3. Hasil penelitian
menunjukkan waktu reaksi dan konsentrasi katalis optimum masing-masing 1 jam dan 4 % dengan persentase konversi produk mencapai 79,86 %. Metil ester yang dihasilkan telah dianalisa sifat fisika yang meliputi indeks bias 1,454, kerapatan 0,880 g/mL (250C) dan viskositas 6,975 cSt (250C).
PENGGUNAAN ISATIN SEBAGAI
INHIBITOR KOROSI BAJA SS 304 DALAM LARUTAN
ASAM
*Harmami dan Adrian Gunawan
Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Teknologi Sepuluh Nopember, Surabaya
Phone : 08883077956, e-mail: harmami@chem.its.ac.id
Abstrak
Penggunaan isatin sebagai inhibitor korosi baja SS 304 dalam media asam dipelajari dengan menggunakan metode pengurangan massa, polarisasi potensiodinamik, serta analisis Scanning Electron Microscopy (SEM). Dari data pengurangan massa maupun data polarisasi menunjukkan nilai efisiensi inhibisi ( % EI ) sebanding dengan konsentrasi inhibitor yang ditambahkan dan berbanding terbalik dengan kenaikan temperatur. Data konstanta Tafel menunjukkan bahwa Isatin dapat bertindak sebagai inhibitor katodik dan anodik (tipe inhibitor campuran). Analisa SEM menunjukkan perbedaan tekstur permukaan spesimen yang direndam pada media asam tanpa dan dengan penambahan Isatin 12.5 mM, dimana tanpa penambahan inhibitor, tekstur permukaan lebih banyak berlubang dan kasar. Proses adsorpsi inhibitor pada permukaan logam diduga diawali dengan adsorpsi fisika dan kemudian dilanjutkan dengan adsorpsi kimia. Adsorpsi kimia dimungkinkan karena luas pelingkupan permukaan logam meningkat seiring dengan meningkatnya konsentrasi inhibitor.
Kata kunci: Inhibitor, Isatin , baja tahan karat 304, dan efisiensi inhibisi.. 1. Pendahuluan
Stainless Steel (SS) 304 merupakan baja nirkarat yang paling banyak diproduksi dibandingkan baja nirkarat yang lainnya dan banyak digunakan baik untuk peralatan rumah tangga maupun untuk keperluan industri karena harganya yang relatif lebih murah dibandingkan tipe 316 maupun tipe yang lain. Baja tipe 304 disebut sebagai baja tahan tahan karat karena dapat membentuk lapisan oksida logam pasif pada permukaannya. Namun demikian dalam lingkungan asam yang korosif , lapisan tahan karat tersebut tidak dapat terbentuk dan logam akan mengalami korosi. Dalam penggunaannya, baja 304 sering mengalami proses cuci asam, sehingga dalam proses tersebut, baja 304 pasti akan mengalami korosi.
Berbagai upaya telah banyak dilakukan untuk mencegah atau setidaknya mengurangi laju korosi dalam suatu proses cuci asam, antara lain dengan penggunaan inhibitor, yakni suatu zat yang ditambahkan dalam jumlah kecil dalam larutan cuci asam untuk menghambat laju korosi (Thretwey, 1991).
Inhibitor korosi dapat berasal dari bahan anorganik (kromat, dikromat, oksalat, dll) atau organik (berbagai jenis minyak dan ekstrak bahan alam). Inhibitor dari bahan anorganik saat ini sudah mulai ditinggalkan karena sifatnya yang tidak ramah lingkungan dan bisa menjadi katalis korosi apabila konsentrasinya tidak tepat (Surya, 2004)
Inhibitor korosi dari bahan organik lebih dipilih karena memiliki afinitas yang cukup tinggi pada logam, nilai effisiensi yang tinggi, serta ramah lingkungan. Effektivitas senyawa organik
sebagai inhibitor sangat dipengaruhi oleh keberadaan heteroatom (O, N, P, dan S), gugus polar, ikatan π, serta pasangan elektron bebas yang menjadi sarana bagi inhibitor untuk melakukan chemisorpsi / berikatan dengan logam secara koordinasi (Spinelli dkk, 2009).
Isatin (1) adalah senyawa turunan indole dengan 2 gugus karbonil di nomor 2 dan 3. Gugus karbonil yang berada di nomor 3 (karbonil golongan keton) sangat reaktif. Sedangkan karbonil pada nomor 2 memiliki sifat seperti amida.
Gambar 1. Struktur Isatin (1)
Penggunaan Isatin sebagai inhibitor laju korosi baja 304 dikaji dalam larutan asam khususnya larutan 1M HCL dan dikaji pula pengaruh temperatur.larutan tersebut terhadap efisiensi inhibisinya.
2. Metodologi Alat dan Bahan Alat
Botol timbang, neraca analitis, gelas beker, alumunium foil, plastik, kertas gosok, labu ukur, buret, erlenmeyer. Instrumen yang digunakan dalam penelitian ini adalah termostat, potensiostat, dan Scanning Electron Microscopy (SEM).
Bahan
Isatin, Asam Klorida Pekat (37%), SS 304, Aquabidest, Aseton, Natrium Hidroksida, dan Asam Oksalat
Prosedur Kerja
Pembuatan Spesimen Baja SS 304
Baja SS 304 dipotong dengan dimensi 3 x 3 x 0.1 cm3 yang digunakan dalam pengukuran dengan menggunakan metode pengurangan berat dan analisis dengan SEM, sedangkan untuk pengukuran dengan metode polarisasi, baja yang digunakan berbentuk silinder dengan diameter 1,4 cm, tebal 0.1 cm. Baja terlebih dahulu digosok dengan kertas gosok grade 500 dan 1000 berturut-turut, kemudian dicuci dengan aquadest dilanjutkan dengan aseton, dan dibilas lagi dengan aquades serta dikeringkan.
Pembuatan Media Korosi
Media korosi yang digunakan adalah larutan HCl 1M tanpa inhibitor, larutan HCl 1M dengan penambahan inhibitor (isatin) dengan variasi konsentrasi 2.5 mM – 12.5 mM
Metode Pengurangan Massa
Spesimen ditimbang dengan neraca analitis kemudian direndam dalam larutan 1M HCL tanpa dan dengan penambahan inhibitor masing-masing selama 3 jam pada variasi temperatur larutan, 35oC, 40 oC, 45 oC, 50 oC, 55 oC. Masing-masing perlakuan dilakukan pengukuran tiga kali ulangan.
Effisiensi inhibisi dapat dihitung dengan menggunakan persamaan :
%IE=Wo-Wi
Wo ×100 %
Dimana Wo pengurangan massa spesimen pada media korosi tanpa inhibitor, dan Wi adalah pengurangan massa spesimen pada media korosi dengan inhibitor.
Metode Polarisasi Potensiodinamik
Metode ini dilakukan untuk mengetahui nilai berbagai parameter korosi (arus korosi, potensial korosi, konstanta Tafel katodik dan anodik). Instrumen yang digunakan adalah Potensiostat type PGS 201 T dengan sel 3 elektroda. Elektroda acuan adalah tipe calomel (SCE), elektroda bantu berupa platina dan elektroda kerja adalah spesimen baja berbentuk silinder. Elektroda kerja, elektroda bantu, dan elektroda pembanding di rangkai menjadi suatu sel dengan larutan elektrolit berupa media korosi tanpa inhibitor atau media korosi dengan inhibitor.
Sel kemudian dihubungkan dengan potensiostat dan komputer untuk membaca data yang diperoleh. Metode polarisasi dilakukan pada suhu kamar. Efisiensi inhibisi (IE) dihitung menggunakan Persamaaan :
%IE=Io-Ii
Io ×100 % dimana Io merupakan densitas arus korosi pada media
korosi tanpa inhibitor dan Ii pada media korosi dengan inhibitor. Analisa SEM
Spesimen hasil metode pengurangan berat, dianalisa permukaannya dengan menggunakan SEM (Scanning Electron Microscopy) dengan perbesaran 10.000 kali. Spesimen yang digunakan adalah hasil rendaman pada media korosi tanpa inhibitor dan media korosi dengan inhibitor yang memiliki nilai %IE maksimum yaitu dengan penambahan Isatin 12.5 mM
Penentuan nilai Energi Aktivasi (Ea)
Nilai pengurangan berat pada media korosi tanpa dan dengan inhibitor pada berbagai temperatur dialurkan sebagai fungsi 1000/T. Nilai Ea diketahui dari slope.
3. Hasil dan Diskusi
Metode Pengurangan Massa
Pengurangan massa merupakan metode selain elektrokimia yang dapat digunakan untuk menentukan laju korosi dan effisiensi inhibisi. Metode ini sederhana dan praktis dilakukan, akan tetapi membutuhkan waktu yang cukup lama untuk perendaman (Spinelli dkk, 2009). Pengurangan massa tersebut terjadi karena logam terdestruksi dan larut menjadi keadaan teroksidasinya yang diakibatkan oleh adanya reaksi kimia antara logam dengan lingkungannya.
Metode ini dilakukan pada temperatur yang bervariasi, yakni mulai dari temperatur Kamar, 35°C, 40°C, 45°C, 50°C, dan 55 OC. Untuk temperatur kamar tidak membutuhkan instrumen
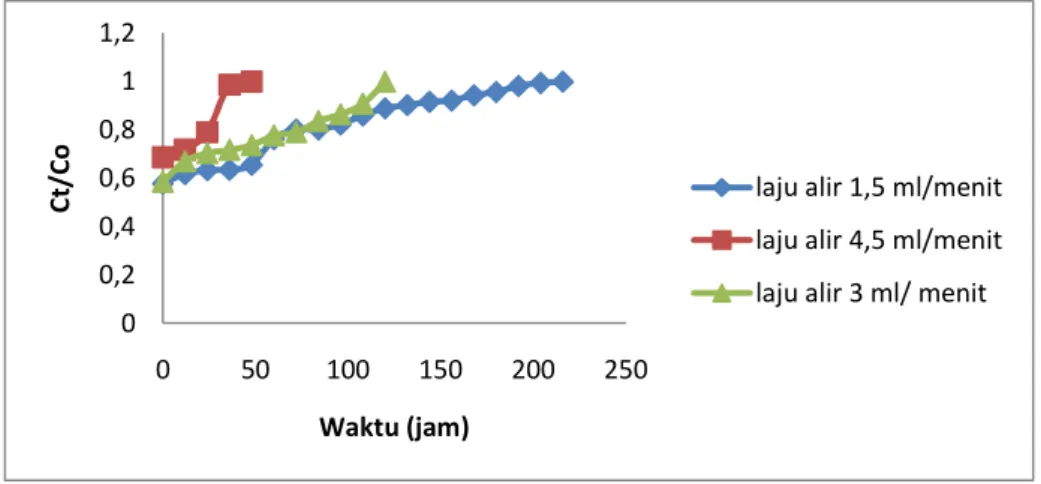
tambahan. Sedangkan untuk temperatur lain digunakan instrumen berupa termostat yang dapat menjaga temperatur dengan konstan. Grafik yang menyatakan hubungan antara konsentrasi isatin dengan efisiensi inhibitor (%EI), dapat dilihat pada gambar 2.
Metode pengurangan massa menunjukkan effisiensi maksimum yang berhasil dicapai adalah sebesar 73.90% pada isatin 12.5 mM di suhu kamar, sedangkan nilai minimum sebesar 42.0% pada isatin 2.5 mM dan suhu 55°C. Metode ini menunjukkan fakta bahwa saat konsentrasi isatin meningkat (pada temperatur yang sama) maka jumlah massa yang berkurang akan semakin kecil (laju korosi berkurang) sehingga effisiensi inhibisinya (%EI) akan meningkat. Hal tersebut karena semakin luas permukaan spesimen yang dilingkupi oleh inhibitor akibat dari peristiwa adsorpsi inhibitor di permukaan baja dan juga semakin berkurangnya serangan ion H+ dan Cl- pada baja akibat bereaksi dengan isatin.
Penelitian lain yang dilakukan Quraishi dkk pada 2008 menunjukkan pola sama dengan yang terjadi pada penelitian ini. Penelitian tersebut menggunakan inhibitor N-(Piperidinomethyl)-3-[(pyridylidene)amino]isatin (PPI) (sebuah turunan isatin) untuk menginhibisi korosi dari baja lunak pada media HCl, ternyata memiliki nilai %EI yang semakin besar saat konsentrasi PPI meningkat. Nilai %EI maksimum yang dicapai adalah 94%, yaitu pada saat konsentrasi isatin 300 ppm. Saat PPI yang ditambahkan melebihi 300 ppm, tidak terjadi perubahan yang signifikan dari nila%EI. Efektivitas dari PPI ditentukan oleh keberadaan ikatan rengkap dan elektron bebas yang terdapat dalam PPI.
Peningkatan temperatur dari media ternyata meningkatkan jumlah pengurangan massa yang mengakibatkan nilai %EI turun. Hal ini dikarenakan peningkatan difusi ion – ion dalam media dan meningkatkan jumlah oksigen terlarut, sehingga reaksi parsial elektrokimia akan semakin cepat dan proses pelarutan logam juga meningkat. Pada media korosi dengan inhibitor yang mengandung inhibitor, kenaikan temperatur akan mengakibatkan proses desorpsi dari inhibitor jika adsorpsinya merupakan fisisorpsi (Harmami dkk, 2006). Grafik yang menunjukkan hubungan antara temperatur dengan %EI pada berbagai konsentrasi isatin dapat dilihat pada gambar 3
40,00 50,00 60,00 70,00 80,00 0 2,5 5 7,5 10 12,5 % E ff is ie n si I n h ib is i Konsentrasi Isatin (mM) Kamar 35°C 40°C 45°C 50°C 55°C
Gambar 3. Grafik Hubungan Antara Temperatur Media dengan Nilai %EI pada Berbagai Konsentrasi Isatin
Hal yang berbeda terjadi saat PPI digunakan sebagai inhibitor korosi pada berbagai variasi temperatur. PPI akan menghasilkan nilai %EI yang meningkat pada saat temperatur media meningkat. Perbedaan ini diakibatkan oleh adanya perbedaan jenis adsorpsi yang terjadi pada PPI dan isatin. Fisisorpsi terjadi pada molekul isatin sedangkan PPI mengalami kemisorpsi yang didahului oleh fisisorpsi. Pada peristiwa kemisorpsi dibutuhkan energi yang cukup tinggi yakni untuk membentuk ikatan antara adsorbat dan adsorben, sehingga pada saat temperaturnya meningkat maka pembentukan ikatan akan lebih mudah dan cepat terjadi. Luas permukaan yang terlingkupi nantinya juga akan bertambah saat temperatur naik dan mengakibatkan semakin tingginya nilai %EI pada penggunaan PPI.
Perbedaaan jenis adsorpsi dan nilai %EI pada isatin dan PPI dikarenakan perbedaan struktur diantara kedua inhibitor tersebut. PPI adalah turunan isatin dengan molekul yang lebih besar dibandingkan isatin sehingga luas pelingkupannya pada logam akan lebih besar dibanding isatin pada konsentrasi sama, sehingga nilai %EI PPI akan lebih besar dibandingkan isatin.
Perbandingan struktur PPI dan isatin, ditampilkan pada gambar 4. PPI memiliki lebih banyak heteroatom (4 atom N dan 1 atom O), molekul isatin memiliki 2 atom O dan 1 atom N, sehingga memungkinkan PPI lebih mudah melakukan ikatan koordinasi (kemisorpsi) dengan logam melalui PEB yang ada di heteroatom tersebut. Isatin sendiri dengan jumlah PEB yang lebih sedikit akan lebih sulit melakukan kemisorpsi dengan logam, sehingga hanya terjadi fisisorpsi.
Keberadaan heteroatom pada PPI tersebut juga akan mengakibatkan lebih banyaknya ion H+ yang tertangkap oleh PPI dibandingkan pada isatin. Karena dua hal yang disebutkan tersebut maka nilai %EImax pada PPI yang mencapai 94% menjadi lebih tinggi dibandingkan %EImax pada isatin yang hanya mencapai 73.90%.
(a) (b)
Gambar 4. Perbandingan Struktur antara (a) PPI dan (b) Isatin
40,00 45,00 50,00 55,00 60,00 65,00 70,00 75,00 80,00 30 35 40 45 50 55 % E ff is ie n si I n h ib is i Temperatur (°C) 2.5 5 7.5 10 12.5
Perhitungan Energi Aktivasi (Ea)
Perhitungan nilai energi aktivasi (Ea) menggunakan data dari metode pengurangan massa. Nilai logaritma natural (ln) jumlah pengurangan massa (∆w) pada larutan dengan konsentrasi isatin yang sama dialirkan pada fungsi 1000/T. Gambar 5 menampilkan hasil pengaluran data tersebut.
Gambar 5. Grafik Hubungan antara ln ∆W vs 1000/T
Berdasar persamaan Arhennius nilai slope yang diperoleh dari persamaan garis tersebut adalah nilai dari –Ea/R. Nilai Ea diperoleh dengan mengalikan nilai slope dengan konstanta gas ideal (R) sebesar 8.314 J/mol. Grafik yang menyatakan hubungan antara energi aktivasi (Ea) dan konsentrasi inhibitor yang digunakan dapat dilihat pada gambar 6.
Gambar 6. Grafik Hubungan Energi Aktivasi (Ea) dan Konsentrasi Isatin
Nilai Ea maksimum diperoleh sebesar 12.22 kJ/mol dan Ea minimum sebesar 6.79 kJ/mol. Terjadi sedikit penurunan nilai Ea pada saat konsentrasi isatin mencapai 12.5 mM, nilai Ea seharusnya lebih besar dari 12.22 kJ/mol tetapi faktanya hanya mencapai 12.14 kJ/mol. Hal tersebut dimungkinkan karena pengaruh kelarutan isatin pada 12.5 mM yang tidak sempurna meski
-5 -4,5 -4 -3,5 -3 -2,5 3 3,1 3,2 3,3 3,4 ln Δ w 1000/T (K-1 ) 0 mM 2.5 mM 5 mM 7.5 mM 10 mM 12.5 mM R² = 0,9344 0 2 4 6 8 10 12 14 0 2,5 5 7,5 10 12,5 E n e rg i A k ti v a si ( K j/ m o l) Konsentrasi Isatin (mM)
telah dilakukan pengadukan dan pemanasan selama 15 menit, akan tetapi hal tersebut tidak terlalu berpengaruh pada kinerja isatin sebagai inhibitor korosi.
Berdasar data dapat diketahui bahwa energi aktivasi dalam media korosi dengan inhibitor lebih besar dibanding dalam media korosi tanpa inhibitor, dan nilai energi aktivasi cenderung naik saat konsentrasi isatin meningkat. Energi aktivasi yang semakin besar juga identik dengan nilai %EI yang semakin besar. Hal ini dikarenakan secara termodinamik, nilai Ea yang besar akan mengakibatkan korosi lebih lambat dan sulit terjadi, sehingga laju korosi dalam media yang sudah ditambahkan inhibitor akan mengalami penurunan dan nilai %EI akan meningkat.
Pada penelitian lain juga ditemukan inhibisi korosi yang menghasilkan nilai Ea meningkat pada saat inhibitor ditambahkan, seperti yang dilaporkan oleh Xianghong dkk pada 2009 saat menggunakan 6-benzylaminopurine sebagai inhibitor korosi. Nilai Ea pada media tanpa inhibitor mencapai 51.86 kJ/mol, sedangkan nilai Ea pada media dengan inhibitor masksimum (300 mg/L) mencapai 120.25 kJ/mol. Peningkatan energi aktivasi ini terjadi karena energi yang dibutuhkan oleh H+ untuk mengkorosi baja meningkat karena terganggu oleh hadirnya inhibitor dan mengakibatkan laju korosi menurun.
Pada penelitian Spinelli dkk pada 2009 yang menggunakan asam kaffeat sebagai inhibitor korosi pada baja lunak dalam asam sulfat, ditemukan fenomena nilai Ea pada media tanpa inhibitor yang lebih besar dibanding pada media dengan inhibitor, dimana hal tersebut dihubungkan dengan terjadinya peristiwa kemisorpsi dari asam kaffeat pada permukaan baja. Nilai Ea yang sama pada media tanpa dan dengan inhibitor juga dapat terjadi, oleh karena itu tipe inhibitor korosi diklasifikasikan menjadi 3 golongan :
i. %EI turun dengan naiknya temperatur, maka Ea dengan inhibitor > Ea tanpa inhibitor. Menandakan adanya fisisorpsi dari inhibitor pada permukaan logam, dan kerja katodik dari inhibitor.
ii. %EI naik dengan naiknya temperatur, maka Ea dengan inhibitor < Ea tanpa inhibitor. Menandakan adanya kemisorpsi dari inhibitor pada permukaan logam
iii. %EI tidak berubah saat temperatur berubah, maka Ea dengan inhibitor = Ea tanpa inhibitor (Xianghong dkk, 2009) Isatin pada penelitian ini termasuk golongan (i), sehingga dapat dikatakan bahwa Isatin merupakan inhibitor yang teradsorp secara fisika pada permukaan logam.
Metode Polarisasi Potensiodinamik
Nilai arus korosi (Icorr) dan potensial korosi (Ecorr) pada proses korosi baja SS 304 dalam media korosi dapat diketahui dengan menggunakan metode polarisasasi potensiodinamik. Instrumen untuk metode ini adalah potensiostat PGZ 201 T dengan sistem 3 elektroda yang terdapat di PTAPB – BATAN Jogjakarta.
Baja SS 304 dengan ketebalan 1 cm dipotong berbentuk silinder dengan diameter 1.4 cm, spesimen terlebih dahulu digosok dengan kertas gosok, untuk membersihkan kerak, kotoran dan lapisan oksida yang terdapat di permukaan baja, kemudian dicuci dengan aquabidest, aseton, dan dibilas dengan aquabidest. Spesimen kemudian dikeringkan.
Spesimen di uji polarisasi potensiodinamik dengan sistem 3 elektroda, spesimen sebagai elektroda kerja (WE), platina sebagai elektroda bantu (AE), dan SCE sebagai elektroda reference (RE), sedangkan untuk elektrolit digunakan larutan HCl tanpa inhibitor dan dengan inhibitor. Media korosi pada metode ini diencerkan 10 kali dari media korosi pada metode pengurangan massa. Hal tersebut dilakukan karena keterbatasan instrumen potensiostat tersebut. Metode Polarisasi potensiodinamik dijalankan dengan scan rate 20 mV/s pada range -2500 mV sampai 1000 mV.
Icorr maksimum diperoleh pada media korosi tanpa inhibitor dengan nilai sebesar 101.9 µA, sedangkan nilai minimum diperoleh pada saat konsentrasi Isatin 1.25 mM sebesar 46.99 µA. Dapat disimpulkan bahwa inhibisinya akan cenderung meningkat pada saat konsentrasi Isatin semakin
meningkat sampai konsentrasi 12.5 mM, dengan nilai % EI minimum sebesar 26.4 % dan maksimum sebesar 53.88 %
Hasil dari polarisasi ditampilkan dalam gambar 7, 8, dan 9 sebagai berikut :
Gambar 7. Kurva Polarisasi SS 304 pada HCl 0.1 M (1) dan HCl 0.1 M dengan Isatin 0.25 mM (2)
Gambar 8. Kurva Polarisasi SS 304 pada HCl 0.1M dengan Isatin 0.5mM (3) dan HCl 0.1 M dengan Isatin 0.75mM (4)
Gambar 9. Kurva Polarisasi SS 304 pada HCl 0.1 M dengan Isatin 1.0 mM (5) dan HCl 0.1 M dengan Isatin 1.25 mM (6)
Nilai berbagai parameter korosi (Icorr, Ecorr, βa, βc, dan % EI) pada berbagai kondisi yang dihasilkan dari metode ini disampaikan dalam tabel 1.
Tabel 1. Nilai Berbagai Parameter Korosi Baja SS 304 pada Media HCl 0.1 M dengan Hadirnya Isatin pada T kamar
[Inhibitor] Ecorr icorr βa -βc % EI
0 mM -862.2 101.9 563.7 273.8 - 0.25 mM -904.8 74.58 591.4 240.7 26.8106 0.5 mM -904.5 74.29 563.3 197.6 26.48675 0.75 mM -783.6 61.16 291.1 172 39.98037 1mM -853.1 57.53 338.9 173.8 43.54269 1.25 mM -836.9 46.99 226.3 136.3 53.88616
Hubungan antara % icorr dengan konsentrasi Isatin dapat dilihat pada gambar 10.
Gambar 10 Grafik Hubungan icorr dengan Konsentrasi Isatin.
Nilai potensial korosi (Ecorr) yang naik turun dimungkinkan oleh adanya proses adsorpsi Isatin di permukaan baja SS 304 saat polarisasi tidak stabil. Akan tetapi inhibisi korosi tetap berlangsung, hal itu terbukti dari nilai Icorr yang terus menurun saat ditambahkan Isatin.
Nilai konstanta tafel anodik pada tabel 1 diatas menunjukkan perubahan yang tak teratur, hal ini menunjukkan bahwa adsorpsi Isatin di permukaan spesimen lemah dan mudah lepas yang merupakan ciri dari adsorpsi secara fisika. Fisisorpsi ini terjadi akibat adanya interaksi elektrostatik antara inhibitor dengan permukaan logam. Sedangkan nilai konstanta tafel katodik, menunjukkan nilai penurunan yang teratur dengan meningkatnya konsentrasi inhibitor, hal tersebut menunjukkan bahwa isatin bekerja cukup baik di sisi katodik, yaitu dengan mengurangi laju reduksi ion H+ menjadi H2
Pada penelitian Isatin yang lain, oleh Quartarone dkk (2003), terdapat peristiwa kemisorpsi antara isatin dengan Cu yang di buktikan oleh spektrofotometri uv-vis. Nilai βc pada penelitian Quartarone ini menunjukkan bahwa Isatin juga bekerja dengan baik pada sisi katoda dengan menghambat laju reduksi H+ menjadi H2. Hal diatas menunjukkan bahwa Isatin adalah tipe inhibitor campuran. R² = 0,9023 0 50 100 150 0 0,25 0,5 0,75 1 1,25 D en si ta s A ru s K o ro si Konsentrasi Isatin (mM)
Mekanisme Inhibisi Korosi
Inhibitor korosi dapat bekerja menghambat korosi dengan berbagai jalan dan persitiwa adsorpsi inhibitor pada permukaan logam merupakan satu mekanisme untuk inhibitor korosi type anodik. Beberapa penelitian sebelumnya menunjukkan bahwa inhibitor organik disukai sebagai inhibitor, karena perilakunya yang memiliki afinitas tinggi pada logam dan ramah lingkungan. Afinitas senyawa organik sangat dipengaruhi oleh keberadaan heteroatom (N, O, P, S), PEB, dan ikatan rangkap (Spinelli dkk, 2009).
Jenis adsorpsi yang terjadi, apakah fisisorpsi, kemisorpsi, ataupun kemisorpsi yang didahului fisisorpsi sangat tergantung pada struktur inhibitor itu sendiri, jenis logam dan keadaan media (pH, Temperatur, dan jumlah inhibitor). Molekul isatin dapat teradsorp secara kimia pada permukaan logam yang ditunjukkan dengan pembentukan kompleks Cu-Isatin dalam media H2SO4 0.5 M yang dibuktikan dengan spektrofotometri uv-vis. Isatin berperan sebagai basa lewis yang mendonorkan PEB, sedangkan logam sebagai asam lewis akan menangkap PEB tersebut, sehingga terbentuk senyawa kompleks. Senyawa kompleks tersebut akan menutup sebagian permukaan logam dan menghambat pelarutan dari logam. Proses kemisorpsi seperti ini membutuhkan energi yang cukup tinggi dan waktu kontak yang lama. Pola kemisorpsi yang terjadi dapat diuji dengan cara fitting terhadap berbagai persamaan isothermal adsorpsi (Quartarone dkk, 2003)
Fisisorpsi terjadi apabila hanya ada interaksi dipol-dipol antara inhibitor dan logam, adsorpsi model ini lemah dan mudah lepas. Fisisorpsi akan terjadi apabila struktur inhibitor tidak memungkinkan untuk mendonorkan pasangan elektron bebas (PEB) nya pada logam. Fisisorpsi inhibitor di permukaan logam ditemukan pula pada penelitian Harmami dkk (2003) yang menggunakan 4-metil imidazole untuk inhibitor korosi baja 316L. Fisisorpsinya diketahui dari nilai energi bebas Gibbs (∆G) yang rendah, dan nilai energi aktivasi korosi saat ditambahkan inhibitor korosi menjadi lebih besar. “Fitting” membuktikan bahwa inhibitor tersebut mengikuti pola Freundlich. Proses fisisorpsi tersebut bisa diikuti dengan kemisorpsi, hal itu dapat dilihat dengan meningkatnya fraksi pelingkupan permukaan logam seiring dengan peningkatan konsentrasi inhibitornya.
Pada penelitian ini menunjukkan bahwa isatin pada awalnya teradsorp secara fisika pada permukaan logam, hal ini diketahui dari nilai βa yang berubah tidak beraturan. Nilai βa tersebut menunjukkan kalau adsorpsi isatin di permukaan logam lemah dan mudah lepas, sama seperti ciri dari fisisorpsi. Nilai energi aktivasi pada media korosi dengan inhibitor yang lebih besar dibandingkan pada media korosi tanpa inhibitor juga menunjukkan adanya fisisorpsi seperti pada penelitian Behpour dkk pada tahun 2009.
Ditinjau berdasarkan struktur, isatin memang kurang mampu untuk mendonorkan PEB pada logam, hal ini terkait dengan terbatasnya PEB yang dimiliki dan adanya delokalisasi elektron pada isatin yang melibatkan PEB dari atom N dan O sehingga mempersulit donor PEB oleh isatin pada logam.
Keberadaan fisisorpsi sebenarnya kurang menguntungkan untuk proses inhibisi korosi, karena ikatan antara inhibitor dan logam yang lemah dan mudah lepas yang memungkinkan peristiwa korosi masih bisa terjadi, akan tetapi pada penelitian ini diketahui bahwa isatin juga berperan pada sisi katodik dengan menghambat laju reduksi dari H+ melalui pembentukan senyawa isatin yang terprotonasi (H-Isatin)+ yang kemudian dapat membentuk garam klorida Isatin (H-isatin)+Cl—. Sulitnya H+ dan Cl- untuk bereaksi dengan logam pada hadrinya isatin akan mengakibatkan nilai Ea meningkat, hal ini terbukti pada penelitian ini, dimana nilai Ea pada media korosi dengan inhibitor lebih besar dibanding Ea pada media korosi tanpa inhibitor.
Analisa SEM (Scanning Electron Microscopy)
Spesimen SS 304 hasil pengurangan massa pada media korosi tanpa inhibitor (HCl 1M tanpa Isatin) dan media korosi dengan inhibitor yang menghasilkan nilai effisiensi maksimum (HCl 1M + Isatin 12.5 mM) dianalisa dengan menggunakan SEM pada perbesaran 5.000 kali. Tujuan dari analisa ini adalah untuk mengetahui kerusakan akibat korosi yang terjadi pada permukaan baja setelah direndam dalam media korosi. Hasil dari analisa SEM pada 2 spesimen tersebut ditampilkan pada gambar 11 a dan b.
Dari hasil analisa SEM tersebut menunjukkan bahwa pada permukaan baja yang direndam dalam media HCl 1M tanpa isatin mengalami kerusakan yang lebih dibandingkan baja yang direndam dalam HCl dan Isatin 12.5 mM. Terlihat lebih banyak cacat di permukaan akibat serangan H+ dan Cl- pada gambar a dibanding gambar b. Cacat logam tersebut terjadi karena adanya bagian logam yang teroksidasi dan larut akibat peristiwa korosi. Pada gambar b yang menunjukkan cacat yang lebih sedikit dibandingkan gambar a menunjukkan bahwa korosi telah terhambat oleh kehadiran isatin. Hal tersebut menunjukkan bahwa isatin bertindak sebagai inhibitor korosi.
(a) (b)
Gambar 11. Hasil SEM spesimen SS 304 pada larutan HCl 1M tanpa Isatin (a) dan dengan Isatin 12.5 mM (b) (perbesaran 5000x)
4. Kesimpulan
Berdasarkan hasil penelitian yang telah dilakukan, menunjukkan bahwa isatin dapat digunakan sebagai inhibitor korosi untuk baja SS 304 dalam larutan HCl.. Dari data hasil pengukuran dengan menggunakan metode pengurangan dan polarisasi potensiodinamik menunjukkan bahwa nilai efisiensi inhibisi meningkat seiring dengan meningkatnya konsentrasi isatin dengan nilai efisiensi sebesar 73.90% pada konsentrasi isatin 12,5 mM. Efisiensi inhibisi tersebut akan turun seiring dengan peningkatan temperatur media. Nilai energi aktivasi yang meningkat menunjukkan terjadinya inhibisi korosi, serta data parameter korosi menunjukkan bahwa isatin adalah tipe inhbitor campuran, yang bekerja pada sisi anodik dan katodik. Proses adorpsi inhibitor pada permukaan logam diawali dengan adsorpsi fisika dan dilanjutkan dengan adsorpsi kimia.
Ucapan Terima Kasih
Penulis mengucapkan rasa terima kasih yang sebesar – besarnya kepada :
1. Badan Tenaga Atom Nasional (BATAN) di Babarsari Yogyakarta yang telah memberikan ijin untuk menggunakan alat potensiostat.
Daftar Pustaka
Behpour, M, S.M. Ghoreishi, N. Soltani, M. Salavati-Niasari (2009), “The inhibitive effect of some bis-N,S-bidentate Schiff bases on corrosion behaviour of 304 stainless steel in hydrochloric acid solution” Corrosion Science 51 : 1073 – 1082
Da Silva, Joaquim F. M, Simon J. Garden and Angelo C. Pinto (2001) “The Chemistry of Isatins: a Review from 1975 to 1999” J. Braz. Chem. Soc., Vol. 12, No. 3 : 273-324,
Harmami, Hendro Juwono, Agus W., Yusuf P., M.Yusuf dan Nurhayati* (2003), “study of 4-methyl imidazole as corrosion inhibitor of 316L austenitic steel in acidic media” Majalah IPTEK 17 : 35 – 39
Hasnan, Ahmad, S., (2006),”Mengenal Baja”, (http://www.oke.or.id/)
Honeycombe, R.W.K., (1995),“Steels Microstructure and Properties”, Second Edition, Edward Arnold, London
Indocor, (1999), Pelatihan Ahli Korosi Muda, Indocor, Bandung
Jones, D.A (1996),”Principles and preventation of corrosion”, Second Edition, Prentice Hall, Inc., United States of America
Migahed, M.A, dkk (2005), “Effectiveness of some non ionic surfactants as corrosion inhibitors for carbon steel pipelines in oil fields” Electrochimica acta 50 : 4683 – 4689.
Mulyono, (2006), “Kamus Kimia”, Bumi Aksara, Jakarta
Oxtoby, David W, (2001), “ Kimia Modern, Edisi Keempat Jilid 1”, Erlangga, Jakarta
Quartarone, G, T. Bellomi, A. Zingales (2003), “Inhibition of Copper Corrosion by Isatin in Aerated 0.5 M H2SO4” Corrosion Science 45 : 715 – 733
Quraishi, M.A, Ishtiaque A, Ashish K S, Sudhish K S, B. Lal, Vakil Singhb (2008), “N-(Piperidinomethyl) -3 [(pyridylidene)amino] isatin: A new and effective acid corrosion inhibitor for mild steel” Materials Chemistry and Physics 112 : 1035 - 1039
Spinelli, A , FS. De Souza (2009), ”Caffeic acid as a green corrosion inhibitor for mild steel” Corrosion Science 51 : 642 – 649
Surya, Indra, D., (2004),“Kimia Dari Inhibitor Korosi”, UNSUD, Sumatra Utara
Thretwey, Kenneth R dan John Camberlein, (1991), “Korosi untuk Mahasiswa Sains dan Rekayasa” Gramedia Pustaka Utama, Jakarta
Xianghong Li, Shuduan Deng, Hui Fu, Guannan Muc (2009), “Inhibition effect of 6-benzyl aminopurine on the corrosion of cold rolled steel in H2SO4 solution” Corrosion Science 51 : 620 – 634
VALIDASI METODE PENGUKURAN LOGAM DALAM
LIMBAH ELEKTROPLATING DENGAN METODE AAS
(ATOMIC ABSORPTION SPECTROPHOTOMETER)
Yatim Lailun Ni’mah, Irmina Kris Murwani dan Ita Ulfin
Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan AlamInstitut Teknologi Sepuluh Nopember, Surabaya
Abstrak
Telah dilakukan validasi metode F-AAS (Flame – Atomic Absorption Spectrophotometric) untuk penentuan kandungan logam Mn, Cu, Zn, dan Fe dalam limbah elektroplating. Parameter validasi meliputi sensitivitas, accuracy (kecermatan), precission, linieritas LOD, LOQ. Hasil Validasi metode AAS untuk penentuan logam Cu, Zn, Fe, dan Mn diperoleh uji linearitas memberikan nilai R2 masing-masing adalah 0,999; 0,996; 0,999 dan 0,999. Nilai presisi untuk logam tersebut berturut-turut adalah , 0,1594; 0,020267; 0,0228 dan 0,044 dan sensitivitasnya berturut-turut 0,1379; 0,217; 0,9624 dan 0,4993. Sedangkan nilai LOD nya adalah 5,48x10-3 ; 4,08x10-3; 0,067 dan 0,0168 dan nilai LOQ nya adalah 0,0183; 0,0136; 0,2235 dan 0,0559. Konsentrasi logam Fe, Mn, Cu dan Zn dalam sampel limbah elektroplating berturut – turut adalah 4,22 ; 0,7275 ; 0,8563 dan 1,033 ppm.
1. Pendahuluan
Di laboratorium Lingkungan ITS yang terdapat di Research Center memiliki beberapa peralatan / instrument yang dapat digunakan untuk menentukan pengukuran kualitas dan kuantitas parameter untuk lingkungan. Diantara instrument yang ada yaitu Spektrofotometer Serapan Atom (Atomic Absorption Spectrophotometer). Instrument tersebut dapat digunakan untuk pengukuran analisa beberapa logam. Sebelum di lakukan untuk pengukuran sampel, maka sebelumnya instrument tersebut perlu di lakukan validasi metode agar data hasil pengukuran yang diperoleh memiliki nilai yang ukurat.Jika pada pengukuran diperoleh data dengan penyimpangan yang terlalu besar, maka kesalahan pengukuran tidak dapat diterima, jadi hasil analisis tersebut tidak valid. Oleh karena itu perlu dilakukan penelitian mengenai validasi metode penentuan beberapa konsentrasi logam yang sering diukur dengan instrumen tersebut. Pengukuran konsentrasi logam dengan AAS perlu divalidasi agar data yang diperoleh lebih presisi dan akurat. Pada penelitian ini dilakukan optimasi dalam pengukuran logam menggunakan AAS dengan beberapa parameter validasi yaitu sensitivitas, accuracy (kecermatan), precission, linieritas dan rentang, LOD dan LOQ.
Validasi metode analisis adalah suatu tindakan penilaian terhadap parameter tertentu, berdasarkan percobaan laboratorium, untuk membuktikan bahwa parameter tersebut memenuhi persyaratan untuk penggunaannya.
Kecermatan (Accuracy) adalah ukuran yang menunjukkan derajat kedekatan hasil analisis dengan kadar analit yang sebenarnya. Kecermatan dinyatakan sebagai persen perolehan kembali (recovery) analit yang ditambahkan. Kecermatan hasil analisis sangat tergantung pada sebaran galat sistematik di dalam keseluruhan tahapan analisis. Oleh karena itu untuk mencapai kecermatan yang tingi hanya dapat dilakukan dengan cara mengurangi galat sistematik tersebut seperti menggunakan peralatan yang telah dikalibrasi, menggunakan pereaksi dan pelarut yang baik, pengontrolan suhu, dan pelaksanaannya yang cermat, taat asas sesuai prosedur.
Kriteria kecermatan sangat tergantung kepada konsentrasi analit dalam matriks sampel dan pada keseksamaan metode (RSD). Vander Wielen, dkk menyatakan bahwa selisih kadar pada
berbagai penentuan (Xd) harus 5% atau kurang pada setiap konsentrasi analit pada mana prosedur dilakukan.
Keseksamaan (Precision) adalah ukuran yang menunjukkan derajat kesesuaian antara hasil uji individual, diukur melalui penyebaran hasil individual dari rata-rata jika prosedur diterapkan secara berulang pada sampel-sampel yang diambil dari campuran yang homogen.
Keseksamaan diukur sebagai simpangan baku atau simpangan baku relatif (koefisien variasi). Keseksamaan dapat dinyatakan sebagai keterulangan (repeatability) atau ketertiruan (reproducibility). Keterulangan adalah keseksamaan metode jika dilakukan berulang kali oleh analis yang sama pada kondisi sama dan dalam interval waktu yang pendek. Keterulangan dinilai melalui pelaksanaan penetapan terpisah lengkap terhadap sampel – sampel identik yang terpisah dari batch yang sama, jadi memberikan ukuran keseksamaan pada kondisi yang normal. Ketertiruan adalah keseksamaan metode jika dikerjakan pad kondisi yang berbeda. Biasanya analiosis dilakkan pada laboratorium – laboratorium yang berbeda menggunakan peralatan, pereaksi, pelarut dana analis ayang berbeda pula. Analisis dilakukan terhadap sampel – sampel yang diduga identik yang dicuplik dari batch yang sama.
Keseksamaan dapat dihitung dengan cara sebagai berikut :
a. Hasil analisis adalah X1, X2, X3,…..Xn, maka simpangan bakunya adalah :
1
)
(
(
2−
−
∑
=
n
X
X
SD
b. Simpangan baku relatif (RSD) atau koefisien variasi (KV) adalah : RSD = SD/X
%
100
x
X
SD
KV
=
Linearitas adalah kemampuan metode analisis yang memberikan respon yang secara langsung atau dengan bantuan transformasi matematik yang baik, proporsional terhadap konsentrasi analit dalam sampel. Rentang metode adalah pernyataan batas terendah dan tertinggi analit yang sudah ditunjukkan dapat ditetapkan dengan kecermatan, keseksamaan, dan linearitas yang dapat diterima.
Sebagai parameter adanya hubungan linier digunakan koefisien korelasi r pada analisis regresi linier Y = a + bX. Hubungan linier yang ideal dicapai jika nilai b = 0 dan r = +1 atau -1 bergantunga pada arah garis. Sedangakan nilai a menunjukkan kepekaan analisis terutama instrumen yang digunakan.
Batas deteksi adalah jumlah terkecil analit dalam sampel yang dapat dideteksi yang masih memberikan respon signifikan dibandingkan dengan blanko. Batas deteksi merupakan parameter uji batas. Batas kuntitasi merupakan parameter pada analisis renik dan diartikan sebagai kuantitas terkecil analit dalam sampel yang masih dapat memenuhi kriteria cermat dan seksama.
Penentuan batas deteksi suatu metode berbeda-beda tergantung pada metode analisis itu menggunakan instrumen atau tidak. Pada analisis yang tidak menggunakan instrumen batas tersebut ditentukan dengan mendeteksi analit dalam sampel pada pengenceran bertingkat. Pada analisis instrumen batas deteksi dapat dihitung dengan mengukur respon blanko beberapa kali lalu dihitung simpangan baku respon blanko dan formula dibawah ini dapat digunakan untuk perhitungan,
SI
S
k
Q
=
.
bQ = LOD (batas deteksi) atau LOQ (batas kuantitasi) k = 3 untuk batas deteksi atau 10 untuk batas kuantitasi Sb = simpangan baku respon analitik dari blanko
SI = arah garis linear (kepekaan arah) dari kurva antara respon terhadap konsentrasi = slope (b pada persamaan garis y = a + bx)
Batas deteksi dan kuantitasi dapat dihitung secara statistik melalui garis regresi linier dari kurva kalibrasi. Nilai pengukuran akan sama dengan nilai b pada persamaan garis linier y = a + bx, sedangkan simpangan baku blanko sama dengan simpangan baku residual (Sy/x).
Batas deteksi (LOD)
Karena k = 3 atau 10, simpangan baku (Sb) = Sy/x, maka : LOD =
SI
x
Sy /
3
Batas kuantitasi (LOQ)
LOQ =
SI
x
Sy /
10
Metode AAS memiliki prinsip kerja pada absorpsi cahaya oleh atom. Atom-atom menyerap cahaya tersebut pada panjang gelombang tertentu, tergantung pada sifat unsurnya. Cahaya pada panjang gelombang ini memiliki cukup energi untuk mengubah tingkat elektronik dari atom–atom logam.
Metode AAS sering digunakan untuk analisis logam karena ketelitiannya sampai tingkat yang sangat kecil, tidak memerlukan pemisahan pendahuluan. Kemungkinan untuk menentukan konsentrasi semua unsur sampai pada ppm. Sebelum pengukuran tidak selalu memisahkan unsur yang ditentukan karena kemungkinan penentuan satu unsur dengan kehadiran unsur lain.
Penelitian ini bertujuan untuk melakukan validasi penentuan logam (Tembaga, Seng , Besi dan Mangan) dari sampel limbah elektroplating dengan Spektofotometer Serapan Atom.
2. Metode Penelitian Alat dan Bahan
Alat yang digunakan adalah Satu unit alat Spektrofotometer Serapan Atom, Mikropipet, pipet volume, pipet tetes, gelas ukur, beker gelas, neraca analitik, dan labu ukur. Sedangkan bahan yang digunakan adalah padatan Seng (II) nitrat Zn(NO3)2.9H2O, padatan tembaga (II) nitrat trihidrat Cu(NO3)2.3H2O, HCl, Larutan standar Cu, Zn, Fe dam Mn digunakan sebagai larutan standar kalibrasi, kertas saring whatman, HNO3 65%, NaOH, aquades, aqua DM dan sampel limbah industri elektroplating.
Prosedur Kerja
Pembuatan Kurva Kalibrasi Larutan Fe, Cu, Mn dan Zn
Larutan induk Fe, Cu dan Mn 1000 ppm masing-masing dipipet sebanyak 10 ml kemudian dimasukkan dalam labu ukur 100 ml dan diencerkan dengan menambahkan larutan HNO3 1% hingga tanda batas, sehingga diperoleh larutan tembaga dengan konsentrasi 100 ppm. Larutan ini kemudian dipipet sebanyak 0; 1; 5; 10; dan 20 mL kemudian dimasukkan dalam labu ukur 100 ml dan diencerkan dengan menambahkan larutan HNO3 1% hingga tanda batas, sehingga diperoleh larutan tembaga dengan konsentrasi 0; 1; 5; 10; dan 20 ppm. Larutan Fe dianalisa dengan AAS pada λ 249,3 nm, dengan tipe nyala AA (udara-asetilen), sensitivitas 0,045 ppm, range kerja 2,5 – 10 ppm dan batas deteksi 0,006 ppm. Larutan Mn dianalisa dengan AAS pada λ 279,5 nm, dengan tipe nyala AA (udara-asetilen), sensitivitas 0,021 ppm, range kerja 1 – 4 ppm dan batas deteksi
0,002 ppm, lalu masing – masing dibuat kurva kalibrasi dengan mengalurkan harga absorbansi (A) terhadap konsentrasi larutan(C).
Sedangkan pembuatan kurva kalibrasi Zn dilakukan dengan cara : larutan induk seng 1000 ppm dipipet sebanyak 10 ml kemudian dimasukkan dalam labu ukur 100 ml dan diencerkan dengan menambahkan larutan HNO3 1% hingga tanda batas, sehingga diperoleh larutan Seng dengan konsentrasi 100 ppm. Larutan ini kemudian dipipet sebanyak 0; 1; 2; 3; dan 4 mL kemudian dimasukkan dalam labu ukur 100 ml dan diencerkan dengan menambahkan larutan HNO3 1% hingga tanda batas, sehingga diperoleh larutan Seng dengan konsentrasi 0; 1; 2; 3 dan 4 ppm. Selanjutnya dianalisa dengan SSA pada λ 357,9 nm, dengan tipe nyala AA (udara-asetilen), lalu dibuat kurva kalibrasi dengan mengalurkan harga absorbansi (A) terhadap konsentrasi larutan(C). Pengukuran konsentrasi Fe, dan Mn dalam sampel limbah industri
Sampel berupa air limbah di ambil 1 mL kemudian ditambah HNO3 1 % 3 tetes, dimasukkan kedalam labu ukur 100 mL kemudian diencerkan sampai tanda batas. Sampel diukur kadar Cu, Fe dan Mn dengan menggunakan SSA.
3. Hasil dan Pembahasan
Persiapan instrumen diawali dengan pemeriksaan lampu yang terpasang pada alat AAS dan dicatat pada nomor berapa lampu tembaga, besi mangan dan seng terpasang. Sebelum alat AAS digunakan untuk mengukur sampel, semua kondisi harus dicek dalam keadaan benar, misalnya gas dan udara sudah mengalir, cooling water pada burner sudah nyala, air pada drill pot tidak boleh kosong, penampung buangan sudah terpasang, panjang gelombang sudah sesuai untuk logam yang diukur, dll.
Analisa yang dilakukan yaitu pembuatan kurva kalibrasi dari logam tembaga, besi, mangan dan seng serta uji linieritas untuk masing-masing logam tersebut serta uji yang lain (presisi, akurasi, selektivitas, LOD dan LOQ).
Hasil yang sudah didapatkan dari penelitian ini yaitu berupa data hasil uji linieritas, uji presisi, selektifitas, LOD dan LOQ untuk logam mangan, seng, besi dan tembaga.
Kurva kalibrasi dibuat dengan mengukur absorbansi dari larutan standar yang telah diketahui konsentrasinya dengan menggunakan AAS pada λ maksimum tertentu untuk masing-masing logam. Kemudian dengan mengalurkan nilai absorbansi terhadap konsentrasi dari larutan standart dan berdasarkan hukum Lambert Beer akan diperoleh suatu persamaan garis lurus melalui regresi linier. Persamaan regresi linier dari kurva kalibrasi ini yang digunakan untuk menghitung konsentrasi logam dalam cuplikan.
Uji Linieritas
Pembuatan Kurva kalibrasi Logam Tembaga, Besi dan Mangan
Kurva kalibrasi logam tembaga (Cu) dibuat dengan mengukur absorbansi larutan standar logam tembaga dengan konsentrasi 0, 1, 5, 10, 20 ppm yang diukur dengan AAS pada λ 324,7 nm. Dari data yang diperoleh kemudian dibuat kurva kalibrasi dengan mengalurkan konsentrasi larutan standar tembaga (x) terhadap absorbansinya (y), dan dapat ditentukan persamaan garis regresi liniernya. Kurva kalibrasi logam tembaga ditunjukkan pada Gambar 1 di bawah ini.
Gambar 1. Kurva kalibrasi larutan standar tembaga
Kurva kalibrasi logam besi dibuat dengan mengukur absorbansi larutan standar logam besi dengan konsentrasi 0, 1, 5, 10, 20 ppm yang diukur dengan AAS pada λ 248,3 nm. Dari data yang diperoleh kemudian dibuat kurva kalibrasi dengan mengalurkan konsentrasi larutan standar tembaga (x) terhadap absorbansinya (y), dan dapat ditentukan persamaan garis regresi liniernya. Kurva kalibrasi logam besi ditunjukkan pada Gambar 2.
Gambar 2. Kurva kalibrasi larutan standar besi
Kurva kalibrasi logam mangan dibuat dengan mengukur absorbansi larutan standar logam mangan dengan konsentrasi 0, 1, 5, 10, 20, ppm yang diukur dengan SSA pada λ 279,5 nm. Dari data yang diperoleh kemudian dibuat kurva kalibrasi dengan mengalurkan konsentrasi larutan standar tembaga (x) terhadap absorbansinya (y), dan dapat ditentukan persamaan garis regresi liniernya. Kurva kalibrasi logam mangan ditunjukkan pada Gambar 3.
y = 0,0309x + 0,0021 R² = 0,9999 0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0 5 10 15 20 25 A b so rb a n si Konsentrasi Tembaga (ppm) y = 0,0044x + 0,0002 R² = 0,9999 0 0,02 0,04 0,06 0,08 0,1 0 5 10 15 20 25 A b so rb a n si Konsentrasi Besi (ppm)
Gambar 3. Kurva kalibrasi larutan standar mangan
Keabsahan kurva kalibrasi diatas dapat diuji dengan menentukan harga koefisien korelasi (R2) atau uji kelinieran yang menyatakan ukuran kesempurnaan hubungan antara konsentrasi larutan standar dengan absorbansinya.
Korelasi dikatakan sempurna jika nilai R2 mendekati +1. sedangkan nilai nol menyatakan tidak ada korelasi antara dua variabel yang diamati. Berdasarkan Gambar 1, 2 dan 3 didapatkan nilai R2 untuk Logam Cu, Fe dan Mn adalah 0.999. Harga R2 yang diperoleh mendekati +1, maka dapat disimpulkan bahwa nilai koefisien korelasi layak artinya titik-titik pada kurva kalibrasi mendekati garis lerengnya.
Pembuatan Kurva kalibrasi Logam Seng
Kurva kalibrasi logam seng dibuat dengan mengukur absorbansi larutan standar logam seng dengan konsentrasi 0, 1, 2, 3, 4, ppm yang diukur dengan SSA pada λ 213,9 nm. Dari data yang diperoleh kemudian dibuat kurva kalibrasi dengan mengalurkan konsentrasi larutan standar tembaga (x) terhadap absorbansinya (y), dan dapat ditentukan persamaan garis regresi liniernya. Kurva kalibrasi logam mangsengan ditunjukkan pada Gambar 4.
Gambar 4. Kurva kalibrasi larutan standar seng
y = 0,0089x - 0,0007 R² = 0,9996 0 0,05 0,1 0,15 0,2 0 5 10 15 20 25 A b so rb a n si Konsentrasi Mangan (ppm) y = 0,0184x + 0,0018 R² = 0,996 0 0,01 0,02 0,03 0,04 0,05 0,06 0,07 0,08 0 1 2 3 4 5 A b so rb a n si Konsentrasi Seng (ppm)
Keabsahan kurva kalibrasi diatas dapat diuji dengan menentukan harga koefisien korelasi (R2) atau uji kelinieran yang menyatakan ukuran kesempurnaan hubungan antara konsentrasi larutan standar dengan absorbansinya. Korelasi dikatakan sempurna jika nilai R2 mendekati +1. Sedangkan nilai nolmenyatakan tidak ada korelasi antara dua variabel yang diamati. Berdasarkan Gambar 4. didapatkan nilai R2 = 0.996. Harga R2 yang diperoleh mendekati +1, maka dapat disimpulkan bahwa nilai koefisien korelasi layak artinya titik-titik pada kurva kalibrasi mendekati garis lerengnya.
Uji Presisi Alat AAS
Uji presisi ini mengacu kepada kesepakatan di dalam satu kelompok hasil eksperimen. Kesepakatan ini tidak berdampak apa pun terhadap hubungannya dengan nilai yang sebenarnya. Uji presisi ini meliputi SD (standar deviasi), RSD dan CV, dimana masing-masing uji tersebut dihitung dengan menggunakan rumus sebagai berikut :
1
)
(
(
2−
−
∑
=
n
X
X
SD
%
100
x
X
SD
RSD
=
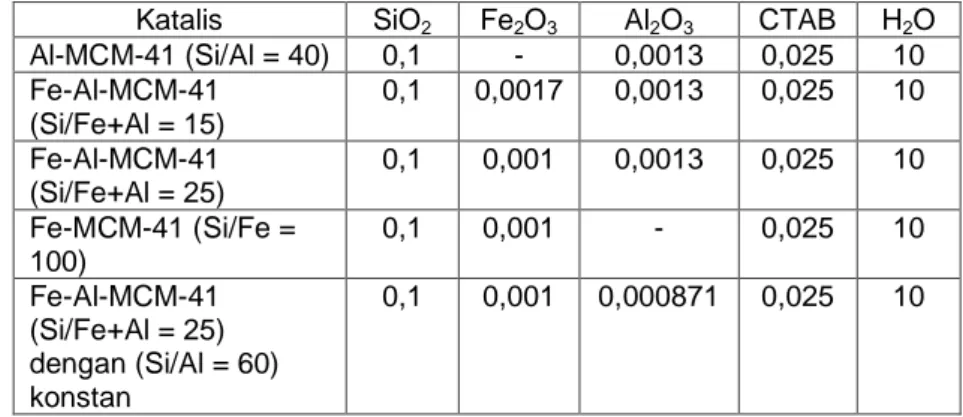
CV = RSD x 100%Uji presisi ini diambil dari salah satu data uji linieritas yang tepat berada pada garis linier, sehingga untuk tiap-tiap logam berbeda-beda konsentrasi yang digunakan. Untuk logam Zn, titik yang tepat berada pada garis linier adalah pada konsentrasi 1 ppm. Sedangkan untuk logam Mn, Fe dan Cu, titik yang berada pada garis linier adalah pada konsentrasi 5 ppm. Data untuk masing – masing logam ada pada Tabel 1 - 4
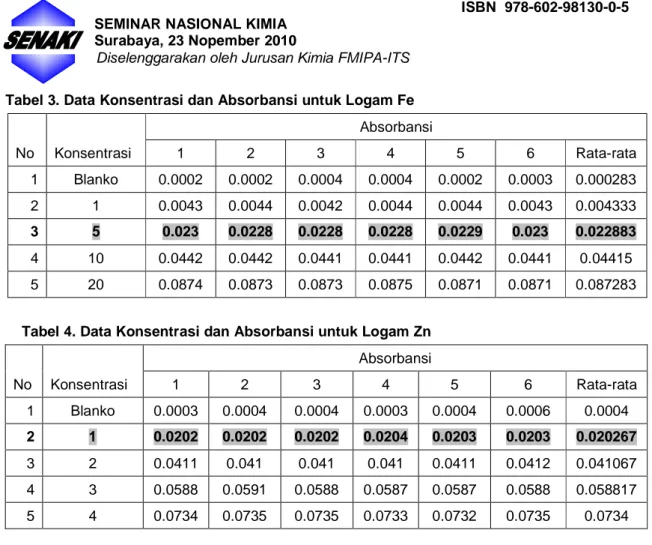
Tabel 1. Data Konsentrasi dan Absorbansi untuk Logam Mn
No Konsentrasi Absorbansi 1 2 3 4 5 6 Rata-rata 1 Blanko 0.0001 0.0001 0.0001 0.0001 0.0002 0.0001 0.000117 2 1 0.0088 0.0088 0.0088 0.0088 0.0087 0.0088 0.008783 3 5 0.0442 0.044 0.044 0.0441 0.044 0.0437 0.044 4 10 0.0849 0.0851 0.0852 0.085 0.0849 0.0846 0.08495 5 20 0.1767 0.1757 0.1763 0.1766 0.1761 0.177 0.1764
Tabel 2. Data Konsentrasi dan Absorbansi untuk Logam Cu
No Konsentrasi Absorbansi 1 2 3 4 5 6 Rata-rata 1 Blanko 0.0001 0.0001 0.0002 0.0001 0.0002 0.0002 0.00015 2 1 0.0307 0.0306 0.0307 0.0307 0.0306 0.0306 0.03065 3 5 0.16 0.1596 0.1596 0.1594 0.1585 0.1593 0.1594 4 10 0.3171 0.3178 0.3154 0.3152 0.3156 0.3157 0.316133 5 20 0.6161 0.6165 0.6138 0.6147 0.6163 0.6148 0.615367
Tabel 3. Data Konsentrasi dan Absorbansi untuk Logam Fe No Konsentrasi Absorbansi 1 2 3 4 5 6 Rata-rata 1 Blanko 0.0002 0.0002 0.0004 0.0004 0.0002 0.0003 0.000283 2 1 0.0043 0.0044 0.0042 0.0044 0.0044 0.0043 0.004333 3 5 0.023 0.0228 0.0228 0.0228 0.0229 0.023 0.022883 4 10 0.0442 0.0442 0.0441 0.0441 0.0442 0.0441 0.04415 5 20 0.0874 0.0873 0.0873 0.0875 0.0871 0.0871 0.087283
Tabel 4. Data Konsentrasi dan Absorbansi untuk Logam Zn
No Konsentrasi Absorbansi 1 2 3 4 5 6 Rata-rata 1 Blanko 0.0003 0.0004 0.0004 0.0003 0.0004 0.0006 0.0004 2 1 0.0202 0.0202 0.0202 0.0204 0.0203 0.0203 0.020267 3 2 0.0411 0.041 0.041 0.041 0.0411 0.0412 0.041067 4 3 0.0588 0.0591 0.0588 0.0587 0.0587 0.0588 0.058817 5 4 0.0734 0.0735 0.0735 0.0733 0.0732 0.0735 0.0734
Data pada Tabel 1 – 4 adalah berbagai konsentrasi standar logam Mn, Cu, Fe dan Zn yang diukur sebanyak enam kali. Konsentrasi yang digunakan untuk menghitung uji presisi alat adalah pada data dicetak tebal. Dari hasil perhitungan didapatkan nilai SD untuk logam Mn, Cu, Fe dan Zn berturut – turut adalah 0,0112; 9,1 x10-3; 0.0224; dan 3.01 x 10-3. Nilai RSD untuk logam Mn, Cu, Fe dan Zn berturut – turut adalah 2,03 x10-3 ; 1,73 x 10-3; 0.00392 2.82 x 10-3. Sedangkan Nilai CV untuk logam Mn, Cu, Fe dan Zn berturut – turut adalah 0,203 % ; 0,173 % 0,392 % dan 0,282 %.
Nilai CV (%) untuk presisi single operator dan rekomendasi range untuk metode AAS langsung dan ekstraksi logam, std method 21st ed AWWA, APHA 3111B) adalah 2,9. CV (%) baik bila memenuhi syarat yaitu CV (%) percobaan ≤ CV (%) metode standart. Semua data diatas (logam Mn, Fe, Cu dan Zn) menunjukkan nilai CV (%) ≤ 2,9.s
Uji Sensitivitas Alat AAS
Kepekaan (S) adalah konsentrasi analit yang memberikan nilai absorbansi = 0,0044 ekivalent dengan 1 % T (transmitansi). Kepekaan dapat dihitung dengan persamaan sebagai berikut :
S = 0,0044 (C1/A1) Dimana:
C1 : Konsentrasi analit dalam larutan kalibrasi A1 : Absorbansi rata-rata larutan kalibrasi C1
Data untuk perhitungan uji sensitivitas untuk tiap logam terdapat pada Tabel 4.5 – 4.8. Dari hasil perhitungan nilai sensitivitas untuk logam Mn, Cu, Fe dan Zn berturut – turut adalah 0,4993 ; 0,1379 ; 0,9624 dan 0,217.
Limit Deteksi.
Larutan blanko yang digunakan adalah larutan blanko yang yang telah dispike menjadi larutan yang mengandung konsentrasi logam sebesar 0,001mg/L. Data untuk tiap logam terdapat pada Tabel 4.5 -4.8 yang ada tulisan blanko.
Limit deteksi ada 2, yaitu LOD (batas deteksi) dan LOQ (batas kuantitasi). LOD dan LOQ dapat dihitung dengan menggunakan rumus sebagai berikut :
LOD =
SI
x
Sy /
3
dan LOQ =SI
x
Sy /
10
Dimana :Sy/x = simpangan baku respon analitik dari blanko
SI = arah garis linear (kepekaan arah) dari kurva antara respon terhadap konsentrasi = slope (b pada persamaan garis y = a + bx)
Dari hasil perhitungan didapatkan nilai LOD dan LOQ untuk logam Mn, Fe, Cu dan Zn berturut – turut adalah 0,0168 dan 0,0559 mg/L ; 0,067 dan 0,2235 mg/L; 5,48 x 10-3 dan 0,0183 mg/L; 4,08 x 10-3 dan 0,0136 mg/L.
Hasil uji presisi, sensitivitas, batas deteksi dan batas kuantitasi, secara ringkas disajikan dalam Tabel 4.9.
Tabel 4.9. Rangkuman Data Uji Validasi Metode AAS Untuk Semua Logam Uji
Mn Fe Cu Zn RSD 2.03 x 10-3 0.00392 1.73 x 10-3 2.82 x 10-3 CV 0.203 0.3919 0.173 0.282 S 0.4993 0.9624 0.1379 0.217 LOD 0.0168 0.067 5.48 x 10-3 4.08 x 10-3 LOQ 0.0559 0.2235 0.0183 0.0136
Hasil pengukuran kadar logam Fe, Mn, Cu dan Zn dalam limbah Elektroplating
Nilai absorbansi yang didapat dari pengukuran dengan AAS untuk keempat logam (Fe, Mn, Cu dan Zn) yang di ukur dimasukkan kedalam persamaan regresi linier sehingga didapatkan konsentrasi logam tersebut dalam limbah elektroplating. Nilai konsentrasi logam Fe, Mn, Cu dan Zn dalam sampel limbah elektroplating berturut – turut adalah 4,22 ; 0,7275 ; 0,8563 dan 1,033 ppm. 4.Kesimpulan
Hasil Validasi metode AAS untuk penentuan logam Cu, Zn, Fe, dan Mn diperoleh uji linearitas memberikan nilai R2 masing-masing adalah 0,999; 0,996; 0,999 dan 0,999. Nilai presisi untuk logam tersebut berturut-turut adalah , 0,1594; 0,020267; 0,0228 dan 0,044 dan sensitivitasnya berturut-turut 0,1379; 0,217; 0,9624 dan 0,4993. Sedangkan nilai LOD nya adalah 5,48x10-3 ; 4,08x10-3; 0,067 dan 0,0168 dan nilai LOQ nya adalah 0,0183; 0,0136; 0,2235 dan 0,0559. Konsentrasi logam Fe, Mn, Cu dan Zn dalam sampel limbah elektroplating berturut – turut adalah 4,22 ; 0,7275 ; 0,8563 dan 1,033 ppm.
Ucapan Terimakasih
Dengan tersusunnya makalah ini, penulis mengucapkan banyak terimakasih kepada pemberi dana dari Program Penelitian Produktif Tahun Anggaran 2010, Jurusan Kimia FMIPA dan Laboratorium Research Center ITS.
Daftar Pustaka
ASTM E 66386 (Reapproved 1991), Standard Practice For Flame AtomicAbsorption Analysis, 1991.
ASTM E 181296,Optimation of Flame Atomic Absorption Spectrometric Equipment, 1996. ASTM E1024 and E1330, 1992
Harmita, (2004), “Petunjuk Pelaksanaan Validasi Metode dan Cara Perhitungannya”, Majalah Ilmu Kefarmasian, Vol. 1, No. 3, hal. 117-135.
Khopkar, S. M., (1984), “Konsep Dasar Kimia Analitik”, Analytical Chemistry Laboratories, Department of Chemistry, Indian Institute of Technology, Bombay.
Samin, (2006), “Jaminan Mutu Metode FAAS dan UVVIS untuk Penentuan Unsur – Unsur dalam Air Tangki Reaktor” Sminar Keselamatan Nuklir 2 – 3 Agustus 2006, Pusat Teknologi Akselerator dan Proses Bahan, BATAN Yogyakarta.
Ebdon L., (1982), “An Introduction to Atomic Absorption Spectroscopy”, Heyden and Son, London
Underwood A. L., (1994), “Analisis kimia Kuantitatif “, Erlangga, Jakarta
Vogel, (1990), “Analisis Anorganik Kualitatif Mikro dan Semimikro”, Bagian 1, Edisi kelima, PT Kalman media pustaka, Jakarta
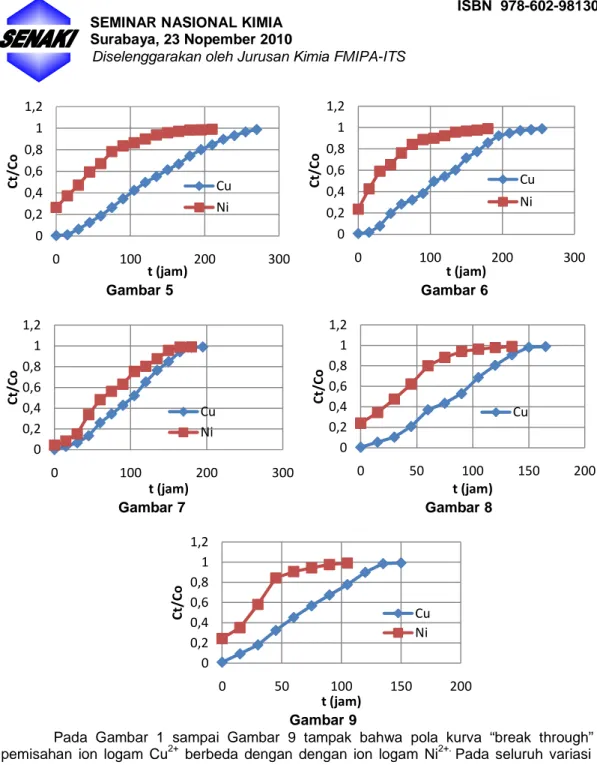
STUDI KOMPARATIF KURVA BREAK THROUGH
PEMISAHAN ION Cu
2+DAN Ni
2+DARI LARUTAN DENGAN
PELET KOMPOSIT CANGKANG KUPANG – KHITOSAN
TERIKATSILANG DALAM UP FLOW FIXED BED
COLUMN
**Eko Santoso
*, Hendro Juwono, Diah Dwi Jayanti, dan Rulina Rachmawati
Laboratorium Kimia Fisika dan Polimer, Kimia FMIPA Institut Teknologi Sepuluh Nopember Surabaya Abstrak
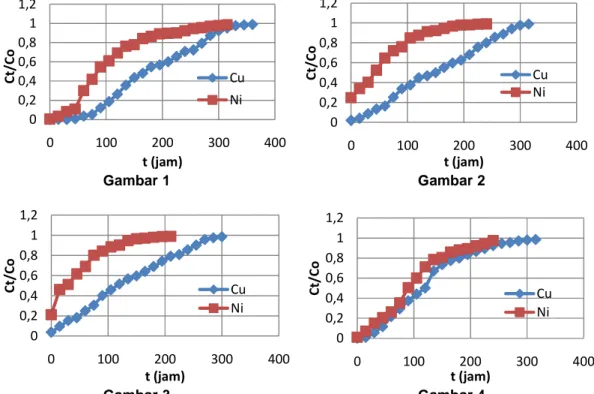
Ion Cu2+ dan Ni2+ secara independen telah dipisahkan dari larutan pada pH optimum dengan pelet komposit cangkang kupang – khitosan terikatsilang dalam up flow fixed bed column. Pelet komposit dibuat dengan variasi komposisi, masing-masing mengandung 93,75%, 95,24%, dan 96,15%(w/w) cangkang kupang. Proses ikatsilang khitosan dilakukan menggunakan gluteraldehid sebagai agen pengikatsilang. Proses pemisahan ion logam dilakukan dengan mengalirkan larutan yang mengadung ion logam ke dalam kolom yang berisi pelet kompsit dengan ukuran bed tertentu (fixed bed column) dengan variasi laju 1,5 mL/menit, 2,0 mL/menit, dan 2,5 mL/menit. Hasil menunjukkan bahwa pada seluruh variasi laju alir, ion Ni2* lebih cepat mengalami break through dibandingkan ion Cu2+. Waktu break through kedua logam semakin menurun dengan meningkatnya laju alir larutan dan dengan meningkatnya kadar cangkang kupang dalam pelet komposit. Fakta ini menunjukkan bahwa agen aktif pemisahan ion logam dalam komposit didominasi oleh khitosan. Secara kinetik, ion Cu2+ bersifat lebih reaktif terikat pada pelet komposit dibandingkan dengan ion Ni2+ dan reaktifitas kedua logam terikat pada pelet komposit menurun dengan menigkatnya laju alir larutan ke dalam kolom.
Kata kunci : komposit, cangkang kupang, khitosan, ion Cu2+, ion Ni2+, dan break through.
1. Pendahuluan
Air limbah dari perindustrian dan pertambangan merupakan sumber utama polutan logam berat. Logam berat dapat membahayakaan bagi kesehatan manusia jika konsentrasinya melebihi batas ambang yang diijinkan. Meskipun konsentrasinya belum melebihi batas ambang, keberadaan logam berat tetap memiliki potensi yang berbahaya untuk jangka waktu yang panjang karena logam berat telah diketahui bersifat akumulatif dalam sistem biologis. Oleh karena itu, saat ini lembaga-lembaga pemerintahan juga memberikan perhatian yang serius dan membuat aturan yang ketat terhadap pengolahan air limbah industri sebelum dibuang ke perairan terbuka [Quek et al., 1998].
Berbagai macam teknologi pemisahan logam-logam berat dan beracun dari air limbah telah dikembangkan, seperti metoda pengendapan kimia, oksidasi-reduksi, filtrasi mekanik, penukar ion, pemisahan membrane, dan adsorpsi dengan karbon. Namun, berbagai teknologi tersebut mempunyai beberapa kendala, yakni disamping biayanya mahal seringkali juga membutuhkan perlakuan-perlakuan khusus. Oleh karena itu, berbagai penelitian telah dilakukan untuk mencari metoda atau teknologi alternatif untuk memisahkan logam-logam berat dan beracun dari air limbah yang lebih baik dengan biaya yang lebih ekonomis.
Salah satu usaha untuk mengatasi persoalan polutan logam berat dalam air limbah yang sekarang banyak diteliti adalah mencari biosorben alami yang melimpah dan murah [Babel and Kurniawan, 2003]. Teknik adsorpsi mempunyai keunggulan dibandingkan teknik pengendapan karena teknik adsorpsi mampu memisahkan logam berat dalam air limbah meskipun konsentrasi logam berat dalam air limbah sangat rendah hingga kurang dari 1,00 ppm. Sedangkan teknik

![Gambar 6. Ketergantungan χ M terhadap temperatur kompleks [Fe II (2-fenil-etil-amin) 3 ]Cl 5](https://thumb-ap.123doks.com/thumbv2/123dok/4905496.3478131/47.892.212.716.479.826/gambar-ketergantungan-temperatur-kompleks-fe-fenil-etil-amin.webp)