Disusun oleh SUGIARTO M0399039
SKRIPSI
Ditulis dan diajukan untuk memenuhi
sebagian persyaratan mendapatkan gelar Sarjana Sains Kimia
JURUSAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SEBELAS MARET
SURAKARTA 2006
Pembimbing I Pembimbing II
Drs. Sentot Budi Rahardjo, Ph.D. NIP. 131 570 162
Sayekti Wahyuningsih, M.Si NIP. 131 479 681
Dipertahankan di depan Tim Penguji Skripsi pada : Hari : Jumat
Tanggal : 3 November 2006
Anggota Tim Penguji :
1. Dian Maruto Widjonarko, M.Si. 1... NIP. 132 258 053
2. Soerya Dewi Marliana, M.Si. 2... NIP. 132 162 561
Disahkan oleh
Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sebelas Maret Surakarta
Dekan Ketua Jurusan Kimia
Drs. Marsusi, M.S. Drs. Sentot Budi Rahardjo, Ph.D. NIP. 130 906 776 NIP. 131570162
DI(8-HIDROKSIKUINOLIN)TEMBAGA(II)TRIHIDRAT DAN TRI (8 - HIDROKSIKUINOLIN) BESI(III) DIHIDRAT” adalah benar-benar
hasil penelitian sendiri dan tidak terdapat karya yang pernah diajukan penelitian ilmiah dan gelar kesarjanaan disuatu perguruan tinggi, dan sepanjang pengetahuan saya juga tidak terdapat kerja atau pendapat orang lain, kecuali yang secara tertulis diacu dalam naskah ini dan disebutkan dalam naskah daftar pustaka.
Surakarta, November 2006
Matematika dan Ilmu Pengetahuan Alam. Universitas Sebelas Maret.
Kompleks tembaga(II)-(8-hidroksikuinolin) dan kompleks besi(III)- 8-hidroksikuinolin disintesis dengan mencampurkan CuSO4.5H2O dan
FeCl3.6H2O dengan 8-hidroksikuinolin pada perbandingan mol logam dan mol
ligan 1 : 2 dan 1 : 3 dalam metanol.
Terbentuknya kompleks ditandai dengan adanya perubahan serapan maksimum pada spektra elektronik kompleks. Formula kompleks diperkirakan dari analisis kadar logam dalam kompleks dengan Spektrofotometer Serapan Atom (SSA), analisis H2O dalam kompleks dengan Differential Thermal Analyzer
(DTA) dan analisis perbandingan muatan kation dan anion kompleks dengan pengukuran daya hantar listrik (DHL) larutan kompleks dengan konduktivitimeter. Sifat kemagnetan ditentukan dengan Magnetic Susceptibility
Balance (MSB) dan gugus fungsi dari ligan yang terkoordinasi pada ion pusat
diperkirakan dari pergeseran serapan maksimum pada spektra Infra Merah
Kompleks Cu(II) dan Fe(III) dengan 8-hidroksikuinolin telah berhasil disintesis, terbentuknya kompleks ditandai adanya perubahan serapan maksimum pada spektra elektronik kedua kompleks dalam metanol yang memperlihatkan beberapa serapan maksimum pada daerah UV dan tampak. Formula kompleks diperkirakan [Cu(8-hidroksikuinolin)2].3H2O dan Fe(8-hidroksikuinolin)3
]
.2H2O.Serapan maksimum kompleks [Cu(8-hidroksikuinolin)2].3(H2O) terjadi pada
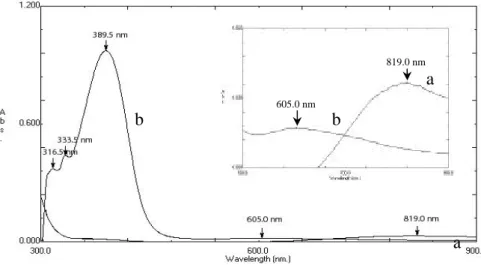
316,50 nm (ε= 2044,50 L.mol-1.cm-1), 333,50 nm (ε = 2419,23 L.mol-1.cm-1), 388,50 nm (ε= 5346,15 L.mol-1.cm-1) dan 605,00 nm (ε = 93,4066 l.mol-1.cm-1) sedangkan Serapan maksimum pada kompleks Fe(8-hidroksikuinolin)3].2(H2O)
terjadi pada 310,00 nm (ε = 3828,85 l.mol-1.cm-1), 359,50 nm (ε = 3395,38 l.mol-1.cm-1), 458,00 nm (ε = 2583,46 L.mol-1.cm-1) dan 576,50 nm (ε = 2002,69 L.mol-1.cm-1). Kedua kompleks bersifat paramagnetik dengan µeff = 1,83-1,87 BM untuk kompleks [Cu(8-hidroksikuinolin)2].3(H2O) dan µeff =
2,64 – 2,66 BM untuk kompleks [Fe(8-hidroksikuinolin)3].2(H2O). Spektrum IR
menunjukkan pergeseran serapan gugus C=N dan gugus C-O yang mengindikasikan kedua gugus fungsi tersebut terkoordinasi pada ion pusat. Kata kunci: Sintesis, Karakterisasi, Di(8-hidroksikuinolin)Tembaga(II)Trihidrat, Tri(8-hidroksikuinolin)Besi(III) Dihidrat
Department of Chemistry. Mathematic and Science Faculty. Sebelas Maret University.
Complexes of copper(II)-(8-hydroxyquinoline) and iron(III)- (8-hydroxyquinoline) are synthesized by mixing CuSO4.5H2O and FeCl3.6H2O
with 8-hidroksikuinolin in 1 : 2 and 1 : 3 mole ratio of metal to ligan in methanol. The forming of complex was indicated by maximum absorption shift of electronic spectra of complex. The formula of complexes are predicted from analysis of % metal in complexes by Atomic Absorption Spectroscopy (AAS), analysis of H2O in complexes by Differential Thermal Analyzer (DTA) and
analysis the ratio of cation and anion charge of complex by the electric conductivity measurement by conductivitymeter. The nature of magnetism complexes are determined by Magnetic Susceptibility Balance (MSB) and the functional group of ligand is coordinated to the center ion predicted from absorbtion maxima shift of infra red spectra.
Complexes of copper(II)-(8-hydroxyquinoline) and iron(III)- (8-hydroxyquinoline) have been synthesized succeessfully, the forming of
complex was indicated by maximum absorption shift of electronic spectra of both the complexes in methanol displays several absorption maximum in the UV and visible regions. The formula of the complexes are predicted [Cu(8-hydroxyquinoline)2].3H2O and [Fe(8-hydroxyquinoline)3].2H2O. The maximum
absorption of [Cu(8-hydroxyquinoline)2].3H2O complex occur at 316,50 nm
(ε= 2044,50 L.mol-1.cm-1), 333,50 nm (ε = 2419,23 L.mol-1.cm-1), 388,50 nm (ε= 5346,15 L.mol-1.cm-1) and 605,00 nm (ε = 93,4066 l.mol-1.cm-1) while the maximum absorption of Fe(8-hydroxyquinoline)3].2H2O complex occur at
310,00 nm (ε=3828,85 l.mol-1.cm-1) 359,50 nm (ε = 3395,38 l.mol-1.cm-1), 458,00 nm (ε = 2583,46 L.mol-1.cm-1) and 576,50 nm (ε = 2002,69 L.mol-1.cm-1).
Both the complexes were paramagnetic with µeff = 1,83-1,87 BM for
[Cu(8-hydroxyquinoline)2].3H2O and µeff = 2,64 – 2,66 BM for
[Fe(8-hydroxyquinoline)3].2H2O. Data of infra red spectra show a shift of C=N
group and C-O group indicate this functional group coordinated to the center ion. Keyword:Synthesis, Characterization, Di(8-droxyquinoline)Copper(II)Trihydrate, Tri(8-Hydroxyquinoline)Iron(III) Dihydra
Hanya kepada Engkaulah kami menyembah Dan hanya kepada engkaulah kami mohon pertolongan
(Q.S Al Fatihah : 5)
Jadikanlah sabar dan shalat sebagai penolongmu. Dan sesungguhnya yang demikian itu berat,
Kecuali bagi orang-orang yang khusuk. (Q.S Al Baqarah : 45)
… sesungguhnya sesudah kesulitan ada kemudahan … (Q.S Al Insyirah : 5)
Karya kecil ini kupersembahkan pada: Ibu dan ayah (Alm) tercinta, Keluarga dan semua teman-temanku
berjudul “SINTESIS DAN KARAKTERISASI KOMPLEKS DI(8-HIDROKSIKUINOLIN)TEMBAGA(II)TRIHIDRAT DAN
TRI(8-HIDROKSIKUINOLIN)BESI(III) DIHIDRAT
.
Sholawat dan salam senantiasa penulis haturkan kepada Rasulullah SAW sebagai pembimbing seluruh umat manusia. Pada kesempatan ini saya ingin menyampaikan banyak terima kasih secara khusus kepada :1. Bapak Drs. Marsusi, MS., selaku Dekan Fakultas MIPA UNS.
2. Bapak Drs. Sentot Budi Rahardjo, Ph.D., selaku Ketua Jurusan Kimia Fakultas MIPA UNS, selaku Pembimbing I dan Pembimbing Akademis yang telah banyak memberikan pengarahan selama masa kuliah.
3. Ibu Sayekti Wahyuningsih, M.Si. selaku Pembimbing II.
4. Ibu Desi Suci Handayani, M.Si. selaku Ketua Laboratorium Kimia Dasar FMIPA UNS
5. Bapak dan Ibu Dosen yang telah membimbing dan mengajarkan ilmunya. 6. Teknisi yang ada di Sub Lab. Kimia dan Laboratorium Kimia Jurusan Kimia
Fakultas MIPA UNS yang telah membantu saya.
7. Ayah(Alm) ibuku tercinta dan kakak adikku tersayang yang selalu memberikan doa restu, dukungan dan segalanya telah diberikan.
8. Seluruh teman-temanku yang tak bisa penulis sebutkan satu persatu terima kasih semuanya atas segala bantuannya.
Penulis menyadari bahwa masih banyak kekurangan dalam penulisan skripsi ini. Oleh karena itu, penulis mengharapkan kritik dan saran untuk menyempurnakannya. Namun demikian, penulis berharap semoga karya kecil ini bermanfaat bagi pembaca
Surakarta, November 2006
HALAMAN PENGESAHAN…………... ii
HALAMAN PERNYATAAN KEASLIAN ... iii
ABSTRAK ... iv
ABSTRACT... v
MOTTO ... vi
HALAMAN PERSEMBAHAN ... vii
KATA PENGANTAR ... viii
DAFTAR ISI………... ix
DAFTAR TABEL…………... xiii
DAFTAR GAMBAR………… ... xiv
DAFTAR LAMPIRAN………... xvi
TABEL LAMPIRAN……… ... xvii
GAMBAR LAMPIRAN……… ... xviii
BAB I PENDAHULUAN……… ... 1
A. Latar Belakang Masalah ... 1
B. Perumusan Masalah………... 2 1. Identifikasi Masalah………... 2 2. Batasan Masalah……… ... 3 3. Rumusan Masalah………... 3 C. Tujuan Penelitian………... 3 D. Manfaat Penelitian………... 3
BAB II LANDASAN TEORI…… ... 4
A. Tinjauan Pustaka……… ... 4
1. Senyawa kompleks……… ... 4
a. Kompleks Besi(III) ... 4
b. Kompleks Tembaga(II)... 5
2. Ligan 8-hidroksikuinolin……… ... 7
2) Kompleks Tetrahedral ... 13
3) Kompleks Squareplanar ... 14
c. Teori Orbital Molekul……… ... 16
4. Sifat Senyawa Kompleks ... 19
a. Spektrum Elektronik ... 19
1) Transisi yang Meliputi Elektron σ, π, dan n... 20
2) Transisi yang Melibatkan Elektron d... 20
a. Spektrum Elektronik Kompleks Fe(III) ... 21
b.Spektrum Elektronik Kompleks Cu(III)... 21
3) Transisi transfer muatan ... 22
b. Daya Hantar Listrik... 22
c. Spektroskopi Infra Merah ... 24
d. Sifat Magnetik... 26
e. Differential Thermal Analysis (DTA) ... 27
B. Kerangka Pemikiran…. ... 28
C. Hipotesis………... 29
BAB III METODOLOGI PENELITIAN………... 30
A. Metode Penelitian………... 30
B. Tempat dan Waktu Penelitian……… ... 30
C. Alat dan Bahan yang Digunakan……….... 30
1. Alat……… ... 30
2. Bahan……… ... 31
D. Prosedur Percobaan ... 32
1. Skema Percobaan... 32
2. Sintesis Senyawa Kompleks ... 34
a. Sintesis Besi(III) dengan 8-hidroksikuinolin ... 34
4. Pengukuran Momen Magnet... 35
5. Pengukuran Spektra Elektronik ... 35
6. Pengukuran Spektra Infra Merah... 35
7. Pengukuran dengan Differensial Thermal Analyzer (DTA) ... 35
8. Pengukuran Daya Hantar Listrik ... 35
E. Teknik Pengumpulan dan Analisis Data ... 35
BAB IV HASIL DAN PEMBAHASAN……… 37
A. Sintesis Kompleks……… ... 37
1. Sintesis Kompleks Cu(II) dengan 8-hidroksikuinolin ... 37
2. Sintesis Kompleks Fe(III) dengan 8-hidroksikuinolin... 38
B. Perkiraan Formula Kompleks………... 39
1. Penentuan Kadar Logam dalam Kompleks ... 39
2 Identifikasi H2O dalam Kompleks ... 40
a
.
Kompleks Cu(II)-(8-hidroksikuinolin) ... 40b. Kompleks Fe(III)-(8-hidroksikuinolin)... 41
3. . Pengukuran Daya Hantar Listrik ... 42
C. Karakterisasi Kompleks... 43 1. Sifat Kemagnetan... 43 2. Spektra Elektronik ... 44 3. Spektra IR ... 46 a.Kompleks [Cu(8-hidroksikuinolin)2].3H2O... 46 b. Kompleks [Fe(III)(8-hidroksikuinolin)3].2H2O ... 48
D. Perkiraan Struktur Kompleks ... 50 1. Perkiraan Struktur Kompleks [Cu(8-hidroksikuinolin)2].3H2O 50
Tabel 2. Tabel 3. Tabel 4. Tabel 5. Tabel 6. Tabel 7. Tabel 8. Tabel 9.
Kadar Logam dalam Kompleks... Kadar besi dalam kompleks besi(III) dengan 8-hidroksikuinolin pada beberapa komposisi secara Teoritis...
Kadar Tembaga dalam Kompleks Tembaga(II) dengan 8-hidroksikuinolin pada beberapa omposisi secara teoritis...
Daya Hantar Listrik Larutan Standar dan Senyawa Kompleks dalam metanol... Harga Momen Magnet Efektif (µeff) Kompleks
[Cu(8-hidroksikuinolin)2].3H2O dan [Fe(8-hidroksikuinolin)3].2H2O...
Panjang Gelombang maksimum (λmaks), Absorbansi (A) dan
Absortivitas Molar (ε) untuk 8-hidroksikuinolin, CuSO4.5H2O,
[Cu(8-hidroksikuinolin)2].3H2O, FeCl3.6H2O dan
[Fe(8-hidroksikuinolin)3]. 2H2O...
Serapan Gugus Fungsi Ligan 8-hidroksikuinolin dan Kompleks Cu(II)- (8-hidroksikuinolin (cm-1)...
Serapan Gugus Fungsi Ligan 8-hidroksikuinolin dan Kompleks Fe(III)- 8-hidroksikuinolin (cm-1)... 39 39 40 42 43 44 47 49
Gambar 3. Gambar 4. Gambar 5. Gambar 6. Gambar 7. Gambar 8. Gambar 9. Gambar 10. Gambar 11. Gambar 12. Gambar 13. Gambar 14. Gambar 15. Gambar 16. Gambar 17. Gambar 18. Gambar 19. Gambar 20. Gambar 21. Gambar 22. Gambar 23. N,N-bis(2-benzimidazolylmethyl)amine……….. Kompleks besi(III) dengan ligan 3.3’-bis(triphenylsilyl)
biphenoxide dan bipyridyl...
Kompleks Bis(L-Methioninato)Copper(II)………. Ligan 1,3,6,7-tetramethyllumazine... Cu(II) dengan ligan 1,3,6,7-tetramethyllumazine... Kompleks Sn(II) dengan 8-hidroksikuinolin... Hibridisasi kompleks [Fe(CN)6]3+...
Hibridisasi pada kompleks [Cu(NH3)4]2+...
Kontur Orbital d... Pemisahan Orbital d Ion Logam Medan Oktahedral... Struktur kompleks oktahedral
[Cu(1,3,6,7-tetramethyllumazine)2 (H2O)2]2-...
Pemisahan Orbital d Ion Logam medan tetrahedral……… Struktur kompleks tetrahedral [Cu(qbsa)2]...
Distorsi kompleks oktahedral... Pembelahan orbital d kompleks planar segiempat... Struktur senyawa kompleks Cu(troponolato)2...
Tingkat Energi Orbital Molekul pada Kompleks Oktahedral.... Tingkat Energi Orbital Molekul pada Kompleks Tetrahedral.... Tingkat energi Orbital Molekul pada kompleks Square Planar.. Tingkat energi orgel untuk konfigurasi elektron d5 dalam medan ligan oktahedral... Tingkat energi orgel untuk elektron konfigurasi d9 pada medan ligan oktahedral... Kemungkinan ikatan koordinasi antara 8-hidroksikuinolin dengan logam Cu2+ dan Fe3+...
5 5 6 6 7 8 9 10 10 11 12 13 14 15 15 16 17 18 18 21 22 28
Gambar 26. Gambar 27. Gambar 28. Gambar 29. Gambar 30. Gambar 31. Gambar 32. Gambar 33. Gambar 34. Gambar 35. Gambar 36. Gambar 37. Gambar 38
Spektra Elektronik (a) CuSO4.5H2O (b)
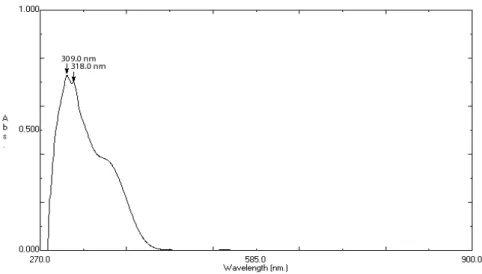
Cu(II)-(8-hidroksikuinolin) dalam metanol ... Spektra Elektronik 8-hidroksikuinolin dalam metanol...
Spektra Elektronik (a) FeCl3.6H2O dan (b) Fe(III)
(8-hidroksikuinolin) dalam metanol... Termogram DTA kompleks CuSO4. 5H2O………
Termogram DTA kompleks Cu(II)-(8-hidroksikuinolin)... Termogram DTA FeCl3.6H2O...
Termogram DTA kompleks Fe(III)-(8-hidroksikuinolin)... Spektra Serapan Gugus Fungsi C=N (a) 8-hidroksikuinolin Dan (b) Kompleks [Cu(8-hidroksikuinolin)2].nH2O ...
Spektra Serapan Gugus Fungsi C-O (a) 8-hidroksikuinolin dan (b) Kompleks [Cu(8-hidroksikuinolin)2)]nH2O...
Spektra Serapan Gugus Fungsi C=N (a) 8-hidroksikuinolin Dan (b) Kompleks [Fe(III)(8-hidroksikuinolin)3].nH2O ...
Spektra Serapan Gugus Fungsi C-O (a) 8-hidroksikuinolin dan (b) Kompleks [Fe(III)(8-hidroksikuinolin)3)]nH2O...
Perkiraan Struktur [Cu(8-hidroksikuinolin)2].3H2O...
Perkiraan Struktur [Fe(8-hidroksikuinolin)3].2H2O...
37 38 38 40 41 41 42 46 47 48 49 50 51
Lampiran 2. Lampiran 3. Lampiran 4. Lampiran 5 Lampiran 6. Lampiran 7. Lampiran 8.
Pengukuran Kadar Tembaga dan Besi dalam Kompleks dengan Spektrofotometer Serapan Atom (AAS)…...…... Pengukuran Sampel Kompleks dengan Differential Thermal Analyzer (DTA)……… Penentuan Momen Magnet Efektif……… Pengukuran Daya Hantar Listrik dengan konduktivitimeter Perhitungan Nilai Absorbtivitas Molar……… Perhitungan Energi Transisi 10 Dq... Spektra Infra Merah………..
59 62 63 67 68 72 73
Tabel 2. Tabel 3. Tabel 4. Tabel 5. Tabel 6. Tabel 7.
Data dan hasil pengukuran kadar Fe dengan AAS dalam
kompleks Fe2+-(8-hidroksikuinolin).. ... Kondisi pengukuran sampel kompleks dengan DTA ... Hasil pengukuran kerentanan magnetik... Harga μeff pada beberapa Harga Xg dari sampel kompleks
[Cu(8-hidroksikuinolin)2].3H2O...
Harga μeff pada beberapa harga Xg dari sampel kompleks
[Fe(8-hidroksikuinolin)3].2H2O ...
Daya hantar listrik larutan standar dan sampel kompleks dalam metanol...……… 61 62 63 65 66 67
Gambar 3. Gambar 4. Gambar 5.
Spektra infra merah ligan 8-hidroksikuinolin ………….. ... Spektra infra merah kompleks [Cu(8-hidroksikuinolin)2].3H2O....
Spektra infra merah kompleks [Fe(8-hidroksikuinolin)3].2H2O...
73 74 75
Dalam sistem biologi makhluk hidup sejumlah kompleks kelat banyak terjadi secara alamiah. Asam amino, protein, dan asam trikarboksilat merupakan ligan utama dalam kompleks kelat tersebut, sedangkan logamnya antara lain besi, magnesium, mangan, tembaga, kobalt, dan seng. Kompleks kelat yang mengandung besi antara lain hemoglobin dan mioglobin yang terdapat dalam sel darah merah verterbrata dan berperan dalam transport oksigen. Kompleks kelat yang mengandung tembaga terdapat pada enzim oksidase seperti asam askorbat dan tirosinase. Kompleks kelat yang mengandung seng terdapat pada insulin yang berperan dalam mengaktifkan beberapa karboksilase, enzim proteolitik dan fosfatase (Wilson dan Gisvold, 1990: 45-46).
Fakta bahwa sejumlah senyawa penting secara biologik adalah kompleks kelat, membuka pendekatan pada kemoterapi dengan pembentukkan kompleks kelat tak alamiah. Salah satu contoh adalah (±) penisilamin yang efektif untuk pengobatan keracunan tembaga (penyakit Wilson). Senyawa (±) Penisilamin dapat meningkatkan ekskresi tembaga dalam urin yang terakumulasi di dalam hati dengan membentuk kompleks kelat dengan logam tersebut.
Ligan 8-hidroksikuinolin yang strukturnya ditunjukkan oleh Gambar 1 merupakan senyawa aromatis polisiklis. Senyawa ini memungkinkan membentuk kompleks kelat karena mempunyai dua atom donor elektron, yaitu O pada gugus C-O dan N tersier pada rantai siklisnya, terutama dengan logam-logam transisi deret pertama yang mempunyai orbital d yang masih kosong.
N O H
Tembaga(II) dan besi(III) merupakan contoh logam transisi blok d divalen deret pertama yang mempunyai konfigurasi elektron 3d8 dan 3d5. Sifat khas logam-logam transisi blok d adalah kemampuannya membentuk kompleks dengan ligan baik anion maupun molekul netral yang dapat bertindak sebagai donor elektron bebas (Cotton and Wilkinson, 1989: 545).
Kompleks 8-hidroksikuinolin dengan tembaga(II) dan besi(III) menarik untuk dipelajari karena eksperimen dan uji klinik menunjukkan bahwa aktivitas antibakteri 8-hidroksikuinolin muncul karena kemampuannya untuk membentuk kelat dengan logam yang esensial dalam metabolisme mikroorganisme terutama
dengan tembaga(II) dan besi(III) (Schunack et al, 1990: 774). Kompleks kelat 8-hidroksikuinolin dengan logam tersebut mampu mengkatalis oksidasi gugus tiol
asam tiositat, suatu koenzim esensial yang diperlukan oleh bakteri untuk proses oksidatif dekarboksilasi asam piruvat (Soekardjo, 1995: 103).
B. Perumusan Masalah 1. Identifikasi Masalah
Beberapa metode yang dapat digunakan untuk sintesis kompleks antara lain merefluks larutan, mencampurkan tanpa pemanasan atau dengan pemanasan. Sintesis kompleks dipengaruhi oleh beberapa hal antara lain suhu, pelarut, dan bahan tambahan lain. Pelarut yang digunakan dalam sintesis harus sesuai baik dengan logam maupun dengan ligan dan pelarut tidak menimbulkan reaksi samping.
Ligan 8-hidroksikuinolin mempunyai dua atom donor elektron, yaitu O
pada gugus hidroksil dan N pada rantai siklisnya. Adanya dua atom donor ini membuat 8-hidroksikuinolin dengan tembaga(II) dan besi(III) dapat
membentuk kompleks dengan beberapa kemungkinan atom/ gugus atom yang terkoordinasi pada atom pusat. Koordinasi dapat terjadi pada salah satu atom donor atau terjadi pada kedua atom donor tersebut membentuk kelat. Kemampuan atom donor berikatan dengan atom pusat dipengaruhi oleh beberapa faktor, antara lain keelektronegatifan dan keruahan (sterik hidran).
Untuk mengetahui apakah senyawa kompleks yang disintesis telah benar-benar terbentuk, maka dilakukan serangkaian karakterisasi sehingga diperoleh
informasi mengenai sifat fisik dan kimiawi dari bahan seperti formula, struktur, sifat kemagnetan, spektra IR, spektra UV-Vis, daya hantar listrik, ada atau tidaknya H2O dalam kompleks dan lain-lain.
2. Batasan Masalah
Terbentuknya kompleks ditandai dengan adanya perubahan serapan maksimum pada spektra elektronik kompleks. Formula kompleks diperkirakan dari hasil pengukuran kadar logam dalam kompleks dengan Spektrofotometer Serapan Atom (SSA). Sifat kemagnetan yang menunjukkan jumlah elektron yang tidak berpasangan ditentukan dengan menggunakan Magnetic Susceptibility
Balance (MSB). Gugus atom dari ligan yang terkoordinasi pada ion pusat atau
logam diperkirakan dari pergeseran puncak serapan pada spektra Infra Merah. Perbandingan muatan kation dan anion diperkirakan dari hasil pengukuran daya hantar listrik (DHL) larutan kompleks dengan konduktivitimeter. Keberadaan H2O dalam kompleks diperkirakan dari analisis Differential Thermal Analyzer
(DTA).
3. Rumusan Masalah Permasalahan yang timbul adalah:
1. Bagaimana sintesis kompleks tembaga(II) dan besi(III) dengan ligan 8-hidroksikuinolin?
2. Bagaimana karakteristik dari masing-masing kompleks yang terbentuk? C. Tujuan Penelitian
Penelitian ini bertujuan untuk:
1. Mengetahui cara sintesis kompleks tembaga(II) dan besi(III) dengan ligan 8-hidroksikuinolin.
2. Mengetahui karakteristik dari masing-masing kompleks yang terbentuk. D. Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan informasi tentang
sintesis dan karakteristik kompleks tembaga(II) dan besi(III) dengan ligan 8-hidroksikuinolin sebagai alternatif obat antibakteri untuk bidang kesehatan.
Suatu kompleks akan terbentuk antara suatu kation atau logam dengan beberapa molekul netral atau ion donor elektron. Kation atau logam tersebut berfungsi sebagai ion pusat, sedangkan molekul netral atau ion donor elektron berfungsi sebagai gugus pengeliling atau lebih sering disebut ligan. Ikatan kovalen koordinasi dalam senyawa kompleks ini terjadi karena donasi pasangan elektron dari ligan ke dalam orbital kosong dari ion pusat. Pada umumnya, ion pusat memiliki orbital-orbital d yang masih belum terisi penuh elektron sehingga dapat berfungsi sebagai akseptor pasangan elektron tersebut (Syarifudin, 1994: 151).
Kestabilan kompleks dipengaruhi oleh ion logam sebagai ion pusat dan ligan penyusunnya. Kestabilan ion kompleks tergantung muatan ion logam, jari-jari, dan muatan (medan listrik). Selain itu dipengaruhi pula faktor CFSE (Crystal
Field Stabilyzation Energy) dan faktor distribusi muatan (logam-logam transisi
deret pertama membentuk kompleks yang stabil dengan yang memilki atom donor N, O dan F). Dilihat dari ligannya kestabilan kompleks juga dipengaruhi oleh faktor besar dan muatan ion, sifat basa, faktor pembentukan kelat (ligan-ligan multidentat yang tidak terlalu besar membentuk kompleks yang lebih stabil dari pada ligan monodentat), faktor besar lingkaran dan faktor ruang atau efek sterik, makin banyak cabang makin tidak stabil (Sukardjo, 1992: 105-110).
1. Senyawa Kompleks a. Kompleks Besi(III)
Besi merupakan salah satu ion logam transisi trivalensi deret pertama yang cukup labil, sehingga dapat membentuk berbagai macam streokimia pada senyawa kompleksnya. Senyawa kompleks Fe(III) umumnya membentuk struktur oktahedral dengan bilangan koordinasi enam. Namun struktur lain seperti tetrahedral dengan bilangan koordinasi empat dan segiempat piramida dengan bilangan koordinasi lima juga dapat terjadi (Cotton dan Wilkinson, 1989: 436 ).
Contoh senyawa kompleks besi(III) dengan struktur oktahedral adalah kompleks besi(III) dengan ligan N-(2’-hidroxybenzyl)-N,N-bis(2-benzimidazolylmethyl)amine, pada kompleks ini atom pusat mengikat lima atom
N dan satu atom O dari ligan seperti ditunjukkan oleh Gambar 2. Spektrum elektroniknya menghasilkan beberapa puncak serapan pada 210, 270, 280, 329-354, dan 415-565 nm (Wang, et al, 1997: 71-77).
Fe N N N N N N N O CH2 C H2 N H2C N N N
Gambar 2. Kompleks Besi (III) dengan ligan
N-(2’-hydroxybenzyl)-N,N-bis(2-benzimidazolylmethyl)amine (Wang, et al, 1997: 71-77)
Ajay Kayal dan Sonny C. Lee (2002: 321-330) melaporkan sintesis kompleks besi(III) dengan ligan 3.3’-bis(triphenylsilyl)biphenoxide dan bipyridyl. Senyawa kompleks yang terbentuk mempunyai struktur segiempat piramida, dengan atom besi(III) mengikat dua atom O, dua atom N dari ligan dan satu Cl- seperti yang ditunjukkan oleh Gambar 3.
N N F e S i P H3 S i P H3 O O C l
Gambar 3. Kompleks besi(III) dengan ligan 3.3’-bis(triphenylsilyl)biphenoxide dan bipyridyl.
b. Kompleks Tembaga(II)
Cu(II) memiliki stabilitas terbesar jika dibandingkan dengan logam transisi deret pertama yang lain dan lebih stabil jika dibandingkan dengan bilangan oksidasi +1 dan +3, karena Cu(I) mudah teroksidasi menjadi Cu(II) dan Cu(III)
mudah tereduksi menjadi Cu(II) (Day and Selbin, 1985: 473 ; Lee, 1991: 827). Cu(II) bisa membentuk senyawa kompleks dengan beberapa bilangan koordinasi, umumnya berada pada bilangan kordinasi 4, 5 dan 6.
Cu(II) dengan ligan L-Metionin (L) membentuk senyawa kelat dengan formula [Cu(L)2] dan berada pada bilangan koordinasi 4. Struktur geometri
kompleks yang terjadi adalah square planar (hasil dari oktahedral yang terdistorsi) dengan dua atom oksigen dan dua atom nitrogen yang terkoordinasi pada Cu(II) seperti yang ditunjukkan oleh Gambar 4. Momen magnetik kompleks ini pada temperatur kamar menunjukkan 1,79 BM (Wagner and Baran, 2002 : 283).
Gambar 4. Struktur senyawa kompleks Bis(L-Methioninato)Copper(II) . Kompleks Cu(II) dengan bilangan koordinasi 6 dijumpai pada kompleks Cu(II) dengan ligan 1,3,6,7-tetramethyllumazine. Struktur kompleks ini adalah oktahedral dengan atom Cu(II) mengikat 2 atom N dan 2 atom O dari ligan
1,3,6,7-tetramethyllumazine (membentuk cincin lima anggota) dan 2 atom O dari
H2O seperti ditunjukkan oleh Gambar 6. Momen magnetik kompleks ini 1,95 BM
yang meingindikasikan kompleks bersifat paramagnetik (Urena, Jimenez and Moreno, 1997: 234-238). N N N N O O CH3 CH3 H3C H3C
Cu N N N N O N N N N O H3C CH3 CH3 O H3C CH3 H3C H3C O CH3 O O H H H H
Gambar 6. Struktur kompleks Cu(II) dengan 1,3,6,7-tetramethyllumazine 2. Ligan 8-hidroksikuinolin
Ligan 8-hidroksikuinolin (C9H7NO) adalah senyawa yang termasuk dalam
senyawa aromatis polisiklis yang mempunyai berat molekul 145,16 g/mol. Senyawa ini larut dalam pelarut organik dan asam seperti asam asetat. Ligan ini relatif cukup stabil dengan titik beku 74 sampai 760C dan mempunyai titik didih 2760C. Ligan 8-hidroksikuinolin akan kurang stabil bila berinteraksi dengan oksidator kuat dan ion logam, dengan ion logam. Ligan 8-Hidroksikuinolin mudah membentuk kompleks kelat.
Ligan 8-hidroksikuinolin mempunyai dua atom donor yaitu O pada gugus hidroksil dan N pada rantai siklisnya yang masing-masing mempunyai pasangan elektron yang dapat berkoordinasi dengan atom pusat.
Alafandy, M., et al, (1996: 175-179) melaporkan sintesis antara Sn(II) dengan 8-hidroksikuinolin. Terbentuknya kompleks ditandai adanya adanya
pergeseran spektra IR gugus C=N ligan bebasnya dari 1508 cm-1 menjadi 1500 cm-1 dan serapan gugus OH ligan bebas yang muncul pada 3048 cm-1
sedangkan pada kompleksnya serapan pada daerah tersebut tidak muncul. Adanya pergeseran spektra IR pada gugus C=N dan OH mengindikasikan terkoordinasinya dua gugus tersebut pada ion pusat.
Kompleks Sn(II) dengan 8-hidroksikuinolin berstruktur geometri square
planar seperti yang ditunjukkan oleh Gambar 7 dan mempunyai serapan
N O
N O
S n
Gambar 7. Struktur kompleks Sn(II) dengan 8-hidroksikuinolin
Ligan 8-Hidroksikuinolin dapat digunakan sebagai zat anti bakteri dan fungi, dimana kemampuan sebagai zat antibakteri dan antifungi diduga karena kemampuannya membentuk kelat dengan mineral-mineral yang esensial pada permukaan bakteri dan fungi.
3. Teori Pembentukan Kompleks
Pembentukan kompleks Cu(II) dan Fe(III) dijelaskan dengan teori ikatan valensi, teori medan kristal, dan teori orbital molekul.
a. Teori ikatan valensi
Teori ikatan valensi atau Valence Bond Theory (VBT) mula-mula diberikan oleh Linus Pauling atas dasar pembentukan ikatan hibrida dalam orbital hibrida (Sukardjo, 1992: 29). Teori ini membahas orbital atom logam dan ligan yang digunakan untuk berikatan. Berdasarkan teori ikatan valensi, ikatan pada ion kompleks terjadi karena ligan mempunyai pasangan elektron bebas dan atom logam mempunyai orbital yang masih kosong (Lee, 1994 : 202).
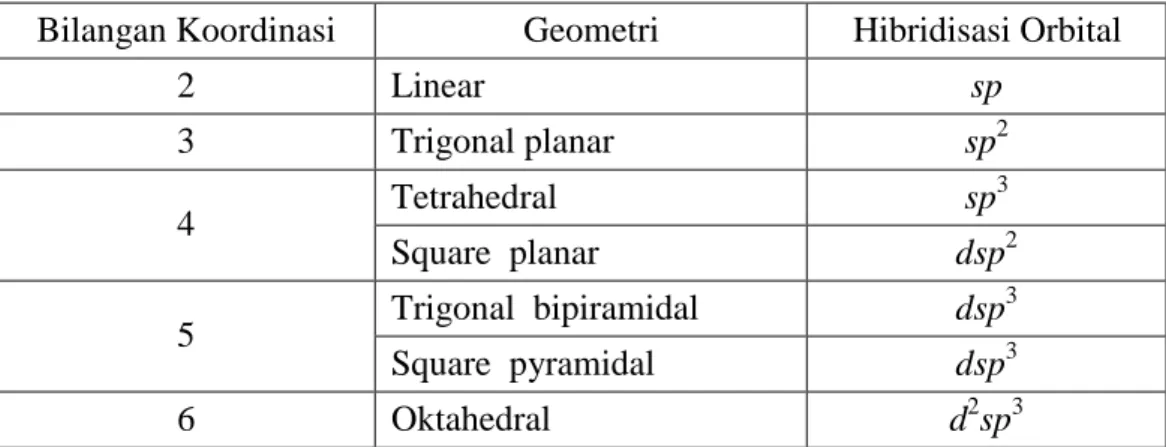
Pauling meramalkan bentuk geometri dari beberapa orbital seperti ditunjukkan oleh Tabel 1 (Sharpe, 1992 : 463)
Tabel 1. Bentuk Hibridisasi dan Konfigurasi Geometri
Bilangan Koordinasi Geometri Hibridisasi Orbital
2 Linear sp 3 Trigonal planar sp2 Tetrahedral sp3 4 Square planar dsp2 Trigonal bipiramidal dsp3 5 Square pyramidal dsp3 6 Oktahedral d2sp3
Dalam pembentukan kompleks, ion pusat harus menyediakan orbital kosong sebanyak ligan yang terkoordinasi untuk ditempati pasangan elektron bebas dari ligan. Misalnya kompleks Fe(III) dengan CN1- yang membentuk geometri oktahedral seperti ditunjukkan oleh Gambar 8. Menurut teori ikatan valensi, Fe(III) harus menyediakan 6 orbital kosong untuk ditempati pasangan elektron bebas dari CN1- seperti diilustrasikan oleh Gambar 8, orbital tersebut adalah dua orbital 3d, satu orbital 4s dan tiga orbital 4p. Ditinjau dari bentuk dan energi, orbital 3d, orbital 4s dan orbital 4p berbeda. Akan tetapi penggabungan dua orbital 3d, satu orbital 4s dan tiga orbital 4p menghasilkan bentuk oktahedral, ini dapat terjadi karena dua orbital 3d, satu orbital 4s dan tiga orbital 4p mengadakan hibridisasi d2sp3 yang berbentuk oktahedral. Ion kompleks [Fe(CN)6]3- disebut sebagai inner orbital complex karena orbital d yang dipakai
lebih rendah daripada orbital s dan p dan ion kompleks dalam keadaan spin rendah. [ A r ] C N1 -C N1 - C N1 - C N1 -C N1 - C N1 -[ A r ] F e3 + F e [ A r ] 3 d 4 s 4 p 3 d [ F e ( C N )6] 3 -3 d 4 s 4 p e l e k t r o n d a r i C N1 -o r b i t a l d2s p3
Contoh hibridisasi logam Cu(II) adalah pada kompleks [Cu(NH3)4]+2 yang
mempunyai bentuk geometri square planar. Menurut teori ikatan valensi, Cu(II) menyediakan 4 orbital kosong untuk ditempati pasangan elektron bebas dari NH3
seperti diilustrasikan oleh Gambar 9, orbital tersebut adalah satu orbital 3d, satu orbital 4s dan dua orbital 4p. Ditinjau dari bentuk dan energi, satu orbital 3d, satu orbital 4s dan dua orbital 4p berbeda. Akan tetapi penggabungan satu orbital 3d, satu orbital 4s dan dua orbital 4p menghasilkan bentuk square planar, ini dapat
terjadi karena satu orbital 3d, satu orbital 4s dan dua orbital 4p mengadakan hibridisasi dsp2 yang berbentuk square planar.
C u [ A r ] 3 d 4 s 4 p [ A r ] 3 d [ A r ] 3 d 4 s 4 p e l e k t r o n d a r i N H3 o r b i t a l h i b r i d a d s p2 [ C u ( N H3) ]2 + N H3 N H3 N H3 N H3 C u2 +
Gambar 9. Hibridisasi pada kompleks [Cu(NH3)4]2+
Teori ikatan valensi mempunyai kelemahan yaitu tidak dapat menjelaskan terjadinya warna-warna dalam kompleks dan adanya spektra elektronik senyawa kompleks. Maka untuk dapat menjelaskannya dibutuhkan teori medan kristal. b. Teori Medan Kristal
Menurut teori medan kristal atau Crytal Field Theory(CFT), ikatan yang terjadi antara ion pusat dan ligan dalam kompleks berupa ikatan ionik, sehingga gaya-gaya yang terlibat hanya berupa gaya eletrostatik. Medan listrik dari ion pusat akan mempengaruhi ligan-ligan di sekelilingnya sedangkan medan gabungan dari ligan akan mempengaruhi elektron dari ion pusat. Pengaruh ligan tergantung dari jenisnya, terutama pada kekuatan medan ligan dan kedudukan geometri ligan dalam kompleks.
Kedudukan obital-orbital d ion logam terhadap sumbu x, dan z diilustrasikan oleh Gambar 10.
Kedudukan orbital dz2 terkonsentrasi sepanjang sumbu z, sedangkan
Orbital dx2-y2 terkonsentrasi sepanjang sumbu x dan y dan kedudukan ketiga
orbital dxy, dxz dan dyz terkonsentrasi diantara sumbu x, y dan z. Dalam keadaan
bebas, kelima orbital ion logam mempunyai energi yang sama (tergenerasi), bila ligan mendekati ion pusat maka terbentuk medan ligan yang menyebabkan terjadinya pembelahan orbital-orbital d dengan tingkat energi yang berbeda atau dapat dikatakan mengalami splitting.
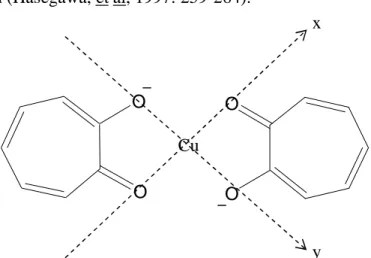
1) Kompleks Oktahedral
Pada kompleks oktahedral, satu ion pusat sebagai pusat oktahedral dikelilingi oleh enam ligan yang terletak pada sumbu oktahedral dalam bidang kubik. Orbital dz2, dx2-y2 yang berada pada sumbu oktahedral mengalami tolakan
lebih besar dari pada dxy, dxz, dyz yang berada diantara sumbu oktahedral karena
adanya tolakan dari ligan. Hal ini mengakibatkan pemisahan (splitting) orbital d, dimana orbital dz2 dan dx2-y2 (orbital eg) mengalami kenaikan energi sedangkan
orbital dxy, dxz, dyz (orbital t2g) mengalami penurunan energi (Huheey and Keither,
1993: 397-398). Pembelahan orbital d pada kompleks oktahedral ditunjukkan oleh Gambar 11.
Gambar 11. Pemisahan Orbital d Ion Logam Medan Oktahedral
Setelah terjadi splitting atau pembelahan, orbital eg mempunyai energi
yang lebih tinggi daripada t2g. Pada pengisian elektron, orbital t2g akan terisi
terlebih dahulu daripada orbital eg. Perbedaan energi antara eg dan t2g biasanya
kehilangan energi, maka energi eg menjadi 0,6 Dq lebih tinggi sedangkan orbital
t2g menjadi 0,4 Dq lebih rendah daripada kompleks hipotesis. Besarnya ∆o untuk
bermacam-macam kompleks berkisar antara 30-60 Kkal/mol. Energi sebesar 0,4 ∆o disebut sebagai Cristal Field Stabilization Energy (CFSE) dari kompleks.
CFSE dihitung dengan memberi harga 0,4 ∆o untuk tiap elektron di orbital t2g dan
-0,6 ∆o untuk tiap elektron di orbital eg.
Contoh kompleks oktahedral adalah Kompleks
[Cu(1,3,6,7-tetramethyllumazine)2(H2O)2]2-, atom Cu(II) sebagai ion pusat terletak
ditengah-tengah medan oktahedral dan dikelilingi oleh dua atom N dan dua atom O dari
1,3,6,7-tetramethyllumazine dan dua atom O dari H2O, yang terletak pada sumbu
oktahedral, seperti yang ditunjukkan oleh Gambar 12.
Cu N N N N O N N N N O H3C CH3 CH3 O H3C CH3 H3C H3C O CH3 O O H H H H
Gambar 12. Struktur kompleks oktahedral [Cu(1,3,6,7-tetramethyllumazine)2
(H2O)2]2-
Pada kompleks Fe(III) pembelahan orbital d sangat bergantung pada kekuatan ligan yang terkoordinasi pada Fe(III). Apabila ligan yang digunakan adalah ligan lemah maka medan ligan akan menghasilkan pembelahan orbital d yang tidak terlalu besar. Jika keadaan ini terjadi, maka elektron-elektron berada dalam keadaan spin tinggi. Pada keadaan ini, menghasilkan peningkatan kestabilan total sama dengan nol. Namun bila ligan yang digunakan adalah ligan
z
x y
kuat maka orbital d akan mengalami pembelahan yang cukup besar dan menyebabkan energinya mengalami peningkatan kestabilan total sebesar 20 Dq. Jika keadaan ini terjadi maka elektron-elektron berada dalam keadaan spin rendah (Sukardjo, 1992: 31-51).
2) Kompleks Tetrahedral
Koordinasi secara tetrahedral identik dengan koordinasi kubus, jika delapan ligan yang berada pada sudut-sudut kubus mendekati atom logam pusat maka ligan-ligan tersebut akan lebih dekat ke arah orbital t2g daripada orbital eg
sehingga energi orbital t2g naik 4 Dq dan energi eg terstabilkan turun 6 Dq. Jadi,
splitting orbital-orbital d dalam medan tetrahedral adalah kebalikan dari medan
oktahedral seperti yang ditunjukkan oleh Gambar 13.
Gambar 13. Pemisahan Orbital d Ion Logam medan tetrahedral
Jika empat ligan yang arahnya berseberangan (alternate) menjauhi dari sudut kubus maka ligan yang tetap berada pada sudut kubus akan membentuk struktur geometri tetrahedral disekitar ion logam. Secara kualitatif energi untuk kesimetrian tetrahedral sama dengan kubus tetapi splitting 10 Dq besarnya setengah dari besar kubus.
Contoh kompleks tetrahedral adalah kompleks [Cu(qbsa)2] dengan qbsa=
N-Quinolin-8-yl-benzenesulfonamid (Macias, Villa, Garcia, Castineiras, Borras
and Marin, 2003:243). Ligan qbsa mendekati ion pusat secara tetrahedral, dimana arah pendekatan ligan-ligan tersebut tidak searah, baik dengan kelompok
orbital t2g maupun dengan orbital eg walaupun demikian arah pendekatan ligan
menuju ion pusat lebih dekat kepada orbital t2g (dxy, dxz, dyz) dibanding dengan
orbital eg ( dx2-y2 dan dz2). Struktur kompleks ini ditunjukkan oleh Gambar 14.
N N C u N N S O O S O O
Gambar 14. Struktur kompleks tetrahedral [Cu(qbsa)2]
3) Kompleks Square planar
Apabila kedua ligan pada posisi trans pada kompleks oktahedral bergerak menjauh dari ion pusat, maka kompleks yang dihasilkan adalah kompleks oktahedral terdistorsi secara tetragonal. Distorsi seperti ini dinamakan distorsi Jahn-Teller. Distorsi Jahn-Teller terdapat pada bentuk oktahedral dimana orbital ion pusatnya terisi secara tidak simetris, yaitu seperti pada Tembaga(II) dengan konfigurasi d9. Kedua ligan disepanjang sumbu z yang menjauhi ion pusat menyebabkan orbital dz2, dxz dan dyz terstabilkan dan energinya berkurang karena
elektron-elektron yang terdapat pada orbital tersebut memperoleh tolakan yang lebih kecil dibandingkan dengan tolakan yang diperoleh dalam bentuk oktahedral. Berkurangnya energi orbital-orbital di atas, disertai dengan bertambahnya energi orbital-orbital dx2-y2 dan dxy (Huheey and Keither, 1993:403-404; Miessler and
Tar, 1991:349).
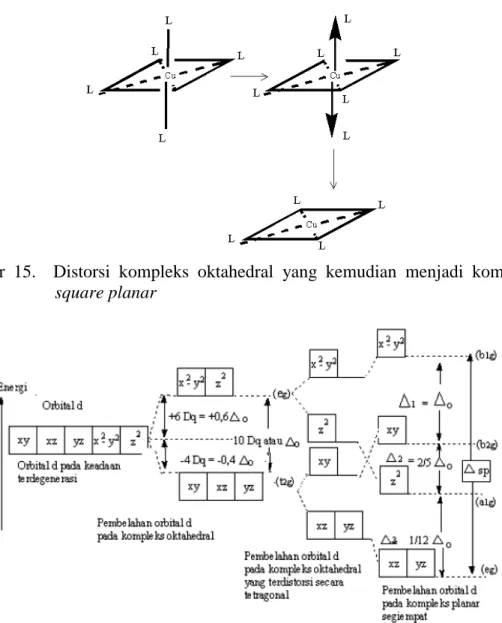
Selanjutnya apabila kedua ligan di sepanjang sumbu z lepas maka menghasilkan struktur square planar (Gambar 15), seperti yang umumnya
z
x y
terbentuk pada kompleks tembaga(II). Pembelahan orbital d pada kompleks square planar dinotasikan sebagai ∆sp (Gambar 16), yaitu energi pembelahan
medan kristal square planar (Day and Selbin, 1985:396).
Gambar 15. Distorsi kompleks oktahedral yang kemudian menjadi kompleks
square planar
Gambar 16. Pembelahan orbital d kompleks planar segiempat (Madan, 1987: 1362; Cotton, et al, 1995: 509)
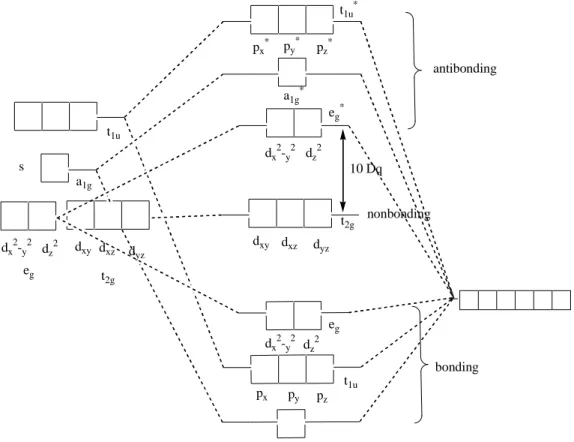
Salah satu contoh kompleks dengan bentuk geometri planar segiempat adalah kompleks [CuL2], L=Troponolato. Pada kompleks ini atom pusat Cu2+
dengan ligan troponolato (L) membentuk senyawa kelat dengan 4 atom oksigen yang terkoordinasi pada atom pusat tersebut seperti yang ditunjukkan oleh Gambar 17. Serapan maksimum kompleks [Cu(troponolato)2] berada pada 220,
maksimum pada daerah 316 nm adalah transisi transfer muatan ligan ke logam atau logam ke ligan (Hasegawa, et al, 1997: 259-264).
O
O O
O Cu
Gambar 17. Struktur senyawa kompleks Cu(troponolato)2
c. Teori Orbital Molekul
Anggapan bahwa ikatan pada kompleks adalah ikatan ionik murni seperti dinyatakan dalam teori medan kristal ternyata tidak sesuai dengan fakta eksperimen (Huheey and Keither, 1993: 413). Hasil eksperimen mengenai besarnya energi yang dilepas bila kompleks terbentuk memberi petunjuk bahwa terdapat sifat ikatan kovalen dalam kompleks. Adanya ikatan kovalen pada kompleks dapat dijelaskan dengan teori orbital molekul. Seperti halnya orbital molekul pada molekul-molekul sederhana, pada kompleks juga terbentuk orbital molekul bonding dan orbital molekul anti bonding (Sharpe, 1992: 473).
Pada kompleks oktahedral yang digunakan untuk membentuk orbital molekul adalah enam orbital logam (orbital s, px, py, pz, dx2-y2, dan dz2) dan enam
orbital ligan (Sharpe, 1992 : 474). Orbital ligan yang simetrinya sesuai akan bertumpang tindih (overlap) dengan orbital logam, tumpang tindih orbital tersebut dapat membentuk orbital molekul bonding dan orbital molekul antibonding. Tiga orbital d logam t2g(dxy, dxz, dyz) merupakan orbital nonbonding, yang tidak terlibat
dalam pembentukan ikatan. Ketiga orbital p membentuk orbital molekul bonding
t1u dan orbital molekul antibonding t1u*. Orbital dx2-y2 dan dz2 membentuk orbital
molekul bonding e1g dan orbital molekul antibonding e1g*. Orbital s membentuk
orbital molekul bonding a1g dan orbital molekul antibonding a1g* (Huheey and
x
Keither, 1993: 396). Diagram tingkat energi orbital molekul pada kompleks octahedral ditunjukkan oleh Gambar 18.
p s d dx2-y2 dz2 dxy dxz d yz t2g dxy dxz dyz t2g dx2-y2 dz2 px py pz a1g t1u eg nonbonding dx2-y2 dz2 eg* a1g* px* py* pz* t1u* 10 Dq antibonding bonding
orbital logam orbital molekul orbital ligan
t1u
a1g
eg
Gambar 18. Orbital Tingkat Energi Orbital Molekul Kompleks Oktahedral Pada kompleks tetrahedral, lima orbital d logam terpisah menjadi dua kelompok yaitu orbital e (dx2-y2, dan dz2) dan t2 (dxy, dxz, dyz). Orbital dx2-y2 dan dz2
merupakan orbital nonbonding, e, yang tak terlibat pada pembentukan ikatan. Ketiga orbital p membentuk orbital molekul bonding t2 dan orbital molekul
antibonding t2*. Orbital dxy, dxz, dan dyz membentuk orbital molekul bonding t2
dan orbital molekul antibonding t2*. Orbital s membentuk orbital molekul
bonding a1 dan orbital molekul antibonding a1* (Huheey and Keither, 1993: 396).
Empat orbital ligan yang punya simetri sama dengan orbital molekul bonding dan orbital molekul antibonding. Diagram tingkat energi orbital molekul pada kompleks tetrahedral ditunjukkan oleh Gambar 19.
p s d dx 2 -y 2 dz 2 dxy dxz dyz e dxy dxz dyz t2 * px py pz a1 t2 nonbonding dx 2 -y 2 dz 2 e a1 px * p y * pz * t2 * 10 Dq antibonding bonding
orbital logam orbital molekul orbital ligan
dxy dxz dyz
t2
t2
a1
t2
Gambar 19. Diagram Tingkat Energi Orbital Molekul pada Kompleks Tetrahedral (Huheey and Keither, 1993 : 411).
Pada senyawa kompleks square planar, diagram tingkat energi orbital molekulnya ditunjukkan oleh Gambar 20.
Gambar 20. Diagram tingkat energi untuk senyawa kompleks Square Planar (Huheey, 1985 : 412)
Pendekatan teori orbital molekul dapat memberikan gambaran yang lebih nyata mengenai antaraksi antara ligan dan ion logam. Orbital ligan kuat dan lemah memberikan interaksi yang berbeda terhadap orbital-orbital logam. Orbital-orbital ligan kuat memiliki interaksi yang sangat kuat dengan Orbital-orbital logam. Interaksi yang sangat kuat tersebut menyebabkan jarak pembelahan antara kelompok orbital e*g dan t2g besar (∆o-nya juga besar). Pada orbital molekul ini,
yang tidak terjadi adalah transisi elektron dari logam ligan (π*) yang melibatkan ikatan π juga disebut sebagai ikatan π balik (π back bonding) dimana densitas elektron dari orbital d dikembalikan lagi oleh logam ke ligan (π*) dikarenakan keruahan elektron. Ikatan π dari logam ligan meningkatkan kestabilan kompleks yang tinggi dan menyukai konfigurasi spin rendah (Miessler dan Tarr, 1991).
Orbital-orbital ligan lemah lebih berinteraksi lemah dengan orbital logam. Hal ini disebabkan ligan-ligan menghasilkan harga ∆o pembelahan kecil sehingga
jarak pembelahan orbital-orbital e*g dan t2g dari interaksi ligan-logam menjadi
kecil. Pendeknya jarak ikatan antara kelompok orbital t2g dan e*g menyebabkan
kelima elektron dari Fe(III) menempati kelompok orbital t2g dan e*. Kelima
elektron ini tidak berpasangan semua. Kompleks tipe ini disebut kompleks spin tinggi. Pada orbital molekul ini terjadi transisi elektron dari ligan ke logam. Ikatan yang terjadi pada umumnya dapat memberikan kestabilan kompleks dan cenderung berada konfigurasi spin tinggi (Huheey and Keither, 1993).
4. Sifat Senyawa Kompleks a. Spektrum Elektronik
Salah satu ciri utama dari senyawa kompleks adalah memiliki warna yang bervariasi. Warna ini disebabkan oleh adanya eksitasi elektron dari tingkat energi yang lebih rendah ke tingkat energi yang lebih tinggi. Elektron yang tereksitasi ini menyerap energi, energi tersebut berbanding terbalik dengan panjang gelombang sinar yang diserap, seperti yang ditunjukkan oleh persamaan (1) (Miessler and Tarr, 1991 : 313-325).
_ ν . c . h λ h.c E= = ………(1)
Keterangan: E = energi (J) H = Konstanta Plank (6,626 . 10-34 Js) C = Kecepatan cahaya (2,998. 108 m/s) λ = Panjang gelombang (m) 1/λ= _ ν = Bilangan gelombang (m-1 )
Elektron-elektron yang terlibat dalam pengabsorpsian cahaya oleh senyawa organik adalah: (1) elektron-elektron yang terlibat langsung dalam ikatan antar atom-atom, (2) elektron-elektron bebas/ tak berpasangan seperti oksigen, nitrogen, halogen, dan belerang. Unsur-unsur blok d menyerap sinar pada daerah sinar tampak dengan pita yang lebar, yang puncak spektranya dipengaruhi oleh lingkungan yang mengelilinginya, seperti konsentrasi larutan dan kestabilan kompleks (Hendayana, 1994: 148). Spesies yang mengabsorpsi dapat mengalami transisi meliputi transisi elektron σ, π, dan n, transisi elektron-elektron d dan f, dan transfer muatan.
1) Transisi yang meliputi elektron σ, π, dan n
Jenis transisi ini terjadi pada molekul-molekul organik dan sebagian kecil anion anorganik. Molekul tersebut mengabsorpsi radiasi elektromagnetik karena adanya elektron valensi yang akan tereksitasi ke tingkat energi yang lebih tinggi. Pengabsorpsian energi pada tingkat-tingkat energi menyebabkan terjadinya transisi σ-σ*, n-π*, dan π-π* dimana π* dan σ* adalah orbital antiikatan sedang n adalah orbital yang tak berikatan.
Transisi σ-σ* mempunyai daerah absorpsi di daerah UV vakum (<180 nm). Transisi σ-σ* terjadi pada panjang gelombang 150-250 nm, sedangkan transisi n-π*, dan π-π* terjadi pada panjang gelombnag 200-700 nm. transisi n-π* mempunyai absorpsitivitas molar 10-100 L. cm-1mol-1 sedangkan transisi π-π* mempunyai absorpsitivitas molar 103-104 L. cm-1mol-1
2) Transisi yang melibatkan elektron d
Transisi d-d mempunyai pita lebar dan umumnya terdeteksi pada daerah tampak.
a. Spektrum Elektronik Kompleks Besi(III)
Konfigurasi elektron besi(III) isoelektronik dengan Mn(II), termasuk dalam sistem d5, pada keadaan ground state medan lemah oktahedral masing-masing orbital d terisi satu elektron, dengan spin pararel sehingga dalam keadaan dasar term simbolnya 6S. Spektrum yang teramati adalah konsekuensi dari transisi spin terlarang dan sangat lemah, seperti pada [Mn(H2O)]2+ (Miessler and Tarr,
1991 : 332).
Diagram tingkat Orgel yang menggambarkan eksitasi elektron besi(III) dengan konfigurasi d5 pada medan ligan oktahedral ditunjukkan oleh Gambar 21, yang enam transisinya adalah:
6 A1g →4T1g (G) 18.000 cm-1 atau 556 nm 6 A1g →4T2g (G) 23.000 cm-1 atau 435 nm 6 A1g →4Eg, 4A1g (G) 24.000-25.000 cm-1 atau 417-400 nm 6 A1g →4T2g (D) 28.000 cm-1 atau 357 nm 6 A1g →4Eg (D) 29.000 cm-1 atau 339 nm
Transisi pada 4F dan 4P tidak terlihat serapannya karena energinya jauh lebih besar dibanding dengan 4G dan 4D sehingga serapan transisi elektron yang terjadi tidak terlihat (serapan sangat kecil).
Gambar 21. Diagram tingkat energi orgel untuk konfigurasi elektron d5 dalam medan ligan oktahedral
b. Spektrum Elektronik Kompleks Cu(II)
Cu(II) memiliki konfigurasi elektron d9 dan term simbol 2D. Term 2D dalam medan oktahedral maupun tetrahedral mengalami splitting menjadi dua
4S 4 Eg , 4 A1g 4A 1g 4T 1g 4T 2g 4 T1g 4 A2g 4T 2g 4 T2u 4E g 4 T1g 4G 4D 4P 4 F
Daerah Medan Ligan
en
er
g
tingkat energi yang ditunjukkan oleh diagram orgel pada gambar 22 (Sharpe 1992: 481).
Gambar 22. Pembelahan tingkat energi konfigurasi d9 pada medan oktahedral (Sharpe 1992: 481).
Unsur konfigurasi d9 pada medan oktahedral hanya mempunyai satu transisi yaitu 2Eg 2T2g, karena hanya terdapat dua tingkat energi (2Egdan 2
T2g) dan hanya satu absorbsi spin yang diperbolehkan dengan energi yang diserap
setara dengan 10 Dq. Sebagai contoh kompleks [Cu(H2O)6]2+ hanya menunjukkan
satu puncak serapan pada 13.000 cm-1 dengan panjang gelombang 769,23 nm. 3) Transisi transfer muatan
Transisi tranfer muatan adalah transisi elektronik dari molekul elektronik yang kaya elektron (basa lewis, donor) ke molekul miskin elektron (asam lewis, akseptor) (William Kemp, 1987: 211). Spektra dari transisi ini biasanya sangat kuat. Kompleks-kompleks yang meliputi yang mengalami transisi ini, misalnya [Fe(SCN)6]3+, [Fe(o-phen)3]3+, [Fe2+Fe3+(CN)6]+(SM Khopkar, 1990: 204).
Transisi d-d memberikan warna pucat bagi senyawa sedangkan transisi transfer muatan memberikan intensitas yang lebih kuat karena warna yang dihasilkan gelap (Jolly, 1991: 238).
b Daya Hantar Listrik
Larutan elektrolit dapat menghantarkan aliran listrik, karena dalam larutan terdapat partikel-partikel bermuatan listrik yaitu ion-ion. Aliran listrik tidak lain adalah aliran elektron. Didalam larutan, elektron-elektron dibawa oleh ion-ion positif dan negatif (Sukardjo, 1992: 89). Daya hantar listrik (conductivity) larutan
d1 oktahedral d9 tetrahedral d9 oktahedral d1 tetrahedral Energi E T2g T2g E
elektrolit pada setiap temperatur tergantung pada ion-ion yang ada dan konsentrasi ion-ion tersebut. Apabila larutan suatu elektrolit diencerkan maka daya hantar listriknya akan turun karena ion yang berada dalam larutan per cm3 membawa arus lebih sedikit.
Daya hantar listrik larutan elektrolit dapat dinyatakan sebagai daya hantar listrik molar (molar conductivity) yang didefinisikan sebagai daya hantar yang ditimbulkan oleh satu mol zat, sesuai persamaan (2) (Atkins, 1990 : 303).
Λm =
C k
... (2) Keterangan :
Λm = daya hantar listrik molar (S.cm2.mol-1)
k = daya hantar listrik spesifik larutan elektrolit (S cm-1) C = Konsentrasi molar elektrolit (mol cm-3)
Apabila satuan Λ adalah Scm2.mol-1 dan satuan konsentrasi mol.L-1 maka persamaan (3) menjadi: Λm = C k 1000 ……… (3) keterangan:
Λm = daya hantar listrik molar (S.cm2.mol-1)
k = daya hantar listrik spesifik larutan elektrolit (S cm-1) C = Konsentrasi molar elektrolit (mol L-1)
Jika daya hantar spesifik larutan merupakan daya hantar yang sudah terkoreksi (k*) dalam satuan μS.cm-1 maka daya hantar molar larutan elektrolit dapat ditulis sesuai persamaan (4).
Λm = C k 1000 * ………. (4) keterangan:
Λm = daya hantar listrik molar (S.cm2.mol-1)
k* = daya hantar listrik spesifik terkoreksi (μS cm-1) = k – kpelarut
Pada senyawa kompleks, anion dapat terkoordinasi pada ion pusat maupun tidak terkoordinasi pada ion pusat. Perbandingan muatan anion dan kation yang terdapat dalam kompleks dapat diketahui dengan pengukuran konduktivitas dari larutan senyawa tersebut. Pengukuran konduktivitas ini memberikan informasi berapa banyak ion (kation dan anion) yang ada dalam larutan saat senyawa itu dilarutkan (Szafran, et al; 1991: 102-103).
c Spektroskopi Infra Merah
Suatu molekul dapat menyerap energi infra merah apabila gerakan vibrasi dan rotasi dari molekul tersebut menghasilkan perubahan netto momen dwikutubnya, sehingga medan listrik bolak-balik dari sinar infra merah sama dengan frekuensi alamiah dari molekul tersebut maka sinar infra merah diserap- molekul (Silverstein, Bassler and Morril, 1986: 96).
Daerah radiasi spektroskopi Infra Merah atau infrared spectroscopy (IR) berkisar pada bilangan gelombang 12800-10 cm-1, atau panjang gelombang 0,78-1000 µm. Umumnya daerah radiasi IR terbagi dalam daerah IR dekat (12800-4000 cm-1; 3,8- 1,2 x 1014 Hz; 2,5-50 μm), daerah IR tengah (4000-200 cm-1;
0,012- 6 x 1012 Hz; 0,78-2,5 μm), dan daerah IR jauh (200-10 cm-1; 60-3 x 1011 Hz; 50-1000 μm). Daerah yang paling banyak digunakan untuk
berbagai keperluan praktis adalah 4000-690 cm-1 (12 – 2 x 1013 Hz; 2,5 - 1,5 µm). Daerah yang biasa disebut sebagai daerah IR tengah (Khopkar, 1990: 231).
Daerah antara 1400 – 4000 cm-1 (2,5 sampai kira-kira 7,1 μm) merupakan daerah yang khusus berguna untuk identifikasi gugus-gugus fungsional. Daerah ini menunjukkan absorpsi sinar infra merah yang disebabkan oleh modus uluran. Sedangkan daerah di sebelah kanan 1400 cm-1 sering kali sangat rumit karena baik uluran maupun tekukan dapat mengakibatkan absorpsi sinar infra merah. Dalam daerah ini biasanya korelasi antara suatu pita serapan dan suatu gugus fungsional secara spesifik tidak dapat disimpulkan, namun tiap senyawa organik mempunyai serapannya yang khas. Oleh karena itu bagian spektrum sebelah kanan 1400 cm-1 disebut daerah sidik jari (finger print region) (Fessenden dan Fessenden, 1984: 317).
Frekuensi vibrasi ulur antara dua atom dan ikatan yang menghubungkannya dapat dihitung berdasarkan hukum Hooke yang ditunjukkan oleh persamaan (5) (Kemp, 1987: 18-19).
1/2 2 11 2 1.m /(m m ) m k 2π 1 ν + = ………..(5) keterangan: ν = frekuensi (detik-1)
k = tetapan gaya ikatan (Nm-1) m1 dan m2 = massa dau atom (g)
Gugus yang dapat menyerap sinar infra merah antara lain: 1) Karbon – Nitrogen pada Amina
Gugus C-N siklik mempunyai vibrasi ulur pada 1342-1266 cm-1 (Silverstain, dan Morril, 1986). Gugus C=N pada rantai siklik mempunyai serapan pada daerah 1580-1570 cm-1 (Alzuet et al, 1998: 317).
2) Karbon-Hidrogen pada metil
Vibrasi tekuk gugus CH3 terletak pada daerah 1470-1430 cm-1 dan
1380-1370 cm-1, sedangkan vibrasi ulur aromatik CH3 berada pada daerah
3080-3010 cm-1 (Silverstein et al, 1986: 135). 3) Hidrogen-Oksigen pada fenol
Gugus OH pada fenol mempunyai vibrasi ulur simetri dengan serapan tajam pada daerah 3600 cm-1 dan vibrasi ulur keadaan melebar pada daerah 3331 cm-1 - 2600 cm-1 (Silverstein, et al, 1986 : 110).
4) Vibrasi C-C aromatik
Gugus C-C aromatik menunjukkan 2 atau 3 pita yang terlihat pada daerah sekitar 1600 cm-1 (Kemp, 1987).
Serapan gugus fungsi pada ligan bebas akan mempunyai serapan yang
berbeda dengan serapan senyawa kompleks. Sebagai contoh kompleks [Sn(8-hidroksikuinolin)2] mempunyai serapan gugus C=N pada 1500 cm-1
ligan bebasnya muncul pada 1100 cm-1 sedangkan pada kompleksnya terletak pada 1108 cm-1 (Alafandy, et al, 1997 : 175-179).
d. Sifat Magnetik
Logam transisi setidaknya mempunyai satu tingkat oksidasi dengan d atau f yang belum terisi elektron. Karena spin elektron menyebabkan medan magnet, maka sifat magnetik dari logam transisi bisa digunakan untuk menentukan tingkat oksidasi, konfigurasi elektronik dan lain-lain. Beberapa senyawa logam transisi mempunyai satu atau lebih elektron tak berpasangan, karenanya mempunyai sifat paramagnetik. Jumlah elektron tak berpasangan pada logam menentukan harga momen magnetik (µ).
Momen magnetik efektif dapat dihitung dari harga kerentanan magnetik (Magnetic Susceptibility), Xg yang diukur dengan Neraca Kerentanan Magnetik
atau Magnetic Susceptibility Balance (MSB). Nilai Xg ini diubah menjadi nilai
kerentanan magnetik molar, XM dan selanjutnya ini dikoreksi terhadap faktor
diamagnetik, XL, dari ion logam, ligan dan anion, sehingga didapatkan nilai
kerentanan magnetik yang terkoreksi, XA (Szafran, Pike, dan Singh, 1991: 49-51).
Hubungan nilai momen magnetik (µeff) dengan kerentanan magnetik
terkoreksi (XA) ditunjukkan oleh persamaan 6. 1/2 A 2 eff X .T Nβ 3k μ = ……..……….(6)
Subsitusi nilai N dan k menghasilkan persamaan (7)
[
]
1/2A eff 2,828X .T
μ = ……….(7)
Keterangan:
N = Tetapan Avogadro (6,022 x 1023 mol-1) k = Tetapan Boltzman (1,381 x 10-16 erg. det-1)
β = Konversi Bohr Magneton (9,273 x 10-21 erg.gauss-1) T = Suhu (oK)
Hubungan nilai momen magnetik spin (µs) uatu senyawa dengan banyak
elektron yang tidak berpasangan dinyatakan dalam persamaan (8) (Jolly, 1991: 454-456).
(
)
[
]
1/2s n n 2
μ = + ………..(8)
keterangan:
µs = Momen magnetik yang ditimbulkan oleh spin elektron (Bohr
Magneton)
n = Jumlah elektron yang tidak berpasangan
Dari persamaan (6), terlihat bahwa nilai momen magnetik bergantung pada jumlah elektron yang tidak berpasangan. Nilai µs dari senyawa kompleks besi(III)
pada umumnya mendekati 5,92 BM pada suhu ruangan jika dalam keadaan spin tinggi dan 1,73 BM pada spin rendah (Lee, 1994: 669).
e. Differential Thermal Analysis (DTA)
Analisis thermal didefinisikan sebagai pengukuran sifat fisika dan kimia dari material sebagai fungsi temperatur. Differential Thermal Analysis (DTA) mengukur perbedaan temperatur (T) antara sampel dengan material pembanding inert (alumina, aluminium, silikon karbida dan gelas), jika temperatur keduanya dinaikkan dengan kecepatan yang sama dan konstan. Panas yang ditambahkan kemudian dicatat dan perubahan ini sebagai konsekuensi dari proses yang terjadi pada sampel yaitu eksotermis atau endotermis (Skoog, 1998 : 803).
Prinsip kerja DTA yaitu apabila temperatur sampel dan zat pembanding dipanaskan pada temperatur konstan maka zat pembanding akan mengalami kenaikan temperatur sesuai dengan kenaikan temperatur yang mengenainya, sementara itu pada sampel akan terjadi kenaikaan suhu atau penurunan temperatur pada batas tertentu sesuai dengan peristiwa yang terjadi pada sampel. Jika perubahan pada sampel telah sempurna maka temperatur sampel akan konstan kembali, seiring dengan zat pembandingnya. Ketika peristiwa yang terjadi adalah eksotermal, maka panas akan dilepaskan oleh sampel sehingga dalam sampel akan terjadi kenaikan temperatur yang ditandai dengan suatu puncak maksimum pada kurva DTA. Sedang apabila perubahan yang terjadi pada sampel adalah proses endotermal maka akan terjadi penyerapan panas oleh sampel yang ditandai dengan penurunan temperatur dari sampel sehingga kurva DTA yang diperoleh adalah sebagai puncak minimum (Currell , 1987 : 117 ).
B. Kerangka Pemikiran
Suatu kompleks dapat terbentuk jika terjadi ikatan kovalen koordinasi antara suatu kation atau logam yang mempunyai orbital kosong dengann molekul
netral atau anion yang mempunyai atom donor elektron. Senyawa 8-hidroksikuinolin mempunyai dua atom donor elektron, yaitu atom O pada gugus
C-O dan N tersier pada rantai siklisnya sedangkan tembaga(II) dan besi(III)
mempunyai orbital d yang masih kosong. Hal ini membuat kompleks 8-hidroksikuinolin dengan tembaga(II) dan besi(III) dapat terbentuk.
Adanya dua atom donor elektron membuat 8-hidroksikuinolin dapat membentuk kompleks dengan besi(III) dan tembaga(II) dengan beberapa kemungkinan atom/gugus yang dapat terkoordinasi pada ion pusat(logam) tetapi ligan-ligan mulltidentat yang tidak terlalu besar cenderung membentuk struktur bidentat (kelat). Pembentukkan kompleks kelat biasanya memberikan kestabilan kompleks yang relatif tinggi akibat penurunan entropi yang signifikan.
Berdasarkan kompleks [Sn(8-hidroksikuinolin)2] yang telah disintesis dari
SnCl2.2H2O dan 8-hidroksikuinolin oleh Alafandy, et al, (1997) menunjukkan
kompleks yang terbentuk adalah kompleks kelat dan atom oksigen terkoordinasi pada atom pusat dalam bentuk anion (ligan mengalami deprotonasi pada gugus OH). Hal ini didukung dengan pergeseran serapan gugus C=N, gugus OH dan gugus C-O pada spektra IR-nya. Dengan demikian kemungkinan ikatan koordinasi yang terjadi antara 8-hidroksikuinolin dengan tembaga(II) dan besi(III) ditunjukkan oleh Gambar 23.
N O 2+ Cu N O 3+ Fe
Gambar 23. Kemungkinan ikatan koordinasi antara 8-hidroksikuinolin dengan logam Cu2+ dan Fe3+
C. Hipotesis
1. Kompleks Cu(II)-(8-hidroksikuinolin) dan Fe(III)-(8-hidroksikuinolin) dapat disintesis dengan cara mencampurkan tembaga(II) dan besi (III) dengan 8-hidroksikuinolin dengan perbandingan tertentu.
2. Karakteristik kompleks Cu(II)-(8-hidroksikuinolin) dan Fe (III)-(8-hidroksikuinolin) antara lain:
a. Kemungkinan formula kompleks tembaga(II) dengan ligan 8-hidroksikuinolin adalah Cu(L)2(H2O)n (n = 0, 1, 2, 3, 4, 5, atau 6)
sedangkan formula besi(III) dengan 8-hidroksikuinolin adalah Fe(L)3(H2O)n (n = 0, 1, 2, 3, 4, 5, atau 6).
b. Spektra elektronik kompleks Cu(II)-(8-hidroksikuinolin) dan Fe(III)- (8-hidroksikuinolin) mempunyai puncak serapan lebih dari satu sebagai
hasil transisi transfer muatan dari ligan ke logam, transisi π- π* ligan dan transisi d-d logam.
c. Kompleks Cu(II)-(8-hidroksikuinolin) dan Fe(III)-(8-hidroksikuinolin) bersifat paramagnetik.
d. Pada spektra IR kompleks terjadi pergeseran puncak serapan pada gugus C=N dan gugus C-O dari 8-hidroksikuinolin yang mengindikasikan terkoordinasinya kedua gugus tersebut pada atom pusat.
Metode yang digunakan pada penelitian ini adalah metode eksperimen.
Kompleks Cu(II)-(8-hidroksikuinolin) dibuat dengan mereaksikan ligan 8-hidroksikuinolin dengan CuSO4.5H2O dalam pelarut metanol dan
kompleks Fe(III)-(8-hidroksikuinolin) dibuat dengan mereaksikan ligan 8-hidroksikuinolin dengan FeCl3.6H2O dalam pelarut metanol.
Karakterisasi kompleks Cu(II)-(8-hidroksikuinolin) dan Fe(III)-(8-hidroksikuinolin) dilakukan dengan pengukuran terhadap rendemen, spektrum UV-Vis, kadar logam, keberadaan molekul H2O, spektra IR, daya hantar listrik
dan sifat magnetik senyawa kompleks.
B. Tempat dan Waktu Penelitian
Penelitian dilakukan selama enam belas bulan yaitu bulan Agustus 2005 – November 2006.
1. Sintesis senyawa kompleks dilakukan Sub. Laboratorium Anorganik Laboratorium FMIPA Universitas Sebelas Maret Surakarta.
2. Penentuan kadar Fe dan Cu dalam kompleks, analisis DTA, pengukuran daya hantar listrik dan pengukuran momen magnet dilakukan di Sub. Laboratorium Kimia Laboratorium Pusat MIPA Universitas Sebelas Maret Surakarta sedangkan analisis kompleks dengan FTIR dilakukan di Laboratorium Kimia Organik Fakultas Kimia Universitas Gajah Mada Yogyakarta.
C. Alat dan Bahan yang Digunakan 1. Alat
a. Peralatan gelas pyrex
b. Magnetik Susceptibility Balance (MSB) AUTO Sherwood Scientific 10169 c. Spektrofotometer UV-Vis Double Beam Shimadzu PC 1601
d. Konduktivitimeter 4071 CE Jenway
f. Spektrofotometer FTIR Perkin Elmer 2000 g. Pengaduk magnetik Haeidholp M1000 Germany h. Neraca Analitik Shimadzu AEL-200
i. Differential Thermal Analyzer Shimadzu DTA-50 j. Desikator
2. Bahan
Semua bahan yang digunakan dalam penelitian ini memiliki derajat kemurnian proanalisis (pa).
e. FeCl3.6H2O (Merck).
b. CuSO4.5H2O Merck).
c. 8-hidroksikuinolin (Merk) d. Metanol (Merck)
e. Asam Klorida (HCl) pekat 37% (Merck) f. Akuades
D. Prosedur Percobaan 1. Skema Percobaan
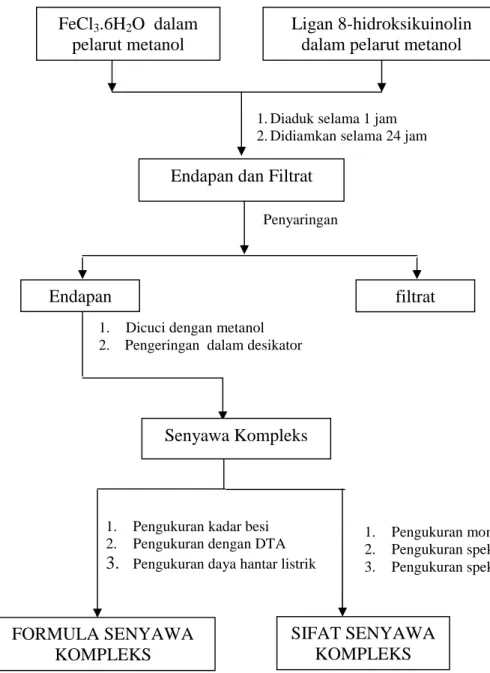
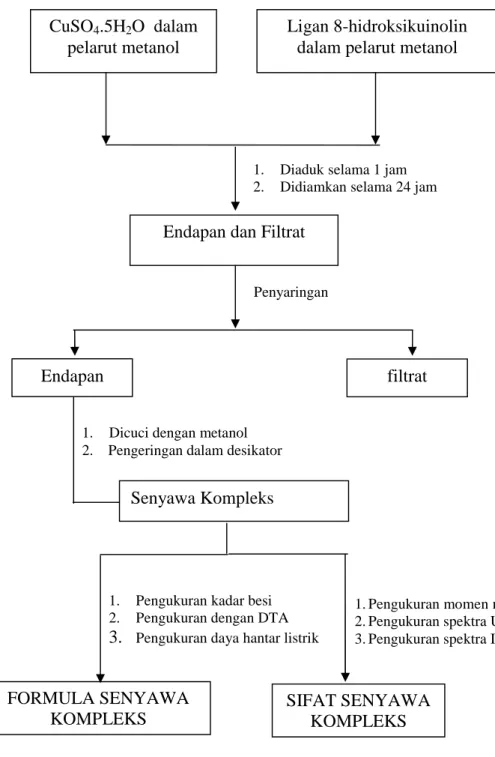
Penelitian dilakukan dengan tahap-tahap seperti ditunjukkan oleh Gambar 24 dan 25 :
Gambar 24. Skema tahap-tahap sintesis dan karakterisasi kompleks Fe(III) dengan 8-hidroksikuinolin
1. Pengukuran momen magnet 2. Pengukuran spektra UV-VIS 3. Pengukuran spektra IR FORMULA SENYAWA KOMPLEKS FeCl3.6H2O dalam pelarut metanol Ligan 8-hidroksikuinolin dalam pelarut metanol
1. Diaduk selama 1 jam 2. Didiamkan selama 24 jam
Endapan dan Filtrat Penyaringan
Endapan filtrat
1. Dicuci dengan metanol 2. Pengeringan dalam desikator
1. Pengukuran kadar besi 2. Pengukuran dengan DTA 3. Pengukuran daya hantar listrik
SIFAT SENYAWA KOMPLEKS Senyawa Kompleks
Gambar 25. Skema tahap-tahap sintesis dan karakterisasi kompleks Cu(II) dengan 8-hidroksikuinolin
1. Pengukuran momen magnet 2. Pengukuran spektra UV-VIS 3. Pengukuran spektra IR FORMULA SENYAWA KOMPLEKS CuSO4.5H2O dalam pelarut metanol Ligan 8-hidroksikuinolin dalam pelarut metanol
1. Diaduk selama 1 jam 2. Didiamkan selama 24 jam
Endapan dan Filtrat
Penyaringan
Endapan filtrat
1. Dicuci dengan metanol 2. Pengeringan dalam desikator
Senyawa Kompleks
1. Pengukuran kadar besi 2. Pengukuran dengan DTA 3. Pengukuran daya hantar listrik
SIFAT SENYAWA KOMPLEKS
![Gambar 14. Struktur kompleks tetrahedral [Cu(qbsa) 2 ] 3) Kompleks Square planar](https://thumb-ap.123doks.com/thumbv2/123dok/4371574.3190560/32.892.288.666.258.617/gambar-struktur-kompleks-tetrahedral-qbsa-kompleks-square-planar.webp)