TINJAUAN PUSTAKA
Muara sungai
Muara sungai termasuk ke dalam ekosistem estuari, dimana air tawar dan air laut bercampur. Bahan-bahan organik dan anorganik yang terdapat di muara sungai sebagian diendapkan, terlarut dan terbawa oleh arus ke laut. Salah satu proses yang mempengaruhi konsentrasi bahan-bahan organik dan anorganik pada muara sungai adalah proses biologi (Chester 1990).
Menurut Dahuri et al. (1996) kualitas air suatu perairan pesisir seperti muara dicirikan oleh karakteristik kimianya yang mudah dipengaruhi oleh masukan air yang berasal dari daratan (melalui sungai) dan lautan sekitarnya. Proses pembuangan limbah dari daratan melalui aliran sungai atau dari lautan yang berlangsung secara terus menerus akan mengakibatkan turunnya kualitas air muara sungai. Pencemaran muara sungai oleh senyawa nitrogen lebih dominan berasal dari daratan.
Pada muara sungai terjadi daur biogeokimia nitrogen, yaitu terjadinya perubahan-perubahan senyawa atau unsur nitrogen dalam medium dan peristiwa yang berbeda. Beberapa proses transformasi senyawa nitrogen melibatkan berbagai jenis bakteri yaitu bakteri yang berperan dalam amonifikasi, asimilasi, fiksasi, nitrifikasi dan reduksi nitrat disimilatif.
Amonifikasi adalah proses pembentukan amonia dari materi organik dilakukan oleh bakteri dan cendawan safrofit. Asimilasi adalah proses pemanfaatan senyawa nitrogen anorganik untuk pembentukan asam amino dalam protoplasma. Fiksasi nitrogen yaitu peristiwa pengikatan gas nitrogen (N2) umumnya terjadi di daratan, simbiosis alga di perairan dan percampuran nitrogen dari atmosfer. Nitrifikasi merupakan reaksi oksidasi pembentukan nitrat yang berasal dari amonia. Reduksi nitrat disimilatif merupakan reaksi reduksi terhadap nitrat dimana nitrat direduksi melalui tahap-tahap tertentu dengan hasil akhir amonium atau gas nitrogen. Reduksi nitrat disimilatif yang dominan terjadi di atas sedimen muara sungai adalah denitrifikasi (Donget al. 2002). Denitrifikasi yaitu reaksi reduksi yang mengubah nitrat menjadi nitrit, nitrit oksida, nitrous oksida dan terakhir gas nitrogen. Reduksi nitrat disimilatif yang dominan pada
bagian sedimen muara sungai adalah nitrat amonifikasi disimilatif (Rusmana 2003a).
Madiganet al. (2006) menyatakan proses penghilangan senyawa nitrogen di tanah dan perairan melalui proses denitrifikasi dan anaerob ammonia oxidation
(anammox). Kedua proses tersebut menghasilkan gas nitrogen dan nitrous oksida (denitrifikasi) sebagai produk akhir. Proses ini jika terjadi di areal pertanian dapat menurunkan produktivitas hasil pertanian.
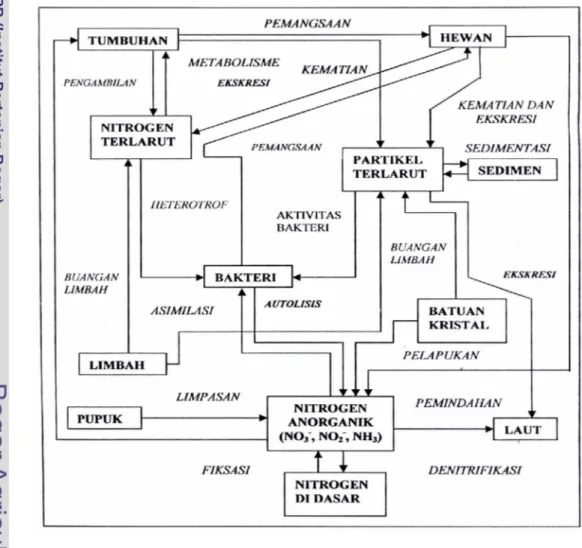
Senyawa-senyawa nitrogen yang terdapat di muara sungai secara umum terlibat dalam daur biogeokimia seperti yang dijelaskan oleh Kennish (1994) seperti terlihat pada Gambar 1.
Muara Sungai Cimandiri dan Cisadane
Muara Sungai Cimandiri kabupaten Sukabumi Jawa Barat, merupakan muara sungai yang telah tercemar. Berbagai sampah rumah tangga / pemukiman, limbah areal pertanian (sawah, perkebunan) dan bahan-bahan lain sepanjang Daerah Aliran Sungai (DAS) Sungai Cimandiri terakumulasi di muara. Kualitas air pada muara sungai Cimandiri sudah mengalami penurunan (Marnis 2008).
Selain limbah yang masuk ke perairan sungai, aktivitas penambangan pasir sepanjang DAS menyebabkan warna perairan di sekitar muara menjadi coklat sampai jarak yang cukup jauh dari pantai (Marnis 2008). Pada kondisi kimia dan fisik perairan seperti itu akan memicu pertumbuhan mikroorganisma-mikroorganisma aerob fakultatif dan anaerob disamping bakteri aerob, termasuk mikroorganisme yang memanfaatkan senyawa nitrogen baik organik (protein, asam amino) atau senyawa anorganik (nitrat, nitrit, dan amonium).
Muara Sungai Cisadane merupakan muara sungai yang tingkat pencemarannya lebih tinggi dari muara Sungai Cimandiri. Sungai Cisadane selain sebagai sumber air yang dimanfaatkan penduduk untuk keperluan sehari-hari, juga merupakan sumber perairan pertanian. Disamping itu berfungsi sebagai tempat penampungan limbah yang berasal dari limbah rumah tangga, industri, pertanian dan perternakan (Brahmana & Suriati 2001).
Beberapa parameter kualitas air yang menunjukkan muara Sungai Cisadane tercemar adalah rendahnya kandungan oksigen terlarut, tingginya konsentrasi nitrit dan amonia serta suhu perairan yang tinggi. Kandungan oksigen terlarut berkisar antara 0,39-2,33 mg/l, dan suhu 32,0-32,60C. Kandungan senyawa nitrit 0,03-0,14 mg/l dan amonia 0,09-1,19 mg/l (Syahputra 2007). Tingkat pencemaran muara Sungai Cisadane pada musim hujan akan lebih rendah karena faktor pengenceran oleh air hujan, termasuk air hujan dari hulu melalui aliran sungai.
Muara sungai yang banyak mengandung limbah organik dan anorganik yang mengandung senyawa nitrogen diduga menghasilkan emisi Nitrous Oksida (N2O) yang lebih besar. Emisi N2O dari perairan dan muara kurang lebih 66%, produksi gas ini berkorelasi positif dengan konsentrasi nitrat atau nitrit perairan (Seitzinger & Kroezen 1998; Rusmana 2003c).
Pada kedua muara sungai diatas senyawa nitrogen umumnya berasal dari limbah organik rumah tangga sepanjang daerah aliran sungai yang mengalami dekomposisi, limbah pupuk nitrogen anorganik areal pertanian dan senyawa nitrogen anorganik tanah yang mengalami erosi tepi sungai. Sumber senyawa nitrogen lain berasal dari proses nitrifikasi, proses dekomposisi mikroorganisma dan eksresi organisma di habitat muara sungai serta gas oksida nitrogen dari udara yang terlarut melalui air hujan. Limbah industri merupakan faktor utama pencemaran yang meningkatkan senyawa nitrogen pada muara Sungai Cisadane disamping faktor-faktor di atas.
Bakteri Pereduksi Nitrat
Kelompok bakteri pereduksi nitrat merupakan mikroorganisma yang terlibat dalam daur nitrogen di alam. Kelompok bakteri ini berperanan dalam pengubahan senyawa nitrat menjadi produk akhir gas nitrogen atau senyawa amonium.
Rusmana (2003b) menyatakan bahwa terdapat tiga proses reduksi nitrat disimilatif pada bakteri yaitu denitrifikasi, reduksi nitrat menjadi amonium disimilatif dan oksidasi amonium disimilatif (anaerob ammonia oxidation,
anammox). Denitrifikasi adalah proses reduksi nitrat menjadi N2O atau N2. Pada proses ini bakteri menggunakan nitrat sebagai penerima elektron terakhir untuk memperoleh energi pada kondisi O2 terbatas atau anaerob (Zumft 1997; Ricardson 2000; Ricardsonet al. 2001). Reduksi nitrat menjadi amonium disimilatif adalah proses untuk menghilangkan kelebihan tenaga pereduksi dan menunjang pertumbuhan bakteri pada kondisi anaerob (Cole 1996). Anamoks adalah oksidasi amonia secara anaerobik dimana terjadi pengubahan amonium dan nitrat atau nitrit menjadi gas nitrogen. Pada metabolisma ini membentuk senyawa antara hidroksil amin dan hidrazin (Jetten et al. 2001).
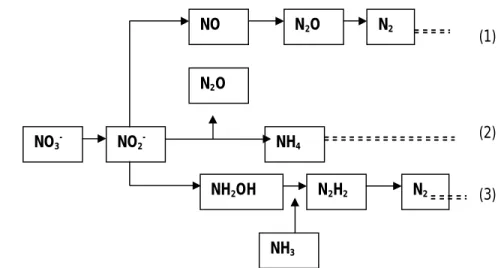
Tiga lintasan proses reduksi nitrat oleh aktivitas bakteri dapat digambarkan sebagai berikut (Rusmana 2003b).
(3)
Enzim-Enzim yang Berperan pada Reduksi Nitrat
Kelompok bakteri pereduksi nitrat baik denitrifikasi, bakteri DNRA maupun anamoks memiliki enzim-enzim tertentu untuk mengkatalisasi reaksi-reaksi reduksi nitrat. Enzim pada bakteri denitrifikasi adalah nitrat reduktase (Nar dan Nap), Nitrit reduktase (Nir), Nitrit oksid reduktase (Nor), Nitrous oksid reduktase (Nos) (Moreno - Vivian et al.1999; Zumft 1997; Ricardsonet al. 2001).
Bakteri DNRA memiliki enzim nitrat reduktase (Nap dan Nar) yang mereduksi nitrat menjadi nitrit dan dua enzim yang mereduksi nitrat menjadi amonium yaitu Nir B (Harboneet al. 1992) danenzim formate dependent nitrite reduction to amonium atau Nrf (Cole 1996). Pada spesies tertentu seperti
Wollinella succinogens danCampylobacter fetus memiliki enzim nitrous oksida reduktase (Nos). Enzim ini mereduksi gas N2O menjadi gas Nitrogen (Zumft 1997).
Enzim yang terdapat pada bakteri anamoks adalah nitrit reducing enzyme
(NR) yaitu enzim yang mereduksi nitrit menjadi hidroksil amin (NH2OH). Hidrazin Hidrolase (HH) enzim yang mereduksi hidroksilamin menjadi hidrazin (N2H4) dan Hydrazine – oxidising enzyme (HZO), enzim yang mengoksidasi hidrazin menjadi gas nitrogen (Jettenet al. 2001).
NH4 NH3 N2 N2H2 NH2OH NO3 -N2 N2O NO NO2 -N2O (2) (1) (3) NH4 NH3 N2 N2H2 NH2OH NO3 -N2 N2O NO NO2 -N2O (2) (1) (3) NH4 NH3 N2 N2H2 NH2OH NO3 -N2 N2O NO NO2 -N2O (2) (1) (3)
Gambar 2 Lintasan reduksi nitrat oleh aktivitas bakteri (1) Denitrifikasi,
(2).Reduksi nitrat amonifikasi disimilatif (3) Oksidasi amonia secara anaerob.
Bakteri Nitrat Amonifikasi Disimilatif (DNRA)
Pada kondisi yang sesuai beberapa genus dapat mereduksi nitrit menjadi amonia melalui proses reduksi nitrat disimilasif. Prosesnya berlangsung pada saat kandungan senyawa nitrit tinggi (Kelsoet al.1997). Kelompok bakteri ini bersifat fermentatif (Rusmana & Nedwell 2004), dapat memanfaatkan senyawa organik untuk pembentukan energi melalui transfer elektron di sitoplasma (Purwoko 2007).
Purwoko (2007) mengemukakan bahwa sebagian besar prokariota fermentatif menghasilkan semua ATP melalui fosforilasi tingkat subtrat, kemudian ATP dihidrolisis oleh ATP sintetase, sehingga dapat menghasilkan perbedaan potensial yang digunakan untuk aktivitas membran. Organisma fermentatif memerlukan akseptor elektron untuk menerima elektron dari NADH. Kelompok bakteri pereduksi nitrat dapat memanfaatkan senyawa nitrat sebagai penerima elektron alternatif untuk mendapatkan energi dibawah kondisi oksigen terbatas (Ricardsonet al. 2001).
Kelompok bakteri DNRA mereduksi senyawa nitrat sejalan dengan penambahan senyawa nitrit, ketika konsentrasi nitrat rendah terjadi penambahan senyawa amonium (Kelso et al. 1997). Pada beberapa pengamatan di lapangan menunjukkan bahwa proses nitrat amonifikasi disimilatif banyak terjadi pada suhu tinggi (Herbert & Nedwell 1990). Bakteri DNRA lebih dominan pada lingkungan yang rasio C/N nya tinggi (Nedwell 1982). Bakteri DNRA lebih kompetitif dari pada bakteri denitrifikasi pada konsentrasi bahan organik tinggi.
Bakteri-bakteri nitrat amonifikasi disimilatif diantaranya adalah Bacillus pyocyanes, Clostridium pasteurianum, Desulfovibrio desulfuricans (Moat et al.
2002). Bacillus licheniformis, Wollinella succinogenes, Citrobacter freundii, Klebsiella oxytoca, K. Pneumonia, Escherichia coli (Rusmana 2003a).
Rusmana (2003a) telah mengisolasi dan mengkarakterisasi Klebsiella
pneumonia yang mereduksi nitrat menjadi amonium dan menghasilkan N2O
sebagai produk sampingnya. Syahputra (2007) telah mengisolasi dan menyeleksi bakteri nitrat amonifikasi disimilatif dari muara sungai Cisadane. Isolat terpilih dikarakterisasi mempunyai kemiripan dengan Escherichia sp 21 CR dengan
tingkat kemiripan 97%. Sebagian besar famili Enterobacteriaceae mereduksi nitrat dan bersifat fermentatif (Holt et al. 1994).
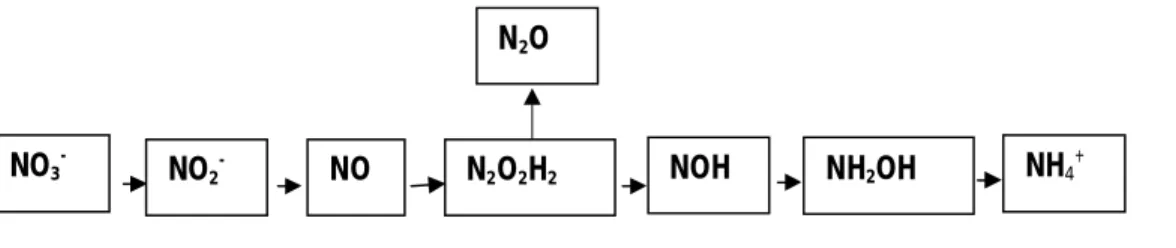
Proses pembentukan N2O pada kelompok bakteri nitrat amonifikasi disimilatif bukan sebagai senyawa antara seperti pada kelompok bakteri denitrifikasi, tetapi merupakan produk samping melalui reaksi kimia dalam menghasilkan amonium (Rusmana 2003a). Bagan proses reaksi kimia reduksi nitrat ke amonium dapat ditunjukkan pada Gambar 3.
Pada kelompok bakteri DNRA terjadi dua tahap reaksi enzimatik yaitu tahap pertama oleh enzim Nap dan Nar seperti pada bakteri dinitrifikasi. Patereu et al.
(1994) menyatakan bahwa ada dua tipe enzim yang mereduksi nitrat menjadi nitrit yaitu nitrat reduktase yang terdapat pada membran (Nar) dan nitrat reduktase yang terdapat pada periplasmik (Nap). Enzim Nar aktivitasnya berhubungan langsung dengan proses respirasi pembentukan ATP yang dapat dipengaruhi oleh konsentrasi oksigen dimana oksigen menghambat sistem transpor nitrat. Enzim Nap yang mereduksi nitrat dalam periplasma tidak sensitif terhadap oksigen. Enzim Nar yang terdapat di membran plasma mempunyai transmembran proton motive force (PMF) tempat terjadinya sintesis ATP (Moreno- Vivianet.al 1999).
Demikian pula menurut Carteret al. (1995) reduksi nitrat dalam periplasma tidak sensitif terhadap hambatan oksigen. Oleh karena itu, nitrat reduktase periplasmik berhubungan dengan kemampuan untuk respirasi nitrat dalam ketersediaan oksigen pada spesies laboratorium. Oksidasi quinol oleh nitrat reduktase periplasmik tidak terpusat untuk menghasilkan gradien proton elektrokimia, tetapi cukup bertindak sebagai katup untuk membantu keseimbangan regulasi reaksi redoks dan mempertahankan jalannya rantai respirasi aerobik.
Gambar 3 Bagan pembentukan N2O pada reduksi nitrat oleh bakteri DNRA (Darjamurni 2003) NH4+ NH2OH NOH N2O2H2 NO NO3- NO2 -N2O
Sitoplasma Periplasma NO2 -NO3 -NarI NarH NarG NapC NrfC NrfB NH4+ NO2 -NrfA NO3- NO2 -NO3- NO2 -Membran plasma NirD NirB NH4+ NO2 -NO3 -NO2 -NapB NapA NrfD NrfB NrfC
Enzim Nap merupakan komplek dari dua sub unit protein. Sub unit Nap A mengikat kofaktor Molibdenum (Mo) sebagai sisi aktif dari enzim. Sub unit Nap B mempunyai dua situs ikatan heme C yang memiliki perbedaan potensial. Nap C merupakan sitokrom tipe tetraheme C, berperan dalam transfer elektron antara Quinol dan Nap AB (Richardson 2000).
Reaksi enzimatik tahap kedua yaitu perubahan nitrit menjadi amonium oleh enzim Nir B yang aktivitasnya bergantung pada NADH sitoplasma sebagai donor elektron (Harbone et al. 1992) dan enzim Nrf yang aktivitasnya bergantung pada format sebagai donor elektron (Cole 1996). Dalam Richardson (2000) kinerja enzim pereduksi nitrat menjadi amonium disimilatif digambarkan sebagai berikut (Gambar 4).
Ketersediaan oksigen di lingkungan pada bakteri nitrat amonifikasi disimilatif diantaranya berkaitan erat dengan sistem sensor regulator sebagai mikroorganisme anaerob fakultatif. Kelompok bakteri DNRA memiliki kemampuan adaptasi dari aerob ke anaerob atau sebaliknya. Oksigen merepresi sintesis reduktase anaerob, sebaliknya pada kondisi oksigen terbatas akan merepresi sintesis ketoglutarat dehidrogenase. Hal ini mengakibatkan perubahan Gambar 4 Enzim pereduksi nitrat bakteri nitrat amonifikasi disimilatif
kondisi jalur asam sitrat dari siklus TCA oksidatif menjadi non siklus/ reduktif (White 1995).
Pada White (1995) dijelaskan bahwa pergantian respirasi oksidatif dan reduktif Escherichia coli sebagai salah satu bakteri DNRA diatur oleh tiga sistem, yaitu sistem Arc (Aerobic respiration control), sistem Nar (Nitrat
anaerobic respiration) dan sistem Fnr. Sistem Arc merupakan sistem dua
komponen. Sistem ini merepresi gen-gen aerob berupa enzim-enzim siklus asam sitrat, piruvat dehidrogenase, asam lemak oksidase, dan sitokrom oksidase. Selain itu sistem Arc menginduksi gen-gen mikroaerob (sitokrom d oksidase dan sintesis kobal alamin).
Sistem Nar terdiri dari 3 protein yaitu Nar X, Nar L dan Nar Q. Sistem ini juga merupakan sistem dua komponen, Nar X berperan sebagai histidin kinase, sedangkan Nar L sebagai protein regulator respons. Sistem ini menginduksi sintesis transkripsi gen nitrat reduktase dan menghambat gen fumarat reduktase serta gen aerobik lainnya. Penelitian selanjutnya diketahui bahwa Nar Q juga berperan sebagai penerima sensor (White 1995 ; Purwoko 2007).
Sistem Fnr merupakan sistem tunggal yang berperanan pada kondisi anaerob. Protein Fnr berperan sebagai regulator positif untuk transkripsi gen-gen dalam pertumbuhan anaerob dan regulator negatif untuk transkripsi gen-gen pertumbuhan aerob (White 1995 ; Purwoko 2007).
METODE PENELITIAN
Waktu dan Tempat penelitian
Penelitian ini dilaksanakan pada bulan Oktober 2008 sampai Maret 2009. Tempat penelitian di Laboratorium Mikrobiologi Departemen Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Bahan Penelitian
Isolat yang digunakan dalam penelitian ini adalah bakteri nitrat amonifikasi disimilatif (DNRA) koleksi Laboratorium Mikrobiologi Departemen Biologi, FMIPA IPB Bogor. Isolat merupakan bakteri terpilih dari penelitian sebelumnya hasil isolasi dari muara Sungai Cimandiri Pelabuhan Ratu Sukabumi Jawa Barat
dan muara Sungai Cisadane Tangerang Banten. Kode isolat dari muara Sungai Cimandiri adalah FR1 dan FR2 (Marnis 2008). Kode isolat dari muara Sungai Cisadane HF7 dan LF6 (Syahputra 2007).
Konfirmasi dan Peremajaan Isolat.
Peremajaan isolat murni dimulai dengan konfirmasi kemurnian isolat menggunakan media padat, dilanjutkan dengan peremajaan isolat murni pada media cair. Komposisi media cair adalah: 10 g Natrium asetat, 4,2 g NaNO3, 3,0 g yeast ekstrak, 0,5 g (NH4)2SO4,0,9 g K2HPO4.3 H2O, 0,5 g MgSO4.7H2O, 0,2 g KH2PO4, 0,1 g CaCl2.2H2O dengan salinitas 2% dan pH 7 (Rodina 1972). Media padat dibuat sama dengan media cair ditambah agar bacto 20 g per liter. Media disterilisasi pada suhu 1210C tekanan udara 1 atmosfer selama 15 menit.
Konfirmasi kemurnian isolat dilakukan dengan cara diinokulasikan masing-masing isolat murni bakteri nitrat amonifikasi disimilatif dengan metoda cawan gores pada medium agar, kemudian diinkubasikan selama 7 hari. Karakterisasi dan morfologi sel tiap isolat dilakukan dengan teknik pewarnaan gram (Hadioetomo 1993).
Konfirmasi kemurnian isolat secara fisiologi dilakukan dengan uji fermentatif. Keempat isolat ditumbuhkan pada medium glukosa dengan indikator
brom cressol purple. Isolat diletakkan pada tabung bertutup untuk membatasi masukan oksigen. Uji ini dilakukan untuk melihat kemampuan fermentasi dari tiap isolat. Perubahan warna ungu menjadi kuning menunjukkan isolat tersebut melakukan fermentasi, jika tidak terjadi perubahan warna bukan kelompok bakteri fermentatif. Peremajaan bakteri pada medium cair dilakukan dengan cara diinokulasikan 1 lup tiap isolat pada medium cair masing-masing sebanyak 20 ml kedalam botol yang berukuran 100 ml. Inkubasi dilakukan selama 24 jam Tahap selanjutnya masing-masing isolat diambil 1 ml dimasukkan ke medium 50 ml untuk perbanyakan inokulan dan diinkubasikan selama 24 jam.
Seleksi Aktivitas Reduksi Nitrat pada Konsentrasi Oksigen (O2) yang Berbeda
Pengukuran aktivitas reduksi nitrat pada konsentrasi oksigen berbeda dilakukan pada botol serum steril 75 ml yang ditutup dengan butyl rubber septum. Pengkondisian konsentrasi oksigen dengan pengaturan volume saturasi udara padahead space botol serum.
Botol serum steril volume 75 ml diisi dengan 23 ml medium cair. Botol dibuat kondisi an aerobik dengan cara menghilangkan oksigen yang terdapat di dalam botol. Gas nitrogen bebas oksigen dialirkan ke dalam botol reaksi dengan menggunakan jarum/syringe steril selama 15 menit. Sebelum gas dimasukkan, gas terlebih dahulu disaring dengan filter steril diameter 47 mm dengan ukuran 0,45 mikro meter.
Langkah berikutnya, saturasi udara pada masing-masing botol dikondisikan menjadi 0%, 1%, 10%, 30%, 50%, 80%, dan 100%. Saturasi udara dimasukkan pada masing-masing botol serum yang telah diberi perlakuan pembebasan oksigen sebanyak 0,5 ml, 5 ml, 15 ml, 25 ml, dan 40 ml. Pada waktu proses pemasukan saturasi udara, gas nitrogen akan terdorong keluar melalui jarum yang dipasang pada tutup botol disampingsyringe, sehingga volume saturasi udara pada masing-masing botol menjadi 1%, 10%, 30%, 50%, 80%. Pengkondisian saturasi udara 100% dilakukan dengan tanpa memasukkan gas nitrogen murni pada botol serum. Kondisi saturasi udara 0% dengan pengisian gas nitrogen murni tanpa memasukkan saturasi udara.
Seluruh botol serum yang telah dikondisikan saturasi udaranya dikocok untuk melarutkan gas perlakuan. Masing-masing botol serum diinokulasi dengan 1 ml isolat. Isolat diletakan pada inkubator berpenggoyang pada kecepatan 80 rpm suhu ruang (28-31)oC selama 96 jam (Suet al. 2001).
Setelah diinkubasi pada kadar oksigen yang berbeda, dilakukan pengukuran densitas sel dengan spektrofotometer pada panjang gelombang 620 nm. Kultur biakan bakteri diambil sebanyak 1ml pada tabung efendorf dan disentrifugasi dengan kecepatan 4000 rpm selama 15 menit untuk mendapatkan supernatan. Supernatan dari kultur biakan dianalisis kandungan nitrit, nitrat dan amonium.
Analisis nitrit.
Analisis Nitrit menggunakan metode Sulfanilamide (Cleseri et al 1989). Nitrit dengan amina aromatik pada sulfalinamide akan membentuk diazonium. Senyawa tersebut dengan NED (N-I-Naphtyl Ethylene Diamine Dyhidrochloride) membentuk gugus kromofor yang berwarna merah muda (Lampiran 1) dan dapat diukur dengan spektrofotometer pada panjang gelombang 540 nm. Kadar nitrit ditentukan dengan cara memasukkan 5 ml sampel yang telah diencerkan kedalam tabung reaksi, ditambahkan 0,1 sulfanilamid (C6H8N2O2S) dan 0,1 NED. Kemudian diukur absorbansinya dengan spektrofotometer pada panjang gelombang 540 nm. Kurva standar natrium nitrit (NaNO2) dengan konsentrasi sebesar : 0 ; 0,2; 0,4; 0,6; 0,8 , dan 1,0 mg/l kemudian dikonversi ke mM digunakan untuk menentukan kadar nitrit pada sampel (Lampiran 2).
Analisis nitrat
Analisis senyawa nitrat dengan menggunakan metode Greenberg et al
(1992). Kadar nitrat ditentukan dengan cara memasukkan 20 ml sampel yang telah diencerkan ke dalam kolom reduksi yang berisi cadmium. Pada saat sampel melewati kolom reduksi, cadmium akan mereduksi nitrat menjadi nitrit. Sampel sebanyak 5 ml direaksikan dengan reagen pada analisis nitrit. Sampel akan menunjukkan perubahan warna merah muda (Lampiran 1), diukur pada panjang gelombang 540 nm. Kurva standar natrium nitrit (NaNO2) dengan konsentrasi sebesar : 0 ; 0,2; 0,4; 0,6; 0,8; dan 1,0 mg/l, kemudian dikonversi ke mM digunakan untuk menentukan kadar nitrit pada sampel. Nilai konsentrasi nitrat adalah hasil pengurangan antara konsentrasi nitrit yang dilewatkan pada kolom reduksi dengan konsentrasi nitrit yang tidak dilewatkan.
Analisis amonium
Pengukuran konsentrasi amonium menggunakan metode phenate (Cleseriet al. 1989). Kadar amonium ditentukan dengan cara 5 ml sampel yang diencerkan , dimasukkan kedalam tabung reaksi, ditambahkan 0,2 ml larutan fenol alkohol (C6H5OH) lalu dihomogenkan, diamkan selama 1 menit lalu tambahkan 0,2 ml Na-Dihidro Nitroprusid (Na2[Fe(CN)NO]2.H2O), kemudian ditambahkan 0,5 ml larutan oksidan yang terdiri dari Natrium Sitrat (C6H5Na3O7.2H2O) dan Natrium
hipoklorit (NaOCl2) dan dibiarkan selama satu jam pada suhu ruang (28-31)o C. Sampel yang telah diberi larutan indikator menunjukkan perubahan warna hijau sampai biru (Lampiran 1), diukur dengan spektrofotometer pada panjang gelombang 640 nm. Kurva standar amonium klorida (NH4Cl) sebesar: 0 ; 0,2; 0,4; 0,6; 0,8 ; 1,0; 2,0; 4,0; dan 8,0 mg/l kemudian dikonversi ke mM digunakan untuk menghitung konsentrasi amonia pada sampel (Lampiran 2).
Perhitungan Pembentukan Gas.
Setelah konsentrasi nitrat (NO3-), nitrit (NO2-), dan amonium (NH4+) diketahui dari masing-masing sampel, dihitung jumlah nitrat yang tereduksi dengan rumus :
[NO3-]tereduksi = [NO3-]kontrol – [NO3-]inokulasi % [NO3-] tereduksi = [NO3-]red x 100 [NO3-]kontrol
Jumlah senyawa nitrit yang terbentuk dihitung dengan rumus sebagai berikut: [NO2-]terbentuk = [NO2-]perlakuan – [NO2-] kontrol
%[NO2-]terbentuk = [NO2-]perlakuan – [NO2-] kontrol x 100 [NO3-]tereduksi
Jumlah senyawa amonium yang terbentuk dihitung dengan rumus sebagai berikut: [NH4+]terbentuk = [NH4+]perlakuan – [NH4+] kontrol
% [NH4+]terbentuk = [NH4+]perlakuan – [NH4+] kontrol x 100 [NO3-]tereduksi
Estimasi produk akhir gas yang terbentuk dihitung dengan rumus [Gas ] = [NO3-]reduksi – [NO2-]terbentuk– [NH4+]terbentuk %[ Gas] = [Gas] X 100%
[NO3-]tereduksi
Keterangan : Konsentrasi nitrat kontrol didapatkan dari sediaan medium steril tanpa bakteri .
Kinetika Aktivitas Reduksi Nitrat Isolat Terpilih
Dua isolat terbaik dalam mereduksi nitrat dan responsif terhadap oksigen dipilih untuk diamati kinetikanya. Botol serum steril volume 125 ml diisi dengan 50 ml medium cair. Sebanyak 1 ml isolat diinokulasikan pada tiap botol yang telah dikondisikan saturasi udaranya secara berurutan masing-masing 1 %, 10%, 100%. Kultur biakan diinkubasikan pada suhu ruang (28-31)oC selama 96 jam (Su et al 2001). Kultur biakan diamati pola pertumbuhannya dan dianalisis konsentrasi nitrat, nitrat, dan amonium dengan metoda yang telah diuraikan sebelumnya. Analisis dilakukan setiap selang waktu 12 jam selama 96 jam (4 hari).
Hasil pertumbuhan digambarkan pada suatu grafik pertumbuhan pada kondisi oksigen berbeda. Korelasi antara konsentrasi sel dengan kerapatan optis (OD) isolat, dilakukan metoda hitungan cawan (Lampiran 3) pada konsentrasi pengenceran 10-6, 10-7, 10-8, dan 10-9. Kultur biakan yang sama diencerkan dan OD dari beberapa pengenceran diukur. Kurva standar pertumbuhan dibuat dari nilai-nilai OD pengenceran dan konsentrasi sel sehingga didapatkan nilai regresi dan persamaan garis (Lampiran 4) untuk menentukan jumlah sel. Laju pertumbuhan spesifik maksimum didapatkan dengan mencari nilai regresi dan persamaan garis dari korelasi waktu inkubasi dengan nilai ln jumlah sel. Laju pertumbuhan maksimum merupakan koefisien variabel x pada persamaan garis Y= ax + c (Maieret al. 2000).
Hasil uji kimia digambarkan dalam suatu grafik yang menunjukkan hubungan lama inkubasi dengan nitrat tereduksi, nitrit, dan amonium serta estimasi gas N2O yang terbentuk pada setiap konsentrasi oksigen yang berbeda. Kecepatan reduksi setiap sel masing-masing isolat dihitung pada kondisi saturasi udara 1 %, 10% dan 100%.