KIMIA DASAR
MATERI 8 LARUTAN
Program Studi Teknologi Pangan/Teknik dan Manajemen Industri Fakultas Teknik
Universitas Pasundan
SILABUS
VI Pertemuan ke - 8 6 LARUTAN
a Larutan Elektrolit dan Non Elektrolit
b Definisi Larutan (termasuk zat terlarut dan pelarut) c Asam,Basa dan Garam
d Elektrolit Kuat e Elektrolit Lemah
f Derajat Dissosiasi/Iomisasi (α)
Larutan elektrolit
▪
LARUTAN adalah campuran homogen dua zat atau lebih yang saling melarutkan dan masing-masing zat penyusunnya tidak dapatdibedakan lagi secara fisik.
▪
Larutan terdiri atas zat terlarut (Solut) dan pelarut (Solven)▪
Berdasarkan daya hantar listriknya (daya ionisasinya), larutan dibedakan dalam dua macam, yaitu1.
larutan elektrolit dan2.
larutan non elektrolit.•
Larutan elektrolit adalah larutan yang dapat menghantarkan arus listrik.Larutan Elektrolit
Larutan yang dapat menhantarkan arus listrik
Larutan elektrolit
Kuat
Larutan Elektrolit LemahLarutan yang zat terlarutnya terionisasi sempurna menjadi
ion-ion yang dapat
menghantarkan arus listrik.
Larutan yang zat terlarutnya
terionisasi sebagian menjadi ion-ion yang dapat menghantarkan arus
listrik.
Larutan yang dapat menhantarkan arus listrik
Larutan Elektrolit
Larutan elektrolit
Kuat Larutan Elektrolit
Lemah
Ciri-ciri (jika menggunakan alat uji elektrolit)
Contoh Ciri-ciri (jika
menggunakan alat uji elektrolit)
Contoh
1. Gelembung gas pada elektrode banyak.
2. Nyala lampu terang atau redup.
1. Gelembung gas pada elektrode sedikit.
2. Lampu mati.
Larutan
Garam Dapur (NaCl) Air aki (H2SO4)
dst.
Larutan cuka (CH3COOH)
Air sumur dst.
Rangkaian alat penguji elektrolit seperti gambar di bawah ini
Elektrolit Kuat Elektrolit Lemah Non Elektrolit
• terionisasi sempurna
• menghantarkan arus listrik
• lampu menyala terang
• terdapat gelembung gas
• terionisasi sebagian
• menghantarkan arus listrik
• lampu menyala redup
• terdapat gelembung gas
• tidak terionisasi
• tidak menghantarkan arus listrik
• lampu tidak menyala
• tidak terdapat gelembung gas
LARUTAN ELEKTROLIT
• Larutan elektrolit, adalah larutan yang dapat menghantarkan arus listrik.
• Mengapa larutan elektrolit dapat menghantarkan arus listrik?
• Dijelaskan oleh Svante August Arrhenius dari Swedia (1887),menggunakan Teori Ionisasi.
• Teori Ionisasi “zat-zat elektrolit jika dilarutkan dalam air akan terurai menjadi ion positif (kation) dan ion negatif (anion)”.
• Menurut Arrhenius: “Larutan elektrolit dapat menghantarkan arus listrik karena mengandung ion-ion yang bergerak bebas”.
• Larutan non elektrolit adalah larutan yang tidak dapat menghantarkan arus listrik.
• Mengapa larutan non elektrolit tidak dapat menghantarkan arus listrik?
• Zat nonelektrolit dalam larutan tidak terurai menjadi ion-ion tetapi tetap berupa molekul
Larutan ini dibedakan atas
:1.
ELEKTROLIT KUATLarutan elektrolit kuat adalah larutan yang mempunyai daya hantar listrik yang kuat, karena zat terlarutnya didalam pelarut (umumnya air), seluruhnya berubah menjadi ion-ion (alpha = 1).
Yang tergolong elektrolit kuat adalah:
a. Asam-asam kuat: HCl, HCl03, H2SO4, HNO3 dan lain-lain.
b. Basa-basa kuat, yaitu basa-basa golongan alkali dan alkali tanah, seperti: NaOH, KOH, Ca(OH)2, Ba(OH)2 dan lain-lain.
c. Garam-garam yang mudah larut, seperti: NaCl, KI, Al2(SO4)3 dan lain-lain
2.
ELEKTROLIT LEMAHLarutan elektrolit lemah adalah larutan yang daya hantar listriknya lemah dengan harga derajat ionisasi sebesar:
O < alpha < 1.
Yang tergolong elektrolit lemah:
a. Asam-asam lemah, seperti : CH
3COOH, HCN, H
2CO
3, H
2S dan lain-lain
b. Basa-basa lemah seperti : NH
4OH, Ni(OH)
2dan lain-lain
c. Garam-garam yang sukar larut, seperti : AgCl,BaSO
4,CaCrO
4, PbI
2dan lain-lain
Larutan non elektrolit adalah larutan yang tidak dapat
menghantarkan arus listrik, karena zat terlarutnya di dalam pelarut tidak dapat menghasilkan ion-ion (tidak mengion).
Tergolong ke dalam jenis ini misalnya:
- Larutan urea
- Larutan sukrosa - Larutan glukosa
- Larutan alkohol dan lain-lain
Gambaran Bentuk Molekul Elektrolit Kuat dan Elektrolit Lemah
Jenis Larutan Sifat dan Pengamatan Lain Contoh Senyawa Reaksi Ionisasi Elektrolit Kuat • Terionisasi sempurna
• Menghantarkan arus listrik
• Lampu menyala terang
• Terdapat gelembung gas
HCL,H2SO4, NaOH,
Ba(OH)2, NaCl,KCl
HCl → H+ + Cl- H2SO4 → 2H+ + so4=
NaOH → Na+ + OH- Ba(OH)2 → Ba2+ + 2OH- NaCL →Na+ + Cl-
KCl → K+ + Cl-
Elektrolit Lemah • Terionisasi sebagian
• Menghantarkan arus listrik
• Lampu menyala redup
• Terdapat gelembung gas
CH3COOH,HCN, NH4OH,Al(OH)3
CH3COOH H+ + CH3COO- HCN H+ + CN-
NH4OH NH4++ OH Al(OH)3 Al 3+ + 3OH-
Larutan Non Elektrolit
Larutan yang tidak dapat menghantarkan arus listrik
Ciri-ciri (jika menggunakan alat
uji elektrolit) Contoh :
1. Gelembung gas tidak ada.
2. Lampu mati.
Larutan gula Larutan alkohol
Dst.
Larutan Non Elektrolit
Larutan non-elektrolit adalah larutan yang
tidak dapat menghantarkan arus listrik, hal ini disebabkan karena larutan tidak dapat
menghasilkan ion-ion (tidak meng-ion).
Yang termasuk dalam larutan non elektrolit antara lain :
* Larutan urea
* Larutan sukrosa
* Larutan glukosa
* Larutan alkohol dan lain-lain
Perbandingan sifat-sifat
larutan elektrolit dan larutan non elektrolit
Reaksi Ionisasi
larutan elektrolit dapat menghantarkan arus listrik disebabkan penguraian zat menjadi ion-ion penyusunnya (proses ionisasi) dalam pelarut air.
A.
Reaksi Ionisasi Elektrolit Kuat dan Elektrolit LemahJenis dan konsentrasi (kepekatan) suatu larutan dapat berpengaruh terhadap daya hantar listriknya.
Untuk menunjukkan kekuatan elektrolit digunakan derajat ionisasi.
Makin besar harga α , makin kuat elektrolit tersebut.
1. Reaksi Ionisasi Elektrolit Kuat
Umumnya elektrolit kuat adalah larutan garam.
Dalam proses ionisasinya, elektrolit kuat
menghasilkan banyak ion maka a= 1 (terurai
senyawa), pada persamaan reaksi ionisasi elektrolit
kuat ditandai dengan anak panah satu arah ke kanan .
Elektrolit kuat ada beberapa dari asam dan basa.
Contoh :
NaCl (aq) Na
+(aq) + Cl
-(aq) KI (aq) K
+(aq) + I
-(aq)
Ca(NO
3)
2(g) Ca
2+(aq) + NO
3-(aq)
Kation dan anion yang dapat membentuk elektrolit kuat.
Kation : Na
+, L
+, K
+, Mg
2+ , Ca
2+, Sr
2+, Ba
2+Anion : Cl
-, Br
-, I
-, SO
42-, NO
3-, ClO
4-, HSO
4-2. Reaksi Ionisasi Elektrolit Lemah
• Larutan. Yang mempunyai á < 1 (derajat ionisasi) kecil,karena sedikit larutan yang terurai (terionisasi).
• Makin sedikit yang terionisasi, makin lemah elektrolit tersebut.
• Dalam persamaan reaksi ionisasi elektrolit lemah ditandai dengan panah dua arah (bolak-balik) artinya tidak semua molekul terurai (ionisasi tidak sempurna)
Contoh :
CH
3COOH(aq) CH
3COO
-(aq) + H
+(aq)
NH
4OH(g) NH
4+(aq) + OH
-(aq)
Derajat Ionisasi
• Banyak atau sedikitnya molekul zat yang terionisasi dinyatakan dalam derajat ionisasi.
• Derajat ionisasi ( α) merupakan perbandingan
banyaknya molekul zat yang terurai dengan banyaknya molekul zat mula-mula.
α = 1, elektrolit kuat
0 < α < 1, elektrolit lemah
α = 0, non elektrolit
Derajat Ionisasi
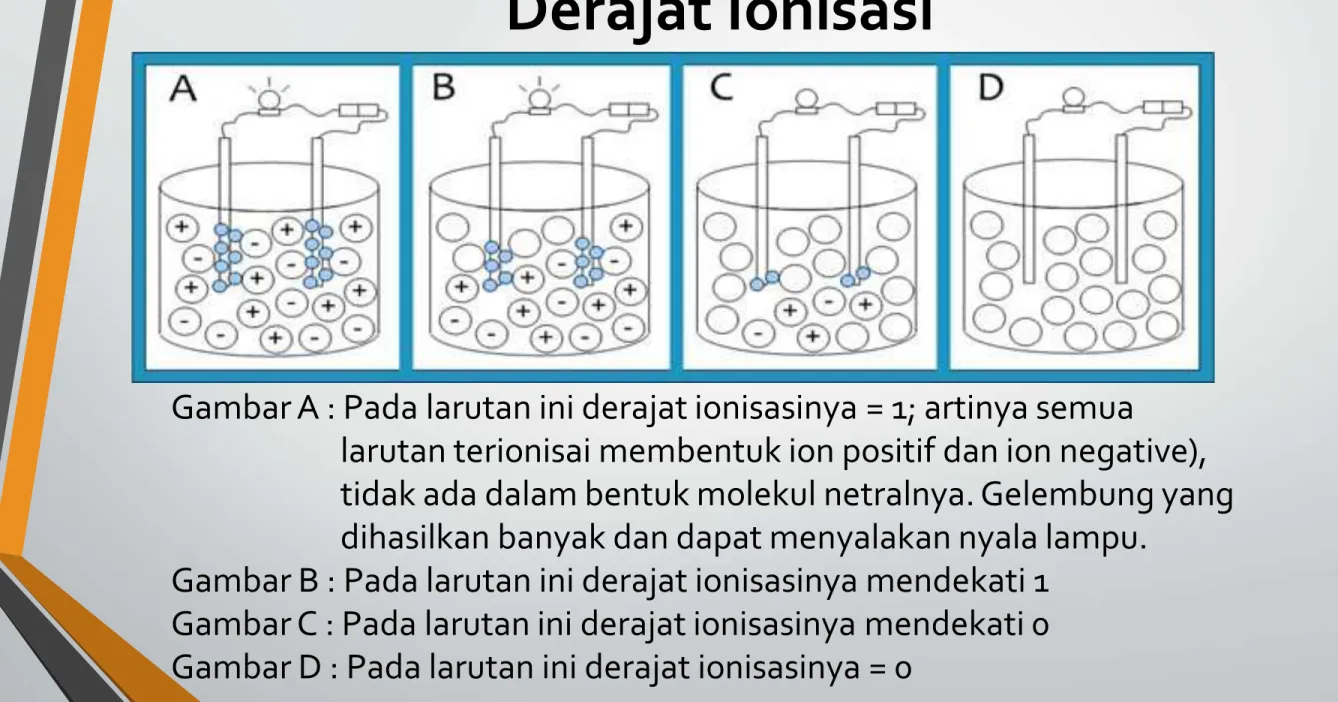
Gambar A : Pada larutan ini derajat ionisasinya = 1; artinya semua
larutan terionisai membentuk ion positif dan ion negative), tidak ada dalam bentuk molekul netralnya. Gelembung yang dihasilkan banyak dan dapat menyalakan nyala lampu.
Gambar B : Pada larutan ini derajat ionisasinya mendekati 1 Gambar C : Pada larutan ini derajat ionisasinya mendekati 0 Gambar D : Pada larutan ini derajat ionisasinya = 0
Derajat Ionisasi
Derajat Ionisasi
Derajat Ionisasi
Derajat Ionisasi
Hubungan Keelektrolitan dengan Ikatan Kimia
A. Senyawa Ion
•
Senyawa ionik tersusun atas ion-ion sekalipun dalam bentuk padat atau kering.•
Senyawa-senyawa ionik dalam keadaan padat tidak dapat menghantarkan arus listrik karena ion-ion yang terikat dengan kuat.•
Namun apabila senyawa ionik dilarutkan dalam pelarut polar misalnya air, maka senyawa ionik adalah suatu elektrolit. Hal ini disebabkan ion-ion yang awalnya terikat kuat pada kisi terlepas kemudian segera masuk danmenyebar dengan air sebagai medium untuk bergerak.
Hubungan Keelektrolitan dengan Ikatan Kimia
B. Senyawa Kovalen Polar
• Senyawa kovalen polar merupakan sumber larutan ion, sebab jika dilarutkan didalam air maka senyawa kovalen polar akan terurai menjkadi ion- ion.
• Ini disebabkan oleh ikatan kovalen pada senyawa tersebut mudah
terputus dalam pelarut air sehingga menghasilkan ion- ion.
Contoh soal:
Bila diketahui suatu reaksi sebagai berikut:
CH
3COOH CH
3COO¯ + H
+Dari reaksi di atas tentukan derajat ionisasinya, bila mula-mula 2 mol asam asetat dilarutkan dalam air dan menghasilkan ion H
+sebanyak 0,5 mol.
Jawab :
Derajat ionisasinya adalah: