BAB 2
TINJAUAN PUSTAKA
2.1. Oleokimia
Oleokimia pada dasarnya merupakan cabang ilmu kimia yang mempelajari trigliserida yang berasal dari minyak dan lemak menjadi asam lemak dan gliserin serta turunan asam lemak baik dalam bentuk ester, amida, sulfat, sulfonat, alkohol, alkoksi maupun sabun. Beberapa produk oleokimia dapat dihasilkan dari petrokimia yang merupakan oleokimia sintetik, misalnya alkohol asam lemak dapat diperoleh dari etilen dan gliserol dari propilen, sedangkan yang dimaksud dengan oleokimia alami merupakan turunan dari lemak dan minyak. Produk petrokimia dari industri olefin seperti propilena dapat diubah menjadi gliserol, demikian juga etilena secara reaksi Ziegler Natta diubah menjadi alkohol asam lemak (Richtler dan Knaut, 1984).
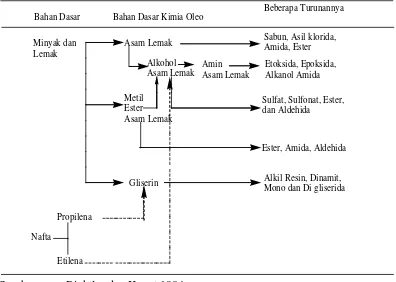
Hasil olahan oleokimia dapat dibagi 2 bagian, yakni : a) bahan dasar oleokimia dan b) turunan oleokimia. Gambaran perubahan oleokimia tersebut dari bahan dasar sampai menjadi oleokimia dan turunan oleokimia seperti berikut pada tabel di bawah (Richtler,dan Knaut, 1984).
Tabel 2.1. Diagram Alir Oleokimia
Bahan Dasar Bahan Dasar Kimia Oleo Beberapa Turunannya Minyak dan
Lemak
Nafta
Asam Lemak
Metil Ester Asam Lemak
Gliserin Alkohol
Asam Lemak Amin Asam Lemak
Sabun, Asil klorida, Amida, Ester Etoksida, Epoksida, Alkanol Amida Sulfat, Sulfonat, Ester, dan Aldehida
Ester, Amida, Aldehida Alkil Resin, Dinamit, Mono dan Di gliserida Propilena
Etilena
Sumber : Richtler dan Knaut,1984 : Alami
: Sintesis
Reaksi-reaksi yang banyak digunakan dalam oleokimia antara lain safonifikasi, esterifikasi, klorinasi, amidasi, aminasi, oksidasi, reduksi, hidrogenasi, sulfasi, sulfonasi, epoksidasi dan sebagainya. Reaksi-reaksi tersebut melibatkan bahan baku lemak atau minyak alami serta propilena dan etilena dalam produk petrokimia (Richtler dan Knault, 1984).
Polivinil asetat, maupun Fenolat. Sebagai slip agent dan pelumas pada bahan resin dapat digunakan amida primer maupun metil – cis – amida serta amida sekunder (Reck, 1985).
2.2. Esterifikasi
Secara umum, reaksi esterifikasi untuk menghasilkan senyawa ester melalui reaksi antara asam karboksilat dengan alkohol berlangsung melalui beberapa tahap reaksi, yang dapat diterangkan sebagai berikut (Fessenden,1990): 1. Oksigen karbonil dari asam karboksilat diprotonisasi oleh asam. Disini terjadi
transfer proton dari katalis asam ke atom oksigen karbonil, sehingga meningkatan elektrofisilisitas dari atom C dari gugus karbonil.
R C
2. Alkohol nukleofilik menyerang karbon positif, dimana atom karbon karbonil kemudian diserang oleh atom oksigen dari alkohol, yang bersifat nukleofilik sehingga terbentuk ion oksonium. Terjadinya pelepasan proton dari gugus hidroksil milik alkohol, menghasilkan kompleks teraktivasi.
3. Protonisasi terhadap salah satu gugus hidroksil yang diikuti oleh pelepasan molekul air menghasilkan ester (eleminasi molekul air diikuti penarikan H+ dan H2O).
- H2O
Gambar 2.1. Mekanisme esterifikasi asam karboksilat dengan metanol (Fessenden,1990)
Pembuatan metil ester asam lemak juga dapat dilakukan dengan reaksi interesterifikasi. Sebenarnya reaksi interesterifikasi yang terjadi pada perubahan trigliserida menjadi metil ester asam lemak dalam penggunaan metanol berlebihan yang alkalis (menggunakan basa (NaOH, CH3ONa) merupakan suatu pembenaran dari konsep HSAB, dimana hard acid (HA) lebih senang terikat dengan hard base
(HB), sebaliknya soft acid (SA) dengan soft base (SB).
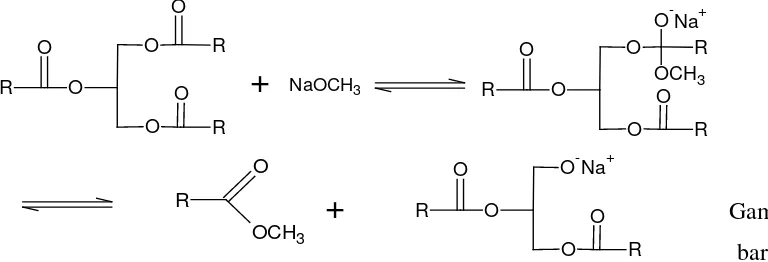
Dengan konsep HSAB tersebut lebih mudah menjelaskan reaksi interesterifikasi dari perubahan trigliserida menjadi metil ester asam lemak yang ditawarkan hamilton mekanisme reaksinya sebagai berikut (Hamilton, 1990).
Gam bar 2.2. Mekanisme Reaksi Interesterifikasi (Hamilton, 1990)
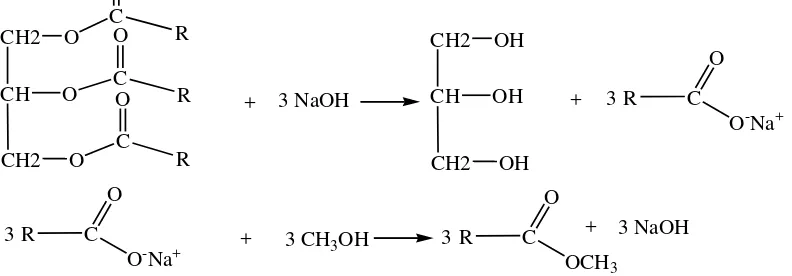
Secara mendasar memang reaksi interesterifikasi terjadi dikarenakan modifikasi gugus terdesak gliseroksi dengan penggunaan gugus pengganti metoksi yang berasal dari penggunaan pelarut metanol dalam suasana alkalis seperti yang ditawarkan pada mekanisme reaksi di atas. Dasar konsep pemikiran tersebut telah banyak diteliti pengaruh berbagai jenis katalis basa yang berbeda nukleofilisitasnya dalam berbagai jenis pelarut semenjak tahun 1954 sampai 1990 pada reaksi oleokimia (Ho, 1977). Akan tetapi sebenarnya lebih mudah menjelaskan konsep tersebut berdasarkan konsep HSAB. Oleh karena itu secara hipotesis tetap dianggap pada reaksi transesterifikasi terjadi reaksi penyabunan
yang diikuti segera oleh reaksi esterifikasi antara garam asam organik yang terbentuk dengan pelarut metanol. Hal ini dapat terjadi dikarenakan Na+ lebih
hard acid daripada asil (R─CH2─CO+) dan demikian juga OH- lebih
hard base daripada metoksida (CH3O-) sehingga segera terbentuk metil ester dan NaOH kembali.
Gambar 2.3. Pembentukan Metil Ester Melalui Reaksi Saponifikasi dan Esterifikasi (Ho, 1977)
Berdasarkan konsep HSAB tersebut juga terdapat dijelaskan perubahan langsung metil ester asam lemak secara reaksi aminasi menjadi turunan amidanya (Brahmana (II), 1998). Penggunaan konsep HSAB dalam reaksi oleokimia akan menyederhanakan tahapan reaksi serta sekaligus lebih efisien dan efektif dari sudut pandang industri kimia.
2.3 Ester Asam Lemak
Yang dikelompok sebagai ester asam lemak meliputi :
a. Ester karboksilat tunggal dengan panjang rantai karbon dari C6 sampai dengan C20
b. Ester asam lemak yang hanya mengandung karbon, nitrogen dan oksigen c. Ester alkohol dari asam lemak tersebut di atas termasuk juga dalam kelompok
ester asam lemak.
Henkel, 1984). Jadi dalam hal ini lilin yang merupakan ester asam lemak alami yang dikelompokkan sebagai ester asam lemak.
Ester asam lemak dalam garis besarnya terbagi atas (Meffert and Henkel, 1984) : a. Ester asam lemak dengan poliol
b. Etoksilat asam lemak dan ester c. Ester alkohol tunggal
Ester asam lemak dengan poliol meliputi ester dari etilena glikol, gliserol, neopentilol maupun karbohidrat. Ester glikol pada umumnya merupakan ester etilena glikol stearat yang banyak digunakan dalam industri kosmetik, dan juga digunakan untuk menstabilkan pemantapan o/w maupun w/o (Meffert and Henkel, 1984). Sedangakan ester gliserol asam lemak, adalah campuran utama monoester dan diester serta dalam jumlah kecil dari C12-18 digunakan secara luas sebagai bahan pemantap o/w pada bahan makanan dan kosmetik (De Navarre, 1962).
Pada proses pembuatan PVC digunakan ester gliserol monostearat dan monooleat sebagai pelumas dahil (internal lubricant) (Bhat, 1990). Ester monostearat gliserol memiliki pengaruh positif terhadap stabilitas termal PVC. Selanjutnya ester neopentilol asam lemak dari C6-10 digunakan secara luas pada jet pesawat sipil maupun militer. Malahan dijumpai sangat sesuai digunakan pada pesawat jet yang memiliki kecepatan 2 – 3 Mach. Juga digunakan pelumas yang stabil terhadap termal pada industri pembuatan serat filamen (Meffert and Henkel, 1984).
Bentuk etoksilasi monogliserida yang dikenal secara luas adalah ester sorbitol etoksilat yang digunakan secara luas sebagai bahan pemantap o/w pada proses pembuatan kosmetik. Sedangkan ester monoalkohol adalah ester dari C16-18 baik dengan metanol, 1- propanol, buatanol, oleil alkohol maupun stearil alkohol digunakan sebagai bahan pemantap w/o pada industri kosmetik, pelumas pada pembuatan tekstil maupun plastik (Meffert and Henkel, 1984).
Selanjutnya ester asam lemak yang banyak digunakan dalam industri oleokimia adalah metil ester. Metil ester yang dapat dibuat secara reaksi interesterifikasi dan saponifikasi yang diikuti esterifikasi dari minyak dan lemak baik yang berasal dari hewan dan tumbuh-tumbuhan, merupakan zat antara yang sangat penting dalam industri oleokimia. Telah banyak penelitian yang dikembangkan untuk meningkatkan hasil reaksi dengan menggunakan berbagai jenis katalis seperti asam sulfat, asam klorida, soda kaustik atau soda potash.
Juga diteliti efisiensi proses dalam industri oleokimia dengan cara membandingkan reaksi interesterifikasi dan esterifikasi. Ternyata reaksi interesterifikasi memberikan keuntungan lebih besar dibandingkan esterifikasi disebabkan perolehan gliserol pada proses pertama jauh lebih tinggi konsentrasinya dibandingkan proses kedua (Yamane and Miyawaki, 1990). Tetapi pada CPO yang mengandung karetenoid lebih menguntungkan melalui proses penyabunan yang diikuti esterifikasi.
Perbedaan hasil reaksi antara pembuatan metil ester asam lemak yang dibandingkan etil ester asam lemak yang menggunakan katalis asam sulfat juga telah diteliti. Ternyata pembuatan metil ester asam lemak jauh lebih efisien dibandingkan dengan etil ester (Ozgul and Turkay, 1993). Hal ini dapat dimengerti karena pengaruh perbedaan kerapatan elektron yang berbeda akibat bertambah panjangnya rantai hidrokarbon alkohol tersebut.
Pembuatan metil ester asam lemak telah dikembangkan dengan cara pengadukan kecepatan tinggi serta suhu kamar dengan waktu reaksi 15-30 menit serta memberikan hasil reaksi pembuatan metil ester asam lemak 90-95 % (Mittelbach and Tritthart, 1988).
Asam oleat (C18:1) yang dapat diperoleh dalam kadar kemurnian 99% dari biji pepaya (Carica papaya) dengan teknik isolasi fraksinasi penambahan urea (Bhat, 1990) ternyata juga banyak ditemukan pada alpokat, kemiri, biji karet disamping yang berasal dari minyak kelapa sawit dan kacang kedelai. Oleat tidak ekonomis ubtuk diproduksi pada industri oleokimia dengan menggunakan bahan baku dari produk petrokimia. Suatu hal menarik untuk dikaji secara bersama oleh peneliti dan praktis dari oleokimia, apa yang telah dilakukan Maycock di Malaysia dalam memanfaatkan fraksi sisa dari hasil pemisahan metil ester yang kaya akan kandungan oleat sebagai bahan bakar ketel (Maycock, 1986).
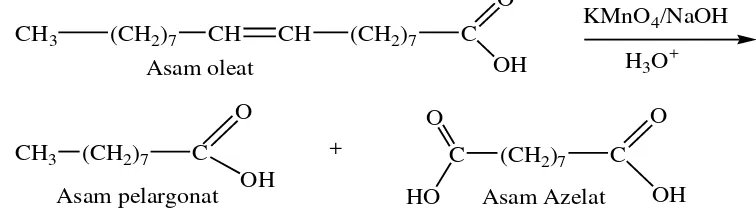
Oksdasi asam oleat dengan KMnO4 hasilnya bervariasi tergantung dari kondisi pada reaksi yang berlangsung.
1. Asam oleat dalam larutan alkali dingin (Ice cold) akan teroksidasi dengan cepat oleh larutan permanganat encer, sehingga menghasilkan asam dihidroksi stearat.
KMnO4/NaOH
CH
CH3 (CH2)7 CH (CH2)7 C
H2O Asam oleat
O
OH
CH
CH3 (CH2)7 CH (CH2)7 C
O
OH
OH OH
Gambar 2.4. Reaksi Oksidasi Asam Oleat dengan KMnO4 suasana basa (Ketaran, 1986)
Asam linoleat (2 ikatan rangkap) dan asam linolenat (3 ikatan rangkap) berturut – turut akan menghasilkan asam tetrahidroksi dan heksahidroksi tetapi dalam jumlah yang kecil.
2. Proses oksidasi asam hidroksi yang terkontrol akan menghasilkan asam ketohidroksi stearat dan diketostearat akhirnya dengan proses pemecahannya rantai karbon akan membentuk asam kaprilat, okasalat, dan suberat.
menghasilkan sejumlah kecil hasil antara yang merupakan persenyawaan asam lemak yang telah diadisi oleh oksigen pada ikatan rangkap (Ketaren, 1986).
+
H3O+
C (CH2)7 C
CH3 (CH2)7 C
Asam Azelat Asam pelargonat
KMnO4/NaOH
CH
CH3 (CH2)7 CH (CH2)7 C
Asam oleat
O
OH
O
OH O
HO O
OH
Gambar 2.5. Reaksi Pembuatan Asam Azelat dari Asam Oleat (Ketaren, 1986) Garvi dan Avni (1981) telah melaporkan bahwa oksidasi terhadap asam lemak tidak jenuh dengan berbagai agen pengoksidasi seperti kalium permanganat, kalium dikromat, asam kromat dan natrium hipoklorit. Oksidasi terhadap asam oleat dalam emulsi minyak dalam air pada suasana netral menghasilkan pembentukan dihidroksi ketodihidroksi dan asam diketo bersama dengan asam azelat dan asam pelargonat.
Reaksi kalium permanganat dalam suasana basa dengan asam risinoleat juga telah dilaporkan oleh Hill dan Me Ewen (1943) yang menghasilkan sekitar 34 % yield dari asam azelat. Disamping itu dengan menggunakan natrium hipoklorit, agen pengaktifan permukaan (surface – active agents) dan ruthenium klorida sebagai katalis bisa mencapai konvensi yang lebih tinggi dan mengurangi waktu reaksi jika dibandingkan dengan sistem tak teremulsi atau heterogen (Zaldman.et.al, 1998).
Asam azelat (asam 1,9 – nonanadioat) merupakan asam lemak dwibasa yang penting untuk berbagai aplikasi. Asam lemak tidak jenuh seperti asam oleat, linoleat maupun resinoleat dapat dioksidasi menjadi asam 1,9 – nonanadioat yang dikenal sebagai asam azelat dengan menggunakan oksidator seperti KMnO4, HNO3, K2Cr2O7 dan senyawa-senyawa peroksida. Pemakaian oksidator kalium permanganat memiliki keunggulan dibandingkan oksidator lainnya, karena dapat didaur ulang. (Brahmana (I), 1998).
hanya 0,2 % pada suhu 15 oC serta 2,2 % pada suhu 6,5 oC, akan tetapi larut sempurna pada 100 oC.
Penggunaan asam azelat secara komersial terbagi 3 bagian :
a. Diester dan poliester linear digunakan sebagai plastizer pembuatan polivinil klorida
b. Diester dipergunakan sebagai minyak pelumas mesin
c. Zat perantara dalam pembuatan polimer seperti poliamida (Nilon 9,9, poliester, poliuretan, benang dan resin).
Pada umumnya plastizer diester digunakan adalah isooktil dan 2 – etil – heksil – azelat. Dioktil azelat, didekil azelat, banyak digunakan dalam minyak pelumas dalam piston dan turbin mesin. Senyawa ini dipergunakan dalam pesawat terbang, karena pada suhu tinggi dia bersifat stabil dan viskositasnya rendah pada suhu rendah.
Asam azelat juga dapat dipergunakan dalam pembuatan suatu polimer nilon 9,9 yaitu dengan mereaksikan asam azelat dengan NH3 mengunakan katalisator P2O5 untuk menghasilkan 1,7 – disiano heptana yang selanjutnya direaksikan dengan H2 menghasilkan 1,9 – diamino yang selanjutnya direaksikan dengan asam azelat menghasilkan nilon 9,9. (Kandesch, 1979).
Gambar 2.6. Reaksi Pembuatan Nilon 9,9 (Kandesch, 1979)
Oksidasi asam oleat dapat menghasilkan sejumlah molekul monobasa yang ekuivalen secara bersama pada pembuatan asam azelat yaitu asam nonanoat yang secara umum dikenal sebagai asam pelargonat (Kandesch, 1979).
HOOC - (CH2)7 - COOH CN - (CH2)7 - CN
H2N - (CH2)7 - NH2
Asam azelat 1, 7 - disiano heptana
1,9 - Diaminnonana
n HOOC - (CH2)7 - COOH Asam azelat
+ n H2N - (CH2)7 - NH2 1,9 - Diaminnonana
(CH2)7 C O
C O
NH - (CH)7 - NH n nilon 9,9
Selanjutnya asam azelat dapat diendapkan dari filtrat yang disaring waktu panas apabila pH 3. Pada kondisi ini setelah didinginkan asam azelat akan mengendap. Asam azelat juga telah diproduksi secara komersial oleh Emerox di Ohio dengan proses ozonolisis asam oleat, diikuti dengan dekomposisi ozonida dengan oksigen (Johnson, 1984).
Asam azelat dapat diturunkan menjadi berbagai senyawa seperti amida azelat dimana dapat direduksi menjadi 1,9 – nonanadiamin dan 1,9 – nonanadiol. Asam azelat juga dapat ditransformasikan menjadi berbagai bentuk senyawa antara lain 1,9 – digliseril nonanadioat (Masmur, 2000) dan 1 – (propoksidioil – 2,3) – 9 – nonanol (Sulastri, 1999). Disamping itu juga digunakan luas sebagai plastizer dalam industri pembuatan resin. Asam azelat juga dapat dipakai sebagai bahan antara polimer untuk pembuatan poliamida, poliester dan perekat poliuretan (Johnson, 1984).
2.5. Reaksi Amidasi
Amida adalah turunan asam karboksilat yang paling tidak reaktif, karena itu golongan senyawa ini banyak terdapat di alam. Amida yang terpenting adalah protein. Amida diberi nama dengan menggantikan akhiran –at atau –oat dengan akhiran amida. Pada contoh – contoh dibawah ini nama IUPAC diberi tanda kurung (Hart, 1990).
H C
O
NH2 CH3 C
O
CH3 C
O
NH2
Struktur resonansi hibrid dari amida dapat dituliskan sebagai berikut :
R C
O
N
H H
R C
O
N
H H
Gambar 2.7. Struktur Resonansi Amida (Hart, 1990) Formamida
(metamida)
asetamida (etanamida)
Karena keelektronegatifan atom N lebih kecil dari atom oksigen maka elektron lebih tertarik ke arah oksigen. Oleh karena itu struktur resonansi dengan C dan N sebagai ikatan ganda ( C ═ N ) cukup mantap. Senyawa amida memiliki titik didih relatif tinggi dibandingkan senyawa lain dengan berat molekul sama. Hal ini disebabkan karena kemampuannya membentuk ikatan hidrogen (Warsito, 1996).
Gambar 2.8. Ikatan Hidrogen Amida (Warsito, 1996)
Amida asam lemak dapat dibuat secara sintetik pada industri oleokimia, dimana berlangsung pada proses Batch. Pada proses amoniak dan asam lemak bebas bereaksi pada suhu 200oC dan tekanan 345 – 690 kPa selama 10 – 20 jam. Dengan proses tersebut dibuat amida primer seperti palmitamida, stearamida serta yang lainnya (Billenstein dan Blaschkes, 1984).
H2O
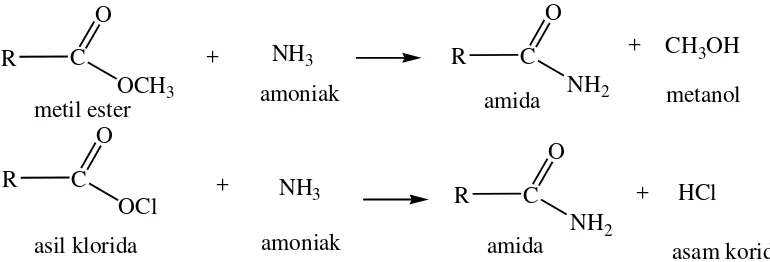
Selain proses Batch amida dapat diperoleh dengan mereaksikan amoniak dengan metil ester atau asil klorida asam lemak.
CH3OH
Gambar 2.9. Reaksi Pembuatan Amida (Billenstein dan Blaschkes, 1984)
Reaksi tersebut mengikuti konsep hard and soft acid and base (HSAB) dimana H+ dari amoniak merupakan hard acid yang mudah bereaksi dengan hard base CH3CO- menghasilkan metanol sebaliknya NH2- lebih bersifat soft base dibandingkan dengan CH3O-, sehingga akan berikatan dengan R – C+═ O yang lebih soft acid dibandingkan H+. Demikian juga halnya dengan reaksi asil klorida asam lemak dengan amoniak dimana H+ dari amoniak merupakan Hard acid yang mudah bereaksi dengan Cl- dari asil klorida yang Hard base membentuk HCl (Ho, 1977).
Pembuatan amida sekunder dilaksanakan dengan mereaksikan asam lemak dengan amina.
Gambar 2.10. Reaksi Pembuatan Amida Sekunder (Ho, 1977)
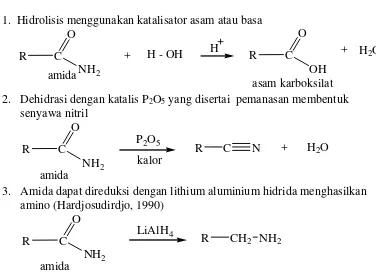
Senyawa – senyawa amida dapat mengalami beberapa reaksi, diantaranya adalah : 1. Hidrolisis menggunakan katalisator asam atau basa
H2O
2. Dehidrasi dengan katalis P2O5 yang disertai pemanasan membentuk senyawa nitril
3. Amida dapat direduksi dengan lithium aluminium hidrida menghasilkan amino (Hardjosudirdjo, 1990)
Gambar 2.11. Reduksi Amida (Hardjosudirdjo, 1990)
Pada reaksi amida gugus karbonil diubah menjadi CH2 dimana reduksi ini menghasilkan bermacam – macam kelas amina tergantung pada struktur amida. (Hart, 1990). Disamping metode di atas amina yang dihasilkan hanya senyawa amina primer dan reduksi dapat dilakukan dengan LiAlH4 atau secara katalitik.
R C N LiAlH4
H2, Ni R CH2 NH2
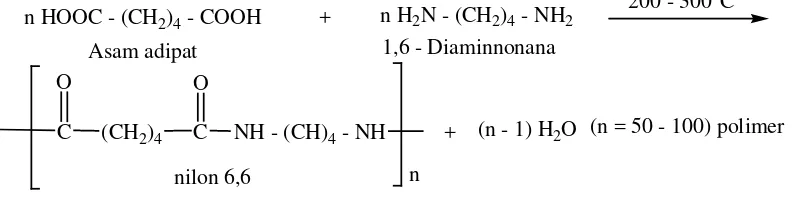
Nilon suatu polimer, yaitu poliamida yang dibuat dari reaksi antara asam adipat dengan heksanal etilediamina.
n HOOC - (CH2)4 - COOH
200 - 300oC n H2N - (CH2)4 - NH2
Asam adipat 1,6 - Diaminnonana
(CH2)4 C O
C O
NH - (CH)4 - NH n nilon 6,6
+ (n - 1) H2O
+
(n = 50 - 100) polimer
Gambar 2.12. Reaksi Pembuatan nilon 6,6 (Hart, 1990)
Dari reaksi tersebut di atas akan menghasilkan H2O oleh karena itu polimerisasi semacam ini disebut kondensasi.
2.6. Katalis
Katalis adalah suatu zat yang mempercepat laju reaksi kimia pada suhu tertentu, tanpa mengalami perubahan atau terpakai oleh reaksi itu sendiri. Suatu katalis berperan dalam suatu reaksi tapi bukan sebagai pereaksi maupun produk. Katalis memungkinkan reaksi berlangsung lebih cepat atau memungkinkan reaksi pada suhu lebih rendah akibat perubahan yang dipicunya terhadap pereaksi. Katalis mengurangi energi yang dibutuhkan untuk berlangsungnya reaksi.
berbeda dengan pereaksi dalam reaksi yang dikatalisinya, sedangkan katalis homogen berada dalam fase yang sama.
Efek kelancaran reaksi dari katalis basa adalah yang paling besar, sehingga katalis inilah yang sekarang paling umum diterapkan dalam praktek seperti CH3ONa dan CH3OK. Larutan natrium metoksida ini dibuat dengan dengan mencampurkan natrium hidroksida dengan metanol absolut atau natrium metoksida yang dibuat dari reaksi CH3OH absolut dengan Na. Reaksi antara semua natrium hidroksida dengan metanol merupakan reaksi eksoterm (menghasilkan panas) membentuk molekul polar (CH3O-Na+). Adanya kandungan air, asam lemak bebas dan hidroperoksida dapat memperlambat aktivitas katalis natrium metoksida.
Untuk menghindari terjadinya penurunan aktivasi katalis ini sebelum perlakuan maka minyak harus diberi perlakuan agar kandungan komponen penggangu dalam minyak tersebut berkurangnya kandungan air, asam lemak bebas dan hidroperoksida yang dapat menurunkan aktivasi katalis natrium metoksida serta beberapa katalis lainnya. Apabila terjadi penurunan aktivasi pada awal reaksi, maka reaksi tidak akan dapat berjalan dengan sempurna (De Greyt.
et.al, 1998).
2.7. Kegunaan Amida
Amida asam lemak atau metil ester asam lemak (Maag, 1894). Dimana dapat digunakan secara luas sebagai slip agent, maupun sebagai pelumas pada berbagai proses pembuatan resin. Sebagai slip agent dan pelumas pada bahan resin seperti PVC, polistirena, polyolefin, polivinil asetat maupu fenolat dapat digunakan amida primer maupun metil – bis – amida serta amida sekunder.
Senyawa amida juga mempunyai banyak kegunaan dalam bidang – bidang tertentu. Salah satu contoh yang paling nyata adalah senyawa sulfonamida. Sulfonamida adalah suatu senyawa kemoterapeutica yang digunakan dalam pengobatan untuk mengobati bermacam – macam penyakit infeksi, antara lain disentri baksiler yang akut, radang usus dan untuk mengobati infeksi yang telah resisten terhadap antibiotika (Nuraini, 1988).
2.8. Dietanolamina
Dietanolamina adalah senyawa yang terdiri dari gugus amina dan dialkohol. Dialkohol menunjukkan adanya adanya dua gugus hidroksil pada molekulnya. Dietanolamina juga dikenal dengan bis (hydroxyethyl)amine, diethyloamine, hydroxtdiethyamine, diolaamine dan 2,2 – iminodiethanol.
Sifat – sifat dietanolamina adalah sebagai berikut : (Anonim, 1976). a.Rumus molekul : C4H11NO2
b.Berat molekul : 105,1364 g/mol c.Densitas : 1,088 g/cm3 d.Titik leleh : 28oC (1 atm) e.Titik didih : 268,8 oC (1 atm)
f.Kelarutan : air, metanol, dan aseton g.Viskositas 30oC : 351,9 cp
Dietanolamida pertama kali diperoleh dengan mereaksikan dua mol dietanolamina dengan satu mol asam lemak. Senyawa ini diberi nama Krichevsky
R C O
O CH3 + HN
CH2CH2OH
CH2CH2OH
N
CH2CH2OH
CH2CH2OH R C
O
+ CH3OH
Metil ester asam lemak dietanoalamina dietanolamida metanol
Gambar 2.13. Reaksi Pembentukan Dietanolamida Dari Metil Ester Asam Lemak (Herawan, 1999)
2.9. Spektroskopi 1H - NMR
Spektroskopi proton atau 1H memberikan informasi struktural mengenai atom-atom hydrogen dalam sebuah molekul organik. Spektrum 1H biasanya diperoleh dengan cara berikut. Sampel senyawa yang akan dianalisis (mg) dilarutkan dalam sejenis pelarut inert yang tidak memiliki inti 1H. Sebagai contoh CCl4 atau pelarut dengan hidrogen yang digantikan oleh deuterium, seperti CDCl3 (deuterikloroform) dan CD3COCD3 (heksadeuterioaseton). Sejumlah kecil senyawa standar ditambahkan. Larutan ini dimasukkan ke dalam tube kaca, diletakkan di tengah kumparan frekuensi radio (rf), yaitu di antara ujung-ujung kutub magnet yang sangat kuat. Inti mensejajarkan diri searah dengan atau melawan medan. Secara berangsur dan terus-meneruskan energi yang diberikan ke inti dinaikkan oleh kumparan rf. Bila energi ini tepat sama dengan celah energi di antara keadaan spin berenergi rendah dan keadaan spin berenergi tinggi, maka energi tersebut diserap oleh inti. Pada saat itu inti dikatakan beresonansi dengan frekuensi terpasang (resonansi magnetik inti).
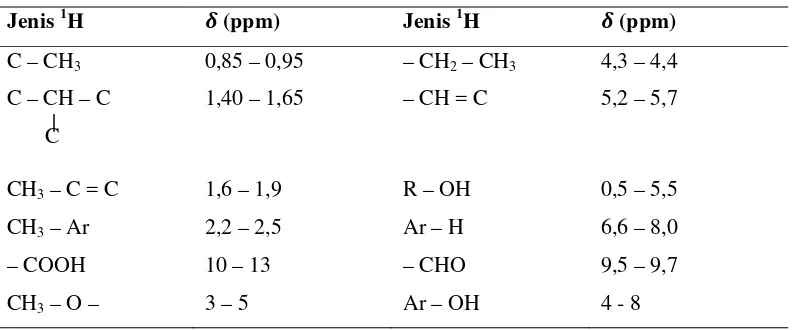
dengan proton yang serupa dalam senyawa standar yang diketahui. Sebagai contoh, benzena memiliki enam hidrogen ekuivalen dan menunjukkan satu puncak pada spektrum NMR 1H-nya pada δ = 7,24. Senyawa aromatik lain juga menunjukkan puncak di daerah ini. Hal ini menunjukkan bahwa kebanyakan hidrogen cincin aromatik akan memiliki pergeseran kimia pada sekitar δ = 7. Demikian pula kebanyakan hidrogen CH3-Ar muncul pada δ = 2,2 - 2,5. Pergeseran kimia dari inti 1H pada berbagai lingkungan kimia telah ditetapkan dengan mengukur spektrum NMR 1H dari sejumlah besar senyawa dengan struktur relatif sederhana yang diketahui. Pergeseran kimia untuk beberapa jenis inti 1H ditunjukkan pada tabel berikut.
Tabel 2.2. Pergeseran Kimia Proton 1H yang khas (Relatif terhadap Tetrametilsilana/TMS)
Jenis 1H � (ppm) Jenis 1H � (ppm)
C – CH3 0,85 – 0,95 – CH2 – CH3 4,3 – 4,4
C – CH – C
C
1,40 – 1,65 – CH = C 5,2 – 5,7
CH3 – C = C 1,6 – 1,9 R – OH 0,5 – 5,5
CH3 – Ar 2,2 – 2,5 Ar – H 6,6 – 8,0
– COOH 10 – 13 – CHO 9,5 – 9,7
CH3 – O – 3 – 5 Ar – OH 4 - 8