Amar ila M alik
Depar temen Far masi FM IPA-UI, Univer sitas Indonesia, Depok.
Pengobatan dengan terapi gen telah berkembang dengan pesat sejak clinical trial terapi ini pertama kali diperkenalkan pada tahun 1990 (Rob-erts, 2004). Terapi gen adalah teknik untuk meng o reksi g en-g en y ang cacat yang bertanggung jaw ab ter-hadap suatu penyakit. Selama ini pen-dekatan terapi gen yang berkembang adalah menambahkan gen-gen nor-mal ke dalam sel yang mengalami ketidak normalan. Pendekatan lain adalah melenyapkan gen abnormal
RN A THERAPEUTIC,
PEN DEKATAN BARU DALAM TERAPI GEN
ABSTRACT
Some diseases, such as cancer, hereditary and genetic diseases, as well as viral infectious diseases, have been treated unsatisfied by the conventional therapy so far, and even more, by the gene therapy. Together with the pharmaceutical industries, researchers put their best effort to hunt some molecules that can be more favorable for such kind of therapy. A fter a pivotal study reported in M ay, 2001, it is certain that Ribonucleic acid (RNA ) could effectively silence gene expression in mammalian cell line, so it was then proposed in 2004 the term RNA therapeutics. A ntisense RNA therapy which came into the stage earlier seemed to be the one that can answer all the problems in knocking out the unwanted messenger in gene expression. RNA interfer-ence (RNA i) concept, which came later in around 2000, began to look like a possible contender. It was reported in some studies that RNA i seems to have some more advan-tages over both stronger gene-silencing effects and greater ease of use. However, the main obstacle of all kind of gene therapy is, undoubtedly, on the delivery of this molecule to enter the target cell, and mostly, to where it is needed most inside the body. Some studies on genetic material delivery system have been reported, and their progress has been discussed.
Keywords: RNA therapeutics, antisense RNA , siRNA , terapi gen, gene silenc-ing.
dengan gen normal dengan melaku-kan reko mbinasi ho mo lo g. Pende-katan ketiga adalah mereparasi gen abnormal dengan cara mutasi balik selektif, sedemikian rupa sehingga akan mengembalikan fungsi normal gen tersebut. Selain pendekatan-pen-d ekatan tersebut, apendekatan-pen-d a penpendekatan-pen-d ekatan lain untuk terapi gen, yaitu mengen-dalikan regulasi ekspresi gen abnor-mal tersebut (Holmes, 2003).
ada-lah lebih ke arah gagasan mencegah diekspresikannya gen-gen yang jelek atau abnormal, atau dikenal dengan gene silencing. Untuk tujuan gene si-lencing atau membungkam ekspresi gen tersebut, maka penggunaan RNA jika dibandingkan dengan DNA lebih d imung kinkan, sehing g a d ikenal istilah RNA therapeutic (Adams, 2005). Suatu studi yang menggemparkan dilaporkan di majalah Nature bulan Mei 2001 yang menunjukkan bahwa RNA dapat membungkam ekspresi gen dengan efektif (Elbashir, 2001). Gagasan terapi gen dengan merepa-rasi mRNA (messenger RNA) daripada mengganti gen yang cacat berarti menggunakan mekanisme regulasi sel itu sendiri, sehingga efek samping yang merugikan lebih dapat ditekan (Penm an, 2002). Setelah ad any a laporan-laporan penelitian tersebut, m aka d im ulailah booming d alam bisnis perusahaan-perusahaan yang berkaitan dengan riset RNA , mau-pun perusahaan-perusahaan farmasi yang berharap RNA therapeutic ini segera d apat d iluncurkan sebagai sediaan o bat (Pallarito , 2004). Na-mun, p ara p akar memp erkirakan masih sekitar tujuh sampai limabelas tahun lagi baru terealisasi (Pray, 2004; Wang, 2004)
Fenomena terapetik RNA
Gen adalah suatu sekuens basa spesifik yang menyandikan instruksi mensintesis suatu protein. Walaupun gen mend apatkan perhatian lebih banyak untuk diteliti dan dibahas,
namun sesungguhnya pro tein lah yang mempunyai peran utama dalam melaksanakan fungsi-fungsi kehi-d up an kehi-d an meny usun may o ritas struktur seluler. Jika suatu gen di-ganggu sehingga menyebabkan pro-tein yang d isand ikannya menjad i tidak mampu untuk melaksanakan fungsi normalnya, maka akan meng-akibatkan suatu cacat genetis.
Alur informasi genetik di dalam sel dari DNA ke RNA dan ke pro-tein disebut sebagai proses ekspresi g en (D ale,1989). Peng ham batan proses ekspresi gen dapat dilakukan pada beberapa tahap, diantaranya adalah tahap translasi, yaitu dengan mengganggu pro ses translasi ter-sebut pada molekul mRNA. Molekul RNA yang akan d itranslasi mem-p uny ai sekuense d i bag ian hulu sebag ai temp at p eng enalan bag i ribosom dalam proses sintesis pro-tein. Ribosom, sebagai mesin pensi-tesis p o lip ep tid a yang kemud ian dimodifikasi lebih lanjut menjadi pro-tein, memerlukan situs pengenalan yang terd apat pad a mRNA untuk dapat melaksanakan pekerjaannya. M anip ulasi p ad a tahap translasi mRNA yang bertujuan untuk menga-tasi suatu penyakit genetis saat ini dikenal dengan istilah antisense RNA, small interfering RNA (si RNA), atau disebut pula RNAinterference (RNAi) (Lieberm an, 2003;
Lucentini, 2004; Pray , 2004; W ang , 2004). Po to ng an pendek dari duplex RNA atau DNA un-tai ganda (short inter-ferring RN A atau siRNA ) dilapo rkan m e n g a k i b a t k a n d eg rad asi RN A -RNA lain di dalam sel y ang memiliki sekuens berkese-suaian. Yang lebih terkini lagi ad alah
ditemukannya lebih kurang empat tahun yang lalu suatu micro RNA (miRNA) yang berperan membung-kam ekspresi gen (Jo hnsto n, 2004; Pfeffer, et al, 2002).
Bany ak teo ri terap etik RN A yang sangat ideal dan menjanjikan te-rapi yang ampuh. Namun, bagaimana cara memasukkan molekul RNA ini ke d alam temp at kerjany a, y aitu nukleus? Untuk menghantar molekul RNA diperlukan suatu wahana yang sesuai untuk membawanya ke target sel tertentu. Wahana paling banyak digunakan dalam terapi gen adalah virus yang telah dimodifikasi secara genetis sehingga mampu membawa DNA manusia normal. Disamping itu, teknologi penghantaran obat dengan bentuk liposome yang kini juga telah banyak mengalami modifikasi, serta teknologi menggunakan pengenalan reseptor, telah mendukung perkem-bangan terap etik RNA (A nantha-swamy, 2003).
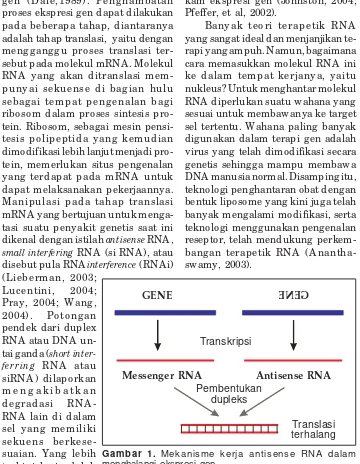
Gambar 1. Mekanisme kerja antisense RNA dalam menghalangi ekspresi gen.
Transkripsi
Pembentukan dupleks
GENE
Translasi terhalang
Messenger RNA
GE NE
Terapi antisense RNA
Prinsip terap i antisense RN A merupakan pemikiran yang brilian yang sebenarnya mengadopsi kon-disi alamiah seperti di dalam meka-nisme pertahanan tanaman terhadap virus, dan suatu mekanisme yang sama pada nematoda Caenorhabditis elegans (Pfeffer, 2004; Lee, 1993). Ketika itu d itemukan suatu RNA untai gand a (double strand RNA = dsRNA) yang menunjukkan kemam-p uan m eng ham bat ekskemam-p resi g en (Lieberman, 2003). Prinsip ini lebih co co k untuk d iim p lem entasikan dalam terapi gen untuk mengatasi p eny akit tertentu d imana terjad i eksp resi g en-g en abno rmal y ang m enim bulkan p eny akit, sep erti misalnya pada penyakit kanker.
Mekanisme kerja antisense RNA adalah sebagai berikut (Dale, 1994; Glick & Pasternak, 1994). Untai RNA yang ditranslasi disebut sebagai untai sense. Sementara itu, untai y ang mempunyai sekuens basa nukleotida komplemen dengan untai sense di-sebut antisense. Jika untai sense berikatan d eng an untai antisense membentuk dupleks, maka terjadi pemblokiran proses translasi yang meng akibatkan terjad iny a p eng -hambatan eksp resi gen (Penman, 2002). Hal ini dapat terjadi disebab-kan ribosom tidak memperoleh akses ke p ad a nukleo tid a p ad a untai mRNA, atau yang dapat pula terjadi ad alah d isebabkan bentuk d uplex RN A sangat mud ah terd egrad asi oleh enzim pendegradasi ribonuk-leat, ribonuclease, di dalam sel.
Peng-gunaan meto d e DNA reko mbinan d aripad a RNA reko mbinan, lebih memungkinkan untuk menghantar-kan gen sintetis yang menyandimenghantar-kan mo lekul RNA antisense ke d alam suatu organisme dengan relatif lebih stabil.
Suatu antisense mRNA (aRNA) jika dimasukkan ke dalam sel suatu o rganisme, maka aRNA akan ber-ikatan dengan mRNA yang ada di dalam sel tersebut sehingga mem-bentuk suatu dupleks (Gambar 1). Terbentuknya dupleks RNA ini akan menyebabkan terjadinya pengham-batan ekspresi gen pada tahap tran-slasi. Untuk berlangsungnya proses translasi, selain ribo so m sebag ai mesin p ensintesis p ro tein, maka diperlukan pula mRNA untai tung-g al, jutung-g a d ip erlukan tRN A y antung-g membawa asam amino – asam amino, serta pro tein-pro tein kecil khusus yang terkandung di dalam ribosom (Thenaw ijaya, 1994).
2004). Perbed aan d alam eksp resi suatu gen tergantung pada apakah gen tersebut diw ariskan atau tidak dari ibu atau dari bapak yang disebut sebagai genomic atau parental imprint-ing.
Dalam praktiknya, terapi gen d engan prinsip antisense tid aklah sem ud ah teo riny a. Dim ulai d ari p ro ses p emasukan mo lekul RN A antisense ke dalam sistem biologis sel o rganisme. Mo lekul ini harus ber-had ap an d eng an ko nd isi ad any a enzim nuklease dimana-mana, baik di dalam sel maupun di dalam sir-kulasi darah (Agrawal, et al., 2003). Untuk menghindari degradasi ini, asam nukleat (dalam hal ini RNA ) d imo d ifikasi secara kimia d engan memodifikasi gugus di dalam struk-tur asam nukleat. Setelah berhasil mengatasi enzim nuklease, molekul asam nukleat harus mampu menem-bus sel membran yang merupakan lapisan lemak ganda. Padahal, asam nukleat terbangun atas gugus fosfat sebagai tulang punggungnya yang menghasilkan muatan negatif ber-sifat hidrofilik. Di dalam sel, asam nukleat harus dialokasikan dengan benar dan tepat ke tempat kerjanya yaitu di nukleus. Namun, sebelum dapat masuk ke dalam nukleus, di dalam sitoplasma sel, asam nuklet terapetik ini harus berhadapan de-ngan berbagai penghalang. Setelah melalui rintang an-rintang an d an masuk ke dalam nukleus dengan me-nembus pori-pori membran nukleus, belum dapat begitu saja melaksana-kan tugasnya. Seringkali DNA dan
RN A nukleus merup akan bentuk yang berlipat secara ko mpak d an d iselubungi o leh pro tein nukleus. Bahkan, d alam hal RNA , struktur terlip atny a belum beg itu bany ak dipahami, dan masih sedikit infor-masi mengenai hal ini, sehingga pada kenyataannya terapi antisense masih merupakan pekerjaan trial and error pada berbagai lokasi dari suatu gen yang dipilih berdasarkan apakah itu pada lokasi awal, pada bagian tengah atau pada bagian lain yang esensial bagi proses ekspresi gen tersebut.
Terapi siRNA
menun-jukkan bahw a RNA i dapat diguna-kan untuk melindungi mencit dari v irus hep atitis (Xia, et al., 2004). Penelitian tentang upaya RNAi untuk mengatasi penyakit-penyakit pada manusia sampai saat ini masih terus dikembangkan.
Mekanisme kerja RNA i adalah melibatkan suatu intermediet aktif yang disebut small interfering RNA (siRNA). Molekul siRNA berukuran kecil yaitu hanya 21-25 nukleotida dengan dua nukleotida pada kedua ujung tidak berpasangan. Molekul ini d ihasilkan d ari hasil kerja suatu enzim Dicer, yaitu suatu ribonuclease dengan energi ATP, yang mengenali dan memotong mRNA yang mem-bentuk dupleks untai ganda menjadi
potongan kecil fragmen untai g and a m RN A . Selain itu, siRNA juga d ihasilkan d ari suatu short hairpin RNA, yaitu untai dupleks RNA yang terbentuk d ari suatu untai tunggal yang mem-bentuk hairpin (seperti jep it ram but, d eng an lengkungan melipat pada salah satu ujung ny a) yang juga dipotong oleh Dicer. Oleh enzim heli-case, siRNA akan dibuka ikatan hidrogennya se-hingga untai antisense d ari siRN A y ang ter-bebas dapat bergabung dengan suatu kompleks protein RNA -induced si-lencing complex (RISC) (Gambar 2). Kompleks tersebut akan meng aktifkan RISC y ang semula inaktif, d an kemud ian pro tein ini akan melaksanakan tugasnya bekerja memutus mRNA pada bagian yang m eng and ung sekuens ho m o lo g dengan siRNA (Agrawal, et al., 2003; Lucentini, 2004; Pray, 2004; Provost, et al., 2002; Tang, 2005).
Berbagai jenis gen dapat dijadi-kan sebagai target potensial untuk dibungkam ekspresinya oleh siRNA. H al ini m em buka harap an y ang menggembirakan tentang pengguna-an siRNA dalam dunia pengobatpengguna-an. Potensi dan spesifisitas siRNA yang besar untuk membungkam ekspresi gen, yaitu 1000 kali lebih besar diban-dingkan oligonukleotida antisense, DNA penyandi
short interfering RNA (siRNA) digabungkan ke genom di dalam nukleus
Produksi protein cacat dapat dihalangi dengan membungkam gen mutan
siRNA bergabung dengan protein membentuk kompleks silencing
Kompleks silencing berikatan ke kopi RNA yang membawa gen cacat dan menghancurkannya
Gambar 2. Mekanisme kerja short interfering RNA (siRNA) dalam menghalangi ekspresi gen. (Dikopi dari NewScientist.com 10.32 13 March 2003).
pula menjadi pendukung harapan tersebut. D iband ing kan d eng an terapi antibodi, terapi siRNA pem-buatannya relatif lebih mudah dan sistem penghantarannya relatif lebih murah pula. Studi in vitro dari RNAi saat ini sedang difokuskan terutama pada terapi infeksi virus dan kanker, dan tampaknya penggunaan klinik aw al bag i terap i RN A i nantiny a adalah lebih utama kepada kedua p enyakit tersebut (A d ams, 2005). Beberapa penelitian in vitro aktivitas RNA i yang telah dilaporkan antara lain adalah menghambat pemben-tukan sel kanker dengan jalan meng-hambat ekspresi gen Ras yang ter-mutasi yang banyak ditemukan pada berbagai tipe kanker, gen human pap-illoma virus (HPV) E6 dan E7, faktor transkripsi, serta ekspresi berlebihan d ari p ro to -o nko g en sep erti Bcl-2 (Lucentini, 2004; Yague, et al., 2004), pada Leukemia-associated tyrosine kinase fusion (TEL-PDGFbR) (Chen, et al., 2004), dan erb B2 (Kawasaki & Tarai, 2004).
Yang menjad ikan RN A i lebih menarik untuk terus diteliti kemam-p uan aktiv itasnya ad alah tingkat spesifisitasnya yang cukup tinggi yang tidak dimiliki oleh inhibtor lain. Disamping itu, RNAi mampu bekerja p ad a berbag ai g en p ad a w aktu bersam aan (Yag ue, et al., 2004 ; Holmes 2003). Namun, kesuksesan terap i RN A i, sebag im ana terap i berbasis materi genetik lain, diten-tukan o leh stabilitas sediaan serta teknik penghantaran yang diguna-kan.
Kendala dalam Penggunaan Terapi RNA secara klinik
Prospek dari penggunaan mole-kul RNA dalam aplikasi pengobatan diharapkan dapat segera direalisasi-kan. N amun d emikian, p ara ahli menyadari masih adanya kendala-kendala yang harus diantisipasi agar molekul RNA tersebut dapat diguna-kan d eng an hasil y ang o p tim al. Faktor-faktor yang menjadi penyulit, yaitu karena antisense RNA maupun siRNA harus dimasukan ke dalam sistem biologis sel hidup, bukan pada med ia sel bebas (A g raw al, et al, 2003); sehingga
1. Mo lekul antisense RNA harus menghindari pemecahan oleh enzim nuklease yang akan memotong asam nukleat menjadi basanya. Enzim ini ada di mana-mana, baik di dalam sirkulasi darah maupun di dalam sel. Untuk membuat asam nukleat lebih resisten terhad ap enzim ini telah dibuat beberapa strategi, salah satu-nya adalah dengan cara mengganti oksigen pada jembatan basa dengan sulfur, sehingga menghasilkan jem-batan fosforotioat yang lebih resiten.
cara, yaitu (1) introduksi langsung siRNA sinetik ; (2) introduksi suatu plasmid atau virus yang menyandi sekuens gen yang akan memproduksi siRNA yang sesuai. Cara kedua di-anggap sebagai cara yang lebih baik karena memberikan efek yang lebih lama.
Asam nukleat bebas mempunyai muatan negatif yang kuat yang ber-asal d ari gugus fo sfat d ari tulang punggung struktur asam nukleat. Hal ini membuat molekul tersebut mudah larut dalam air, tetapi tidak dapat larut dalam lemak ganda struktur membran sel. Dengan menggabung-kan asam nukleat d eng an suatu pembaw a yang berfungsi mening-katkan transpor ke dalam sel; atau juga d ikemas d alam suatu kapsul lemak, misalnya liposom, yang telah digunakan secara luas untuk trans-port amfoterisin dan beberapa obat kanker, diharapkan dapat memenuhi keperluan penghantarannya (A nan-thasw amy, 2003). Dilaporkan pula suatu sistem penghantar yang sangat m enjanjikan, y aitu berup a lig an peptida dari suatu reseptor kompleks enz im serp in y ang d ibuat mem-bentuk ko mp leks d eng an materi genetik ini, yang mana dapat meng-hantar ke berbagai sel target (Rob-erts, 2004).
Walaupun sampai saat ini belum ditemukan sistem penghantaran yang sesuai, p ara ahli tetap o p tim is. Sebagian dari mereka yakin, bahwa penghantaran antisense RNA d an siRNA mungkin tidak memerlukan vektor berupa virus, ataupun sistem
penghantaran yang eksotik seperti pada terapi gen. Mereka berpendapat bahwa siRNA dapat secara langsung diintoduksikan ke jaringan seperti telah d isebutkan d i atas. N amun demikian, hal inipun bukan berarti tanpa masalah, karena tubuh manusia akan d engan cepat mend egrad asi siRNA yang masuk. Untuk mengatasi hal tersebut perlu dilakukan upaya untuk m ening katakan stabilitas siRNA, salah satunya dengan modi-fikasi kim ia (D o w nw ard , 2004; Lucentini, 2004).
d engan RNA d imulai pad a target lokasi aw al untuk transkripsi atau translasi, d engan harap an bahw a lo kasi tersebut relatif terbuka (Agrawal, et al., 2003).
4. M asalah selanjutny a ad alah bagaimana d apat terjad i interaksi antara terap i d an target, sehinga d apat menghasilkan hibrid a yang stabil. A ntara basa g uanin (G) d eng an sito sin (C) terd ap at tig a ikatan hidrogen, sehingga merupa-kan ikatan yang lebih stabil diban-dingkan dengan dua ikatan hidrogen antara adenin (A) dengan timin (T). Panjang minimum untuk rancangan suatu untai RNA d itentukan o leh besarnya genom. Di dalam genom manusia, bagi mo lekul RNA yang terdiri dari basa berjumlah kurang dari 12-15, tampaknya akan menga-lami proses penggandaan, dan mung-kin akan merusak gen atau messen-ger yang tidak sesuai. Oleh karena itu, agar terapi stabil dan dikenali, maka panjang basa nukleo tidanya adalah antara 13-20 basa.
5. Setelah terbentuk hibrida, tugas selanjutnya adalah merusak target. A ntisense y ang d irancang untuk mRNA akan berhasil jika didukung o leh enzim RNase H, yaitu enzim yang bekerja memotong messenger. Jika antisense adalah untai tunggal DNA , maka akan langsung berpar-tisipasi dalam destruksi messenger selanjutnya. Destruksi messenger ini memang d iinginkan. A kan tetap i hibrid ini lambat laun akan
menim-bulkan instruksi genetik yang dapat menerjemahkannya ke dalam protein yang berhubungan dengan penyakit, dan ini dilakukan oleh ribosom yang mempunyai aktivitas instrinsik untuk m eng uraikan d an m em fasilitasi pembacaan pesan genetik tersebut. Untuk menghind ari hal ini, harus d ibuat antisense y ang ikatanny a kuat. Dupleks DNA / RNA lebih lemah d arip ad a d up leks RN A / DNA, maka sedang pula dikembang-kan usaha untuk membuat DNA yang mirip RNA (Agrawal, et al., 2003).
6. Dari sisi efikasi, RN A i telah diketahui menunjukkan spesifisitas y ang cukup ting g i. A kan tetap i, sebagaimana molekul-molekul kecil yang lain, kemungkinan terjadinya m asalah d alam ap likasi klinik tetap lah ad a. Efek samp ing yang mungkin saja terjadi berupa terham-batnya ekspresi gen-gen lain yang bukan target, baik akibat degradasi mRN A , p eng hambatan translasi, ataupun melalui induksi penekanan g en secara g lo bal d eng an jalan mengaktifkan resp o ns interfero n, terlebih jika siRNA d iekspresikan oleh vektor virus.
Penutup
3. Ananthaswamy, A. 2003. Under-cover Genes Slip into the Brain. N ew Scientist.co m 14:48 20 March 2003.
4. Chen, J., et al. 2004. Stable Ex-p ressio n o f Small Interfering RNA Sensitizes TEL-PDGFbR to inhibitio n w ith im atinib o r rapamycin. Jo urnal o f Clinical Investigation 113: 1784-1791. 5. Dale, J.W. 1994. Molecular
Ge-netics of Bacteria. 2nd Edition. John Wiley & Sons, Chichester. Hal: 1-25; 75-105.
6. Dow nw ard, J. 2004. RNA inter-ference. British Medical Journal 328:1245-1248.
7. Elbashir, S.M. et al. 2001. Du-plexes o f 21-nucleo tid e RNA s mediate RNA interference in cul-tured mammalian cells. Nature 411: 494-498.
8. Glick, B. R. and Pasternak, J.J. 1994. Molecular Biotechnology, Principles and A pplications of Recombinant DNA. ASM Press. Hal: 403-418.
9. Holmes, B. 2003. Gene therapy may sw itch o ff Huntingto n’ s. N ew Scientist.co m 10.35, 13 March 2003.
10. Johnston, N. 2004. Seeds of a icro Revolution. The Scientist, 18(17): 16-17.
11. Kawasaki, H. and Taira, K. 2004. Induction of DNA Methylation and Gene Silencing by short in-terfering RNA s in human cells. E-pub of print Nature, 1038/ na-ture2889, Aug 15.
penyakit. Secara teori mekanismenya sederhana, namun pada kenyataan-nya bakenyataan-nyak hal yang masih menjadi kend ala d an m enjad i p ekerjaan penting bagi para peneliti, antara lain kestabilan. Perlu kerja sama para peneliti d engan perusahaan-peru-sahaan farmasi, sehingga terapi ini bisa d ip ercep at untuk d ap at d i-manfaatkan bagi kesehatan seluruh manusia. RNAi memberikan harapan yang lebih menggembirakan diban-dingkan antisense RNA dalam dunia pengo batan, salah satunya ad alah dalam pengobatan kanker. Spesifi-sitas dan efektivitas penghamabtan eksp resi g en melalui mekanisme RNAi menjanjikan efek terapi dengan indeks terapeutik yang cukup lebar. Kendala besar yang sekarang masih dihadapi adalah bagaimana siRNA sebagai agens RNAi dapat dihantar-kan secara stabil menuju sel yang spesifik. Perkembangan yang cukup menggembirakan d ari hasil pene-litian ini yang telah dilakukan secara in vivo pada hew an coba memung-kinkan pilot study pada manusia dapat dilakukan dalam w aktu yang tidak lama lagi.
DA FTA R PUSTA KA
1. Adams, A. 2005. RNA Therapeu-tic enter Clinical Trials, The Sci-entist, January 17
12. Lee, R.C., et al. 1993. The C. elegans heterochronic gene lin-4 enco d es sm all RN A s w ith antisense complementary to lin-14. Cell 116: 589-592.
13. Lieberman, J., et al. 2003. Inter-fering with Disease: Opportuni-ties and roadblocks to harness-ing RNA interferences. TRENDS in Molecular Medicine 9(9). 14. Lucentini, J. 2004. Silencing
Can-cer. The Scientist 18(17): 14-15 15. Pallarito , K. 2004. Fueling the
Fires of RNA Interference. The Scientist, 18(17): 18-19.
16. Penman, D. 2002. Subtle Gene Therapy Tackles Blo o d Diso r-der. New Scientist.com 16:26 11 October 2002.
17. Pfeffer, S. et al. 2004. Identifica-tio n o f V irus-enco d ed m icro RNAs. Science 304: 734-736. 18. Pray, L.A. 2004. Viroids, Viruses,
and RNA Silencing. The Scientist 18(16):23.
19. Provost, P., et al. 2002. Ribonu-clease Activity and RNA binding o f reco mbinant human Dicer. The EMBO Journal 21(21): 5864-5874.
20. Roberts, J.P. 2004. Gene therapy’s Fall and Rise (Again). The Scien-tist 18(18): 22-24.
21. Tang , G. 2005. siRN A and miRNA : an insight into RISCs, TRENDS in Molecular Medicine 30(2).
22. Thenaw ijay a, M . 1994. Leh-ninger, Dasar-d asar Bio kimia. Jilid 3. Penerbit Erlangga. Hal: 123-233.
23. Wang, M.B. et al., 2004. On the ro le o f RN A silencing in the pathogenicity and evolution of viroids and viral satellite. Proc Natl Acad Sci 101: 3275-3280. 24. Xia, H. et al. 2004. RNA i
sup-presses polyglutamine-induced neurodegeration in a model of spino cerebellar ataxia. Nature Methods 10: 816-820.