EFEK ANTIFUNGI EKSTRAK KELOPAK BUNGA ROSELLA (Hibiscus sabdariffa L) TERHADAP PERTUMBUHAN
Trichophyton rubrum in vitro
SKRIPSI
Untuk Memenuhi Persyaratan Memperoleh Gelar Sarjana Kedokteran
SITA AULIA SARI G0006158
FAKULTAS KEDOKTERAN UNIVERSITAS SEBELAS MARET
ABSTRAK
Sita Aulia Sari, G0006158, 2010. Efek Antifungi Ekstrak Kelopak Bunga Rosella terhadap Pertumbuhan Trichophyton rubrum in vitro. Fakultas Kedokteran, Universitas Sebelas Maret, Surakarta.
Tujuan penelitian : Dermatofitosis adalah infeksi jamur pada kulit yang salah satunya disebabkan oleh Trichophyton rubrum. Pengobatan dermatofitosis menggunakan obat kimiawi mempunyai kekurangan diantaranya adalah mahalnya harga dan resistensi beberapa obat. Kelopak bunga Rosella memiliki kandungan flavonoid, dimana flavonoid ini memiliki aktivitas antifungi. Flavonoid yang terkandung dalam kelopak bunga Rosella diantaranya adalah anthocyanin, gossypeptin (hexahydroxyflavone) 3-glucoside (Bisset, 1994), flavonol glucoside hibiscritin, flavonoid gossypeptin, delphinidine monoglucoside, cyanidin 3-monoglucoside. Penelitian ini bertujuan untuk mengetahui pengaruh ekstrak kelopak bunga Rosellaterhadap pertumbuhan Trichophyton rubrumin vitro. Metode penelitian : Jenis penelitian ini adalah eksperimental laboratorium. Objek penelitian yang dipakai adalah Trichophyton rubrum di mana sampel diambil secara random sampling. Penelitian ini menggunakan Sabouraud Dextrosa Agar sebanyak 7 cawan petri yang ditanami dengan biakan
Trichophyton rubrum di mana masing-masing cawan petri dibuat sumuran dengan diameter 6 mm sebanyak 4 buah sehingga didapatkan sumuran sebanyak 28 buah. Masing-masing sumuran diisi dengan kontrol negatif (akuades steril), kontrol positif (flukonazol 25 µg/ml), dan ekstrak kelopak bunga Rosella konsentrasi 10%, 20%, 30%, 40%, dan 50%. Cawan petri kemudian diinkubasi pada suhu 25º C selama 7 hari dan diukur besar zona hambatan di sekitar sumuran. Data yang diperoleh dianalisis dengan uji One Way ANOVA yang dilanjutkan dengan uji
Least Significance Difference (LSD) dengan menggunakan SPSS 16,0 for Windows.
Hasil penelitian : Uji One Way ANOVA menunjukkan adanya perbedaan rata-rata diameter zona hambatan antara semua konsentrasi ekstrak kelopak bunga Rosella yang signifikan (p < 0,05). Adanya peningkatan rata-rata diameter zona hambatan pada masing-masing konsentrasi hingga konsentrasi 50 %.
Simpulan penelitian : Ekstrak kelopak bunga Rosella memiliki efek antifungi terhadap pertumbuhan Trichophyton rubrum in vitro.
ABSTRACT
Sita Aulia Sari, G0006158, 2010. The Antifungal Effect of Rosella Calyx Extract on Trichophyton rubrum Growth in vitro. Faculty of Medicine, Sebelas Maret University, Surakarta.
Objective : Dermatophytosis is a fungal infection on skin that one of them caused by Trichophyton rubrum. Dermatophytosis treatment using chemical drugs have many shortcomings like high cost and drug resistance. Rosella calyx contens flavonoids, which has antifungal effect. Flavonoids on Rosella calyx is anthocyanin, gossypeptin (hexahydroxyflavone) 3-glucoside (Bisset, 1994), flavonol glucoside hibiscritin, flavonoid gossypeptin, delphinidine 3-monoglucoside, cyanidin 3-monoglucoside. The objective of this study is to know the effect of Rosella calyx on Trichophyton rubrum growth in vitro.
Methods : The study was performed as experimental laboratory. The object of the study is Trichophyton rubrum. The Trichophyton rubrum colonies sample of this study took by random sampling. The study used Trichophyton rubrum colonies on 7 Sabouraud Dextrosa Agar plate. Each plate has 4 holes. Each hole filled by aquades as negative control, fluconazole 25 µg/ml as positive control, and various Rosella calyx extract concentration (10%, 20%, 30%, 40%, and 50%). The plate was incubated in 25o C incubator for 7 days and measured the diameter of Rosella calyx extract inhibition effect. The data sample was collected and analyzed by One Way ANOVA test and Least Significance Difference (LSD) test on SPSS 16,0 for Windows.
Results : The One Way ANOVA test showed that there was difference of inhibition diameter means between all of the various Rosella calyx extract concentration groups (p < 0,05). The diameter of Rosella extract inhibition effect increased for each concentration up to 50 %. Positive control inhibition diameter compare to 20 % Rosella calyx extract concentration has no significantly.
Conclusion : The study was concluded that Rosella calyx extract has an antifungal effect to Trichophyton rubrum growth in vitro.
PENGESAHAN SKRIPSI
Skripsi dengan judul: Efek Antifungi Ekstrak Kelopak Bunga Rosella (Hibiscus sabdariffa L) terhadap Pertumbuhan Trichophyton rubrum in vitro
Sita Aulia Sari, G0006158, Tahun 2010
Telah diuji dan sudah disahkan di hadapan Dewan Penguji Skripsi Fakultas Kedokteran Universitas Sebelas Maret
Pada Hari Selasa , Tanggal 8 Juni 2010
Pembimbing Utama
Sri Wahjono, dr., MKes.DAF (K)
NIP. 19450824 197310 1 001
Dekan FK UNS
Prof.Dr.H.A.A. Subijanto, dr., MS.
BAB I PENDAHULUAN
A. Latar Belakang Masalah
Kondisi geografis Indonesia yang merupakan daeah tropis dengan suhu
dan kelembapan yang tinggi akan memudahkan tumbuhnya jamur, sehingga
infeksi oleh karena jamur di Indonesia banyak ditemukan. Penyakit kulit
karena infeksi jamur prevalensinya cukup tinggi di Indonesia dan sangat
disayangkan lebih banyak ditemukan pada masyarakat yang berekonomi
lemah. Kondisi perekonomian yang memburuk saat ini berpengaruh pada
berbagai segi kehidupan, termasuk pada hygiene perorangan dan lingkungan
serta prioritas pemeliharaan kesehatan, akan mengakibatkan prevalensi
penyakit kulit akibat jamur meningkat (Bramono, 2008). Menurut data yang
diperoleh dari Bagian Penyakit Kulit dan Kelamin Rumah Sakit Dr.Moewardi
Surakarta, pada tahun 2009 kasus penyakit kulit akibat jamur ditemukan
sebesar 40% dari jumlah seluruh kasus yang ditangani (data diambil pada
tanggal 25 Januari 2010).
Penyakit kulit akibat infeksi jamur paling banyak dijumpai di Indonesia
adalah dermatofitosis. Dermatofitosis adalah suatu infeksi pada rambut, kulit,
Walaupun dermatofitosis tidak sampai menimbulkan kematian, tetapi
akan mempengaruhi kualitas hidup seseorang akibat gatal yang mengganggu
atau penampilan yang kurang baik (Bramono, 2008). Namun, pada
kenyataannya obat antijamur relatif sedikit bila dibandingkan dengan obat-obat
antimikroba yang lain (Pratiwi, 2001). Obat yang dipakai untuk infeksi jamur
superfisialis diantaranya adalah obat golongan mikonazole, bifonazole,
flukonazol, ketokonazole, griseofulvin, terbinafine, dan itrakonazole. Diantara
obat-obat tersebut hanya itrakonazole yang bersifat fungisid namun saying
harganya cukup mahal sehingga tidak terjangkau oleh masyarakat ekonomi
lemah, sedangkan obat yang lain bersifat fungistatik sehingga kekambuhan
dapat sering terjadi (Nasution, 2005). Selain hal tersebut, telah diketahui
adanya resistensi jamur dermatofit terhadap beberapa obat, diantaranya
griseofulvin, ketokonazol (Nasution, 2005), dan terbinafin (Mukherjee et al., 2003). Berdasarkan hal tersebut, penggunaan tanaman herbal sebagai obat
antijamur dapat dijadikan sebagai sebuah alternatif.
Pemakaian tanaman obat cenderung meningkat sejalan dengan
berkembangnya industry jamu atau obat tradisional, kosmetik, farmasi,
makanan, dan minuman (Cheppy dan Hernani, 2002). Salah satu yang popular
akhir-akhir ini adalah Rosella (Hibiscus sabdariffa L) yang memiliki banyak manfaat bagi kesehatan diantaranya adalah dapat memperlambat pertumbuhan
jamur, bakteri, atau parasit (Buana dkk, 2008). Hal ini diduga karena
gossypeptin (hexahydroxyflavone) 3-glucoside (Bisset, 1994), flavonol
glucoside hibiscritin, flavonoid gossypeptin, delphinidine 3-monoglucoside,
cyanidin 3-monoglucoside (Maryani dan Kristiana, 2005). Senyawa flavonoid
ini memiliki aktivitas biologi sebagai antibakteri, antijamur, antiviral,
antiprotozoa, antioksidan, dan antiinflamasi (Cushnie dan Lamb, 2005; Hughes
et al., 2008)
Berdasarkan uraian di atas, untuk lebih memberikan dasar bagi bukti
kemanfaatan kelopak bunga Rosella sebagai antifungi, maka peneliti ingin
membuktikan adanya efek antifungi ekstrak kelopak bunga Rosella terhadap
pertumbuhan Trichophyton rubrum in vitro.
B. Perumusan Masalah
Apakah ekstrak kelopak bunga Rosella (Hibiscus sabdariffa L) memiliki efek antifungi terhadap pertumbuhan Trichophyton rubrum in vitro?
C. Tujuan Penelitian
Untuk mengetahui efek antifungi ekstrak kelopak bunga Rosella
(Hibiscus sabdariffa L) terhadap pertumbuhan Trichophyton rubrum in vitro.
D. Manfaat Penelitian
Penelitian ini dapat memberikan informasi ilmiah mengenai efek antifungi
kelopak bunga Rosella (Hibiscus sabdariffa L) terhadap pertumbuhan
Trichophyton rubrum in vitro.
2. Aspek Aplikatif
a. Penelitian ini diharapkan dapat
memberikan informasi ilmiah kepada masyarakat ilmiah pada
khususnya dan masyarakat luas pada umumnya tentang manfaat ekstrak
kelopak bunga Rosella yang dapat digunakan sebagai antifungi.
b. Memberi peluang kemungkinan
BAB II
LANDASAN TEORI
A. Tinjauan Pustaka
1. Rosella
a. Klasifikasi
Kingdom : Plantae
Subkingdom : Tracheobionta
Superdivision : Spermathophyta
Division : Magnoliophyta
Class : Magnoliopsida
Subclass : Dilleniidae
Ordo : Malvales
Family : Malvaceae
Genus : Hibiscus L
Species : Hibiscus sabdariffa L (USDA, 2009)
b. Nama daerah
1) Karkade : Arab, Afrika Utara
2) Asam susur : Malaysia
3) Kachieb priew : Thailand
4) Roselle : Inggris
6) Merambos hijau : Jawa Tengah
7) Asam Kecur : Meranjat
8) Kesew jawe : Pagar Alam
9) Asam jarot : Padang
10)Asam Rejang : Muara Enim
( Maryani dan Kristiana, 2005; Wangjaya, 2008)
c. Deskripsi Tanaman
Rosella merupakan herba tahunan yang bisa mencapai
ketinggian 0,5-3 meter. Batangnya bulat, tegak, berkayu, dan
berwarna merah. Daunnya tunggal, berbentuk bulat telur, pertulangan
menjari, ujung tumpul, tepi bergerigi, dan pangkal berlekuk. Panjang
daun 6-15 cm dan lebarnya 5-8 cm. Tangkai daun bulat berwarna
hijau, dengan panjang 4-7 cm.
Bunga Rosella yang keluar dari ketiak daun merupakan bunga
tunggal, artinya pada setiap tangkai hanya terdapat satu bunga. Bunga
ini mempunyai 8-11 helai kelopak yang berbulu, panjangnya 1 cm,
pangkalnya saling berlekatan, dan berwarna merah. Bagian inilah
yang sering dimanfaatkan sebagai bahan makanan dan minuman.
Mahkota bunga berbentuk corong, terdiri dari 5 helaian,
panjangnya sekitar 3-5 cm. Tangkai sari yang merupakan tempat
melekatnya kumpulan benangsari berukuran pendek dan tebal.
Buahnya berbentuk kotak kerucut, berambut, terbagi menjadi 5
ruang, berwarna merah. Bentuk biji menyerupai ginjal, berbulu,
dengan panjang 5 mm dan lebar 4 mm. Saat masih muda, biji
berwarna putih dan setelah tua berubah menjadi abu-abu. (Maryani
dan Kristiana, 2005)
Gambar 1. Tanaman Bunga Rosella (Wangjaya, 2008)
d. Habitat dan Persebaran
Rosella dapat tumbuh dengan baik di daerah beriklim tropis
dan subtropis yang hangat yang memiliki ketinggian kurang lebih
0-900 meter di atas permukaan laut. Pertumbuhannya membutuhkan
rata-rata temperatur bulanan 25-30°C, curah hujan 140-270 mm per
bulan dan kelembapan udara (>70%). Tanaman ini mempunyai hábitat
asli di daerah yang terbentang dari India hingga Malaysia. Namun
sekarang tanaman ini telah menyebar di daerah tropis dan subtropis di
seluruh dunia (Maryani dan Kristiana, 2005).
Rosella mengandung beberapa zat gizi yang bermanfaat bagi
tubuh. Kandungan zat gizi Rosella dapat dilihat pada table berikut :
Tabel 1. Kandungan Rosella
Nama
Kalori 49 kal 43 kal 44 kal
Air 84,5% 85,6% 86,2% 7,6%
Protein 1,9 gr 3,3 gr 1,6 gr 24%
Lemak 0,1 gr 0,3 gr 0,1 gr 22,3%
Karbohidrat 12,3gr 9,2 gr 11,2 gr
-Besi 2,9 gr 4,8 mg 3,8 mg
-Beta karoten 300 ig 4135 ig 285 ig
-Asam
Selain kandungan di atas, Rosella juga mengandung senyawa
flavonoid anthocyanin, gossypeptin (hexahydroxyflavone) 3-glucoside
(Bisset, 1994; Hughes, 2008), flavonol glucoside hibiscritin, flavonoid
gossypeptin, delphinidine 3-monoglucoside, cyanidin
3-monoglucoside (Maryani dan Kristiana, 2005). Senyawa flavonoid ini
bermanfaat sebagai antibakteri, antijamur, antiviral, antiprotozoa,
f. Aktifitas antifungi
Kelopak bunga Rosella (Hibicscus sabdariffa L) mengandung beberapa senyawa flavonoid yakni anthocyanin, gossypeptin
(hexahydroxyflavone) 3-glucoside (Bisset, 1994), flavonol glucoside
hibiscritin, flavonoid gossypeptin, delphinidine 3-monoglucoside,
cyanidin 3-monoglucoside (Maryani dan Kristiana, 2005). Flavonoid
termasuk senyawa phenolic yang disintesis tumbuhan sebagai respon
terhadap infeksi mikroorgansme, karena itu flavonoid merupakan
senyawa antimikrobial yang efektif (Al-Bayati dan Al-Mola, 2008).
Flavonoid ini bisa ditemukan pada buah , sayuran, kacang-kacangan,
batang,bunga, teh, dan madu. Aktifitas biologis yang dimiliki oleh
flavonoid diantaranya adalah antibakteri, antijamur, antiviral,
antiprotozoa, antioksidan, dan antiinflamasi (Cushnie dan Lamb,
2005). Mekanisme kerja flavonoid dalam menghambat pertumbuhan
jamur yakni dengan menyebabkan gangguan permeabilitas membrane
sel jamur. Gugus hidroksil yang terdapat pada senyawa flavonoid
menyebabkan perubahan komponen organik dan transport nutrisi yang
akhirnya akan mengakibatkan timbulnya efek toksik terhadap jamur.
Efek antifungi flavonoid juga berhubungan dengan hambatan sintesis
protein DNA (Sabir, 2005; Salwa dan Neimat, 2007; Lima et al., 2008).
2. Trichophyton rubrum
Kingdom : Fungi
Divisi : Ascomycota
Kelas : Eurotiomycetes
Ordo : Onygenales
Famili : Arthgrodermataceae
Genus : Trichophyton
Spesies : Trichophyton rubrum
(Rippon, 1974)
b. Morfologi
Trichophyton rubrum dideskripsikan pertama kali oleh Malmsten pada tahun 1845. Jamur ini tumbuh secara lambat. Jamur
golongan dermatofita ini membentuk koloni filamen pada biakan
Sabouroud Dekstrosa Agar. Pada umumnya genus Trichophyton
memiliki dinding tipis, makrokonidia halus, mikrokonidia kecil,
berdinding tipis, berbentuk lonjong dan terletak pada konidiofora yang
pendek dan tersusun secara satu persatu pada sisi hifa (en thyrse) atau kelompok (en grappe). Hifa Trichophyton rubrum halus dan hampir semua jenis jamur ini mampu membentuk hifa spiral (Gandahusada
dkk., 1998).
Spesies jamur ditentukan oleh sifat koloni, hifa, dan spora
yang dibentuk. Pada media Sabouroud Dekstrosa Agar mikrokonodia kecil, perifer, atau seperti buah pear, berwarna putih, permukaan
bawah plate. Makrokonidia berdinding halus berbentuk silinder
(Lusia, 2004).
Gambar 2. Biakan dan Gambar Mikroskopis
Trichophyton rubrum (Wolff et al, 2008)
c. Habitat
Jamur Trichophyton adalah dermatofita yang habitatnya di tanah, binatang, dan manusia, terutama pada daerah yang beriklim
tropis dan basah. Berkaitan dengan afinitasnya, genus Trichophyton
dibagi menjadi geofilik (hidup di tanah), antropofilik (hidup pada
daerah di Asia Tenggara, dan sebagian di Afrika, Australia, dan
hampir di seluruh dunia (Robbins, 2005). Penyakit infeksi jamur yang
disebabkan karena Trichophton rubrum ini dapat ditularkan melalui kontak langsung pada bagian yang terinfeksi (Wolff et al, 2008).
d. Patogenesis
Dermatofita merupakan jamur yang menginfeksi jaringan
keratin seperti pada kulit, rambut, dan kuku. Infeksi dimulai dengan
perlekatan dermatofita pada jaringan keratin dan kemudian terjadi
penetrasi ke stratum corneum yang dibantu oleh enzim keratolitik
proteinase, lipase dan enzim mucinolitik yang dihasilkan oleh jamur
(Wolff et al, 2008). Enzim keratolitik proteinase tersebut berdifusi ke lapisan epidermis dan menimbulkan reaksi inflamasi. Pertumbuhan
jamur dengan pola radial menyebabkan timbulnya lesi kulit
melingkar, batas tegas dan meninggi yang disebut ringworm atau tinea
(Mansjoer dkk, 2000).
Berikut ini beberapa manifestasi klinik yang ditimbulkan oleh
infeksi jamur Trichophyton rubrum: 1) Tinea pedis
Tinea pedis adalah dermatofitosis yang paling banyak di dunia
(Robbins, 2005). Tinea Pedis adalah infeksi jamur superficial
pada pergelangan kaki, telapak, dan sela jari-jari kaki. Penyakit
ini ditularkan pada semua usia terutama pada daerah tropis.
mempermudah infeksi. Manifestasi klinisnya berupa eritema,
maserasi serta sisik pada sela jari-jari kaki, dapat meluas pada
telapak kaki serta dapat berkembang menjadi pustula dan vesikula
(Siregar, 2004).
Gambar 3. Tinea Pedis (Daili dkk, 2005) 2) Tinea manus
Serupa dengan Tinea Pedis tapi pada pergelangan tangan, telapak
tangan, bahkan ujung-ujung jari tangan. Gambaran klinisnya
berupa vesikel-vesikel atau skuama dengan eritema, berbatas
tegas dengan disertai rasa gatal (Siregar, 2004).
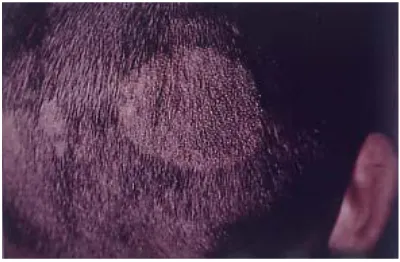
Gambar 4. Tinea Manus (Daili dkk, 2005) 3) Tinea capitis
Menyerang kulit kepala dan rambut. Ciri khas penyakit ini adalah
pada laki-laki, lingkungan kotor dan panas serta udara yang
lembab ikut berperan dalam penularan. Kelainan yang tergantung
dari bentuknya. Keluhan penderita umumnya gatal dan nyeri
(Siregar, 2004).
Gambar 5. Tinea Capitis (Daili dkk, 2005) 4) Tinea corporis
Tinea corporis adalah infeksi jamur dermatofita yang mengenai
wajah, badan, lengan, serta tungkai. Dapat menyerang pada
semua umur, tetapi lebuh banyak pada dewasa, di daerah tropis
serta lembab,. Gejala berupa gatal, berkeringat, macula
hiperpigmentasi, lebih sering kronis (Siregar, 2004).
Tinea unguium adalah infeksi jamur dermatofit pada kuku, sering
pada dewasa biasanya bersama tinea pedis et manus, dan pada
daerah tropis. Gejala klinis berupa penampakan kuku suram,
lapuk dan rapuh, dan dimulai dari arah distal (Siregar, 2004).
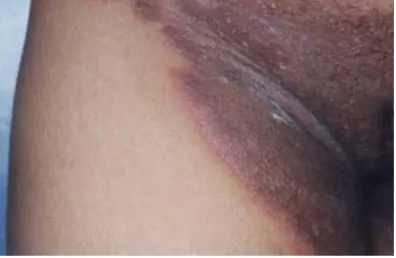
Gambar 7. Tinea Unguium (Daili dkk, 2005) 6) Tinea cruris
Tinea cruris adalah infeksi jamur dermatofita yang menyerang
daerah cruris. Prevalensi lebih banyak pada orang dewasa
terutama laki-laki, dan mereka yang tinggal di daerah tropis
(Siregar, 2004).
Gambar 8. Tinea Cruris (Daili dkk, 2005)
B. Kerangka Pemikiran
C. Hipotesis
Ekstrak kelopak bunga Rosella (Hibiscus sabdariffa L) memiliki efek antifungi terhadap Trichophyton rubrum.
Flavonoid : Anthochyanin
Gossypetin (hexahydroxyflavone) 3-glucoside Flavonol glucoside hibiscritin
Flavonoid gossypeptine
Delphinidine 3-monoglucoside
Gangguan permeabilitas membran
BAB III
METODE PENELITIAN
A. Jenis Penelitian
Penelitian ini merupakan penelitian eksperimental laboratorium.
B. Lokasi Penelitian
Penelitian ini dilakukan di Laboratorium Mikrobiologi Universitas
Setia Budi Surakarta.
C. Subjek Penelitian
Biakan Trichophyton rubrum yang diperoleh dari Laboratorium Mikrobiologi Universitas Setia Budi Surakarta.
D. Teknik Pengambilan Sampel
Pengambilan sampel dilakukan dengan cara Random Sampling
(Utarini, 2000). Sampel yang dipilih yaitu biakan Trichophyton rubrum
dalam agar miring yang berumur 7 hari. Koloni Trichophyton rubrum
diambil untuk diencerkan dengan NaCl 0,9 % sampai kekeruhannya
ekuivalen dengan standarisasi 0,5 Mc Farland (Santos et al, 2006).
E. Identifikasi Variabel
1. Variabel bebas : ekstrak kelopak bunga Rosella (Hibiscus sabdariffa L)
2. Variabel tergantung : efek antifungi (diameter zona hambatan)
3. Variabel luar
1) Umur jamur
2) Jumlah sample (jumlah koloni)
3) Tumbuhnya kuman kontaminan
4) Volume ekstrak kelopak bunga Rosella pada sumuran
5) Suhu pengeraman
b. Variabel luar tidak terkendali
Kecepatan tumbuh Trichophyton rubrum pada media
F. Skala Variabel
1. Kadar ekstrak kelopak bunga Rosella (Hibiscus sabdariffa L) : skala rasio
2. Diameter zona hambatan (efek antifungi) : skala rasio
G. Definisi operasional variabel
1. Ekstrak kelopak bunga Rosella (Hibiscus sabdariffa L)
Ekstrak kelopak bunga Rosella yang digunakan adalah ekstrak ethanol
kelopak bunga Rosella yang diencerkan dengan kadar pengenceran
yang berbeda-beda menggunakan akuades steril. Ethanol yang yang
merupakan pelarut dalam proses ekstraksi akan menguap saat
pemanasan pada proses ekstraksi, sehingga akuades steril sebagai
pengencer ekstrak kemudian dipakai sebagai kontrol negatif (Ngane et al, 2006). Pada uji pendahuluan, konsentrasi ekstrak yang dipakai adalah 20%, 40%, 60%, dan 80% (Olaleye, 2007). Sedangkan kadar
pendahuluan yang dibandingkan dengan kontrol positif dimana
konsentrasi yang memiliki hasil yang paling mendekati dengan kontrol
positif yang akan digunakan sebagai konsentrasi dasar untuk
menentukan konsentrasi yang akan dipakai. Kontrol positif yang
digunakan adalah flukonazol 25 µg/ml.
2. Efek antifungi
Zona hambatan pada penelitian ini dapat dilihat dari besarnya diameter
daerah halo atau zona jernih sekitar sumuran yang telah diberi ekstrak
kelopak bunga Rosella. Zona jernih tersebut menunjukkan hambatan
pertumbuhan Trichophyton rubrum. 3. Variabel luar yang terkendali
a. Umur jamur
Umur jamur dikendalikan dengan memilih biakan Trichophyton rubrum pada Saboraud Dextrose Agar Slant yang berumur 7 hari (Santos et al, 2006).
b. Jumlah sampel (jumlah koloni)
Jumlah Trichophyton rubrum dapat dikendalikan dengan mengencerkan jamur sebelum ditanam hingga ekuivalen dengan
standar 0,5 Mc Farland (Santos et al, 2006) yang kurang lebih sama dengan jumlah koloni sebesar 1x107 sampai 1x108 CFU/ml (Quelab,
2005).
Untuk mengendalikan tumbuhnya kuman kontaminan maka pada
Saboraud Dextrosa Agar ditambahkan ditambahkan kloramfenikol (Bridson, 1998).
d. Volume ekstrak kelopak bunga Rosella pada sumuran
Volume ekstrak yang digunakan adalah 0,05 ml.
e. Suhu pengeraman
Jamur diinkubasi pada suhu 25° C selama 7 hari (Ngane et al, 2006).
4. Variabel luar yang tidak terkendali
Kecepatan pertumbuhan Trichophyton rubrum merupakan variabel luar yang tidak dapat dikendalikan karena pertumbuhan dipengaruhi
oleh banyak faktor misalnya sebaran koloni.
H. Desain penelitian
1. Uji pendahuluan
Dilakukan untuk menentukan konsentrasi ekstrak kelopak bunga
Rosella yang dipakai pada penelitian. Pada uji pendahuluan ini, zona
hambatan pada masing-masing konsentrasi ekstrak kelopak bunga
Rosella akan dibandingkan dengan zona hambatan pada kontrol
positif. Konsentrasi ekstrak kelopak bunga Rosella yang memiliki
sebagai konsentrasi acuan untuk menentukan konsentrasi yang akan
digunakan pada penelitian.
2. Penelitian
Trichohyton rubrum yang telah setara dengan standar 0,5 Mc Farland
Dibiakkan dalam 3 Saboraud Dekstrosa Agar plate
Dibuat 4 sumuran berdiameter 6 mm
Plate 1-2
Sumuran 1 : konsentrasi 20% Sumuran 2 : konsentrasi 40% Sumuran 3 : konsentrasi 60% Sumuran 4 : konsentrasi 80%
Plate 3 ;
Sumuran 1-2 : kontrol positif (flukonazol 25µg/ml)
Sumuran 3-4 : kontrol negatif (akuades steril)
Seluruh cawan petri dimasukkan ke dalam inkubator pada suhu 25°C selama 7 hari
Diameter zona hambatan diukur
Hasil dari uji pendahuluan akan digunakan untuk menentukan konsentrasi yang akan dipakai pada penelitian
I. Alat dan bahan penelitian
1. Alat penelitian
a. Cawan petri dengan diameter 10 cm
b. Osche kolong
c. Autoclave
Dibiakkan dalam 7 Saboraud Dextrosa Agar plate
dibuat 4 sumuran berdiameter 6mm pada masing-masing Sabouraud Dextrosa Agar plate untuk pemberian aquades steril, ekstrak kelopak
bunga Rosella dengan berbagai konsentrasi dan flukonazol
Rosella
Seluruh cawan petri dimasukkan ke dalam inkubator pada suhu 25°C selama 7 hari
Diameter zona hambatan diukur
d. Inkubator
e. Pipet mikron
f. Bunsen
g. Tabung reaksi
h. Alat pembuat sumuran berdiameter 6 mm
i. Pipet ukur 0,01 ml
j. Penggaris
k. Standar 0,5 Mc.Farland
l. Timbangan digital
2 Bahan
a. Saboraud Dextrose Agar (SDA) b. Biakan Trichophyton rubrum
c. Ekstrak kelopak bunga Rosella (Hibiscus sabdariffa L) d. Akuades steril
e. Kapsul Flukonazol
f. Kloramfenikol
g. NaCl 0,9%
J. Cara Kerja
1. Pembuatan Ekstrak
a. Kelopak bunga Rosella diserbuk dengan mesin penyerbuk
b. Kemudian serbuk kelopak bunga Rosella ditambahkan
ethanol 70% diaduk selama 30 menit diamkan 24 jam, lalu
disaring. Proses ini diulang 3 kali.
c. Dipisahkan ampas dengan filtratnya. Filtrat yang diperoleh
diuapkan dengan vacuum rotary evaporator, pemanas water bath
suhu 70
d. Dari proses diatas diperoleh ekstrak kental, yang kemudian
dituang ke dalam cawan porselin, dipanaskan dengan pemanas
water bath sambil terus diaduk.
e. Proses ekstraksi selesai dan didapatkan ekstrak kelopak
bunga Rosella.
Pembuatan ekstrak dilaksanakan di LPPT Universitas Gadjah
Mada Yogyakarta.
2. Penelitian Pendahuluan
Penelitian pendahuluan dilakukan untuk menentukan konsentrasi
ekstrak kelopak bunga Rosella yang nanti akan digunakan pada
penelitian.
a. Pembuatan media agar dari Saboraud Dextrose Agar
1) Sebanyak 5,85 gram Saboraud Dextrose Agar
bubuk ditambahakan dengan 90 ml akuades, diaduk
kemudian dipanaskan.
Setiap 1000 ml Saboraud Dextrose Agar memerlukan 400 mg kloramfenikol, maka :
Kloramfenikol yang diperlukan untuk 90 ml Saboraud Dextrose Agar adalah 90 ml x 400 mg = 36 mg
1000 ml
Setiap 250 mg kloramfenikol dilarutkan dalam 10 ml NaCl
0,9 % maka:
NaCl 0,9% yang diperlukan adalah 36 mg x 10 ml = 1,44 ml
250 mg
(Bridson, 1998)
3) Larutan kloramfenikol yang ditambahkan pada
Saboraud Dextrose Agar cair untuk mencegah tumbuhnya kuman kontaminan. (Bridson, 1998).
4) Saboraud Dextrose Agar cair disterilkan dengan autoclave dengan suhu 121 selama 15 menit bersama
peralatan penelitian lain yang akan digunakan.
5) Saboraud Dextrose Agar cair dituang ke dalam 3 buah cawan petri yang telah disterilkan dan dibiarkan dingin.
b. Penanaman Trichophyton rubrum
Biakan subkultur dari Trichophyton rubrum diambil menggunakan osche steril ke dalam larutan NaCl 0,9% sampai
Trichophyton rubrum dituang ke masing-masing cawan petri yang berisi Saboraud Dextrose Agar. Kemudian sampel diratakan. c. Pada setiap plate, sumuran diberi 0,05 ml ekstrak kelopak
bunga Rosella (Hibiscus sabdariffa L) dengan konsentrasi 20%, 40%, 60% dan 80%. 0,05 ml flukonazol 25 µg (Ellis, 2009)
sebagai kontrol (+) dan aquades sebagai kontrol (-) (Ngane et al, 2006).
d. Semua cawan petri dimasukkan ke dalam incubator pada
suhu 25 selama 5-7 hari (Ngane et al, 2006)
e. Zona jernih disekeliling sumuran diukur dengan
meggunakan penggaris.
3. Tahap Penelitian
a. Penentuan besar sampel dihitung dengan rumus Federer
(Olaleye, 2007)
Keterangan :
n = besar sampel
t = jumlah kelompok perlakuan
Karena penelitian ini menggunakan 8 kelompok perlakuan, maka:
(n-1) (t-1) > 15
6n > 21
n > 3,5
Dari perhitungan di atas, setiap kelompok perlakuan minimal
harus memiliki jumlah sampel sebesar 4 sampel. Pada penelitian
ini akan digunakan 4 sampel pada masing-masing kelompok
perlakuan.
b. Pembuatan media Saboraud Dextrose Agar
1) Sebanyak 13,65 gram Saboraud Dextrose Agar
bubuk ditambahkan dengan 210 ml aquades, diaduk
kemudian dipanaskan.
2) Kloramfenikol ditambahkan pada Saboraud
Dextrose Agar cair untuk mencegah tumbuhnya kuman kontaminan (Bridson, 1998)
Setiap 1000 ml Saboraud Dextrose Agar memerlukan 400 mg kloramfenikol, maka :
Kloramfenikol yang diperlukan untuk 330 ml Saboraud Dextrose Agar cair
= 210 ml x 400 mg = 84 mg
1000 ml
Setiap 250 mg kloramfenikol dilarutkan dalam 10 ml NaCl
0,9% maka :
NaCl 0,9% yang diperlukan= 84 mg x 10 ml = 3,36
250 mg
(Bridson, 1998)
c. Larutan kloramfenikol ditambahkan pada Saboraud
Dextrose Agar cair untuk mencegah tumbuhnya kuman kontaminan (Bridson, 1998)
d. Saboraud Dextrose Agar cair disterilkan dengan autoclave dengan suhu 121 selama 15 menit bersama peralatan penelitian
lain yang akan digunakan.
e. Saboraud Dextrose Agar cair dituang ke dalam 7 buah cawan petri yang telah disterilkan dan dibiarkan dingin
f. Setelah itu dibuat 4 sumuran pada masing-masing plate
dengan diameter 6 mm.
g. Penanaman biakan Trichophyton rubrum
0,2 ml sampel cair Trichophyton rubrum yang setara dengan kekeruhan 0,5 Mc Farland dituang ke masing-masing cawa petri yang berisi Saboraud Dextrose Agar. Cawan petri digoyang untuk meratakan koloni (Santos et al, 2006).
h. Ekstrak kelopak bunga Rosella (Hibiscus sabdariffa L) diencerkan dengan akuades dengan konsentrasi yang ditentukan
kemudian setelah melihat hasil penelitian pendahuluan. Jumlah
perlakuan yang akan dilakukan sebanyak 5 kelompok perlakuan.
i. Masing-masing sumuran diisi dengan 0,05 ml aquades
sabdariffa L) dengan 5 konsentrasi yang berbeda-beda dan 0,05 ml flukonazol 25 µg sebagai kontrol positif. Setiap kelompok
perlakuan diuji dalam 4 sumuran.
j. Semua cawan petri kemudian dimasukkan ke dalam
incubator dengna suhu 25 selama 5-7 hari (Ngane et al, 2006). k. Zona jernih di sekeliling sumuran diukur dengan
menggunakan penggaris.
K. Analisis Data
Analisa data dilakukan dengan membandingkan diameter zona hambat
disekeliling sumuran yang menggambarkan efek antifungi ekstrak kelopak
bunga Rosella pada berbagai konsentrasi. Dalam penelitian ini data akan
diolah dengan menggunakan uji statistik parametrik yakni One Way ANOVA kemudian dilanjutkan dengan Post Hoc Test LSD. Uji ANOVA dilakukan untuk membandingkan rata-rata diameter ketujuh kelompok
sekaligus sehingga dapat diketahui apakah ketujuh kelompok perlakuan
memiliki rata-rata diameter zona hambatan yang berbeda secara signifikan
atau tidak dan untuk membandingkan perbedaan antara masing-masing
kelompok diuji dengan LSD. Data akan diolah dengan menggunakan
Statistical Product and Service Sollution (SPSS) 16,0 for windows.
BAB IV
HASIL PENELITIAN
A. Data Hasil Penelitian
Sebelum uji penelitian, dilakukan terlebih dahulu uji pendahuluan
mengenai pengaruh ekstrak kelopak bunga Rosella terhadap pertumbuhan
Trichophyton rubrum secara in vitro yang didapatkan hasil seperti pada tabel berikut :
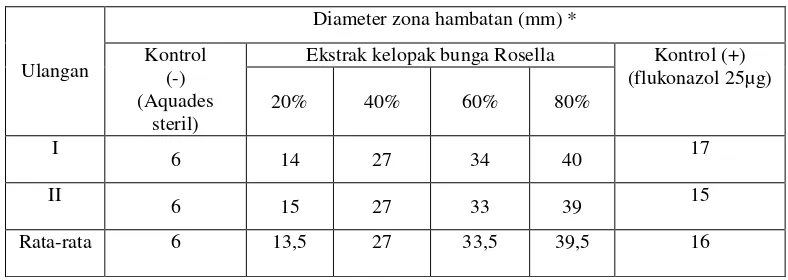
Tabel 2. Hasil Pengukuran Diameter Zona Hambatan Trichophyton rubrum
pada Uji Pendahuluan
*Keterangan : Pengukuran diameter zona hambatan termasuk diameter sumuran 6 mm
Dari hasil uji pendahuluan di atas terlihat bahwa diameter zona
hambatan pada konsentrasi 20% menunjukkan hasil yang paling mendekati
dengan hasil diameter zona hambatan kontrol positif, sehingga konsentrasi
20% dipakai menjadi dasar atau acuan untuk menentukan konsentrasi yang
akan dipakai pada penelitian yang sebenarnya. Uji pendahuluan dilanjutkan Diameter zona hambatan (mm) *
dengan uji penelitian yang memakai konsentrasi 10 % hingga 50 % dengan
interval 10 % , diharapkan semakin pendek intervalnya dapat diperoleh hasil
yang lebih baik. Hasil uji penelitian dapat dilihat pada tabel 3.
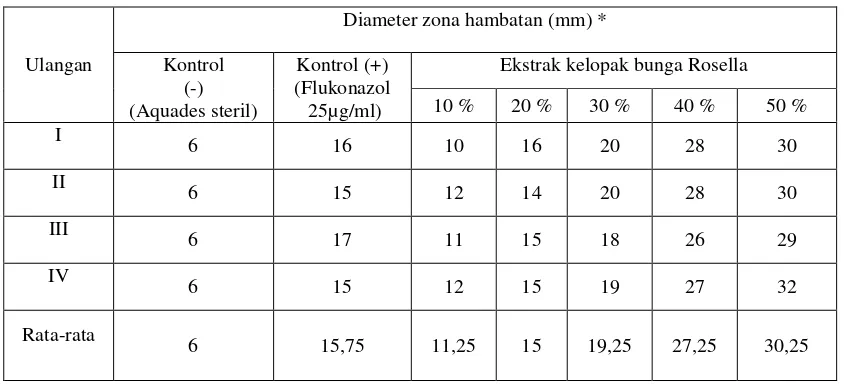
Tabel 3. Hasil Pengukuran Diameter Zona Hambatan Trichophyton rubrum
pada Uji Penelitian
*Keterangan : Pengukuran diameter zona hambatan termasuk diameter sumuran 6 mm
Berdasarkan hasil uji penelitian (tabel 3), kemudian dibuat diagram
yang menggambarkan rata-rata diameter zona hambatan Trichophyton rubrum pada masing-masing kelompok perlakuan.
Diameter zona hambatan (mm) *
Gambar 9. Diagram Rata-rata Zona Hambatan Berbagai Konsentrasi Ekstrak Kelopak Bunga Rosella
Pada diagram gambar 8 di atas dapat dilihat adanya perbedaan
diameter zona hambatan yang menunjukkan perbedaan efek antifungal pada
masing-masing kelompok perlakuan. Pada kelompok ekstrak kelopak bunga
Rosella tampak bahwa efek antifungal terhadap pertumbuhan Trichophyton rubrum secara in vitro meningkat seiring dengan meningkatnya konsentrasi ekstrak kelopak bunga Rosella yang digunakan. Kontrol negatif dengan
menggunakan aquadest steril tidak menunjukkan adanya efek antifungi,
angka 6 mm pada gambar 8 di atas merupakan diameter sumuran, bukan
merupakan diameter zona hambatan.
B. Analisis Data
Z O N A
H A M B A T (mm)
+ - 10% 20% 30% 40% 50%
Data hasil penelitian pada tabel 3 yang berupa diameter zona
hambatan dianalisis dengan uji One Way ANOVA yang kemudian dilanjutkan dengan Post Hoc Test berupa uji Least Significance Difference
(LSD). Data diolah dengan program Statistical Product and Service Solution (SPSS) 16,00 for Windows.
1. Uji One Way ANOVA
Hasil penelitian pada tabel 3, setelah diuji dengan uji One Way
ANOVA dengan program Statistical Product and Service Solution (SPSS)
16,00 for Windows, didapatkan hasil sebagai berikut :
Tabel 4. Hasil Uji Statistik One Way ANOVA ANOVA
diameter
Sum of Squares df Mean Square F Sig.
Between Groups 1762.357 6 293.726 347.507 .000
Within Groups 17.750 21 .845
Total
1780.107 27
Perbedaan rata-rata diameter zona hambatan antara seluruh kelompok
perlakuan dianalisis secara statistik dengan uji One Way ANOVA dan didapatkan p < 0,05 seperti pada tabel di atas, sehingga didapatkan bahwa
terdapat perbedaan rata-rata zona hambatan yang signifikan di antara ketujuh
kelompok perlakuan.
Karena ada perbedaan yang signifikan di antara kesembilan kelompok
perlakuan, maka dilanjutkan dengan Post Hoc Test berupa uji LSD untuk membandingkan rata-rata diameter zona hambatan antar kelompok perlakuan
sehingga dapat diketahui kelompok mana yang berbeda secara signifikan atau
tidak dengan kelompok lain. Adapun hasil uji LSD didapatkan hasil sebagai
berikut :
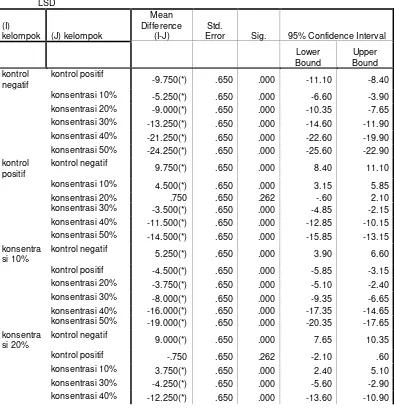
Tabel 5. Hasil Uji Statistik Least Significance Difference (LSD) Multiple Comparisons
Error Sig. 95% Confidence Interval
konsentrasi 50% -15.250(*) .650 .000 -16.60 -13.90
* The mean difference is significant at the .05 level.
Hasil uji LSD menunjukkan perbandingan rata-rata diameter zona
hambatan kelompok kontrol negatif menunjukkan perbedaan yang signifikan
dengan semua kelompok lainnya. Perbandingan rata-rata diameter zona
hambatan kelompok kontrol positif menunjukkan perbedaan yang signifikan
dengan semua kelompok, kecuali dengan kelompok konsentrasi 20%.
Perbandingan rata-rata diameter zona hambatan kelompok konsentrasi 10%
menunjukkan perbedaan yang signifikan dengan semua kelompok.
Perbandingan rata-rata diameter zona hambatan kelompok konsentrasi 20%
menunjukkan perbedaan yang signifikan dengan semua kelompok, kecuali
dengan kelompok kontrol positif. Perbandingan rata-rata diameter zona
hambatan kelompok 30% menunjukkan perbedaan yang signifikan dengan
40% menunjukkan perbedaan yang signifikan dengan semua kelompok.
Perbandingan rata-rata diameter zona hambatan kelompok konsentrasi 50%
menunjukkan perbedaan yang signifikan dengan semua kelompok.
BAB V PEMBAHASAN
Pada tahap persiapan sebelum penelitian, telah dilakukan uji pendahuluan
yang bertujuan untuk menentukan konsentrasi ekstrak kelopak bunga Rosella
yang akan digunakan dalam penelitian. Pada uji pendahuluan, ekstrak kelopak
bunga Rosella dibuat dalam 4 konsentrasi, yaitu 20 %, 40 %, 60 %, dan 80%
(Olaleye, 2007) . Selain itu pada uji pendahuluan juga digunakan kontrol positif
flukonazol 25 µg/ml. Konsentrasi ini adalah konsentrasi standar yang biasa
digunakan untuk uji sensitifitas flukonazol terhadap Trichophyton rubrumin vitro
dimana flukonazol akan memberikan hasil yang positif (Ellis, 2009). Dari hasil uji
pendahuluan ini akan dicari konsentrasi ekstrak yang memberi hasil yang
mendekati hasil pada kontrol positif. Berdasarkan hasil uji pendahuluan pada tabel
2, hasil diameter pada konsentrasi 20% adalah hasil yang paling mendekati
sebagai dasar atau acuan untuk menentukan konsentrasi ekstrak yang akan dipakai
dalam uji penelitian. Konsentrasi yang digunakan pada penelitian ini dimulai dari
konsentrasi 10% hingga 50 % dengan interval 10 %, diharapkan semakin pendek
intervalnya dapat diperoleh hasil yang lebih baik.
Pada penelitian ini, biakan Trichophyton rubrum dibagi dalam tujuh kelompok yang masing-masing diberi perlakuan yang berbeda. Kelompok
pertama diberi perlakuan dengan akuades steril sebagai kontrol negatif, kelompok
kedua diberi flukonazol 25 µg/ml sebagai kontrol positif, kelompok ketiga sampai
ketujuh masing-masing diberi ekstrak kelopak bunga Rosella konsentrasi 10%,
20%, 30%, 40%, dan 50%.
Kontrol negatif yang digunakan dalam penelitian ini adalah akuades steril.
Berdasarkan hasil pada tabel 3 dapat dilihat bahwa pada kelompok pertama yang
menggunakan aquades steril sebagai kontrol negatif tidak terdapat zona hambatan.
Biakan Trichophyton rubrum yang diberi perlakuan dengan kontrol negatif akuades steril memperlihatkan pertumbuhan merata di sekitar sumuran. Hal ini
menunjukkan bahwa sampel Trichophyton rubrum yang digunakan untuk penelitian tumbuh dengan baik.
Kontrol positif yang digunakan dalam penelitian ini adalah flukonazol
dengan konsentrasi karena telah terbukti bekerja secara tepat dan efektif untuk
pengobatan infeksi jamur superficial dan sistemik (Adiguna, 2000). Konsentrasi
flukonazol yang dipakai dalam kontrol positif ini adalah konsentrasi yang
menunjukkan hasil sensitif pada uji sensitifitas terhadap Trichophyton rubrum in vitro dengan menggunakan metode difusi, yakni konsentrasi 25µg/ml (Ellis,
2009). Mekanisme antifungi flukonazol adalah dengan mengganggu struktur dan
fungsi membran sel jamur. Flukonazol menghambat biosíntesis ergosterol yang
merupakan sterol utama penyusun membran sel jamur. Berkurangnya ergosterol
akan menyebabkan membran sel jamur menjadi tidak stabil sehingga akan terjadi
kebocoran komponen penting dalam sel. Kebocoran
komponen-komponen penting dalam sel jamur tersebut akan mengganggu metabolisme sel
jamur sehingga pertumbuhan terhambat dan akan terjadi kematian sel jamur
(Neal, 2006).
Hasil penelitian pada tabel 3 menunjukkan bahwa ekstrak kelopak bunga
Rosella (Hibiscus sabdariffa L) memiliki efek antifungi terhadap Trichophyton rubrum in vitro. Hal ini sesuai dengan hipotesis awal yang menyebutkan bahwa ekstrak kelopak bunga Rosella (Hibiscus sabdariffa L) memiliki efek antifungi terhadap Trichophyton rubrum in vitro. Efek antifungi ditunjukkan dengan adanya zona hambatan yang terbentuk pada kelompok perlakuan ekstrak kelopak bunga
Rosella konsentrasi 10%, 20%, 30%, 40 %, dan 50%.Pada grafik batang (gambar
8)dapat dilihat bahwa semakin tinggi konsentrasi ekstrak kelopak bunga Rosella
yang digunakan, semakin besar rata-rata diameter zona hambatan yang
dihasilkan. Hal ini juga bisa dinyatakan bahwa makin tinggi konsentrasi ekstrak kelopak bunga Rosella yang digunakan semakin tinggi pula efek antifungi yang
dihasilkan.
Uji One Way ANOVA digunakan untuk mengetahui apakah terdapat perbedaan rata-rata diameter zona hambatan yang signifikan pada ketujuh
menunjukkan bahwa perbedaan rata-rata diameter zona hambatan pada ketujuh
kelompok perlakuan adalah signifikan dengan p < 0,05, yang menunjukkan bahwa
ekstrak kelopak bunga Rosella mempunyai pengaruh yang berbeda di setiap
konsentrasi dalam menghambat pertumbuhan Trichophyton rubrum secara in vitro.
Uji LSD (tabel 5), terlihat bahwa kelompok kontrol negatif (aquadest
steril) memiliki perbedaan yang signifikan dengan semua kelompok perlakuan.
Hal ini dikarenakan aquadest steril tidak mempunyai efek antifungal terhadap
Trichophyton rubrum. Kelompok kontrol positif juga memiliki perbedaan yang signifikan dengan semua kelompok, kecuali dengan kelompok ekstrak kelopak
bunga Rosella dengan konsentrasi 20 %. Begitu pula dengan kelompok perlakuan
ekstrak kelopak bunga Rosella dengan konsentrasi 20%, kelompok ekstrak
kelopak bunga Rosella konsentrasi 20% memiliki perbedaan signifikan dengan
semua kelompok perlakuan kecuali dengan kontrol positif. Pemberian 0,05 ml
kelompok ekstrak kelopak bunga Rosella konsentrasi 20 % menghasilkan zona
hambatan yang hampir sama dengan pemberian 0,05 ml flukonazol konsentrasi
25µg/ml. Walaupun sedikit berbeda (sedikit lebih besar pada flukonazol), namun
dari analisis statistik menunjukkan bahwa kedua kelompok tersebut memiliki efek
antifungal yang tidak berbeda secara signifikan. Dengan ini dapat disimpulkan
bahwa ekstrak kelopak bunga Rosella konsentrasi 20% memiliki keefektifan yang
sama dengan flukonazol 25 µg/ml dalam menghambat pertumbuhan jamur
masing-masing memiliki perbedaan hasil yang signifikan dengan semua kelompok
perlakuan.
Dari hasil penelitian ini, ekstrak kelopak bunga Rosella (Hibiscus sabdariffa L) dapat digunakan sebagai alternatif terapi untuk infeksi jamur dermatofitosis khususnya jamur Trichophyton rubrum. Penggunaan ekstrak kelopak bunga Rosella sebagai infeksi dermatofitosis ini dapat digunakan secara
topikal maupun sistemik, namun perlu dilakukan penelitian lebih lanjut untuk
mengetahui dosis terapi yang tepat dan dosis toksiknya. Ekstrak tanaman Rosella
ini tergolong memiliki derajat toksisitas yang rendah. Berdasarkan penelitian yng
dilakukan pada tikus, ekstrak kelopak bunga Rosella memiliki dosis letal pada
dosis diatas 5000 mg/kg. Selain itu, pemakaian yang lama dan dengan dosis tinggi
juga dilaporkan mengganggu testis dari tikus (Ali et al., 2005).
Efek antifungi yang dihasilkan oleh kelopak bunga Rosella pada penelitian
ini diduga disebabkan karena kelopak bunga Rosella (Hibicscus sabdariffa L) mengandung beberapa senyawa flavonoid yakni anthocyanin, gossypeptin
(hexahydroxyflavone) 3-glucoside (Bisset, 1994), flavonol glucoside hibiscritin,
flavonoid gossypeptin, delphinidine 3-monoglucoside, cyanidin 3-monoglucoside
(Maryani dan Kristiana, 2005). Pada penelitian ini tidak dilakukan ekstraksi
dengan isolasi zat flavonoid, namun pada ekstraksi digunakan pelarut ethanol
yang akan melarutkan zat flavonoid. Flavonoid merupakan senyawa polar, oleh
karena itu flavonoid larut dalam pelarut polar seperti ethanol, methanol, butanol,
aseton, dimetil sulfoksida, dimetilforfamid, dan air (Arini, 2003)
.
Ethanol ini akanpenelitian. Flavonoid disintesis tumbuhan sebagai respon terhadap infeksi
mikroorganisme, karena itu flavonoid merupakan senyawa antimikrobial yang
efektif (Al-Bayati and Al-Mola, 2008). Aktifitas biologis yang dimiliki oleh
flavonoid diantaranya adalah antibakteri, antijamur, antiviral, antiprotozoa,
antioksidan, dan antiinflamasi (Cushnie and Lamb, 2005). Mekanisme antifungi
antara flukonazol dan ekstrak kelopak bunga Rosella dalam menghambat
pertumbuhan jamur pada dasarnya sama yakni senyawa flavonoid dapat
mengganggu struktur dan fungsi membran sel jamur. Mekanisme kerja flavonoid
dalam menghambat pertumbuhan jamur menyebabkan gangguan permeabilitas
membran sel jamur. Gugus hidroksil yang terdapat pada senyawa flavonoid
menyebabkan perubahan komponen dari membrane sel jamur dan transport nutrisi
yang akhirnya akan mengakibatkan timbulnya efek toksik terhadap jamur (Sabir,
2005; Salwa dan Neimat, 2007; Lima et al., 2008).
Dalam penelitian yang dilakukan oleh Olaleye (2007) telah dibuktikan
bahwa flavonoid yang terkandung dalam ekstrak methanol kelopak bunga Rosella
juga merupakan antibakteri yang efektif terhadap Staphylococcus aureus, Bacillus stearothermophilus, Micrococcus luteus, Serratia mascences, Clostridium sporogens, Escherichia coli, Klebsiella pneumoniae, Bacillus cereus,
Pseudomonas fluorescence. Selain itu, anthocyanin yang terkandung dalam kelopak bunga Rosella ini memiliki efek kardioprotektif (Jonadet, 1990),
hipokolesterolemi (Chen et al., 2003), antioksidan dan hepatoprotektif ( Wang et al., 2000).
SIMPULAN DAN SARAN
A. Simpulan
Ekstrak kelopak bunga Rosella (Hibiscus sabdariffa L) memiliki efek antifungi terhadap pertumbuhan Trichophyton rubrum secara in vitro
sehingga dapat dijadikan salah satu alternatif terapi pada penyakit infeksi
dermatofitosis terutama infeksi jamur Trichophyton rubrum. B. Saran
1. Perlu dilakukan penelitian lebih lanjut dengan ekstraksi zat flavonoid
yang terkandung dalam kelopak bunga Rosella yang dimungkinkan
berpengaruh dalam menghambat pertumbuhan jamur Trichophyton rubrum.
2. Perlu dilakukan penelitian secara in vivo untuk mengetahui pengaruh ekstrak kelopak bunga Rosella terhadap Trichophyton rubrum.
3. Perlu dilakukan penelitian tentang efek antifungi ekstrak kelopak
bunga Rosella (Hibiscus sabdariffa L) terhadap jamur dermatofita yang lain.
DAFTARPUSTAKA
Adiguna M.S. 2004. Epidemiologi Dermatomikosis di Indonesia. Dalam:
Dermatomikosis Superfisialis. Jakarta : Fakultas Kedokteran Universitas Indonesia. hh: 1-6.
Ali B.H., Wabel N.A., Blunden G. 2005. Phytochemical, pharmacological and toxicological aspects of Hibiscus sabdariffa L. Phytotherapy Research. volume 19 issue 5 pp 369 – 375.
Al-Bayati F.A., Al-Mola H.F. 2008. Antibacterial and antifungal activities of different part of Tribulus terrestris L. growing in Iraq. J Zhejiang Univ Sci B. 9 (2): 154-159.
Arini, S., Nurmawan D., Alfiani F., Hertiani T. 2003. Daya antioksidan dan kadar flavonoid hasil ekstraksi ethanol-air daging buah mahkota dewa (Phaleria macrocarpa (Scheff.) Boerl.). Buletin Penalaran Mahasiswa UGM. Vol 10 No.01.
Bisset N.G. 1994. Herbal Drug and Phytopharmaceuticals. Stuttgart: Medpharm GmbH Scientific Publisher.
Bramono K. 2008. Dermatomikosis dan Infeksi HIV/AIDS : Sebagai masalah dan sebagai Petunjuk?. http://perdoski.org/index.php/public/information/mdvi-detail-editorial/13. (8 September 2009).
Bridson E.Y. 1998. The Oxoid Manual. 8th Edition. England: Oxoid Limited Hampsire.
Buana M.F., Indrianto N., Setyawati L., Sari D.K., Islakhiyah K. 2008. Budidaya Rosella Merah (Hibiscus sabdariffa) sebagai Makanan Tambahan yang Bergizi Tinggi dan Apotek Hidup di Pekarangan Rumah. Program Kreativitas Mahasiswa.
Chen C.C., Hsu J.D., Wang S.F., Chrang H.C., Yang M.Y., Kao E.S., Ho Y.O., Wang C.J. (2003). Hibscus sabdariffa extrac inhibit the development of atherosclerosis in cholesterol-fed rabbits. J. Agric. Food Chem. 51(18): 5472-5477.
Cheppy S., Hernani. 2002. Budidaya Tanaman Obat Komersial. Jakarta: Penebar Swadaya. hh:1-2.
Chusnie T.P., Lamb A.J. 2005. Antimikrobial activity of Flavonoids.
International Journal of Antimikrobial Agents. 26(5): 343-56.
Daili E.S., Menaldi S.L.,Wisnu I.M. 2005. Penyakit Kulit yang Umum di Indonesia. Jakarta : Medical Multimedia Indonesia.
Ellis D. 2009. Antifungal Susceptibility Testing. http://www.mycology.adelaide. (30 Januari 2009).
Gandahusada S., Ilahude H.D., Pribadi W. 1998. Parasitologi Kedokteran. Jakarta : Balai Pustaka.
Harahap M. 2000. Ilmu Penyakit Kulit. Jakarta : Hipokrates. h: 75.
Hughes N.M., Vogelmann T.C., Smith W.K. 2008. Optical effects of abaxial anthocyanin on absorption of red wavelengths by understorey species : revisiting the back-scatter hyphotesis. Journal of Experimental Botany.
Jonadet M, Bastide J, Bastide P, Boyer B, Carnat A.P., Lamaison J.L. 1990. In vitro enzyme inhibitory and in vivo cardio-protective activities of Hibiscus sabdariffa L. J. Pharmacol. Belgium. 45(2): 120-124.
Lima B., Aguero M.B., Zydaglo J., Tapiai A., Solis C., Rojas De Arias A., Yaluff G., Zaccino S., Feresini G.E., Hirschmann G.S. 2008. Antimicrobial Activity of extracts, Essential Oil and Metabolites Obtained from Tagetas Mendocina. J.Chil. Chem. Soc.
Mansjoer A., Suprohaita, Wardhani W.I., Setiowulan W. (eds). 2000.Mikosis Superfisialis – Dermatofitosis. Dalam : Kapita Selekta Kedokteran. Jakarta : Media Aesculapius. h : 93.
Maryani H., Kristiani L. 2005. Khasiat dan Manfaat Rosella. Jakarta : Agromedia Pustaka.
Nasution M.A. 2005. Mikrobiologi dan Mikologi Kedokteran ; Beberapa Pandangan Dermatologis.http://www.usu.ac.id. (8 September 2009).
Ngane A.N., Etame R.E., Ndifor F., Biyiti L., Zollo P.H., Bouchet P. 2006. Antifungal activity of Chromolaena odorata (L.) King & Robinson (Asteraceae) of Cameroon. Chemotherapy. 52: 103-106.
Olaleye M.T. 2007. Cytotoxicity and antibacterial activity of methanolic extract of Hibiscus sabdariffa.Journal of Medicinal Plants Research. Vol. 1(1).
Pratiwi S.F. 2001. Uji Daya Antijamur Minyak Atsiri beberapa Spesies Suku Zingiberaceae. Pharmacon. 2: 46-50
Quelab. 2005. Mc Farland Standar. http://www.quelab.com/htmleng/2900a.html. (15 Maret 2008).
Rippon J.W. 1974. Medical Mycology : The Pathogenic Fungi and The Pathogenic Actinomycetes. 1st edition. Philadelphia, London, Toronto : W. B. Saunders Company, pp: 1-9, 96-169.
Robbin M.C. 2005. Tinea Pedis. http;//www.emidicine.com (8 September 2009).
Sabir A. 2005. Aktivitas antibakteri flavonoid propolis Trigona sp trhadap bakteri Streptococcus mutans (in vitro). Majalah Kedokteran Gigi. 38:135-141.
Salwa A.A., Neimat A.E. 2007. The effect of Egyptian honeybee propolis on growth of Aspergillus versicolor and sterigmatocystin biosynthesis in Ras cheese. Journal of Dairy Research. 74: 74-78.
Santos D.A., Barros M.E.S., Hamdan J.S. 2006. Establishing a method of inoculums preparation for susceptibility testing of Trichophyton rubrum
and Trichophyton mentagrophytes. Journal of Clinical Microbiology. 44:98-101.
Siregar R.S. 2004. Atlas Berwarna Saripati Penyakit Kulit. Jakarta : EGC.
United State Departement of Agriculture. 2009. Hibiscus sabdariffa L.
Utarini A., Trisnantoro L. (eds). 2000. Catatan Kuliah Metode Penelitian. Yogyakarta : Fakultas Kedokteran Universitas Gadjah Mada Yogyakarta. Hh: 42-43
Wang C.J., Wang J.M., Lin W.L., Chu C.Y., Chou F.P., Tseng T.H. 2000. Protective effect of Hibiscus anthocyanins against tert – butyl hydroperoxide – induced hepatic toxicity in rats. Food Chem. Toxicol. 38 (5): 411 – 416.
Wangjaya. 2008. Mengenal Tanaman Rosella. http://rosela-info.blogspot.com/. (3 Oktober 2009).