LAPORAN PRAKTIKUM KIMIA ANALITIK III
“PENENTUAN KADAR FE DALAM SAMPEL DENGAN MEDOTE SPEKTROFOTOMETRI”
Tanggal praktikum: Kamis, 6 Oktober 2016 Tanggal pengumpulan laporan: Kamis, 20 Oktober 2016
DISUSUN OLEH :
AHMAD HANIF FAHRUDY (1147040003) ANGGI YULIAN SILVIYANADEWI (1147040009)
AYU HASNA ASTARI (1147040015)
KIMIA V-A JURUSAN KIMIA
FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SUNAN GUNUNG DJATI BANDUNG
PENENTUAN KADAR FE DALAM SAMPEL DENGAN MEDOTE SPEKTROFOTOMETRI
Ahmad Hanif Fahrudy, Anggi Yulian Silviyanadewi, Ayu Hasna Astari
Laboratorium Kimia Analitik, Universitas Islam Negeri Sunan Gunung Djati Bandung, 40614, Indonesia
ABSTRAK
Penentuan kadar Fe dalam sampel dilakukan dengan metode spektrofotometri. Instrumen yang digunakan yaitu spektrofotometer UV-Vis dengan panjang gelombang spektrum UV 200-350 nm dan spektrum sinar tampak 350-800 nm. Pada percobaan ini digunakan larutan standar Fe(SO4)2.6H2O dengan konsentrasi 1 ppm; 1,5 ppm; 2 ppm; 2,5 ppm; dan 3 ppm. Nilai adsorbansi larutan sampel Fe yaitu 0,0525 dengan maks 509,0 nm. Konsentrasi sampel Fe dalam sampel yaitu sebesar 0,2180 ppm.
1. PENDAHULUAN
2. Spektrofotometer UV-Vis (Ultra Violet-UV-Visibel) adalah instrumen yang digunakan dalam
menganalisis suatu senyawa kimia dengan pengukuran didaerah ultra violet dan didaerah tampak. metode spektrofotometri berdasarkan pada serapan sinar oleh senyawa yang ditentukan, sinar yang digunakan adalah
sinar yang semonokromatis mungkin.
3. Spektrofotometri UV-Vis melibatkan energi elektronik yang cukup besar pada molekul yang dianalisis, sehingga spektrofotometer UV-Vis lebih banyak dipakai untuk analisis kuantitatif dibanding kualitatif.
ultraviolet (200–350 nm) dan sinar tampak (350 – 800 nm) oleh suatu senyawa. Serapan cahaya ultra violet dan cahaya tampak
mengakibatkan transisi elektronik, yaitu promosi elektron-elektron dari orbital keadaan dasar yang berenergi rendah ke orbital keadaan tereksitasi berenergi lebih tinggi.
5. Panjang gelombang cahaya UV atau cahaya tampak bergantung pada mudahnya promosi elektron. Molekul-molekul yang memerlukan lebih banyak energi untuk promosi
elektron, akan menyerap pada panjang gelombang yang lebih pendek. Molekul yang memerlukan energi lebih sedikit akan menyerap pada panjang gelombang yang lebih panjang. Senyawa yang menyerap cahaya dalam daerah tampak (senyawa berwarna) mempunyai elektron yang lebih mudah dipromosikan dari pada
senyawa yang menyerap pada panjang gelombang lebih pendek.
6. Prinsip kerja spektrofotometri UV-Vis adalah interaksi yang terjadi antara energi yang berupa sinar monokromatis dari sumber sinar dengan materi yang berupa molekul. Besar energi yang diserap tertentu dan menyebabkan elektron tereksitasi dari keadaan dasar ke keadaan tereksitasi yang memiliki energi lebih tinggi.
7. Prinsip kerja
spektrofotometri berdasarkan hukum Lambert Beer, yaitu apabila cahaya monokromatik (Io) melalui suatu media (larutan), maka sebagian cahaya tersebut diserap (Ia), sebagian dipantulkan (Ir), dan sebagian lagi dipancarkan (It).
8. Hukum Lambert-Beer berlaku pada larutan dengan konsentrasi kurang dari sama dengan 0.01 M untuk
sebagian besar zat. Namun, pada larutan dengan
molekul terlarut dapat memengaruhi molekul terlarut lain sebagai akibat dari kedekatan masing-masing molekul pada larutan dengan konsentrasi yang pekat tersebut. Ketika satu molekul dekat dengan
molekul yang lain maka nilai serapan molar dari satu molekul itu akan berubah atau terpengaruh. Secara keseluruhan, nilai adsorbansi yang dihasilkan pun ikut terpengaruh, sehingga secara kuantitatif nilai yang
ditunjukkan tidak mencerminkan jumlah
molekul yang diukur di dalam larutan uji.
9. BAHAN DAN METODE 9.1 Pembuatan Larutan Standar
10. Pembuatan larutan standar Fe(II) 100 ppm yaitu dengan menyiapkan padatan Fe(SO4)2.6H2O 0,07 gram lalu dimasukkan dalam gelas kimia 250 ml. Padatan tersebut dilarutkan dengan 100 ml akuades, ditambahkan 2 ml asam sulfat. Larutan
kemudian dipipet 10 ml dengan pipet volum dan dimasukkan ke dalam labu ukur 250 ml, lalu diencerkan hingga tanda batas (250 ml) dan larutan ini menjadi 10 ppm. Kemudian preparasi deret standar (variasi ppm) dari larutan Fe(II) 10 ppm dihitung dengan pengenceran mol (10 ppm) dan mol (variasi ppm). Di mana variasi ppmnya 1; 1,5; 2,0; 2,5; 3,0 dan volume
larutannya 2,5; 3,75; 5; 6,25; 7,5.
10.1Pengukuran Adsorbansi Larutan Standar dan Larutan Sampel
11. Masing-masing volum deret standar dimasukkan dalam labu ukur 50 ml. Kemudian pada masing-masing labu ukur
ditentukan adsorbansi larutan dengan panjang gelombang maksimum 509,0 nm dan blankonya 0,0001.
12. HASIL DAN PEMBAHASAN
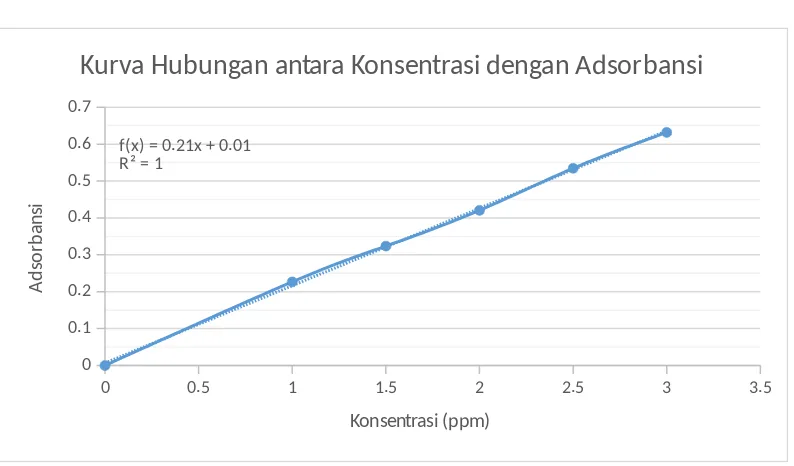
13. Pada larutan standar Fe pada labu ukur dengan konsentrasi 1 ppm terbentuk larutan jingga dengan adsorbansi 0,2267, larutan labu ukur (1,5 ppm) terbentuk larutan jingga + dengan adsorbansi 0,3237, larutan labu ukur (2,0 ppm) terbentuk larutan jingga ++ dengan adsorbansi 0,4206, larutan labu ukur (2,5 ppm) terbentuk larutan jingga ++++ dengan
adsorbansi 0,5345, dan larutan labu ukur (3,0 ppm) terbentuk larutan jingga +++++ dengan adsorbansi 0,6318.
14. Warna pada larutan standar adalah berbanding lurus dengan konsentrasinya, di mana larutan dengan konsentrasi rendah memiliki warna yang lebih cerah, sedangkan larutan yang memiliki konsentrasi tinggi warnanya semakin gelap.
15. Dari data pada tabel dan gambar, terlihat bahwa semakin besar konsentrasi suatu larutan, semakin besar pula nilai
adsorbansinya, sehingga kurva yang dihasilkan yaitu linear dengan persamaan y=0,2096x+0,0068 .
16. Pada sampel yang
mengandung Fe, larutan sampelnya berwarna jingga (---) dan nilai adsorbansinya yaitu 0,0525.
Konsentrasi Fe dalam sampel dapat diketahui dari adsorbansinya, dengan menghitung x dari persamaan linear kurva standar dengan y adalah adsorbansi larutan sampel:
17. y=ax+b
18. y=0,2096x+0,0068
19.
x=Konsentrasi Fe dan y=Adsorbansi sampel
20. x=y−0,0068
Fe2+ meskipun sampel yang digunakan adalah
FeSO4.6H2O yang mana Fe memiliki bilangan oksidasi 2. Senyawa Fe2+ diketahui lebih stabil dari pada Fe3+ karena pada orbital 3d, senyawa Fe2+ memiliki 6 elektron yang terisi penuh, sedangkan pada senyawa Fe3+, orbital 3d hanya terisi 5 elektron.
25. Pada analisis dengan metode spektrofotometri UV-Vis, larutan yang
diidentifikasi haruslah berwarna. Pada keadaan dasar, larutan besi tidak berwarna sehingga perlu penambahan larutan 1,10-fenantrolin agar membentuk senyawa kompleks berwarna. Hal ini disebabkan karena spektrofotometer hanya mengidentifikasi larutan berwarna yang sesuai dengan hukum Lambert-Beer.
26. Reaksi antara Fe dengan 1,10-fenantrolin merupakan reaksi kesetimbangan yang berlangsung pada pH 6 sampai 8, sehingga
diperlukan larutan buffet berupa natrium asetat sebelum ditambah 1,10-fenantrolin.
27. Pada perhitungan adsorpsi Uv-Vis, digunakan panjang gelombang sebesar 509 nm karena pada panjang gelombang tersebut, daya serap larutan standar Fe (II) berada pada titik maksimum. Senyawa Fe (II) dapat mengabsorpsi radiasi karena mengandung elektron yang dapat dieksitasikan ke tingkat energi yang lebih tinggi.
sehingga nilai adsorbansinya kurang tepat.
29. DAFTAR PUSTAKA 30. Gandjar, Ibnu Gholib dan
Rohman. 2007. Kimia Farmasi Analisis. Yogyakarta: Pustaka Pelajar.
31. Fatimah, S, Yanlinastuti dan Yoskasih. 2005. Kualifikasi Alat Spektrometer UV-vis Untuk
Penentuan Uranium dan Besi dalam-U30. Hasil Penelitian
32. Harjadi. 1990. Ilmu Kimia Analitik Dasar. Jakarta: PT. Gramedia.
33. Khopkar, S. M. 2003. Konsep Dasar Kimia Analitik. Jakarta: Universitas Indonesia.
34. Basset, J. 1994. Kimia Analisis Kuantitatif Anorganik. Jakarta: EGC.
37. Tabel Hubungan Konsentrasi terhadap adsorbansi 38.
N
39. Larutan Uji
40. Konsentrasi (ppm)
41. Adsor bansi 42.
1
43. Larutan
Standar 1 44. 1
45. 0,226 7 46.
2
47. Larutan
Standar 2 48. 1,5
49. 0,323 7 50.
3
51. Larutan
Standar 3 52. 2
53. 0,420 6 54.
4
55. Larutan
Standar 4 56. 2,5
57. 0,534 5 58.
5
59. Larutan
Standar 5 60. 3
61. 0,631 8
62. Gambar Kurva Larutan Standar 63.