PENYEDIAAN DAN KARAKTERISASI KITOSAN DARI KULIT
UDANG LIPAN (
Squilla mantis
) SEBAGAI ADSORBEN
UNTUK MENURUNKAN KADAR KOLESTEROL
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
RETNA DAMAYANTI 090822015
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN
ALAM
UNIVERSITAS SUMATERA UTARA
MEDAN
PERSETUJUAN
Judul : PENYEDIAAN DAN KARAKTERISASI
KITOSAN DARI KULIT UDANG LIPAN (Squilla
mantis) SEBAGAI ADSORBEN UNTUK
MENURUNKAN KADAR KOLESTEROL
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN
ALAM ( FMIPA ) UNIVERSITAS SUMATERA UTARA
Disetujui di
Medan, Juli 2013
Komisi Pembimbing :
Pembimbing 2 Pembimbing 1
Dr. Rumondang Bulan. NST. MS Prof.Dr.Harry Agusnar, M.Sc, M.Phil
NIP.19540830195032001 NIP.195308171983031002
Diketahui/Disetujui oleh
Departemen Kimia FMIPA USU Ketua,
PERNYATAAN
PENYEDIAAN DAN KARAKTERISASI KITOSAN DARI KULIT
UDANG LIPAN (
Squilla mantis
) SEBAGAI ADSORBEN
UNTUK MENURUNKAN KADAR KOLESTEROL
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Juli 2013
PENGHARGAAN
Puji dan syukur saya panjatkan kepada Allah SWT yang dengan segala curahan rahmat serta cinta-Nya skripsi ini dapat diselesaikan dengan tepat waktu sebagai salah satu persyaratan untuk meraih gelar Sarjana Sains pada Departemen Kimia pada Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara. Serta shalawat dan salam saya sampaikan pada Rasulullah Muhammad SAW, sebagai sosok tauladan umat.
Selanjutnya saya menyampaikan penghargaan dan cinta kasih yang terdalam dan tulus kepada Ayahanda tersayang dan Ibunda tercinta atas segala doa, semangat, bimbingan dan pengorbanan yang telah diberikan kepada saya sehingga saya bisa menyelesaikan studi saya sampai sekarang ini. Serta tak lupa terima kasih untuk Suami Tercinta yang telah memberikan izin dan dukungan kepada saya hingga saya dapat menyelesaikan skripsi ini.
Dengan segala kerendahan hati, saya mengucapkan terima kasih yang sebesar-besarnya kepada Bapak Prof. Dr. Harry Agusnar, M.Sc, M.Phill selaku dosen Pembimbing 1 yang telah memberikan topik skripsi ini dan banyak memberikan tunjuk ajar serta pengarahan, bimbingan, masukan dan saran sehingga terselesaikannya skripsi ini. Kepada Ibu DR. Rumondang Bulan Nst, MS selaku dosen Pembimbing II juga sebagai Ketua Departemen Kimia FMIPA USU yang telah banyak membantu hingga selesainya skripsi ini. Kepada serta seluruh staff pegawai Departemen Kimia. Bapak dan Ibu dosen yang telah memberikan ilmunya selama masa studi saya di FMIPA USU, Kepada Bapak Dr. Darwin Yunus Nst.MS sebagai Koordinator Kimia Ektensi yang telah banyak memberikan dukungannya kepada saya.
Saya menyadari bahwa skripsi ini masih banyak kekurangan, karena keterbatasan pengetahuan saya. Oleh karena itu, saya mengharapkan kritik dan saran yang membangun demi kesempurnaan skripsi ini, dan semoga skripsi ini bermanfaat bagi kita semua.
Medan, Juli 2013
ABSTRAK
Telah dilakukan penelitian mengenai penyediaan dan karakterisasi kitosan dari kulit udang lipan (Squilla mantis) sebagai adsorben untuk menurunkan kadar kolesterol. Kitosan diperoleh melalui proses deasetilasi kitin. Kitosan yang diperoleh digunakan sebagai adsorben untuk menurunkan kadar kolesterol, dengan cara menambahakan kitosan dengan variasi massa sebanyak 1, 3, 5 dan 7 gram ke dalam hasil ekstraksi lemak dan dengan variasi waktu perendaman 15, 30, 45 dan 60 menit. Besarnya kadar kolesterol dianalisis dengan menggunakan metode Kromatografi Gas (KG). Hasil penelitian menunjukkan bahwa dengan penambahan 1 gram kitosan , kadar kolesterol akan menurun sebesar 12,43%; 19,28%; 25,57% dan 32,94%. Pada penambahan 3 gram kitosan, kadar kolesterol akan menurun sebesar 14,37%; 25,46%; 32,18% dan 37,54%. Dengan penambahan 5 gram kitosan , kadar kolesterol akan menurun sebesar 32,89%; 36,12%; 42,46% dan 48,57%. Dan dengan penambahan 7 gram kitosan, kadar kolesterol akan menurun sebesar 28,75%; 32,54%; 35,23% dan 37,48%.
THE PREPARATION AND CHARACTERIZATION OF CHITOSAN FROM MANTIS SHELL (Squilla mantis) AS AN ADSORBENT
TO DECREASE CONCENTRATION OF CHOLESTEROL
ABSTRACT
A research about the manufacture and characterization of chitosan from mantis shells (Callinectes Sapidus) as an adsorbent to decrease concentration of cholesterol has been studied. Chitosan is obtained through the deacetylation process of chitin. That chitosan used as adsorbent to decrease concentration of cholesterol by adding chitosan with the variation of mass 1, 3, 5 and 7 grams into the result extraction of fat and with the variation of immersion time 15, 30, 45 and 60 minutes. The concentration of cholesterol are analyzed by using Gas Chromatography (GC). The result of research show that by adding 1 gram chitosan, concentration of chitosan decreased 12,43%; 19,28%; 25,57% and 32,94% respectively. In addition 3 grams chitosan, concentration of cholesterol decreased 14,37%; 25,46%; 32,18% and 37,54% respectively. By adding 5 grams chitosan, concentration of cholesterol decreased 32,89%; 36,12%; 42,46% and 48,57% respectively. And by adding 7 grams chitosan, concentration of cholesterol decreased 28,75%; 32,54%; 35,23% and 37,48% resperctively.
Keyword : Squilla mantis, Chitosan, Absorbent, Cholesterol
DAFTAR ISI
2.6 Spektroskopi IR dan FTIR 2.7 Kromatografi Gas
2.7.1 Sistem Peralatan Kromatografi Gas 2.7.2 Pemakaian Kromatografi Gas
Bab 3 Metodologi Penelitian 3.1 Alat dan Bahan
3.1.1 Alat-alat 3.1.2 Bahan-bahan 3.2 Prosedur Penelitian
3.2.1 Pembuatan Larutan Pereaksi 3.2.2 Proses Ekstraksi Kitin
3.2.3 Proses Deasetilasi Kitin menjadi Kitosan 3.2.4 Penentuan Kadar Air (AOAC 1995) 3.2.5 Penentuan Kadar Abu (AOAC 1995) 3.3.6 Analisis Unsur C, H, dan N
3.2.7 Proses Penentuan Kadar Kolesterol dari Lemak Udang lipan
3.3 Bagan penelitian
3.3.1 Proses Ekstraksi Kitin
3.3.2 Proses Deasetilasi Kitin menjadi Kitosan
3.3.3 Penentuan Kadar Kolesterol dari Lemak Udang lipan 3.3.4 Proses Penyerapan Kolesterol
Bab 4 Hasil dan Pembahasan 4.1 Hasil penelitian
4.1.1 Kitin 4.1.2 Kitosan
4.1.3 Penentuan Kolesterol 4.2 Pengolahan Data
4.2.1 Penurunan Persamaan Garis Regresi dengan Metode Least Square
4.2.2 Koefisien Korelasi 4.2.3 Penentuan Konsentrasi
4.2.4 Penentuan Kadar Kolesterol setelah Penambahan Kitosan
4.2.4.1 Penentuan Kadar Kolesterol setelah Penambahan 1 gram Kitosan
4.2.4.2 Penentuan Kadar Kolesterol setelah Penambahan 3 gram Kitosan
4.2.4.3 Penentuan Kadar Kolesterol setelah Penambahan 5 gram Kitosan
4.2.4.4 Penentuan Kadar Kolesterol setelah Penambahan 7 gram Kitosan
4.3 Pembahasan
4.3.1 Penentuan Derajat Deasetilasi 4.3.2 Analisa spektrum FT-IR
4.3.3 Pengaruh Kitosan Terhadap Kadar Kolesterol
Bab 5 Kesimpulan dan Saran 5.1 Kesimpulan 5.2 Saran
DAFTAR TABEL
Halaman
Tabel 2.1 Spesifikasi Kitin Komersil Tabel 2.2 Spesifikasi Kitosan Komersil
Tabel 2.3 Aplikasi dan Fungsi Kitosan di Berbagai Bidang
Tabel 4.1 Kitin dan Kitosan yang dihasilkan dari Kulit Udang lipan Tabel 4.2 Karakterisasi Kitin Udang lipan
Tabel 4.3 Analisis Unsur C, H, dan N pada Kitin Tabel 4.4 Karakteristik Kitosan Udang lipan Tabel 4.5 Analisis Unsur C, H dan N pada Kitosan
Tabel 4.6 Kondisi Alat GC Merek Helwett Packard HP-6890 pada Pengukuran Larutan Standar Kolesterol
Tabel 4.7 Data Larutan Standar Kolesterol
Tabel 4.8 Data Hasil Penurunan Persamaan Regresi untuk Kolesterol Tabel 4.9 Data Hasil Luas Puncak Kolesterol pada Lemak Udang lipan Tabel 4.10 Pengaruh Waktu Perendaman 1 gram Kitosan Terhadap Penyerapan Kolesterol dari Lemak Udang lipan
Tabel 4.11 Pengaruh Waktu Perendaman 3 gram Kitosan Terhadap Penyerapan Kolesterol dari Lemak Udang lipan
Tabel 4.12 Pengaruh Waktu Perendaman 5 gram Kitosan Terhadap Penyerapan Kolesterol dari Lemak Udang lipan
Tabel 4.13 Pengaruh Waktu Perendaman 7 gram Kitosan Terhadap Penyerapan Kolesterol dari Lemak Udang lipan
DAFTAR GAMBAR
Halaman
Gambar 2.1 Struktur Kitin Gambar 2.2 Struktur Kitosan Gambar 2.3 Struktur Kolesterol
Gambar 2.4 Skematis Alat Kromatografi Gas
DAFTAR LAMPIRAN
Halaman
Gambar 1. Spektrum FT-IR Kitin Udang lipan Gambar 2. Spektrum FT-IR Kitosan Udang lipan Gambar 3. Spektrum FT-IR Kitosan Komersil Gambar 4. Kromatogram larutan standar Kolesterol dengan konsentrasi 0.01 g/ml
Gambar 5. Kromatogram larutan standar Kolesterol dengan konsentrasi 0,02 g/ml
Gambar 6. Kromatogram larutan standar Kolseterol dengan konsentrasi 0,03 g/ml
Gambar 7. Kromatogram larutan standar Kolesterol dengan konsentrasi 0,04 g/ml
Gambar 8. Kromatogram larutan standar Kolesterol dengan konsentrasi 0,05 g/ml
Gambar 9. Kromatogram sampel kolesterol I Gambar 10. Kromatogram sampel kolesterol II Gambar 11. Kromatogram sampel kolesterol III
Gambar 12. Kromatogram sampel kolesterol setelah penambahan 1 gram kitosan dengan waktu perendaman 15 menit
Gambar 13. Kromatogram sampel kolesterol setelah penambahan 1 gram kitosan dengan waktu perendaman 30 menit
Gambar 14. Kromatogram sampel kolesterol setelah penambahan 1 gram kitosan dengan waktu perendaman 45 menit
Gambar 15. Kromatogram sampel kolesterol setelah penambahan 1 gram kitosan dengan waktu perendaman 60 menit
Gambar 16. Kromatogram sampel kolesterol setelah penambahan 3 gram kitosan dengan waktu perendaman 15 menit
Gambar 17. Kromatogram sampel kolesterol setelah penambahan 3 gram kitosan dengan waktu perendaman 30 menit
Gambar 18. Kromatogram sampel kolesterol setelah penambahan 3 gram kitosan dengan waktu perendaman 45 menit
Gambar 19. Kromatogram sampel kolesterol setelah penambahan 3 gram kitosan dengan waktu perendaman 60 menit
Gambar 20. Kromatogram sampel kolesterol setelah penambahan 5 gram kitosan dengan waktu perendaman 15 menit
Gambar 21. Kromatogram sampel kolesterol setelah penambahan 5 gram kitosan dengan waktu perendaman 30 menit
Gambar 22. Kromatogram sampel kolesterol setelah penambahan 5 gram kitosan dengan waktu perendaman 45 menit
Gambar 23. Kromatogram sampel kolesterol setelah penambahan 5 gram kitosan dengan waktu perendaman 60 menit
Gambar 24. Kromatogram sampel kolesterol setelah penambahan 7 gram kitosan dengan waktu perendaman 15 menit
Gambar 26. Kromatogram sampel kolesterol setelah penambahan 7 gram kitosan dengan waktu perendaman 45 menit
ABSTRAK
Telah dilakukan penelitian mengenai penyediaan dan karakterisasi kitosan dari kulit udang lipan (Squilla mantis) sebagai adsorben untuk menurunkan kadar kolesterol. Kitosan diperoleh melalui proses deasetilasi kitin. Kitosan yang diperoleh digunakan sebagai adsorben untuk menurunkan kadar kolesterol, dengan cara menambahakan kitosan dengan variasi massa sebanyak 1, 3, 5 dan 7 gram ke dalam hasil ekstraksi lemak dan dengan variasi waktu perendaman 15, 30, 45 dan 60 menit. Besarnya kadar kolesterol dianalisis dengan menggunakan metode Kromatografi Gas (KG). Hasil penelitian menunjukkan bahwa dengan penambahan 1 gram kitosan , kadar kolesterol akan menurun sebesar 12,43%; 19,28%; 25,57% dan 32,94%. Pada penambahan 3 gram kitosan, kadar kolesterol akan menurun sebesar 14,37%; 25,46%; 32,18% dan 37,54%. Dengan penambahan 5 gram kitosan , kadar kolesterol akan menurun sebesar 32,89%; 36,12%; 42,46% dan 48,57%. Dan dengan penambahan 7 gram kitosan, kadar kolesterol akan menurun sebesar 28,75%; 32,54%; 35,23% dan 37,48%.
THE PREPARATION AND CHARACTERIZATION OF CHITOSAN FROM MANTIS SHELL (Squilla mantis) AS AN ADSORBENT
TO DECREASE CONCENTRATION OF CHOLESTEROL
ABSTRACT
A research about the manufacture and characterization of chitosan from mantis shells (Callinectes Sapidus) as an adsorbent to decrease concentration of cholesterol has been studied. Chitosan is obtained through the deacetylation process of chitin. That chitosan used as adsorbent to decrease concentration of cholesterol by adding chitosan with the variation of mass 1, 3, 5 and 7 grams into the result extraction of fat and with the variation of immersion time 15, 30, 45 and 60 minutes. The concentration of cholesterol are analyzed by using Gas Chromatography (GC). The result of research show that by adding 1 gram chitosan, concentration of chitosan decreased 12,43%; 19,28%; 25,57% and 32,94% respectively. In addition 3 grams chitosan, concentration of cholesterol decreased 14,37%; 25,46%; 32,18% and 37,54% respectively. By adding 5 grams chitosan, concentration of cholesterol decreased 32,89%; 36,12%; 42,46% and 48,57% respectively. And by adding 7 grams chitosan, concentration of cholesterol decreased 28,75%; 32,54%; 35,23% and 37,48% resperctively.
Keyword : Squilla mantis, Chitosan, Absorbent, Cholesterol
BAB 1
PENDAHULUAN
1.1Latar Belakang
Kitin adalah polisakarida alami seperti selulosa, dekstran, alginat, dan sebagainya
yang dapat terdegradasi secara alami dan non toksik. Kitin merupakan polisakarida rantai linier dengan rumus β (1-4)-2-asetamido-2deoksi-D-glucopiranosa, sedangkan kitosan adalah deasetilasi kitin (Merck Index, 1976).
Kitin banyak didapati pada kulit-kulit luar arthropoda, crustacea (seperti
udang, rajungan, dan lobster), mollusca, annelida, dinding yeast dan serangga. Kitin
juga terdapat pada tumbuhan tingkat rendah seperti jamur terutama pada bagian
miselium dan sporanya (Muzzarelli, 1977).
Indonesia merupakan negara maritim yang kaya akan bahan baku kitin yang
banyak terdapat dalam kulit udang, kulit udang lipan, dan cumi-cumi akan menjadi
sangat potensial dalam produksi kitin dan kitosan. Pemanfaatan udang lipan
umumnya baru terbatas untuk keperluan makanan, biasanya hanya dagingnya saja
yang diambil sedangkan kulitnya dibuang, padahal kulit udang lipan mengandung
senyawa kitin yang cukup tinggi yaitu, sekitar 20-30 % berat kulit keringnya.
Sedangkan kulit udang lipan sendiri merupakan limbah pengalengan udang lipan
yang belum diolah secara maksimal. Penggunaan kitin dibatasi oleh sifat-sifat yang
tidak larut dan sulit dipisahkan dengan bahan lain yang terikat terutama protein,
sehingga untuk pemanfaatannya kitin perlu diubah terlebih dahulu menjadi kitosan
Salah satu cara lain memanfaatkan limbah ini adalah dengan mengektraksi
senyawa kitin yang terdapat di dalamnya, lalu dengan proses deasetilasi kitin diolah
proses yang relatif sederhana , karena itin masih terikat dengan unsur-unsur lainnya
antara lain protein dan mineral. (Romatua, 2002)
Kitosan adalah suatu biopolimer dari D-glukosamin yang dihasilkan dari
proses deasetilasi kitin dengan menggunakan alkali kuat. Kitosan bersifat sebagai
polimer kationik yang tidak larut dalam air, dan larutan alkali dengan pH di atas 6,5.
Kitosan mudah larut dalam asam organik seperti asam formiat, asam asetat, dan asam
sitrat (Rahayu, 2007).
Untuk menghasilkan kitosan yang bermutu tinggi tergantung pada kitin yang
dihasilkan. Sekiranya kitin yang dihasilkan tidak murni, maka tidak akan dihasilkan
kitosan. Untuk inilah perlu diketahui derajat deasetilasi di dalam kitosan, karena
merupakan sifat utama dari kitosan. Kitosan mempunyai kadar nitrogen yang
bergantung kepada derajat deasetilasi. Salah satu metode untuk mengetahui derajat
deasetilasi adalah dengan menggunakan spektrofotometri (Muzarelli, 1977).
Kitosan merupakan biopolimer yang banyak digunakan di berbagai industri
kimia, antara lain dipakai sebagai koagulan dalam pengolahan limbah air, bahan
pelembab, pelapis benih yang akan ditanam, adsorben ion logam, anti kanker /anti
tumor, anti lemak, komponen tambahan pakan ternak, sebagai lensa kontak, pelarut
lemak, dan pengawet makanan (Rahayu, 2007).
Lemak dan minyak merupakan zat makanan yang penting untuk menjaga
kesehatan tubuh manusia. Selain itu lemak dan minyak juga merupakan sumber
energi yang lebih efektif dibanding dengan karbohidrat dan protein. Satu gram
minyak atau lemak dapat menghasilkan 9 kkal, sedangkan karbohidrat dan protein
hanya menghasilkan 4 kkal/gram. Lemak hewani mengandung banyak sterol yang
disebut lemak, sedangkan lemak nabati mengandung fitosterol dan lebih banyak
mengandung asam lemak tak jenuh sehingga umumnya berbentuk cair. Lemak
hewani ada yang berbentuk padat yang biasa berasal dari lemak susu, lemak babi,
lemak sapi. Minyak atau lemak, mengandung asam-asam lemak essensial seperti
asam linoleat, linolenat dan arakidonat yang dapat mencegah penyempitan pembuluh
Salah satu upaya untuk menurunkan kadar lemak dalam lemak dengan
menggunakan biopolimer kitosan. Senyawa ini akan membawa muatan listrik positif,
dapat menyatu dengan zat asam empedu yang bermuatan negatif sehingga
menghambat penyerapan lemak, karena zat lemak yang masuk bersama makanan
harus dicerna dan diserap dengan bantuan zat asam empedu yang disekresi liver
(Hargono, 2008).
Berdasarkan latar belakang di atas, peneliti tertarik untuk meneliti tentang
pengaruh penambahan kitosan dari kulit udang lipan terhadap penyerapan kolesterol
dari lemak udang lipan.
1.2Permasalahan
Apakah kitosan dari kulit udang lipan dapat digunakan sebagai adsorben
untuk menurunkan kadar kolesterol dari lemak udang lipan.
1.3Pembatasan Masalah
Penelitian ini hanya dibatasi pada penyediaan kitin dari kulit udang lipan
serta penyerapan kolesterol dari lemak udang lipan pada penambahan kitosan dengan
variasi massa (1, 3, 5 dan 7) gram kitosan dan dengan variasi waktu perendaman
(15, 30, 45 dan 60) menit.
1.4Tujuan Penelitian
Tujuan dari penelitian ini adalah untuk melakukan penyediaan dan
karakterisasi kitosan dari kulit udang lipan sebagai adsorben untuk menurunkan
1.5Manfaat Penelitian
Dari hasil penelitian ini diharapkan dapat memberikan informasi hasil
ekstraksi kitosan dari kulit udang lipan dapat digunakan untuk menurunkan kadar
kolesterol.
1.6Metodologi Penelitian
Penelitian ini adalah penelitian laboratorium, dimana isolasi kitin dari kulit
udang lipan melalui tiga tahap, yaitu deproteinasi dengan NaOH encer,
demineralisasi dengan HCl selanjutnya proses deasetilasi dengan penambahan NaOH
untuk menghasilkan kitosan. Penentuan kadar kolesterol dari lemak udang lipan
dilakukan dengan mengekstraksi lemak terlebih dahulu. Proses penyerapan lemak
dari lemak udang lipan dilakukan dengan penambahan kitosan sebanyak 1 gram
dengan variasi waktu perendaman 15, 30, 45 dan 60 menit. Kemudian dilakukan hal
yang sama untuk variasi penambahan kitosan sebanyak 3, 5 dan 7 gram. Kemudian
hasilnya dianalisa secara kromatografi gas.
1.7Lokasi Penelitian
Penelitian ini dilakukan di Laboratorium Penelitian FMIPA USU dan di
BAB 2
TINJAUAN PUSTAKA
2.1 Udang Lipan (Squilla mantis )
Udang lipan (Squilla matis) merupakan salah satu spesies yang termasuk
dalam kelas Krustase. Panjanag udang ini mencapai 30-35 cm. Jenis udang ini
memiliki varietas yang beraneka warna, mulai dari warna gelap, coklat hingga yang
berwarna terang seperti Gambar 2.1.
Gambar 2.1 Udang Lipan
Morpologi :
Kingdom : Anninula
Filum : Arthropoda
Kelas : Crustacea
Sub Kelas : Malacostacea
Ordo : Stomapoda
Famili : Squilla mantis
Genus : Harpiosquilla
2.2 Kitin
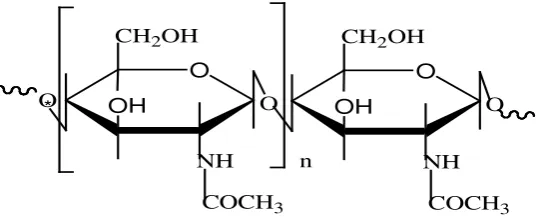
Kitin merupakan poli (2-asetamido-2-deoksi-β-(1→4)-D-glukopiranosa) dengan
rumus molekul (C8H13NO5)n yang tersusun atas 47% C, 6% H, 7% N, dan 40% O.
Struktur kitin menyerupai struktur selulosa dan hanya berbeda pada gugus yang
terikat di posisi atom C-2. Gugus pada C-2 selulosa adalah gugus hidroksil,
sedangkan pada C-2 kitin adalah gugus N-asetil (-NHCOCH3, asetamida)
O
Gambar 2.1 Struktur kitin
Di alam, kitin dikenal sebagai polisakarida yang paling melimpah setelah
selulosa. Kitin umumnya banyak dijumpai pada hewan avertebrata laut, darat, dan
jamur dari genus Mucor, Phycomyces, dan Saccharomyces. Keberadaan kitin di alam
umumnya terikat pada protein, mineral, dan beragai macam pigmen. Sebagian besar
kelompok Crustacea, seperti udang lipan, udang dan lobster, merupakan merupakan
sumber utama kitin komersial. Di dunia, kitin diproduksi secara komerisal 120 ribu
ton per tahun. Kitin yang berasal dari udang lipan dan udang sebesar 39 ribu ton
(32,5%) dan dari jamur 32 ribu ton (26,7%) (Knorr,1991).
Kitin yang terdapat pada kulit ini masih terikat dengan protein, CaCO3,
pigmen dan lemak. Berbagai teknik dilakukan untuk memisahkannya, tetapi melalui
tiga tahapan yaitu demineralisasi dengan HCl encer, deproteinisasi dengan NaOH
encer (setelah tahap ini diperoleh kitin) dan selanjutnya deasetilasi kitin
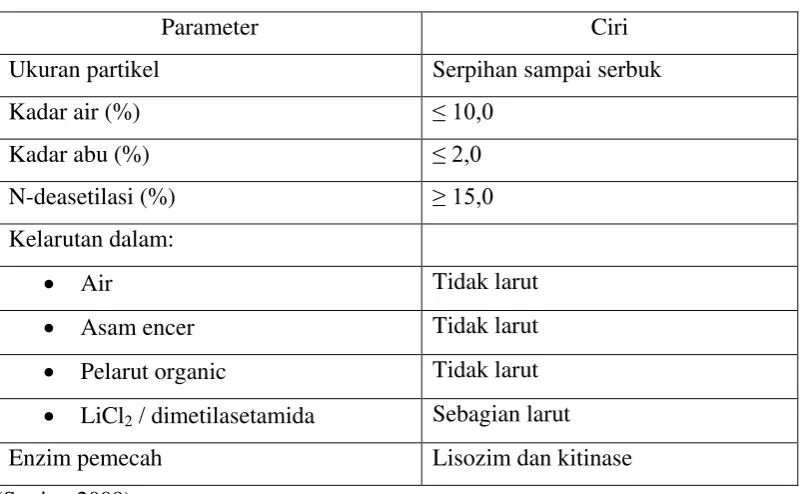
Tabel 2.1 Spesifikasi Kitin Komersil
Parameter Ciri
Ukuran partikel Serpihan sampai serbuk
Kadar air (%) ≤ 10,0
Kadar abu (%) ≤ 2,0
N-deasetilasi (%) ≥ 15,0
Kelarutan dalam:
• Air Tidak larut
• Asam encer Tidak larut
• Pelarut organic Tidak larut
• LiCl2 / dimetilasetamida Sebagian larut
Enzim pemecah Lisozim dan kitinase
(Sugita, 2009)
Kitin merupakan bahan yang tidak beracun dan bahkan mudah teruai secara
hayati (biodegradable). Bentuk fisiknya berupa padatan amorf yang berwarna putih
dengan kalor spesifik 0,373 ± 0,03 kal/g/oC. Kitin hapir tidak larut dalam air, asam encer, dan basa, tetapi larut dalam asam format, asam metanasulfonat,
N,N-dimetilasetamida yang mengandung 5% litium klorida, heksaflouroisopropil alkohol,
heksafluoroaseton dan campuran 1,2-dikloroetana-asam trikloroasetat dengan nisbah
35:65 (%v/v). Asam mineral pekat seperti H2SO4, HNO3, dan H3PO4 dapat
melarutkan kitin sekaligus menyebabkan rantai panjang kitin terdegradasi menjadi
satuan-satuan yang lebih kecil (Sugita, 2009).
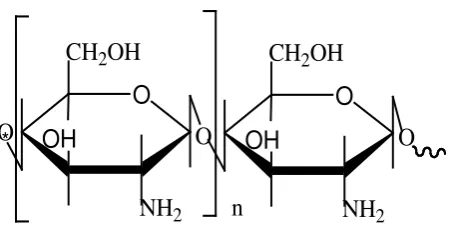
2.3 Kitosan
Kitosan adalah poli-(2-amino-2-deoksi-β-(1-4)-D-glukopiranosa) dengan rumus
O
Gambar 2.2 Struktur Kitosan
Proses deasetilasi kitosan dapat dilakukan dengan cara kimiawi maupun
enzimatik. Proses kimiawi menggunakan basa, misalnya NaOH, dan dapat
menghasilkan kitosan dengan derajat deasetilasi 85-93%. Namun proses kimiawi
menghasilkan kitosan dengan bobot molekul yang beragam dan deasetilasinya juga
sangat acak, sehingga sifat fisik dan kimia kitosan tidak seragam. Selain itu, proses
kimiawi juga dapat menimbulkan pencemaran lingkungan, sulit dikendalikan, dan
melibatkan banyak reaksi samping yang dapat menurunkan rendemen. Proses
enzimatik dapat menutupi kekurangan proses kimiawi. Pada dasarnya deasetilasi
secara enzimatik bersifat selektif dan tidak merusak rantai kitosan, sehingga
menghasilkan kitosan dengan karakteristik yang lebih seragam agar dpat memperluas
bidang aplikasinya.
Tabel 2.2 Spesifikasi Kitosan Komersil
Parameter Ciri
Ukuran partikel Serpihan sampai serbuk
Kadar air (%) ≤ 10,0
Kadar abu (%) ≤ 2,0
Warna larutan Tidak berwarna
N-deasetilasi (%) ≥ 70,0
Kelas viskositas (cps)
• Rendah < 200
• Medium 200799
• Tinggi pelarut organic 8002000
• Sangat tinggi ˃ 2000
Kitosan telah digunakan di berbagai bidang industri seperti industri makanan
aditif, kosmetik, material pertanian, dan untuk anti bakterial. Kitosan juga sering
digunakan sebagai adsorben pada ion logam transisi dan spesies organik. Hal ini
disebabkan oleh adanya gugus amino (-NH2) dan gugus hidroksil (-OH) dari rantai
kitosan yang dapat dijadikan sebagai tempat untuk berkoordinasi dan bereaksi
(Juang, 2002).
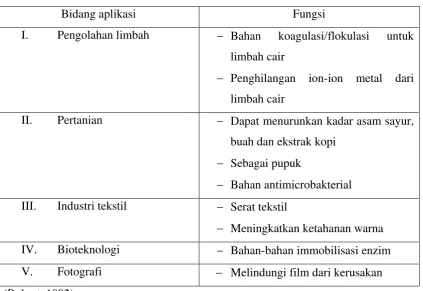
Tabel 2.3 Aplikasi dan fungsi kitosan di berbagai bidang
Bidang aplikasi Fungsi
I. Pengolahan limbah − Bahan koagulasi/flokulasi untuk
limbah cair
− Penghilangan ion-ion metal dari limbah cair
II. Pertanian − Dapat menurunkan kadar asam sayur,
buah dan ekstrak kopi − Sebagai pupuk
− Bahan antimicrobakterial
III. Industri tekstil − Serat tekstil
− Meningkatkan ketahanan warna
IV. Bioteknologi − Bahan-bahan immobilisasi enzim
V. Fotografi − Melindungi film dari kerusakan
(Robert, 1992)
2.4 Lemak
Lemak hewan pada umumnya berupa zat padat pada suhu ruangan,
sedangkan lemak yang berasal dari tumbuhan berupa zat cair. Lemak yang
mempunyai titik lebur tinggi mengandung asam lemak jenuh , sedangkan lemak cair
atau yang biasa disebut minyak mengandung asam lemak tidak jenuh
Lemak hewani mengandung banyak sterol yang disebut lemak, sedangkan
lemak nabati mengandung fitosterol dan lebih banyak mengandung asam lemak tak
jenuh sehingga umumnya berbentuk cair. Lemak hewani ada yang berbentuk padat
(lemak) yang biasanya berasal dari lemak hewan darat seperti lemak susu,lemak
babi, lemak sapi. Lemak nabati yang berbentuk cair dapat dibedakan atas tiga
golongan yaitu: (a) dryng oilI yang akan membentuk lapisan keras bila mongering di
udara.; (b) semi drying oil seperti minyak jagung, minyak biji kapas dan minyak
bunga matahari; dan (c) non drying oil misalnya minyak kelapa dan minyak kacang
tanah.
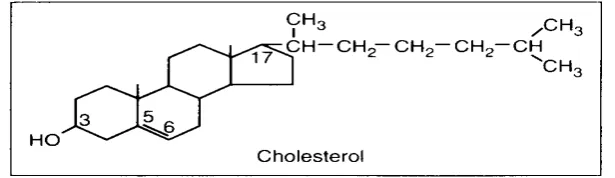
2.5 Kolesterol
Kolesterol merupakan bagian yang penting dalam sel dan jaringan tubuh, otak,
syaraf, ginjal, limpa, hari dan kulit yang disebut “endogeneous cholesterol”
sedangkan “exogeneous choloesterol”, bersumber dari kuning telur, ikan,
udang,sapi, kambing, dan lemak hewan lainnya. Konsentrasi total kolesterol dalam
plasma darah berkisar 180 – 250 mg/100 ml (Suhardjo dan Kusharto 1987). Adapun
struktur kimia dari kolesterol disajikan pada gambar 2.5.
Gambar 2.3 Struktur Kolesterol (Sampaio etal.2006)
Kolesterol dapat larut dalam pelarut lemak, misalnya eter, kloroform, benzene
dan alkohol panas. Apabila terdapat dalam konsentrasi tinggi, kolesterol mengkristal
yang tidak berwarna, tidak berasa dan tidak berbau, dan mempuntai titik lebur
150-151oC. Endapan lemak apabila terdapat dalam pembuluh darah dapat menyebabkan penyempitan pembuluh darah karena dinding pembuluh darah menjadi makin tebal.
Hal ini juga mengakibatkan berkurangnya kelenturan pembuluh darah, maka aliran
darah akan terganggu dan untuk mengatasi gangguan ini jantung harus memompa
2.6 Spektroskopi IR dan FTIR
Spektroskopi adalah ilmu yang mempelajari segala sesuatu tentang interaksi antara
materi dengan radiasi elektromagnetik (REM). Interaksi yang terjadi dalam
spektroskopi inframerah ini merupakan inteaksi dengan REM melalui absorbsi
radiasi. Pancaran inframerah pada umumnya mengacu pada bagian spectrum
elektromagnetik yang terletak di antara daerah tampak dan glombang mikro. Molekul
menyerap radiasi elektromagnetik dengan panjang gelombang yang khusus.
Absorbansi cahaya ultraviolet mengakibatkan pindahnya sebuah electron ke orbital
dengan energy yang lebih tinggi. Radiasi inframerah tidak cukup mengandung
energy untuk melakukan eksitasi tersebut, absorbsinya hanya mengakibatkan
membesarnya amplitudo getaran atom-atom yang terikat satu sama lain (Sudarmadji,
1989).
Analisa kuantitatif dari spektroskopi FTIR dapat dilakukan berdasarkan
spektra inframerah yang dihasilkan, salah satu contohnya adalah penentuan derajat
deasetilasi dari kitin dan kitosan menggunakan persamaan Domszy dan Roberts
(Sugita,2009).
%DD = 1- [(A1665 / A3450) x 1/1,33] x 100%
dimana: A1665 = absorbansi pada bilangan gelombang 1665 cm-1 A3450 = absorbansi pada bilangan gelombang 3450 cm-1
1,33 = tetapan yang diperoleh dari perbandingan A1665 / A3450
untuk kitosan dengan asetilasi penuh
2.7. Kromatografi Gas
Kromatografi gas adalah sebuah teknik untuk memisahkan suatu zat yang mudah
(stationary phase). Pemisahan ini berdasarkan sifat-sifat penyerapan isi kolom untuk
memisahkan komponen sampel yang berbentuk gas. Isi kolom yang biasa digunakan
untuk keperluan ini adalah silica gel, saringan molekul dan arang. Sampel yang
dianalisis dapat berbentuk gas, cair maupun padat, namun cair dan padat harus
terlebih dahulu diubah menjadi bentuk gas dengan cara pemanasan. (Sudjadi, 1986).
Selanjutnya percobaan kromatografi Tsweet dilanjutkan oleh C.Dhere pada
tahun 1911 dalam usahanya memisahkan zat warna karoten. Usaha ini lebih jauh
dilanjutkan di Amerika oleh L.S. Palmer pada tahun 1914 sehingga dia berhasil dengan baik memisahkan α, β, dan γ karoten di Universitas Missouri. (Mulja,M., Suharman., 1995).
2.7.1. Sistem Peralatan Kromatografi Gas
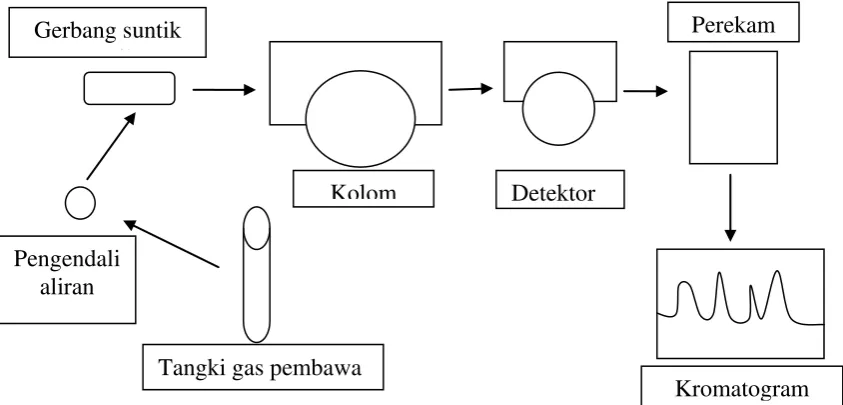
Diagram skematik peralatan Kromatografi Gas ditunjukkan oleh gambar
di bawah ini dengan komponen utama adalah: kontrol dan penyedia gas pembawa;
ruang suntik sampel; kolom yang diletakkan dalam oven yang dikontrol secara
termostatik; sistem deteksi dan pencatat (detector dan recorder); serta komputer yang
dilengkapi dengan perangkat pengolah data
(Mc.Nair, Bonelli, 1988)
A. Gas Pembawa
Faktor yang menyebabkan suatu senyawa dapat bergerak melalui kolom
Kromatografi Gas ialah keatsirian yang merupakan sifat senyawa itu dan aliran gas
melalui kolom. Aliran gas dipaparkan dengan dua peubah, aliran yang diukur dengan
ml/menit dan penurunan tekanan antara pangkal dan ujung kolom, sifat gas yang
pasti, biasanya merupakan hal sekunder yang ditinjau dari segi pemisahannya, tetapi
mungkin ada pengaruh kecil pada daya pisah. Pemilihan gas pembawa sampai taraf
tertentu bergantung pada detektor yang dipakai: hantar bahang, ionisasi nyala,
tangkap elektron, atau khas tehadap unsur. Walaupun agak kurang baik biasanya
dipakai helium. Sebuah Kromatografi Gas biasanya dipasang dengan suatu gas
pembawa, detektor pengionan tertentu memerlukan argon, gas yang sangat besar
kerapatannya dan alirannya lebih lambat (penurunan tekanan lebih besar) biasanya
nitrogen dipakai dengan detektor ionisasi nyala walaupun gas lain memang dapat
dipakai. (Roy J. Gritter., 1991).
B. Sistem injeksi
Komponen Kromatografi Gas yang utama selanjutnya adalah ruang suntik atau inlet.
Fungsi dari ruang suntik ini adalah untuk mengantarkan sampel ke dalam aliran gas
pembawa. Berbagai macam jenis inlet dan teknik pengantar sampel telah tersedia.
Penyuntikan sampel dapat dilakukan secara manual atau secara otomatis (yang dapat
menyesuaikan jumlah sampel).
Sampel yang akan dikromatografi dimasukkan ke dalam ruang suntik melalui
gerbang suntik yang biasanya berupa lubangyang ditutupi dengan septum atau
pemisah karet. Ruang suntik harus dipanaskan tersendiri (terpisah dari kolom) dan
kemas yang memerlukan 1-100 μl sampel. Karena pengukuran secara akurat sulit
dilakukan jika sampel yang disuntikkan terlalu kecil (pada kolom kapiler), maka
ditempuh suatu cara untuk mengecilkan ukuran sampel setelah penyuntikan. Salah
satu cara yang dilakukan adalah dengan menggunakan teknik pemecah suntikkan
(split injection). (Abdul,R., 2007).
C. Kolom
Aliran gas selanjutnya menemui kolom, yang diletakkan dalam oven bertemperatur
konstan. Ini adalah jantung instrumentasi tersebut, tempat dimana kromatografi dasar
berlangsung. Kolom-kolom memiliki variasi dalam hal ukuran dan bahan isian.
Ukuran yang umum adalah sepanjang 6 kaki dan berdiameter dalam 1/4 inci, terbuat
dari tabung tembaga atau baja tahan karat; untuk menghemat ruang, bisa dibentuk U
agar gulungan spiral. Tabung itu diisi dengan suatu bahan padat halus dengan luas
permukaan besar yang relatif inert. Namun padatan itu sebenarnya hanya sebuah
penyangga mekanik untuk cairan, sebelum diisi kedalam kolom, padatan tersebut
diimpregnasi dengan cairan yang diinginkan yang berperan sebagai fase stasioner
sesungguhnya. Cairan ini harus stabil dan nonvolatile pada temperature kolom, dan
harus sesuai dengan temperatur tertentu.
D. Detektor
Setelah muncul dari kolom itu, aliran gas lewat melalui sisi lain detektor. Maka elusi
zat terlarut dari kolom yang direkam secara elektrik. Laju aliran gas pe,bawa adalah
hal yang penting, dan biasanya pengukur aliran untuk itu tersedia. Mungkin ada
kutup pengatur lain pada ujung keluaran sisitem, walaupun secara normal gas-gas
yang muncul dialirkan keluar pada tekanan atmosfer. Karena pekerjaan laboratorium
secara terus menerus terpapar oleh uap senyawa-senyawa yang terkromatografi yang
mungkin tak baik waluapun kadarnya biasanya kecil, maka ventilasi pada keluaran
instrument harus diperhatikan. Ketentuan bisa dibuat untuk menjebak zat terlarut
yang dipisahkan setelah muncul dari kolom jika hal ini dibutuhkan untuk
2.7.2. Pemakaian Kromatografi Gas
Dalam Kromatografi Gas untuk mengikuti reaksi, senyawa dilewatkan melalui zona
reaksi dalam sistem tertutup antara tempat injeksi sampel dengan detektor. Reaksi
berlangsung setelah melalui tempat injeksi sampel. Reaksi seharusnya berlangsung
seketika dan hasil reaksi mempunyai waktu retensi normal, yaitu 8-10 detik.
Pengambilan suatu komponen senyawa dengan gugus tertentu juga dapat dilakukan
dengan membubuhkan dalam kolom kromatografi, suatu reagen yang relatif untuk
menahan komponen tersebut. Untuk perbandingan dua kolom dengan instrumen
pencatat dapat dimanfaatkan. Senyawa dapat diubah menjadi bentuk lain dengan
beda waktu retensi, misalnya dengan melewatkan H2O pada CaC2 dapat terbentuk CH≡CH asetilena. (Khopkar, 2003).
Kromatografi Gas sebagai instrumen untuk analisis fisiko-kimia menduduki
posisi yang sangat penting dan banyak dipakai, apa sebabnya :
1. Aliran fase mobil (gas) sangat terkontrol dan kecepatannya tetap.
2. Sangat mudah terjadi pencampuran uap sampel ke dalam aliran fase mobil.
3. Pemisahan fisik terjadi di dalam kolom yang jenisnya banyak sekali, panjang, dan
temperaturnya dapat diatur.
4. Banyak sekali macam detektor yang dapat dipakai pada kromatografi gas (saat ini
dikenal 13 macam detektor) dan tanggap detektor adalah proporsioanal dengan
jumlah tiap komponen yang keluar dari kolom.
5. Kromatgrafi gas sangat mudah digabung dengan instrumen fisio-kimia yang
lainnya, contoh: FT-IR/MS.
Kelima hal tersebut di atas telah melebarkan wawasan atau jangkauan
pemakaian Kromatografi gas yang sampai saat ini dikenal secara luas dan sangat
BAB 3
METODOLOGI PENELITIAN
3.1 Alat dan Bahan
3.1.1 Alat-alat yang digunakan dalam penelitian ini :
- Timbangan Elektrik Chyo Electronic Balance
- Gelas Beaker Pyrex
- Hot plate stirrer Ikamag Rec-G
- Blender Philips
- Kromatogafi Gas Hewlett Packard
3.1.2 Bahan-bahan yang digunakan dalam penelitian ini :
- Kulit Udang lipan
- Lemak Udang lipan
- NaOH Teknis
- HCl Teknis
- CH3COOH glassial p.a ( E. Merck )
- Asam Phospat 90% p.a ( E. Merck )
- Standar kolesterol (5-α-Cholestan-3-β-ol) p.a (E.Merck)
3.2 Prosedur Penelitian
3.2.1 Pembuatan Larutan Pereaksi
a. Larutan NaOH 0,5%
Sebanyak 5 g NaOH dilarutkan dengan 1000 mL akuades dalam labu takar
1000 mL sampai garis tanda, kemudian dihomogenkan.
b. Larutan NaOH 5%
Sebanyak 50 g NaOH dilarutkan dengan 1000 mL akuades dalam labu takar
1000 mL sampai garis tanda, kemudian dihomogenkan.
c. Larutan NaOH 50%
Sebanyak 500 g NaOH dilarutkan dengan 1000 mL akuades dalam labu
takar 1000 mL sampai garis tanda, kemudian dihomogenkan.
d. Larutan HCl 5%
Sebanyak 135,135 mL HCl dimasukkan ke dalam labu takar 1000 mL.
Kemudian diencerkan dengan akuades sampai garis tanda, kemudian
e. Larutan Asam Asetat 1%
Sebanyak 10 mL asam asetat glassial dimasukkan ke dalam labu takar 1000
mL. Kemudian diencerkan dengan akuades sampai garis tanda, kemudian
dihomogenkan.
f. Larutan KOH-alkohol 0,5 N
Sebanyak 7,125 g KOH dilarutkan dengan 50 mL alkohol 96%, kemudian
dimasukkan ke dalam labu takar 250 mL. Kemudian diencerkan dengan
alkohol 96% sampai garis tanda, lalu dihomogenkan.
3.2.2 Proses Ekstraksi Kitin (Modifikasi Metode Arisol. A, 1992)
Kulit udang lipan keringkan ditimbang dgn berat tertentu dan kemudian
direndam dalam larutan NaOH 0,5% , selama 24 jam, dicuci dengan H2O cara ini dilakukan sebanyak 2 kali. Untuk perlakuan dideproteinasi ditambah lagi
dengan larutan NaOH 5% selama 24 jam, dicuci dengan H2O hingga pH netral
lalu keringkan pada suhu kamar kemudian dihaluskan. Setelah itu
didemineralisasi dengan HCl 5% selama 24 jam , dicuci dengan H2O hingga
pH netral kemudian dikeringkan pada suhu kamar dan dilakukan uji kelarutan
dalam asam formiat 90%
3.2.3 Proses Deasetilasi Kitin menjadi Kitosan (Metode Arisol. A,1992)
Timbang kitin udang lipan dan masukan dalam larutan NaOH 50% dengan
suhu kamar selama 9 hari, pengadukan dilakukan setiap hari kemudian dicuci
dengan H2O hingga pH netral lalu dikeringakan pada suhu kamar dan dihaluskan. Lakukan uji kelarutan dengan asam asetat 1%, jika uji kelarutan
positif maka diperoleh kitosan dari kitin udang lipan dan uji karakterisasi
3.2.4 Penentuan Kadar Air (AOAC 1995)
Sebanyak 2 g kitosan dimasukkan ke dalam cawan porselin yang telah
diketahui bobotnya. Kemudian dikeringkan dalam oven pada suhu 105oC selama 3 jam, didinginkan dalam desikator, lalu ditimbang
Kadar air = ( X−Y )
X x 100%
Dengan X = bobot sampel mula-mula (g)
Y = bobot sampel kering (g)
3.2.5 Penentuan Kadar Abu (AOAC 1995)
Sejumlah sampel ditimbang dalam cawan porselen yang telah diketahui
bobotnya, diabukan pada tanur bersuhu 550oC sampai pengabuan sempurna. Selanjutnya didinginkan dalam desikator lalu ditimbang
Kadar abu = W1 − W2
W x 100%
Dengan W = bobot sebelum diabukan (g)
W1 = bobot cawan + cawan sesudah diabukan (g)
W2 = bobot cawan kosong (g)
3.2.6 Analisis Unsur C, H dan N
Timbang sampel 0,1000 untuk diukur dengan Analisis Unsur (Carlo Erba,
3.2.7 Proses Penentuan Kadar Kolesterol dari Lemak Udang lipan
Timbang 25 g lemak udang lipan dan masukkan 100 mL kloroform dalam
gelas beaker, diaduk dengan waktu pengadukan 1 jam kemudian sentrifugasi
dengan kecepatan 3000 rpm selama 20 menit dan didekantasi larutan
(supernatan) ke dalam gelas beaker. Lakukan disaponifikasi hasil ekstraksi
lemak dengan 30 mL KOH-alkohol 0,5 N selama ± 1 jam dan dinginkan.
Setelah itu diekstraksi dengan 25 mL n-heksan diambil lapisan atasnya dan
masukkan ke dalam botol vial lalu dianalisa kadarnya secara kromatografi
gas.
3.2.8 Proses Penyerapan Kolesterol dengan Kitosan
Timbang 25 g udang lipan dan masukkan 100 mL kloroform dalam gelas
beaker, diaduk dengan waktu pengadukan 1 jam kemudian sentrifugasi
dengan kecepatan 3000 rpm selama 20 menit lalu didekantasi larutan
(supernatan) masukkan ke dalam gelas beaker ditambahkan dengan 1 g
kitosan, diaduk dimana waktu kontak penyerapan divariasikan
masing-masing 15, 30, 45dan 60 menit, lalu saring. Setelah itu disaponifikasi
filtratnya dengan 30 mL KOH-alkohol 0,5 N selama 1 jam dan didinginkan ,
lalu diekstraksi dengan 25 mL n-heksan pada lapisan atas diambil dan
masukan ke dalam botol vial lalu dianalisa kadarnya secara kromatografi
gas. Untuk prosedur yang sama pada variasi penambahan kitosan sebanyak
3.3 Bagan Penelitian
3.3.1 Proses Ekstraksi Kitin (Modifikasi Arisol.A.1992)
Direndam dengan larutan NaOH 0,5% selama 24 jam (dilakukan 2 kali)
Dicuci dengan air hingga pH netral
Dideproteinasi dengan larutan NaOH 5% selama 24 jam
Dicuci dengan air hingga pH netral
Dikeringkan pada suhu kamar
Didemineralisasi dengan larutan HCl 5% selama 24 jam
Dicuci dengan air hingga pH netral
Dikeringkan pada suhu kamar
Dihaluskan
Dilakukan uji kelarutan dengan asam formiat 90%
Kulit Udang lipan Kering
Kitin Udang lipan
Hasil
3.3.2 Proses Deasetilasi Kitin menjadi Kitosan (Metode Arisol.A,1992)
Direndam dengan larutan NaOH 50%
selama 9 hari dengan pengadukan setiap hari
Dicuci dengan air hingga pH netral
Dikeringkan pada suhu kamar
Dihaluskan Kitin Udang lipan
Kitosan
Uji kelarutan Karakterisasi
3.3.3 Penentuan Kadar Kolesterol dari Lemak Udang lipan dengan Metode
Beyer & Jensen
Dilarutkan dengan 100 mL kloroform dalam beaker gelas, diaduk dengan waktu pengadukan 1 jam Disentrifuge dengan kecepatan 3000 rpm selama 20 menit
Didekantasi
Dimasukkan ke dalam beaker glass
Disaponifikasi hasil ekstraksi lemak dengan 30 mL KOH-alkohol 0,5 N selama ± 1 jam
Didinginkan
Diekstraksi dengan 25 mL n-heksan
Dimasukkan ke dalam botol vial
Dianalisa kadarnya secara kromatografi gas 25 g Udang lipan
Filtrat Residu
Lemak cair
Lapisan Atas Lapisan Bawah
3.3.4 Proses Penyerapan Kolesterol
3.3.4.1Penambahan kitosan
Dilarutkan dengan 100 mL kloroform dalam gelas beaker, diaduk dengan waktu pengadukan 1 jam
Disentrifuge dengan kecepatan 3000 rpm selama 20 menit
Didekantasi
Dimasukkan ke dalam gelas beaker
Ditambahkan dengan 1 g kitosan, diaduk dimana waktu penyerapan
divariasikan masing-masing 15, 30, 45 dan 60 menit
Disaring
Disaponifikasi dengan 30 mL KOH-alkohol 0,5 N selama ± 1 jam
Didinginkan
Diekstraksi dengan 25 mL n-heksan
Dimasukkan ke dalam botol vial
Dianalisa kadarnya secara kromatografi gas
3.3.4.2
Filtrat Residu
Lemak cair
Lapisan Atas Lapisan Bawah
Hasil
25 g Udang lipan
BAB 4
HASIL DAN PEMBAHASAN
4.1. Hasil Penelitian
4.1.1. Kitin
Ekstraksi kitin dari kulit udang lipan sebelum dilakukan proses deproteinasi maka
kulit direndam lebih dahulu dalam larutan NaOH 0,5% selama 24 jam untuk
melepaskan jaringan otot yang melekat, lalu diulangi sekali lagi sebelum dicuci
dengan air. Deproteinasi kitin merupakan reaksi hidrolisis dalam suasana asam atau
basa. Proses deproteinasi menggunakan larutan NaOH 5% akan mengurangi protein
dari kulit udang lipan. (Sugita, 2009)
Demineralisasi dilakukan untuk menghilangkan mineral-mineral yang ada
dengan cara menggunakan asam klorida. Dimana asam klorida akan melarutkan
mineral yang ada. Reaksinya adalah sebagai berikut :
CaCO3(s) + 2 HCl CaCl2 (l) + H2O + CO2 (g)
Dari proses-proses di atas diketahui bahwa setiap proses yang dilakukan akan
mengurangi berat sampel yang ada, karena setiap proses yang dilakukan bertujuan
untuk menghilangkan senyawa-senyawa yang tidak diinginkan dari sampel. Hal ini
Tabel 4.2. Karakterisasi Kitin Udang Lipan
No Parameter Pengamatan
1 Kadar Air (%) 8.0
2 Kadar Abu (%) 1,65
3 Kelarutan dalam asam phospat 90% Larut
Kitin yang diperoleh dari ekstraksi kulit udang lipan ternyata larut dalam asam
phospat 90% dan menghasilkan larutan berwarna coklat muda.
Hasil analisis unsur pada kitin C, H, dan N yang diperoleh ditunjukkan pada
tabel di bawah ini.
Tabel 4.3 Analisis Unsur C, H, dan N pada Kitin
Analisis Unsur Kitin Standar a (%)
Kitin Kulit Udang Lipanb (%)
C 47,00 46,60
H 6,45 6,80
N 6,89 6,50
Keterangan :
a : Kitin Standar (Muzzarelli, 1977)
b : Kitin yang dihasilkan dari Kulit Udang Lipan
4.1.2. Kitosan
Pengolahan kitosan dapat dilakukan dengan proses deasetilasi menggunakan basa
kuat pada temperatur yang cukup tinggi. Dengan kondisi ini, gugus asetil yang ada
pada kitin akan terlepas sehingga senyawa amida yang ada pada kitin berubah
menjadi senyawa amina. Perubahan struktur inilah yang dinamakan kitosan. (Harry,
2010)
Karakterisasi kitosan seperti kadar air, kadar abu dan uji kelarutannya dapat
Tabel 4.4. Karakterisasi Kitosan Udang Lipan
No Parameter Pengamatan
1 Kadar air (%) 10
2 Kadar abu (%) 1,62
3 Kelarutan dalam asam asetat 1% Larutan sangat kental
Hasil analisis unsur C, H, dan N pada kitosan yang diperoleh ditunjukkan
pada tabel 4.5.
Tabel 4.5 Analisis Unsur C, H, dan N pada Kitosan
Analisis Unsur Kitosan
Komersil a (%)
Kitosan Udang lipan b (%)
C 40,25 40,30
H 5,80 5,20
N 6,40 7,40
Keterangan :
a : Kitosan Komersil (Fluka)
b : Kitosan yang dihasilkan dari kulit udang lipan
4.1.3. Penentuan Kolesterol
Kondisi alat Kromagrafi Gas (GC) pada pengukuran larutan standar kolesterol, dan
Tabel 4.6. Kondisi Alat GC Merek Hewlett Packard HP-6890 pada pengukuran larutan standar Kolesterol
Tabel 4.7. Data larutan standar Kolesterol
Keterangan :
xi = konsentrasi larutan standar kolesterol
yi = Area pada Kromatogram, dapat dilihat pada gambar 4,5,6,7,8
4.2 Pengolahan Data
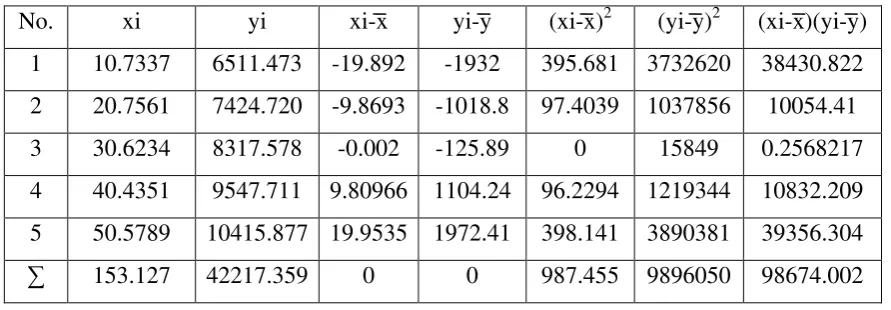
4.2.1 Penurunan Persamaan Garis Regresi dengan Metode Least Square
Untuk memperoleh kadar kolesterol yang terdapat dalam lemak udang lipan dengan
menghitung luas puncak untuk masing-masing konsentrasi. Data yang diperoleh
diolah dengan metode Least-Square dan akhirnya diperoleh persamaan garis
regresinya. Penentuannya adalah sebagai berikut :
No. Parameter Kondisi
Tabel 4.8 Data Hasil Penurunan Persamaan Regresi Untuk Kolesterol
5 50.5789 10415.877 19.9535 1972.41 398.141 3890381 39356.304 ∑ 153.127 42217.359 0 0 987.455 9896050 98674.002
Persamaan garis regresi untuk kurva kalibrasi dapat diturunkan dari persamaan garis:
y = ax + b
Dimana: a = slope
b = intersept
Selanjutnya harga slope dapat ditentukan dengan menggunakan metode Least-Square
sebagai berikut :
a = ∑(Xi−X)(Yi−Y) ∑(Xi−X)2
b = y – ax
Dengan mensubstitusikan harga-harga yang tercantum pada tabel 4.6 diatas pada
persamaan ini maka diperoleh :
a = 98674 .002
987.455
= 99.92757
b = 8443.472 – (99.92757 x 30.62544)
Maka persamaan yang diperoleh adalah :
y = 99.92757 x + 5383.146
dimana y = luas puncak
x = konsentrasi larutan standar.
4.2.2 Koefisien Korelasi
Koefisien korelasi ( r ) dapat ditentukan dengan menggunakan persamaan sebagai
berikut:
4.2.3 Penentuan Konsentrasi
Untuk menghitung konsentrasi dari kolesterol
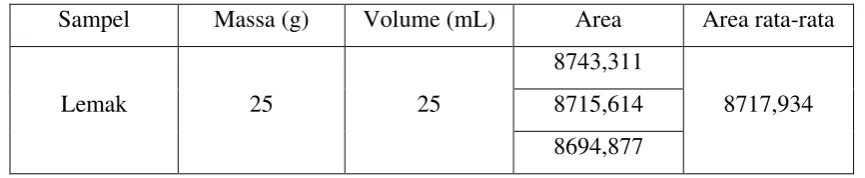
Tabel 4.9 Data Hasil Luas Puncak kolesterol FTIR pada Lemak Udang lipan
Sampel Massa (g) Volume (mL) Area Area rata-rata
- Data pada area dapat dilihat dari gambar 9,10,11.
4.2.4 Penentuan Kadar Kolesterol setelah Penambahan Kitosan
Kadar kolesterol dari lemak udang lipan setelah penambahan 1 gram kitosan dengan
waktu perendaman selama 15 menit, dapat ditentukan dengan cara :
y = ax + b
- Kadar kolesterol setelah penambahan 1 gram kitosan dengan waktu
perendaman selama 15 menit adalah 29,224 mg/ml
- Berat lemak setelah penambahan 1 gram kitosan dengan waktu perendaman
selama 15 menit = 29,224 mg/ml x 25 ml
= 730,6 mg
= 0,7306 g
- % penyerapan kolesterol dengan waktu perendaman selama 15 menit
% penyerapan = berat kolesterol awal – berat kolesterol akhir
berat kolestrol awal x 100%
= 0,8343 – 0,7306
0,8343 x 100%
= 12,43%
Dengan cara yang sama, maka dapat ditentukan kadar kolesterol dan % penyerapan
menggunakan 1 gram kitosan dengan variasi waktu perendaman 15, 30, 45 dan 60
menit seperti ditunjukkan pada tabel di bawah ini ,
4.2.4.2 Penentuan Kadar Kolesterol setelah Penambahan 3 gram Kitosan
Kadar kolesterol dari lemak udang lipan setelah penambahan 3 gram kitosan dengan
waktu perendaman selama 15 menit, dapat ditentukan dengan cara :
- Kadar kolesterol setelah penambahan 3 gram kitosan dengan waktu
perendaman selama 15 menit adalah 28.576mg/ml
- Berat kolesterol setelah penambahan 3 gram kitosan dengan waktu
perendaman selama 15 menit = 28,576 mg/ml x 25 ml
= 714,2 mg
= 0,7144 gram
- % penyerapan kolesterol dengan waktu perendaman selama 15 menit
% penyerapan = berat kolesterol awal – berat kolesterol akhir
berat kolesterol awal x 100%
= 0,8343 – 0,7144
0,8343 x 100%
= 14,37%
Dengan cara yang sama, maka dapat ditentukan kadar kolesterol dan % penyerapan
menggunakan 3 gram kitosan dengan variasi waktu perendaman 15, 30, 45 dan 60
menit seperti ditunjukkan pada tael di bawah ini ,
Tabel 4.12 Pengaruh waktu perendaman 5 gram kitosan terhadap penyerapan kolesterol dari lemak udang lipan
4.3 Pembahasan
4.3.1. Penentuan Derajat Deasetilasi
Analisis kuantitatif dari spektroskopi FT-IR dapat dilakukan berdasarkan spectrum
Infra merah yang dihasilkan, dimana penentuan derajat deasetilasi dari kitosan
menggunakan persamaan Domszy dan Robers (Sugita,2009)
%DD = 1- [(A1665 / A3450) x 1/1,33] x 100%
dimana: A1665 = absorbansi pada bilangan gelombang 1665 cm-1 A3450 = absorbansi pada bilangan gelombang 3450 cm-1
1,33 = tetapan yang diperoleh dari perbandingan A1665 / A3450 untuk kitosan dengan asetilasi penuh
Maka besarnya nilai dari Derajat Deasetilasi kitosan udang lipan adalah
%
Berdasarkan Proton Laboratories Inc. (Nuraida,2000) yang menyatakan bahwa
kitosan memiliki derajat deasetilasi ≥ 70% maka dapat dinyatakan bahwa proses
4.3.2 Analisa Spektrum FT-IR
Analisa dengan menggunakan spectrum infra merah ini digunakan untuk
memberikan informasi tentang adanya perubahan gugus fungsi yang menandakan
adanya interaksi secara kimia. Hasil dari spektrum infra merah dapat dilihat pada
lampiran.
Spektroskopi FT-IR dari kitin dan kitosan secara umum menunjukkan adanya
kesamaan gugus-gugus yang terdapat pada masing-masing polimer tersebut.
Perbedaan yang dapat diamati yaitu pergeseran bilangan gelombang dan perubahan
nilai transmitant yang menunjukkan kuantitas dari gugus tersebut di dalam polimer.
Pada masing-masing polimer yang dikarakterisasi terdapat juga gugus-gugus
lain seperti ulur O-H, ulur N-H, ulur C-H, ulur C-O dan ulur C-N. Ulur O-H pada
masing- masing polimer telihat membentuk spektra yang melebar ke bawah sehingga
ulur N-H yang juga berada pada daerah ini tidak dapat diamati. Adanya ulur N-H
dapat diperjelas dengan adanya tekukan N-H pada masing-masing polimer.
Ulur C-O pada polimer-polimer tersebut berasal dari gugus metanol yang
melekat pada rantai polimer. Sedangkan ulur C-H berasal dari rantai utama polimer.
Adanya ulur C-H akan diperkuat dengan tekukan C-H dari metil maupun metilen
pada masing-masing polimer.
Spektra FT-IR dari kitin dan kitosan yang dihasilkan telah menunjukkan
gugus-gugus yang seharusnya ada di dalam polimer kitin dan kitosan. Besarnya
bilangan gelombang pada gugus-gugus kitin dan kitosan dapat dibandingkan dengan
spektra FT-IR dari kitin dan kitosan standar untuk melihat kualitas dari kitin dan
Tabel 4.14 Perbandingan spektra FT-IR kitin dan kitosan dengan standarnya
Gugus terkait Kitin standar
(cm-1)
Pada spektrum FT-IR untuk kitosan udang lipan yang didapat, terlihat bahwa
masih terdapatnya gugus fungsi C=O. Hal ini sebabkan karena sebenarnya kitin
ataupun kitosan
merupakan ko-polimer N-asetil-D-Glukosamin dan D-Glukosamin. Kitin biasanya
mempunyai derajad deasetilasi kurang dari 10 %. Secara umum derajat deasetilasi
untuk kitosan sekitar 60% dan sekitar 90-100 % untuk kitosan yang mengalami
deasetilasi penuh. (L.H Rahayu, 2007)
4.3.3 Pengaruh kitosan terhadap kadar kolesterol
Penentuan kadar kolesterol dari lemak udang lipan dilakukan dengan mengekstraksi
lemak terlebih dahulu dengan menggunakan metode Beyer & Jensen. Dimana lemak
tersebut dilarutkan dengan kloroform untuk memisahkan fraksi-fraksi dari lemak
tersebut. Kemudian filtratnya disaponifikasi dengan KOH-alkohol yang bertujuan
untuk memisahkan lemak dengan fraksi lemak yang lainnya. Dimana kolesterol
adalah fraksi lemak yang tidak tersabunkan. Kemudian diekstraksi dengan n-heksan
untuk menarik kolesterol tersebut. Selanjutnya diukur kadarnya dengan metode
dengan memvariasikan konsentrasi larutan standar dengan menggunakan persamaan
least square sehingga diperoleh persamaan linear Y = 99.927577 X + 5383.146
Dari hasil penelitian diperoleh kadar kolesterol setelah penambahan 1 gram
kitosan dengan variasi waktu penyerapan 15, 30, 45 dan 60 menit adalah 29,224
(mg/mL); 26,936 (mg/mL); 25,172 (mg/mL) dan 22,376 (mg/mL). Dengan kata lain,
kadar kolesterol setelah penambahan 1 gram kitosan mengalami penurunan sebesar
12,24%; 19,28%; 24,57% dan 32,94% (Tabel 4.10). Kadar kolesterol setelah
penambahan 3 gram kitosan adalah 28,576 (mg/mL); 24,872 (mg/mL); 22,632
(mg/mL) dan 20,844 (mg/mL). Maka dengan penambahan 3 gram kitosan kadar
kolesterol mengalami penurunan sebesar 14,37%; 25,46%; 32,18% dan 37,54% (
tabel 4.11 ).
Dari tabel 4.12 dapat dilihat bahwa kadar kolesterol setelah penambahan 5
gram kitosan dengan variasi waktu perendaman 15, 30, 45 dan 60 menit adalah
22,392 (mg/mL); 21,316 (mg/mL); 19,200 (mg/mL) dan 17,160 (mg/mL). Sehingga
kadar kolesterol mengalami penurunan sebesar 32,89%; 36,12%; 42,46% dan
48,57%. Dan kadar kolesterol setelah penambahan 7 gram kitosan adalah 23,776
(mg/mL); 22,512 (mg/mL); 21,612 (mg/mL) dan 20,864 (mg/mL). Maka kadar
kolesterol mengalami penurunan sebesar 28,75%; 32,54%; 35,23% dan 37,48%
(tabel 4.13).
Dari keterangan di atas dapat dilihat bahwa pengaruh penambahan kitosan
sebanyak 1,3 dan 5 gram berpengaruh secara positif terhadap penyerapan kolesterol.
Namun pada penambahan 7 gram kitosan tidak menunjukkan korelasi yang
signifikan terhadap penyerapan kolesterol. Hal ini disebabkan karena larutan yang
dihasilkan setelah penambahan 7 gram kitosan sangat kental sehingga menyebabkan
proses pengadukan menjadi tidak sempurna, mengakibatkan persentasi
penyerapannya menjadi menurun.
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Berdasarkan penelitian yang dilakukan makan dapat disimpulkan:
1. Penyediaan kitin dan kitosan dari 1520 gram kulit udang lipan kering
menghasilkan 15,3% kitin udang lipan dan 82,86% kitosan udang lipan.
2. Derajat deasetilasi yang dihasilkan untuk kitosan udang lipan ini adalah
82,65%.
3. Penyerapan optimal kadar kolesterol dengan menggunakan kitosan dari kulit
udang adalah pada penambahan 5 gram kitosan.
5.2 Saran
Berdasarkan penelitian yang telah dilakukan, diharapkan pada penelitian selanjutnya
untuk dapat memvariasikan konsentrasi NaOH yang digunakan pada proses
deasetilasi kitin agar diperoleh kitosan dengan kualitas yang lebih baik. Serta dapat
dilakukan proses ekstraksi kolesterol dari lemak dengan menggunakan metode yang
DAFTAR PUSTAKA
Arisol. A and Radzi. Z. 1992. An Economical Technique for Producing Chitosan. In
Advances in Chitin and Chitosan. Elsevier Applied Sci. pp 627-632.
Abdul, R. 2007. Kimia Farmasi Analisis. Yogyakarta : Pustaka Pelajar.
Astuti,P. 2007. Adsorbsi Limbah Zat Warna Tekstil Jenis Procion Red MX 8B Oleh Kitosan dan Kitosan Sulfat Hasil Deasetiasi Kitin Kulit Bekicot (Achatina Fullica). Surakarta. Universitas Sebelas Maret.
Brive,C.J. 1984. Introduction Chitin: Accomplishments and Perspectives. Chitin, Chitosan and Related Enzyme. Orlando: Acadec Press Inc. pp xvii-xxiii
Christian,D,G. 2005. Analytical Chemistry .Sixth Edition. New York: John Willey And Sons.
Dachriyanus. 2004. Analisis Struktur Senyawa Organic Secara Spektroskopi. Padang: Andalas University Press.
Denas,G. & Sanza I. 2000. Synthesis and Characterization of Chitosan-PHB Blends.
Hargono. 2008. Pembuatan Kitosan dari Limbah Kulit Udang serta Aplikasinya dalam Meresuksi Lemak Lemak Udang lipan. Semarang: UNDIP.
Harry. N. 2010. Studi Karakterisasi Pembuatan Kitin dan Kitosan dari Kulit Belangkas (Tachypleus Gigas) Untuk Penentuan Berat Molekul. Skripsi. Medan: Universitas Sumatera Utara
Hendri,J. 2008. Teknik Deproteinasi Kulit Rajungan (Portunus pelagious) Secara Enzimatik dengan Menggunakan Bakteri Pseudomonas aeruginosa untuk Pembuatan Polimer Kitin dan Deasetilasinya. Lampung: UNILA.
Hwang,J.& Shin,H. 2002. Rheological Properties of Chitosan Solution. Korea: Australia rheology Journal.
Iriani,R. 2002. Pemanfaatan Kitosan dari Kulit Udang (PanaeusMonodon) dan Kulit Belangkas (Tachypleus Gigas), untuk Menurunkan Kadar Ni, Cr Limbah Cair Industri Pelapisan Logam. Tesis. USU. Medan.
Knorr,D. 1991. Recovery and Utilization of Chitin and Chitosan in Food Processing Waste Management. Food Tech. 45(1): 114-122
Mc.Nair. 1988. Dasar Kromatografi Gas. Bandung : Penerbit Institut Teknologi Bandung.
Melany,N.R. 2007. Sintesis Kompleks Kitosan Hidrogel-Tembaga (II) dari KItosan Hidrogel yang Berasal dari Kulit Udang lipan. Skripsi. Inderalaya. Universitas Sriwijaya.
Merck Index. 1976. An Encyclopedia of Chemical and Drugs. USA; Windholz, M., S.Budavari, L.Y.Stroumtsos, M.Nocther (Eds). Merck & Co.Inc. pp 259-276.
Mulja, M. 1995. Analisis Instrumental. Surabaya: Airlangga University Press.
Muzarelli,R,A,A. 1977. Chitin . Perngamon Press. New York: Oxford.
Poedjiadi, A. 2006. Dasar-Dasar Biokimia. Jakarta: UI-Press.
Rahayu,L.H dan S.Purnavita. 2007. Optimasi Pembuatan Kitosan dari Kitin Limbah Kulit Rajungan (Portunus pelagicus) untuk Adsorben Ion Logam Merkuri:Semarang
Sudarmadji,S. 1989. Analisa Bahan Makanan dan Pertanian. Yogyakarta: Liberty.
Sudjadi. 2006. Metode Pemisahan. Fakultas Farmasi Universitas Gadjah Mada. Yogyakarta : Penerbit Kanisius.
Sugita,P.2009. Sumber Biomaterial Masa Depan. Kitosan. Bandung: IPB Press.
Roberts.G.A. 1991. Chitin Chemistry. Nottingham Politechnic. USA: Mc Millan.
Underwood, A.L. 1999. Analisis Kimia Kuantitatif. Edisi ke-6. Jakarta : Erlangga.