STUDI PENDAHULUAN ISOLASI BAKTERI Rhizobium DARI
BINTIL AKAR TANAMAN PUTRI MALU ( Mimosa pudica. L)
SERTA PEMANFAATANNYA SEBAGAI PUPUK HAYATI
(BIOFERTILIZER) DENGAN MENGGUNAKAN BENTONIT
SEBAGAI MEDIUM PEMBAWA
SKRIPSI
IRWAN PANDAPOTAN HARAHAP
060822016
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
STUDI PENDAHULUAN ISOLASI BAKTERI Rhizobium DARI BINTIL AKAR
TANAMAN PUTRI MALU ( Mimosa pudica. L) SERTA PEMANFAATANNYA
SEBAGAI PUPUK HAYATI (BIOFERTILIZER) DENGAN MENGGUNAKAN BENTONIT SEBAGAI MEDIUM PEMBAWA
SKRIPSI
Diajukan Untuk Melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
IRWAN PANDAPOTAN HARAHAP 060822016
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : STUDI PENDAHULUAN ISOLASI BAKTERI
Rhizobium DARI BINTIL AKAR TANAMAN
PUTRI MALU (Mimosa pudica. L) SERTA
PEMANFAATANNYA SEBAGAI PUPUK
MIKROBA (BIOFERTILIZER) DENGAN
BENTONIT SEBAGAI MEDIUM PEMBAWA.
Kategori : SKRIPSI
Nama : IRWAN PANDAPOTAN HARAHAP
Nomor Induk Mahasiswa : 060822016
Program Studi : SARJANA (S1)
Departemen : KIMIA
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN
ALAM (FMIPA) UNIVERSITAS SUMATERA UTARA
Disetujui
Medan, Desember 2008
Komisi Pembimbing :
Pembimbing 2 Pembimbing 1
Drs. Firman Sebayang, MS DR. Ribu Surbakti, MS
NIP. 131 459 468 NIP 130 872 290
Diketahui/Disetujui oleh
Departemen Kimia FMIPA USU Ketua,
PERNYATAAN
STUDI PENDAHULUAN ISOLASI BAKTERI Rhizobium DARI BINTIL AKAR
TANAMAN PUTRI MALU (Mimosa pudica . L) SERTA PEMANFAATANNYA
SEBAGAI PUPUK MIKROBA(BIOFERTILIZER) DENGAN MENGGUNKAN BENTONIT SEBAGAI MEDIUM PEMBAWA
SKRIPSI
Saya mengakui bahwa karya ilmiah ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Desember 2008
PENGHARGAAN
Puji dan syukur penulis panjatkan kepada Allah SWT yang Maha Pemurah dan Maha Penyayang, dengan limpah kurnia-Nya skripsi ini berhasil diselesaikan dalam waktu yang telah ditetapkan
ABSTRAK
THE INTRODUCTION STUDY OF Rhizobium BACTERIA’S ISOLATED
FROM THE Mimosa pudica’ |ROOT NODULES AND IT’S ADVENTAGE AS
BIOFERTILIZER THE USE OF BENTONIT AS A CARRIER
ABSTRACT
The research of the use of bentonit as a carrier for Rhizobium bacteria and the aplication result for mung bean has been done in the Biochemistry, Mathematics and science Faculty, University of north Sumatera, Medan. The aim of this research is to get know the ability of Rhizobium to fixation nitrogen from the air. The isolated of Rhizobium have got by isolated the bacteria with selective media, by using Yeast Ekstract Manitol Agar (YEMA) and congo red. The isolated of Rhizobium inoculated to bentonit. The result of the aplication test from mung bean plant showed the plant that were given by biofertilizer for I week has average width of leaf 2,28 cm, length of leaf 5,81 cm, widely of leaf 14,80 cm2, while the maize of blank has avarege for I week width of leaf 2,06 cm, length of leaf 4,03 cm, widely of leaf 13,79 cm2, II week has average width of leaf 3,59 cm, length of leaf 6,83 cm, widely of leaf 27,60 cm2, blank II week has average width of leaf 2,8 cm, length of leaf 6,06 cm, widely of leaf 26,19 cm2, III week has average width of leaf 4,89 cm, length of leaf 7,89 cm, widely of leaf 44,19 cm2, blank III week has average width of leaf 3,76 cm, length of leaf 7,1 cm, widely of leaf 41,36 cm2, IV week has average width of leaf 6,80 cm, length of leaf 9,58 cm, widely of leaf 57,86 cm2 , blank IV week has average width of leaf 5,73 cm, length of leaf 8,23 cm, widely of leaf 48,44 cm2.
DAFTAR ISI
2.4. Proses fiksasi nitrogen udara oleh mikroba 10
2.4.1. Fiksasi nitrogen secara nonsimbiotik 11
3.3.3. Pembuatan biakan murni 23
3.3.3.1. Pengidentifikasian Bakteri 23
3.3.4. Pembuatan Starter 23
3.3.5. Pencampuaran Starter dengan medium pembawa 24
3.3.6. Pengujian Jumlah sel dari Media Pembawa 24
3.3.7. Pengujian lapangan 24
3.3.8. Penentuan aktivitas air (Aw
3.4. Bagan Penelitian Isolasi Bakteri Rhizobium Metode Dubey, 2006 26
4.2.1. Perhitungan aktivitas air (Aw
DAFTAR TABEL
Halaman Tabel 2.8 Komposisi Medium Yeast Extrak Manitol Agar (YEMA) 17 Tabel 4.1 Data perhitungan jumlah koloni bakteri Rhizobium 43
Table 4.2 Data Perhitungan jumlah total sel Rhizobium 43
Table 4.3 Data hasil pertambahan luas daun kacang hijau per minggu 42
DAFTAR GAMBAR
Halaman
Gambar 1. Bakteri Rhizobium pada Yeast Ekstrak Manitol Agar (YEMA) 44 + Congo Red
Gambar 2. Bakteri Rhizobium pada Yeast Ekastrak Manitol Agar (YEMA) 44
Gambar 7. Gambar tanaman Kacang Hijau Minggu I
Tanaman Kacang Hijau Minggu II Perbandingan 46
Gambar 11. Gambar tanaman Kacang Hijau Minggu II
Tanaman Kacang Hijau Minggu II Perbandingan 47
Gambar 15. Gambar tanaman Kacang Hijau Minggu III
Gambar 18. Gambar tanaman Kacang Hijau Minggu IV
Tanaman Kacang Hijau Minggu I Perbandingan 50
1:2, 1:3, 1:4,1:5, 1:6, dan Blanko
Gambar 19. Gambar tanaman Kacang Hijau Minggu IV
Tanaman Kacang Hijau Minggu II Perbandingan 50 1:2, 1:3, 1:4,1:5, 1:6, dan Blanko
Gambar 20. Gambar tanaman Kacang Hijau Minggu IV
Tanaman Kacang Hijau Minggu III Perbandingan 51 1:2, 1:3, 1:4,1:5, 1:6, dan Blanko
Gambar 21. Gambar tanaman Kacang Hijau Minggu IV
DAFTAR GRAFIK
Halaman
ABSTRAK
THE INTRODUCTION STUDY OF Rhizobium BACTERIA’S ISOLATED
FROM THE Mimosa pudica’ |ROOT NODULES AND IT’S ADVENTAGE AS
BIOFERTILIZER THE USE OF BENTONIT AS A CARRIER
ABSTRACT
The research of the use of bentonit as a carrier for Rhizobium bacteria and the aplication result for mung bean has been done in the Biochemistry, Mathematics and science Faculty, University of north Sumatera, Medan. The aim of this research is to get know the ability of Rhizobium to fixation nitrogen from the air. The isolated of Rhizobium have got by isolated the bacteria with selective media, by using Yeast Ekstract Manitol Agar (YEMA) and congo red. The isolated of Rhizobium inoculated to bentonit. The result of the aplication test from mung bean plant showed the plant that were given by biofertilizer for I week has average width of leaf 2,28 cm, length of leaf 5,81 cm, widely of leaf 14,80 cm2, while the maize of blank has avarege for I week width of leaf 2,06 cm, length of leaf 4,03 cm, widely of leaf 13,79 cm2, II week has average width of leaf 3,59 cm, length of leaf 6,83 cm, widely of leaf 27,60 cm2, blank II week has average width of leaf 2,8 cm, length of leaf 6,06 cm, widely of leaf 26,19 cm2, III week has average width of leaf 4,89 cm, length of leaf 7,89 cm, widely of leaf 44,19 cm2, blank III week has average width of leaf 3,76 cm, length of leaf 7,1 cm, widely of leaf 41,36 cm2, IV week has average width of leaf 6,80 cm, length of leaf 9,58 cm, widely of leaf 57,86 cm2 , blank IV week has average width of leaf 5,73 cm, length of leaf 8,23 cm, widely of leaf 48,44 cm2.
BAB 1
PENDAHULUAN
1.1.Latar Belakang
Mengingat akan semakin mahalnya harga pupuk dan manfaat yang besar terhadap kelestarian ekosistem, maka penggunaan pupuk buatan mulai dikompensasikan dengan penggunaan pupuk alternatif yang lebih murah dan dampaknya terhadap penurunan kualitas lingkungan jauh lebih kecil. Salah satu alternatif pupuk buatan semacam ini adalah pupuk hayati Pada tahun 1990-an penggunaan mikroba dalam bentuk isolat di dalam pembuatan pupuk telah banyak dikembangkan yang dikenal dengan pupuk hayati (Boifertilizer) terutama untuk negara-negara yang telah maju, seperti: Amerika serikat, Francis, Belgia, Jerman, Hungaria, Australia, India, Taiwan, Afrika Utara dan negara lainnya. (Yuwono.T, 2006).
Pupuk hayati atau lebih dikenal dengan nama pupuk mikroba telah banyak beredar di pasaran dan beberapa daerah mulai digunakan oleh petani. Pupuk hayati menurut SK Menteri Pertanian No. R.130.760.11.1998 digolongkan kedalam kelompok pupuk alternatif. Secara umum istilah pupuk hayati diartikan sebagai suatu bahan yang mengandung sel hidup atau dalam keadaan laten dari suatu strain penambat nitrogen, pelarut, atau mikroorganisme selulolitik yang diberikan ke biji, tanah, atau ketempat pengomposan. Pupuk hayati banyak dimanfaatkan petani untuk meningkatkan hasil dan memperbaiki mutu. Di Indonesia pupuk bio yang telah lazim digunakan seperti: Legin, Bio-lestari, OST Rajawali, Emas, Bio-SP, Rhizo-Plus, Rhiposant dll
nitrogen buatan yang dibuat dengan proses Harber-Bocsh memerlukan energi sebanyak 13.500 Kilo kalori/Kg nitrogen dengan suhu sekitar 8000
Dari segi ekonomi penggunaan pupuk hayati sangat hemat dibanding pupuk kimia. Pupuk bio, seperti Legin, Bio-Lestari, Rhiposant mempunyai Kandungan bakteri Rhizobium 10.000.000 – 1.000.000.000 sel tiap g, masa simpan 6 bulan setelah diproduksi. Disimpan dalam kemasan polycellonium / aluminium foil, berat bersih 30 g untuk pertanaman 2000 m
F dengan tekanan diatas tekanan atmosfer. Energi sebanyak ini biasanya diperlukan oleh energi fossil, misalnya minyak bumi, sehingga produksi pupuk nitrogen buatan mempunyai implikasi yang besar dalam peyediaan energi serta menimbulkan masalah yang besar. Di lain pihak, Rhizobium mampu melakukan pengikatan nitrogen dari atmosfer hanya dengan energi biologis yang sangat kecil sehingga tidak menimbulkan masalah energi maupun lingkungan. Keberadaan mikrobia – mikrobia seperti inilah yang kemudian menimbulkan gagasan untuk pemanfaatannya sebagai pupuk hayati.(Yuwono.T, 2006)
2
untuk 1 ha diperlukan 5 kantong standard.
Diantara bakteri yang bermanfaat, Rhizobium yang paling banyak digunakan untuk pupuk hayati. Koloni Rhizobium bersimbiosa dengan akar tanaman leguminosa membentuk bintil akar yang berperan dalam pengikatan nitrogen sehingga mampu memfiksasi nitrogen (Sutanto.R, 2002).
Dalam formulasi pupuk hayati, seringkali bahkan tidak diperlukan bahan – bahan kimia buatan karena bahan – bahan tersebut dapat diganti dengan bahan pembawa (carier). Pupuk hayati mempunyai kelebihan dibanding dengan pupuk kimia buatan karena bahan – bahannya berasal dari alam sehingga tidak menimbulkan persoalan pencemaran lingkungan seperti halnya dengan pupuk kimia buatan. Beberapa bahan pembawa yang dapat digunakan untuk formulasi inokulan rhizobia antara lain gambut, lignite, arang, zeolit, bentonit (Yuwono.T, 2006).
kebutuhan industri perminyakan sebagai lumpur pemboran dan industri makanan dan pupuk (Proyek Kerja Dinas Pertambangan Sumatera Utara, 1999/2000).
Tanaman putri malu memiliki nama ilmiah Mimosa pudica Linn. Di beberapa daerah, tumbuhan dari famili Mimosaceae ini juga dikenal dengan nama si kejut, rebah bangunt. Tumbuh di pinggir jalan, tanah lapang, cepat berkembang biak, tumbuh berbaring di tanah. Tumbuhan yang berasal dari Amerika tropis ini hidup di ketinggian 1 – 2000 meter. Seluruh bagian tumbuhan (akar, batang , daun) dapat digunakan sebagai obat (Fauzi, Kusuma, R dan Zaky. B. M., 2005).
Penelitian sebelumya yang dilakukan oleh Lubis K., Surbakti R., Sebayang F., 2007, diduga memiliki kelemahan yaitu karena menggunakan serbuk gergaji sebagai media pembawa yang bersifat hidroskopis, menyebabkan kadar Aw (Water activitiy)
selalu berubah sehingga persyaratan hidup untuk bakteri Rhizobium tidak terpenuhi. Salah satu faktor yang menentukan mutu pupuk hayati adalah jumlah mikroorganisme yang terkandung didalamnya. Hasil penelitian menunjukan bahwa penyimpanan pada suhu rendah umumnya lebih cocok untuk ketahanan hidup mikroorganisme daripada suhu tinggi. Peningkatan suhu menyebabkan kelembaban menurun. Dengan mempertahankan kelembaban, kematian mikroorganisme dapat dikurangi.
Oleh karena itu penulis tertarik untuk melakukan penelitian tentang isolasi bakteri Rhizobium dari bintil akar tanaman putri malu (Mimosa pudica L) serta pemanfaatannya sebagai pupuk hayati (biofertilizer) dengan menggunakan bentonit sebagai medium pembawa dalam bentuk tabur.
1.2.Permasalahan
1.3.Pembatasan Masalah
Berhubung dengan luasnya permasalahan yang dicakup maka penulis membatasi masalah yang berhubungan dengan penelitian ini, yaitu:
1. Pengambilan sampel hanya dilakukan pada satu lokasi saja.
2. Isolasi bakteri Rhizobium dilakukan pada media selektif dengan menggunakan media Yeast Ekstract Monitor Agar (YEMA) dan pengujiannya dilakukan dengan penambahan Congo Red (Dubey, 2005).
3. Bentonit yang digunakan diambil dari satu lokasi saja.
4. Variasi perbandingan yang dilakukan 1 : 2 sampai 1 : 6. ( Masing – masing 5 g bentonit dicampurkan dengan 10 ml, 15 ml, 20 ml, 25 ml , 30 ml starter kultur dalam wadah yang berbeda)
1.4.Tujuan Penelitian
Adapun tujuan dari penelitian ini adalah untuk :
1. Untuk memperoleh biakan murni Rhizobium yang diisolasi dari akar tanaman putri malu.
2. Untuk membuat pupuk hayati yang memenuhi standart dengan menggunakan variasi konsentrasi antara Rhizobium hasil isolasi dengan bentonit yang digunakan sebagai carrier
3. Untuk membandingkan kesuburan tanaman aplikasi di lapangan antara tumbuhan yang ditambahkan bakteri Rhizobium dengan blanko.
1.5.Manfat Penelitian
1.6.Metodologi Penelitian
Penelitian ini dilakukan secara eksperimen di laboratorium yaitu pembuatan pupuk mikroba dengan menggunakan bakteri Rhizobium yang diisolasi dari bintil akar tanaman putri malu. Penelitian ini dilakukan beberapa tahap :
1. Preparasi sampel 2. Penyiapan media 3. Isolasi bakteri
4. Uji mikroskop untuk Rhizobium
5. Perbanyakan (penanaman kembali) untuk mendapatkan biakan murni. 6. Inokulasi bakteri pada bentonit
7. Perhitungan jumlah sel bakteri (dilakukan dari minggu 1 sampai minggu 5) 8. Pengujian lapangan. (Dilakukan selama 4 minggu) (Dubey, 2005).
1.7.Lokasi Penelitian.
Penelitian ini dilakukan di laboratorium Biokimia/Kimia Bahan Makanan dan laboratorium Mikrobiologi FMIPA Universitas Sumatera Utara.
BAB 2
TINJAUAN PUSTAKA
2.1 Tanaman Putri Malu
Tanaman putri malu tumbuh liar di pinggir jalan, lapangan terlantar, dan tempat - tempat terbuka yang terkena sinar matahari. Tumbuhan asli Amerika tropis ini dapat di temukan pada ketinggian 1-1200 m, cepat berkembang biak, tumbuh memanjat, atau berbaring, tinggi 0,3 - 1,5 m. Batang bulat, berambut, dan berduri tempel. Daun berupa daun majemuk menyirip genap ganda dua yang sempurna. Jumlah anak daun setiap sirip 5 - 26 pasang. Helaian anak daun berbentuk memanjang sampai lanset ujung runcing, pangkal membundar, tepi rata, permukaan atas dan bawah licin, panjang 6 - 16 mm, lebar 1 - 3 mm, berwarna hijau, umumnya tepi daun berwarna ungu. Jika daun tersebut tersentuh, akan melipat diri . Bunga bulat, berbentuk seperti bola, bertangkai, berwarna ungu. Buah berbentuk polong, pipih, berbentuk garis. Biji bulat dan pipih. (Dalimartha. S, 2003).
2.1.1 Sistematika tumbuhan Putri malu (Mimosa pudica L)
Kingdom : Plantae
Divisi : Spermatophita
Kelas : Angiospermae
Sub kelas : Dicotyledoneae
Ordo : Fabales
Famili : Mimosaceae
Sub Famili : Mimosoideae
Genus : Mimosaideae
2.1.2. Bintil akar
Macam asosiasi yang lain antara akar dan tumbuhan tingkat tinggi dan organisme tingkat rendah dijumpai pada leguminosa. Pada akar - akarnya terdapat bintil yang berkembang sebagai akibat penetrasi bakteri pengikat nitrogen (spesies Rhizobium) ke dalam rambut akar. Bakteri tersebut memasuki akar terutama melalui rambut akar. Sambil memperbanyak diri, bakteri tersebut membentuk benang infeksi dengan terkurungnya dalam selubung dari bahan seperti gum. Benang – benang itu menembus ke dalam akar dan merangsang sel – selnya. Jumlah sel dalam bintil meningkat mula – mula karena pembelahan di seluruh massa sel yang bulat itu dan kemudian karena aktivitas daerah meristematik setempat yang tidak dimasuki bakteri. Sel – sel terdiferensiasi itu di daerah sebagain dalam, yaitu zona bakteroid, mengandung bakteri yang dilepaskan dari benang – benang infeksi. Bintil – bintil pada tingkatan itu secara sekilas mirip dengan primordium akar lateral. (Fahn, A., 1991).
Perkembangan bintil akar dipengaruhi oleh beberapa faktor yaitu : 1. Konsentrasi nutrient anorganik
2. Suhu tanah (suhu sekitar 250 – 300
3. Cahaya dan naungan (cahaya yang cukup banyak dapat meningkatkan jumlah bintil sedangkan naungan akan menurunkan berat bintil akar).
C optimum untuk pembentukan bintil dan pada suhu yang lebih rendah atau jauh lebih panas pembentukan bintil akar akan terhambat).
4. Konsentrasi CO2
5. Ketersedian nitrogen di dalam tanah (konsentrasi nitrogen yang tinggi dapat mengurangi jumlah maupun berat bintil akar).(Yuwono.T, 2006).
(konsentrasi karbondioksida yang tinggi dapat meningkatkan jumlah bintil akar).
Selama pertumbuhan bintil, bakteri mengalami transformasi ke bentuk bakteroid yang ukurannya lebih besar daripada aslinya. Transformasi ini berhubungan dengan sintesis leghemoglobin, nitrogenase dan enzim lain yang diperlukan untuk fiksasi N2. waktu
antara infeksi sampai dengan bakteri mampu memfiksasi N2 sekitar 3-5 minggu.
2.2. Rhizobium sp
Rhizobium adalah salah satu contoh kelompok bakteri yang berkemampuan sebagai penyedia unsur hara bagi tanaman. Bila bersimbiosis dengan tanaman legume, kelompok bakteri ini akan menginfeksi akar tanaman dan membentuk bintil akar didalamnya. Rhizobium hanya dapat memfiksasi nitrogen atmosfer bila berada di dalam bintil akar dari mitra legumnya. Peranan Rhizobium terhadap pertumbuhan tanaman khususnya berkaitan dengan masalah ketersedian nitrogen bagi tanaman inangnya (Rao, N.S., Subba, 1994).
Bakteri Rhizobium aktif dapat diketahui secara visual dari bintil – bintil bundar di akar tanaman. Bila akar dibelah, didalamnya akan tampak warna kemerahan bila bagian ini dipijit, akan keluar cairan kemerahan. Bakteri Rizobium akan giat mengadakan fiksasi N pada tanah yang kandungan nitrogennya rendah dan akan berkurang pada tanah yang kandungan nitrogennya tinggi. Bakteri Rhizobium mampu bertahan di dalam tanah selama beberapa tahun (Ismawati.E, 2003).
Adapun ciri – ciri umum bakteri Rhizobium adalah merupakan gram negatif, bersifat aerob, berbentuk batang dengan ukuran sekitar 0,5 – 0,9 µm x 1,2 – 3 µm. Bakteri ini termasuk dalam famili Rhizobiaceae. Bakteri ini banyak terdapat di dalam daerah perakaran tanaman legume dan membentuk hubungan simbiotik inang khusus (Yuwono.T, 2006).
2.3. Simbiosis antara Rhizobium dengan Leguminosa
Simbiosis antara Rhizobium dengan leguminosa dicirikan oleh pembentukan struktur bintil akar pada tanaman inang (leguminosa). Pembentukan bintil akar diawali dengan sekresi produk metabolisme tanaman ke daerah perakaran yang menstimulasi pertumbuhan bakteri. Secara umum tahap pembentukan bintil akar pada tanaman leguminosa terjadi melalui beberapa tahapan, yaitu :
1. Pengenalan pasangan yang sesuai antara tanaman dengan bakteri yang diikuti oleh pelekatan bakteri Rhizobium pada permukaan rambut akar tanaman.
2. Invasi rambut akar oleh bakteri melalui pembentukan benang infeksi 3. Perjalanan bakteri ke akar utama melalui benang infeksi.
4. Pembentukan sel - sel bakteri yang mengalami deformasi, yang disebut sebagai bakteriod, didalam sel akar tanaman.
5. Pembelahan sel tanaman dan bakteri sehingga terbentuk bintil akar.
Peletakan Rhizobium pada rambut akar dapat terjadi karena pada permukaan sel Rhizobium dan Bradyrhizobium terdapat suatu protein pelekat (adhesion) yang disebut sebagai rhicadhesin. Rhicadhesin adalah suatu protein pengikat kalsium yang berfungsi dalam pengikatan kompleks kalsium pada permukaan rambut akar. Disamping itu juga terdapat senyawa lain yang berperan dalam pengikatan bakteri yaitu lectin yang merupakan protein yang mengandung karbohidrat.
Penetrasi awal sel bakteri ke dalam rambut akar dilakukan melalui ujung rambut akar. Setelah bakteri melekat, rambut akan menggulung yang disebabkan oleh senyawa yang dikeluarkan oleh bakteri yang disebut sebagai faktor Nod, selanjutnya bakteri memasuki rambut akar dan menginduksi pembentukan benang infeksi yang kemudian tumbuh kearah sel-sel akar. Faktor Nod yang dihasilkan oleh bakteri selanjutnya menstimulasi pembelahan sel – sel tanaman sehingga terbentuk bintil akar (Yuwono.T, 2006).
bakteroid. Bakteroid dikelilingi oleh membran sel tanaman yang disebut membran peribakteroid. Pengikatan nitrogen baru dapat terjadi setelah terbentuk struktur bakteroid. Jika tanaman mati maka bintil akar akan rusak sehingga bakteri terlepas keluar dari sel - sel akar tanaman (Yuwono.T, 2006).
2.4. Proses fiksasi nitrogen udara oleh mikroba
Nitrogen hampir 80% udara yang kita hirup tapi tidak dapat kita pakai, begitu juga semua hewan, tumbuhan, jamur, dan hampir semua bakteri. Namun nitrogen dalam bentuk organik merupakan komponen utama tubuh semua makhluk hidup. Protein asam nukleat, vitamin, dan berbagai molekul lain semua mengandung nitrogen. Beberapa spesies bakteri berkemampuan khusus untuk mereduksi atau mengikat N2
udara untuk membentuk ammonia. Ammonia ini adalah suatu produk senyawa nitrogen yang dapat dipakai oleh tumbuhan dan mikroba sebagai bahan pembangun untuk mensintesa asam amino, demikian pula senyawa bernitrogen lain (Jean L.Marx, 1991).
Fenomena fiksasi nitrogen atmosfer dikenal sebagai diazotrofi (diazotrophy) atau penambatan nitrogen secara biologis (biological nitrogen fixation) sehingga mikrobia yang mampu melakukan fiksasi nitrogen disebut sebagai diazotrof (diazotroph) atau penambat nitrogen (Yuwono. T, 2006).
Proses pengikatan nitrogen ini merupakan salah satu dari banyak proses biokimiawi didalam tanah yang memainkan salah satu peranan penting, yaitu mengubah nitrogen atmosfer (N2
1. Mikroorganisme nonsimbiotik, yaitu yang hidup bebas dan mandiri di dalam tanah
atau nitrogen bebas) menjadi nitrogen dalam persenyawaan (nitrogen terikat). Dua organisme terlibat dalam proses ini :
Besarnya serta pentingnya fiksasi nitrogen hayati dapat di nilai dari perkiraan yang dibuat baru – baru ini yang menyatakan organisme hidup mengikat nitrogen dalam jumlah lebih besar daripada yang dilakukan oleh pabrik diseluruh dunia pada tahun 1974 jumlah nitrogen yang diikat oleh organisme hidup ialah 175 ton, sedangkan yang dihasilkan oleh pabrik hanya 4 juta ton (Pelczar. M, 1998).
2.4.1 Fiksasi nitrogen secara nonsimbiotik.
Fiksasi nitrogen non simbiotik dilakukan oleh Clostridium pasteurium dan Azotobakter. Clostridium bersifat anaerobik, sedangkan Azotobakter bersifat aerobik. Kemampuan fiksasi nitrogen Clostridium jauh lebih kuat jika dibandingkan dengan kemampuan fiksasi nitrogen Azotobakter (Budiyanto.A.K, 2002).
2.4.2. Fiksasi nitrogen secara simbiotik oleh Rhizobium
Fiksasi semacam ini dilakukan oleh Rhizobium dengan leguminosae. Sebelum memfiksasi nitrogen, bakteri ini harus tumbuh terlebih dahulu dalam jaringan akar. Infeksi dari sitem jaringan ini oleh bakteri dikaitkan dengan pembentukan benang infeksi yang berkembang menjadi akar rambut. Bakteri pengfiksasi nitrogen kemudian merusak ke dalam jaringan inang melalui benang infeksi inang. Beberapa sel kemudian diinfeksi, sehingga menyebabkan pembengkakan sel dan peningkatan pembelahan sel, sehingga terjadilah pembentukan nodula. Dalam sistem ini terlibat leguminosa, bakteri, dan nodula. Dalam proses ini baik bakteri maupun tanaman mendapatkan keuntungan dari infeksi ini. Bakteri mengubah N2
infeksi pada akar tanaman maka disekitarnya akan timbul nodula atau bintil akar, dan disinilah bakteri hidup. Setiap nodula dapat mengandung berjuta – juta bakteri dan sejumlah nitrogen yang berkumpul pada nodula. Tanaman leguminosa mengikat atmosferik melalui akar akarnya dan tidak melalui daun – daunnya. Dalam kedaan pertumbuhannya yang muda, akar – akar tanaman itu berkandungan nitrogen lebih besar. Bakteri Rhizobium dalam penelitian lebih dikenal, yaitu sebagai bakteri yang bersimbiosis dengan akar tanaman kacang – kacangan dengan membentuk nodula (Mulyani. M, 1991).
Untuk memfiksasi nitrogen, bakteri Rhizobium menggunakan enzim nitrogenase, dimana enzim ini akan menambat gas nitrogen di udara dan merubahnya menjadi gas amoniak. Gen yang mengatur proses fiksasi ini adalah gen nif (Singkatan nitrogen – fixation). Gen – gen nif ini berbentuk suatu rantai , tidak terpencar kedalam sejumlah DNA (deoxyribonucleic acid) yang sangat besar yang menyusun kromosom bakteri, tetapi semuanya terkelompok dalam suatu daera
Reduksi N2 ke NH3 di dalam nodul dari legum dikatalisis oleh enzim Nitrogenase
dalam bakteroid Rhizobium. Enzim ini dipengaruhi oleh oksigen, menyebabkan inaktivasi yang tidak balik. Suatu hal penting yang perlu diperhatikan bila melakukan ekstraksi dan pemurnian enzim ini ialah kondisinya yang anaerobik. Enzim ini terdiri dari 2 protein yang mengkatalisis reduksi N2 (tidak akan mengkatalisis reduksi N2
tanpa yang lainnya), masing-masing dengan berat molekul 222.000 dalton dan 60.000 dalton. Sub unit yang lebih besar tersusun dari 4 sub unit. Protein yang besar juga mengandung 2 atom Molibdenum. Protein yang kecil terdiri dari 2 sub unit yang identik masing-masing mengandung atom besi. Aktivitas Nitrogenase dapat dimonitor menggunakan Sodium dithionite (Na2S2O4) sebagai reduktan. Mg2+ dan ATP
(adenosin triphospate) dibutuhkan untuk reduksi N2 invitro. ADP (Adenosin
diphosphate) yang dihasilkan akan menghambat aktivitas Nitrogenase, oleh karenanya sistem ini harus menggunakan fosforilasi ADP ke ATP ). Dengan kondisi demikian, Nitrogenase mengkatalisis reduksi N2 (N≡N) ke NH3 dan juga asetilen (CH≡CH) dan
H2 (aktivitas hidrogenase). Nitrogenase dalam bakteroid Rhizobium hanya berfungsi
pada kondisi relatif tanpa oksigen, tetapi reduksi yang setara dengan yang dibutuhkan untuk reduksi N2 dibentuk dari oksidasi aerob terhadap sumber karbon dalam
bakteroid. Pengendalian masuknya oksigen untuk respirasi dicapai dengan adanya protein pembawa O2, leghemoglobin yang memiliki afinitas tinggi terhadap O2, yang
menyediakan bakteroid dengan O2 dan dalam bentuk yang dapat melindungi
Nitrogenase dari kerusakan.
Bintil akar pada tanaman legum berwarna kemerahan seperti haemoglobin. Warna merah pada bintil akar disebabkan oleh adanya pigmen yang disebut Leghemoglobin (LHb) yang mengandung besi. Leghemoglobin hanya ditemukan pada bintil akar yang sehat, sedangkan tanaman yang tidak sehat mempunyai bintil akar berwarna putih karena tidak mempunyai LHb sehingga penambatan nitrogen tidak dapat terjadi pada bintil akar yang tidak sehat semacam itu. LHb berada diluar membran bakteroid. Penelitian menunjukkan bahwa membran bakteroid berperan dalam memisahkan bakteroid dari sistem penyangga oksigen. Konsentrasi LHb dapat digunakan untuk memperkirakan efisiensi bintil akar dalam penambatan nitrogen (N2
(Yuwono. T, 2006) ).
Dalam proses fiksasi nitrogen, baik nitrogenase (protein Mo-Fe) maupun nitrogenase reduktase (protein Fe) bersifat esensial dalam penambatan nitrogen. Protein Fe berintekrasi dengan Mg++sedangkan protein Mo-Fe mengkatalisis reduksi N2 menjadi NH3, H+ menjadi H2 dan mengubah asitetilen menjadi etilen. Selama
penambatan nitrogen, sumber reduktan untuk transfer electron berasal dari ferredoxin atau flavodoxin yang tereduksi. Ferrodoxin yang tereduksi memberikan electron ke frotein Fe sehingga mereduksi protein Mo-Fe dan diikuti oleh pelepasan phosphat anorganik (Pi). kompleks enzim nitrogenase memperoleh energi dari ATP yang
dihasilkan pada saat terjadi proses respirasi. Akhirnya, protein Mo-Fe memberikan electron ke substrat yang dapat direduksi, misalnya N2. Secara umum reaksi
Mg N
++
2 + 16 ATP + 8e- + 10 H+ 2 NH4+ + H2+ + 16 ADP + 16 Pi
Ammonia adalah produk stabil pertama pada proses fiksasi nitrogen. Setelah terbentuk, ammonia kemudian ditransfer melalui membran bakteroid ke sel tanaman yang selanjutnya akan digunakan dalam metabolisme tanaman. (Yuwono. T, 2006)
2.5. Pupuk Hayati
Nama lain pupuk hayati adalah biofertilizer. Ada yang juga menyebutnya pupuk bio. Apapun namanya pupuk hayati bisa diartikan sebagai pupuk yang hidup. Sebenarnya nama pupuk kurang cocok, karena pupuk hayati tidak mengandung hara. Pupuk hayati tidak mengandung N, P, dan K. Kandungan pupuk hayati adalah mikrooganisme yang memiliki peranan positif bagi tanaman. Kelompok mikroba yang sering digunakan adalah mikroba-mikroba yang menambat N dari udara, mikroba yang malarutkan hara (terutama P dan K), mikroba-mikroba yang merangsang pertumbuhan tanaman.
Istilah pupuk hayati lebih tepat disebut sebagai inokulan mikrobia, seperti yang dikemukan oleh Rao (1982). Meskipun demikian istilah pupuk hayati sudah lebih dikenal dan sebagai alternatif bagi pupuk kimia buatan (artifical Chemical fertilizer). Mikrobia yang umum digunakan untuk membuat formulasi suatu pupuk hayati adalah kelompok bakteri atau jamur. (Yuwono.T, 2006).
Kelompok mikroba penambat N sudah dikenal dan digunakan sejak lama. Mikroba penambat N ada yang bersimbiosis dengan tanaman dan ada juga yang bebas (tidak bersimbiosis). Contoh mikroba yang bersimbiosis dengan tanaman antara lain adalah Rhizobium sp. Sedangkan contoh mikroba penambat N yang tidak bersimbiosis
adalah Azosprillium sp dan Azotobacter sp
umumnya diperoleh dari alam tanpa ada penambahan kimia, kecuali bahan kimia yang diperlukan untuk mendukung pertumbuhan jasad hidupnya selama dalam penyimpanan. Dalam formulasi pupuk hayati, seringkali bahkan tidak diperlukan bahan – bahan kimia buatan karena bahan – bahan tersebut dapat diganti dengan bahan alami misalnya gambut, kapur alam. Pupuk hayati mempunyai kelebihan dibanding dengan pupuk kimia buatan karena bahan – bahannya berasal dari alam sehingga tidak menimbulkan persoalan pencemaran lingkungan seperti halnya dengan pupuk kimia buatan. (Yuwono.T, 2006).
2.5.1 Jenis – jenis pupuk Hayati
Legin adalah pupuk nitrogen hayati kualitas tinggi, yang berbentuk powder / bubuk yang mengandung bakteri Rhizobium 10.000.000 – 1.000.000.000 sel per gram untuk menginokulasi (menulari) tanaman kacang tanah (Arachis hypogaea) dan Kedelai (Glicine Max). Masa Laku 6 bulan setelah diproduksi. Kemasan dalam polycellonium /aluminium foil berat bersih 30 g (untuk kedelai) dan 150 g (untuk Kacang Tanah)
Bio – Lestari satu kantong standar berisi 40 g untuk pertanaman 2000 m2 atau 200 g/ha. Pupuk ini mengandung populasi sel bakteri penambat N2 non-simbiotik
Rhizobium , dan fungi pelarut fosfat propagul per g bahan pembawa.Penggunaanya Jangan tercampur dengan pupuk kimia. Pada lahan masam diperlukan pengapuran secukupnya sampai pH 5,5 .Penyimpanan Bio-lestari harus di bawah suhu <200C dan jauh dari sinar .Jangan digunakan lagi bila melebihi masa kadaluwarsa. Rhizoplus satu kantong standard berisi 30 g untuk 2000 m2
Manfaat dan Keunggulan pupuk hayati
, untuk 1 ha diperlukan 5 kantong standard.
• Merangsang aktivitas mikroba rizosfer • Memperlebat dan memperkuat perakaran • Memperkokoh dan memperkuat tanaman
• Efektif untuk kacang tanah, kedelai, dan sengon • Tidak mudah terkontaminasi dengan mikroba lain
Keuntungan pupuk hayati
• Menghemat pemakaian pupuk • Menghemat pestisida
• Tidak merusak tanah dan aman lingkunga
2. 6 Teknik dasar pembuatan pupuk hayati
Mikrobia yang akan dikemas sebagai pupuk hayati terlebih dahulu harus ditumbuhkan dalam medium yang sesuai sehingga dapat dihasilkan jumlah sel yang tinggi. Kebutuhan nutrisi dalam medium perbanyakan sel bervariasi dengan macam mikroba yang digunkan. Oleh karena itu setiap spesies mikrobia memerlukan medium dengan komposisi yang spesifik, meskipun beberapa kelompok mikrobia yang berbeda dapat ditumbuhkan dalam medium yang sama. Oleh karena itu jika pupuk hayati dibuat dengan menggunkanan campuran mikroba yang berbeda, maka sebaiknya masing – masing mikrobia ditumbuhkan secara terpisah dalam medium yang paling Sesuai. Secara umum produksi inokulan yang akan digunakan sebagai pupuk hayati meliputi beberapa tahapan, yaitu :
1. Isolasi dan skrining mikrobia yang akan digunakan sebagai pupuk hayati 2. Perbanyakan mikrobia dalam medium yang sesuai.
3. Pencampuran dengan bahan pembawa (carrier) 4. Pengemasan (Yuwono. T, 2006).
2.7 Tekhnik kultivasi dan perbanyakan Rhizobium
Rhizobium pada umumnya dipelihara dengan menumbuhkan dalam medium padat Yeast Extract Manitol Agar (YEMA). Untuk menjaga kemampuan fisiologisnya agar tidak mengalami penurunan, maka Rhizobium harus diremakajan secara berkala. Kultur yang dipelihara inilah yang digunakan sebagai kultur induk yang digunakan sebagai inokulum untuk perbanyakan yang akan diformulasi sebagai pupuk hayati. Komposisi medium Yeast Extract Manitol Agar (YEMA) yang umum digunakan untuk pemeliharaan Rhizobium adalah sebagai berikut :
Tabel 2.7. Komposisi Medium Yeast Extrak Manitol Agar (YEMA)
Selain medium dengan komposisi seperti diatas, beberapa peneliti atau produsen inokulan Rhizobium menggunakan medium dengan komposisi yang bervariasi . perbanyakan medium dilakukan dengan menumbuhkan bakteri dalam medium cair dalam skala volume yang disesuikan dengan kapasitas produksi inokulan.
Perkembangbiakan dilakukan dengan menggunakan fermentor besar dengan ragam alat pengaturan, misalnya pH, oksigen terlarut, suhu dan shaker (penggojok). Selai itu perbanyakan dapat juga dilakukan dengan menggunkan fermentor yang lebih sederhana yaitu menggunakan tabung erlenmeyer meskipun tanpa peralatan khusus. Jika perbanyakan dilakukan dengan menggunakan tabung erlenmeyer, maka harus dilakukan penggojokan dengan alat penggojok (shaker) secara teratur yang dapat diatur kecepatannya. Medium yang digunakan untuk perbanyakan sama dengan yang digunakan untuk pemeliharaan kultur tetapi tanpa menggunkan agar. Meskipun medium cair dengan komposisi seperti diatas sudah cukup untuk perbanyakan Rhizobium, namun pengalaman menunjukkan bahwa penggunaan medium biphasik dapat menghasilkan biomassa sel yang lebih banyak. Medium biphasik adalah medium yang terdiri dari atas dua fase yaitu medium fase padat (medium yang ditambah dengan agar) yang ada dibagian bawah tabung erlenmeyer. Diatas medium padat lalu dituangkan medium fase cair dengan komposisi cair dengan komposisi sama dengan medium padat tetapi tanpa agar.
Kultur cair Rhizobium yang sudah dibuat selanjutnya dicampur dengan bahan pembawa (carrier material). Bahan pembawa yang dapat digunakan untuk Rhizobium ada beberapa macam, namun idealnya dengan karakteristik :
1. Mempunyai kemampuan menahan air yang tinggi 2. Tidak toksik terhadap mikroba
3. Mendukung pertumbuhan mikroba
4. Secara umum steril atau mudah disterilkan 5. Bahan mudah diperoleh dengan harga murah 6. Mempunyai daya lekat terhadap benih
10.Mudah dicampur dan dikemas.
Beberapa bahan pembawa yang dapat diguanakan untuk formulasi inokulan rhizobia antara lain gambut, lignit, arang, zeolit dan lain – lain. Setelah dicampur dengan bahan pembawa, campuran Rhizobium dengan bahan pembawa tersebut kemudian dikemas. Inokulan yang sudah dikemas selanjutnya dapat dibawa ketempat penggunaan atau dipasarkan (Yuwono. T, 2006).
2.8 Uji Untuk membedakan Rhizobium dari kerabat dekatnya Agrobaktesrium
Mungkin terlihat bahwa beberapa galur Rhizobium yang keefektifannya berbeda – beda, yang seringkali berkaitan dengan genus kerabatnya Agrobakterium, dipisahkan dari tanaman yang sama. Jelas sekali bahwa pemisahan lebih lanjut isolat semacam itu menjadi langkah penting.
Medium Congo Merah ; telah diketahui bahwa pada medium agar yang dibubuhi congo merah (2,5 ml dari larutan 1 % per liter agar manitol berekstrak khamir), rhizobia akan membentuk koloni yang putih bening, berkilauan , menonjol dan lebih kecil dengan tepi keseluruhan utuh yang berbeda denagan koloni Agrobakterium yang berwarna merah (Rao, N.S., Subba, 1994).
2.9. Bentonit
Bentonit merupakan salah satu jenis lempung yang banyak terdapat dibeberapa wilayah di Indonesia, diantaranya terdapat di sebahagaian besar daerah Nusa Tenggara, Sulawesi, Jawa Barat, Jawa Tengah, Yogyakarta, Jawa Timur, Sumatera Selatan, Jambi dan Sumatera Utara. Di Sumatera Utara bentonit ini banyak ditemui di daerah Pangkalan Berandan, Kab. Simalungun, Kab. Karo dan sekitarnya. Bentonit adalah sejenis lempung yang mengandung mineral montmorilonit yang bersifat plastik. Rumus umum bentonit adalah Al2O34SiO2.H2O. Bentonit dikenal ada dua
bumi, gas alam, dan uap panas bumi dan dapat digunakan pada minyak kelapa sawit, industri kimia farmasi (Soedjoko, 1987).
Jenis kalsium – magnesium pada industri penyaringan lilin, minyak kelapa, industri besi baja yaitu sebagai perekat pasir cetak dalam proses pengecoran baja, industri kimia sebagai katalisator, zat pemutih, zat penyerap, pengisi, lateks dan tinta cetak (Soedjoko, 1987).
Berdasarkan hasil uji laboratorium, analisa terhadap contoh bentonit yang diambil langsung di lapangan, maka diperoleh komposisi bentonit adalah Kalsium oksida (CaO) 0,23 %, Magnesium Oksida (MgO) 0.98 %, Alumunium Oksida (Al2O3) 13,45 %, Ferri Oksida (Fe2O3) 2,18 %, Slika (SiO2) 74,9 %, K2O 1,72 %g.
H2O 4 % (Proyek Kerja Dinas Pertambangan Sumatera Utara, 1999/2000).
Pemakaian bentonit terutama untuk kebutuhan industri perminyakan sebagai lumpur pemboran dan industri makanan ternak dan pupuk, semakin besar luas permukaannya maka makin besar pula zat – zat yang terbawa atau melekat pada bentonit. Sehingga sifat ini dimanfaatkan sebagai bahan pembawa (Carrier) (Soedjoko, 1987).
Selain bahan pembawa utama, biasanya juga ditambahkan beberapa bahan lain, misalnya kapur dan lempung yang fungsinya antara lain untuk megatur pH-nya supaya sesuai dengan pH yang dibutuhkan oleh Rhizobia serta untuk memperoleh tekstur bahan inokulan yang baik , mudah dikemas dan digunakan (Yuwono. T, 2006).
2.10. Aktivitas air (Aw)
Aktivitas air adalah kebutuhan air untuk pertumbuhan mikroorganisme atau aktivitas kimia air. Bakteri termasuk jenis bakteri yang tumbuh dengan cepat apabila keadaan sekitarnya memungkinkan. Masing – masing jenis mikroorganisme membutuhkan jumlah air yang berbeda untuk pertumbuhannya. Kebanyakan bakteri nonhalofilik mempunyai tingkat pertumbuhan maksimum pada kisaran nilai Aw 0,980 - 0,997,
bakteri halofilik masih dapat tumbuh pada nilai Aw
Organisme
0,750. Aktivitas air minimal beberapa jenis mikroorganisme tertentu:
Aw minimal
Sebagian besar bakteri 0,90
Sebgaian besar jamur 0,80
Khamir Osmofilik 0,60
(Purnomo ,H. 1995). BAB 3
BAHAN DAN METODE PENELITIAN
3.1. Bahan-bahan
1. Bintil akar putri malu
2. Media Yeast Ekstrak Manitol Agar (YEMA) steril 3. Bentonit
4. Akuades 5. Akuades steril 6. Larutan Klorok
7. Congo Red p.a.(E.Merck)
8. Safranin p.a.(E.Merck)
9. Iodine
10.Kristal Violet p.a.(E.Merck)
p.a.(E.Merck)
11.Aseton alkohol p.a.(E.Merck)
12. Alkohol 96% Teknis
3.2. Alat-alat
1. Cawan Petri Pyrex
2. Tabung reaksi Pyrex
3. Pipet volume Pyrex
4. Labu Takar Pyrex
5. Gelas ukur Pyrex
6. Gelas Beaker Pyrex
7. Gelas Erlenmeyer Pyrex
9. Oven Gallenkamp
10.Autoclave Webeco
11.Incubator Fischer scientific
12.Mikroskop Prior England
13.Neraca analitik Ohaus
14.Water bath Griffin
15.Shaker Julabo SW 22
16.Bunsen 17.Jarum ose
18.Gelas objek dan Cover 19.Spatula
20.Pipet Tetes 21.Batang Pengaduk 22.Plastik tahan panas 23.Alumunium foil 24.Hockey Stick
3.3. Prosedur
3.3.1 Pengambilan Sampel
Sampel yang digunakan adalah Rhizobium dari tanaman Putri malu, yang memiliki bintil akar. Putri malu diambil dari lapangan terbuka. Pengambilan sampel dilakukan dengan mencabut putri malu yang akarnya berbintil lalu dikumpulkan. Putri malu yang diperoleh dibawa ke laboratorium Biokimia FMIPA USU.
3.3.2. Isolasi Rhizobium dari bintil akar
10 detik dan dibilas dengan akuades selama 2 menit. Kemudian bintil akar yang steril tersebut digiling.
3.3.2.1. Identifikasi Rhizobium dengan Congo Red
Diambil kembali 1 - 2 ose dari suspensi yang sebelumnya telah diperoleh kemudian digoreskan pada medium YEMA steril + congo Red yang telah disiapkan. Lalu diinkubasikan pada suhu 370C selama 24 – 48 jam. Sehingga dipastikan bakteri yang tumbuh semua berwarna putih. Pertumbuhan Rhizobium diamati dengan memperhatikan bentuk dan sifat – sifatnya. Pada umumnya koloninya putih transparan, flat dan sedikit berlendir
3.3.3. Pembuatan Pembiakan Murni
Bakteri yang diperoleh ditumbuhkan kembali pada medium YEMA steril dengan menggunakan metode garis sinambung, lalu diinkubasi pada suhu 37oC selama 24 – 48 jam. Tujuannya yaitu untuk memperoleh biakan murni dari bakteri Rhizobium.
3.3.3.1. Pengidentifikasian Bakteri
Plat kaca/gelas objek disterilkan terlebih dahulu dengan alkohol. Kemudian diambil satu ose biakan murni dari media diletakkan di atas plat kaca. Diteteskan akuades sebanyak 2 tetes lalu difiksasi sampai kering. Plat kaca kemudian ditetesi dengan larutan kristal violet dan diamkan selama ± 30 detik, lalu dicuci dengan akuades. Ditetesi kembali dengan larutan iodin dan didiamkan selama ± 30 detik, lalu dicuci dengan akuades. Kemudian ditetesi dengan larutan aseton alkohol dan didiamkan selama 30 ± detik, dicuci dengan akuades. Lalu ditetesi kembali dengan larutan safranin dan diamkan selama ± 30 detik, dicuci dengan akuades. Dibiarkan mengering lalu diamati di bawah mikroskop.
Biakan murni Rhizobium yang ditumbuhkan kembali pada YEMA steril kemudian diambil 1 sampai 2 ose dan dicampur dengan 100 ml Yeast Manitol Broth (YMB) dalam tabung erlenmeyer dikocok dengan alat penggojok (Shaker) selama 9 hari hingga diperoleh starter kultur.
3.3.5. Pencampuran Starter Dengan Medium Pembawa
Bentonit sebagai medium pembawa sebelumnya harus disterilkan terlebih dahulu. Sterilisasi dilakukan pada suhu 1210C dan pada tekanan 15 psi selama 2 x 30 menit. Medium yang sudah disterilisasi dibagi dalam suatu wadah plastik dengan pembagian:
1. Wadah I : 5 g bentonit ditambahkan dengan 10 ml starter 2. Wadah II : 5 g bentonit ditambahkan dengan 15 ml starter 3. Wadah III : 5 g bentonit ditambahkan dengan 20 ml starter 4. Wadah IV : 5 g bentonit ditambahkan dengan 25 ml starter 5. Wadah V : 5 g bentonit ditambahkan dengan 30 ml starter
Sehingga memiliki perbandingan 1:2, 1:3, 1:4, 1:5, 1:6. Kemudian dicampur sampai merata kedalam media pembawa dan diletakkan pada suhu kamar atau 270C.
3.3.6. Pengujian Jumlah Sel dari Media Pembawa
Masing – masing wadah dengan perbandingan 1:2, 1:3, 1:4, 1:5, 1:6 ditimbang sebanyak 1 g dan dimasukkan dalam tabung reaksi yang berbeda, kemudian ditambahkan dengan 10 ml akuadest steril. Dikocok sampai homogen dengan menggunakan vortex lalu didiamkan selama 30 detik sampai 1 menit atau sampai partikel tanah mengendap. Dipipet sebanyak 1ml dengan menggunakan pipet volume kemudian dimasukkan kedalam tabung reaksi, lalu divortex (pengenceran 10-2). Dilakukan hal yang sama sampai pengenceran 10-9. suspensi diambil sebanyak 0,25 ml dan disebarkan pada medium YEMA + Congo Red dalam cawan Petri dengan menggunakan metode cawan sebar. Kemudian diinkubasi pada suhu 370C selama 24 - 48 jam. Isolasi Rhizobium dari media pembawa dilakukan dari minggu 1 sampai minggu ke 5.
Pupuk hayati yang diperoleh kemudian diaplikasikan dalam bentuk tabur ke dalam masing-masing pot tanaman kacang hijau . Diukur lebar daun, Panjang Daun dan luas daun dari minggu 1 sampai minggu ke 4.
3.3.8. Penentuan Aktivitas air (Aw) pupuk hayati
Disaring
Dibilas dengan akuades steril selama 2 menit
Dibilas dengan akuades steril selama 2 menit
Diinokulasi 1 - 2 ose pada media YEMA + Congo Red pada cawan petri
Diinkubasi pada suhu 37oC selama 24-48 jam
Koloni berwarna putih
Diinokulasi pada media Yeast Manitol Broth (YMB) lalu dishaker pada temperatur kamar selama 9 hari
Didapat perbandingan 1:2, 1:3, 1:4, 1:5, 1:6 Suspensi bintil akar tanaman
putri malu
Biakan Murni Rhizobium
Dicuci dengan akuades steril
Disemprot dengan alkohol 96% selama 10 detik
Bentonit ditimbang sebanyak 30 g
Disterilkan di dalam autoclave pada suhu 1210C dan tekanan 15 psi selama 2x30 menit
Ditimbang sebanyak 5 g bentonit kedalam 5 wadah yang berbeda Bintil akar tanaman
putri malu
Disemprot dengan larutan klorok selama 10 detik 3.4 Bagan penelitian
3.4.1. Bagan Penelitian Isolasi Bakteri Rhizobium Metode Dubey, 2006
3.4.1.1 Isolasi Rhizobium dari akar tanaman Putri malu
Wadah I 5g bentonit +
10 ml starter
Digiling
Ditanam ulang untuk mendapatkan biakan murni
Bentonit steril
Dimasukkan kedalam masing-masing 5 tabung reaksi
Ditambahkan 10 ml akuades steril
Filtrat Rhizobium Endapan bentonit
Dipipet sebanyak 1 ml
Filtrat
Diambil sebanyak 0,25 ml
Dihitung jumlah sel pada media pembawa dari minggu 1 sampai minggu ke 5
Suspensi Rhizobium
Ditimbang sebanyak 1 g
Didiamkan selama 1 menit
Dimasukkan kedalam tabung reaksi
Dilakukan pengenceran 10-2 – 10-9 dengan cara divorteks
Disebarkan pada media YEMA + Congo Red dalam cawan petri Rhizobium pada bentonit 3.4.1.2.Perhitungan Jumlah Sel Pada Bahan Pembawa (Carrier)
3.4.1.3. Uji Aplikasi lapangan
Pupuk Hayati
Diukur panjang daun, lebar daun dan luas daun Selama 4 minggu
Tanaman Kacang Hijau
BAB 4
HASIL DAN PEMBAHASAN
4.1. Hasil Penelitian
Dari hasil penelitian pupuk hayati dan pengaplikasian pada tanaman kacang hijau yang dilakukan, diperoleh hasil bahwa pertumbuhan kacang hijau dengan penambahan starter kultur dan bentonit 1:6 memperlihatkan hasil yang paling baik dibandingkan dengan perbandingan 1:2, 1:3, 1:4, 1:5, dan blanko. Hal ini dapat dilihat dari table berikut ini :
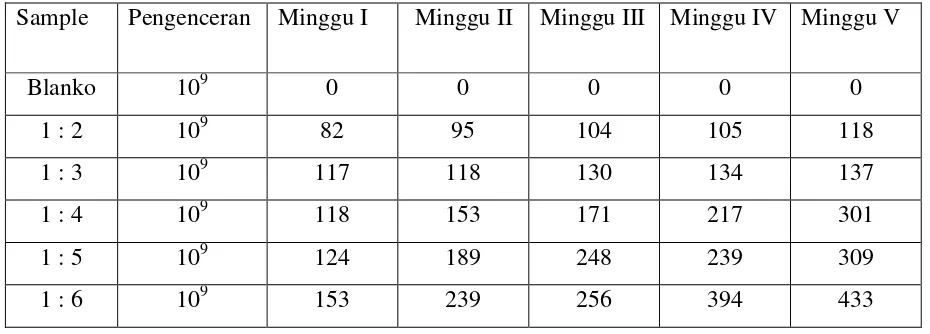
Tabel 4.1. Data perhitungan jumlah koloni bakteri Rhizobium
Sample Pengenceran Minggu I Minggu II Minggu III Minggu IV Minggu V
Blanko 109 0 0 0 0 0
1 : 2 109 82 95 104 105 118
1 : 3 109 117 118 130 134 137
1 : 4 109 118 153 171 217 301
1 : 5 109 124 189 248 239 309
1 : 6 109 153 239 256 394 433
Table 4.2. Data Perhitungan jumlah total koloni Rhizobium
Sampel Pengenceran Minggu I Minggu II Minggu III Minggu IV MInggu V
Blanko 109 0 0 0 0 0
Table 4.3. Data hasil pertambahan luas daun tanaman kacang hijau per minggu
4.1.1 Perhitungan Jumlah Total Sel Rhizobium
a = Rata – rata jumlah koloni per Petri agar
df = Faktor pengenceran
V = Volume suspensi biakan yang disebarkan
4.2. Perhitungan luas daun
LD = xnx r2
BDS BDT π
Dimana BDT = Berat daun total
BDS = Berat daun sampel
= 14,70 cm2 (Data lengkapnya di lampiran
3).
4.2.1 Perhitungan aktivitas air (Aw
A
2 = berat sampel yang dilarutkan
Perbandingan 1 : 2
4.3. Pembahasan
Menurut Lay, B.,W, 1994 dalam Lubis, Khairina, 2007, perhitungan jumlah sel
dilakukan dengan cara standart plate count. Didasarkan pada asumsi bahwa
setiap sel mikroorganisme hidup dalam suspensbiakan tumbuh menjadi 1 koloni setelah diinkubasikan dalam media biakan dan lingkungan yang sesuai. Setelah masa inkubasi, jumlah koloni yang tumbuh dihitung dan merupakan perkiraan atau dugaan dari jumlah mikroorganisme dalam suspensi tersebut. Koloni yang tumbuh tidak selalu berasal dari satu sel mikroorganisme, karena beberapa mikroorganisme tertentu cenderung untuk berkelompok. Bila ditumbuhkan pada media dan lingkungan kelompok bakteri ini hanya akan menghasilkan 1 koloni. Berdasarkan hal tersebut seringkali digunakan istilah colony forming (CFU/ml) untuk penghitungan jumlah mikroorganisme hidup.
Dari hasil penelitian yang dilakukan diperoleh jumlah koloni bakteri Rhizobium
Sampel Pengenceran Minggu I Minggu II Minggu III Minggu IV MInggu V
Blanko 109 0 0 0 0 0
1 : 2 109 328 x 109 380 x 109 416 x 109 420 x 109 472 x 109 1 : 3 109 468 x 109 472 x 109 520 x 109 536 x 109 548 x 109 1 : 4 109 472 x 109 612 x 109 684 x 109 868 x 109 1204 x 109 1 : 5 109 496 x 109 756 x 109 992 x 109 956 x 109 1236 x 109 1 : 6 109 612 x 109 956 x 109 1024 x 109 1576 x 109 1732 x 109
langsung. Pupuk hayati yang lazim digunakan seperti Legin, Bio-lestari, Rhizoplus mempunyai jumlah sel Rhizobium 10.000.000 – 1.000.000.000, dengan masa simpan 6 bulan, disimpan dibawah suhu 20 dalam kantong polycellonium/alumunium foil, dalam satu kantong berisi 30 g – 40 g untuk 2000 m2, untuk 1 ha diperlukan 5 kantong standard dan digunakan untuk tanman kacang – kacangan. Isolasi bakteri Rhizobium dari bintil akar tanaman putri malu dengan menggunakan carrier bentonit dapat memenuhi standard sebagai pupuk hayati yang lazim digunakan dipasaran dilihat dari jumlah koloni, dan cara penyimpanannya dan pengaplikasiannya di lapangan
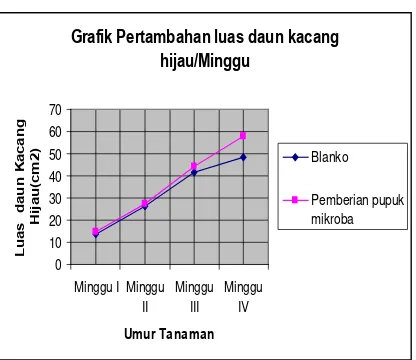
Hasil rata-rata pengujian aplikasi lapangan selama empat minggu pada tanaman kacang hijau yang diberi pupuk hayati dan tanpa pemberian pupuk (blanko).
Perlakuan Pupuk Hayati Blanko
Minggu I Lebar daun (cm) 2.28 2.06
Menurut Dinas Pertambangan Sumatera Utara, 1999/2000, bentonit mempunyai komposisi SiO2 74,9 %, Al2O3 13,45 %, Fe2O3 2,18 %, MgO 0.98 -%, CaO 0,23 %,
H2O 4 %, K2O 1,72 %. Menurut Soedjoko (1987) Semakin besar luas permukaan
bentonit maka semakin besar pula zat – zat yang terbawa atau melekat pada bentonit sehingga sifat ini dimanfaatkan sebagai bahan pembawa (carier). Bentonit juga mudah menyerap air dan melakukan pertukaran ion dan berfungsi untuk mengatur pH-nya supaya sesuai dengan pH yang dibutuhkan rhizobia serta untuk memperoleh tekstur bahan inokulan yang baik dan mudah dikemas serta digunakan dan dapat mempertahankan viabilitas dan efektifitas mikroba.
Dari hasil pengujian aktivitas air (Aw) yang dilakukan, diperoleh hasil 1 : 2
memiliki Aw = 0,793, 1 : 3 memilki Aw = 0,838, 1 : 4 memiliki Aw = 0,866, 1 : 5
memiliki Aw = 0,884, 1 : 6 memilki Aw = 0,899. Menurut Purnomo, Hari, 1995,
bakteri Rhizobium dapat tumbuh pada nilai Aw
Umumnya bahan pembawa yang sering digunakan adalah bahan – bahan organik, mineral dan liat. Bahan organik bisa tepung – tepungan, terigu, tapioka, maizena, sagu, kompos, gambut . Bahan mineral biasanya zeolit, gypsum, bentonit, kapur dan lainnya. Ada juga yang menggunakan tanah liat tertentu. Bahan – bahan ini bisa tunggal atau bisa juga merupakan campuran bahan-bahan. Ada juga memberikan tambahan nutrisi pada bahan pembawa tersebut
0,750 – 0,900.
BAB 5
KESIMPULAN DAN SARAN
5.1. Kesimpulan
Dari hasil penelitian tentang bentonit sebagai media pembawa bakteri Rhizobium dan hasil aplikasinya pada tanaman kacang hijau, dapat diambil kesimpulan sebagai berikut :
1. Biakan murnini Rhizobium dapat diperoleh dengan cara mengisolasi bakteri Rhizobium pada media selektif yaitu dengan menggunakan media Yeast Ekstrak Manitol Agar (YEMA) steril dan pengujiannya dilakukan dengan penambahan congo red, kemudian dilakukan perbanyakan atau penanaman kembali.
2. Hasil pengujian lapangan pada tanaman kacang hijau selama empat minggu menunjukkan, tanaman kacang hijau yang diberi pupuk hayati dengan variasi konsentrasi antara Rhizobium hasil isolasi dengan bentonit yang digunakan sebagai carrier untuk perbandingan 1 : 6 memiliki rata-rata lebar daun 7,25 cm, panjang daun 10,18 cm, luas daun 56,45 cm2 sedangkan tanaman blanko Memiliki rata – rata lebar daun 5,73 cm, panjang daun 8,23 cm, luas daun 47,21 cm2
3. Bentonit dapat digunakan sebagai media pembawa, karena memenuhi standart sebagai pupuk hayati seperti tercantum pada Rao, Subba, N.S yaitu mempunyai jumlah sel 10
. Hal ini disebabkan karena pada perbandingan 1 : 6 merupakan kemampuan optimum media untuk menampung bakteri.
8
-109 5.2. Saran
sel hidup/g.
1. Disarankan untuk penelitian selanjutnya menggunakan rumah kaca untuk aplikasi lapangan supaya hasil yang diperoleh lebih bagus karena tidak ada gangguan dari jenis bakteri – bakteri lain yang mampu memfiksasi nitrogen dari udara.
DAFTAR PUSTAKA
Budiyanto, A. K.2002. Mikrobiologi Terapan.Surabaya. Universitas Muhammadiyah Malang - Press
Dalimartha, S. 2003. Atlas Tumbuhan Obat Indonesia. Jakarta.Trubus Agriwidya.
Dinas Kehutanan Tkt II. 2005. Kab. Karo.
Dinas Pertambangan Sumatera Utara. 2000/2001. Proyek Kerja
Dinas Perekonomian Tkt. II. 2006. Kab Karo.
Dubey, R. C. 2006. A Text Book of Biotechnology. New Delhi: S. Chand & Company Ltd. AN ISO 9001 : 2000 Company
Fahn, A. 1991. Anatomi Tumbuhan. Edisi Ketiga . Yogyakarta: Gadjah Mada University Press.
Fauzi, R. Kusuma, B. Muhammad Zaky. 2005. Tumbuhan Liar Berkhasiat Obat. Jakarta: Agro Media Pustaka.
Ismawati, E. 2004. Pupuk Organik. Jakarta. Penebar Swadaya.
Lingga, P. 2004. Petunjuk Penggunaan Pupuk. Jakarta. Penebar Swadaya.
Lubis, Khairina.,Surbakti R.,Sebayang F. 2007. Studi Pendahuluan Isolasi Bakteri Rhizobium Dari Bintil Akar Tanaman Putri Malu (Mimmosa Pudica L.) Serta Pemanfaatannya Sebagai Pupuk Mikroba.
Marx, J.L. 1991. Revolusi Bioteknologi. Jakarta. Yayasan Obor Indonesia.
Motsara, MR and Bisoyi, RN. 2001. Corp. Demonstration on Biofertilizer. New Delhi. N.B.D Center Ghaziabad.
Novizan. 2002. Petunjuk Pemukuan yang efektif. Jakarta. Agro Media Pustaka.
Purnomo, Hari, 1995. Aktivitas Air dan Peranannya Dalam Pengawetan Pangan. Jakarta: Penerbit Universitas Indonesia (UI-Press).
Rahmawati.N 2005. Pemanfaatan Biofertilizer Pada Pertanian Organik. USU Repository.
Rao, S. 1994. Mikroorganisme Tanah dan Pertumbuhan Tanaman. Edisi II. Jakarta. UI – Press.
Sarma, OP. 2002. Plant Taxonomy. New Delhi tata MC Grow – Hill Publishing Company Limited.
Sitompul. SM., B.Guritno. 1995. Analisis Pertumbuhan tanaman. Cetakan pertama. Gajdah Mada University Press.
Soedjoko, TS.,Bobby. Adrianto.1987. Penelitian Pemanfaatan Bentonit Indonesia. Buletin PPTM Vol 9, No.2
Sutedjo, M. M. 1991. Mikrobiologi Tanah. Jakarta. PT Rieka Cipta.
Sutanto, R. 2002. Penerapan Pertanian Organik (Pemasyarakatan dan pengembangannya). Jakarta. Penerbit Kanisius.
Tabel 4.1. Data perhitungan jumlah koloni bakteri Rhizobium
Sample Pengenceran Minggu I Minggu II Minggu III MInggu IV Minggu V
Blanko 109 0 0 0 0 0
1 : 2 109 82 95 104 105 118
1 : 3 109 117 118 130 134 137
1 : 4 109 118 153 171 217 301
1 : 5 109 124 189 248 239 309
1 : 6 109 153 239 256 394 433
Table 4.2. Data Perhitungan jumlah total sel Rhizobium
Sampel Pengenceran Minggu I Minggu II Minggu III Minggu IV MInggu V
Blanko 109 0 0 0 0 0
1 : 2 109 328 x 109 380 x 109 416 x 109 420 x 109 472 x 109 1 : 3 109 468x 109 472 x 109 520 x 109 536 x 109 548 x 109 1 : 4 109 472 x 109 612 x 109 684 x 109 868 x 109 1204 x 109 1 : 5 109 496 x 109 756 x 109 992 x 109 956 x 109 1236 x 109 1 : 6 109 612 x 109 956 x 109 1024 x 109 1576 x 109 1732 x 109
Tabel Kadar Aw
Perbandingan
pada bentonit yang dicampur dengan Starter
Berat sampel Berat kadar air Aw
1 : 2 15,814 4,120 0,793
1 : 4 26,628 4,109 0,866
1 : 5 32,031 4,163 0,884
1 : 6 37,444 4,165 0,889
GAMBAR TANAMAN KACANG HIJAU MINGGU III
Gambar Tanaman Kacang Hijau Minggu I Perbandingan 1:2, 1:3, 1:4,1:5, 1:6, dan Blanko
Gambar Tanaman Kacang Hijau Minggu II Perbandingan 1:2, 1:3, 1:4,1:5, 1:6, dan Blanko
Gambar Tanaman Kacang Hijau Minggu IV Perbandingan 1:2, 1:3, 1:4,1:5, 1:6, dan Blanko
GAMBAR TANAMAN KACANG HIJAU MINGGU IV
Gambar Tanaman Kacang Hijau Minggu I Perbandingan 1:2, 1:3, 1:4,1:5, 1:6, dan Blanko
Gambar Tanaman Kacang Hijau Minggu III Pengenceran 1:2, 1:3, 1:4,1:5, 1:6, dan Blanko
GAMBAR TANAMAN KACANG HIJAU MINGGU I
Gambar Tanaman Kacang Hijau Minggu I Perbandingan 1:2, 1:3, 1:4,1:5, 1:6, dan Blanko
Gambar Tanaman Kacang Hijau Minggu II Perbandingan 1:2, 1:3, 1:4,1:5, 1:6, dan Blanko
Gambar Tanaman Kacang Hijau Minggu IV Perbandingan 1:2, 1:3, 1:4,1:5, 1:6, dan Blanko
GAMBAR TANAMAN KACANG HIJAU MINGGU II
Gambar Tanaman Kacang Hijau Minggu I Perbandingan 1:2, 1:3, 1:4,1:5, 1:6, dan Blanko
Gambar Tanaman Kacang Hijau Minggu III Perbandingan 1:2, 1:3, 1:4,1:5, 1:6, dan Blanko
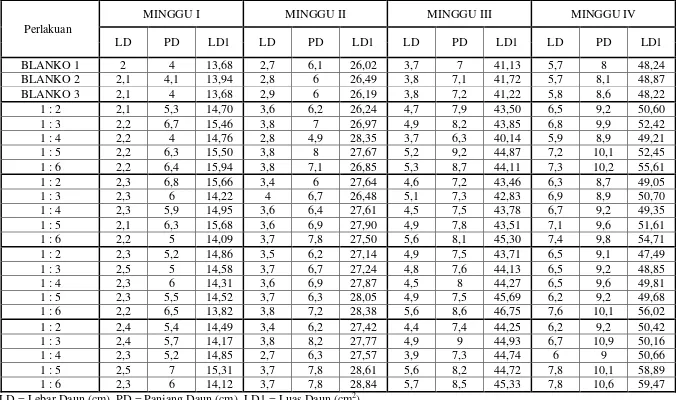
Tabel 4.3 Hasil pertambahan luas daun kacang hijau per minggu
LD = Lebar Daun (cm), PD = Panjang Daun (cm), LD1 = Luas Daun (cm2 Perlakuan
)
MINGGU I MINGGU II MINGGU III MINGGU IV
LD PD LD1 LD PD LD1 LD PD LD1 LD PD LD1
BLANKO 1 2 4 13,68 2,7 6,1 26,02 3,7 7 41,13 5,7 8 48,24
BLANKO 2 2,1 4,1 13,94 2,8 6 26,49 3,8 7,1 41,72 5,7 8,1 48,87
BLANKO 3 2,1 4 13,68 2,9 6 26,19 3,8 7,2 41,22 5,8 8,6 48,22
1 : 2 2,1 5,3 14,70 3,6 6,2 26,24 4,7 7,9 43,50 6,5 9,2 50,60
1 : 3 2,2 6,7 15,46 3,8 7 26,97 4,9 8,2 43,85 6,8 9,9 52,42
1 : 4 2,2 4 14,76 2,8 4,9 28,35 3,7 6,3 40,14 5,9 8,9 49,21
1 : 5 2,2 6,3 15,50 3,8 8 27,67 5,2 9,2 44,87 7,2 10,1 52,45
1 : 6 2,2 6,4 15,94 3,8 7,1 26,85 5,3 8,7 44,11 7,3 10,2 55,61
1 : 2 2,3 6,8 15,66 3,4 6 27,64 4,6 7,2 43,46 6,3 8,7 49,05
1 : 3 2,3 6 14,22 4 6,7 26,48 5,1 7,3 42,83 6,9 8,9 50,70
1 : 4 2,3 5,9 14,95 3,6 6,4 27,61 4,5 7,5 43,78 6,7 9,2 49,35
1 : 5 2,1 6,3 15,68 3,6 6,9 27,90 4,9 7,8 43,51 7,1 9,6 51,61
1 : 6 2,2 5 14,09 3,7 7,8 27,50 5,6 8,1 45,30 7,4 9,8 54,71
1 : 2 2,3 5,2 14,86 3,5 6,2 27,14 4,9 7,5 43,71 6,5 9,1 47,49
1 : 3 2,5 5 14,58 3,7 6,7 27,24 4,8 7,6 44,13 6,5 9,2 48,85
1 : 4 2,3 6 14,31 3,6 6,9 27,87 4,5 8 44,27 6,5 9,6 49,81
1 : 5 2,3 5,5 14,52 3,7 6,3 28,05 4,9 7,5 45,69 6,2 9,2 49,68
1 : 6 2,2 6,5 13,82 3,8 7,2 28,38 5,6 8,6 46,75 7,6 10,1 56,02
1 : 2 2,4 5,4 14,49 3,4 6,2 27,42 4,4 7,4 44,25 6,2 9,2 50,42
1 : 3 2,4 5,7 14,17 3,8 8,2 27,77 4,9 9 44,93 6,7 10,9 50,16
1 : 4 2,3 5,2 14,85 2,7 6,3 27,57 3,9 7,3 44,74 6 9 50,66
1 : 5 2,5 7 15,31 3,7 7,8 28,61 5,6 8,2 44,72 7,8 10,1 58,89
Tabel perhitungan luas daun kacang hijau
BDT = Berat Daun Total (cm), BDS = Berat Daun Sampel (cm), LD = Luas Daun (LD). Perlakuan
MINGGU I MINGGU II MINGGU III MINGGU IV
BDT BDS LD BDT BDS LD BDT BDS LD BDT BDS LD
BLANKO 1 0,2300 0,0432 13,68 0,4232 0,0418 26,02 0,7234 0,0452 41,13 0,8673 0,0462 48,24 BLANKO 2 0,2399 0,0442 13,94 0,4361 0,0423 26,49 0,7192 0,0443 41,72 0,8927 0,0440 48,87 BLANKO 3 0,2396 0,0450 13,68 0,4319 0,0426 26,06 0,7234 0,0451 41,22 0,8826 0,0463 48,22
1 : 2 0,2165 0,0457 14,70 0,4972 0,0487 26,24 0,7921 0,0468 43,50 0,9687 0,0492 50,60
1 : 3 0,2822 0,0469 15,46 0,5163 0,0492 26,97 0,7832 0,0459 43,85 0,9812 0,0481 52,42
1 : 4 0,2412 0,0420 14,76 0,4633 0,0420 28,35 0,7232 0,0463 40,14 0,9346 0,0488 49,21
1 : 5 0,2788 0,0462 15,50 0,4555 0,0423 27,67 0,8032 0,0460 44,87 1,0326 0,0506 52,45
1 : 6 0,2797 0,0451 15,94 0,4473 0,0428 26,85 0,8221 0,0479 44,11 1,1209 0,0518 55,61
1 : 2 0,2938 0,0482 15,66 0,4603 0,0428 27,64 0,7627 0,0451 43,46 0,9524 0,0499 49,05
1 : 3 0,2518 0,0455 14,22 0,4823 0,0468 26,48 0,7717 0,0463 42,83 0,9884 0,0501 50,70
1 : 4 0,2397 0,0412 14,95 0,4888 0,0455 27,61 0,7529 0,0442 43,78 0,9812 0,0511 49,35
1 : 5 0,2692 0,0441 15,68 0,4799 0,0442 27,90 0,7603 0,0459 43,51 1,0020 0,0499 51,61
1 : 6 0,2402 0,0438 14,09 0,4932 0,0461 27,50 0,8126 0,0461 45,30 1,1219 0,0527 54,71
1 : 2 0,2503 0,0433 14,86 0,4732 0,0448 27,14 0,7926 0,0466 43,71 0,9627 0,0521 47,49
1 : 3 0,2582 0,0455 14,58 0,4822 0,0455 27,24 0,8123 0,0473 44,13 0,9732 0,0512 48,85
1 : 4 0,2473 0,0444 14,31 0,4793 0,0442 27,87 0,7821 0,0454 44,27 0,9929 0,0516 49,81
1 : 5 0,2526 0,0447 14,52 0,4792 0,0439 28,05 0,7893 0,0444 45,69 0,9627 0,05498 49,68
1 : 6 0,2592 0,0482 13,82 0,4926 0,0446 28,38 0,8223 0,0452 46,75 1,2034 0,0532 56,02
1 : 2 0,2492 0,0442 14,49 0,4598 0,0431 27,42 0,7593 0,0441 44,25 0,9732 0,0496 50,42
1 : 3 0,2526 0,0458 14,17 0,4927 0,0456 27,77 0,7884 0,0451 44,93 0,9934 0,0509 50,16
1 : 4 0,2427 0,0420 14,85 0,4421 0,0412 27,57 0,7521 0,0432 44,74 0,9522 0,0483 50,66
1 : 5 0,2812 0,0472 15,31 0,4932 0,0443 28,61 0,8126 0,0467 44,72 1,2397 0,0541 58,89